A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تنفيذ نظام متماسك مكافحة ستوكس رامان نثر (CARS) على تي: الياقوت وOPO بالليزر القائم ستاندرد الليزر الضوئي مجهر
In This Article
Summary
متماسك مكافحة ستوكس رامان نثر (CARS) المجهري بناء على الاهتزاز الأصيل من السندات جزيء يسمح التسمية خالية انتقائية كيميائيا تصوير الخلايا الحية. يعرض هذا العمل على تنفيذ تقنية المجهر التكميلية على multiphoton الليزر مجهر المسح المعياري بناء على الفيمتو ثانية تي: ليزر الياقوت والليزر OPO.
Abstract
أصبحت ليزر الياقوت والبصرية مذبذب حدودي (OPO) لتكرار خط ليزر متاحة للعلماء الأحياء: المجاهر ليزر المسح الجمع بين الفيمتو ثانية تي. تم تصميم هذه الأنظمة في المقام الأول لمتعدد القنوات ثنائي الفوتون مضان المجهر. ومع ذلك، من دون أي تعديل، مكملا المجهر الضوئي غير الخطية مثل ثاني التوافقي جيل (SHG) أو الجيل الثالث التوافقي (تي إتش جي) ويمكن أيضا أن يؤديها مع هذا الإعداد، مما يسمح التصوير التسمية خالية من جزيئات منظم أو متوسطة مائي واجهات الدهون. هذه التقنيات هي مناسبة تماما للمراقبة في الجسم الحي، لكنها محدودة في خصوصية الكيميائية. كيميائيا التصوير الانتقائي يمكن الحصول عليها من إشارات الاهتزاز الكامنة على أساس تشتت رامان. يوفر متحد البؤر رامان المجهر القرار المكانية 3D، ولكنه يتطلب متوسط القوة العالية واكتساب الوقت الطويل. للتغلب على هذه الصعوبات، قد سمحت التطورات الحديثة في تكنولوجيا الليزر جمعةاإلمنائية من غير الخطية المجهر الذبذبات الضوئية، ولا سيما متماسك مكافحة ستوكس رامان نثر (CARS). ولذلك فقد ظهرت سيارات المجهر كأداة قوية لتصوير الخلايا البيولوجية والحية، من خلال نسبة الدهون في رسم الخرائط كيميائيا (عن طريق الاهتزاز CH تمتد)، والمياه (عن طريق الاهتزازات تمتد OH)، البروتينات أو الحمض النووي. في هذا العمل، وصفنا تنفيذ تقنية السيارات على يقترن OPO القياسية multiphoton الليزر مجهر المسح. لأنه يقوم على التزامن في الوقت المناسب من خطوط الليزر اثنين عن طريق ضبط طول واحد من مسار شعاع الليزر. نقدم تنفيذ خطوة بخطوة من هذه التقنية على نظام multiphoton القائمة. خلفية أساسية في مجال البصريات التجريبية مفيدة ولا يتطلب نظام عرض المعدات التكميلية باهظة الثمن. نحن لتوضيح أيضا CARS تصوير الحصول على الأغماد المايلين العصب الوركي من القوارض، وتبين لنا أن هذا التصوير لا يمكن أن يؤديها في وقت واحد مع التصوير الضوئي غير الخطية الأخرى، مثل تي القياسيةالتعليم الجامعي الفوتون تقنية مضان وتوليد التوافقي الثاني.
Introduction
أصبح المجهر الضوئي تقنية كبيرة لرؤية تدميري من العمليات الحيوية في الكائنات النظم البيولوجية مع قرار التحت خلوية. مضان المجهر حاليا على النقيض التصوير الأكثر شعبية المستخدمة في الخلايا الحية نظرا لخصوصيته عالية وحساسية 1. وقد ظهرت لوحة كبيرة من تحقيقات الفلورسنت (الأصباغ الخارجية والبروتينات المشفرة وراثيا، النانوية أشباه الموصلات). وقد ازدهرت مختلف عينة الإضاءة التقنيات التي تعتمد الفلورسنت (مثل المجهر متحد البؤر أو اثنين الفوتون) لإجراء التصوير 3D وللحد من العيب الرئيسي لهذا الأسلوب الذي photobleaching من 2. وتشمل القيود الأخرى شرط وضع العلامات fluorophore لأن معظم الأنواع الجزيئية ليست الفلورسنت جوهريا، وبالتالي هذه fluorophores يتعين عرضه بشكل مصطنع في العينة المصورة. قد يكون هذا التلاعب الاصطناعي التخريبية خاصة بالنسبة للجزيئات صغيرة أو يحرض عاءential الصور سمية. هذه الأسباب تجعل مضان المجهر ليس مناسبة تماما لالمجراة في عمليات الرصد. وبالتالي، فإن استخدام تقنيات التصوير البصرية مع حساسية عالية والتناقضات الجزيئية محددة دون استخدام جزيئات الفلورسنت مرغوب فيه للغاية في العلوم الطبية الحيوية.
ظهرت عدة تقنيات التصوير البصرية اللاخطية دون وضع العلامات أو تلطيخ، بما في ذلك الجيل الثاني التوافقي (SHG) 3،4 والجيل الثالث التوافقي (THG) 5. وقد استخدمت مجموعات المساعدة الذاتية المجهر إلى الترتيبات الهيكلية صورة على مستوى supramolecular مثل الأنابيب الدقيقة أو الكولاجين 6. يتم إنشاء THG من التغاير البصرية مثل واجهة بين وسط مائي والدهون (7). وقد تجلى THG أيضا إلى صورة المايلين 8،9. وفي كلتا الطريقتين يمكن تنفيذها على مضان المجهر ثنائي الفوتون وتتطلب شعاع ليزر واحد فقط. ومع ذلك فإنها تتطلب كثافة الليزر عالية الطاقة (عادة 50ميغاواط في 860 نانومتر للمجموعات المساعدة الذاتية 10، 25 - 50 ميغاواط في 1180 نانومتر لTHG 9)، والتي هي ضارة في عينات المعيشة، وليس لتوفير خصوصية الكيميائية المطلوبة للا لبس فيه صورة الهياكل البيولوجية المحددة.
كيميائيا التصوير الانتقائي يمكن الحصول عليها من المتأصلة إشارات اهتزاز الجزيئية على أساس تشتت رامان. عندما شعاع من ضوء يضرب المسألة، الفوتونات يمكن استيعابها ومتناثرة من الذرات أو الجزيئات. ومعظم الفوتونات المنتشرة لها نفس الطاقة، أي تردد، كما الفوتونات الحادث. وتسمى هذه العملية نثر رايلي. ومع ذلك، سوف تكون مبعثرة عدد قليل من الفوتونات في تردد بصري يختلف عن تردد الفوتونات الحادث، أي مع عملية نثر غير مرن دعا رامان نثر. الفرق في الطاقة تأتي من الإثارة وسائط الذبذبات اعتمادا على التركيب الجزيئي والبيئة. لذلك، رامان عفوية نثر الأقليمايديس التصوير انتقائية كيميائيا كما الجزيئات المختلفة لها ترددات الذبذبات محددة. ومع ذلك فإنه محدود بسبب اشارة ضعيفة للغاية. وقد تم تطوير متحد البؤر رامان المجهري ويوفر القرار المكانية 3D، ولكنه يتطلب ارتفاع متوسط السلطة والاستحواذ وقت طويل لل11. للتغلب على هذه الصعوبات، وقد سمحت التطورات الحديثة في تكنولوجيا الليزر صعود غير الخطية المجهر الذبذبات الضوئية، ولا سيما متماسك نثر المضادة للستوكس رامان (CARS) 11،12،13.
السيارات هي ثالث ترتيب عملية البصرية اللاخطية. ثلاثة أشعة الليزر، ويتألف من شعاع مضخة في تردد ω P، وتركز شعاع ستوكس في تردد ω S وشعاع مسبار (وهي في معظم الأحيان مضخة) في عينة وتوليد شعاع مكافحة ستوكس في تردد ω AS = ( 2ω P - ω S) 14. إشارة المضادة للستوكس يمكن أن تتعزز بشكل كبير عندما يكون الفرق ترددبين المضخة وستوكس الحزم يتم ضبطها لرامان الجزيئي الاهتزاز Ω R = (ω ف - ω S). ويستند إشارة سيارات على تفاعل الفوتون متعددة. وبالتالي فإنه يولد أوامر إشارة متماسكة من حجم أقوى من تشتت رامان عفوية.
وقد تجلى CARS المجهر لأول مرة بشكل تجريبي من قبل دنكان وآخرون. 15. تسومبوش آخرون تحسين ثم هذه التقنية، وباستخدام اثنين تركز بالقرب من الأشعة تحت الحمراء أشعة الليزر الفيمتو ثانية مع عدسة الهدف من الفتحة العددية العالية، مما يتيح للمرحلة حالة مطابقة السيارات وتجنب ثنائي الفوتون غير الرنانة الخلفية 16. ولذلك فقد ظهرت سيارات المجهر كأداة قوية ليعيش الخلايا والأنسجة والتصوير، عن طريق الكشف كيميائيا جزيئات مثل الدهون (عن طريق الاهتزاز CH تمتد) 17،18 والمياه (عن طريق الاهتزازات تمتد OH)، والبروتينات، الحمض النووي في الخلايا الحية 19،20 ولكن أيضا بالديوتيريوم مركب كيميائيالصورة للصناعات الدوائية 21 وتطبيقات التجميل 22.
فإن القيود الرئيسية من المجهري غير الخطية تنبع من تعقيد وتكلفة من المصادر الضوئية. يتطلب نظام السيارتين الليزر الطول الموجي الانضباطي مع فترات نبض قصيرة ومع القطارات نبض متزامنة زمنيا ومكانيا. واستندت السيارات في وقت مبكر المجاهر على اثنين بيكو ثانية متزامنة تي: ليزر الياقوت 20. تم الحصول CARS التصوير أيضا من واحد الفيمتو ثانية تي: ليزر الياقوت توليد مصدر الضوء supercontinuum 23. في الآونة الأخيرة، ومصادر الليزر تتكون من واحد الفيمتو ثانية تي: لقد تم استخدام ليزر الياقوت ضخ مؤشرات التذبذب حدودي البصرية الانضباطي (OPO) للسيارات المجهر. هذا الإعداد يسمح جوهريا مزامنة مؤقتا الحزم مع فرق من التردد بين المضخة وشعاع ستوكس تغطي كامل طيف الذبذبات الجزيئي 24. وبالإضافة إلى ذلك، المجاهر المسح بالليزر على أساس turn-تتوفر الآن لعدم الفيزياء مفتاح ليزر خ م وOPO، وتستخدم في المقام الأول لمدة الفوتون مضان (مدفوعات نهاية الخدمة). إمكانات هذه مجموعة عمليات يمكن أن تتعزز بشكل كبير دون الحاجة إلى استثمارات تكميلية عن طريق دمج الآخرين التصوير الضوئي غير الخطية، لأن كل الخطية (NLO) التصوير طريقة حساسة للهياكل أو جزيئات محددة. لذا المتعدد الوسائط NLO التصوير تستفيد من إمكانات NLO المجهري لعينات بيولوجية معقدة 25. وقد سمح للاقتران من هذه التقنيات في تحقيق العديد من الأسئلة الحيوية، ولا سيما على ايض الدهون والجلد أو سرطان تطوير 26، والهيكل العظمي تنمية العضلات 27، آفات تصلب الشرايين 28. وعلاوة على ذلك، فإن تنفيذ شعاع الليزر المسح الضوئي مع CARS يعطي القدرة على التصوير ارتفاع معدل، أي أداة جذابة لدراسة العمليات الديناميكية في الجسم الحي.
والهدف من هذا العمل هو إظهار كل خطوة لتنفيذ رتقنية انه CARS على multiphoton الليزر مجهر المسح القياسية. ويستند المجهر على تي fsec: ليزر الياقوت وOPO (التي تضخها تي: ليزر الياقوت) التي تديرها برنامج لعلماء الأحياء. تم تنفيذ التكامل عن طريق ضبط طول واحد من مسار شعاع الليزر من أجل مزامنة في الوقت شعاعين. وصفنا تنفيذ خطوة بخطوة من هذا الأسلوب الذي يتطلب الخلفية الأساسية فقط في مجال البصريات التجريبية. نحن لتوضيح أيضا CARS التصوير الحصول على الأغماد المايلين العصب الوركي من القوارض، ونظهر هذا التصوير لا يمكن أن يؤديها في وقت واحد مع الآخرين التصوير الضوئي غير الخطية، مثل تقنية مضان ثنائي الفوتون القياسية والجيل الثاني التوافقي.
Access restricted. Please log in or start a trial to view this content.
Protocol
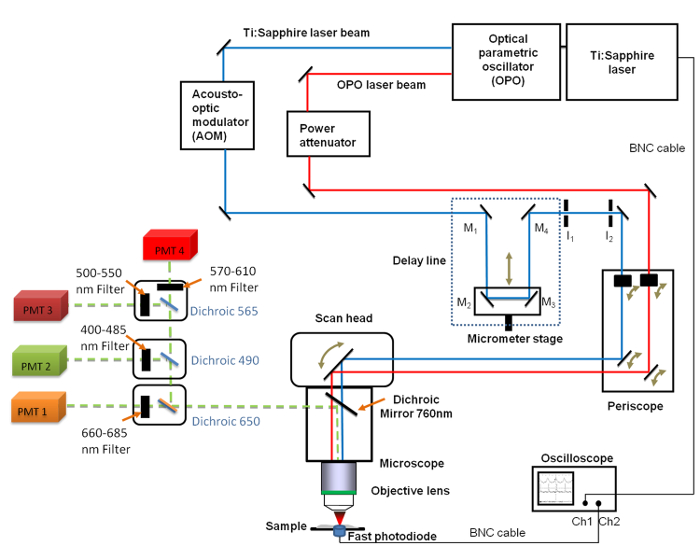
الشكل 1. عرض تخطيطي من العام انشاء ويشمل تي: الياقوت (680 - 1080 نانومتر) وOPO (1050 - 1300 نانومتر) ليزر، خط تأخير مع المرايا 4 (M 1 إلى M 4)، الذبذبات السريعة، والثنائي الضوئي واثنين من قزحية العين الثابتة أغشية I 1 و I 2. مرايا م 2 وM 3 يتم إصلاحها في مرحلة الترجمة الخطية مواتية لتغيير طول خط تأخير مع قرار ميكرومتر. 660 - كان وضعه 685 نانوميتر تمرير مرشح أمام أنبوب مضخم (PMT) المستخدمة للسيارات التصوير الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
1. بدء التشغيل من نظام ليزر
- تحقق من أن منظمة الشفافية الدولية: تم تعيين الطول الموجي الياقوت إلى 800 نانومتر أو تحديدهذا الطول الموجي على تي: الياقوت تحكم امدادات الطاقة. بدوره الرئيسي من الاستعداد ليوم للتبديل على تي: ليزر الياقوت.
- بدوره على الليزر OPO في الجزء الخلفي من وحدة تحكم OPO وفتح تي: مصراع الياقوت على تي: الياقوت تحكم امدادات الطاقة.
- التبديل على الكمبيوتر اللوحي إلى ضخ ما يصل OPO. انقر على الرموز OPO متصل ومتصلة عن بعد على اللوحة. انتظر 30-40 دقيقة لالاحماء.
- التبديل على جهاز الكمبيوتر المجهر وتشغيل مفاتيح "مجهر مكونات". بدء تشغيل البرنامج بالنقر المزدوج على أيقونة على سطح المكتب.
- في برنامج اكتساب التبويب، فتح أداة الليزر في إدارة الإعداد للعمل على حد سواء ليزر من البرنامج. اختر تي: ليزر الياقوت في والليزر OPO تشغيل. تحقق قيمة قوة الليزر الضوئية (القيم النموذجية من 3700 ميغاواط في 800 نانومتر و 700 ميغاواط في 1000 نانومتر).
- لتكوين مسار الشعاع والليزر،فتح أداة مسار الضوء في مجموعة أداة إدارة إعداد ومراجعة المربع أنبوب مضخم الأول (PMT).
- للتحقق من منظمة الشفافية الدولية: بقعة الليزر الياقوت في إخراج هذا الهدف، فتح أداة القنوات في مجموعة أداة اكتساب المعلمة. حدد تي: السلطة الياقوت في قيمة منخفضة (حوالي 1٪)، والحد من الربح إلى 0 (لا حاجة لصورة في هذه المرحلة) وانقر على زر المستمر لبدء إجراء المسح الضوئي لإطلاق شعاع الليزر من خلال الهدف المجهر. تحقق من وجود بقعة حمراء من خلال الملاحظة المباشرة عن طريق وضع بطاقة العرض يزر الأشعة تحت الحمراء في إخراج الهدف المجهر الهواء (10X).
- للتحقق من بقعة الليزر OPO، ووقف الفحص من منظمة الشفافية الدولية: الياقوت الليزر عن طريق النقر على زر إيقاف. حدد السلطة OPO في قيمة منخفضة في إطار القنوات وانقر على Cزر ontinuous.
2. إعدادات مجهر
- وضع يدويا المرآة مزدوج اللون مع طول موجة قطع في 760 نانومتر في شريط التمرير sideport في الفضاء لا نهاية فوق الأنفية الموضوعية لإطلاق ضوء ما يصل إلى 760 نانومتر من العينة إلى هذه الفرق في الكشف غير descanned وضع (NDD).
- ضبط عصابة ضيقة تمرير مرشح في 660-685 نانومتر في عاكس مكعب NDD أمام PMT1 لتسجيل فقط CARS إشارة في 670 نانومتر إلى إنتاج النتائج المعروضة في هذا العمل.
- وضع مرشح ضيقة النطاق تتراوح 500-550 نانومتر في المكعب عاكس NDD أمام PMT3 للمراقبة مضان من المايلين. وضع مرشح ضيقة النطاق تتراوح 565-610 نانومتر في المكعب عاكس أمام PMT4 للمراقبة مجموعات المساعدة الذاتية.
- لتحديد في البرنامج تسجيل إشارة على كاشف مع المخصص الفرقة تمرير مرشح، فتح أداة مسار الضوء في القائمة إدارة الإعداد في علامة التبويب اكتساب. تفعيل PMT المطلوب (خانة الاختيار) واختر لونا لهذه القناة. في هذا العمل، وقد تم اختيار اللون الأخضر للسيارات والأحمر لمضان وأرجواني لمجموعات المساعدة الذاتية.
3. الزمني التزامن
ملاحظة: أشعة الليزر اثنين تنبع من نفس تي: تأخر ليزر الياقوت ولكن شعاع OPO عند إنشائه حتى لا تتم مزامنة شعاعين في الوقت المناسب عندما تصل المجهر. والهدف هنا هو تأخير واحد من شعاعين لإعادة مزامنة-منها في الوقت المناسب قبل ان تصل الى المجهر.
- التواصل مع الكابلات BNC قناة الإدخال CH1 من الذبذبات إلى الإخراج ليزر BNC الكهربائية (سينك. آوت). ربط مدخلات قناة CH2 من الذبذبات إلى الثنائي الضوئي واختيار القنوات CH1 كقناة الزناد عن طريق الضغط على MENU الزناد، ثم إلى القائمة الرئيسية زر المصدر ثم الزر الجانبية القائمة التي تتطابق مع القناة المختارة CH1.
- موقف وإصلاح يحتوي على مشاركات تصاعد البصرية والضوئي في طائرة الوصل من هدف المجهر الهواء (10X) أو في مسار الشعاع المجهر بعد إزالة الهدف. ملاحظة: إذا لزم الأمر، وإزالة المكثف والناقل لها.
- في أداة القنوات (مجموعة أداة اكتساب المعلمة)، تعريف منظمة الشفافية الدولية: الطول الموجي لليزر الياقوت في 830 نيوتن متر عند طاقة منخفضة (أي أقل من 1٪ من القوة الكاملة). في أداة الوضع اكتساب، والحد من منطقة المسح الضوئي إلى نقطة واحدة من أجل إلقاء الضوء على الثنائي الضوئي مع أصغر شعاع. التبديل على المسح الضوئي ليزر عن طريق النقر على زر المستمر.
- الصحافة AUTOSET على لوحة الذبذبات أمام يدويا ونقل موقف الضوئي للحصول على القطارات نبض على الشاشة. اضغط على زر تشغيل / إيقاف لتجميد الشاشة.
- لحفظ نسخة من العرض الذبذبات، اضافة الى وجود 3.5بوصة القرص المرن في محرك الأقراص المرنة أو ربط ميناء GPIB على اللوحة الخلفية للكمبيوتر. ثم اضغط SHIFT ورقيا القائمة، اضغط على شكل (الرئيسي) لتحديد شكل صورة TIFF وتحديد في القائمة ميناء قناة الانتاج. اضغط على زر ورقيا لتسجيل عرض الذبذبات القطارات نبض تي: ليزر الياقوت.
- إيقاف تي: المسح الضوئي ليزر الياقوت عن طريق النقر على زر إيقاف. بالنقر على القنوات أداة تحديد إشارة OPO في 1107 قوة نانومتر والمنخفضة. التبديل على المسح الضوئي ليزر OPO وتسجيل القطارات نبضة ليزر OPO على الذبذبات. إيقاف الفحص OPO الليزر.
- قارن التحول الزمني بين منظمة الشفافية الدولية: الياقوت وإشارات OPO.
ملاحظة: التحول التحول ر الزمني يعطي طول الخط تأخير DelayLine L التي لابد من تنفيذها بعد المعادلة: L delayLine = ج5؛ ر التحول حيث c هي سرعة الضوء. - اختيار واحد من خطوط الليزر.
ملاحظة: في هذا العمل، وتي: تم اختيار خط ليزر الياقوت لمساحة حرة كانت متاحة بالقرب من خط ليزر. وبالإضافة إلى ذلك، هذا الاختيار يسمح لتحقيق إعادة التنظيم من خط ليزر مع ضوء الليزر مرئية. - فتح خط ليزر عن طريق إزالة أنابيب واقية في موقف حيث سيتم تنفيذ خط تأخير.
الحذر! ارتداء نظارات السلامة المناسبة وإزالة الأساور سلسلة أو مشاهدة من المعصمين. - اختيار الطول الموجي في المدى المرئي من أجل أن تكون قادرة على مراقبة بسهولة شعاع الليزر (700 نانومتر على سبيل المثال، في انخفاض القوة في أداة القنوات من البرنامج). التبديل على المسح الضوئي ليزر.
- وضع ومع مجموعة المشاركات تصاعد البصرية اثنين القزحية أغشية على طول خط ليزر مفتوح. موقف قزحية العين في الخروج من خط تأخير وتضع القزحية أخرى عند مدخل منظار.
ملاحظة: المؤسسة العامةضوابط riscope من قبل اثنين من المرايا بمحركات يقودها البرامج زاوية مدخل شعاع الليزر في الرأس المسح الضوئي للمجهر المسح بالليزر. - تقليل قزحية الحجاب الحاجز الفتحة وتوفيق أوضاع الحجاب الحاجز لتتناسب مع مسار شعاع الليزر. اصلاحها على الطاولة البصرية. ضبط الوضع الرأسي للثالث غشاء القزحية المحمول، للتحقق من ارتفاع شعاع ليزر في حين تحديد المواقع تباعا المرايا أربعة من خط تأخير.
ملاحظة: هذه الأغشية القزحية بمثابة الرقابة لإجراء إعادة التنظيم التي تبين مسار لمتابعة. - وضع مرآة شنت M1 على مرآة الحركية المدمجة جبل عند مدخل خط تأخير (كما هو موضح في الشكل رقم 1)، وضبط موقفها وتوجهها للحفاظ على ارتفاع شعاع باستخدام قزحية الحجاب الحاجز المحمول. مكان المرايا (شنت أيضا على يتصاعد مرآة الحركية المدمجة) M2 و M3 على 90 درجة على مرحلة الترجمة التي سيتم وضعه في midcourse. الموقف منها لتتناسب مع طول خط تأخير وفقا لحسابات سابقا.
- ضبط اتجاه M2 و M3 مع استخدام قزحية الحجاب الحاجز المحمول. تعيين M4 (الثابتة أيضا على جبل المدمجة) عند مخرج خط تأخير (قبل قزحية I 1 كما هو موضح في الشكل رقم 1) وبعناية ضبط الموقف وزاوية لتتناسب مع مسار شعاع الليزر من خلال اثنين من أغشية قزحية الثابتة.
- ضع بطاقة عرض ليزر في إخراج الهدف المجهر والتحقق من ملف شعاع الليزر من خلال النقر على مستمر لتشغيل المسح الضوئي ليزر. مراقبة قرص مشرق موحد. إذا لزم الأمر، وضبط قليلا اتجاه M4.
- الموقف مرة أخرى الضوئي السريع تحت شعاع الليزر في التركيز طائرة عينة من المجهر. لاحظ التحول الزمني بين منظمة الشفافية الدولية: شعاع ليزر الياقوت وشعاع OPO على الذبذبات.
ملاحظة: إذا لزم الأمر، تغيير طول خط تأخير عن طريق تحريك النظام برمته M2، M3 التي شنت علىمرحلة الترجمة (من دون تغيير الترجمة مرحلة ضبط) لمزامنة كل من البقول. التغييرات من بضعة سنتيمترات يمكن أن يكون مطلوبا.
4. المكانية التداخل من الشعاع
ملاحظة: لإنتاج إشارة سيارات، مطلوب التداخل المكاني للأشعة الليزر اثنين. إضاءة بديلة لكل من الحزم على نفس الخرز الملون في جميع أنحاء مع اثنين من الأصباغ الفلورية مختلفة يمكن استخدامها للإشارة إلى التحول المكاني. يمكن تعديلات دقيقة من المواقف مرآة ثم التقليل من التحول.
- استخدام المجهرية الفلورسنت قبل تركيبه. أو جبل المجهرية في تعليق على الشرائح المجهر نظيفة كما هو موضح أدناه:
- قبل أخذ العينات، ومزيج (على خلاط القشرة أو sonicating) الحل الخرز للتأكد من أن حبات يتم تعليق موحد.
- تطبيق 5 ميكرولتر من تعليق حبة لسطح شريحة وانتشرت مع طرف ماصة. انتظر الحبرية لتجف ثم تطبيق 5 ميكرولتر من جبلجي المتوسطة، مثل الجلسرين والماء أو النفط الغمر على عينة الجافة من الخرز. تغطية عينة مع ساترة وختم ساترة مع الغراء سريع التجفيف أو البارافين ذاب.
- وضع الخرز البوليسترين الفلورسنت ثابتة على شريحة المجهر في إطار الهدف المياه 20X. إضافة بضع قطرات من الماء لغمر الهدف.
- لتحقيق التركيز على الخرز، وفتح علامة التبويب موقع في البرنامج للتبديل من وضع المسح بالليزر إلى الملاحظة المباشرة من العينة مع العين، عن طريق الضغط على زر على الانترنت. فتح أداة بصري لتحديد مرشح مخصصة والتبديل على مصابيح الهالوجين من خلال النقر على الرموز.
- يدويا إزالة مرآة مزدوج اللون في شريط التمرير sideport في الفضاء لا نهاية، واستخدام محرك تركيز المجهر لتركيز طائرة عينة من خلال مراقبة الخرز مع oculars. استبدال المرآة مزدوج اللون.
- في الحدد علامة التبويب، قم بالتبديل إلى وضع المسح بالليزر عن طريق الضغط على زر اتصال. انتقل إلى علامة التبويب اكتساب لتحديد معايير لمسح: تحديد حجم الإطار إلى 512 بكسل، وسرعة المسح الضوئي من 9، وهو المتوسط من 1، عمق قليلا من 8 بت و زيادة منطقة المسح الضوئي إلى أقصى حد.
- في أداة قنوات علامة التبويب اكتساب، إضافة المسار (المسار 1) لو لم يخلق بالفعل. تحديد الطول الموجي في 830 نانومتر، وانخفاض القوة لمنظمة الشفافية الدولية: شعاع ليزر الياقوت ضع علامة على اللون إلى اللون الأخضر في مربع المسار 1 من النافذة القنوات وفي PMT3 أو مربع PMT4 من نافذة مسار الضوء.
- في أداة قنوات علامة التبويب اكتساب، إضافة المسار الثاني (المسار 2). تحديد الطول الموجي في 1107 قوة نانومتر، وانخفاض لشعاع الليزر OPO. وضع علامة في اللون إلى الأحمر في المربع المسار 2 من نافذة القنوات وفي مربع PMT3 من نافذة مسار الضوء.
- ضبط كسب كلا المسارين إلى 600. ثم تطبيق بالتسلسل فحص شعاعين على العينة عن طريق النقر على مستمر.
- لاحظ الصورة في مساحة الشاشة في عرض 2D. في العرض عرض كتلة التحكم الخيار، وضبط كثافة العرض.
ملاحظة: إذا لزم الأمر، تحرك قليلا محرك نركز على العثور على طائرة التركيز من الخرز. ضبط المحاصيل وتكبير الصورة في حبة واحدة أو في مجموعة من الخرز المجاورة. - استخدام وحدة تحكم المنظار إلى تداخل الحزم في الطائرة س ص. في البرنامج، افتح علامة التبويب المحافظة. انقر على خيارات النظام وعرض إطار أداة بمحركات الناظور. استخدام التعديلات الخشنة وغرامة من المرايا منظار للتي: شعاع ليزر الياقوت لمزامنة في الفضاء كلتا الصورتين.
- للتلاعب المنظار، استخدام أشرطة التعديل الأول لرأسي وسكالثانية واحد للحركات الأفقي لشعاع الليزر. تحريك شعاع مع مرآة المدخلات حتى تكون الصورة واضحة قليلا، ثم تعويض عن كثافة الليزر مع مرآة إخراج منظار من خلال النقر على "المدخلات" و "المخرجات".
- من أجل تتداخل عموديا الحزم، في علامة التبويب المحافظة، فتح أداة تلسكوب الموازاة وضبط قيمة المسافة البؤرية للتي: شعاع ليزر الياقوت.
- تحرك بلطف موقف موضوعي العمودي للتحقق من الفرق من التركيز على كل الصور. أو، واتخاذ ض المكدس من العينة عن طريق فتح في علامة التبويب اكتساب الأداة Z-ستاك واختيار معلمات مختلفة (المدى، وعدد من شرائح). الصحافة أورثو في منطقة الشاشة صورة لرؤية الحزم في المقطع العرضي المحوري. تعظيم ض التداخل عن طريق القيام بنفس الإجراء عدة مرات.
5. التعديلات النهائية ومتماسكة لمكافحة ستوكس رامان نثر (CARS) إشارة مراقبة من زيت الزيتون الدكتورoplets
- وضع قطرات من زيت الزيتون على طبق من زجاج وتغطية ذلك من قبل الانزلاق غطاء زجاجي. إضافة بضع قطرات من الماء لغمر الهدف الغمر 20X المياه. التركيز على حافة الانزلاق الغطاء باستخدام oculars (كما هو موضح سابقا في 4.2).
- في أداة قنوات علامة التبويب اكتساب، حدد في المسار رقم 1 الطول الموجي 830 نانومتر لمنظمة الشفافية الدولية: شعاع ليزر الياقوت وفي 1107 نانومتر لOPO. وضع علامة على حد سواء ليزر في المسار رقم 1 للحصول على المسح الضوئي في وقت واحد في كل من الليزر. صلاحيات تعيين في قيمة منخفضة لبداية.
- في إطار مسار ضوء، حدد PMT1. التبديل على المسح الضوئي ليزر عن طريق النقر على زر المستمر. تحرك قليلا من التركيز على توفير ضوء الليزر في طبقة رقيقة النفط.
- إذا لزم الأمر، وزيادة الطاقة الضوئية من كلا الليزر. ضبط كثافة الشاشة في العرض عرض كتلة التحكم الخيار. تحرك ببطء مرحلة الترجمة من خط تأخير حتى تصبح إشارة SIGتعزيز nificantly.
- بعد التحالفات غرامة كاملة، والتحقق ما إذا كان هو حقا CARS إشارة: نقل قليلا مرحلة الترجمة؛ شدة إشارة يجب أن تصبح أضعف. و / أو إيقاف واحد من شعاع الليزر، إما تي: ليزر الياقوت أو OPO. مرة أخرى يجب أن يكون هناك تسوس قوي في شدة مقارنة إشارة سيارات.
- لتحقيق أقصى قدر من إشارة للسيارات، حدد الخيار على برنامج لتوفير قيمة يعني كثافة الصورة كاملة (في وجهة النظر HISTO من علامة التبويب مساحة الشاشة). ضبط الطول الموجي (نانومتر قليل)، ثم س، ص، ض مواقف للتركيز شعاع لتعظيم قيمة كثافة يعني.
6. الضميمة من مسار الضوء من خط تأخير
- منذ يكرس النظام النهائي لغير الفيزيائيين، أرفق مسار الضوء من خط تأخير مع أنابيب أو مربع الضميمة، لتجنب الوصول المباشر إلى غير مرئية ذروة عالية شعاع الليزر السلطة ضارة. الحرص على توفير الوصول إلى مرحلة الترجمةمقبض الباب.
7. الطول الموجي ضبط للسيارات
- استخدام المعادلة
 لضبط موجات الليزر إلى الاهتزاز رامان المطلوب. إعادة إنشاء النتائج المعروضة في هذا العمل لCARS صورة إشارة من السندات CH جود تمتد الاهتزاز من 3015 سم -1، حدد λ تي: الياقوت = 830 نانومتر، وλ OPO = 1095 نانومتر.
لضبط موجات الليزر إلى الاهتزاز رامان المطلوب. إعادة إنشاء النتائج المعروضة في هذا العمل لCARS صورة إشارة من السندات CH جود تمتد الاهتزاز من 3015 سم -1، حدد λ تي: الياقوت = 830 نانومتر، وλ OPO = 1095 نانومتر.
ملاحظة: رامان ترددات الذبذبات المميزة لوحظ في العينات البيولوجية، مثل المياه، CH السندات يمكن العثور عليها في ايفانز وآخرون 13 أو في إليس وآخرون 29.. - استخدام المعادلة
 لتحديد الطول الموجي انبعاث إشارة سيارات. لCH التصوير السندات من قبل السيارات، واختيار مرشح ضيقة النطاق في 670 نانومتر منذ CARS λ = 670 نانومتر مع موجات الليزر عرض 7.1.
لتحديد الطول الموجي انبعاث إشارة سيارات. لCH التصوير السندات من قبل السيارات، واختيار مرشح ضيقة النطاق في 670 نانومتر منذ CARS λ = 670 نانومتر مع موجات الليزر عرض 7.1.
ملاحظة: تطبيق الهاتف المحمول للمركباتailable لحساب CARS λ من λ P وλ S القيم (أنظر المرجع 30).
8. مراقبة من السيارات الإشارة والمعشق المايلين من التخفيضات العصب الوركي
ملاحظة: تم إجراء جميع التجارب على الحيوانات وفقا للوائح المؤسسية.
- إعداد التخفيضات العصب الوركي المحورية والطولية على شريحة المجهر كما وردت في أوتشيليك وآخرون. 31.
- إعداد الحل تلطيخ الأحمر fluoromyelin عن طريق تمييع المخزون حل 300 مرات في برنامج تلفزيوني. الفيضانات التخفيضات العصبية مع الحل تلطيخ لمدة 20 دقيقة في RT. إزالة حل ويغسل 3 مرات لمدة 10 دقيقة مع برنامج تلفزيوني.
- ضع التخفيضات في إطار الهدف الغمر بالماء 20X. وضع ساترة. إضافة بضع قطرات من برنامج تلفزيوني لتزج الهدف وضبط بؤرة الهدف هو الحصول على صورة واضحة عن التخفيضات من خلال oculars (كما هو موضح سابقا في 4.2).
- في المسار 1، حدد تي: الياقوت وOPO الليزر وتحديد الأطوال الموجية ل830 نانومتر و 1095 نانومتر، على التوالي. في إطار مسار ضوء، حدد PMT1 واللون الأخضر.
- في المسار 2، حدد OPO الليزر فقط (الطول الموجي في 1095 نانومتر). في إطار مسار ضوء، حدد PMT4 واللون الأحمر.
- لكل من أشعة الليزر، وتحديد الطاقة المنخفضة وتعيين الربح إلى 600 لبداية. التبديل على المسح بالليزر وضبط المعلمات التالية لتحسين CARS وإشارة مضان يتناقض: القيم السلطة، مرحلة الترجمة مقبض الباب (قليلا جدا)، موجات (قليل نانومتر)، وعرض كثافة.
- لتسجيل الصور النهائية في ارتفاع القرار، وتحديد في أداة الوضع اكتساب المعلمات التالية: حجم الإطار من 1024 بكسل، سرعة المسح الضوئي من 7، المتوسط 4. اضغط على زر المفاجئة لتسجيل صورة واحدة. حفظ الصورة في شكل الملكيةفي لتسجيل الصورة والمعلمات الاستحواذ الكامل.
9. مراقبة من السيارات وإشارات مجموعات المساعدة الذاتية من التخفيضات العصب الوركي
- إعداد العصب الوركي كما وردت في أوتشيليك وآخرون. 31.
- اتبع الإجراء كما هو موضح في جزء 8 للحصول على صورة من خلال oculars ولتحديد CARS المعلمة إشارة (المسار 1).
- في المسار 2، حدد OPO الليزر فقط (الطول الموجي في 1095 نانومتر). في إطار مسار ضوء، حدد PMT3 واللون الأرجواني.
- اتبع الإجراء كما هو موضح في جزء 8 للتبديل على المسح الضوئي ليزر وحفظ صور عالية الدقة.
Access restricted. Please log in or start a trial to view this content.
النتائج
تردد القطار نبض القياسية تي: ليزر الياقوت هو عادة حوالي 80 ميغاهرتز. وOPO له نفس تردد منذ يتم ضخها من قبل منظمة الشفافية الدولية: ليزر الياقوت. لذا مطلوب الذبذبات السريعة لللا يقل عن 200 ميغاهيرتز. والضوئي السريع في نطاق مطلوب أيضا 600 إلى 1100 نانومتر. يح...
Access restricted. Please log in or start a trial to view this content.
Discussion
أصعب جزء من هذا العمل هو التزامن الزمني للأشعة الليزر. فإنه يتطلب الضوئي السريع جنبا إلى جنب مع الذبذبات السريعة، ولكن فقط تداخل الخام في وقت لا يمكن أن يؤديها في البداية. ثم هناك حاجة إلى مزيد من التعديل من عدد قليل سم. وأخيرا، والتحركات ميكرومتر من مرحلة الترجمة الخ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
The authors want to thank Dr. Philippe Combette (IES, UM, Montpellier, France) for the loan of the fast oscilloscope and acknowledge financial supports from Montpellier RIO Imaging (MRI). HR acknowledges ANR grants France Bio Imaging (ANR-10-INSB-04-01) and France Life Imaging (ANR-11-INSB-0006) infrastructure networks for coherent Raman imaging developments. This work was mainly supported by an European Research Council grant (FP7-IDEAS-ERC 311610) and an INSERM - AVENIR grant to NT.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Oscilloscope | Tektronix | TDS 520D | 500 MHz |
| Photodetector | Thorlabs | DET08C/M, T4290 | 5 GHz InGaAs, 800 - 1,700 nm |
| Ti:Sapphire laser Chameleon Ultra Family II | Coherent | ||
| Optical parametric oscillator OPO Compact Family | APE Berlin | ||
| Axio Examiner microscope LSM 7 MP | Carl Zeiss | ||
| Motorized periscope | Newport | ||
| Objective W Plan-Apochromat 20X/1.0 | Carl Zeiss | ||
| Beam combiner | Carl Zeiss | ||
| Acousto-optic modulator | Carl Zeiss | ||
| OPO power attenuator | Carl Zeiss | ||
| Photomultiplier tube | Carl Zeiss | ||
| ZEN software | Carl Zeiss | ||
| Bandpass filters | Carl Zeiss | LSM BiG 1935-176 | 400 - 480 nm; 500 - 550 nm; 465 - 610 nm |
| Dichroic mirror | Carl Zeiss | Cutoff wavelength 760 nm | |
| Silver mirrors | Newport | 10D20ER.2 | λ/10, 480 - 20,000 nm, Quantity 4 |
| Single-axis translation stage with standard micrometer | Thorlabs | PT1/M | Quantity 1 |
| Aluminium breadboard | Thorlabs | MB1015/M | Quantity 1 |
| Mirror mount | Thorlabs | KMSS/M | Quantity 4 |
| Mirror holder for Ø1" Optics | Thorlabs | MH25 | Quantity 4 |
| Iris diaphragms | Thorlabs | ID8/M | Quantity 3 |
| Protective box | Thorlabs | TB4, XE25L900/M, T205-1.0, RM1S | Quantity 1 |
| Optical posts | Thorlabs | TR40/M, PH50/M, PH75/M, BA2/M | Quantity 8 (lengths depending on the set-up) |
| 661 - 690 nm bandpass filter | Semrock | 676/29 nm BrightLine® single-band bandpass filter | Quantity 1 |
| Fluorescent beads | ThermoFisher | TetraSpeck™ Fluorescent Microspheres Size Kit | |
| Laser viewing card | Thorlabs | IR laser viewing card | |
| Laser safety glass | Newport | LV-F22.P5L07 | |
| FluoroMyelin™ Red Fluorescent Myelin Stain | ThermoFisher | F34652 |
References
- Valeur, B., Berberan-Santos, M. N. Molecular Fluorescence: Principles and Applications. , 2nd Edition, Wiley-VCH Verlag GmbH. (2012).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Moreaux, L., Sandre, O., Mertz, J. Membrane imaging by second-harmonic generation microscopy. JOSA B. 17 (10), 1685-1694 (2000).
- Zoumi, A., Yeh, A., Tromberg, B. J. Imaging cells and extracellular matrix in vivo by using second-harmonic generation and two-photon excited fluorescence. Proc. Natl. Acad. Sci. USA. 99 (17), 11014-11019 (2002).
- Yelin, D., Silberberg, Y. Laser scanning third-harmonic-generation microscopy in biology. Opt. Express. 5 (8), 169-175 (1999).
- Campagnola, P. J., Millard, A. C., Terasaki, M., Hoppe, P. E., Malone, C. J., Mohler, W. A. Three-dimensional high-resolution Second-Harmonic Generation imaging of endogenous structural proteins in biological tissues. Biophys. J. 81 (1), 493-508 (2002).
- Olivier, N., et al. Cell lineage reconstruction of early zebrafish embryos using label-free nonlinear microscopy. Science. 329 (5994), 967-971 (2010).
- Farrar, M. J., Wise, F. W., Fetcho, J. R., Schaffer, C. B. In vivo imaging of myelin in the vertebrate central nervous system using third harmonic generation microscopy. Biophys. J. 100 (5), 1362-1371 (2011).
- Lim, H., Sharoukhov, D., Kassim, L., Zhang, Y., Salzer, J. L., Melendez-Vasquez, C. V. Label-free imaging of Schwann cell myelination by third harmonic generation microscopy. Proc. Natl. Acad. Sci. U.S.A. 111 (50), 18025-18030 (2014).
- Strupler, M., Pena, A. M., Hernest, M., Tharaux, P. L., Martin, J. L., Beaurepaire, E., Schanne-Klein, M. C. Second harmonic imaging and scoring of collagen in fibrotic tissues. Opt. Express. 15 (7), 4054-4065 (2007).
- Cheng, J. X., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: Instrumentation, theory, and applications. J. Phys. Chem. B. 108 (3), 827-840 (2004).
- Volkmer, A. Vibrational imaging and microspectroscopies based on coherent anti-Stokes scattering microscopy. J. Phys. D: Appl. Phys. 38, R59-R81 (2005).
- Evans, C. L., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: chemical imaging for biology and medicine. Annu. Rev. Anal. Chem. 1, 883-909 (2008).
- Mukamel, S. Principles of nonlinear optical spectroscopy. , Oxford University Press. New York. (1995).
- Duncan, M. D., Reintjes, J., Manuccia, T. J. Scanning coherent anti-Stokes Raman microscope. Opt. Lett. 7 (8), 350-352 (1982).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering. Phys. Rev. Lett. 82 (20), 4142-4145 (1999).
- Folick, A., Min, W., Wang, M. C. Label-free imaging of lipid dynamics using Coherent Anti-Stokes Raman Scattering (CARS) and Stimulated Raman Scattering (SRS) microscopy. Curr. Opin. Genet. Dev. 21 (5), 585-590 (2011).
- Wang, P., Liu, B., Zhang, D., Belew, M. Y., Tissenbaum, H. A., Cheng, J. X. Imaging lipid metabolism in live Caenorhabditis elegans using fingerprint vibrations. Angew. Chem. Int. Ed. Engl. 53 (44), 11787-11792 (2014).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annu. Rev. Phys. Chem. 62, 507-530 (2011).
- Cheng, J. X., Jia, Y. K., Zheng, G., Xie, X. S. Laser-scanning coherent anti-Stokes Raman scattering microscopy and applications to cell biology. Biophys J. 83 (1), 502-509 (2002).
- Chiu, W. S., Belsey, N. A. N., Garrett, L., Moger, J., Delgado-Charro, M. B., Guy, R. H. Molecular diffusion in the human nail measured by stimulated Raman scattering microscopy. Proc Natl. Acad. Sci. U.S.A. 112, 7725-7730 (2015).
- Chen, X., Grégoire, S., Formanek, F., Galey, J. -B., Rigneault, H. Quantitative 3D molecular cutaneous absorption in human skin using label free nonlinear microscopy. J. of Control. Release. 200, 78-86 (2015).
- Kano, H., Hamaguchi, H. In vivo multi-nonlinear optical imaging of a living cell using a supercontinuum light source generated from a photonic crystal fiber. Opt. Express. 14 (7), 2798-2804 (2006).
- Brustlein, S., Ferrand, P., Walther, N., Brasselet, S., Billaudeau, C., Marguet, D., Rigneault, H. Optical parametric oscillator-based light source for coherent Raman scattering microscopy: practical overview. J. Biomed. Opt. 16 (2), 021106(2011).
- Chen, H., et al. A multimodal platform for nonlinear optical microscopy and microspectroscopy. Opt. Express. 17 (3), 1282-1290 (2009).
- Yue, S., Slipchenko, M. N., Cheng, J. X. Multimodal nonlinear optical microscopy. Laser Photonics Rev. 5 (4), 496-512 (2011).
- Sun, Q., Li, Y., He, S., Situ, C., Wu, Z., Qu, J. Y. Label-free multimodal nonlinear optical microscopy reveals fundamental insights of skeletal muscle development. Biomed Opt Express. 5 (1), 158-166 (2013).
- Le, T. T., Langohr, I. M., Locker, M. J., Sturek, M., Cheng, J. X. Label-free molecular imaging of atherosclerotic lesions using multimodal nonlinear optical microscopy. J. Biomed. Opt. 12 (5), 054007(2007).
- Ellis, D. I., Cowcher, D. P., Ashton, L., O'Hagana, S., Goodacre, R. Illuminating disease and enlightening biomedicine: Raman spectroscopy as a diagnostic tool. Analyst. 138, 3871-3884 (2013).
- A•P•E Angewandte Physik & Elektronik GmbH. , Germany. Available from: http://www.ape-berlin.de/en/page/calculator (2015).
- Ozçelik, M., et al. Pals1 is a major regulator of the epithelial-like polarization and the extension of the myelin sheath in peripheral nerves. J Neurosci. 30 (11), 4120-4131 (2010).
- Heinrich, C., Hofer, A., Ritsch, A., Ciardi, C., Bernet, S., Ritsch-Marte, M. Selective imaging of saturated and unsaturated lipids by wide-field CARS-microscopy. Opt. Express. 16 (4), 2699-2708 (2008).
- Kyriakidis, N. B., Skarkalis, P. Fluorescence spectra measurement of olive oil and other vegetable oils. J. AOAC Int. 83 (6), 1435-1439 (2000).
- King, R. Microscopic anatomy: normal structure. Handb. Clin. Neurol. 115, 7-27 (2013).
- Monsma, P. C., Brown, A. FluoroMyelin Red is a bright, photostable and non-toxic fluorescent stain for live imaging of myelin. J. Neurosci. Methods. 209 (2), 344-350 (2012).
- Wang, H., Fu, Y., Zickmund, P., Shi, R., Cheng, J. X. Coherent anti-stokes Raman scattering imaging of axonal myelin in live spinal tissues. Biophys. J. 89 (1), 581-591 (2005).
- Wang, H. W., Fu, Y., Huff, T. B., Le, T. T., Wang, H., Cheng, J. X. Chasing lipids in health and diseases by coherent anti-Stokes Raman scattering microscopy. Vib. Spectrosc. 50 (1), 160-167 (2009).
- Jung, Y., Tam, J., Jalian, H. R., Anderson, R. R., Evans, C. L. Longitudinal, 3D in vivo imaging of sebaceous glands by coherent anti-stokes Raman scattering microscopy: normal function and response to cryotherapy. J. Invest. Dermatol. 135 (1), 39-44 (2015).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved