Method Article
تحديد قمع نظام المناعة مقابل حماية الجهاز العصبي المركزي للالدوائية التدخلات في إزالة الميالين المناعة الذاتية
* These authors contributed equally
In This Article
Summary
This protocol describes how to determine whether pharmacological treatments for experimental autoimmune encephalomyelitis show CNS protection as a consequence of suppressing immune cell infiltration or are neuroprotective during the onslaught of immune cell infiltration.
Abstract
A major hallmark of the autoimmune demyelinating disease multiple sclerosis (MS) is immune cell infiltration into the brain and spinal cord resulting in myelin destruction, which not only slows conduction of nerve impulses, but causes axonal injury resulting in motor and cognitive decline. Current treatments for MS focus on attenuating immune cell infiltration into the central nervous system (CNS). These treatments decrease the number of relapses, improving quality of life, but do not completely eliminate relapses so long-term disability is not improved. Therefore, therapeutic agents that protect the CNS are warranted. In both animal models as well as human patients with MS, T cell entry into the CNS is generally considered the initiating inflammatory event. In order to assess if a drug protects the CNS, any potential effects on immune cell infiltration or proliferation in the periphery must be ruled out. This protocol describes how to determine whether CNS protection observed after drug intervention is a consequence of attenuating CNS-infiltrating immune cells or blocking death of CNS cells during inflammatory insults. The ability to examine MS treatments that are protective to the CNS during inflammatory insults is highly critical for the advancement of therapeutic strategies since current treatments reduce, but do not completely eliminate, relapses (i.e., immune cell infiltration), leaving the CNS vulnerable to degeneration.
Introduction
يتميز مرض التصلب المتعدد (MS) من قبل الآفات الالتهابية في الغالب في المناطق المادة البيضاء في الدماغ في مرحلة مبكرة من المرض. بعد تطور طويل الأمد، تم الكشف عن الرمادي ضمور المسألة التصوير بالرنين المغناطيسي، ويمثل مرحلة العصبية للمرض. وتعزى دباق رد الفعل، إزالة الميالين، والأضرار محور عصبي في المادة البيضاء في الجهاز العصبي المركزي تسلل الخلايا المناعية. أي من العلاجات المستخدمة حاليا في MS عكس أو مباشرة منع تنكس عصبي في الجهاز العصبي المركزي - بدلا من ذلك، فإنها تقلل من التهاب في تهدئة تنشيط الخلايا T و / أو تسلل إلى الجهاز العصبي المركزي. لأنه لا يوجد علاج لمرض التصلب العصبي المتعدد والمرضى باستخدام العلاجات الحالية لا يزالون يعانون من تطور المرض والاكتشافات من الأدوية التي تمنع إزالة الميالين والعصبية وفقدان مهمة خطيرة. ومع ذلك، التفريق بين التأثيرات على الخلايا المناعية وتلك الموجودة على الجهاز العصبي المركزي ويمكن أن يكون من الصعب تجريبيا، كنتيجة - أي تقليل الضرر الذي يصيب الجهاز العصبي المركزي - تبدو الصورةAME بغض النظر عن الآليات التي يحدث فيها. لذلك، وتقييم حماية الجهاز العصبي المركزي يجب شراكة مع تقديرات الجهاز العصبي المركزي تسلل الخلايا المناعية وتكاثر الخلايا المناعية في محيط لتحديد كيفية وكلاء الدوائية تؤثر على آليات المرض.
التجريبية التهاب الدماغ والنخاع المناعي الذاتي (بنت) هو نموذج حيواني راسخة من الاضطرابات الالتهابية المناعة الذاتية التي كانت مسؤولة بشكل مباشر عن اكتشاف الأدوية المستخدمة حاليا لعلاج مرض التصلب العصبي المتعدد 1-4. وغالبا ما تستخدم الفئران لEAE، مع C57BL / 6 الفئران كونها سلالة شعبية على أساس توافر المتغيرات الجينية. C57BL / 6 الفئران التي يسببها مع EAE المعرض تطور المرض المزمن مع بداية اليوم حوالي 10 بعد الاستقراء. تسلل من لحمة الحبل الشوكي والمخيخ هي سمة من التشريح المرضي من هذه الحيوانات، مع عدم وجود تسلل في لحمة القشرية 5. الآفات بالإضافة إلى ذلك، القشرية وإزالة الميالين في بالمطر والسمات المميزة للمرض 6-9، والتي هي غائبة نسبيا في C57BL / 6 الفئران. لذلك، قد يكون من الأفضل عندما يكون ذلك ممكنا لاستخدام الفئران SJL، التي تعاني من مرض منتكس والآفات وجدت في كل من الدماغ والحبل الشوكي التي تظهر مشابهة لتلك التي في MS 10.
العلاج لا يمكن أن تصنف على أنها اعصاب إذا الخلايا المناعية لا تصل أبدا إلى الجهاز العصبي المركزي. لذلك، هذا البروتوكول يجعل من استخدام تحليل cytometric تدفق المخ والحبل الشوكي، والطحال من الفئران EAE لتحديد آثار العلاج على تسلل الخلايا المناعية في الجهاز العصبي المركزي وانتشار الخلايا المناعية في محيطها، كما هو موضح سابقا (11). يوصف أيضا تحليلات المناعى أنسجة الجهاز العصبي المركزي لتحديد مدى وطبيعة العصبية. الجمع بين هذه الأساليب يسمح لتحديد ما إذا كانت تنشيط الخلايا المناعية وانتشرت في محيطها، ما إذا كانت الخلايا المناعية دخلت الجهاز العصبي المركزي، وعما إذا كان الجهاز العصبي المركزي والعلاقات العامةotected من التهاب أو تلف. إذا اشتبه آثار اعصاب على الرغم من تأثيرات على الجهاز المناعي، ويمكن المجربون يغير العلاج تبدأ مرات بعد تسلل الخلايا المناعية في حدث الجهاز العصبي المركزي.
هنا، نقدم بروتوكول باستخدام نموذجين مختلفين من EAE نشط، والخلية بوساطة نموذج حيواني T من مرض التصلب العصبي المتعدد، والتدفق الخلوي تحليل جنبا إلى جنب مع المناعية على مختلف نقاط وقت أثناء المرض لتحديد مدى فعالية من العلاجات التجريبية على الجوانب المختلفة ل MS المرضية. وهذه الطريقة سوف تساعد الباحثين في التفريق بين الآثار المترتبة على انتشار الخلايا المناعية وتسلل مقابل حماية الجهاز العصبي المركزي، مما يجعل من الاسهل لتضييق كيف تعمل الأدوية على التسبب بالمرض.
Protocol
الإجراءات التجريبية التي تنطوي على الفئران يجب أن تتوافق مع اللوائح المؤسسية والحكومية ذات الصلة. لهذه الدراسة، تم إيواء الفئران ومعالجتها وفقا للمعاهد الوطنية للصحة وجامعة ألاباما في برمنغهام المبادئ التوجيهية المؤسسية رعاية الحيوان واللجنة الاستخدام.
1. EAE الحث والتهديف
- حمل EAE في C57BL / 6 الفئران 11-13 أو الفئران SJL 10،11 كما هو موضح سابقا (13).
ملاحظة: يجب أن المجربون اختيار مثالي نموذجا للمسألة أبحاثهم (انظر المناقشة لمزيد من التفاصيل). - عشرات سجل وصف يوميا كما في السابق 11 لكل الماوس اعتبارا من يوم 7 وظيفة الاستقراء. مقارنة متوسط درجات اليومية مع مرور الوقت بين مجموعات العلاج.
2. علاج
- علاج الفئران EAE قبل بداية ظهور أعراض المرض لتحديد ما إذا كان العلاج يؤثر على المناعة تسلل خلية أو انتشار الأسلحة النووية.
- اختيار العلاج، ليثود التسليم، وتواتر العلاج مع مراعاة الدواء الدم في الدماغ حاجز نفاذية، نصف الحياة، والجرعة.
ملاحظة: EAE يزيد الدم في الدماغ حاجز نفاذية وقد تسمح المخدرات للوصول إلى الجهاز العصبي المركزي التي لن يكون الأمر خلاف ذلك قادرة في الحيوانات السليمة. إجراء التجارب لمنحنيات الاستجابة للجرعة تبحث في عشرات السريرية EAE قد تساعد في اختيار الجرعة المناسبة من الدواء. يجب أن يتم تنفيذ الضوابط مركبة بالتوازي مع العلاج من تعاطي المخدرات. بدلا من ذلك، الفئران خروج المغلوب الشرطية يمكن استخدامها مع تتزاحم والضوابط. - استخدام SJL أو C57BL / 6 الفئران لهذه التجربة. علاج الفئران في وقت مبكر بعد EAE الاستقراء (يوم 7)، قبل ظهور الأعراض باستخدام طريقة اختيار التسليم.
- التضحية وتشريح الفئران في ذروة المرض (حوالي اليوم 15)، كما في الخطوة 3.1 والخطوات الفرعية، على أساس أعلى متوسط درجات السريري مع مرور الوقت.
- سلوك تدفق الخلوي في النخاع الشوكي الماوس (كما في الخطوة 3.2) لتحديد infiltrati الخلايا المناعيةعلى الجهاز العصبي المركزي، وعلى الطحال (كما في الخطوة 3.3) لتحديد انتشار الخلايا المناعية في الهامش. على الفئران منفصلة، سلوك المناعية (كما في الخطوة 4) لقياس الخلايا النجمية والخلايا الدبقية الصغيرة، والحفاظ على المايلين.
- اختيار العلاج، ليثود التسليم، وتواتر العلاج مع مراعاة الدواء الدم في الدماغ حاجز نفاذية، نصف الحياة، والجرعة.
- علاج الفئران EAE بعد بداية ظهور أعراض المرض لتحديد ما إذا كان العلاج تحمي الجهاز العصبي المركزي بعد وقوع المناعة تسلل خلية.
- كرر الخطوة 2.1.1.
- استخدام الفئران SJL لهذه التجربة، حيث أن هذه الفئران لها الهجوع أمراض قابلة للقياس. علاج الفئران خلال الذروة الأولى في مرض (أو، إذا رغبت في ذلك، في ذروة انتكاسة التالية) مقاسا علامات سريرية متوسط.
- التضحية الفئران في الحث الوقت بعد EAE المطلوب. بسبب تسلل حدث بالفعل، فإنه قد لا يكون مفيدا لقياس تسلل عن طريق تحليل نظام مراقبة الأصول الميدانية. ومع ذلك، واتخاذ النخاع الشوكي لقياس رد الفعل دباق والمايلين لتحديد ما إذا كانت هناك حماية الجهاز العصبي المركزي على الرغم من تسلل الخلايا المناعية.
3. تحليل التدفق الخلوي
- تشريح
- تسمية ثلاثة أنابيب مخروطية 15 مل (واحد للدماغ، واحدة للحبل الشوكي، وواحدة لالطحال) لكل حيوان مع هوية الحيوان ونوع من الأنسجة الواردة. منع جميع الأنسجة في أنابيب منفصلة عن الإجراء بأكمله على الجليد.
- لتحليل FACS من الطحال، التضحية الفئران في ذروة المرض (~ يوم 15 بعد EAE الاستقراء) باستخدام ثاني أكسيد الكربون بمعدل تدفق نحو 15٪ حجم الحاويات في الدقيقة الواحدة عن 2-3 دقائق. تأكيد القتل الرحيم من عدم وجود التنفس. بعد التضحية من كل فأر، وإزالة الطحال 14 و المكان إلى الفرد، وصفت 15 مل أنبوب مخروطي (من الخطوة 3.1.1) التي تحتوي على RPMI الجليد الباردة تستكمل مع 2٪ FCS، و 100 وحدة دولية البنسلين، و 100 ميكروغرام / مل الستربتومايسين ( يشار إلى "وسائل الإعلام" في جميع أنحاء البروتوكول).
- لتحليل FACS من الدماغ والحبل الشوكي، نفذ نضح القلب عن طريق خفض الأذين الأيمن للماوس مع مقص جراحي لاطلاق سراح circulatinز الدم وثقب البطين الأيسر مع إبرة متصلة حقنة مليئة 10 مل من الجليد الباردة برنامج تلفزيوني. ببطء حقن 10 مل برنامج تلفزيوني.
- قطع رأس الفأر وجعل تقطيع خط الوسط من فروة الرأس مع مقص جراحي. قشر الجلد مرة أخرى بواسطة اليد أو مع ملقط وجعل تقطيع خط الوسط من الجمجمة مع مقص جراحي، وذلك باستخدام نقطة دخول الحبل الشوكي كبقعة البداية.
- قشر بعيدا الجمجمة مع ملقط الصغيرة واستخدام مغرفة لتحرير الدماغ. ضع العقول إلى المسمى أنابيب مخروطية 15 مل (من الخطوة 3.1.1) التي تحتوي على وسائل الاعلام.
- إزالة الجلد الماوس، مع ملقط ومقص جراحي، وسلب الماوس باستخدام مقص جراحي. قطع أطرافه، والذيل، والأضلاع، وأي العضلات المحيطة مع مقص جراحي لتحرير العمود الفقري.
- قطع العمود الفقري إلى حوالي 5 قطع متساوية تقريبا مع مقص جراحي والضغط طرف واحد من قطعة واحدة مع مرقئ، ومن ثم استخدام ر مرقئ آخرس مواصلة الضغط، تتحرك على طول قطعة حتى ساقيها والحبل الشوكي من أعلى. كرر ذلك لكل قطعة من العمود الفقري ووضع الحبال في الفرد، وصفت 15 مل أنابيب مخروطية (من الخطوة 3.1.1) التي تحتوي على وسائل الاعلام.
- تقييم تسلل الخلايا المناعية في المخ والحبل الشوكي
- قطع العقول والنخاع الشوكي إلى أجزاء أصغر باستخدام مقص العقيمة. سحق مع المكبس من حقنة 3 مل أكثر من 70 ميكرومتر مصفاة الخلية في أنبوب 50 مل الجديد بينما الشطف مصفاة مع وسائل الإعلام. جلب كل أنبوب إلى حجم 50 مل مع وسائل الإعلام. أجهزة الطرد المركزي في 453 x ج لمدة 5 دقائق لخلايا بيليه.
- طاف نضح وبيليه resuspend في 4 مل من 40٪ سائل الإعلام التدرج الكثافة. بعناية تراكب 40٪ التدرج الكثافة التي تحتوي على الخلايا على أعلى 2 مل من 70٪ كثافة التدرج في الجديدة 15 مل المخروطية أنبوب ماصة ببطء شديد على جدار أنبوب مخروطي لضمان طبقات المناسبة من الانحدار. تدور في 796 x ج لمدة 20 دقيقة في RT معمن الفرامل.
- بعناية إزالة طبقة المايلين العليا من التدرج مع نقل ماصة 1 مل، ثم إزالة خلايا قابلة للحياة في واجهة مع 1 مل نقل ماصة ونقل إلى 15 مل أنبوب مخروطي الشكل الجديد. جعل أنبوب إلى 15 مل مع وسائل الإعلام وأجهزة الطرد المركزي في 448 x ج لمدة 10 دقيقة.
- بيليه resuspend في 200 ميكرولتر وسائل الاعلام ووضع في بئر واحدة من لوحة 96-جيدا جولة القاع (كل عينة من كل حيوان سوف يذهب إلى جانب الخاص بها). أجهزة الطرد المركزي لوحة في 410 x ج لمدة 5 دقائق.
- نفض الغبار قبالة طاف و resuspend بيليه في 200 ميكرولتر من وسائل الإعلام restimulation (RPMI تستكمل مع 10٪ FCS، و 100 وحدة دولية / مل البنسلين، 100 ميكروغرام / مل الستربتومايسين، 2 مم L-الجلوتامين، 1X الأحماض الأمينية غير الأساسية، 1 ملم البيروفات الصوديوم ، و 55 ميكرومتر β-المركابتويثانول، بالإضافة إلى 50 نانوغرام / مل phorbol ميريستات خلات (سلطة النقد الفلسطينية)، 750 نانوغرام / مل ionomycin، والمانع النقل البروتين Brefeldin A). وضع لوحة في حاضنة عند 37 درجة مئوية لمدة 4 ساعات.
ملاحظة: سلطة النقد الفلسطينية وionomالنتائج restimulation ycin في تفعيل جميع الخلايا اللمفية تي-بغض النظر عن خصوصية المستضد بهم من أجل تقييم عدد كل مجموعة فرعية الخلايا التائية في نسيج معين. ومع ذلك، استجابات الخلايا التائية المستجيب مستضد معين يمكن تقييم بطرق مختلفة، بما في ذلك restimulating الخلايا مع MOG الببتيد في وجود Brefeldin و15،16. - تقييم الظواهر خلية الجهاز العصبي المركزي CD4 + T
- بعد الحضانة، الطرد المركزي ال 96 جيدا لوحة ذهابا وأسفل (من الخطوة 3.2.5)، في 410 x ج لمدة 5 دقائق ونفض الغبار قبالة طاف. يتم تنفيذ كافة الخطوات تلطيخ التالية في هذه اللوحة.
- غسل الخلايا في 200 ميكرولتر PBS مع 2٪ FCS وأجهزة الطرد المركزي في 410 x ج لمدة 5 دقائق. نفض الغبار قبالة طاف واحتضان الخلايا مع 200 ميكرولتر PBS تحتوي على 2٪ FCS مع نادي بلوك (استنساخ 2.4G2) عن 10-15 دقيقة على الجليد.
- لبدء صمة عار خارج الخلية، وخلايا الطرد المركزي في 410 x ج لمدة 5 دقائق، ونفض الغبار قبالة طاف، وبيليه resuspend في 50 &# 956؛ ل من الكوكتيل وصمة عار سطح تحتوي على fluorophore المسمى الأجسام المضادة ضد CD4 (1: 200، 1 ميكروغرام / مل)، TCRβ (1: 200، 1 ميكروغرام / مل)، وصبغة الجدوى (1: 500) المخفف في برنامج تلفزيوني لمدة 15 دقيقة على الجليد. خلايا الطرد المركزي في 410 x ج لمدة 5 دقائق ونفض الغبار قبالة طاف. غسل الخلايا 2X في 200 ميكرولتر PBS ثم الطرد المركزي في 410 x ج لمدة 5 دقائق.
- بعد إزالة وصمة عار خارج الخلية، والشروع في إجراء تلطيخ الخلايا عن طريق تثبيت / permeabilization تليها تلطيخ الخلايا.
- للبدء، ونفض الغبار قبالة طاف وإصلاح / خلايا permeabilize مع Foxp3 عامل النسخ الكواشف تلطيخ 17 (وفقا لتعليمات الشركة الصانعة، وانظر قائمة المواد) لمدة 30 دقيقة ليلة وضحاها في 4 درجة مئوية.
- غسل الخلايا في المخزن permeabilization 150 ميكرولتر من عدة وأجهزة الطرد المركزي لوحة في 410 x ج لمدة 5 دقائق. نفض الغبار قبالة طاف وصمة عار الخلايا في المخزن permeabilization 50 ميكرولتر مع fluorophore المسمى الأجسام المضادة ضد IL-17A (1: 200، 1 ميكروغرام / مل)، IFN-γ (1: 200، 1 ميكروغرام / مل)، وFoxp3 (1: 200، و 2.5 ميكروغرام / مل) المخفف في برنامج تلفزيوني لمدة 30 دقيقة على الجليد.
- خلايا الطرد المركزي في 410 x ج لمدة 5 دقائق ونفض الغبار قبالة طاف. لإزالة الأجسام المضادة الزائدة غسل 3X في المخزن permeabilization 200 ميكرولتر ثم الطرد المركزي في 410 x ج لمدة 5 دقائق. نفض الغبار قبالة طاف و resuspend في 200 ميكرولتر برنامج تلفزيوني.
- تحليل الخلايا عن طريق التدفق الخلوي، النابضة على CD4 + الحية TCRβ + الخلايا كما هو موضح سابقا 11 لتقييم نسبة الخلايا معربا كل جزيء. عد الخلايا باستخدام عدادة الكريات 18 أو غيرها من طريقة التحقق من صحة لتحديد عدد الخلايا في الماوس مع كل من الظواهر خلايا CD4 + T.
- باستخدام البيانات التي تم الحصول عليها، وحساب النسبة المئوية وعدد خلايا CD4 + T اختراق الدماغ والحبل الشوكي من كل فأر، مع التركيز بشكل خاص على هؤلاء السكان والتي تلعب أدوارا حاسمة في EAE المرضية والحماية19: IL-17A + IFN-γ -، IL-17A + IFN-γ +، IL-17A - IFN-γ +، Foxp3 +.
- تقييم الطرفية تكاثر الخلايا T وتفعيل
- سحق الطحال مع الشرائح زجاج بلوري في طبق ثقافة 60 × 15 مم. ضع تعليق الخلية في أنبوب 15 مل المخروطية باستخدام وسائل الإعلام لتعليق الخلايا. ملء أنبوب إلى 15 مل مع الخلايا وسائل الإعلام وأجهزة الطرد المركزي في 448 x ج لمدة 5 دقائق.
- نضح وسائل الإعلام و resuspend بيليه في 2 مل الناشر ACK عازلة في RT لليز خلايا الدم الحمراء لحوالي 3 دقائق.
- جلب أنبوب لحجم 15 مل مع وسائل الإعلام والانفعال على 70 ميكرومتر مصفاة الخلية في أنبوب جديد. خلايا الطرد المركزي في 448 x ج لمدة 5 دقائق، نضح طاف، و resuspend في 2 مل سائل الإعلام.
- تقييم الطرفية تكاثر الخلايا CD4 + T من كي-67 تلطيخ
- ضع قسامة صغيرة (عادة 200 ميكرولتر) من مكافئأرقام uivalent من splenocytes من 3.3.3 إلى الآبار الفردية (واحد لكل عينة) في لوحة ذهابا والقاع 96-جيدا.
- أجهزة الطرد المركزي في 410 x ج لمدة 5 دقائق ونفض الغبار قبالة طاف. resuspend في 200 ميكرولتر PBS تحتوي على 2٪ FCS وتكرار الطرد المركزي. نفض الغبار من الخلايا طاف و resuspend مع برنامج تلفزيوني يحتوي على 2٪ FCS مع نادي بلوك (استنساخ 2.4G2)، واحتضان ل10-15 دقيقة على الجليد. وصمة عار للخارج الخلية كرر الخطوة 3.2.6.3.
- بعد إزالة وصمة عار خارج الخلية، والشروع في إجراء تلطيخ الخلايا عن طريق تثبيت / permeabilization تليها تلطيخ الخلايا.
- كرر الخطوة 3.2.6.4.1.
- خلايا الطرد المركزي في 410 x ج لمدة 5 دقائق ونفض الغبار قبالة طاف. غسل الخلايا 1X في 200 العازلة ميكرولتر permeabilization من عدة وأجهزة الطرد المركزي في 410 x ج لمدة 5 دقائق. نفض الغبار قبالة طاف وصمة عار الخلايا في المخزن permeabilization 50 ميكرولتر مع anti-كي-67 الأجسام المضادة (1: 200، 1 ميكروغرام / مل) لمدة 30 دقيقة.
- خلايا الطرد المركزي في 410 x ج فوص 5 دقائق ونفض الغبار قبالة طاف. غسل الخلايا 2X في 200 العازلة ميكرولتر permeabilization من عدة وأجهزة الطرد المركزي في 410 x ج لمدة 5 دقائق.
- نفض الغبار قبالة طاف وغسل الخلايا 1X في 200 ميكرولتر برنامج تلفزيوني وأجهزة الطرد المركزي في 410 x ج لمدة 5 دقائق. تحليل الخلايا عن طريق التدفق الخلوي، النابضة على CD4 + الحية TCRβ + الخلايا كما هو موضح سابقا 11، ثم تقييم في المئة كي-67 + الخلايا.
- تقييم الطرفية الظواهر خلايا CD4 + T
- وضع 200 ميكرولتر من الخلايا (من الخطوة 3.3.3) في لوحة 96-جيدا ذهابا والقاع (بئر واحدة لكل عينة) وأجهزة الطرد المركزي في 410 x ج لمدة 5 دقائق وإعادة تنشيط كما هو الحال في 3.2.5.
- وضع لوحة في حاضنة عند 37 درجة مئوية لمدة 4 ساعات. تنفيذ الإجراء تلطيخ نفسه كما في الخطوة 3.2.6 والخطوات الفرعية. تحليل الخلايا عن طريق التدفق الخلوي كما هو الحال في 3.2.6.4.4-3.2.6.5.5.
4. المناعية لد الكمي
- إعداد الأنسجة
- التضحية الفئران EAE في تجربة منفصلة عن تلك المستخدمة في الخطوة 3 والخطوات الفرعية في أي لحظة بعد EAE التحريض (في كثير من الأحيان ~ 30 يوما، خلال المرحلة المزمنة من المرض لC57BL / 6 الفئران أو خلال الذروة في متوسط درجات السريرية ل SJL الفئران) باتباع الخطوات التالية لتحديد مدى دباق رد الفعل وإزالة الميالين.
- تخدير الفئران مع 2.5٪ الأيزوفلورين و97،5٪ الأكسجين وتأكيد عمق مناسب من التخدير مع اصبع القدم لطيف قرصة باستخدام ملقط، وتبحث عن عدم استجابة. أداء نضح transcardiac كما هو موضح في الخطوة 3.1.3. بعد حقن برنامج تلفزيوني في البطين الأيسر، استخدم حقنة جديدة لحقن 10 مل من 4٪ لامتصاص العرق في برنامج تلفزيوني تنبيه: لامتصاص العرق والجلد والرئة إزعاج قد تسبب أضرارا خطيرة للعيون، ويشتبه في انها تسبب سرطان. تجنب استنشاق، ابتلاع، والاتصال مع الجلد والعينين. يجب أن يتم تنفيذ نضح في غطاء الدخان.
- إزالة العقول والأعمدة الفقرية كما هو موضح في الخطوات 3.1.4 - 3.1.6. ربط الأعمدة الفقرية لالعصي مع سلسلة لضمان التوافق على التوالي من الحبل الشوكي.
- وضع العقول في قارورة التلألؤ المسمى مع معرف الحيوان مع حوالي 20 مل من 4٪ لامتصاص العرق في برنامج تلفزيوني، والنخاع الشوكي في أنابيب مخروطية 50 مل المسمى مع معرف الحيوان مع حوالي 50 مل من 4٪ لامتصاص العرق في برنامج تلفزيوني لمرحلة ما بعد إصلاح بين عشية وضحاها.
- لcryoprotect العقول، وشطف 3 مرات في برنامج تلفزيوني 1X وتخزينها في 4 درجة مئوية في 30٪ سكروز في برنامج تلفزيوني 1X. السماح للعقل أن تنخفض إلى الجزء السفلي من عبواتها (حوالي 3 أيام).
- إزالة الكالسيوم من العمود الفقري من قبل الشطف ذلك 3 مرات في برنامج تلفزيوني 1X ووضعه في حجم كبير (حوالي 50 مل للماوس الحبل الشوكي) من 0.5 M EDTA في برنامج تلفزيوني 1X (بدأت ودرجة الحموضة يكون ~ 10؛ درجة الحموضة إلى ~ 7.8 مع 6 N حمض الهيدروكلوريك) ل2-3 أسابيع حتى العظم لم يعد جامدة. Cryoprotect العمود الفقري عن طريق اتباع الخطوة 4.1.5.
- أدمغة تضمين والأعمدة الفقرية في أكتوبر باتباع الخطوات الفرعية أدناه بمجرد أن تنخفض إلى الجزء السفلي من عبواتها.
- جعل خليط من 1 جزء 30٪ سكروز في برنامج تلفزيوني 1X و 2 أجزاء أكتوبر (على سبيل المثال، إضافة 15 مل 30٪ سكروز في برنامج تلفزيوني 1X إلى 30 مل أكتوبر).
- يضاف خليط أكتوبر / السكروز إلى القالب تضمينها (22 × 22 × 20 مم للأدمغة و 22 × 30 × 20 مم للالنخاع الشوكي) إلى أن حوالي نصف كامل.
- قطع الأعمدة الفقرية إلى 6 قطع متساوية الحجم باستخدام شفرة حلاقة والمكان الى 22 × 30 × 20 مم تضمين العفن تواجه الأمام لأقسام الحبل الشوكي الاكليلية. ضع العقول كلها في 22 قوالب × 22 × 20 مم تواجه الأمام.
- إضافة أكتوبر / خليط السكروز لتغطية الأنسجة والسماح لها الجلوس لمدة 1 ساعة. بحيث يمكن للفقاعات الهروب. خلال هذه الساعة، إضافة 2-methylbutane إلى طبق التي يمكن أن تعقد تضمين القوالب لفلاش تجميد. وضع الطبق على الجليد الجاف وتغطية ما قبل بارد.
- فلاش تجميد القالب في 2-methylbutane على الثلج الجاف ومخزن في -80 درجة مئوية داخل تيار مترددontainer لمنع الجفاف.
- عندما تصبح جاهزة، قسم الأنسجة في 16 ميكرون مع ناظم البرد وجبل على الشرائح اتهم كهربية. وضع كل قسم 10 عشر على شريحة في كل من الدماغ والحبل الشوكي (على سبيل المثال، الشريحة 1 سيكون المادتين 1 و 11، و 21، والشريحة 2 سيكون لها الأبواب 2 و 12، و 22، وهلم جرا). تخزين الشرائح في -80 درجة مئوية أو استخدام الحق بعيدا عن تلطيخ.
- تلطيخ لدباق رد الفعل والمايلين
- عندما تصبح جاهزة للتلوين، اختر شريحة واحدة في كل من الدماغ والحبل الشوكي في وصمة عار لكل حيوان في نفس (أو ما شابه ذلك قدر الإمكان) المنطقة. للدماغ، واختيار الشرائح تظهر الجسم الثفني وحزمة الحزامي.
- مكان الشرائح مع الأنسجة على كتلة الحرارة عند 70 درجة مئوية لمدة 7 دقائق. بعد 7 دقائق إيقاف كتلة الحرارة والسماح للشرائح باردة على كتلة الحرارة لمدة 10 آخرين - 15 دقيقة. هذا سيمنع أقسام الأنسجة من السقوط الشرائح أثناء إجراء تلطيخ.
- غسل الشرائح 3 مرات في كل برنامج تلفزيوني 1X مع المنظفات بنسبة 0.1٪ غير أيوني (لمستضدات الخلايا) أو برنامج تلفزيوني 1X (عن الأجسام المضادة التي تستهدف المستضدات السطحية) لمدة 5 دقائق.
ملاحظة: بما أن الأجسام المضادة المستخدمة في هذا البروتوكول هي الخلايا، وسيتم استخدام المنظفات غير أيوني في الخطوات اللاحقة. لا تسمح أبدا الشرائح حتى يجف تماما بعد هذه الخطوة. - وضع الشرائح في وعاء، وتغطي مع سيترات عازلة درجة الحموضة 3.0. لجعل عازلة سيترات، إضافة 0.192 غرام حامض الستريك لا مائي إلى الحجم النهائي من 100 مل من الماء. ضبط درجة الحموضة مع حمض الخليك إذا فوق درجة الحموضة 3.0 أو هيدروكسيد الصوديوم إذا أدناه.
- احتضان الشرائح عند 37 درجة مئوية لمدة 30 دقيقة ويغسل 3 مرات في برنامج تلفزيوني 1X بنسبة 0.1٪ المنظفات غير أيوني لمدة 5 دقائق.
- دائرة منطقة حول الأنسجة باستخدام قلم حاجز مسعور ووضع الشرائح في غرفة ترطيب (على سبيل المثال، مربع الشريحة التي تحتوي مناشف ورقية مبللة). إضافة إلى عازلة تمنع الأنسجة. احتضان لمدة 30 دقيقة في RT.
ملاحظة: حجب عازلة يتكون من برنامج تلفزيوني 1Xبالإضافة إلى المنظفات غير أيوني 0.3٪ والمصل المناسب (5٪) على أساس مجموعة من الأجسام المضادة الثانوية، أي مصل الحصان للبروتين النخاعين الأساسي (ب ب) وييفي الدبقية البروتين الحمضية (GFAP)، ومصل الماعز لIba1. - نفض الغبار عازلة تمنع من الشرائح وإضافة الأجسام المضادة الأولية (1: 1000 أو 0.2 ميكروغرام / مل الماعز المضادة للبروتين النخاعين الأساسي للقليلة التغصن، 1: 1000 أو 1 ميكروغرام / مل إلى 3 ميكروغرام / مل الماوس مكافحة GFAP لالنجمية، أو 1 : 750 أو 0.67 ميكروغرام / مل أرنب مكافحة Iba1 عن الخلايا الدبقية الصغيرة) المخفف في عازلة تمنع المناسب (راجع الخطوة 4.2.6) إلى منطقة حلقت. ترك في 4 درجة مئوية خلال الليل في غرفة ترطيب.
- الأجسام المضادة نفض الغبار في عرقلة العازلة من الشرائح وغسل الشرائح 3 مرات في برنامج تلفزيوني 1X بنسبة 0.1٪ المنظفات غير أيوني لمدة 5 دقائق.
- إضافة الضد الثانوية (1: 200 أو 7.5 ميكروغرام / مل الحصان المعقدة البيروكسيديز المضادة للماوس لم ب ب وGFAP، أو الماعز المعقدة البيروكسيديز المضادة للأرنب لIba1) المخفف في عازلة تمنع المناسب (انظر الظريفص 4.2.6) إلى منطقة حلقت وترك شرائح لاحتضان في غرفة ترطيب لمدة 1 ساعة على RT.
- الأجسام المضادة نفض الغبار في عرقلة العازلة من الشرائح وغسل الشرائح 3 مرات في برنامج تلفزيوني 1X بنسبة 0.1٪ المنظفات غير أيوني لمدة 5 دقائق.
- إعداد-أفيدين البيوتين-البيروكسيديز المعقدة (ABC) في المناعي (انظر قائمة المواد) 30 دقيقة قبل الاستخدام وتستنهض الهمم على شاكر لحين الحاجة إليها في 4.2.12. إضافة 0.3٪ H 2 O 2 في الميثانول إلى منطقة حلقت لمدة 10 دقيقة لإرواء النشاط البيروكسيداز الذاتية.
- حل نفض الغبار قبالة الشرائح ويغسل في 2 مرات في برنامج تلفزيوني 1X أو برنامج تلفزيوني 1X بنسبة 0.1٪ المنظفات غير أيوني لمدة 5 دقائق، ثم 1 مرة في برنامج تلفزيوني 1X. إضافة ABC كاشف للمنطقة حلقت لمدة 30 دقيقة.
- حل نفض الغبار قبالة الشرائح ويغسل 3 مرات في برنامج تلفزيوني 1X لمدة 5 دقائق، ثم 2 مرات في الماء لمدة 5 دقائق. جعل 3،3'-diaminobenzidine (DAB) حل (انظر قائمة المواد) وإضافته لتغطية الأجزاء.
ملاحظة: هذه الخطوة تتطلب المجهر لمراقبة الأمثل كشفالوقت أيون من تلطيخ ويجب أن يتم لنفس المقدار من الوقت للشرائح ليتم مقارنتها. - غسل الشرائح 3 مرات في الماء لمدة 5 دقائق لكل منهما. يذوى الأنسجة عن طريق وضع في الحلول التالية لمدة 2 دقيقة لكل منهما: 70٪ من الإيثانول في الماء، و 95٪ من الإيثانول في الماء، و 100٪ من الإيثانول في الماء، 50٪ الزيلين و 50٪ من الإيثانول، و 100٪ الزيلين. ختم ساترة على الشريحة مع تصاعد المتوسط راتنجية.
- بدلا من ذلك، نفذ مناعي تلطيخ كما هو موضح سابقا 11 لتقييم دباق رد الفعل باستخدام أجسام مضادة ضد إيبا-1 و GFAP.
- التقاط صور من كل قسم الحبل الشوكي (ملطخة الأجسام المضادة منها باستخدام DAB) مع 4X، 0.13 هدف NA وحفظ الصور كما و tiff. بدلا من ذلك، واتخاذ الصور من الجسم الثفني وحزمة الحزامي في اليمين أو اليسار نصف الكرة المخ باستخدام 20X، 0.50 هدف NA وحفظ الصور كما و tiff. لتقرير أكثر شمولا من الحمل آفة في الدماغ، فمن المفيد أن تشمل كلا من نصف الكرةوفاق في التحليلات.
- قياس مساحة جزء يعني لدباق رد الفعل (تلطيخ Iba1 وGFAP)
- تحميل المعاهد الوطنية للصحة يماغيج (http://imagej.nih.gov/ij/) ومفتوحة على جهاز كمبيوتر. في برنامج ImageJ، استخدم القائمة سلسلة ملف> فتح وحدد صورة من الخطوة 4.2.16. رسم المنطقة باستخدام "التحديدات مضلع" أداة على شريط القوائم. لالنخاع الشوكي، وتتبع القسم بأكمله؛ لالعقول، والجسم الثفني وحزمة الحزامي. تحويل الصورة إلى 16 بت من خلال الذهاب الى صورة> نوع والنقر على "16 بت".
- دي الضوضاء صورة عن طريق الذهاب إلى عملية> طرح الخلفية وتعيين "المتداول نصف قطر الكرة" إلى ما لا يقل عن حجم أكبر الكائن الذي ليست جزءا من الخلفية (راجع دليل المستخدم يماغيج في http: //rsbweb.nih . محافظة / ط / مستندات / دليل / 146-29.html).
ملاحظة: للحصول على صورة 4X من إيبا-1 تلطيخ نستخدم 4.0 وGFAP نستخدم 50.0، ولكن قد تختلف هذه الأرقام حسب تكبير الصورة وكثافة تلطيخensity. - تحقق "سطح مكافئ انزلاق" ثم انقر على "موافق". إذهب إلى صورة> ضبط> العتبة ... وتعيين أدنى مستوى العتبة (الشريط العلوي) باستخدام قضبان الانزلاق. تشمل تلطيخ فقط التي هي الخلوي وتكون متناسقة عبر الصور. للصور مع الخلفيات الداكنة (ينطبق على تلطيخ الفلورسنت فقط)، تأكد من تحديد خانة "الخلفية المظلمة".
- الذهاب إلى تحليل> تعيين القياسات ... واختر "جزء المنطقة" (يعطي في المئة من مساحة thresholded داخل المنطقة من الفائدة). تأكد من أن "الحد الى عتبة" لم يتم التحقق منه، ويتم اختبار "تسمية العرض". انقر على زر "موافق" عند اكتماله.
- للحصول على قياسات، انتقل إلى تحليل> قياس. ستظهر "نتائج" مربع منبثق ويمكن حفظ هذه البيانات كما هو أو نسخها في برنامج آخر. لتحليل ومقارنة القيم "منطقة الكسر" بين مجموعات العلاج.
- الكمي لم ب ب تلطيخ التي كتبها التقيدكثافة كال
- صورة مفتوحة ورسم مساحة من الاهتمام كما هو موضح في الخطوة 4.3.1. الذهاب إلى تحليل> تعيين القياسات ... واختر "يعني قيمة الرمادي" (مجموع القيم الرمادية في اختيار مقسوما على عدد من بكسل). تأكد من أن "الحد الى عتبة" لم يتم التحقق منه، ويتم اختبار "تسمية العرض". انقر على زر "موافق" عند اكتماله.
- للحصول على قياسات، انتقل إلى تحليل> قياس. مراقبة على "نتائج" مربع منبثقة تظهر. نسخ هذه البيانات وحفظها كما هي أو نسخ إلى برنامج آخر.
- للتحليل، نسخ ولصق القيم في برنامج آخر. تحويل قيمة الرمادي متوسط في الكثافة الضوئية (OD) باستخدام الصيغة: OD = تسجيل 10 (255 / يعني قيمة الرمادي).
النتائج
هنا، استخدمنا نموذجين من EAE لفهم ما إذا كان وكيل الدوائية يوفر حماية الجهاز العصبي المركزي من قبل أي تخفيف الجهاز العصبي المركزي تسلل خلايا T أو منع المايلين وإصابة محور عصبي أثناء هجمة التهاب تسلل الخلايا المناعية. لتحديد ما إذا كان عامل علاجي يمنع تسلل الخلايا المناعية في الحبل الشوكي، يتم استخدام نموذج الفأر C57BL / 6 من EAE المزمن حيث تسلل الخلايا المناعية وعلم الأمراض وتقع في الغالب في الحبل الشوكي (الشكل 1A). لتحديد ما إذا كان الدواء العلاجية يوفر حماية الجهاز العصبي المركزي خلال اقتحام الخلايا المناعية في الجهاز العصبي المركزي، ونموذج حيواني SJL من الانتكاس تحويل بين EAE يستخدم، والذي يدل على علم الأمراض في كل من الدماغ والحبل الشوكي (الشكل 1B).
تقييم السريرية
إجراء تقييمات السريرية ذات الصلة وفقا للعنوان التالي لنموذجي (الشكل 1C) أو غير نمطية (الشكل 1D) EAE. لأمراض السريرية النمطية، على درجة من 0 هو أي سلوك غير طبيعي. عندما التقطت من قاعدة الذيل، الذيل قد تدور بسرعة (مثل الكثير من دوار المروحية) وسوف رجليه الخلفيتين تنتشر على حدة. والنتيجة السريرية لل1 هي ذيل يعرج جزئيا، والتي يمكن تحديدها من خلال رفع الماوس بواسطة قاعدة الذيل. قد يكون أضعف الدورية مثل طائرات الهليكوبتر العادي أو غائبا، وجزء من الذيل قد يكون يعرج تماما. وهناك طريقة مفيدة لتحديد مدى الشلل الذيل لتشغيل واحد إصبع يصل طول الذيل، وذيل unparalyzed سوف تلتف عادة حول الإصبع، في حين ذيل بشلل جزئي لن تكون قادرة على القيام بذلك. والنتيجة السريرية من 2 تمثل ذيل مشلولة تماما. لا حركة الذيل يحدث على الإطلاق عند اختيار الماوس لأعلى عند قاعدة الذيل. والنتيجة السريرية من 3 تمثل الجزئي الشلل هند أطرافهم. يتطلب تحديد هذه النتيجة أن الفأر أن يكون حرا في الانتقال إلى رابطة العمل المنصفر السطح. إذا كان أحد أطرافه الخلفية يجر بعد أن تحرك الماوس إلى الأمام، أو في حالة ظهور واحد أو كلا الأطراف الخلفية لتكون مشلولة جزئيا، يمكن إعطاء بنتيجة 3. والنتيجة السريرية من 4 تمثل كامل الشلل هند أطرافهم. مع هذه النتيجة، فإن الماوس يكون غير قادر على تحريك أطرافه الخلفية وسوف سحب نفسه إلى الأمام باستخدام أطرافه الأمامية. والنتيجة السريرية من 5 تمثل الماوس المحتضر، أو ماوس مع صعوبة تتحرك نفسها عبر قفصه أو التنفس. إذا كان الماوس لا يمكن سحب نفسه على طول الجزء السفلي من القفص أو في حال صعوبة في التنفس لها، والماوس يجب أن الموت الرحيم إنسانية. والنتيجة السريرية من 6 تمثل الماوس عثر عليه ميتا في قفصه. والنتيجة من 6 غير عادية وينبغي التحقيق في أسباب الوفاة غير EAE.
قد المرض السريري غير نمطية أو قد لا يكون مصحوبا الشلل. قد يكون من الضروري لتشمل نظامين التهديف منفصلة إذا حضر ماوس مع المرض الغامض بالإضافة إلى أعراض نموذجية. والنتيجة من 0 هو أي سلوك غير طبيعي، لالصورة مع نظام التسجيل نموذجي. والنتيجة السريرية من 1 يمثل بدوره رئيس طفيف أو الميل في حين أن الفأر هو المشي. ويمكن تحديد ذلك عن طريق السماح الماوس على السير إلى الأمام وبملاحظة الاتجاهية المستمر اليمين أو اليسار لحركته. والنتيجة السريرية من 2 تمثل منعطفا رئيس أكثر وضوحا وضعف القدرة المقوم. كما هو الحال مع النتيجة الشاذة من 1، والفأر لديه اتجاهها إلى حركتها وقد يجدون صعوبة طفيفة مع التوازن. والنتيجة السريرية من 3 تمثل عدم القدرة على السير في خط مستقيم. الماوس سوف يجدون صعوبة في تحقيق التوازن وقد تستخدم الجانب من القفص للمساعدة في حق نفسه لأنه يمشي. والنتيجة السريرية من 4 تمثل الماوس ممددة على جانبها، غير قادر على المشي بسبب قضايا الموازنة. قد يكون الفأر قادرا على سحب نفسه على طول الجزء السفلي من القفص ولكن قد يكون اتجاهها لحركته. والنتيجة السريرية من 5 تمثل المتداول المستمر ما لم تدعمها. فأر التي تصل إلى هذه النتيجة يجب أن الموت الرحيم إنسانية. عيادةالله بنتيجة 6 تمثل الماوس عثر عليه ميتا في قفصه. والنتيجة من 6 غير عادية وينبغي التحقيق في أسباب الوفاة غير EAE.
قد يكون من الضروري للسماح ل "في ما بينهما" العشرات، على سبيل المثال، إضافة 0.5 إلى درجة إذا كانت التغييرات حالة الفأر قليلا أو اذا كان اختيار بين اثنين من عشرات أمر صعب. على سبيل المثال، الفأر الذي يبدأ في التحرك ببطء أكثر من نظيرتها العادية ولكن يعرض من الشلل، أو ماوس أن يشبك قدميه الخلفيتين مع جبهتها بدلا من التفلطح الساقين للخروج عندما التقطت من ذيله يجوز إعطاء درجة من 0.5 . فأر التي يمكن سحب نفسها فقط على طول الجزء السفلي من القفص وغير قادرة على نشل أطرافه الخلفية بشكل دوري أو عند لمسها يمكن أن تعطى الدرجة 3.5 فقط.
تقييم وتخفيض المناعة تسلل خلية
بعد تحريض EAE في / 6 نموذج الفأر C57BL (الشكل 1A، يوم 0)، presentati مستضدعلى وانتشار خلايا تي في الطحال تحدث في أيام 1-5 تليها تسلل الخلايا المناعية في الجهاز العصبي المركزي حول يوم 7. بعد حوالي 3 إلى 5 أيام من الفئران المناعة تسلل خلية الأولية الحالية مع علامات سريرية. لتقييم ما إذا كان عامل علاجي يتم حظر تسلل الخلايا المناعية في الحبل الشوكي، يتم إدخال المخدرات أو مركبة في يوم 7 بعد تقديم المستضد وانتشار في الطحال ولكن قبل بدء الخلايا المناعية التسلل إلى الحبل الشوكي. إذا كان قد تم الموهن تسلل الخلايا المناعية، يجب أن تعكس مسار المرض السريري علامات سريرية محسنة خلال مرحلة ارتفاع المرض من أيام 10-15 (الشكل 2).
ومن شأن الحد من تسلل الخلايا المناعية أيضا أن يؤدي إلى انخفاض neuroinflammation. وتعتبر كثرة الخلايا النجمية على رد الفعل وكثرة الدبيقيات بصمات كبيرة لneuroinflammation. تلطيخ لالنجمية مع GFAP والخلايا الدبقية الصغيرة مع إيبا-1 يمكن استخدامها لتقييم تشانغوفاق في المتوسط تلطيخ منطقة الكسر لقياس neuroinflammation (الشكل 3).
لتحديد ما إذا كان يتم تقليل تسلل الخلايا المناعية، تتم إزالة النخاع الشوكي ومعالجتها لتحليل التدفق الخلوي في ذروة المرض (الشكل 1A، ما يقرب من يوم 18). هذا يضمن أن أكبر عدد من الخلايا المناعية قد دخلت في النخاع الشوكي. يعتبر مدخل للخلايا T في الجهاز العصبي المركزي الحدث التهابات بدء وتم العثور على كل من الخلايا Th1 و Th17 في النماذج الحيوانية من EAE وكذلك مرضى التصلب المتعدد. معا، وينبغي أن يشمل تحليل cytometric تدفق تقييم كلا النوعين من الخلايا T المسببة للأمراض. وعلاوة على ذلك، Tregs و-جيدا اتسم خلايا القامع تي أن يضعف المرض. ولذلك، فإن النسبة المئوية للTregs من مجموع السكان CD4 + يجب تقييمها مقارنة مع نسبة السكان الخلية التائية المستجيب. هذا وسوف تكشف إذا كان قد حدث انخفاض عام في الخلايا التائية تسلل أو إذا ذره هو انحراف من الظواهر الخلايا التائية في الجهاز العصبي المركزي. المؤامرات نقطة التمثيلية (الشكل 4A) يبرهن على وجود انخفاض في العدد الإجمالي للCD4 + T تسلل خلايا في النخاع الشوكي من الفئران المعالجة المخدرات مقارنة مع النخاع الشوكي من الفئران المعالجة المركبة (أرقام في الأرباع اليمنى العليا). لتقييم TH1، Th17، والخلايا Treg يتم تقييم البروتينات توقيع التالية: IFN-γ +، IL-17 +، وFoxp3 +، على التوالي، وينبغي أن يتم تخفيض الشكل (4A). يجب إجراء التحليل الإحصائي على CD4 +، IFN-γ +، IL-17 +، وأرقام الهواتف المحمولة Foxp3 + ليبرهن على وجود انخفاض كبير (الشكل 4B). استبعاد انحراف من مجموعات فرعية الخلايا التائية، وتقييم إحصائي للنسبة IFN-γ + IL-17 +، IFN-γ + IL-17 -، IL-17 + IFN-γ -، ويتم تنفيذ Foxp3 + الخلايا ( فايجوري 4C).
للقضاء على إمكانية أن خفض في الجهاز العصبي المركزي تسلل خلايا T هو نتيجة لتثبيط انتشار الأسلحة النووية، التنشيط، والتمايز في محيطها، يحتاج إلى تقييم عدد بنشاط تكاثر الخلايا T بالإضافة إلى نسبة فرعية الخلايا التائية. وينبغي إيجاد أي تغيير في نسبة CD4 +، IFN-γ +، IL-17 +، أو Foxp3 + إذا التنشيط والتمايز لم تتأثر (الشكل 5A). وعلاوة على ذلك، أي تغيير في الخلايا Ki67 + CD4 + يجب أن توجد لو الانتشار لا يتأثر (الشكل 5B). يتم تقديم العلاج بالعقاقير في يوم 7 أو في وقت لاحق لتجنب تغيير تقديم المستضد الأولي وتفعيل الخلايا التائية في الهامش. ومع ذلك، في نماذج وراثية غالبا ما يتم حذف البروتينات بشكل جوهري خلال مرحلة التطور الجنيني أو إغراؤه قبل تحريض EAE صنع خلية طحالية ASSEssment من أهمية كبيرة.
تقييم حماية الجهاز العصبي المركزي
لإثبات ما إذا كان عامل علاجي خاص ينظم علم الأمراض في الجهاز العصبي المركزي بعد تسلل خلية المناعة، وينبغي أن تدار التدخلات المخدرات خلال الذروة الأولى في التهديف المرض السريري. نموذج SJL من EAE هو مفيد لهذه التجارب منذ هذه الفئران يحمل النمط الظاهري منتكس. إذا كان العلاج بالعقاقير يمنع المايلين-عصبي انحطاط، تحسنا في علامات سريرية وسيراعى في (الشكل 6). تقييم المرضية المايلين يجب أن تؤكد تماما خفض الضرر المايلين يتفق مع تحسين علامات سريرية. لتقييم كمي سلامة المايلين، DAB تلطيخ من البروتين الأساسي المايلين (ب ب) يتم تنفيذ، تليها التحليل الإحصائي للكثافة ضوئية لهذه تلطيخ (الشكل 7). لمزيد من إثبات أن neuroinflammation ومستدامة أو ينقص من therapeالتدخلات UTIC، دباق رد الفعل يمكن تقييم من خلال قياس مساحة جزء يعني لدباق رد الفعل على النحو المبين أعلاه (الشكل 3). لإثبات أن التدخل العلاجي هو حماية مباشرة الجهاز العصبي المركزي من دون آثار المناعية، يجب أن تكون مخفضة تخفيف من تسلل الخلايا المناعية في الجهاز العصبي المركزي وانتشار في الطحال. ولمعالجة ذلك، يجب أن يتم تنفيذ طرق الدماغ والحبل الشوكي تقييم من تسلل خلية المناعة، وتقييم الطرفية تكاثر الخلايا T والتنشيط كما هو موضح أعلاه (أرقام 4 و 5). معا، العوامل العلاجية التي تمنع إصابة الخلايا في الجهاز العصبي المركزي مع عدم وجود دليل على وجود انخفاض في الجهاز العصبي المركزي تسلل خلايا T أو انتشار خلايا تي في محيط علاجات الجهاز العصبي المركزي واقية.
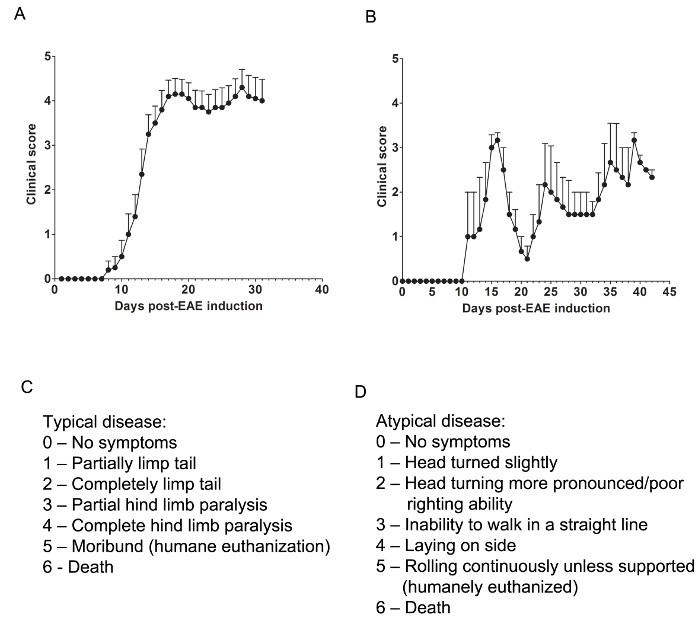
الشكل 1. الممثل دورة الفتشوبLTS من عشرات السريرية من EAE في C57BL / 6 و الفئران SJL. (A) عشرات السريرية (يعني ± SEM) من C57BL / 6 الفئران (ن = 10) الناجم مع MOG 35-55 لإنتاج EAE مع المرض المزمن. (ب) عشرات السريرية (يعني ± SEM) من الفئران SJL (ن = 3) الناجم مع حزب العمال التقدمي 139-151 لإنتاج EAE مع المرض منتكس. (ج) سجل عنوان طبي يستخدم لتتبع تطور المرض عادة في الفئران EAE. (د) وسجل عنوان طبي يستخدم لتتبع تطور المرض الغامض في الفئران EAE. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
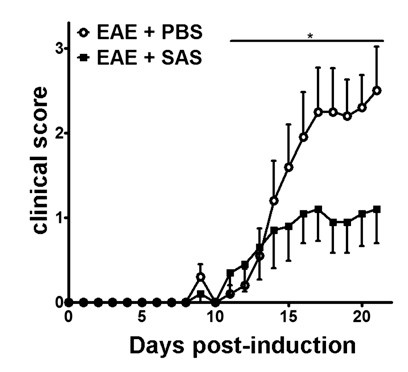
الشكل 2. الدوائية العلاج قبل المناعي تسلل خلية في C57BL / 6 الفئران مع EAE. عشرات السريرية (يعني ± SEM) من C57BL / 6 الفئران تعامل مع برنامج تلفزيوني (ن = 20) أو SAS (ن = 19) من يوم 7 postimmunization مع MOG 35-55. البيانات من ثلاث تجارب مستقلة المجمعة. تم تحديد الفرق الإحصائي باستخدام الذيل يومين اختبار مان ويتني U اللامعلمية، * ف <0.05. إعادة طباعة بإذن من (11).
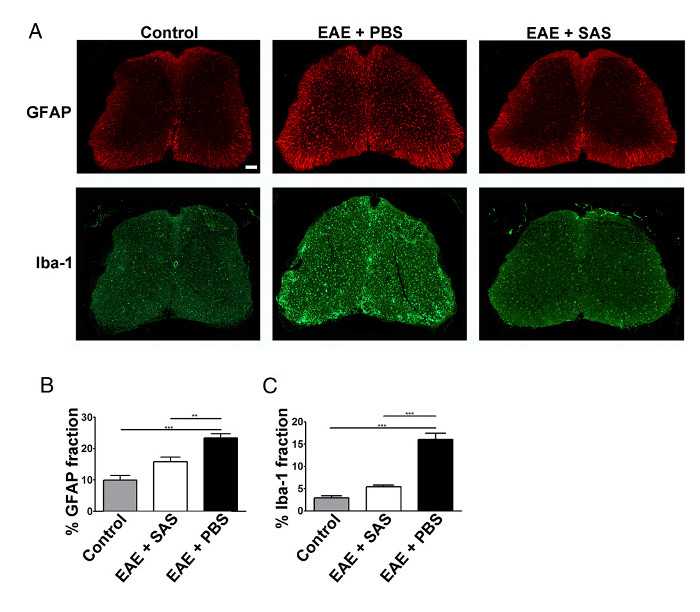
الشكل 3. مناعي يلطخ والكمي من رد الفعل دباق في العمود الفقري حبال من التحكم، EAE، والمعالجة C57BL / 6 الفئران. (أ) وضع العلامات الفلورية للGFAP (النجمية) وايبا-1 (الخلايا الدبقية الصغيرة) في النخاع الشوكي لإدارة (غير المطعمين ) الفئران (من اليسار وحات) والفئران EAE تعامل مع برنامج تلفزيوني (لوحات المتوسطة) أو SAS (لوحات اليمين). شريط مقياس = 100 ميكرون. تم تحديد الكمي لتلطيخ باستخدام تقنية منطقة الكسر لقياس المئة immunopمنطقة ositive لGFAP (ب) وايبا-1 (C). يعني ± SEM، ن = 3 السيطرة، ن = 3 SAS المعاملة، أو ن = 4 الفئران التي عولجت في برنامج تلفزيوني، 6 أقسام في الماوس. تم تحديد فروق ذات دلالة إحصائية باستخدام في اتجاه واحد أنوفا، * ف <0.05، ** ف <0.01 ***، ف <0.001. إعادة طبع بإذن من (11). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
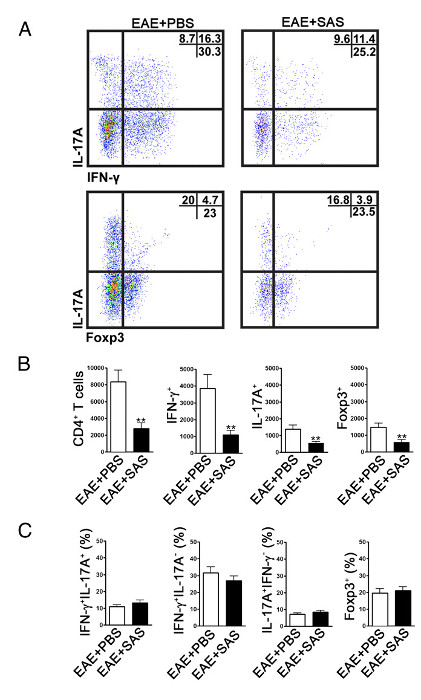
الرقم تحليل 4. نظام مراقبة الأصول الميدانية من EAE C57BL / 6 الماوس العمود الفقري حبال يتظاهرون خفضت الخلايا التائية تسلل في الفئران المعالجة. وعولج C57BL / 6 الفئران مع SAS أو برنامج تلفزيوني، ابتداء من 7 د postinduction من EAE. وقد تم الحصول على النخاع الشوكي في يوم 15. (A) مؤامرات نقطة التمثيلية تظهر TH1 (IFN-γ + / IL-17 -) وTh17 (IFN-γ- / IL-17 +) الخلايا في CD4 + بوابة (لوحات العليا) والخلايا التنظيمية تي (Foxp3 +) (لوحات أقل). تظهر المؤامرات نقطة مئوية في الربع العلوي الأيمن. (ب) تم تحليلها إحصائيا الأرقام المطلقة للخلايا CD4 + وكذلك IFN-γ +، IL-17A +، وFoxp3 + الخلايا. (ج) التغير في النسبة المئوية للسكان الخلايا التائية بين SAS- وتعامل PBS الفئران EAE تم فحص أيضا. يعني ± SEM، ن = 10 لبرنامج تلفزيوني المعالجة، و n = 9 للSAS المعالجة من تجربتين مستقلة. تم استخدام اثنين من الذيل اختبار ر لجميع الرسوم البيانية. ** ف <0.01. إعادة طبع بإذن من (11). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
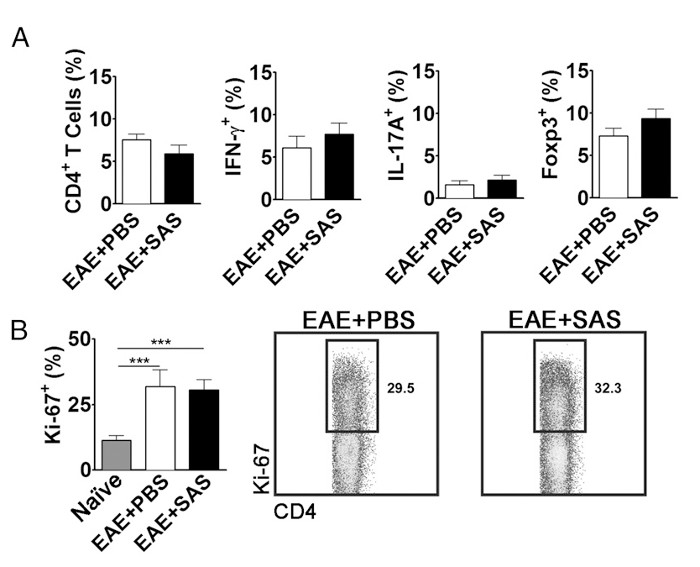
الرقم 5. FACS تحليل EAE C57BL / 6 الماوس الطحال مما يدل المكافئة T ملفات خلية التعبير وانتشار في الفئران المعالجة وغير المعالجة. الطحال من PBS- والفئران التي عولجت SAS-تم تحليل 15 د postinduction من EAE. (أ) النسبة المئوية للخلايا CD4 + T، TH1 (IFN-γ + / IL-17 -)، Th17 (IFN-γ - / IL-17 +) الخلايا، وتي التنظيمية (Foxp3 +) في الطحال من PBS- المعالجة (ن = 10) وSAS المعالجة (ن = 9) الفئران من تجربتين مستقلة. (ب، اللوحة اليسرى) نسبة كي-67 خلايا + في عدد السكان CD4 + من الطحال ساذجة (ن = 4)، وكذلك من PBS- (ن = 5) والفئران التي عولجت SAS (ن = 5) حفز مع EAE. أظهر في اتجاه واحد أنوفا اختبار دلالة إحصائية بين نسبة كي-67 + الخلايا من الطحال ساذجة مقارنة مع أي PBS- أو المعالجة SAS-الطحال EAE. ولم يلاحظ أي أهمية بين PBS- وتعامل SAS-الطحال EAE. (B، اللوحة اليمنى) مؤامرات نقطة التمثيلية. الأرقام تشير إلى نسبة الانتشار. تظهر المؤامرات نقطة مئوية. الرسوم البيانية تمثل الذيل يومين اختبار ر ***، ف <0.001. إعادة طبع بإذن من (11). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
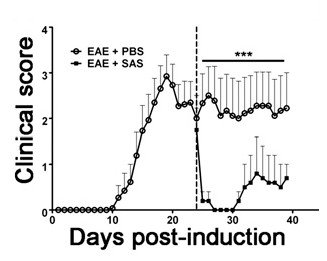
الشكل 6. الدوائية العلاج بعد المناعي تسلل خلية في الفئران SJL مع EAE. عشرات السريرية (يعني ± SEM) من الفئران SJL تعامل مع برنامج تلفزيوني (ن = 8) أو SAS (ن = 8) من يوم 24 postimmunization (خط متقطع) مع حزب العمال التقدمي 139-151. البيانات يعني ± SEM من علامات سريرية. تم تحديد الفرق الإحصائي باستخدام الذيل يومين اختبار مان ويتني U اللامعلمية ***، ف <0.001. ويمثل الخط الأعلى القيم المستخدمة لإحصائيةتحليل. إعادة طباعة بإذن من (11).
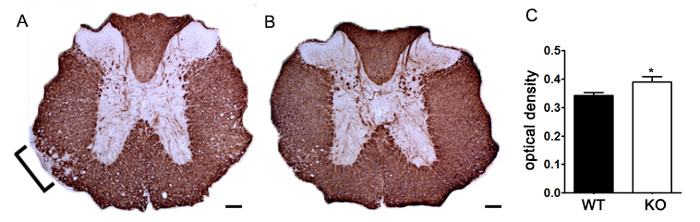
الرقم 7. الكمي لم ب ب تلطيخ باستخدام الكثافة البصرية. (A) تلطيخ الممثل من MBP في الحبل الشوكي الصدري من الماوس خروج المغلوب الوراثي غير محدد مقارنة مع الشاهد littermate C57BL / 6 الماوس الناجم مع EAE. قوس يشير منطقة التمثيلية انخفاض MBP تلطيخ يشير إلى إزالة الميالين. (ب) م ب ب تلطيخ من الحبل الشوكي الصدري من خروج المغلوب الوراثي غير محدد C57BL / 6 الماوس. (ج) غير محدد الفئران خروج المغلوب الوراثية التي يسببها مع EAE (KO، ن = 6 الفئران، 2-4 قطني وأقسام الصدرية لكل حيوان) تظهر كثافة ضوئية أعلى (OD) من تلطيخ MBP في الحبل الشوكي من wildtype (WT، ن = 3 الفئران، 2-4 القطنية والصدرية أقسام لكل حيوان) الفئران التي يسببها مع EAE. باليود تحليلها إحصائيانانوغرام اختبار ر ثنائي الطرف، * ف <0.05. أشرطة الخطأ تمثل SEM. شريط مقياس 100 ميكرون.
Discussion
المرضى الذين يعانون من مرض التصلب العصبي المتعدد لا تزال تعاني من انتكاسات المرض في حين أخذ الأدوية التي تخفف من تنشيط الخلايا T و / أو تسلل إلى الجهاز العصبي المركزي، تستدعي تطوير خيارات العلاج التي تحمي بشكل مباشر على الجهاز العصبي المركزي. وقد كلاسيكي استخدمت EAE في تصميم نموذج لأعراض مرض التصلب العصبي المتعدد، ويمكن أن تكون أداة قوية عند دراسة طبيعة التفاعلات بين نظام المناعة والجهاز العصبي المركزي في الجسم الحي. باستخدام توقيت اعتبارات العلاج في EAE، على سبيل المثال، قبل أو بعد بدء المرض، جنبا إلى جنب مع دراسة تسلل المناعة الخلايا في الجهاز العصبي المركزي وانتشار والتنشيط في المحيط، فمن الممكن لتحديد آثار العلاجات على كل من نظام المناعة، و الجهاز العصبي المركزي.
بينما يستخدم EAE في الماوس C57BL / 6 أكثر على نطاق واسع، EAE في SJL الماوس قد يكون أكثر تمثيلا للغالبية حالات مرض التصلب العصبي المتعدد، حيث أن هذه الفئران لديها النمط الظاهري منتكس وتسلل الخلايا المناعية في لحمةمن الدماغ 10. الفئران SJL لها انتعاشا واضحا خلال مغفرة كذلك، مما يجعل من الممكن لبدء العلاج بعد أن قدم المرض ولكن في أوقات انخفاض التهاب. من المهم أن نعتبر أن الفئران SJL لا الانتكاس دائما وتحوي في التزامن، مما أدى إلى تقلب كبير محتمل عندما يتم تجميع النتائج. لذلك، قد يكون بعض الباحثين أن يختاروا تظهر نتائج ممثلة لعشرات السريرية من حيوان واحد في حين أخذ الفئران لتحليل نظام مراقبة الأصول الميدانية والأنسجة في نقاط فردية في تطور المرض.
النظر عند إجراء التلاعب على الفئران EAE يمكن أن تساعد في تحديد كيفية تأثير علاج جهاز المناعة أو الجهاز العصبي المركزي. هناك العديد من الخيارات لحين بدء العلاج، ولكل منها دلالة خاصة بها لما إذا كانت الخلايا المناعية دخلت الجهاز العصبي المركزي، وكيف يمكن أن تتفاعل مع الجهاز العصبي المركزي. العلاج قبل ظهور الأعراض يعني أن الخلايا المناعية لم يدخل بعد أو تسبب ضررا على الجهاز العصبي المركزي.العلاج بعد ظهور الأعراض يعني أن الخلايا المناعية دخلت الجهاز العصبي المركزي وسببت بعض الأضرار. باستخدام الفئران SJL، يمكن العلاج أيضا أن تبدأ خلال انتكاسة، حيث الخلايا المناعية يتسللون بنشاط ويسبب التهاب، أو خلال مغفرة، حيث قد تكون الخلايا المناعية أقل انتشارا في الجهاز العصبي المركزي مع أقل التهاب. الفرضيات الأولية بشأن كيفية تأثير العلاجات الجهاز العصبي المركزي والجهاز المناعي يمكن أن يتم عند النظر فيها الخلايا المناعية هي في عملية المرضية خلال فترة العلاج.
وهناك عدد من الطرق التي يمكن أن تؤثر على علاجات الخلايا المناعية والجهاز العصبي المركزي، ولكل منها النتيجة النهائية للحد من شدة الأعراض EAE. وبالتالي، فمن الضروري استخدام تحليل cytometric تدفق والمناعية للنظر في كيفية الخلايا المناعية تتأثر في محيط والجهاز العصبي المركزي، ما إذا كانت الخلايا المناعية دخلت الجهاز العصبي المركزي، وكيف يتفاعل الجهاز العصبي المركزي للعلاج. في حين تحليل تدفق cytometric من الحبل الشوكي يمكن تحديد كيفية العديد من الخلايا هكتارلقد دخلت الجهاز العصبي المركزي في وقت معين، واحد لا يمكن تحديد أن هذا التأثير يرجع إلى انخفاض الاتجار الخلايا المناعية إلا انتشار الخلايا المناعية لا يتأثر في الطحال. وبالتالي فإنه من الضروري تحليل كل الأنسجة الطرفية والجهاز العصبي المركزي، وتحديد ما هي النتائج يعني ميكانيكيا عند مقارنة كل من الأنسجة. ومن الممكن أيضا لمحات نشاط الخلايا المناعية لتغييرها عن طريق العلاج، على سبيل المثال وجود التبديل في التائية المساعدة الشخصية خلايا الثقيلة المسببة للأمراض إلى T المستوى خلية الثقيلة التنظيمي. وعند النظر إلى علامات لأنواع مختلفة من الخلايا ومقارنة التعبير في المئة بين الحيوانات المعالجة وغير المعالجة بالتالي أيضا من الاعتبارات المهمة. مفهوم الناشئة في مجال البحوث MS تشير إلى أن الخلايا باء تلعب دورا هاما في إزالة الميالين المناعة الذاتية. وذلك بناء على الدراسات التي تبين أن الخلايا B ضرورية لتنشيط خلايا T 20. ويدعم هذا المفهوم من نجاح العلاجات مثل ريتوكسيماب، الجسم المضاد ضد CD20 السابقضغطت على سطح الخلايا البائية 21،22. كما يتضح من نجاح أوكرليزوماب الأجسام المضادة وحيدة النسيلة في التجارب السريرية، والمخدرات التي تستهدف الحواتم مختلفة من CD20 قد يحسن من فعالية B العلاجات المستهدفة للخلية 23.
واحد الحد من التقنيات المقدمة هنا هو أنه من الممكن للخلايا المناعية للدخول إلى الجهاز العصبي المركزي ولكن لن يتمكن من السفر في لحمة. المناعية يمكن أن تستخدم لكشف استكفاف ماحول الأوعية الخلايا المناعية وتقييم المسافة المقطوعة في لحمة بين الحيوانات المعالجة وغير المعالجة. الحد محتمل آخر ينطوي على آثار microbiome على EAE المرضية. المتعايشة الأمعاء الجراثيم يمكن أن تؤثر بشكل كبير المرضية المرض (24)؛ وبالتالي، الفئران الموجودة في المستعمرات المختلفة، وحتى في أقفاص مختلفة يمكن أن خلافات واسعة في شدة المرض. وفقا لذلك، فمن الأفضل دائما حيث من الممكن استخدام الضوابط littermate التي أثيرت في نفس القفص لالتجارب التي تنطوي على EAE. ملاحظة أخيرة هي أنه إذا كان من المستحسن تجريبيا للقضاء على آثار التغيرات التكاثري الخلايا المناعية في محيطها، قد يكون من الممكن القيام بذلك باستخدام السلبي نقل الحث بدلا من تحريض نشط الموصوفة في هذا البروتوكول.
مزيد من التأكيد لالعصبية ويمكن تحقيق ذلك باستخدام نظام المشاركة في ثقافة 11 لاختبار آليات محددة لموت الخلايا أو من خلال استخدام الفئران خروج المغلوب الشرطية التي تسمح للحذف من البروتينات بشكل انتقائي على نوع من الخلايا. وعلاوة على ذلك، لتمديد التنقيب وكلاء الدوائية التي اعصاب، ينبغي أن تدرج علامات transection المحاور وفاة الخلايا العصبية. منطقة أخرى ذات أهمية هي عودة الميالين. محاور جرح غير قادرة على remyelinate يقدم المزيد من الدعم أن العلاجات اعصاب يجب أن يكون جزءا هاما من العلاجات عودة الميالين. بالإضافة إلى ذلك، محاور كمون الفعل أكثر عرضة للإصابة من myelinaمحاور تيد. وهذا يشير إلى أنه عندما يصبح محور عصبي التدخلات العلاجية عديمة الميلين التي تعزز عودة الميالين في الوقت المناسب ومنع الإصابة محور عصبي. لاستكشاف هذه السبل، في النماذج الحية الأخرى لإزالة الميالين وعودة الميالين يمكن استخدام (أي cuprizone وليزوليسيتين). الطريقة الموصوفة ركزت هنا على تقييم العصبية عن طريق قياس فقدان المايلين. لتقييم عودة الميالين عدد الخلايا الاولية فضلا عن قدرتها على التكاثر وسيكون من المهم للتحقيق أيضا تنضج. مع ذكر هذه النماذج البديلة، يجب على المرء أن تنظر أيضا في نماذج مختلفة من الدماغ التي تتوسط فيروسي. هناك نوعان جيدا اتسم RNA نماذج الفيروسية التي تنتج فقدان المايلين: واحد هو التهاب الدماغ والنخاع تايلر الفئران، وهو فيروس غير يلفها الفيروسات البيكورناوية، والآخر هو الماوس فيروس التهاب الكبد الوبائي، وهو عضو من عائلة فيروس فيروسات تاجية 25،26.
EAE هو أداة قيمة للحجرudies لكيفية التلاعب أو علاجات تؤثر على نظام المناعة والجهاز العصبي المركزي في الجسم الحي. بروتوكول الموصوفة هنا يمكن أن تساعد في تحديد مكان العلاجات التي تؤثر على عملية المرض، سواء كان ذلك في محيطها، في حاجز الدم في الدماغ، أو في الجهاز العصبي المركزي. لا العلاجات الحالية لمرض التصلب العصبي المتعدد علاج هذا المرض والمرضى في كثير من الأحيان تجربة تراجع مع مرور الوقت. وبالمثل، والأمراض الأخرى التي تنطوي على تسلل المناعة الخلايا في الجهاز العصبي المركزي وتدهور المايلين، بما في ذلك التهاب الدماغ والنخاع المنتشر الحاد، التهاب النخاع المستعرض، والبصري التهاب النخاع و الأعصاب، والعلاجات تفتقر التي تحمي الجهاز العصبي المركزي كما هو مباشرة لهجوم من قبل التسلل الخلايا المناعية. مع الأخذ في الاعتبار توقيت العلاج واستخدام تحليل تدفق cytometric من الطحال والنخاع الشوكي بالتزامن مع المناعية للجهاز العصبي المركزي لتقييم التهاب وتلف سيسمح للقرارات الآلية التي ينبغي اتخاذها بشأن العلاج.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
وقد تم تمويل هذا العمل من قبل NINDS P30-NS069324، والوطنية التصلب المتعدد SocietyRG 4587-A-1، مؤسسة Civitan الدولي للابحاث، ومؤسسة مايك L. Jezdimir مستعرض التهاب النخاع الشوكي، وجامعة ألاباما مؤسسة الخدمات الصحية - صندوق الهبات عامة، والوطنية مؤسسة العلم 1355183، وT32 AI007051 من المعهد الوطني للحساسية والأمراض المعدية والمعاهد الوطنية للصحة.
Materials
| Name | Company | Catalog Number | Comments |
| 22 x 22 x 20 mm embedding mold | Fisher Scientific | NC9719245 | |
| 22 x 30 x 20 mm embedding mold | Fisher Scientific | NC9531194 | |
| 2-Mercaptoethanol (55 mM) | Thermo Fisher Scientific | 21985-023 | |
| 2-Methylbutane | Fisher Scientific | O3551-4 | |
| 30 x 22 x 20 mm embedding mold | Fisher Scientific | 18-30 | |
| ACK Lysing Buffer | Quality Biological | 118-156-101 | |
| anti-CD4 PE-Cy7 | BD Biosciences | 552775 | 0.2 mg/ml stock concentration |
| anti-Foxp3-FITC | eBioscience | 11-5773-82 | 0.5 mg/ml stock concentration |
| anti-GFAP (Cocktail) | Biolegend | 835301 | 1 - 3 mg/ml stock concentration |
| anti-Iba-1 Polyclonal Antibody (50 µg) | Wako | 019-19741 | 0.5 mg/ml stock concentration |
| anti-IFN-γ APC | eBioscience | 17-7311-82 | 0.2 mg/ml stock concentration |
| anti-IL-17A PerCP-Cy5.5 | eBioscience | 45-7177-82 | 0.2 mg/ml stock concentration |
| anti-Ki-67 PE | eBioscience | 12-5698-82 | 0.2 mg/ml stock concentration |
| anti-MBP (D-18) | Santa Cruz Biotechnology | sc-13912 | 0.2 mg/ml stock concentration |
| anti-TCRβ FITC | eBioscience | 11-5961-85 | 0.5 mg/ml stock concentration |
| anti-TCRβ PE | eBioscience | 12-5961-83 | 0.2 mg/ml stock concentration |
| Biotinylated Goat Anti-Rabbit IgG | Vector Labs | BA-1000 | 1.5 mg/ml stock concentration |
| Biotinylated Horse Anti-Mouse IgG | Vector Labs | BA-2000 | 1.5 mg/ml stock concentration |
| Citric Acid, Anhydrous, 99.5% | Fisher Scientific | AC42356-5000 | |
| Ethylenediaminetetraacetic acid (EDTA), tetrasodium salt dihydrate, 99% | Fisher Scientific | AC446085000 | |
| Fetal Bovine Serum | HyClone | SH30071.03 | |
| Fisherbrand Superfrost Plus Microscope Slides, case of 10 | Fisher Scientific | 12-550-15 | |
| Golgi Plug | BD Biosciences | 555029 | protein transport inhibitor |
| Immedge Hydrophobic Barrier Pen | Fisher Scientific | NC9545623 | |
| Ionomycin | EMD Millipore | 407952-5mg | |
| L-Glutamine, 100x | Corning | 25-005-Cl | |
| MEM Nonessential Amino Acids | Corning | 25-025-Cl | |
| Near IR Live/Dead Staining Kit | Life Technologies | L10119 | viability dye |
| Normal goat serum | Vector Labs | S-1000 | |
| Normal horse serum | Vector Labs | S-2000 | |
| Paraformaldehyde, 96% | Fisher Scientific | AC416785000 | |
| Penicillin-Streptomycin Solution, 100x | Corning | 30-002-Cl | |
| Percoll | GE Healthcare | 17-0891-01 | density gradient |
| Permount | Fisher Scientific | SP15-500 | resinous mounting medium |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma | P1585-1mg | |
| Purified anti-Myelin Basic Protein Antibody | BioLegend | 808401 | |
| RPMI 1640 | Corning | 10-040-CM | |
| Sodium Pyruvate | Corning | 25-000-Cl | |
| Tissue-Tek CRYO-OCT Compound | Fisher Scientific | 14-373-65 | |
| Triton X-100 | Sigma-Aldrich | T9284 | nonionic detergent |
| Vectastain Elite ABC Kit (Standard) | Fisher Scientific | NC9206402 | avidin-biotin-peroxidase complex (ABC) in immunoperoxidase |
| Vector Laboratories Peroxidase Substrate Kit (DAB) | Fisher Scientific | NC9276270 | DAB solution |
References
- Teitelbaum, D., Meshorer, A., Hirshfeld, T., Arnon, R., Sela, M. Suppression of experimental allergic encephalomyelitis by a synthetic polypeptide. Eur J Immunol. 1, 242-248 (1971).
- Yednock, T. A., et al. Prevention of experimental autoimmune encephalomyelitis by antibodies against alpha 4 beta 1 integrin. Nature. 356, 63-66 (1992).
- Ridge, S. C., et al. Suppression of experimental allergic encephalomyelitis by mitoxantrone. Clinical immunology and immunopathology. 35, 35-42 (1985).
- Steinman, L., Zamvil, S. S. How to successfully apply animal studies in experimental allergic encephalomyelitis to research on multiple sclerosis. Annals of Neurology. 60, 12-21 (2006).
- Kuerten, S., et al. MP4- and MOG:35-55-induced EAE in C57BL/6 mice differentially targets brain, spinal cord and cerebellum. J Neuroimmunol. 189, 31-40 (2007).
- Brownell, B., Hughes, J. T. The distribution of plaques in the cerebrum in multiple sclerosis. J Neurol Neurosurg Psychiatry. 25, 315-320 (1962).
- Kidd, D., et al. Cortical lesions in multiple sclerosis. Brain. 122 (Pt 1), 17-26 (1999).
- Kutzelnigg, A., Lassmann, H. Cortical lesions and brain atrophy in MS. Journal of the neurological sciences. 233, 55-59 (2005).
- Geurts, J. J., et al. Cortical lesions in multiple sclerosis: combined postmortem MR imaging and histopathology. AJNR Am J Neuroradiol. 26, 572-577 (2005).
- Rasmussen, S., et al. Persistent activation of microglia is associated with neuronal dysfunction of callosal projecting pathways and multiple sclerosis-like lesions in relapsing--remitting experimental autoimmune encephalomyelitis. Brain. 130, 2816-2829 (2007).
- Evonuk, K. S., et al. Inhibition of System Xc(-) Transporter Attenuates Autoimmune Inflammatory Demyelination. J Immunol. 195, 450-463 (2015).
- Rowse, A. L., et al. Lithium controls central nervous system autoimmunity through modulation of IFN-gamma signaling. PloS one. 7, e52658(2012).
- Bittner, S., Afzali, A. M., Wiendl, H., Meuth, S. G. Myelin oligodendrocyte glycoprotein (MOG35-55) induced experimental autoimmune encephalomyelitis (EAE) in C57BL/6 mice. J Vis Exp. , (2014).
- Flaherty, S., Reynolds, J. M. Mouse Naive CD4+ T Cell Isolation and In vitro Differentiation into T Cell Subsets. J Vis Exp. , (2015).
- McWilliams, I. L., Rajbhandari, R., Nozell, S., Benveniste, E., Harrington, L. E. STAT4 controls GM-CSF production by both Th1 and Th17 cells during EAE. J Neuroinflammation. 12, 128(2015).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. J. Vis. Exp. , (2012).
- Law, J. P., et al. The importance of Foxp3 antibody and fixation/permeabilization buffer combinations in identifying CD4+CD25+Foxp3+ regulatory T cells. Cytometry Part A : the journal of the International Society for Analytical Cytology. 75, 1040-1050 (2009).
- Strober, W., et al. Monitoring cell growth. Current protocols in immunology. Appendix 3, Appendix 3A(2001).
- Korn, T., et al. Myelin-specific regulatory T cells accumulate in the CNS but fail to control autoimmune inflammation. Nature medicine. 13, 423-431 (2007).
- Pierson, E. R., Stromnes, I. M., Goverman, J. M. B cells promote induction of experimental autoimmune encephalomyelitis by facilitating reactivation of T cells in the central nervous system. Journal of immunology. 192, 929-939 (2014).
- Hauser, S. L., et al. B-cell depletion with rituximab in relapsing-remitting multiple sclerosis. The New England journal of medicine. 358, 676-688 (2008).
- Bar-Or, A., et al. Rituximab in relapsing-remitting multiple sclerosis: a 72-week, open-label, phase I trial. Ann Neurol. 63, 395-400 (2008).
- Kappos, L., et al. Ocrelizumab in relapsing-remitting multiple sclerosis: a phase 2, randomised, placebo-controlled, multicentre trial. Lancet. 378, 1779-1787 (2011).
- Berer, K., et al. Commensal microbiota and myelin autoantigen cooperate to trigger autoimmune demyelination. Nature. 479, 538-541 (2011).
- Bergmann, C. C., Lane, T. E., Stohlman, S. A. Coronavirus infection of the central nervous system: host-virus stand-off. Nat Rev Microbiol. 4, 121-132 (2006).
- Anghelina, D., Pewe, L., Perlman, S. Pathogenic role for virus-specific CD4 T cells in mice with coronavirus-induced acute encephalitis. The American Journal of Pathology. 169, 209-222 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved