A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
وتوليف الهلاميات المائية functionalized RGD-كأداة للتطبيقات العلاجية
In This Article
Summary
We present a protocol for the synthesis of RGD-functionalized hydrogels as devices for cell and drug delivery. The procedure involves copper catalyzed alkyne-azide cycloaddition (CuAAC) between alkyne-modified polyacrylic acid (PAA) and a RGD-azide derivative. The hydrogels are formed using microwave-assisted polycondensation and their physicochemical properties are investigated.
Abstract
The use of polymers as biomaterials has provided significant advantages in therapeutic applications. In particular, the possibility to modify and functionalize polymer chains with compounds that are able to improve biocompatibility, mechanical properties, or cell viability allows the design of novel materials to meet new challenges in the biomedical field. With the polymer functionalization strategies, click chemistry is a powerful tool to improve cell-compatibility and drug delivery properties of polymeric devices. Similarly, the fundamental need of biomedicine to use sterile tools to avoid potential adverse-side effects, such as toxicity or contamination of the biological environment, gives rise to increasing interest in the microwave-assisted strategy.
The combination of click chemistry and the microwave-assisted method is suitable to produce biocompatible hydrogels with desired functionalities and improved performances in biomedical applications. This work aims to synthesize RGD-functionalized hydrogels. RGD (arginylglycylaspartic acid) is a tripeptide that can mimic cell adhesion proteins and bind to cell-surface receptors, creating a hospitable microenvironment for cells within the 3D polymeric network of the hydrogels. RGD functionalization occurs through Huisgen 1,3-dipolar cycloaddition. Some PAA carboxyl groups are modified with an alkyne moiety, whereas RGD is functionalized with azido acid as the terminal residue of the peptide sequence. Finally, both products are used in a copper catalyzed click reaction to permanently link the peptide to PAA. This modified polymer is used with carbomer, agarose and polyethylene glycol (PEG) to synthesize a hydrogel matrix. The 3D structure is formed due to an esterification reaction involving carboxyl groups from PAA and carbomer and hydroxyl groups from agarose and PEG through microwave-assisted polycondensation. The efficiency of the gelation mechanism ensures a high degree of RGD functionalization. In addition, the procedure to load therapeutic compounds or biological tools within this functionalized network is very simple and reproducible.
Introduction
الهلاميات المائية وشبكات ثلاثية الأبعاد تتكون من البوليمرات عبر ربط ماء، والتي هي طبيعية أو اصطناعية، ويتميز هيكل ثلاثي الأبعاد مميزة. وهذه الأجهزة هي جذابة على نحو متزايد في مجالات الطب الحيوي من تسليم المخدرات وهندسة الأنسجة وناقلات الجينات وأجهزة الاستشعار الذكية 1،2. في الواقع، نسبة عالية من المياه الخاصة بهم، فضلا عن ممتلكاتهم الانسيابية والميكانيكية جعلها المرشحين المناسبين لتقليد microenvironments الأنسجة اللينة وجعلها أدوات فعالة لخلوى للذوبان في الماء أو النمو تسليم عامل. واحدة من أكثر استخدامات واعدة هي بمثابة مادة بيولوجية عن طريق الحقن تحمل الخلايا والمركبات النشطة بيولوجيا. الهلاميات المائية قد تحسين بقاء الخلية ومصير الخلايا الجذعية السيطرة من خلال عقد وتقديم بالضبط إشارات التنظيمية الخلايا الجذعية بطريقة الفسيولوجية ذات الصلة، كما لوحظ في في التجارب المختبرية والتجارب المجراة في 3،4. الميزة الرئيسية لهذا هي إمكانيةللحفاظ على حقن الخلايا داخل منطقة التلقيح (في الموقع)، والتقليل من كمية الخلايا التي تترك المجال وextravasates في سيل الدورة الدموية، المهاجرة في جميع أنحاء الجسم وفقدان الهدف المنشود 5. ومن المقرر أن المواقع عبر ربط لها، التي شكلتها روابط تساهمية أو قوات متماسكة بين سلاسل البوليمر 6 استقرار الشبكات هيدروجيل ثلاثية الأبعاد.
في هذا الإطار، تطبيق الكيمياء انتقائية متعامد لسلاسل البوليمر هو أداة مرنة قادرة على تحسين أداء هيدروجيل 7. في الواقع، يمكن تعديل البوليمرات مع مجموعات كيميائية مناسبة تساعد على توفير المواد الكيميائية المناسبة، الخصائص الفيزيائية والميكانيكية لتعزيز بقاء الخلية واستخدامها في تكوين الأنسجة. في نفس الطريق، وبين التقنيات لتحميل الخلايا أو عوامل النمو داخل المصفوفة هلام، واستخدام الببتيد RGD يسمح التحسينات في التصاق الخلايا والبقاء على قيد الحياة. RGD هو ثلاثي الببتيد يتكونمن أرجينين، الجلايسين وحمض الأسبارتيك، التي هي حتى الآن الأكثر فعالية وكثيرا ما يلجأ ثلاثي الببتيد نظرا لقدرتها على معالجة أكثر من مستقبلات الخلايا الالتصاق وتأثيرها البيولوجي على ترسيخ خلية والسلوك والبقاء على قيد الحياة 8،9. في هذا العمل، هو درس تركيب الهلاميات المائية-functionalized RGD بهدف تصميم شبكات تتميز الخصائص الكيميائية الحيوية الكافية لالمكروية الخلية مضياف.
استخدام أشعة الميكروويف في التوليف هيدروجيل يوفر إجراء بسيط للحد من التفاعلات الجانبية والحصول على أعلى معدلات التفاعل والغلة في فترة أقصر من الوقت مقارنة مع العمليات الحرارية التقليدية 10. لا يتطلب هذا الأسلوب خطوات تنقية وعوائد الهلاميات المائية عقيمة بسبب تفاعلات البوليمرات وعدم وجود المذيبات العضوية في نظام رد فعل 11. ولذلك، فإنه يضمن نسبة عالية من RGD ربطها بالشبكة البوليمرية لأنه لا يوجد وزارة الدفاعمطلوبة ifications إلى مجموعات كيميائية البوليمر تشارك في تشكيل هلام. مجموعة الكربوكسيل، من دوس وكربومير، ومجموعة الهيدروكسيل، من PEG والاغاروز، تؤدي إلى هيدروجيل هيكل ثلاثي الأبعاد من خلال تفاعل التكثيف المتعدد. وتستخدم البوليمرات المذكورة لتركيب الهلاميات المائية في العمود الفقري العلاجات إصلاح إصابات الحبل 12. هذه الأجهزة، كما ورد في سابقة يعمل 13،14، وتبين توافق مع الحياة عالية وكذلك الخواص الميكانيكية والفيزيائية التي تشبه العديد من الأنسجة الحية وفي طبيعة متغيرة الانسيابية. وعلاوة على ذلك، فإنها تبقى محلية في الموقع، في منطقة الحقن.
في هذا العمل، وتعديل مجموعة الكربوكسيل دوس مع شاردة آلكاين (الشكل 1)، ويتم تصنيعه مركب RGD أزيدي استغلال التفاعل من مجموعة محطة ثلاثي الببتيد -NH 2 مع مركب كيميائي استعداد مع هيكل (CH 2) ن - N 3 (<قوي> الشكل 2). وفي وقت لاحق، وأجزاء من الكمية المخصصة المعدلة ويتفاعل مع مشتق RGD-أزيد من خلال CuAAC نقرة رد فعل 15-17 (الشكل 3). استخدام (I) المحفز النحاس يؤدي إلى تحسينات كبيرة في كل من معدل التفاعل وانتقائية موضعية. يتم استخدام رد الفعل CuAAC على نطاق واسع في التركيب العضوي وفي علوم البوليمر. فهو يجمع بين الكفاءة العالية والتسامح عالية للفئات الوظيفية، وأنه لم يتأثر استخدام المذيبات العضوية. والانتقائية العالية، وفترة رد الفعل السريع وإجراء تنقية بسيطة تسمح حصولهم البوليمرات نجوم، بوليمرات كتلة أو سلاسل تطعيم الأنصاف المطلوب 18. هذه الاستراتيجية نقرة يجعل من الممكن لتعديل البوليمرات بعد البلمرة لتخصيص الخصائص الفيزيائية وفقا لتطبيق الكيمياء الحيوية النهائي. الظروف التجريبية CuAAC هي استنساخه بسهولة (رد فعل حساس إلى الماء، في حين قد تحدث أكسدة والنحاس الحد الأدنى)، وطبيعةالتريازول شكلت يضمن الاستقرار للمنتج. يمكن اعتبار استخدام معدن النحاس إلى نقطة حرجة، نظرا لتأثير سام المحتمل ضد الخلايا وفي المكروية البيولوجية، ولكنها تستخدم لغسيل الكلى كوسيلة من وسائل تنقية للسماح الإزالة الكاملة للمخلفات الحفازة. وأخيرا، تعديل دوس يستخدم RGD في التوليف هيدروجيل (الشكل 4) والخصائص الفيزيائية للشبكات التي أسفر عنها التحقيق، من أجل مراجعة وظائف المحتملة لهذه النظم إلى خلايا أو المخدرات الناقلين.
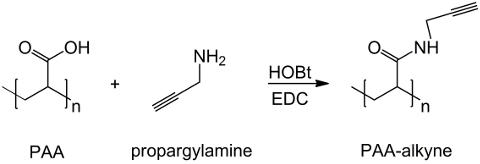
الشكل 1: دوس تعديل التوليف آلكاين مخطط من functionalization دوس مع مجموعة آلكاين؛ "ن" يشير إلى أحادية مع مجموعة الكربوكسيل التفاعل مع propargylamine. الرجاء انقر هنا لعرضنسخة أكبر من هذا الرقم.

الشكل 2:.. RGD-أزيدي تركيب وتوليف مشتقات RGD-أزيد الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الرقم 3: انقر فوق رد فعل مخطط انقر التفاعل بين مشتقات RGD-أزيد وآلكاين-دوس. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: هيدروجيل synthesis. RGD functionalized إجراء التوليف هيدروجيل. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
ملاحظة: كما تستخدم المواد الكيميائية كما وردت. يتم شراؤها الخطية RGD، ولكن يمكن أن تعدها القياسية FMOC المرحلة الصلبة الببتيد التوليف 16،19. المذيبات هي من الصف التحليلية. يتطلب غسيل الكلى استخدام الغشاء مع M ث قطع يساوي 3500 دا. وتتميز هذه المركبات توليفها من قبل 1 H NMR الأطياف المسجلة على 400 ميغاهرتز الطيف باستخدام الكلوروفورم (CDCl 3) أو أكسيد الديوتيريوم (D 2 O)، والمذيبات، ويتم الإبلاغ عن التحولات الكيميائية كقيم δ في أجزاء لكل مليون. وعلاوة على ذلك، يتعرض الهلاميات المائية لتحليل FT-IR باستخدام تقنية KBR بيليه وتوصيف الجسدية ويشمل دراسات دبق تقييمها باستخدام أنبوب اختبار مقلوب عند 37 درجة مئوية.
1. توليف 4 Azidobutanoyl كلوريد 1
- حل 500 ملغ من 4 azidobutanoic حمض (3.90 ملمول) في 10 مل من ثنائي كلورو ميثان و 0.5 مل من ثنائي ميثيل الفورماميد.
- تبريد حل في 0 درجة مئوية، وذلك باستخدام حمام الثلج.
- إضافة 505 ميكرولتر من كلوريد أوكساليل (5.85 ملمول) إلى 5 مل من ثنائي كلورو ميثان وببطء إضافة قطرة قطرة إلى نظام رد فعل، مع التحريك.
- بعد 1 ساعة عند 0 درجة مئوية باستخدام حمام الثلج، والعودة إلى درجة حرارة الغرفة.
- إزالة المذيب تحت ضغط منخفض باستخدام المبخر الدوار.
- تميز المنتجات التي حصلت عليها 1 H-NMR الطيفي، حل العينة في CDCl 3 16.
2. تجميع RGD-أزيد مشتق 2
- حل 50 ملغ من RGD (0.145 ملمول) في 1 مل من 1 M هيدروكسيد الصوديوم.
- حل 24 ملغ من 1 (0.16 ملمول) في 2 مل من رباعي هيدرو الفوران.
- إضافة كل من الحل RGD إلى حل 1 قطرة قطرة في 0 درجة مئوية باستخدام حمام الثلج.
- العودة إلى درجة حرارة الغرفة ويقلب بين عشية وضحاها.
- إضافة 1 مل من 1 M حمض الهيدروكلوريك.
- إزالة المذيب تحت ضغط منخفض باستخدام المبخر الدوار.
- تميز OBTained المنتج من قبل 1 H-NMR الطيفي، حل العينة في D 2 O 16.
3. دوس آلكاين تعديل 3
- حل 200 ملغ من 35٪ ث / ث حل دوس (2.8 ملمول) في 15 مل من الماء المقطر.
- إضافة 15.4 ملغ من هيدروكلوريد propargylamine (0.20 ملمول).
- حل 42.8 ملغ من هيدرات 1-hydroxybenzotriazole (HOBt، 0.28 ملمول) في 14 مل من 1: الأسيتونتريل 1 ت / ت: المقطر المحلول المائي عن طريق التسخين إلى 50 درجة مئوية.
- إضافة كل من الحل HOBt إلى حل دوس في درجة حرارة الغرفة.
- إضافة 53.6 ملغ من ethyldimethylaminopropylcarbodiimide (EDC، 0.28 ملمول) إلى خليط التفاعل.
- استخدام 1 M حمض الهيدروكلوريك لضبط درجة الحموضة إلى 5.5 ويقلب نظام رد فعل بين عشية وضحاها في درجة حرارة الغرفة.
- Dialyze الحل. حل 11.2 غرام من كلوريد الصوديوم في 2 لتر من الماء المقطر ثم قم بإضافة 0.2 مل من 37٪ وزن / وزن حمض الهيدروكلوريك. Dialyze الحل باستخدام غشاء مع M ث قطع من 3.5 كيلو دالتون.
- PERFOغسيل الكلى جمهورية مقدونيا لمدة ثلاثة أيام. تغيير الحل غسيل الكلى يوميا مع 2 لتر من الماء المقطر الطازجة تحتوي على 0.2 مل من 37٪ وزن / وزن حمض الهيدروكلوريك.
- تخزين الحل النهائي في -80 درجة مئوية. يجفد ذلك في مجفاد وفقا لبروتوكولات الشركة المصنعة.
- تميز البوليمر functionalized بنسبة 1 H-NMR الطيفي، حل العينة في D 2 O 16.
4. تجميع أجزاء من الكمية المخصصة-RGD بوليمر 4
- حل 78 ملغ من دوس تعديل آلكاين 3 (1.083 ملمول) في 10 مل من الماء المقطر.
- حل 25 ملغ من RGD أزيد 2 مشتق (0.0722 ملمول) في 5 مل من رباعي هيدرو الفوران.
- إضافة كل من الحل RGD إلى حل البوليمر.
- إضافة 2.2 ملغ من يوديد النحاس (0.0116 ملمول) و 2.2 ملغ من الصوديوم أسكوربات (0.0111 ملمول).
- ارتداد الخليط الناتج بين عشية وضحاها في 60 درجة مئوية، مع التحريك.
- تبريد الخليط إلى 25 درجة مئوية.
- Dialyzالبريد الحل. حل 11.2 غرام من كلوريد الصوديوم في 2 لتر من الماء المقطر ثم قم بإضافة 0.2 مل من 37٪ وزن / وزن حمض الهيدروكلوريك. Dialyze الحل باستخدام غشاء مع M ث قطع من 3.5 كيلو دالتون.
- أداء غسيل الكلى لمدة ثلاثة أيام. تغيير الحل غسيل الكلى يوميا مع 2 لتر من الماء المقطر الطازجة تحتوي على 0.2 مل من 37٪ وزن / وزن حمض الهيدروكلوريك.
- تخزين الحل النهائي في -80 درجة مئوية. يجفد ذلك في مجفاد وفقا لبروتوكولات الشركة المصنعة.
- تميز المنتجات التي حصلت عليها 1 H-NMR الطيفي، حل العينة في D 2 O 16.
5. RGD functionalized هيدروجيل التجميعي
- إعداد برنامج تلفزيوني. حل 645 ملغ من برنامج تلفزيوني الملح في 50 مل من الماء المقطر.
- مزيج 40 ملغ من كربومير و 10 ملغ من دوس functionalized 4 في 9 مل من برنامج تلفزيوني (الخطوة 5.1)، في درجة حرارة الغرفة، حتى حل كامل (30 دقيقة).
- إضافة 400 ملغ من PEG في حل والحفاظ على التحريك لمدة 45 دقيقة.
- وقف التحريك والسماح للنظام ليستقر لمدة 30 دقيقة.
- استخدام 1 N هيدروكسيد الصوديوم لضبط درجة الحموضة إلى 7.4.
- إلى 5 مل من الخليط التي تم الحصول عليها، إضافة 25 ملغم من مسحوق الاغاروز.
- أشرق النظام مع أشعة الميكروويف في 500 W حتى الغليان، لفترة عادة ما بين 30 ثانية و 1 دقيقة، والحرارة الكهرمغنطيسية تصل إلى 80 درجة مئوية.
- ترك الخليط تتعرض لدرجة حرارة الغرفة حتى تنخفض درجة حرارته إلى 50 درجة مئوية وإضافة 5 مل من برنامج تلفزيوني (الخطوة 5.1)، من أجل الحصول على حل في نسبة 1: 1 الحجمي.
- إعداد 12 لوحة تحتوي على multiwell اسطوانات من الفولاذ التي يبلغ قطرها 1.1 سم.
- خذ 500 مكل من الحل ووضعها على كل اسطوانات من الفولاذ.
- ترك في بقية لمدة 45 دقيقة حتى gelification كاملة للنظام.
- إزالة اسطوانات باستخدام ملقط الفولاذ المقاوم للصدأ للحصول على الهلاميات المائية.
6. تحميل من أداة علاجية (المخدرات أو خلايا)
- كرر الواحدEPS 5،1-5،7.
- عندما الخليط (بالفعل في دولة سول) تبلغ 37 درجة مئوية، إضافة 5 مل من محلول يحتوي على محلول الدواء أو خلية الثقافة المطلوبة، من أجل الحصول على النظام النهائي في نسبة 1: 1 الحجمي.
- كرر الخطوات من 5،9-5،12 للحصول على شبكات البوليمرية مع biocompounds شرك جسديا داخل هلام.
7. هيدروجيل توصيف
- تحليل FT-IR
- بعد تشكيل هلام، ونقع واحدة من الهلاميات المائية synthetized في 2.5 مل من الماء المقطر لمدة 24 ساعة.
- إزالة الوسط المائي حيث غمرت هيدروجيل وتجميد الجافة مع السائل N 2.
- صفح العينة هيدروجيل وفقا لتقنية بيليه KBR.
- إضافة ملعقة كاملة من شركة KBR إلى هاون العقيق. تأخذ كمية صغيرة من عينة هيدروجيل (حوالي 0.1-2٪ من المبلغ كي بي آر، أو ما يكفي لتغطية رأس ملعقة) وتخلط مع مسحوق KBR.
- طحن الخليط حتى المسحوق على ما يرام ومتجانسة.
- استخدام عدة بيليه كي بي آر لتشكيل بيليه الأشعة تحت الحمراء. اضغط على مسحوق باستخدام الصحافة مختبر اليدوية: لمدة 3 دقائق في قدرة ضغط تساوي 5 أطنان ثم لمدة 3 دقائق في قدرة ضغط من 10 ألف طن.
- الافراج عن الضغط للحصول على بيليه النهائي كما متجانسة وشفافة في المظهر. أدخل بيليه إلى صاحب العينة الأشعة تحت الحمراء وتشغيل الطيف 16.
- الدراسات دبق
- ملء 2 مل أنبوب microcentrifuge مع 900 ميكرولتر من برنامج تلفزيوني وتتوازن إلى 37 درجة مئوية.
- إضافة 100 ميكرولتر من محلول البوليمر مستعدة لتشكيل هيدروجيل واحتضان عند 37 درجة مئوية.
- عكس الأنبوب ومراقبة إذا يتدفق هلام في 1 و 2 و 5 و 10 و 20 دقيقة. تسجيل الوقت الذي لا يتدفق الجل لأن الوقت دبق.
النتائج
ويتم تصنيع مشتقات دوس آلكاين بكفاءة من حمض بولي اكريليك وpropargylamine، أظهرت كما في الشكل رقم 1 حيث n تسميات مونومرات التي تتفاعل مع أمين مجموعة الكربوكسيل. يتم تأكيد هوية المنتج من قبل 1 H-NMR الطيفي. ويبين الشكل (5) وH-NMR الطيف 1 من دوس تعديل م...
Discussion
The PAA post-polymerization modification with alkyne moieties and the RGD functionalization with the azide group guarantee the formation of a stable bond between the polymer and the peptide. Indeed, triazole serves as a rigid linking unit among the carbon atoms, attached to the 1,4 positions of the 1,2,3-triazole ring and it cannot be cleaved hydrolytically or otherwise. In addition, triazole is extremely difficult to oxidize and reduce, unlike other cyclic structures such as benzenoids and related aromatic heterocycles<...
Disclosures
The authors state no conflict of interest and they have not received any payment in preparation of this manuscript.
Acknowledgements
سيكون الكتاب أود أن أشكر الدكتور ماوريتسيو ماسي للمناقشة مثمرة والآنسة كيارا Allegretti لتحرير اللغة. هناك دعم للبحوث المؤلفين بواسطة باندو جيوفاني Ricercatori 2010 (MINISTERO ديلا تحية GR-2010- 2312573).
Materials
| Name | Company | Catalog Number | Comments |
| Poly(acrylic acid) solution average Mw ~100,000, 35 wt% in H2O | Sigma Aldrich | 523925 | CAS 9003-01-4 |
| Poly(ethylene glycol) 2,000 | Sigma Aldrich | 84797 | CAS 25322-68-3 |
| Carbomeer 974P | Fagron | 1387083 | |
| Agarose | Invitrogen Corp. | 16500-500 | UltraPure Agarose |
| RGD peptide | abcam | ab142698 | |
| 4-azidobutanoic acid | Aurum Pharmatech | Z-2421 | CAS 54447-68-6 |
| Oxalyl chloride | Sigma Aldrich | O8801 | CAS 79-37-8 |
| Propargylamine hydrochloride 95% | Sigma Aldrich | P50919 | CAS 15430-52-1 |
| Copper(I) iodide | Sigma Aldrich | 3140 | CAS 7681-65-4 |
| Sodium ascorbate | Sigma Aldrich | Y0000039 | CAS 134-03-2 |
| Phosphate buffered saline | Sigma Aldrich | P4417 | |
| Dialysis Membrane | Spectrum Laboratories, Inc. | 132725 | Spectra/Por 3 Dialysis Membrane Standard RC Tubing MWCO: 3.5 kD |
References
- Slaughter, B. V., Khurshid, S. S., Fisher, O. Z., Khademhosseini, A., Peppas, N. A. Hydrogels in Regenerative Medicine. Adv. Mater. 21 (32-33), 3307-3329 (2009).
- Rossi, F., Perale, G., Papa, S., Forloni, G., Veglianese, P. Current options for drug delivery to the spinal cord. Expert Opin. Drug Deliv. 10 (3), 385-396 (2013).
- Huebsch, N., et al. Harnessing traction-mediated manipulation of the cell/matrix interface to control stem-cell fate. Nat. Mater. 9 (6), 518-526 (2010).
- Mothe, A. J., Tam, R. Y., Zahir, T., Tator, C. H., Shoichet, M. S. Repair of the injured spinal cord by transplantation of neural stem cells in a hyaluronan-based hydrogel. Biomaterials. 34 (15), 3775-3783 (2013).
- Khetan, S., et al. Degradation-mediated cellular traction directs stem cell fate in covalently crosslinked three-dimensional hydrogels. Nat. Mater. 12 (5), 458-465 (2013).
- Ashley, G. W., Henise, J., Reid, R., Santi, D. V. Hydrogel drug delivery system with predictable and tunable drug release and degradation rates. Proc. Natl. Acad. Sci. U S A. 110 (6), 2318-2323 (2013).
- Rossi, F., van Griensven, M. Polymer Functionalization as a Powerful Tool to Improve Scaffold Performances. Tissue Eng. Part A. 20 (15-16), 2043-2051 (2014).
- Gould, S. T., Darling, N. J., Anseth, K. S. Small peptide functionalized thiol-ene hydrogels as culture substrates for understanding valvular interstitial cell activation and de novo tissue deposition. Acta Biomater. 8 (9), 3201-3209 (2012).
- Azagarsamy, M. A., Anseth, K. S. Wavelength-Controlled Photocleavage for the Orthogonal and Sequential Release of Multiple Proteins. Angew. Chem. Int. Edit. 52 (51), 13803-13807 (2013).
- Larrañeta, E., et al. Microwave-Assisted Preparation of Hydrogel-Forming Microneedle Arrays for Transdermal Drug Delivery Applications. Macromol. Mater. Eng. 300 (6), 586-595 (2015).
- Cook, J. P., Goodall, G. W., Khutoryanskaya, O. V., Khutoryanskiy, V. V. Microwave-Assisted Hydrogel Synthesis: A New Method for Crosslinking Polymers in Aqueous Solutions. Macromol. Rapid Comm. 33 (4), 332-336 (2012).
- Perale, G., et al. Multiple drug delivery hydrogel system for spinal cord injury repair strategies. J. Control. Release. 159 (2), 271-280 (2012).
- Rossi, F., Perale, G., Storti, G., Masi, M. A Library of Tunable Agarose Carbomer-Based Hydrogels for Tissue Engineering Applications: The Role of Cross-Linkers. J. Appl. Polym. Sci. 123 (4), 2211-2221 (2012).
- Frith, J. E., et al. An injectable hydrogel incorporating mesenchymal precursor cells and pentosan polysulphate for intervertebral disc regeneration. Biomaterials. 34 (37), 9430-9440 (2013).
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click chemistry: Diverse chemical function from a few good reactions. Angew. Chem. Int. Edit. 40 (11), (2001).
- Sacchetti, A., Mauri, E., Sani, M., Masi, M., Rossi, F. Microwave-assisted synthesis and click chemistry as simple and efficient strategy for RGD functionalized hydrogels. Tetrahedron Lett. 55 (50), 6817-6820 (2014).
- Ossipov, D. A., Hilborn, J. Poly(vinyl alcohol)-based hydrogels formed by "click chemistry". Macromolecules. 39 (5), 1709-1718 (2006).
- Truong, V., Blakey, I., Whittaker, A. K. Hydrophilic and Amphiphilic Polyethylene Glycol-Based Hydrogels with Tunable Degradability Prepared by "Click" Chemistry. Biomacromolecules. 13 (12), 4012-4021 (2012).
- Hou, R. Z., et al. New synthetic route for RGD tripeptide. Prep. Biochem. Biotechnol. 36 (3), 243-252 (2006).
- Rossi, F., Chatzistavrou, X., Perale, G., Boccaccini, A. R. Synthesis and Degradation of Agar-Carbomer Based Hydrogels for Tissue Engineering Applications. J. Appl. Polym. Sci. 123 (1), 398-408 (2012).
- Mauri, E., Rossi, F., Sacchetti, A. Tunable drug delivery using chemoselective functionalization of hydrogels. Mater. Sci. Eng. C. 61, 851-857 (2016).
- Joaquin, A., Peppas, N. A., Zoldan, J. Hydrogel Polymer Library for Developing Induced Pluripotent Stem Cell Derived Cardiac Patches. Tissue Eng. Part A. 20, S55-S55 (2014).
- Rossi, F., et al. Tunable hydrogel-Nanoparticles release system for sustained combination therapies in the spinal cord. Colloids Surf. B Biointerfaces. 108, 169-177 (2013).
- Kolb, H. C., Sharpless, K. B. The growing impact of click chemistry on drug discovery. Drug Discov. Today. 8 (24), 1128-1137 (2003).
- Ossipov, D. A., Yang, X., Varghese, O., Kootala, S., Hilborn, J. Modular approach to functional hyaluronic acid hydrogels using orthogonal chemical reactions. Chem. Commun. 46 (44), 8368-8370 (2010).
- Anderson, S. B., Lin, C. C., Kuntzler, D. V., Anseth, K. S. The performance of human mesenchymal stem cells encapsulated in cell-degradable polymer-peptide hydrogels. Biomaterials. 32 (14), 3564-3574 (2011).
- Caron, I., et al. A new three dimensional biomimetic hydrogel to deliver factors secreted by human mesenchymal stem cells in spinal cord injury. Biomaterials. 75, 135-147 (2016).
- Lee, J. W., Kim, H., Lee, K. Y. Effect of spacer arm length between adhesion ligand and alginate hydrogel on stem cell differentiation. Carbohyd. Polym. 139, 82-89 (2016).
- Liu, Y., Fan, Z., Wang, Y., Yu, L. Controlled Release of Low Molecular Protein Insulin-like Growth Factor-1 through Self-Assembling Peptide Hydrogel with Biotin Sandwich Approach. J.Biomed. Eng. 32 (2), 387-392 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved