A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إجراءات التكيف مختبر تطور الكائنات الدقيقة باستخدام ناظم كيميائي
* These authors contributed equally
In This Article
Summary
هنا، نقدم بروتوكول للحصول تطور مختبر التكيف من الكائنات الحية الدقيقة في ظل ظروف استخدام الثقافة ناظم كيميائي. أيضا، وتناقش التحليل الجيني لسلالة تطورت.
Abstract
Natural evolution involves genetic diversity such as environmental change and a selection between small populations. Adaptive laboratory evolution (ALE) refers to the experimental situation in which evolution is observed using living organisms under controlled conditions and stressors; organisms are thereby artificially forced to make evolutionary changes. Microorganisms are subject to a variety of stressors in the environment and are capable of regulating certain stress-inducible proteins to increase their chances of survival. Naturally occurring spontaneous mutations bring about changes in a microorganism's genome that affect its chances of survival. Long-term exposure to chemostat culture provokes an accumulation of spontaneous mutations and renders the most adaptable strain dominant. Compared to the colony transfer and serial transfer methods, chemostat culture entails the highest number of cell divisions and, therefore, the highest number of diverse populations. Although chemostat culture for ALE requires more complicated culture devices, it is less labor intensive once the operation begins. Comparative genomic and transcriptome analyses of the adapted strain provide evolutionary clues as to how the stressors contribute to mutations that overcome the stress. The goal of the current paper is to bring about accelerated evolution of microorganisms under controlled laboratory conditions.
Introduction
يمكن أن الكائنات الحية الدقيقة على البقاء والتكيف مع بيئات متنوعة. تحت ضغط شديد، يمكن أن يحدث التكيف عن طريق الاستحواذ على الظواهر المفيدة التي كتبها الطفرات الجينومية عشوائية واختيار إيجابية لاحقة 1-3. لذلك، يمكن أن الخلايا الميكروبية التكيف عن طريق تغيير التمثيل الغذائي أو الشبكات التنظيمية للنمو الأمثل، وهو ما يطلق عليه "تطور التكيف". الأخيرة النزعات الميكروبية الهامة، مثل انتشار الجراثيم وحدوث سلالات ميكروبية قوية، ترتبط ارتباطا وثيقا جدا لالتكييفية تطور تحت ظروف ضاغطة. تحت ظروف المختبر محددة، ونحن قادرون على دراسة آليات التطور الجزيئي وحتى التحكم في اتجاه تطور ميكروبات لمختلف التطبيقات. على عكس الكائنات متعددة الخلايا والكائنات وحيدة الخلية هي مناسبة تماما لتطور مختبر التكيف (الرابطة) وذلك للأسباب التالية: أنها تجديد بسرعة، والحفاظ على عدد كبير من السكان، وأنه من السهل لخلق والحفاظ هومبيئات ogeneous. جنبا إلى جنب مع التطورات الحديثة في تقنيات تسلسل الحمض النووي وتقنيات عالية الإنتاجية، الرابطة يسمح لمراقبة مباشرة من التغيرات الجينية التي تؤدي إلى تغييرات تنظيمية النظامية. ديناميات طفرية ومجموعة متنوعة من السكان هي أيضا ملاحظتها. استراتيجيات الهندسة الوراثية يمكن تحديد من تحليل سلالات الرابطة 4،5.
ثقافة ناظم كيميائي هي الطريقة المستخدمة للحصول على خلايا ثابتة للدولة وزيادة الإنتاجية في عمليات التخمير 6. يضاف متوسطة جديدة ويتم حصاد ثقافة مرق أثناء عملية (ويشمل هذا الأخير المتوسطة والكتلة الحيوية). ثقافة ناظم كيميائي على المدى الطويل، ومع ذلك، يتغير الإنتاجية ثابتة للدولة للثقافة ويجلب تراكم الطفرات العفوية والاختيار خلال ثقافة (الشكل 1A). تحت ضغوط الانتقاء مختلفة (الضغوطات)، ومما يعزز تراكم الطفرات. وهناك زيادة تدريجية من التوتر في المدى الطويل يوفر ناظم كيميائي لمجموعة مستمرة من الطفرات التي تعمل ضد الضغوطات معينة، مثل درجة الحرارة ودرجة الحموضة، والضغط الاسموزي والتجويع المغذيات، والأكسدة، والمنتجات النهائية السامة، وما إلى ذلك نقل مستعمرة من وسط صلب ونقل المسلسل من الوسط السائل (المتكررة ثقافة دفعة) تسمح للباحثين للحصول على الكائنات الحية الدقيقة تطورت (الشكل 1B و1C). على الرغم من أن الثقافة ناظم كيميائي يتطلب أساليب معقدة، وتجمع التنوع (عدد مكررات وحجم السكان) أعلى من تلك التي يحصل عليها عن طريق التحويل مستعمرة وتقنيات نقل التسلسلية. تعرض الضغط مستقر إلى الخلايا الفردية وانخفض التباين في دولة الخلوية خلال ثقافة ناظم كيميائي (الحالة المستقرة) هي فوائد أخرى من الرابطة بالمقارنة مع التقنيات المعتمدة ثقافة دفعة واحدة. هو عرض ALE التوتر الناجم عن الإشريكية القولونية يتعرضون لظروف السكسينات عالية في هذه المقالة.
ديزيل / ftp_upload / 54446 / 54446fig1.jpg "/>
الشكل 1: طرق تطور مختبر التكيف (A) ناظم كيميائي؛ (ب) نقل المسلسل؛ (ج) نقل مستعمرة. الأرقام أعلى توضح مفهوم طرق الرابطة، والأرقام السفلية توضح عدد الخلايا التي نمت خلال الرابطة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
1. إعداد المعدات
- الحصول على جرة ناظم كيميائي (150-250 مل) أو دورق مخروطي (250 مل) تحتوي على مدخل الميناء والميناء منفذا. ربط الموانئ مع أنبوب السيليكون السماح لمعدلات تدفق 10-100 مل / ساعة. اختياريا، استخدم فتحة التهوية، ومنفذ منفذ الهواء، ومدخل المياه ومنفذ الموانئ التي تسيطر عليها درجة الحرارة.
- الحصول على جهاز مناسبة لجرة ناظم كيميائي ينص على الانفعالات والتحكم في درجة الحرارة (أو استخدام حاضنة تهتز الدوارة).
- الحصول على اثنين من مضخات تحوي من أجل تقديم متوسطة جديدة وجمع الثقافة.
- الحصول على جرة خزان (10-20 لتر) يحتوي على منفذ ميناء المتوسط ومنفذ مدخل الهواء.
- الحصول على أنبوب السيليكون مناسبة لمعدل التخفيف (أي الرقم 0.8 مم، ومجموعة تدفق ،06-36 مل / دقيقة، L / S 13 الأنابيب).
2. إعداد المتوسطة والتعقيم
- متوسط الأولي
- حل 0.3 غرام غلوكوز، 0.08 ز NH 4الكلورين، 0.05 غرام كلوريد الصوديوم، 0.75 ز نا 2 هبو 4 · 2H 2 O، و 0.3 ز KH 2 PO 4 في 90 مل من الماء المقطر (DW) في جرة ناظم كيميائي.
- ختم جرة ناظم كيميائي جنبا إلى جنب مع الأنابيب باستخدام المشابك. لا ختم تنفيس الهواء.
- تعقيم جرة ناظم كيميائي في الأوتوكلاف في درجة حرارة 121 مئوية لمدة 15 دقيقة. بعد التعقيم، وتخزين جرة ناظم كيميائي في درجة حرارة الغرفة.
- حل 0.02 غرام MgSO 4 · 7H 2 O، 0.01 غ CaCl 2، و 0.1 ملغ الثيامين في 10 مل DW (حل A).
- حل تصفية باستخدام حقنة ومرشح حقنة تعقيمها قبل (مرشح 0.45 ميكرون المسام).
- إضافة الحل ويرشح لجرة ناظم كيميائي.
- الإجهاد المتوسطة
- حل 30 ز الجلوكوز، 8 ز NH 4 CL، 5 غرام كلوريد الصوديوم، و 75 ز نا 2 هبو 4 · 2H 2 O، 30 ز KH 2 PO 4، و 300 غرام صوديوم السكسينات هيدرات (نا 2 · السكسينات · 6H <فرعية> 2 O؛ الضغوطات المستخدمة في هذه التجربة) في 9.9 L DW في جرة الخزان.
- ختم جرة خزان جنبا إلى جنب مع الأنابيب باستخدام المشابك. لا ختم تنفيس الهواء.
- تعقيم جرة خزان في الأوتوكلاف في درجة حرارة 121 مئوية لمدة 15 دقيقة. بعد التعقيم، وتخزين جرة في درجة حرارة الغرفة.
- حل ز 2 MgSO 4 · 7H 2 O، 1 غرام CaCl 2، و 10 ملغ الثيامين في 100 مل DW (حل A).
- تصفية حل ومع حقنة ومرشح حقنة تعقيمها قبل (مرشح 0.45 ميكرون المسام).
- إضافة الحل ويرشح لجرة الخزان.
- جو معقم و مطهر ربط أنبوب السيليكون تعقيمها إلى جرة خزان وإرفاق مضخات تحوي.
- الضغط العالية المتوسطة
- إعداد المتوسطة كما في القسم 2.2، ولكن مع زيادة تركيز الإجهاد (أي 3-5 جرام / لتر أعلى في التكيف السكسينات).
ملاحظة: هذا البروتوكول هو التكيف مع الإجهاد عشرفي أن يتم تسليمها عن طريق وسيط. في حالة الضغوطات المادية مثل درجة الحرارة، والإثارة، أو الإضاءة، وينبغي تصميم زراعة وفقا لذلك.
- إعداد المتوسطة كما في القسم 2.2، ولكن مع زيادة تركيز الإجهاد (أي 3-5 جرام / لتر أعلى في التكيف السكسينات).
3. زراعة الأولية
- تلقيح مستعمرة واحدة من النوع البري E. القولونية في أنبوب اختبار 15 مل تحتوي على 4 مل من المتوسط الأولي.
- احتضان أنبوب اختبار في حاضنة تهتز لمدة 12 ساعة على 37 درجة مئوية و 220 دورة في الدقيقة.
- نقل جو معقم و مطهر 1 مل من preculture إلى جرة ناظم كيميائي.
- احتضان جرة ناظم كيميائي، وتوفير للتهوية (الهواء 50 مل / دقيقة) والإثارة (200 دورة في الدقيقة)، عند 37 درجة مئوية لمدة 6 ساعات.
4. التأكيد على التكيف
- جو معقم و مطهر توصيل نهاية الأنبوب السيليكون من المضخات لجرة ناظم كيميائي.
- بدء ضخ مخرج (10 مل / ساعة أو أعلى) وجمع الثقافة.
ملاحظة: يجب أن تكون الثقافة في مرحلة الأسي، وعادة 4-8 ساعة بعد زراعة الأولية. - الفصلإيك الكثافة الضوئية (600 نانومتر) من ثقافة من الأنابيب منفذ.
- بدء ضخ مدخل (10 مل / ساعة، أي ما يعادل نسبة التخفيف من 0.1 ساعة -1).
- تحقق الكثافة البصرية للثقافة في 600 نانومتر من منفذ أنابيب كل 24 ساعة.
- تشغيل ناظم كيميائي لمدة 96 ساعة (دوران 9.6 أضعاف) أو أكثر. إذا كانت كثافة بصرية مستقرة، تبادل الخزان الذي يحتوي على متوسط ارتفاع الضغط. إذا كانت الكثافة البصرية أقل من 0.2، والتوقف عن تغذية مضخة مدخل ل6 ساعات. إعادة تشغيل مضخة مدخل وتأكد من أن الكثافة البصرية هي أكثر من 0.2.
- زيادة تدريجية في تركيز الإجهاد عن طريق تغيير إلى خزان يحتوي على تركيز الإجهاد العالي.
- أخذ عينات من ثقافة تكييفها كلما يصل معلما (على سبيل المثال، سلالة تتكيف مع 100 غرام / لتر الإجهاد السكسينات)، ومخزن لمزيد من التحليل الجيني.
- لتخزين العينة، خلط العينة ثقافة (0.5 مل) مع تعقيم 80٪ الجلسرين solutiعلى (0.5 مل)، وتخزينه في -80 درجة مئوية.
ملاحظة: إذا كانت الكائنات الحية الدقيقة يكتسب القدرة على الحط من الإجهاد أثناء عملية الرابطة، وتركيز الإجهاد في جرة التخمير ليست هي نفسها كما أنه في خزان جديد.
عزل 5. واحد مستعمرة من سلالة تتكيف الإجهاد
- إعداد المتوسطة لوحة أجار (1.6٪ أجار) التي تحتوي على نفس الضغوطات وعلى نفس التركيز من المتوسط.
- لوحة ثقافة منفذ (0.1 مل) من ناظم كيميائي، واحتضان عند 37 درجة مئوية لمدة 16 ساعة.
- اختيار المستعمرات واحد من لوحة باستخدام مسواك معقمة وتلقيح لهم في 15 مل من أنابيب الاختبار تحتوي على نفس الضغوطات وفي نفس التركيز المتوسط كما في ناظم كيميائي، واحتضان لمدة 6 ساعات.
- نقل 1 مل من مرق الثقافة في قارورة 250 مل مخروطي يحتوي على 50 مل من المتوسط. الحصاد 0.5 مل من مرق ثقافة كل 1 ساعة، وقياس OD في 600 نانومتر. مقارنة معدل نمو الاجهاد تكييفهان إلى أن من سلالة من النوع البري نظرا لالضغوطات.
النتائج
لارتفاع السكسينات من التوتر التكيف، والبرية من نوع E. كان القولونية W3110 سلالة مثقف في ناظم كيميائي في D = 0.1 ساعة -1 لمدة 270 يوما (الشكل 2).
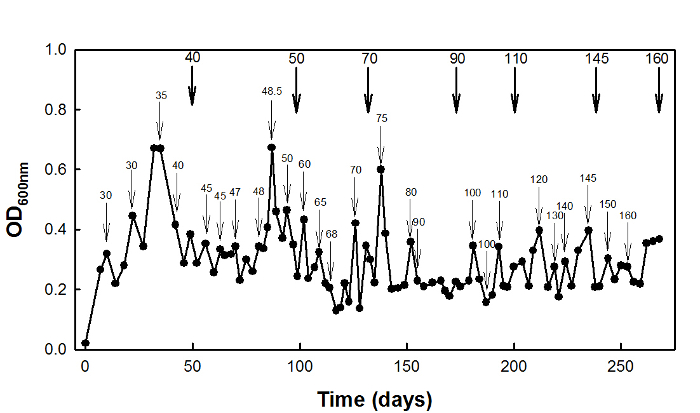
الشكل 2...
Discussion
الكائنات الدقيقة قادرة على التكيف مع جميع البيئات تقريبا بسبب معدل نموها السريع والتنوع الجيني. تطور مختبر التكيف تمكن الكائنات الدقيقة تتطور في ظل ظروف مصممة، الذي يوفر وسيلة لاختيار الكائنات الفردية إيواء الطفرات العفوية التي تعود بالفائدة تحت ظروف معينة.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This study was financially supported by the Korean Ministry of Science, ICT and Future Planning (Intelligent Synthetic Biology Center program 2012M3A6A8054887). P. Kim was supported by a fellowship from the Catholic University of Korea (2015).
Materials
| Name | Company | Catalog Number | Comments |
| Mini-chemostat fermentor | Biotron Inc. | - | manufactured by special order |
| silicon tubing | Cole-Parmer | Masterflex L/S 13 | tubing size can be varied depending on the dilution rate and the size of fermentor jar. |
| reservoir jar | Bellco | Media storage bottle | 20 L |
| chemicals | Sigma-Aldrich | - | reagent grade |
| glucose | Sigma-Aldrich | G5767 | ACS reagent |
| NH4Cl | Sigma-Aldrich | A9434 | for molecular biology, suitable for cell culture, ≥99.5% |
| NaCl | Sigma-Aldrich | 746398 | ACS reagent, ≥99% |
| Na2HPO4·2H2O | Sigma-Aldrich | 4272 | 98.5-101% |
| KH2PO4 | Sigma-Aldrich | 795488 | ACS reagent, ≥99% |
| MgSO4·7H2O | Sigma-Aldrich | 230391 | ACS reagent, ≥98% |
| CaCl2 | Sigma-Aldrich | 793639 | ACS reagent, ≥96% |
| thiamine·HCl | Sigma-Aldrich | T4625 | reagent grade, ≥99% |
| Na2·succinate·6H2O | Sigma-Aldrich | S2378 | ReagentPlus, ≥99% |
References
- Rando, O. J., Verstrepen, K. J. Timescales of genetic and epigenetic inheritance. Cell. 128, 655-668 (2007).
- Kim, H. J., et al. Short-term differential adaptation to anaerobic stress via genomic mutations by Escherichia coli strains K-12 and B lacking alcohol dehydrogenase. Front Microbiol. 5, 476 (2014).
- Mendizabal, I., Keller, T. E., Zeng, J., Yi, S. V. Epigenetics and evolution. Integr Comp Biol. 54, 31-42 (2014).
- Lee, J. Y., Seo, J., Kim, E. S., Lee, H. S., Kim, P. Adaptive evolution of Corynebacterium glutamicum resistant to oxidative stress and its global gene expression profiling. Biotechnol Lett. 35, 709-717 (2013).
- Lee, J. Y., et al. Artificial oxidative stress-tolerant Corynebacterium glutamicum. AMB Express. 4, 15 (2014).
- Narang, A. The steady states of microbial growth on mixtures of substitutable substrates in a chemostat. J Theor Biol. 190, 241-261 (1998).
- Kwon, Y. D., Kim, S., Lee, S. Y., Kim, P. Long-term continuous adaptation of Escherichia coli to high succinate stress and transcriptome analysis of the tolerant strain. J Biosci Bioeng. 111, 26-30 (2011).
- Barrick, J. E., Lenski, R. E. Genome dynamics during experimental evolution. Nat Rev Genet. 14, 827-839 (2013).
- Li, H., et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25, 2078-2079 (2009).
- McKenna, A., et al. The Genome Analysis Toolkit: a MapReduce framework for analyzing next-generation DNA sequencing data. Genome Res. 20, 1297-1303 (2010).
- Deatherage, D. E., Barrick, J. E. Identification of mutations in laboratory-evolved microbes from next-generation sequencing data using breseq. Methods Mol Biol. 1151, 165-188 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved