A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الشعرية الكهربائي لرصد الببتيد مسمار على الأفلام الشيتوزان في الوقت الحقيقي
In This Article
Summary
Free solution capillary electrophoresis is a fast, cheap and robust analytical method that enables the quantitative monitoring of chemical reactions in real time. Its utility for rapid, convenient and precise analysis is demonstrated here through analysis of covalent peptide grafting onto chitosan films for improved cell adhesion.
Abstract
خالية من حل الشعرية الكهربائي (CE) يفصل التحاليل والمركبات اتهم عموما في حل من خلال تطبيق مجال كهربائي. بالمقارنة مع تقنيات الفصل التحليلية الأخرى، مثل اللوني، CE رخيصة وقوية ويتطلب أي تحضير العينة (لعدد من المصفوفات الطبيعية المعقدة أو عينات البوليمر) على نحو فعال. CE سريع، ويمكن استخدامها لمتابعة تطور مخاليط في الوقت الحقيقي (على سبيل المثال، حركية التفاعل الكيميائي)، وإشارات لوحظت في المركبات فصل ويتناسب طرديا مع كمية في الحل.
هنا، وأثبت كفاءة CE لرصد تطعيم التساهمية من الببتيدات على الأفلام الشيتوزان للتطبيقات الطبية اللاحقة. الخصائص المضادة للميكروبات وحيويا الشيتوزان تجعل من مادة جذابة للتطبيقات الطبية الحيوية مثل ركائز نمو الخلايا. تطعيم تساهمي في RGDS الببتيد (أرجينين - الجلايسين -ويهدف سيرين) على سطح الأفلام الشيتوزان في تحسين مرفق الخلية - حمض الأسبارتيك. تاريخيا، تم استخدام اللوني وتحليل الحمض الأميني لتوفير قياس مباشر من مبلغ الببتيد المطعمة. ومع ذلك، فإن فصل سريع وغياب إعداد العينات المقدمة من قبل CE يمكن رصد في الوقت الحقيقي على قدم المساواة دقيقة بعد عملية ترقيع الببتيد. CE غير قادرة على فصل وتحديد مختلف مكونات خليط التفاعل: (عدم المطعمة) الببتيد وكلاء اقتران الكيميائية. في هذه الطريقة استخدام CE النتائج في تحسين الأفلام لتطبيقات المصب.
وتميزت الأفلام الشيتوزان من خلال الحالة الصلبة الرنين المغناطيسي النووي (الرنين المغناطيسي النووي) الطيفي. هذا الأسلوب هو أكثر استهلاكا للوقت، ولا يمكن أن تطبق في الوقت الحقيقي، ولكن غلة القياس المباشر من الببتيد، وبالتالي بالتحقق من صحة تقنية CE.
Introduction
حل الحرة الشعرية الكهربائي (م) هو الاسلوب الذي يفصل بين المركبات في الحلول المبنية على من نسبة 1،2 الشحنة للاحتكاك. وكثيرا ما ذكر نسبة الشحنة للحجم في الأدب، ولكن لا ينطبق هذا التبسيط إلى polyelectrolytes، بما في ذلك البروتينية في هذا العمل، وأظهرت أيضا أن لا يكون مناسبا لجزيئات عضوية صغيرة 3. CE يختلف عن تقنيات الفصل الأخرى من حيث أنه لايوجد مرحلة ثابتة، فقط بالكهرباء الخلفية (عادة عازلة). وهذا يسمح للتقنية ليكون قويا في قدرته على تحليل مجموعة كبيرة من العينات مع المصفوفات المعقدة 4 مثل الألياف النباتية 5، التخمير يهيئ 6 مسمار على البوليمرات الاصطناعية 7، عينات المواد الغذائية 8، والببتيدات بالكاد القابلة للذوبان 9 دون تحضير عينة مملة و طهارة. وهذا أمر مهم خاصة بالنسبة للpolyelectrolytes المعقدة التي لديها قضايا الحل (قاوك والشيتوزان 10 و جيلان اللثة 11)، وبالتالي وجود مجمعة كما أو عجلت في حل وتم تحليلها بنجاح دون عينة الترشيح. وعلاوة على ذلك، فإن تحليل السكريات في حبوب الإفطار تشارك حقن عينات مع جزيئات من عينات حبوب الافطار عجلت في الماء 8. هذا يمتد أيضا إلى تحليل polyelectrolytes متفرعة أو بوليمرات 12،13. كما تم الانتهاء من أعمال مكثفة في مجال تطوير تقنيات CE خصيصا لتحليل البروتينات لالبروتينات 14، الفصل انطباقي من الببتيدات الطبيعية أو الاصطناعية 15 و فصل رقاقة من البروتينات والببتيدات 16. منذ الانفصال وتحليل تجري في شعري، وتستخدم كميات صغيرة فقط من العينة، والمذيبات التي تمكن CE لتكلفة تشغيلها أقل من تقنيات الفصل أخرى بما في ذلك 5،6،17 اللوني. منذ الانفصال من قبل CE سريع، لأنها تتيح رصد ومراقبةحلقة من حركية التفاعل. وقد تجلى ذلك في حالة تطعيم الببتيدات على الأفلام الشيتوزان لتحسين التصاق الخلية 18.
الشيتوزان هو السكاريد المستمدة من -deacetylation N من الكيتين. الأفلام الشيتوزان يمكن استخدامها لمختلف التطبيقات الطبية الحيوية مثل bioadhesives 19 وركائز نمو الخلايا 18،20، نظرا لتوافق مع الحياة الشيتوزان البالغ عددهم 21. مرفق الخلية البروتينات المصفوفة خارج الخلية المحددة، مثل فبرونيكتين، الكولاجين و laminin، يرتبط ارتباطا مباشرا لبقاء الخلايا 22. وتجدر الإشارة إلى أنواع مختلفة من الخلايا وغالبا ما تتطلب مرفق لمختلف البروتينات المصفوفة خارج الخلية من أجل البقاء وظيفة مناسبة. وقد تبين مرفق الخلية إلى الأفلام الشيتوزان ليتم تعزيزها من خلال تطعيم الفيبرونكتين 23؛ ومع ذلك، وإعداد وتنقية وتطعيم هذه البروتينات كبيرة غير قابلة للتطبيق اقتصاديا. بالتناوب مجموعة من الببتيدات الصغيرة هفثبت ه لتكون قادرة على محاكاة خصائص البروتينات كبيرة المصفوفة خارج الخلية. على سبيل المثال، الببتيدات مثل RGD محاكيات الفيبرونكتين استخدمت لتسهيل وزيادة مرفق الخلية 24 (أرجينين - الجلايسين - حمض الأسبارتيك) وRGDS (سيرين أرجينين - الجلايسين - - حمض الأسبارتيك). أدى التساهمية تطعيم RGDS على الأفلام الشيتوزان في تحسين مرفق الخلية لخلايا المعروف أن نعلق على فبرونيكتين في الجسم الحي 18. استبدال البروتينات أكبر يحب فبرونيكتين مع الببتيدات الصغيرة التي لديها نفس الوظيفة توفر انخفاض كبير في التكاليف.
هنا، تم تنفيذ الببتيد تطعيم لالشيتوزان كما نشرت سابقا (18). كما هو موضح سابقا، ويوفر هذا النهج التطعيم بسيطة وفعالة عن طريق استخدام وكلاء اقتران EDC، حمض الهيدروكلوريك (1 إيثيل-3- (3-dimethylaminopropyl) carbodiimide) وNHS (N -hydroxysuccinimide) إلى functionalize الأحماض الكربوكسيلية من RGDS أن يكون تطعم بهفيلم الشيتوزان. اثنين من مزايا هذه الطريقة التطعيم هي أنه لا يتطلب أي تعديل الشيتوزان أو من الببتيد، واضطلعت بها في وسط مائي لتحقيق التوافق مع تطبيقات زراعة الخلايا المستقبلية 18،20. كما يمكن شحن وكلاء اقتران والببتيد، م هي طريقة مناسبة لتحليل حركية التفاعل. الأهم من ذلك، تحليل حركية التفاعل عبر CE يمكن رصد في الوقت الحقيقي من رد فعل التطعيم، وبالتالي تمكن كل من تحسين وقياس درجة التطعيم.
في حين أنه ليس من الضروري بشكل روتيني، ونتائج التحليل CE يمكن التحقق من صحة خارج الخط من قبل القياس المباشر من الببتيد تطعيم على الأفلام الشيتوزان باستخدام الحالة الصلبة الرنين المغناطيسي النووي (الرنين المغناطيسي النووي) الطيفي 25،26 للتدليل على تطعيم التساهمية من الببتيد على فيلم 18. ومع ذلك، بالمقارنة مع الحالة الصلبة الرنين المغناطيسي الطيفي، في الوقت الحقيقي التحليل الذي قدمهCE تمكن من تقدير حجم استهلاك الببتيد في الوقت الحقيقي، وبالتالي القدرة على تقييم حركية التفاعل.
الطريقة المذكورة أعلاه بسيط ويسمح للتحليل في الوقت الحقيقي من الببتيد تطعيم على الأفلام الشيتوزان مع تقدير غير مباشر لمدى التطعيم. ويمكن تمديد الأسلوب هو موضح في التقييم الكمي في الوقت الحقيقي من التفاعلات الكيميائية المختلفة طالما المواد المتفاعلة أو المنتجات التي سيتم تحليلها يمكن توجيه الاتهام.
Protocol
1. إعداد الشيتوزان الأفلام
- تزن من 2 غرام من حامض الخليك الجليدي، الكامل إلى 100 مل مع الماء عالى النقاء.
- تزن من 1.7 غرام من مسحوق الشيتوزان، إضافة 100 مل من 2٪ م / م الخليك محلول مائي الحمضية. يحرك المزيج لمدة 5 أيام مع شريط التحريك ولوحة التحريك المغناطيسي في درجة حرارة الغرفة إما مغطاة بورق الألمنيوم أو في الظلام.
- أجهزة الطرد المركزي تشتت الشيتوزان في 1076 x ج في 23 درجة مئوية لمدة 1 ساعة. جمع طاف مع حقنة وتجاهل راسب.
- لكل فيلم، قسامة 10 مل من تعليق الشيتوزان إلى 9 سم البلاستيك طبق بيتري في درجة حرارة الغرفة. ترك الأفلام تغطيتها لتجف لمدة 7 أيام على الأقل.
- قطع باستخدام مقص الأفلام الجافة إلى 1 × 1 سم الساحات. ملاحظة: يمكن أن يكون مؤقتا التجربة في هذه المرحلة.
2. إعداد المالحة الفوسفات مخزنة (PBS)
- تزن من 8 ز كلوريد الصوديوم، 0.2 غرام كلوريد البوتاسيوم، 1.44 ز فوس ثنائي الصوديوم الهيدروجينيةphate و 0.24 جم هيدروجين فوسفات البوتاسيوم.
- حل هذه المواد الكيميائية وزنه في 800 مل من الماء عالى النقاء ويعاير الحل مع حمض الهيدروكلوريك المركز لدرجة الحموضة 7.4.
ملاحظة: يمكن أن يكون مؤقتا التجربة في هذه المرحلة.
3. إعداد 75 ملم الصوديوم بورات العازلة في درجة الحموضة 9.2
- تزن من 3.0915 غرام من حمض البوريك. حله في 75 مل من الماء عالى النقاء.
- عاير محلول حمض البوريك إلى الرقم الهيدروجيني من 9.2 بمحلول هيدروكسيد الصوديوم بتركيز 10 M أو أعلى.
الحذر: تتركز حلول هيدروكسيد الصوديوم هي للتآكل، وينبغي التعامل معها قفازات. - كاملة مع الماء عالى النقاء للحصول على 100 مل من محلول. هذا ينتج العازلة بورات الصوديوم 500 ملي في درجة الحموضة 9.2.
- تمييع 500 ملي العازلة بورات الصوديوم مع الماء عالى النقاء إلى 75 ملي العازلة بورات الصوديوم. ملاحظة: يمكن أن يكون مؤقتا التجربة في هذه المرحلة.
4. إعداد الشيتوزان فايLMS للتفاعل التطعيم
- شطف 10 الأفلام الشيتوزان مربع (1 × 1 سم) في 5 مل من برنامج تلفزيوني لمدة 2 ساعة في طبق بيتري في درجة حرارة الغرفة.
- خلال هذا الوقت، وإعداد والتحقق من صحة الصك الشعرية الكهربائي (الخطوة 5).
5. إعداد والتحقق من شعري الكهربائي صك
- إعداد 43.5 سم عارية تنصهر السيليكا الشعرية التي يبلغ قطرها الداخلي 50 ميكرون (43.5 سم هو الطول الكلي، الطول الفعلي إلى إطار الكشف عادة 35 سم) عن طريق إضعاف الطلاء الخارجي البوليمر من شعري في طول مجموعة مع إناء حادة ثم يقبلون الشعرية.
- إنشاء إطار للالشعرية باستخدام ولاعة لحرق طلاء البوليمر في 8.5 سم من مدخل وبعد أن يبرد القضاء عليها نظيفة مع الايثانول. حرق طلاء الشعرية في نهاية كل لبضعة ملليمترات مع أخف وزنا، وبعد أن يبرد القضاء عليها نظيفة مع الايثانول.
- مكان الشعرية الإعلامييننافذة كشف دي وتثبيته في الكاسيت الشعرية عن طريق وضعها في أطوال متساوية في مدخل ومخرج ولف حولها ومغزل من الكاسيت. ثم تثبيت الكاسيت في الصك الشعرية الكهربائي.
- تعيين معلمات الأسلوب لكل فصل. في قائمة البرامج حدد "طريقة" ثم "تحرير طريقة بأكمله". ضبط درجة الحرارة والوقت والجهد، وقوارير تستخدم لفصل (على سبيل المثال 25 درجة مئوية، 10 دقيقة، 30 كيلو فولت).
- في قسم ما قبل تكييف، تعيين الإحمرار على التوالي: 10 دقيقة مع 1 م هيدروكسيد الصوديوم (في الماء)، 5 دقائق مع 0.1 M هيدروكسيد الصوديوم (في الماء)، 5 دقائق مع الماء عالى النقاء و 5 دقائق مع 75 ملي العازلة بورات الصوديوم في الرقم الهيدروجيني 9.2 للأسلوب الأول من سلسلة من التحليلات.
- لأساليب اللاحقة، تعيين مجموعة الإحمرار متتالية في قسم ما قبل تكييف: 1 دقيقة مع 1 م هيدروكسيد الصوديوم (في الماء)، 5 دقائق مع 75 ملي العازلة بورات الصوديوم في الرقم الهيدروجيني 9.2.
- في قسم الحقن، ووضع معايير لحقن الهيدروديناميكية مع الضغط 30 مليبار لمدة 10 ثانية لجميع الأساليب. في قسم الانفصال، تهيئة الظروف الفصل إلى 30 كيلو فولت عند 25 درجة مئوية لمدة 9 دقائق لجميع الأساليب.
ملاحظة: راجع دليل المستخدم لأداة CE محدد وإجراءات تشغيل أداة CE قد تختلف بين المصنعين. تحضير محلول هيدروكسيد الصوديوم 1 م في اليوم.
- حقن وفصل معيار داخلي محايد (10 ميكرولتر من 10٪ ت / ت ثنائي ميثيل سلفوكسيد (DMSO)، في الماء المخفف إلى 450 ميكرولتر من 75 ملي العازلة بورات الصوديوم). ثم حقن وفصل بالطريقة نفسها معيارا oligoacrylate (المذاب في الماء عالى النقاء في 10 ز ∙ L -1، انظر قائمة من المواد) للتحقق من صحة الشعيرات الدموية. وقفة تسلسل هنا حتى رد فعل التطعيم هو على استعداد للبدء.
6. مسمار RGDS على الشيتوزان السينمائي
- تزن خارج الببتيد (1 RGDS ملغ)وكلاء اقتران (3 ملغ EDC، حمض الهيدروكلوريك و 2 ملغ NHS).
- 2 ساعة بعد بداية تمرغ فيلم الشيتوزان في برنامج تلفزيوني، حل الببتيد وكلاء اقتران في 5 مل من برنامج تلفزيوني.
- اتخاذ قسامة 50 ميكرولتر من هذا الحل. إضافة 2 ميكرولتر من 10٪ ت / ت DMSO في الماء كمعيار محايد الداخلي للقسامة. تحليل قسامة مع اوربا (راجع الخطوة 7).
- إزالة 5 مل من برنامج تلفزيوني تستخدم لشطف الأفلام الشيتوزان من طبق بيتري. إضافة محلول 5 مل من الببتيد واقتران وكلاء لطبق بتري تحتوي على الأفلام الشيتوزان.
- تغطية طبق بيتري مع فيلم البارافين ووضعه على شاكر المداري في درجة حرارة الغرفة. خذ 50 مكل من ردود فعل الإعلام في أوقات معينة.
ملاحظة: الساعة التحليل الكلي مع CE هو 15 دقيقة، وبالتالي قسامة يمكن أن تؤخذ كل 15 دقيقة (أو كل 30 دقيقة إذا تم رصد اثنين من ردود الفعل في موازاة ذلك، وما إلى ذلك).- إضافة 2 ميكرولتر من 10٪ ت / ت DMSO في الماء كمعيار محايد الداخلي لكل آلiquot.
ملاحظة: يجب أن تحلل أجزاء مأخوذة مع CE حالما يتم نقلهم (راجع الخطوة 7).
- إضافة 2 ميكرولتر من 10٪ ت / ت DMSO في الماء كمعيار محايد الداخلي لكل آلiquot.
- بعد 4 ساعات من الهز وإزالة قسامة، وإزالة طبق بيتري من شاكر. إزالة المتوسطة رد فعل من طبق بيتري. إضافة 5 مل من برنامج تلفزيوني لشطف الأفلام الشيتوزان.
- إزالة برنامج تلفزيوني من طبق بيتري، وشطف فيلم الشيتوزان مع الماء عالى النقاء والسماح لهم لتجف بين عشية وضحاها. إزالة الماء عالى النقاء وتخزين الأفلام في -20 درجة مئوية في البلاستيك طبق بتري.
7. رصد رد الفعل التطعيم عن طريق م
- حقن وقسامات منفصلة من ردود فعل الإعلام مباشرة بعد إزالة من طبق بيتري باستخدام الظروف التحليل كما في القسم 5.2.
- عند الانتهاء من فصل شطف الشعرية مع الماء عالى النقاء لمدة 10 دقيقة. جففه من خلال مطاردة مع قارورة فارغة (الهواء) لمدة 10 دقيقة.
ملاحظة: يمكن أن يكون مؤقتا التجربة في هذه المرحلة.
8. Trea البيانات tment لCE
- تحقق من صحة كل فصل، من خلال التأكد من أن كل من التيار خلال فصل ووقت الهجرة من علامة التنقل electroosmotic ([دمس] في هذه الحالة) هي مماثلة لتلك التي لوحظت في الفصل القياسية oligoacrylate.
ملاحظة: ما يصل إلى 10-15٪ الاختلاف هو مقبول من القيمة الحالية المتوقعة من حوالي 50 أمبير والهجرة قيمة الوقت 1.3 دقيقة (يجب أن تستخدم القيم التنقل الكهربي بدلا من مرة الهجرة إذا كنت بحاجة لتكرار أعلى). - لكل فصل ناجحة، تصدير البيانات الخام من برنامج الكهربائي الشعرية من خلال اختيار مجموعة بيانات محددة، والنقر فوق الحق على الصادرات واختيار إشارة المناسبة.
- تحويل البيانات الخام التي سجلتها م (كما عرضت امتصاص الأشعة فوق البنفسجية بوصفها وظيفة من الوقت الهجرة). تحويل المحور السيني (الهجرة وقت ر م) إلى μ التنقل الكهربي التالية المعادلة 1:
ن 1 "SRC =" / ملفات / ftp_upload / 54549 / 54549eq1.jpg "/> (1)
حيث L d هو طول لكاشف، L ر هو الطول الكلي للالشعرية، والخامس هو الجهد، ور EO هو الوقت المناسب هجرة مسكوكة محايد (المعيار الداخلي DMSO في هذه الحالة) 27.
تحويل العمودي من البيانات الخام (الامتصاصية في الاتحاد الافريقي) لتوزيع التنقلات الكهربي W (μ) التالية المعادلة 2: 28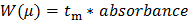 (2)
(2)
9. توصيف إضافية من الأفلام-المطعمة الببتيد 18
- إدراج الأفلام الشيتوزان-المطعمة الببتيد، وتوالت حول نفسها، في 4 مم الحالة الصلبة الرنين المغناطيسي الدوار. ملء الدوار مع الفوسفات مخزنة المالحة إلى تضخم الأفلام، وإغلاق الدوار. الانتظار لبضع ساعات.
- تحليل الفيلم مع 13 </ سوب> C NMR الطيفي 18.
النتائج
م هي مناسبة تماما لمراقبة التطعيم من الببتيدات (على سبيل المثال، RGDS) على الأفلام الشيتوزان. تشمل وكلاء اقتران مناسبة EDC، حمض الهيدروكلوريك وNHS التي تنشط الببتيد إلى أن تطعم به الشيتوزان (الشكل 1). CE قادر على فصل جزيئات مختلفة من الاهتمام ...
Discussion
بساطة بروتوكول صفها هنا يجعل من مناسبة بشكل مثالي لتطبيق على نطاق واسع. ومع ذلك، يحتاج إلى عناية خاصة ليتم دفعها إلى من الخطوات الرئيسية التالية.
إعداد الأداة المناسبة CE
من المهم أن ?...
Disclosures
الكتاب تعلن أنه ليس لديهم مصالح مالية المتنافسة.
Acknowledgements
MG, MO'C and PC thank the Molecular Medicine Research Group at WSU for Research Seed Funding, as well as Michele Mason (WSU), Richard Wuhrer (Advanced Materials Characterisation Facility, AMCF, WSU) and Hervé Cottet (Montpellier) for discussions.
Materials
| Name | Company | Catalog Number | Comments |
| Water | Millipore | All water used in the experiment has to be of Milli-Q quality | |
| Chitosan powder (medium molecular weight) | Sigma-Aldrich | 448877 | lot MKBH1108V was used. Significant batch-to-batch variations occur with natural products such as polysaccharides |
| Acetic acid - Unilab | Ajax Finechem | 2-2.5L GL | laboratory reagent |
| Dimethylsulfoxide | Sigma-Aldrich | D4540 | laboratory reagent, slightly hazardous to skin, hazardous if ingested |
| Sodium hydroxide | Sigma-Aldrich | 221465 | laboratory reagent, corrosive |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide | Sigma-Aldrich | D80002 | Irritant to skin |
| N-hydroxysuccinimide | Sigma-Aldrich | 130672 | Irritant to skin |
| Sodium chloride | Ajax Finechem | 466-500G | laboratory reagent |
| Potassium chloride - Univar | Ajax Finechem | 384-500G | analytical reagent, slight skin irritant |
| Disodium hydrogen phosphate - Unilab | Ajax Finechem | 1234-500G | laboratory reagent, slight skin irritant |
| Potassium dihydrogen phosphate - Univar | Ajax Finechem | 4745-500G | analytical reagent, slight skin irritant |
| Oligoacrylate standard | custom made | See reference for synthetic protocol: Castignolles, P.; Gaborieau, M.; Hilder, E. F.; Sprong, E.; Ferguson, C. J.; Gilbert, R. G. Macromol. Rapid Commun. 2006, 27, 42-46 | |
| Boric acid | BDH AnalR, Merck Pty Ltd | 10058 | Corrosive |
| Hydrochloric acid - Unilab | Ajax Finechem | A1367-2.5L | laboratory reagent, corrosivie |
| Fused silica tubing | Polymicro (Molex) | TSP050375 | Flexible fused silica capillary tubing with standard polyimide coating, 50 µm internal diameter, 363 µm outer diameter |
| Agilent 7100 CE | Agilent Technologies | G7100CE | Capillary electrophoresis instrument |
| Orbital shaker | IKA | KS260 | |
| Electronic balance | Mettler Toledo | MS204S | |
| Milli-Q Synthesis | Millipore | ZMQS5VF01 | Ultrapure water filtration system |
| Parafilm | Labtek | PM966 | Parrafin wax |
References
- Muthukumar, M. Theory of electrophoretic mobility of a polyelectrolyte in semidilute solutions of neutral polymers. Electrophoresis. 17, 1167-1172 (1996).
- Barrat, J. L., Joanny, J. F. . in Advances in Chemical Physics, Vol Xciv Vol. 94 Advances in Chemical Physics. , 1-66 (1996).
- Fu, S. L., Lucy, C. A. Prediction of electrophoretic mobilities. 1. Monoamines. Anal. Chem. 70, 173-181 (1998).
- Harvey, D. . Modern Analytical Chemistry. , (2000).
- Oliver, J. D., Gaborieau, M., Hilder, E. F., Castignolles, P. Simple and robust determination of monosaccharides in plant fibers in complex mixtures by capillary electrophoresis and high performance liquid chromatography. J. Chromatogr. A. 1291, 179-186 (2013).
- Oliver, J. D., Sutton, A. T., Karu, N., Phillips, M., Markham, J., Peiris, P., Hilder, E. F., Castignolles, P. Simple and robust monitoring of ethanol fermentations by capillary electrophoresis. Biotechnology and Applied Biochemistry. 62, 329-342 (2015).
- Thevarajah, J. J., Sutton, A. T., Maniego, A. R., Whitty, E. G., Harrisson, S., Cottet, H., Castignolles, P., Gaborieau, M. Quantifying the Heterogeneity of Chemical Structures in Complex Charged Polymers through the Dispersity of Their Distributions of Electrophoretic Mobilities or of Compositions. Anal. Chem. 88, 1674-1681 (2016).
- Toutounji, M. R., Van Leeuwen, M. P., Oliver, J. D., Shrestha, A. K., Castignolles, P., Gaborieau, M. Quantification of sugars in breakfast cereals using capillary electrophoresis. Carbohydr. Res. 408, 134-141 (2015).
- Miramon, H., Cavelier, F., Martinez, J., Cottet, H. Highly Resolutive Separations of Hardly Soluble Synthetic Polypeptides by Capillary Electrophoresis. Anal. Chem. 82, 394-399 (2010).
- Mnatsakanyan, M., Thevarajah, J. J., Roi, R. S., Lauto, A., Gaborieau, M., Castignolles, P. Separation of chitosan by degree of acetylation using simple free solution capillary electrophoresis. Anal. Bioanal. Chem. 405, 6873-6877 (2013).
- Taylor, D. L., Ferris, C. J., Maniego, A. R., Castignolles, P., in het Panhuis, M., Gaborieau, M. Characterization of Gellan Gum by Capillary Electrophoresis. Australian Journal of Chemistry. 65, 1156-1164 (2012).
- Thevarajah, J. J., Gaborieau, M., Castignolles, P. Separation and characterization of synthetic polyelectrolytes and polysaccharides with capillary electrophoresis. Adv. Chem. 2014, 798503 (2014).
- Sutton, A. T., Read, E., Maniego, A. R., Thevarajah, J., Marty, J. -. D., Destarac, M., Gaborieau, M., Castignolles, P. Purity of double hydrophilic block copolymers revealed by capillary electrophoresis in the critical conditions. J. Chromatogr. A. 1372, 187-195 (2014).
- Righetti, P. G., Sebastiano, R., Citterio, A. Capillary electrophoresis and isoelectric focusing in peptide and protein analysis. Proteomics. 13, 325-340 (2013).
- Ali, I., Al-Othman, Z. A., Al-Warthan, A., Asnin, L., Chudinov, A. Advances in chiral separations of small peptides by capillary electrophoresis and chromatography. J. Sep. Sci. 37, 2447-2466 (2014).
- Kasicka, V. Recent developments in capillary and microchip electroseparations of peptides (2011-2013). Electrophoresis. 35, 69-95 (2014).
- Taylor, D. L., Thevarajah, J. J., Narayan, D. K., Murphy, P., Mangala, M. M., Lim, S., Wuhrer, R., Lefay, C., O'Connor, M. D., Gaborieau, M., Castignolles, P. Real-time monitoring of peptide grafting onto chitosan films using capillary electrophoresis. Anal. Bioanal. Chem. 407, 2543-2555 (2015).
- Rinaudo, M. Chitin and chitosan: Properties and applications. Prog. Polym. Sci. 31, 603-632 (2006).
- Li, Z., Leung, M., Hopper, R., Ellenbogen, R., Zhang, M. Feeder-free self-renewal of human embryonic stem cells in 3D porous natural polymer scaffolds. Biomaterials. 31, 404-412 (2010).
- Domard, A. A perspective on 30 years research on chitin and chitosan. Carbohydr. Polym. 84, 696-703 (2011).
- Shekaran, A., Garcia, A. J. Nanoscale engineering of extracellular matrix-mimetic bioadhesive surfaces and implants for tissue engineering. Biochim. Biophys. Acta Gen. Subj. 1810, 350-360 (2011).
- Custodio, C. A., Alves, C. M., Reis, R. L., Mano, J. F. Immobilization of fibronectin in chitosan substrates improves cell adhesion and proliferation. J. Tissue Eng. Regen. Med. 4, 316-323 (2010).
- Boateng, S. Y., Lateef, S. S., Mosley, W., Hartman, T. J., Hanley, L., Russell, B. RGD and YIGSR synthetic peptides facilitate cellular adhesion identical to that of laminin and fibronectin but alter the physiology of neonatal cardiac myocytes. Am. J. Physiol. Cell Physiol. 288, C30-C38 (2005).
- Lefay, C., Guillaneuf, Y., Moreira, G., Thevarajah, J. J., Castignolles, P., Ziarelli, F., Bloch, E., Major, M., Charles, L., Gaborieau, M., Bertin, D., Gigmes, D. Heterogeneous modification of chitosan via nitroxide-mediated polymerization. Polym. Chem. 4, 322-328 (2013).
- Gartner, C., Lopez, B. L., Sierra, L., Graf, R., Spiess, H. W., Gaborieau, M. Interplay between Structure and Dynamics in Chitosan Films Investigated with Solid-State NMR, Dynamic Mechanical Analysis, and X-ray Diffraction. Biomacromolecules. 12, 1380-1386 (2011).
- Castignolles, P., Gaborieau, M., Hilder, E. F., Sprong, E., Ferguson, C. J., Gilbert, R. G. High resolution separation of oligo(acrylic acid) by capillary zone electrophoresis. Macromol. Rapid Commun. 27, 42-46 (2006).
- Chamieh, J., Martin, M., Cottet, H. Quantitative Analysis in Capillary Electrophoresis: Transformation of Raw Electropherograms into Continuous Distributions. Anal. Chem. 87, 1050-1057 (2015).
- Maniego, A. R., Ang, D., Guillaneuf, Y., Lefay, C., Gigmes, D., Aldrich-Wright, J. R., Gaborieau, M., Castignolles, P. Separation of poly(acrylic acid) salts according to topology using capillary electrophoresis in the critical conditions. Anal. Bioanal. Chem. 405, 9009-9020 (2013).
- Chung, T. W., Lu, Y. F., Wang, S. S., Lin, Y. S., Chu, S. H. Growth of human endothelial cells on photochemically grafted Gly-Arg-Gly-Asp (GRGD) chitosans. Biomaterials. 23, 4803-4809 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved