Method Article
تحريض تصلب الشرايين المتسارع في الفئران: نموذج "الأسلاك- إصابة"
In This Article
Summary
تصف هذه الدراسة إجراءً جراحيًا لتحريض تصلب الشرايين المتسارع في الفئران. بالمقارنة مع طرق أخرى باستخدام الإصابات الناجمة عن الكهرباء أو التبريد، والإصابات التي تسببها الميكانيكية يحاكي حالة الإنسان من إعادة الأوعية الدموية بعد العلاجات إعادة تنظيم الأوعية الدموية ومثالية لدراسة الآليات الجزيئية المعنية.
Abstract
تصلب الشرايين هو مرض الليفي الليفي التكاثري الذي يتطور في جدار الشرايين ، مما يؤدي إلى نقص في تدفق الدم أو نقص تدفق الدم. وعلاوة على ذلك ، عن طريق تمزق جدار الأوعية الدموية المعيبة ، يؤدي تصلب الشرايين إلى تكوين الخثارة الانسدادي ، والذي يمثل السبب الرئيسي في احتشاء عضلة القلب أو السكتة الدماغية والسبب الأكثر شيوعًا للوفاة. على الرغم من التقدم في مجال القلب والأوعية الدموية، لا تزال العديد من الأسئلة دون إجابة، والبحوث الأساسية الإضافية أمر ضروري لتحسين فهمنا للآليات الجزيئية أثناء تصلب الشرايين وآثاره. بسبب الدراسات السريرية المحدودة، هناك حاجة لنماذج حيوانية تمثيلية لإعادة خلق الظروف الارتدادية مثل تكوين neointima بعد زرع الدعامات، رأب الأوعية بالون، أو استئصال الرحم. منذ الماوس يقدم العديد من المزايا، وهو النموذج الأكثر استخداما لدراسة العمليات الجزيئية، وتقترح الدراسة الحالية إجراء الغازية من التجويف البطانية، والمعروف أيضا باسم نموذج الأسلاك إصابة، والذي يمثل حالة الإنسان من تكوين neointima في الشرايين بعد إجراءات إعادة الأوعية الدموية.
Introduction
تصلب الشرايين هو الأمراض الرئيسية الكامنة في أحداث القلب والأوعية الدموية مثل احتشاء عضلة القلب أو السكتة الدماغية. الآليات الرئيسية التي تؤدي إلى متلازمات القلب والأوعية الدموية الحادة هي تمزق البلاك ، والتآكل السطحي ، وتشكيل الخثرة. هناك حالات سريرية متعددة متصلة بتطوير البلاك: البلاك تصلب الشرايين الأصلي، إعادة الاستراحة بعد استئصال بطانة الرحم، و إعادة الاستراحة بعد رأب الأوعية بالون مع / بدون زرع الدعامات1. بعد الإصابة الشريانية, قمع العمليات الالتهابية2,3 و شفاء المقصورة البطانية ضرورية لمنع حدوث مضاعفات أخرى1. تقتصر البحوث السريرية على عينات الأنسجة والدم بسبب الاعتبارات الأخلاقية والتكاليف ونقص المعرفة في الآليات الأساسية. لهذه الأسباب، هناك حاجة لدراسة الآليات الجزيئية في النماذج الحيوانية4-6، والتي يمكن إعادة تهيئة الظروف السريرية. نموذجنا للتشكيل السريع في سياق تصلب الشرايين هو نتيجة لسنوات عديدة من الخبرة في تنفيذ هذه النماذج في الحيوانات الصغيرة7-11. نموذج الماوس هو النموذج الأكثر جاذبية للبحوث ، وذلك بسبب سهولة التعامل معها ، والقدرة على وجود مجموعات حيوانية كبيرة بسبب انخفاض التكاليف المتعلقة بشراء الحيوانات والعناية بها ، وتوافر مختلف سلالات المعدلة وراثيا و بالضربة القاضية.
العيب الرئيسي لنموذج الماوس هو صغر حجم الشرايين الرئيسية التي تتعرض لمرض تصلب الشرايين (الشريان السباتي ، الشريان الأورطي ، والشريان الفخذي) ، والذي يتطلب خبرة ومهارات جراحية مؤهلة للتلاعب بالأوعية والحث على البلاك تصلب الشرايين. لذلك ، يتم تقديم نموذج تشكيل neointima المتسارع ، في سياق إعادة الاستراحة بعد استئصال الرحم أو زرع الدعامات ، المقترح في هذه الورقة مع دليل إرشادي خطوة بخطوة واقتراحات لتسهيل مقدمة للموظفين المهتمين. عيب آخر هو أن يتم الحرمان على جدار الشريان الطبيعي ، وبالتالي ، فإن تكوين الإلتمة الجديدة سيكون معتدلًا مقارنة بالحالة السريرية. ارتفاع مستوى الكولسترول البلازما وصلت في apolipoprotein E خروج المغلوب (Apoe-/-) الفئران تغذيها حمية عالية الدهون يخلق بيئة مناسبة الموالية للالتهابات اللازمة لتشكيل اللايمة الجدد.
يتم إجراء الجراحة تحت منظار مجسم. يتعرض الشريان السباتي عن طريق شق متوسط في منطقة عنق الرحم البطنية. يتم التلاعب بالهياكل التشريحية فوق الشريان السباتي المحيط به والحد الأدنى من التلاعب به لتقليل الالتهاب بعد الجراحة. يتم كشف تشعب الشريان السباتي. للحث على تشكيل نيوينزيما المتسارعة، يتم إعداد الشرايين السباتية الداخلية والخارجية لوقف تدفق الدم وتهتك الشريان السباتي المشترك اللاحقة. في الختام، يمكن تعلم هذه الطريقة من قبل الموظفين ذوي الخبرة الدنيا في العمليات الجراحية الحيوانية.
Protocol
وتُجرى التجارب الواردة في هذه الورقة وفقا للقانون الألماني وللمبادئ التوجيهية الأوروبية لرعاية الحيوانات. يتم تربيت الحيوانات في منشأة الحيوانات التابعة لمعهد علوم الحيوان المختبرية، مستشفى آخن الجامعي، ألمانيا، تحت إشراف البروفيسور د. ر. تولبا والدكتور أ. تيوبنر (مسؤول رعاية الحيوان).
1. العناية بالحيوان
- إبقاء الفئران في وحدة الرعاية المتخصصة، وضمان الحصول على الغذاء السليم والسيطرة البيطرية المتخصصة والعلاج. إذا تم نقل الحيوانات أو شراؤها من أطراف ثالثة، يرجى التأكد من فترة إقامة لمدة أسبوع واحد قبل الخضوع للعملية.
2. إغراء فرط ااءض الدم
- تغذية 6 - 8 أسابيع من العمر, 18 - 20 ز, أنثى (اختياريا) ApoE-/- الفئران مع اتباع نظام غذائي atherogenic (21% الدهون, 0.15% الكوليسترول, 19.5% الكاندين, wt/wt) أسبوع واحد قبل العملية الجراحية ومواصلة النظام الغذائي حتى يتم إجراء تحليل البلاك الإثيرات.
3. الإعداد الجراحي
- تخدير الفئران باستخدام حقنة داخل الصفاق من 100 ملغم / كغ الكيتامين عن طريق وزن الجسم و 10 ملغ / كغ xylazine بواسطة وزن الجسم. تأكيد التخدير السليم قبل الجراحة عن طريق عدم وجود ردود الفعل وحركة شعيرات. ضع كمية صغيرة من مرهم العين العقيم في العين لتقليل التجفيف.
- ضمان الحفاظ على الظروف المعقمة لتجنب العدوى أثناء الجراحة باستخدام مواد وأدوات معقمة.
- حلق الفئران في منطقة الرقبة البطنية. تطهير الجلد مع البيتادين قبل شق. إجراء شق جلدي 1 سم في المنطقة الوسطى من منطقة الرقبة، على رأس القصبة الهوائية.
- فصل الجسمين الدهون لضمان رؤية مناسبة على منطقة القصبة الهوائية. استخدام الداود لعقد طبقة العضلات وفضح الشريان السباتي. إذا كان موجودا، قم بإجراء تشريح حاد للطبقة العضلية الرقيقة التي تغطي الشريان السباتي.
- استخدم ملقطًا منحنية حادة لفصل الشريان السباتي عن العصب المبهم والوريد الوداجي. وهكذا، ينبغي أن تكون منطقة التشعب مع الشريان السباتي الداخلية والخارجية مرئية. استخدام 0.9٪ من كلوريد الزلال من أجل تجنب جفاف الأنسجة أثناء العملية الجراحية.
4. الأسلاك - إصابة
- ضع خياطة حريرية طولها 7 سم 0/5 تحت الشريان السباتي، قريبًا من القوس الأبهري. جعل حلقة مفتوحة، وعلى استعداد لتكون مغلقة في أي وقت.
- ضع خيطين حريريين 0/7 (كل منهما بطول 1.5 سم) حول الشريان السباتي الخارجي: حلقة واحدة قريبة من نقطة التشعب، وحلقة واحدة كقطة قدر الإمكان. إعدادها كـ حلقة مفتوحة، جاهزة للإغلاق في أي وقت.
- ضع خياطة حريرية واحدة 0/7 (طولها 1.5 سم) تحت الشريان السباتي الداخلي. تحضيره كـ حلقة مفتوحة، جاهزة للإغلاق في أي وقت.
- ضع طاولة الماوس برأس الماوس نحو المشغل لضمان تحديد الموضع المناسب لإدراج سلك الإرشاد أثناء التجويف (الشكل 1A).
- تحت وجهة نظر مجهرية، ووقف تدفق الدم من خلال الشريان السباتي المشترك عن طريق عقد وسحب نهايات خياطة الحرير 0/5 مع ملقط الهيموستات.
- مباشرة بعد رباط الشريان السباتي المشترك، أغلق حلقات الغرز الموضوعة على الشريان السباتي الداخلي والخياطة على الشريان السباتي الخارجي بإحكام (الشكل 1B).
- إجراء شق صغير (استئصال الشرايين، نصف قطر السفينة) قذر إلى الشريان السباتي الخارجي، بين الحلقتين، وذلك باستخدام مقص صغير (الشكل 1C). إذا كان الشق كبيرًا جدًا، يرجى اتباع تعليمات استكشاف الأخطاء وإصلاحها (راجع المناقشة).
- استخدام أسلاك دليل مصقول تجاريا أو استخدام الموظفين المتخصصين في المنزل لتلميع الأسلاك دليل. تطهير 14 بوصة مصقول الأسلاك دليل مرنة مع الكحول وترطيبه في قطرة من 0.9٪ كلوريد الزخرق لضمان الانزلاق السليم في السفينة.
- أدخل سلك الدليل في الشريان السباتي المشترك عن طريق استئصال الشرايين العرضية للشريان السباتي الخارجي (الشكل 1D). الحصول على التجويف endothelial عن طريق تمرير سلك دليل على طول السفينة أثناء الدورية. كرر هذا الإجراء ثلاث مرات. الحفاظ على نفس السعة من حركة التناوب في كل الماوس لزيادة استنساخ.
- أغلق الحلقة القريبة على الشريان السباتي الخارجي بإحكام. استعادة تدفق الدم في الشريان السباتي عن طريق قطع خياطة حول الشريان المشترك والخياطة حول الشريان السباتي الداخلي.
5. خياطة والانتعاش
- إزالة الداورس والعودة طبقة العضلات واثنين من الهيئات الدهون إلى الوضع الفسيولوجي.
- أغلق الجلد بثلاث خياطة منفصلة 0/6، إذا كانت هناك حاجة إلى قياسات صدى القلب. إذا لم تكن هناك حاجة إلى التصوير، استخدم مقاطع معدنية لإغلاق الجلد.
- وضع الماوس إلى أسفل على جانبها الأيسر تحت ضوء الأشعة تحت الحمراء حتى يستيقظ. لا تترك حيواناً غير مراقب ولا في صحبة أخرى حتى يتم استردادها بالكامل.
- لتحديد المستقبل، وضع علامة على الماوس باستخدام النظام المحلي. اسأل مسؤول رعاية الحيوان من المؤسسة المحلية.
6- تحليل البلاك الثيرمي
- تخدير الفئران عند نقطة نهاية الوقت باستخدام حقن داخل الصفاق من 100 ملغم / كغ الكيتامين عن طريق وزن الجسم و 10 ملغ / كغ xylazine بواسطة وزن الجسم. تأكيد التخدير السليم من عدم وجود ردود الفعل وحركة شعيرات.
- تنفيذ exsanguination بواسطة الرجعية المدارية أو ثقب القلب وجمع الدم لمزيد من التحليل2.
- تطهير الجلد مع البيتادين. افتح تجويف الصدر وأزل الوريكلوم الأيمن من القلب. Perfuse الفوسفات المخزنة عن طريق محلول البطين الأيسر لإزالة الدم المتبقي من الوعاء ومن ثم 4% PFA لإصلاح الأنسجة.
- إذا لم يكن هناك حاجة إلى تثبيت، explant الشريان السباتي مباشرة بعد غسل2،4،11. تنفيذ بروتوكولات قياسية مع تحليلات الاهتمام: التضمين البارافين، الخ، الـ(مرنا) أو تحليل البروتين، إلخ.
- للقياسات morphometrical، بعناية explant الشريان السباتي بما في ذلك التشعب، مع الحد الأدنى من التلاعب، كما هو أقرب إلى القوس الأبهري باستخدام ملقط منحني ومقص صغير.
- قم بتضمين الشريان السباتي في كتلة البارافين باستخدام بروتوكولات التضمين القياسية. لإجراء المقطع مستعرض، ضع الشريان السباتي تستقيم على تشعب. قطع 5 ميكرومتر المقاطع التسلسلية سميكة بدءا من التشعب وجمعها جميعا على الشرائح النسيجية المغلفة (الشكل 2A).
- وصمة عار كل 10th المقطع باستخدام ميثات تلطيخ لتسليط الضوء على2،4،11اللاتف. بعد جمع الصور المجهرية لجميع السفن (باستخدام هدف 10X) ، وقياس التجويف ، وكذلك الصفيحة الداخلية والخارجية لكل قسم ، وذلك باستخدام برامج خاصة مصممة2،4،11، كما هو مبين في الشكل 2B. حساب النمو الايحاء والوسائط من السفن.
- تحليل خلايا العضلات الملساء ومحتوى الضامة، أو الانتعاش البطانية في المقاطع التسلسلية، وذلك باستخدام الملطخات المناعيةالمعتادة 2 (الشكل 2C).
النتائج
يستغرق إجراء الحث اللويحات التهيّد 15 -20 دقيقة ويظهر معدل وفيات أدنى ، ويرجع ذلك في الغالب إلى النزيف الذي يحدث أثناء الإجراء. بعد الجراحة ، تتعافى الفئران من التخدير في غضون 20 - 25 دقيقة. لم يلاحظ أي إعاقة جسدية، مثل الشلل، أو اضطراب التغذية بعد الجراحة.
تؤدي إصابة الأسلاك إلى إزالة البطانية ، وتحاكي الآفات الوعائية بعد إزالة البالون أو زرع الدعامات. مباشرة بعد الإصابة، سيتم تغطية جدار الأوعية الدموية المجردة مع طبقة من الجلطات، والتي تتوسط وتفضل التصاق من monocytes12. تنشيط خلايا العضلات الملساء من وسائل الإعلام سوف تتكاثر والهجرة إلى المساحات إينتينتال, تشكيل neointima. سوف السلف الأخرى لخلايا العضلات الملساء هجرة من الدم (يقدر أن يكون 40٪) والمساهمة في نمو neointima. سوف ينتهي تشكيل البلاك بعد إعادة endothelialization كاملة، وعادة بعد 4 أسابيع من الأسلاك إصابة.
يمكن تقييم تكوين neointima باستخدام تلطيخ ال Movat. يتم حساب حجم اللوحة لكل شريحة باستخدام البرنامج كما هو مبين في الشكل 2B. يمكن أن يتراوح الحجم الكلي للبلاك (الشريان السباتي الأيسر) بين 70,000 - 100,000 ميكرومتر مربع، في حين أن حجم وعاء التحكم (الشريان السباتي الأيمن) يمكن أن يتراوح بين 7,000 - 8,000 ميكرومتر مربع. هذه القيم تعتمد إلى حد كبير على الجراح. لذلك، نوصي بشدة باستخدام نفس الجراح أثناء التجارب لنفس الدراسة.
تشبه البلاك المتقدمة في استنساب الدعامات ، والتي تتكون في الغالب من خلايا العضلات الملساء المتكاثرة والمهاجرة من وسائل الإعلام. التكوين الخلوي الذي تحدده إجراءات التلطيخ المناعية يبين أن محتوى الخلية العضلية الملساء هو ما يقرب من 30-40٪، في حين تم العثور على الضامة في 15-25٪ من neointima من السفينة المصابة. ويمكن قياس إعادة endothelialization بعد تلطيخ لعلامة البطانية، وتحسب كنسبة مئوية من محيط ملطخة على محيط كامل من تجويف. عادة ما يصل إعادة endothelialization 80 - 90 ٪ بعد 3 أسابيع ، وينبغي أن تكون كاملة تقريبا بعد 4 أسابيع (الشكل 2C). لتتبع نمو البلاك أثناء تطوره، يمكن تكرار نفس التحليل لكل نقطة زمنية بعد إصابة السلك، اعتماداً على الفائدة والموضوع المدروس (انظر الجدول 1).
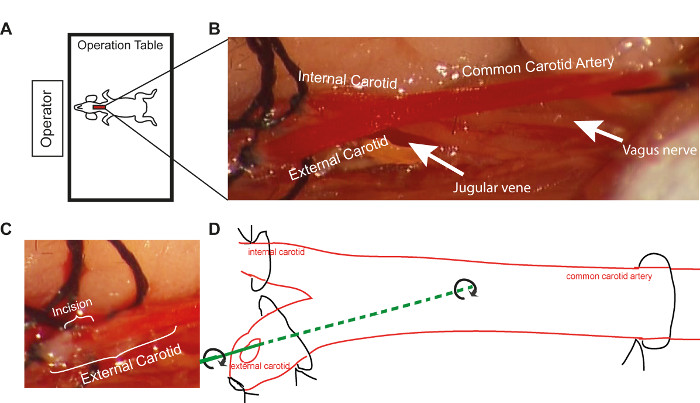
الشكل 1- الـ 1 التمثيل التخطيطي للإجراءات المنطوقة. (أ) وضع طاولة العملية باتجاه المشغل أثناء إجراء الأسلاك - الضرر (ب) الرؤية الموسعة للشريان السباتي المشترك وفروعه، كما يظهر تحت المجهر عند التكبير 10X (C) حجم الشق في الشريان السباتي الخارجي تحت المجهر عند تكبير 10X (D) التمثيل التخطيطي لإجراء إصابة السلك باستخدام سلك دليل 14 بوصة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
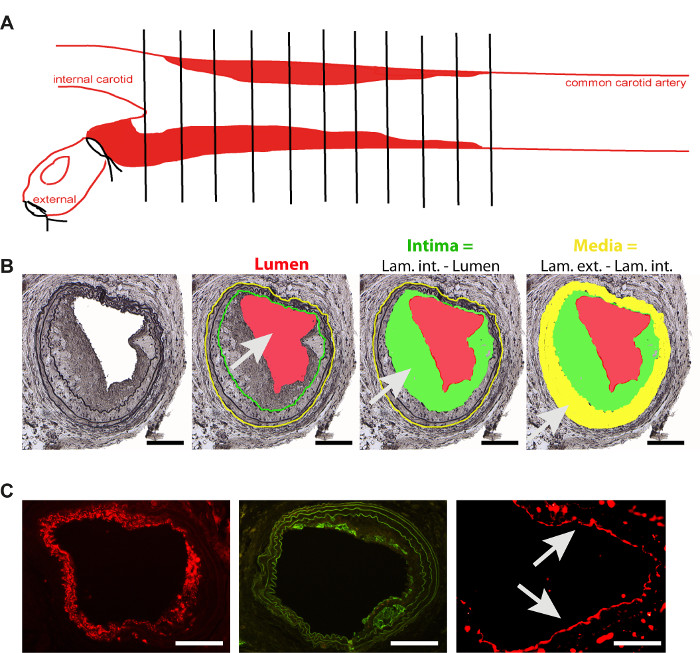
الشكل 2- الانبعاثات 2 من 100 تحليل لوحة ريسينسيس. (أ) التمثيل التخطيطي لتحليل البلاك في الشريان السباتي المشترك، بعد أربعة أسابيع من تحريض الأسلاك والإصابة (B) تكوين Neointima بعد 4 أسابيع من الأسلاك - إصابة والتمثيل التخطيطي للبارامترات الرئيسية المستخدمة للتحليل. إنتيما (المنطقة الخضراء) هو الفرق بين التجويف (الأحمر) وlamina interna (الخط الأخضر). وسائل الإعلام (المنطقة الصفراء) هو الفرق بين اللامينا externa (الخط الأصفر) وinterna (الخط الأخضر). شريط مقياس 100 μm(C) صور تمثيلية من تلطيخ أنواع الخلايا الرئيسية المشاركة في تكوين neointima. خلايا العضلات الملساء (العضلات الملساء actin -أحمر، شريط مقياس 100 ميكرومتر)، الضامة (ماك 2- الأخضر، شريط مقياس 100 ميكرومتر) وخلايا البطانية (CD31- أحمر، والسهام، شريط مقياس 50 ميكرومتر). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الوقت | ترومبوس | لوحة (μm²) |
الضامه (% من البلاك) |
خلايا العضلات الملساء (% من البلاك) |
إعادة التسهيلية (% محيط تجويف) |
| يوم واحد | هذا | 0 | 0 | 0 | 0 |
| أسبوع | - | < 30 000 | > 10 | < 50 | < 50 |
| أسبوعان | - | < 000 50 | > 10 | < 50 | > 50 |
| 3 أسابيع | - | < 70 000 | 15-25 | 30-40 | 80-90 |
| 4 أسابيع | - | 70 000 – 100 000 | 15-25 | 30-40 | كامله |
الجدول 1- الانبعاثات 1000 تطوير البلاك المعتمد على الوقت.
| نموذج | الحيوانات | مزايا | Disanvantages |
| تصلب الشرايين الأصلي الناجم عن النظام الغذائي | الصغيره |
|
|
| كبيره |
|
| |
| توسيع بالون | الصغيره |
|
|
| كبيره |
|
| |
| إصابة سلكية | الصغيره |
|
|
| زرع الدعامات | الصغيره |
|
|
| كبيره |
|
|
الجدول 2- مزايا وعيوب النماذج الموجودة من إصابة الشرايين.
Discussion
في هذه الورقة، نقدم نصائح مفيدة لإجراء إجراء الأسلاك الضرر حتى من قبل الموظفين مع الحد الأدنى من الخبرة في العمليات الجراحية الحيوانية. هناك خطوتان حاسمتان في تنفيذ هذا الإجراء: شق الشريان السباتي الخارجي وإدخال السلك. يجب إجراء شق في الشريان السباتي الخارجي إلى أقصى حد ممكن من التشعب ، من أجل ضمان ما يكفي من المواد المتبقية (الشكل 1C). يجب أن لا يكون الشق كبيرًا جدًا ، نظرًا لخطر قطع الوعاء بأكمله. الخطوة الحاسمة الثانية هي ارتفاع خطر النزيف أثناء استئصال الشرايين وإدخال السلك الإرشادي إذا لم يتم إيقاف تدفق الدم بكفاءة. وعلاوة على ذلك، قد لا يحدث الهجر البطانية أو تمزق الشرايين ممكن إذا لم يتم إدخال سلك دليل بشكل صحيح في وعاء التجويف. لتجنب هذا، يجب أن يكون سطح السلك الدليل مصقول بعناية قبل العملية.
لتحسين البروتوكول ، فإن موقف جدول التشغيل مع رأس الماوس نحو الجراح يضمن رؤية أفضل ، وإمكانية الوصول والتحكم في التلاعب سلك دليل السليم. وعلاوة على ذلك، لزيادة استنساخ، واستخدام نفس السلك دليل في جميع الدراسات. بما أن حجم السلك لا يتغير ، فمن المهم النظر في جميع الاختلافات المحتملة بين الفئران والقضاء عليها باستخدام نفس الجنس والعمر والوزن لجميع الفئران المدرجة في الدراسة. بعد ذلك ، سوف ايفانز الأزرق تلطيخ مساعدة الجراح تحديد كفاءة التخدم. إن وجود المعدات المناسبة شرط أساسي لنجاح الإجراء. 10X stereomicroscope ضروري لتنفيذ هذا الإجراء. الإعداد السليم للسلك الدليل (على سبيل المثال تلميع ذلك) أمر بالغ الأهمية. لذلك، نوصي بشدة أن يتم إعداد سلك دليل من قبل الموظفين التقنيين المتخصصين حيثما كان ذلك متاحا.
هناك العديد من خطوات استكشاف الأخطاء وإصلاحها في هذا البروتوكول. إذا كان القذف الشريان السباتي الخارجي بالقرب من التشعب، ربط بعناية externa، بالقرب من التشعب، لذلك لا يحدث أي نزيف. أثناء القطع، لا يمكن رؤية الشريان السباتي الخارجي. لذلك ، ضع في اعتبار التشعب على مستوى خياطة الحرير. جمع المقاطع عندما يختفي خياطة الحرير. إذا كان شق في الشريان السباتي الخارجي كبيرًا جدًا وتمزق الوعاء ، فتأكد من انقطاع تدفق الدم إلى المفصل السباتي والشريان السباتي الداخلي بشكل فعال ومحاولة العثور على فتح الوعاء باستخدام ملقط. بعد إدخال سلك دليل وأداء التجويف، ربط السفينة بالقرب من التشعب. أثناء القطع، تبدأ في جمع عندما يبدأ الحرير من الغرزة في الاختفاء. إذا حدث تمزق الشرياني أثناء التمزق مع سلك الدليل، تحقق تحت المجهر إذا كان السلك الإرشادي مصقول بشكل صحيح.
على الرغم من تشابه نموذج إصابة السلك مع الحالات السريرية ، تركز العديد من المجموعات على تصلب الشرايين الأصلي في الفئران ، أو يختارون تحريضات تصلب الشرايين الغازية ، مثل رأب الأوعية بالون في الفئران أو الأرانب ، بسبب نقص الموظفين المدربين الذين يمكنهم إجراء عمليات جراحية حيوانية صغيرة. على الرغم من فوائد استخدام الأرانب / الفئران، على سبيل المثال لا حاجة للمعدات المصغرة، لا نماذج الفئران ولا نماذج الأرانب تقدم مجموعة متنوعة من سلالات مختلفة بالضرب التدريجي، من حيث دراسة الآليات الجزيئية المشاركة في نمو النيوستريما والتجلط في الدعامات.
النماذج الحالية لدراسة التهاب بقية الدعامات في الفئران صعبة، وتتطلب مهارات جراحية عالية، ولها مخاطر عالية من مضاعفات مثل النزيف أو الشلل. على سبيل المثال، فإن الإصابة الميكانيكية أو زرع الدعامات في الشريان الأورطي الصدري عن طريق الشريان الفخذي مصحوبة بمعدل وفيات مرتفع (35%) بسبب الشلل الساقي أو نزيف13-15. كما أننا نصف زرع الدعامات في الشريان السباتي للماوس16. الإجراء مشابه; ومع ذلك، فإن معالجة الأنسجة لتحليلها معقدة وغير متاحة لجميع المختبرات16. يمكن الوصول إلى الشريان السباتي مباشرة، ليس فقط لإجراءات التشغيل، ولكن أيضًا لطرق التصوير الموجودة مثل التصوير بالموجات فوق الصوتية. يمكن أن يتم الحث إصابات أخرى في الشرايين السباتية في الفئران باستخدام الأجهزة الكهربائية17. هذا الأسلوب سهل الأداء ويضمن قابلية التكاثر العالية. ومع ذلك ، فإنه يسبب الإصابة في جميع طبقات السفينة ، والتي ليست متطابقة مع الإصابة الميكانيكية. تطبيقات البالون لها فوائد، مثل التكيف مع قطر السفينة بما يتماشى مع الممارسة السريرية ولها تأثير قوي على النتيجة المرضية. على الرغم من بالونات الماوس متوفرة، فهي مكلفة للغاية، وبالتالي، لا تستخدم على نطاق واسع. بدلا من ذلك، والأسلاك الضرر هو الأسلوب المنشأ، تقليد تضيق في الدعامات.
يتم إجراء التجويف على جدار الشريان الطبيعي ، على الرغم من وجود خلفية تصلب الشرايين. لذلك، فإن تشكيل neointima تكون معتدلة بالمقارنة مع الوضع السريري. يوضح العدد الكبير من النماذج قبل الكلينيكية أن أياً من النماذج لا يفي بجميع المعايير اللازمة للكشف عن الآليات الخلوية والجزيئية التي تؤدي إلى الفيزيولوجيا المرضية لدى البشر (انظر الجدول 2).
بعد إجراء إجراء الأسلاك، يمكن إجراء التحليل البيولوجي والجزيئي لتحديد الخلايا والبروتينات والكائنات الـ mRNAs و microRNAs والجينات أو المؤشرات الحيوية الأخرى، والتي يمكن استخدامها كأهداف علاجية لتطوير استراتيجيات علاج جديدة لتصلب الشرايين، ولا سيما لتشكيل نيوستريما بعد إصابة الأوعية الدموية. إذا كان متوفرا، يمكن رصد نمو البلاك باستخدام الموجات فوق الصوتية عالية التردد أو غيرها من تقنيات التصوير عالية الدقة. وعلاوة على ذلك، فإن إتقان هذه التقنية من شأنه أن يعطي المشغل الفرصة لتكييف البروتوكول مع نماذج تحفيز تصلب الشرايين الغازية الأخرى، مثل وضع طوق، الربط الجزئي أو حتى زرع الدعامات.
Disclosures
ولا توجد أي إفصاحات من جانب أصحاب البلاغ.
Acknowledgements
وقد تم دعم هذا العمل من قبل مركز متعدد التخصصات للبحوث السريرية IZKF آخن (مجموعة البحوث المبتدئة إلى E.A.L.) داخل كلية الطب في جامعة RWTH Aachen. كما نشكر السيدة رويا سلطان على مساعدتها في تلطيخ الكيمياء المناعية.
Materials
| Name | Company | Catalog Number | Comments |
| Stereomicroscope | Olympus | SZ/X9 | - |
| Forceps | FST, Germany | 91197-00 | standard tip curved 0,17 mm |
| Hemostat forceps | FST, Germany | 13007-12 | curved |
| Scissors | FST, Germany | 91460-11 | Straight |
| Vannas scissor | Aesculap, Germany | OC 498 R | - |
| Retractors | FST, Germany | 18200-10 | 2.5 mm wide |
| Retractors | FST, Germany | 18200-11 | 5 mm wide |
| Ketamine 10% | CEVA, Germany | - | - |
| Xylazine 2% | Medistar, Germany | - | - |
| Bepanthene eye and nose cream | Bayer, Germany | - | - |
| Silicon tube | IFK Isofluor, Germany | custom-made product | diameter 500 µm, |
| section thickness 100 µm, | |||
| polytetrafluorethylene catheter | |||
| PROLENE Suture 6/0 | ETHICON | 8707H | polypropylene monofilament suture, unresorbable, needle CC-1, 13 mm, 3/8 Circle |
| 7/0 Silk | Seraflex | IC 1005171Z | - |
| Michel Suture Clips | FST, Germany | 12040-01 | - |
| Clip Applying Forcep | FST, Germany | 12018-12 | - |
| 14”Wire for Catheter | Abbot | 1000462H | Use 10 cm from stiff part and equalize the ends |
| Mice | Charles River | Apolipoprotein E -/- mice with C57/Bl6 background | - |
References
- Simsekyilmaz, S., Liehn, E. A., Militaru, C., Vogt, F. Progress in interventional cardiology: challenges for the future. Thromb Haemost. 113 (3), 464-472 (2015).
- Kubo, N., McCurdy, S., Boisvert, W. A. Defective Fas Expression on Bone Marrow Derived Cells Alters Atherosclerotic Plaque Morphology in Hyperlipidemic Mice. Discoveries. 3 (1), e37 (2015).
- Saffarzadeh, M., et al. Characterization of rapid neutrophil extracellular trap formation and its cooperation with phagocytosis in human neutrophils. Discoveries. 2 (2), e19 (2014).
- Lindner, V., Fingerle, J., Reidy, M. A. Mouse model of arterial injury. Circ Res. 73 (5), 792-796 (1993).
- Schwartz, R. S., et al. Preclinical evaluation of drug-eluting stents for peripheral applications: recommendations from an expert consensus group. Circulation. 110 (16), 2498-2505 (2004).
- Schwartz, R. S., et al. Restenosis and the proportional neointimal response to coronary artery injury: results in a porcine model. J Am Coll Cardiol. 19 (2), 267-274 (1992).
- Curaj, A., et al. Noninvasive molecular ultrasound monitoring of vessel healing after intravascular surgical procedures in a preclinical setup. Arterioscler Thromb Vasc Biol. 35 (6), 1366-1373 (2015).
- Liehn, E. A., Schober, A., Weber, C. Blockade of keratinocyte-derived chemokine inhibits endothelial recovery and enhances plaque formation after arterial injury in ApoE-deficient mice. Arterioscler Thromb Vasc Biol. 24 (10), 1891-1896 (2004).
- Liehn, E. A., Zernecke, A., Postea, O., Weber, C. Chemokines: inflammatory mediators of atherosclerosis. Arch Physiol Biochem. 112 (4-5), 229-238 (2006).
- Simsekyilmaz, S., et al. Role of extracellular RNA in atherosclerotic plaque formation in mice. Circulation. 129 (5), 598-606 (2014).
- Wu, Z., et al. Rhodamine-loaded intercellular adhesion molecule-1-targeted microbubbles for dual-modality imaging under controlled shear stresses. Circ Cardiovasc Imaging. 6 (6), 974-981 (2013).
- Schober, A., et al. Crucial role of the CCL2/CCR2 axis in neointimal hyperplasia after arterial injury in hyperlipidemic mice involves early monocyte recruitment and CCL2 presentation on platelets. Circ Res. 95 (11), 1125-1133 (2004).
- Ali, Z. A., et al. Increased in-stent stenosis in ApoE knockout mice: insights from a novel mouse model of balloon angioplasty and stenting. Arterioscler Thromb Vasc Biol. 27 (4), 833-840 (2007).
- Chamberlain, J., et al. A novel mouse model of in situ stenting. Cardiovasc Res. 85, 38-44 (2010).
- Rodriguez-Menocal, L., et al. A novel mouse model of in-stent restenosis. Atherosclerosis. 209 (2), 359-366 (2010).
- Simsekyilmaz, S., et al. A murine model of stent implantation in the carotid artery for the study of restenosis. J Vis Exp. , e50233 (2013).
- Schroder, K., et al. NADPH oxidase Nox2 is required for hypoxia-induced mobilization of endothelial progenitor cells. Circ Res. 105 (6), 537-544 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved