A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحديد الركيزة الخصوصيات لالليباز وفسفوليباز المرشحين
In This Article
Summary
Many predicted (phospho)lipases are poorly characterized with regard to their substrate specificities and physiological functions. Here we provide a protocol to optimize enzyme activities, search for natural substrates, and propose physiological functions for these enzymes.
Abstract
الكائنات الحية الدقيقة وتنتج مجموعة واسعة من (الفوسفات) الليباز التي تفرز من أجل جعل ركائز الخارجية المتاحة للكائن الحي. بدلا من ذلك، وغيرها (الفوسفات) يباسيس قد تترافق مع جسديا الكائن إنتاج يسبب دوران من الدهون الذاتية وأفسحت المجال لإعادة تشكيل الأغشية الخلوية في كثير من الأحيان. على الرغم من أن المحتملة (الفوسفات) يباسيس يمكن التنبؤ بها مع عدد من الخوارزميات عندما تسلسل الجين / بروتين متاح، وكثيرا ما لم يتم الحصول على دليل تجريبي من الأنشطة الإنزيمية والخصوصيات الركيزة، والوظائف الفسيولوجية المحتملة. توضح هذه المخطوطة وتعظيم الاستفادة من الظروف فحص لالمحتملين (الفوسفات) يباسيس مع خصوصيات الركيزة غير معروفة وكيفية توظيف هذه الظروف الأمثل في البحث عن الركيزة الطبيعية من (الفوسفات) الليباز منها. استخدام ركائز اللونية الاصطناعية، مثل المشتقات ص -nitrophenyl، قد تساعد على كشف قاصرالنشاط الأنزيمي لتوقع (الفوسفات) الليباز في ظل ظروف قياسية. وبعد أن واجه مثل هذه النشاط الأنزيمي البسيط و المعلمات متميزة لفحص انزيم يمكن أن تختلف من أجل الحصول على التحلل أكثر كفاءة من الركيزة الاصطناعية. بعد أن تحدد الظروف التي انزيم يعمل بشكل جيد، يجب أن يعاير مجموعة متنوعة من ركائز الطبيعية المحتملة لتدهورها، وهي العملية التي يمكن اتباعها توظيف أساليب الكروماتوغرافي متميزة. تعريف خصوصيات الركيزة للإنزيمات جديدة، غالبا ما يقدم فرضيات لدور الفسيولوجية المحتمل لهذه الإنزيمات، التي ثم يمكن اختبارها تجريبيا. وعقب هذه المبادئ التوجيهية، كنا قادرين على تحديد فسفوليباز C (SMc00171) التي تحط فسفاتيديل إلى phosphocholine ومادة ال diacylglycerol، في خطوة حاسمة لإعادة تشكيل الأغشية الموجودة في بكتيريا Sinorhizobium meliloti على شروط تحد من الفوسفور للنمو. لمدة توقع patatin-مثل فوسفوليباز (SMc00930 وSMc01003) من نفس الحي، ونحن يمكن إعادة تعريف خصوصيات الركيزة وتوضيح أن SMc01003 هو الليباز مادة ال diacylglycerol.
Introduction
الدهون القائم على الجلسرين مثل triacylglycerols و(glycero) الفوسفورية تشكل مهمة وربما الطبقات الشحمية الأكثر شهرة 1. Triacylglycerols (العلامات) هي الدهون أو الزيوت، والتي تعمل عادة على نسبة الدهون في التخزين، وبالتالي كمصادر الطاقة والكربون المحتملة. الكلمات يمكن أن يتحلل من الليباز، والتي كثيرا ما يفرز من قبل الكائن الحي إنتاج الهضم الكلمات الخارجية وجعلها متاحة كمصدر للكربون. أيضا، يباسيس وقد درس على نطاق واسع خلال السنوات نظرا لتطبيقات التكنولوجيا الحيوية الهامة. 2.
نظرا لطبيعة محبة للجهتين وشكلها شبه اسطواني، (glycero) الفوسفورية خواص تشكيل غشاء وتشكل عادة مكونات شحمي الرئيسية للغشاء bilayered 3. في الكائنات الحية الدقيقة بسيطة، مثل البكتيريا القولونية، فقط ثلاثة متغيرات رئيس مجموعة كبيرة، phosphatidylglycerol (PG)، كارديوليين (CL)، وphosphatidواجهت ylethanolamine (PE)، على الرغم من واحد يجب أن يكون على علم بأن كل واحد منهم يمكن أن تكون بديلا مع عدد كبير من مختلف سلاسل أسيل الدهنية في التعطيل -1 أو -2 موقف SN مما أدى إلى عدد كبير من مختلف الأنواع الجزيئية 4 . قد يكون بكتيريا أخرى الفوسفورية أخرى بالإضافة أو بدلا من ذلك. على سبيل المثال، Sinorhizobium meliloti، بكتيريا التربة، والتي هي قادرة على تشكيل جذور العقيدات التعايش المثبتة للنيتروجين مع البرسيم البقوليات (الحجازي)، ويتضمن بالإضافة إلى المؤسسة العامة ثان فوسفورية zwitterionic، فسفاتيديل (PC) 5. أيضا، والدهون لا تحتوي على الفوسفور أو الجلسرين قد تكون محبة للجهتين وتشكل جزءا من الغشاء الخلوي. على سبيل المثال، على ظروف النمو، يحد من الفوسفور، في س. meliloti، يتم استبدال (glycero) الفوسفاتية إلى حد كبير من نسبة الدهون في غشاء التي لا تحتوي على الفوسفور، أي sulfolipids، والدهون الأورنيثين، وdiacylglyceryl trimethylhomoserine (DGTS) 6. في البكتيريا، ويتم تشكيل DGTS من مادة ال diacylglycerol (داج) في مسار من خطوتين 7 ولكن كان مصدر لتوليد داج غير واضح. وتشير التجارب نبض مطاردة الكمبيوتر قد تكون مقدمة لDGTS 8 و باستخدام المنهجية الموصوفة في هذه المخطوطة استطعنا تحديد فسفوليباز C (PlcP، SMc00171) التي يتم تشكيلها بموجب شروط تحد من الفوسفور والتي يمكن تحويل الكمبيوتر إلى داج وphosphocholine 8.
وفي دراسة منفصلة، اكتشفنا أن مخلقة أسيل، لجنة الزراعة (FadD) متحولة -deficient س meliloti أو من الإشريكية القولونية تراكم الأحماض الدهنية الحرة عند دخول مرحلة ثابتة من 9 النمو. على الرغم من أن هذه الأحماض الدهنية يبدو أن تستمد من الدهون غشاء، المصدر الدقيق للأحماض الدهنية الحرة أو الانزيم (ق) تحريرهم لم تكن معروفة. مرة أخرى، وتوظيف الاستراتيجية الواردة في هذه المخطوطة، وهما 10 (الفوسفات) يباسيس مثل patatin (SMc00930 وSMc01003) التي ساهمت في تكوين الأحماض الدهنية الحرة في س. وتوقع meliloti 11. والمثير للدهشة، وتستخدم SMc01003 همرشولد الركيزة تحويله إلى monoacylglycerol وأخيرا الجلسرين والأحماض الدهنية الحرة 11. لذلك، SMc01003 هو الليباز داغ (DglA).
ورغم أن عددا من الخوارزميات وجود للتنبؤ المحتملين (الفوسفات) يباسيس 12،13، وظيفتها دقيقة وغير معروفة عادة دور الفسيولوجية. نحن هنا الخطوط العريضة لبروتوكول، لاستنساخ وبإفراط توقع أو المحتملة (الفوسفات) الليباز. توضح هذه المخطوطة كيف المقايسات الإنزيم يمكن تطوير وتحسين ل(الفوسفات) الليباز overexpressed باستخدام ركائز اللونية الاصطناعية. نحن نقدم أمثلة كيف مع فحص انزيم الأمثل الحقيقية (الفوسفات) الليباز الركيزة يمكن أن يكون مصادفة، وكيف يمكن أن تثري هذه النتائج فهمنا للعلم وظائف الأعضاء الميكروبية.
Protocol
1. استنساخ وبإفراط الهيكلية الجيني لالليباز وتوقع
- باستخدام تفاعل البلمرة المتسلسل (PCR) 14 وأليغنوكليوتيد محددة (الجدول 1) 15، تضخيم الجين (smc01003، smc00930، أو smc00171)، يتوقع أن رمز لالليباز أو فسفوليباز، من الحمض النووي الجيني للكائن الحي المضيف (أي ، جرثومة S. meliloti).
- إدخال تقييد مواقع محددة (مع تسلسل مصممة للأليغنوكليوتيد]). هضم جزء تضخيم الحمض النووي مع إنزيمات تقييد المقابلة واستنساخ ذلك إلى ناقلات التعبير مثل البلازميدات من سلسلة الحيوانات الأليفة (16).
- بعد التأكد من تسلسل الحمض النووي الصحيح لهذا الجين المستنسخة، وتحويل ناقلات لسلالة التعبير مثل الإشريكية القولونية BL21 (DE3) pLysS 16.
- إعداد ما قبل الثقافة بين عشية وضحاها من المضيف التعبير E. القولونية BL21 (DE3) ررYSS، إيواء ناقلات الحيوانات الأليفة منها مع الجينات المستنسخة أو ناقلات فارغة، في 100 مل قوارير الثقافة التي تحتوي على 20 مل من لوريا Bertani مرق (LB) 17 بالإضافة إلى المضادات الحيوية اللازمة. ثقافة الخلايا عند 30 درجة مئوية (أو في درجة حرارة النمو المعتادة من البكتيريا التي الليباز ينبع).
- باستخدام بين عشية وضحاها الثقافات مسبقا، تطعيم 500 مل من المتوسط LB prewarmed (بالإضافة إلى المضادات الحيوية المطلوبة) في 2 قوارير ثقافة L للحصول على الكثافة البصرية الأولية في 620 نانومتر (OD 620) = 0.05. اتبع نمو الثقافات وفي لOD 620 = 0.3، إضافة الآيزوبروبيل-β-D-thiogalactoside (IPTG) إلى تركيز النهائي من 100 ميكرومتر، واحتضان في إطار التحريض على 30 درجة مئوية لمدة 4 ساعات.
- في نهاية فترة الحضانة، ونقل كل ثقافة إلى أنبوب الطرد المركزي 500 مل وأجهزة الطرد المركزي في 5000 x ج في 4 درجة مئوية لمدة 30 دقيقة. و resuspend الكريات الخلية البكتيرية في 5 مل من العازلة تعليق (على سبيل المثال، SMc00930- وSMc01003، معربا عن الخلايا في 50 ملي تريس، حمض الهيدروكلوريك 8.0 درجة الحموضة والخلايا SMc00171، معربا في 50 ملي ايتانول أمين، حمض الهيدروكلوريك درجة الحموضة 9.8). تخزين تعليق خلية في -80 درجة مئوية حتى الاستخدام.
2. إعداد مقتطفات البروتين الخالية من خلية وتحديد كثافة البروتين
- تذويب الايقاف الخلية البكتيرية وتخزينها على الجليد. تمرير تعليق خلية ثلاث مرات من خلال خلية الضغط الباردة في 20،000 رطل لكل في 2. إزالة خلايا سليمة والحطام الخلية بواسطة الطرد المركزي في 5000 x ج لمدة 30 دقيقة على 4 درجات مئوية.
- بعد الطرد المركزي، وإعداد aliquots من 100 و 500 ميكرولتر من طاف لتحليلها لاحقا وتخزينها في -80 درجة مئوية حتى الاستخدام.
- استخدم إحدى قسامة 100 ميكرولتر لتحديد تركيز البروتين مقتطفات خالية من الخلايا متميزة على طريقة الاختيار أو كما هو موضح 18.
3. استخدام ركائز الاصطناعي لتحسين أنزيمأنشطة (الفوسفات) يباسيس
- للحصول على تغطية الأولية من الأنشطة الإنزيمية متميزة، واستخدام ركائز المصطنعة التي تسفر عن المنتجات الملونة على التحلل، مثل ص -nitrophenol (ص -NP).
- لفحوصات انزيم الأمثل بالفعل مع ركائز ص -nitrophenyl استر الاصطناعية (المبين لفسفوليباز C PlcP (SMc00171)، وكذلك لفوسفوليباز مثل patatin توقع SMc00930 وSMc01003)، وخطط pipetting لاستخدام وصفت في الجدول 2.
- عندما استكشاف المحتملين (الفوسفات) الليباز الجديد، وإعداد أول فحص انزيم القياسية التي تحتوي على 50 ملي تريس، حمض الهيدروكلوريك، ودرجة الحموضة 8.5، 100 مم كلوريد الصوديوم، 0.05٪ تريتون X-100، 0.5 مم ص مركب يحتوي على -nitrophenyl (ص -nitrophenyl الفوسفات ، bis- ص -nitrophenyl الفوسفات، ص -nitrophenyl ديكانوات، أو ص -nitrophenyl بالميتات)، وخالية من الخلايا استخراج البروتين (راجع 1، 3، 10، 30، 100، 300، و 1،000 ميكروغرام) في إجمالي حجم 1 مل في 1 مل CUVE البلاستيكttes.
ملاحظة: استخدام درجة الحموضة القلوية (الشكل 1) عند اتباع ص -nitrophenyl المائي استر في الفحص المستمر. بدلا من ذلك، استخدم واحد المقايسات الوقت نقطة لمجموعة من القيم ودرجة الحموضة، إضافة هيدروكسيد الصوديوم في نهاية فترة الحضانة لإنهاء رد فعل الانزيم، والتأكد من أن جميع ص -NP موجود في شكل فينولات. - متابعة سير الوقت لزيادة الامتصاصية في 405 نانومتر، ويرجع ذلك إلى تشكيل ص -NP، في معمل عند 30 درجة مئوية على فترة 5 دقائق. تحديد تشكيل الخطي في البداية من ص -NP من خلال تحديد المنحدر الأولي من زيادة الامتصاصية في الوقت.
- حساب التغير في تركيز (Δc) لص -NP باستخدام قانون لامبرت-البيرة (ΔA = ε Δc د) 1.
ملاحظة: ΔA هو التغيير خطية من الامتصاصية العزم، ε هو معامل الانقراض المولي في طول موجة كل منها (في وحدات من M -1 سم -1)، د هو طول مسار الضوء (1 سم)، وΔc هو تغيير تركيز (في وحدات M) يحدد لاحقا.- وبالنظر إلى أن حجم الاختبار هو 1 مل، وحساب كمية ص -NP تشكيلها.
ملاحظة: المبلغ = تركيز حجم س. - حساب نشاط انزيم بقسمة مبلغ ص -NP التي شكلتها في الوقت الذي تتشكل. تحديد نشاط انزيم معين بقسمة نشاط انزيم من كمية البروتين (في ملغ) الذي كان مسؤولا عن توليد هذا النشاط.
- وبالنظر إلى أن حجم الاختبار هو 1 مل، وحساب كمية ص -NP تشكيلها.
- مقارنة التغيرات الامتصاصية التي أثارتها مقتطفات من البروتين الذي قد أعرب عن الجينات المرشحة (smc00171، smc00930، أو smc01003) مع مقتطفات التي تؤوي سوى ناقلات فارغة.
ملاحظة: من أجل متابعة الخطوات التالية، يجب أن تكون أنشطة محددة، والناجمة عن مقتطفات من البروتين الذي قد أعرب عن الجينات المرشحة، على الأقل مرتين أو مخام من القيم التي تم الحصول عليها لأنشطة محددة الناجمة عن مقتطفات من البروتين التي تؤوي سوى ناقلات فارغة. - لمزيد من التجارب، حدد تلك الظروف التي التحلل من مركب يحتوي على -nitrophenyl ف هو الحد الأدنى مع مقتطفات خالية من الخلايا (أي ناقلات فارغة) والذي تشكيل أكثر وضوحا من ص -NP وأنيون ص -nitrophenolate (الشكل 1) يمكن ملاحظتها عندما تستخدم مستخلصات البروتين، والذي كان قد أعرب عن الجينات المرشحة.
- بعد تحديد نشاط انزيم الأولي في 3.1، وتحسين الظروف فحص للانزيم منها من خلال تغيير درجة الحموضة، نوع من العازلة، العازلة قوة، وتركيزات كلوريد الصوديوم، المنظفات مثل تريتون X-100، وغياب أو وجود الكاتيونات الثنائي التكافؤ مختلفة.
- لتركيزات مختلفة من كل متغير، وتحديد نشاط انزيم معين (انظر 3.1.4.2) (أعلى رقم تم الحصول عليها يحدد حالةمن نشاط انزيم القصوى). استخدام مزيج من الظروف المثلى اجه لكل متغير لتعريف فحص انزيم الأمثل فيها كل متغير موجود في تركيز الأمثل.
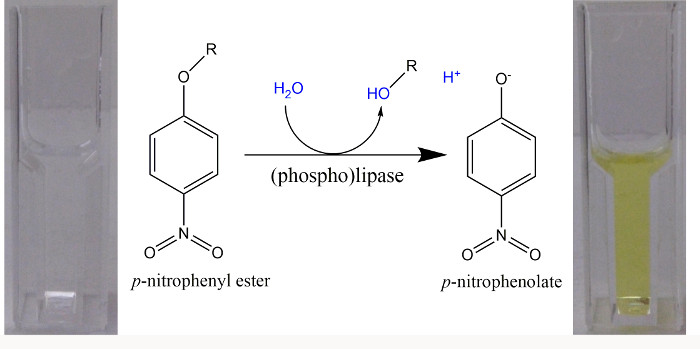
الشكل 1. ص استرات -Nitrophenyl ركائز الاصطناعية لل(الفوسفات) الليباز في الفحص الطيفي. وعند التحلل من استرات ص -nitrophenyl، تتشكل من الأحماض (R-OH) وص -nitrophenol (ص -NP). ويرجع ذلك إلى PK ل= 7.2 لتفارق من الفينول H + من ص -NP، في الرقم الهيدروجيني> 9.2 أكثر من 99٪ في شكل ص -nitrophenolate أصفر مشرق ومعامل الانقراض المولي من 18،000 م -1 سم - 1 يمكن استخدامها في طول الموجة من 405 نانومتر لتقدير حجم الحرة ص -nitrophenolate 22. عندما استخدمت مخازن مع الرقم الهيدروجيني 8.5، تم تحديد الامتصاصية في 400 نانومتر، ومعامل الانقراض المولي من 14،500 م -1 سم -1 كان يعمل 23. يرجى النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
ملاحظة: بعد أن حددت الظروف المثلى لنشاط الإنزيم من الفائدة، والشروع في البحث عن الركيزة الحقيقية / الفسيولوجية من هذا الليباز. من حيث المبدأ، واتخاذ اثنين، وغالبا ما متكاملين، لتحقيق هذا الهدف، وهو في نهج الجسم الحي أو نهج في المختبر.
4. في فيفو التعرف على الفسيولوجية الركيزة لالليباز
ove_content "> ملاحظة: في هذا النهج في الجسم الحي، والتعبير عن الليباز الاهتمام كائن المضيف 8،11 لتسجيل مرور الوقت ما إذا كانت تعبيرا عن الليباز يغير الشخصي host's الدهون في نهج آخر في الجسم الحي، تولد متحولة ناقصة من الجينات في المصالح 8،11 ودراسة ما إذا كانت الدهون لها يختلف عن النوع البري نسخة 6،8،11. ومن أجل الحصول على التقييم الكمي من الدهون الكائن الحي، ويتكون طريقة بسيطة في radiolabeling المركبات الخلوية ، واستخراج الدهون، وفصل لهم من قبل اللوني، وقياس نسبة الدهون في فصل المسمى بالإشعاع.- Radiolabeling من الدهون.
- إعداد ما قبل الثقافة بين عشية وضحاها من كائن حي من الفائدة (إي كولاي أو جرثومة S. meliloti) في 5 مل من مستنبت المطلوب (المتوسطة معقدة أو تعريف الحد الأدنى من المتوسط) وينمو بمعدل 30 درجة مئوية.
- من قبل الثقافة، تطعيم في 20 مل من سالي متوسطة جديدة في قارورة الثقافة 100 مل للحصول على OD الأولي 620 = 0.3 للثقافة.
- يأخذ قسامة (1 مل) من الثقافة تحت ظروف معقمة ونقل إلى البوليسترين 14 مل العقيمة أنبوب جولة القاع.
- إضافة 1 μCi من [1- 14 C] خلات (60 زارة التجارة والصناعة في ملمول) للثقافة 1 مل.
- احتضان ثقافة السائل في إطار التحريض على 30 درجة مئوية لمدة 24 ساعة.
- في نهاية فترة الحضانة، ونقل الثقافة إلى أنبوب microcentrifuge 1.5 مل وأجهزة الطرد المركزي في 12000 x ج في درجة حرارة الغرفة لمدة 5 دقائق.
- Resuspend وبيليه في 100 ميكرولتر من المياه. في هذه المرحلة، وتخزين تعليق خلية في -20 درجة مئوية أو مباشرة الاستمرار في استخراج الدهون القطبية (القسم 4.2).
- استخراج الدهون القطبية.
ملاحظة: الطريقة الموضحة هنا أساسا يتبع الإجراء ذكرت بليغ وداير (19).- إلى 100 ميكرولتر من المعل خلية مائيension، إضافة 375 ميكرولتر من الميثانول: حل الكلوروفورم (2: 1؛ المجلد / المجلد).
- دوامة لمدة 30 ثانية، واحتضان لمدة 5 دقائق في درجة حرارة الغرفة.
- الطرد المركزي 5 دقائق في 12000 x ج في درجة حرارة الغرفة.
- طاف لنقل 1.5 مل أنبوب microcentrifuge جديد.
- إضافة 125 ميكرولتر من كلوروفورم و 125 ميكرولتر من المياه، دوامة 30 ثانية.
- الطرد المركزي 1 دقيقة في 12000 x ج في درجة حرارة الغرفة.
- نقل المرحلة الكلوروفورم السفلى لأنبوب جديد والجافة مع تيار من غاز النيتروجين.
- حل الدهون المجففة في 100 ميكرولتر من كلوروفورم: حل الميثانول (1: 1؛ المجلد / المجلد).
ملاحظة: عند هذه النقطة، قسامة من 5 ميكرولتر من محلول الدهون يمكن قياسها عن طريق عد التلألؤ السائل. - لتحليل طبقة رقيقة الكروماتوغرافي (TLC)، تجف أسفل 95 ميكرولتر المتبقية مع تيار من غاز النيتروجين وتنحل الدهون المجففة في 20 ميكرولتر من كلوروفورم: حل الميثانول (1: 1؛ المجلد / المجلد). استخدام قسامة 3 ميكرولترلتحليل TLC.
- فصل الدهون القطبية التي اللوني طبقة رقيقة (TLC).
ملاحظة: اعتمادا على الطبقات الدهون ليتم تحليلها، يمكن أن تستخدم تركيبات مختلفة من مراحل الصلبة والمتنقلة للانفصال. هنا فصل نموذجي عن الدهون اتهم القطبية وأخرى، أكثر ملاءمة لالدهون القطبية محايدة، وذلك باستخدام عالية الأداء طبقة رقيقة اللوني (HPTLC) ورقة هلام السيليكا الألومنيوم كمرحلة الصلبة، وترد.- فصل الدهون القطبية التي يتقاضاها ثنائي الأبعاد TLC (2D-TLC).
- تطبيق قسامة 3 ميكرولتر من عينة الدهون في زاوية واحدة من ورقة HPTLC هلام السيليكا الألومنيوم (10 × 10 سم)، 2 سم من حافة صفيحة.
- إعداد وتخلط الطور المتحرك (140 مل الكلوروفورم، 60 مل الميثانول، و 10 مل من الماء) للفصل في البعد الأول.
- معطف غرفة تطوير TLC داخليا مع ورقة اللوني.
ملاحظة: هذا هو لضمان أن المرحلة الغاز من الغرفةسيتم المشبعة بسرعة (في غضون 30 دقيقة) بعد المرحلة المتنقلة للالبعد الأول قد أضيفت إلى الغرفة وتم إغلاق الغرفة مع لوحة من الزجاج. - إعداد وتخلط الطور المتحرك (130 مل الكلوروفورم، 50 مل الميثانول، و 20 مل الجليدية حمض الخليك) للفصل في البعد الثاني ونقل إلى غرفة TLC الثانية تطوير المغلفة داخليا مع ورقة اللوني والسماح للتشبع الغرفة.
- نقل بعناية ورقة هلام السيليكا الألومنيوم HPTLC مع عينة الدهون المجففة إلى الغرفة الأولى وتطوير (أي أداء اللوني) لوحة لمدة 60 دقيقة في غرفة مغلقة في البعد الأول 5.
- إزالة لوحة من الغرفة وترك المذيبات الجافة قبالة في غطاء تدفق لمدة 30 دقيقة.
- بعد تحويل لوحة بمقدار 90 درجة فيما يتعلق اللوني السابق، ونقل ورقة الألومنيوم هلام السيليكا HPTLC، الذي يكون قد تم فصل الدهون في بعد واحد، إلى سكوند الغرفة وتطوير لوحة لمدة 60 دقيقة في البعد الثاني 5.
- إزالة ورقة من غرفة والسماح للمذيبات تجف قبالة في غطاء تدفق لا يقل عن 2 ساعة.
- فصل الدهون القطبية محايدة.
- تطبيق 3 مكل من عينات الدهون على ورقة هلام السيليكا الألومنيوم HPTLC ابتداء 2 سم من حواف اللوحة. إذا تم تحليل عينات متعددة في اللوني ذات بعد واحد، والحفاظ على مسافة 1.5 سم على الأقل بين مختلف البقع تطبيق نموذج.
- إعداد وتخلط الطور المتحرك (140 مل الهكسان، 60 مل ثنائي إيثيل الإيثر، و 8 مل حامض الخليك) ونقل إلى غرفة تطوير TLC المغلفة داخليا مع ورقة اللوني ومغطاة بصفيحة زجاجية للسماح للتشبع الغرفة (30 دقيقة).
- نقل ورقة الألومنيوم هلام السيليكا HPTLC مع عينات الدهون المجففة إلى الغرفة وتطوير لوحة لمدة 30 دقيقة في غرفة مغلقة.
- إزالة لوحة من الغرفةوالسماح للمذيبات تجف قبالة في غطاء تدفق لمدة 2 ساعة.
- فصل الدهون القطبية التي يتقاضاها ثنائي الأبعاد TLC (2D-TLC).
- الكمي والتصور من الدهون القطبية فصل.
- مرة واحدة ورقة TLC المتقدمة جافة، واحتضان مع شاشة التلألؤ photostimulable (البولندي) في شريط مغلق لمدة 3 أيام.
- فضح الشاشة المحتضنة لماسح ضوئي البولندي والحصول على صورة افتراضية من الدهون رديولبلد فصل.
- أداء الكمي باستخدام برنامج البولندي 20.
- التصور وعزل الطبقات الدهون القطبية الفردية.
- احتضان ورقة TLC المتقدمة لمدة 10 دقيقة في غرفة اللوني في وجود من 1 غرام من بلورات اليود.
ملاحظة: مطلق المركبات شحمي حل اليود وتظهر على شكل بقع بنية اللون. - دائرة البقع مع قلم رصاص، مقارنتها مع الحراك النسبي (R و) من المركبات القياسية (أي 1،2-dipalmitoyl- التعطيل -glycerol، dipalmitoyl-L-α-فوسphatidylcholine، DL-α-monopalmitin، أو حمض البالمتيك)، وتحديد إلى أي فئة الدهون لأنها قد تنتمي.
- في غطاء الدخان، والسماح للاليود تتبخر من ورقة TLC.
- مع مساعدة من ملعقة، تتخلص من هلام السيليكا التي تحتوي على مركب من الاهتمام من ورقة، واستخراج المركب من هلام السيليكا مع مزيج من 100 ميكرولتر من الماء و 375 ميكرولتر من الميثانول: حل الكلوروفورم (2: 1؛ المجلد / المجلد).
- تواصل مع استخراج وفقا لبليغ وداير على النحو المبين (4.2.2 فصاعدا).
- متجر تنقية الطبقة الشحمية في 100 ميكرولتر من كلوروفورم: حل الميثانول (1: 1؛ المجلد / المجلد) عند درجة حرارة -20 درجة مئوية حتى الاستخدام.
- احتضان ورقة TLC المتقدمة لمدة 10 دقيقة في غرفة اللوني في وجود من 1 غرام من بلورات اليود.
5. في المختبر التعرف على الفسيولوجية الركيزة لالليباز
ملاحظة: في هذا النهج في المختبر، ودراسة ما إذا كان الليباز من الفائدة يمكن تحويل خليط من الدهون معزولة أو الدهون نقية الفردية إلى هيدرول المقابلةمنتجات يسيس وفقا للشروط المحددة بالشكل الأمثل في 3.2.
- استخدام أنظمة pipetting للفحوصات انزيم كما في الجدول رقم 3 للكمبيوتر محددة فسفوليباز C SMc00171 (انظر 5.2)، فسفوليباز و(انظر 5.3)، ومديرية الشؤون الجغرافية الليباز SMc01003 (انظر 5.4) النشاط.
- تقرير النشاط فسفوليباز C PC-معين (الجدول 3).
- إلى أنبوب microcentrifuge 1.5 مل، إضافة 5000 التهم لكل دقيقة (CPM) من إجمالي 14 PC-المسمى C وحل تريتون X-100.
- مزيج الجافة تحت تيار من النيتروجين.
- إضافة ايتانول أمين، حمض الهيدروكلوريك، ودرجة الحموضة 9.8 العازلة، وكذلك كلوريد الصوديوم وMnCl 2 الحلول والمياه bidistilled للحصول على الحجم النهائي من 99.5 ميكرولتر. دوامة لمدة 5 ثوان.
- إضافة 0.5 ميكرولتر من انزيم (5 البروتين ميكروغرام) (أي استخراج خالية من الخلايا التي overexpressed SMc00171 موجود) لبدء التفاعل. مزيج لفترة وجيزة.
- احتضان عند 30 درجة مئوية لمدة 4 ساعات.
- وقف رد فعل من قبلإضافة 250 ميكرولتر من الميثانول و 125 ميكرولتر من كلوروفورم.
- استخراج الدهون كما هو موضح سابقا (انظر 4.2).
- الدهون منفصلة أحادية البعد (1D) -TLC (انظر 4.3.2 و 4.4)، وتحليلها بواسطة التصوير البولندي.
- تقرير النشاط فسفوليباز ألف (الجدول 3).
- إلى أنبوب microcentrifuge 1.5 مل، إضافة 5000 نسخة في الدقيقة 14 من إجمالي الدهون الفوسفاتية المسمى C وحل تريتون X-100.
- مزيج الجافة تحت تيار من النيتروجين.
- لالنهائي فحص 100 ميكرولتر، إضافة تريس، حمض الهيدروكلوريك، ودرجة الحموضة 8.5 العازلة، حل كلوريد الصوديوم والماء. دوامة لمدة 5 ثوان.
- إضافة 5 ميكرولتر من انزيم (50 ميكروغرام البروتين) (أي استخراج خالية من الخلايا التي overexpressed SMc00930 أو SMc01003 موجود).
- احتضان عند 30 درجة مئوية لمدة 5 ساعة.
- وقف رد الفعل من خلال إضافة 250 ميكرولتر من الميثانول و 125 ميكرولتر من كلوروفورم.
- استخراج الدهون كما هو موضح سابقا (انظر 4.2)، منفصلةلهم من قبل 1D-TLC باستخدام 130 مل الكلوروفورم، 50 مل الميثانول، وحمض الخليك 20 مل الجليدية كمرحلة النقالة، وتحليلها بواسطة التصوير البولندي.
- تقرير من مادة ال diacylglycerol (داج) النشاط الليباز.
- إعداد داغ المسمى C-14.
- Radiolabel س. الثقافات meliloti (انظر 4.1) واستخراج الدهون القطبية (انظر 4.2) كما هو موضح. منفصل س. meliloti إجمالي مقتطفات من المادة الدهنية التي كتبها 1D-TLC في الكلوروفورم: الميثانول: حمض الخليك (130: 50: 20؛ المجلد / المجلد) باستخدام الشروط الموضحة للفصل في البعد الثاني في 4.3.1.
- تصور جهاز الكمبيوتر عن طريق تلطيخ اليود واستخدام قلم رصاص بمناسبة توطين فسفاتيديل (PC).
- عزل PC رديولبلد كما هو موضح في 4.5.
- تحديد PC المستخرج من التلألؤ العد.
ملاحظة: من المتوقع عن 320،000 جهاز كمبيوتر التدوير. - علاج PC (250،000 نسخة في الدقيقة) مع 0.1 U من فسفوليباز C من المطثية الحاطمة في 50 ملي تريس، حمض الهيدروكلوريك، ودرجة الحموضة 7.2، 0.5٪ تريتون X-100 و 10 ملم CaCl 2 لمدة 2 ساعة في إجمالي حجم 100 ميكرولتر ووقف رد الفعل من خلال إضافة 250 ميكرولتر من الميثانول و 125 ميكرولتر من كلوروفورم.
- استخراج الدهون كما هو موضح سابقا ومنفصلة بها من قبل 1D-TLC (انظر 4.3.2).
- عزل مادة ال diacylglycerol من لوحة السيليكا وقياس من قبل عد التلألؤ (كما هو موضح في 4.2)
- مادة ال diacylglycerol الليباز فحص (الجدول 3).
- إلى أنبوب microcentrifuge 1.5 مل، إضافة 5000 نسخة في الدقيقة 14 وصفت C-داج وحل تريتون X-100.
- مزيج الجافة تحت تيار من النيتروجين.
- لالنهائي فحص 100 ميكرولتر، إضافة تريس، حمض الهيدروكلوريك (الرقم الهيدروجيني 9.0) العازلة، حل كلوريد الصوديوم والماء bidistilled. دوامة لمدة 5 ثوان.
- بدء رد فعل عن طريق إضافة 5 ميكرولتر من انزيم (50 ميكروغرام البروتين المستخلص الخالي من الخلايا).
- احتضان عند 30 درجة مئوية لمدة 4 ساعات.
- وقف رد الفعل من خلال إضافة 250 ميكرولتر من الميثانولد 125 ميكرولتر من نسبة الدهون في الكلوروفورم واستخراج كما هو موضح سابقا (انظر 4.2).
- تحليل الدهون القطبية المحايدة التي كتبها 1D-TLC (انظر 4.1.3.2) والتصوير البولندي لاحق.
- إعداد داغ المسمى C-14.
النتائج
آخر من أجهزة الكمبيوتر الخاصة فسفوليباز C SMc00171 مع Bis- ص -nitrophenyl الفوسفات
مقتطفات خالية من الخلايا التي تم الحصول عليها من E. القولونية BL21 (DE3) × pLysS، التي أعربت ...
Discussion
على مدى السنوات ال 20 الماضية، تم التسلسل جينومات العديد من الكائنات الحية وعلى الرغم من ثروة من البيانات تسلسل الجينوم قد ولدت، وتفسير وظيفي لا يزال متخلفا، وبالتالي يعيق فهمنا من وظيفة الجينوم. وغالبا ما تسند وظائف الجينات في الجينوم على أساس التشابه في الجينات وظي...
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
وأيد هذا العمل من المنح المقدمة من المجلس الوطني للعلوم بحوث والتكنولوجيا والمكسيك (CONACYT والمكسيك) (82614، 153998، 253549، و178359 في INVESTIGACION CIENTIFICA باسيكا وكذلك 118 في INVESTIGACION أون Fronteras دي لا Ciencia) ومن المديرية العامة لل Asuntos دي الشخصية Académico-الجامعة الوطنية المستقلة بالمكسيك (DGAPA-UNAM، PAPIIT IN202616، IN203612).
Materials
| Name | Company | Catalog Number | Comments |
| Chloroform | JT Baker | 9180-03 | TLC analysis & Lipid extraction |
| Methanol | JT Baker | 9070-03 | TLC analysis & Lipid extraction |
| Acetic Acid | JT Baker | 9507-05 | TLC analysis & Lipid extraction |
| Hexanes | JT Baker | 9309-02 | TLC analysis & Lipid extraction |
| Diethylether | Sigma | 32203 | Enzymatic assays |
| bidistilled water | ANY | NA | Enzymatic assays |
| Tris Base | Sigma | T-1503 | Enzymatic assays |
| HCl | Baker | 9535-02 | Enzymatic assays |
| NaCl | Baker | 3624-01 | Enzymatic assays |
| Triton X-100 | Sigma | X-100 | Enzymatic assays |
| LB broth | ANY | NA | Bacterial growth, 10 g tryptone + 5 g yeast extract + 10 g NaCl per liter of bidistilled water |
| tryptone | Becton Dickinson and Company | 211705 | Bacterial growth |
| yeast extract | Becton Dickinson and Company | 212750 | Bacterial growth |
| TY broth | ANY | NA | Bacterial growth, 8 g tryptone + 3 g yeast extract + 66 mg CaCl2·2H2O per liter of bidistilled water |
| CaCl2·2H2O | Baker | 1332-01 | Enzymatic assays |
| isopropyl-β-D-thiogalactoside (IPTG) | Invitrogen | 15529-019 | Bacterial growth |
| Diethanolamine | Sigma | D-8885 | Enzymatic assays |
| MnCl2 | Sigma | 221279 | Enzymatic assays |
| Phospholipase A2 snake venom | Sigma | P0790 | Enzymatic assays |
| Phospholipase C Clostridium perfringens | Sigma | P7633 | Enzymatic assays |
| Bis-p-nitrophenyl phosphate | Sigma | 07422AH | Enzymatic assays |
| p-nitrophenyl stearate | Sigma | N3627 | Enzymatic assays |
| p-nitrophenyl dodecanoate | Sigma | 61716 | Enzymatic assays |
| p-nitrophenyl decanoate | Sigma | N0252 | Enzymatic assays |
| p-nitrophenyl palmitate | Sigma | N2752 | Enzymatic assays |
| p-nitrophenyl butyrate | Sigma | N9876 | Enzymatic assays |
| p-nitrophenyl octanoate | Sigma | 21742 | Enzymatic assays |
| Acetic Acid, sodium salt [1-14C] | Perkin Elmer | NEC084 | Bacterial growth |
| dimethylsulfoxide (DMSO) | JT Baker | 9224-01 | Enzymatic assays |
| Aluminium HPTLC silica gel 60 plates. Silica gel HPTLC plates size 20 x 20 cm, 25 sheets. | Merck | 105547 | TLC analysis & Lipid extraction |
| Spectrometer UV/VIS Lambda 35 | Perkin Elmer | NA | Enzymatic assays |
| Storm 820 Phosphorimager | Molecular Dynamics | NA | Photostimulable Luminescence scanner |
| Multipurpose Scintillation Counter | Beckman Coulter | NA | Radioactivity Quantification |
| French Pressure Cell | ThermoSpectronic | NA | Breakage of cells |
| chromatography paper 3MM Chr | Whatman | 3030917 | TLC analysis |
| Sinorhizobium meliloti 1021our | reference 11 | studied strain | |
| Escherichia coli BL21 (DE3) pLysS Competent cells | Novagen | 69451 | protein expression strain |
| pET9a vector | Novagen | 69431 | protein expression vector |
| pET17b vector | Novagen | 69663 | protein expression vector |
| sterile polystyrene round-bottom tube (14 ml) Falcon | Becton Dickinson | 352057 | radiolabeling of bacterial cultures |
| polypropylene microcentrifuge tubes (1.5 ml) | Eppendorf | 30125.15 | Enzymatic assays |
| 1,2-dipalmitoyl-sn-glycerol | Sigma | D9135 | lipid standard |
| L-α-phosphatidylcholine, dipalmitoyl | Sigma | P6267 | lipid standard |
| DL-α-monopalmitin | Sigma | M1640 | lipid standard |
| palmitic acid | Sigma | P0500 | lipid standard |
References
- Nelson, D. L., Cox, M. M. . Lehninger, Principles of Biochemistry. , (2013).
- Jaeger, K. E., Eggert, T. Lipases for biotechnology. Curr. Opin. Biotechnol. 13 (4), 390-397 (2002).
- Dowhan, W., Bogdanov, M., Mileykovskaya, E. Functional roles of lipids in membranes. Biochemistry of Lipids, Lipoproteins and Membranes. , 1-37 (2008).
- Dowhan, W. Molecular basis for membrane phospholipid diversity: why are there so many lipids?. Annu. Rev. Biochem. 66, 199-232 (1997).
- De Rudder, K. E. E., Thomas-Oates, J. E., Geiger, O. Rhizobium meliloti mutants deficient in phospholipid N-methyltransferase still contain phosphatidylcholine. J. Bacteriol. 179, 6921-6928 (1997).
- Geiger, O., Röhrs, V., Weissenmayer, B., Finan, T. M., Thomas-Oates, J. E. The regulator gene phoB mediates phosphate stress-controlled synthesis of the membrane lipid diacylglyceryl-N,N,N-trimethylhomoserine in Rhizobium (Sinorhizobium) meliloti. Mol. Microbiol. 32 (1), 63-73 (1999).
- Klug, R. M., Benning, C. Two enzymes of diacylglyceryl-O-4'-(N,N,N,-trimethyl)homoserine biosynthesis are encoded by btaA and btaB in the purple bacterium Rhodobacter sphaeroides. Proc. Natl. Acad. Sci. USA. 98 (10), 5910-5915 (2001).
- Zavaleta-Pastor, M., et al. Sinorhizobium meliloti phospholipase C required for lipid remodeling duringphosphorus limitation. Proc. Natl. Acad. Sci. USA. 107 (1), 302-307 (2010).
- Pech-Canul, A., et al. FadD is required for utilization of endogenous fatty acids released from membrane lipids. J. Bacteriol. 193 (22), 6295-6304 (2011).
- Banerji, S., Flieger, A. Patatin-like proteins: a new family of lipolytic enzymes present in bacteria?. Microbiology. 150 (Pt 3), 522-525 (2004).
- Sahonero-Canavesi, D. X., et al. Fatty acid-releasing activities in Sinorhizobium meliloti include unusual diacylglycerol lipase. Environ. Microbiol. 17 (9), 3391-3406 (2015).
- Fischer, M., Pleiss, J. The Lipase Engineering Database: a navigation and analysis tool for protein families. Nucl. Acid. Res. 31 (1), 319-321 (2003).
- Sigrist, C. J. A., et al. New and continuing developments at PROSITE. Nucleic Acids Res. 41 (Database issue), D344-D347 (2013).
- Lorenz, T. C. Polymerase Chain Reaction: Basic Protocol Plus Troubleshooting and Optimization Strategies. J. Vis. Exp. (63), e3998 (2012).
- Untergasser, A., et al. Primer3 - new capabilities and interfaces. Nucl. Acids Res. 40 (15), e115 (2012).
- Studier, F. W., Rosenberg, A. H., Dunn, J. J., Dubendorff, J. W. Use of T7 RNA polymerase to direct expression of cloned genes. Methods Enzymol. 185, 60-89 (1990).
- Miller, J. H. . Experiments in Molecular Genetics. , (1972).
- Desjardins, P., Hansen, J. B., Allen, M. Microvolume Protein Concentration Determination using the NanoDrop 2000c Spectrophotometer. J. Vis. Exp. (33), e1610 (2009).
- Bligh, E. G., Dyer, W. J. A rapid method for total lipid extraction and purification. Can. J. Biochem. Physiol. 37 (8), 911-917 (1959).
- Molecular Dynamics. . Phosphorimager SI User´s Guide. , (1994).
- Dixon, M., Webb, E. . Enzymes: Third Edition. , (1979).
- Rudolph, A. E., et al. Expression, characterization, and mutagenesis of the Yersinia pestis murine toxin, a phospholipase D superfamily member. J. Biol. Chem. 274 (17), 11824-11831 (1999).
- Kato, S., Yoshimura, T., Hemmi, H., Moriyama, R. Biochemical analysis of a novel lipolytic enzyme YvdO from Bacillus subtilis. Biosci. Biotechnol. Biochem. 74 (4), 701-706 (2010).
- Peppelenbosch, M. P. Kinome profiling. Scientifica (Cairo). , (2012).
- Manafi, M., Kneifel, W., Bascomb, S. Fluorogenic and chromogenic substrates used in bacterial diagnostics. Microbiol. Rev. 55 (3), 335-348 (1991).
- Kuznetsova, E., et al. Enzyme genomics: Application of general enzymatic screens to discover new enzymes. FEMS Microbiol. Rev. 29 (2), 263-279 (2005).
- Scopes, R. K. . Protein Purification, Principles and Practice. , (2010).
- Geiger, O., Lopez-Lara, I. M., Sohlenkamp, C. Phosphatidylcholine biosynthesis and function in bacteria. Biochim. Biophys. Acta. 1831 (3), 503-513 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved