A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تدفق تحليل Cytometric من القاتل الطبيعي خلية التحللي آخر في الدم الجامع البشري
In This Article
Summary
This work describes an advanced workflow for the accurate and fast determination of NK (Natural Killer) cell count and NK cell cytotoxicity in human blood samples.
Abstract
NK الخلية السمسة هو مقياس يستخدم على نطاق واسع لتحديد تأثير التدخل الخارجي على وظيفة الخلايا القاتلة الطبيعية. ومع ذلك، فإن دقة واستنساخ هذا الاختبار يمكن اعتبار غير مستقر، سواء بسبب أخطاء المستخدم أو بسبب حساسية الخلايا القاتلة الطبيعية للتلاعب التجريبية. للقضاء على هذه القضايا، تم إنشاء سير العمل الذي يقلل منها إلى أدنى حد ويرد هنا. ولتوضيح ذلك، حصلنا على عينات من الدم، في نقاط زمنية مختلفة، من العدائين (ن = 4) التي قدمت لنوبة شديدة من ممارسة الرياضة. أولا، الخلايا القاتلة الطبيعية ويتم تحديد وقت واحد وعزل من خلال وضع علامات CD56 والفرز على أساس المغناطيسي، مباشرة من الدم الكامل ومن اقل من واحد ملليلتر. تتم إزالة الخلايا القاتلة الطبيعية فرزها في أي كاشف أو متوجا الأجسام المضادة. ويمكن عدها من أجل إقامة دقيق NK عدد خلايا في كل ملليلتر من الدم. ثانيا، الخلايا القاتلة الطبيعية فرزها (المستجيبات الخلايا أو E) يمكن أن تكون مختلطة مع 3،3'-Diotadecyloxacarbocyanine البركلورات (ديو) الموسومة خلايا K562 (الخلايا المستهدفة أو تي) في ل1-فحص الأمثل: 5 T: نسبة E، وتحليلها باستخدام التصوير تدفق الكريات التي تسمح لتصور كل حدث والقضاء على أي إيجابية كاذبة أو السلبيات كاذبة (مثل الحلل أو خلايا المستجيب). ويمكن الانتهاء من هذا العمل في حوالي 4 ساعات، ويسمح للحصول على نتائج مستقرة جدا حتى عند التعامل مع العينات البشرية. عندما تكون متاحة، يمكن للفرق البحثية اختبار عدة تدخلات التجريبية في المواد البشرية، ومقارنة القياسات عبر عدة نقاط وقت دون التأثير على سلامة البيانات و.
Introduction
الخلايا القاتلة الطبيعية تشكل عنصرا أساسيا من نظام المناعة الفطري. في حين أنها تنظم جدا، لديهم القدرة على التعرف والقضاء على الخلايا الشاذة من خلال الاتصال خلية الى خلية ودون تفعيل مسبق 1. على هذا النحو، فإنها تشكل خط سريع من الدفاع ضد الالتهابات. ممارسة، وخاصة مكثفة، وقد تبين لخفض عابر جهاز المناعة 2، 3، 4، 5. الخلايا القاتلة الطبيعية معرضة بشكل خاص لهذا الغرض 4، 6، 7، على نحو فعال خلق نافذة تعزيز حساسية للمرض. ومن هنا فإن دراسة التدخلات قبل أو أثناء أو بعد ممارسة التمرينات الرياضية بهدف الحد من تأثيرها على وظيفة الخلايا القاتلة الطبيعية هي ذات أهمية خاصة لرفاه الرياضيين بعد المسابقات.
= "jove_content"> ومع ذلك، معقد دراسة مثل هذه التدخلات من قبل العديد من العوامل: 1) الخلايا القاتلة الطبيعية هي متفرق 8، في حوالي 1٪ من مقصورة خلايا الدم البيضاء. 2) الخلايا القاتلة الطبيعية حساسة جدا للإجهاد وتعتمد على التعرض المستمر لظروف فسيولوجية لتبقى قابلة للحياة ومستقرة خلال التجريب. و3) فحوصات القياسية لتحديد NK الخلايا السمية الخلوية، مثل التدرجات Ficoll 9 والافراج عن المقايسات 10، لا يعول عليها وغير متناسقة. التنوع الكامن من العينات البشرية تفاقم فقط هذه القضايا. العينات البشرية الطازجة التي تم جمعها خلال التدخلات التنظيم إلى حد ما ويصعب الحصول، على الأقل بالمقارنة مع العينات الحيوانية أو خطوط الخلايا خلد. وهذا يقلل من فرص تكرار التجارب أو إضافة المشاركين في مجموعة الدراسة للوصول إلى عتبات ذات دلالة إحصائية. بشكل جماعي، ودعم هذه القضايا الحاجة إلى وجود بروتوكول مبسط يسمح FOص كل من الإنتاجية العالية وتحليل عالية الموثوقية من NK نشاط الخلايا التحللي في العينات البشرية.
أنشأنا سير العمل الذي يقصر الوقت اللازم لتحديد وعزل الخلايا واختبار NK من الدم الكامل البشري مع تقليل التعرض لعوامل خارجية. الطريقة المثلى لاستخدام أداتين، فارز مقرها المغناطيسي خلية وتدفق التصوير الكريات، و، إلى أقصى حد T-فحص معين: نسبة E للسماح للكشف عن ارتفاعات أو انخفاضات NK الخلايا السمية الخلوية.
Protocol
ملاحظة: أجريت جميع إجراءات جمع الدم وفقا للمبادئ التوجيهية التي وضعتها جامعة ولاية الآبالاش (ASU) لجنة المراجعة المؤسساتية (IRB).
1. جمع الدم كله
- هل لديك فصاد مصدقة رسم الدم وفقا لتوجيهات منظمة الصحة العالمية.
- سحب الدم إلى واحدة 4 مل أنبوب جمع الدم التي تحتوي على حمض دي البوتاسيوم Ethylenediaminetetraacetic (K 2 EDTA). عكس أنبوب جمع الدم وفقا لتعليمات الشركة الصانعة. حافظ على أنبوب جمع الدم في درجة حرارة الغرفة على مقعد بين كبار الروك حتى الانفصال.
2. إعداد الخلايا المستهدفة وصفت ديو-
- تنمو K562 الخلايا في كامل Iscove في التعديل Dulbecco وسائل الإعلام (IMDM) تستكمل مع المصل 10٪ بقري جنيني (FBS) و 1٪ البنسلين الستربتوميسين لعدة أسابيع السابقة لفحص للتأكد من صحة الخلايا. ضبط ويركزأيون الخلايا إلى 3 × 10 5 خلية / مل يوميا من خلال استكمال خلية العد ومرور لاحق من الخلايا. إجراء تغيير وسائل الإعلام كاملة كل 2 إلى 3 أيام.
- في يوم الفحص، إجراء تعداد خلايا باستخدام 1: 1 عدادة الكريات.
- إزالة 10 ميكرولتر من القارورة K562 ومكان في أنبوب 1.5 مل.
- إضافة 10 ميكرولتر من صبغة زرقاء التريبان في نفس أنبوب 1.5 مل لعامل التخفيف من 1: 1.
- بلطف أنبوب نفض الغبار إلى المزيج K562 الخلايا والتريبان صبغة زرقاء.
- السماح K562 خلايا التريبان صبغة زرقاء لاحتضان لمدة 1 دقيقة في درجة حرارة الغرفة.
- إزالة 15 ميكرولتر من خلايا K562 الملون من الأنبوب.
- ماصة على عدادة الكريات لعدد خلايا.
- عدد الخلايا في الساحات الزاوية أربعة فضلا عن ساحة الأوسط ليصبح المجموع خمسة مربعات.
- حساب عدد الخلايا باستخدام المعادلة:
مجموع خلية / مل = مجموع الخلايا عدها X (عامل تخفيف / عدد المربعات) X 10000 / مل
- الخلايا المستهدفة و resuspend K562 في مناطق ذات كثافة النهائية من 1 × 10 6 خلية / مل في المصل مستنبت IMDM مجانا.
- لغير ملوثين خلايا K562 المستهدفة، إضافة 10 مل من الخلايا المستهدفة K562 إلى واحد 15 مل أنبوب في مناطق ذات كثافة من 1 × 10 6 خلية / مل ليصبح المجموع 10 × 10 6 K562 الخلايا. المكان الى 37 درجة مئوية مع حاضنة 5٪ CO 2 لتصبح جاهزة للاستخدام.
- للخلايا المستهدفة ديو الملون K562، إضافة 10 مل من K562 يستهدف الخلايا لواحد 15 مل أنبوب في مناطق ذات كثافة من 1 × 10 6 خلية / مل ليصبح المجموع 10 × 10 6 K562 الخلايا.
- إضافة 1 ميكرولتر من ديو خلية وضع العلامات حل لكل مليلتر من التعليق الخلية في أنبوب 15 مل المخصصة لديو تلطيخ وبلطف دوامة. على سبيل المثال، إضافة 10 ميكرولتر من ديو خلية وضع العلامات حل ل10 × 10 6 K562 خلية / مل في حجم 1 × 10 6 خلية / مل.
- حل احتضان K562-ديو لمدة 20 دقيقة عند 37 درجة مئوية مع 5٪ CO 2 في أنبوب 15 مل.
- إتبعجي الحضانة، إضافة 3 مل من المياه المالحة الفوسفات مخزنة في درجة حرارة الغرفة (PBS) إلى حل K562-ديو تحتوي على 15 مل أنبوب.
- أجهزة الطرد المركزي لمدة 10 دقيقة في 135 x ج في درجة حرارة الغرفة.
- إزالة بعناية طاف دون الإخلال بيليه الخلية مع 1000 ميكرولتر-حجم قابل للتعديل ماصة.
- إضافة 10 مل من IMDM جديدة لخلية بيليه التي تحتوي على 15 مل أنبوب.
- بلطف أنبوب دوامة resuspend الخلايا.
- كرر الخطوات من 2،7-2،10 مرتين أخريين.
- تخزين الخلايا في الحاضنة 37 درجة مئوية مع 5٪ CO 2 لتصبح جاهزة للاستخدام.
ملاحظة: خلايا يمكن تخزينها في الحاضنة لمدة تصل إلى 24 ساعة ولكن من الأفضل لاستخدامها في نفس اليوم.
3. إعداد الضوابط
- نقل التالية في منفصلة وصفت بشكل مناسب 1.5 مل أنابيب:
- إضافة 500 ميكرولتر من IMDM الطازجة التي تحتوي على معلق ديو المسمى K562 الخلايا في "إيجابي مزدوجة" المسمى 1.5 مل أنبوب.
- إضافة 500 ميكرولتر من IMDM الطازجة التي تحتوي على معلق الخلايا K562 المسمى ديو-في "ديو فقط" وصفت أنبوب 1.5 مل.
- إضافة 500 ميكرولتر من IMDM الطازجة التي تحتوي على خلايا K562 غير المسماة معلق في "التأيد Propidium (PI) فقط" وصفت أنبوب 1.5 مل.
- وضع إيجابي مزدوج و PI أنابيب فقط في 55 ° C حمام الماء لمدة 5 دقائق.
- بعد انقضاء مدة 5 دقائق، وإزالة الأنابيب ومسح أسفل مع الايثانول 70٪.
- إضافة 10 لتر من PI إلى إيجابي مزدوج و PI 1.5 مل أنابيب.
- وضع جميع الضوابط الخلية المستهدفة K562 ثلاثة في الحاضنة عند 37 درجة مئوية لمدة 30 دقيقة.
- بعد انقضاء حضانة 30 دقيقة، الطرد المركزي جميع الضوابط الخلية المستهدفة ثلاثة K562 لمدة 2 دقيقة على 163 ز س.
- إزالة بعناية طاف دون الإخلال بيليه الخلية.
- resuspend كل سيطرة مع 20 ميكرولتر من وسائل الإعلام الجديدة زراعة الخلايا IMDM، وترك في الحاضنة 37 درجة مئوية مع 5٪ CO 2 على الأقل30 دقيقة للإشارة ديو المثلى.
ملاحظة: يتم التحكم في الآن جاهزة للتشغيل من خلال تدفق التصوير الكريات.
4. NK خلية الفصل الآلي
- بدوره على فاصل الخلايا وتسمح للدورة البدء وحتى النهاية.
- التأكد من أن جميع زجاجات إضاءات السوائل هي الخضراء والتي الزجاجة النفايات فارغة.
- الحصول على درجة حرارة الغرفة 15 مل أنبوب الرف.
ملاحظة: اختيار هو بناء على أحجام العينة. على سبيل المثال، لحجم أقل من 3 مل استخدام أنبوب رف 15 مل وبلغ حجم التداول أكثر من 3 مل استخدام 50 مل أنبوب الرف. - أنابيب العينات التسمية وفقا لذلك (كرر لكل عينة / مشارك): مشارك 1 كامل عينة الدم. مشارك 1 جزء السلبية؛ مشارك 1 جزء إيجابي.
- ماصة بلطف 1.5 مل من الدم الكامل من الخطوة 1.2 إلى "الجامع لعينة الدم" 15 مل أنبوب.
- وضع المسمى بشكل مناسب 15 مل "الجامع لعينة الدم" أنبوب من الخطوة 4.5 والمسمى 15 مل "جزء سلبي" و"جزء إيجابي" أنابيب من الخطوة 4.4 في رف أنبوب. استخدام thefollowing عينة رف انشاء: صف (R1) A: كامل عينة الدم، صف (R2) ب: السلبية، جزء الخالي من الملصقات، صف (R4) C: إيجابي، جزء المسمى مغناطيسيا.
- إدراج رف فاصل على MiniSampler لautolabeling.
- حدد "الكاشف" في القائمة، وتسليط الضوء على موقف حيث سيتم وضع القارورة في الرف الفاصل.
- حدد "اقرأ الكاشف" لتفعيل قارئ رمز 2D.
- ضع القارورة كاشف المناسبة أمام قارئ رمز 2D بين 0،5-2،5 سم من غطاء قارئ رمز.
ملاحظة: على سبيل المثال، كاشف اللازمة لفصل الخلايا القاتلة الطبيعية هو CD56. - عقد كاشف قارورة في زاوية أمام 2D قارئ رمز للقراءة الأمثل.
- ضع القارورة كاشف في موقف فاصل الرف المناسب.
- تسليط الضوء على المواقف المطلوبة تحت علامة التبويب فصل على الشاشة.
- من القائمة الفرعية وصفها، تعيين الاتحاد الافريقيبرنامج tolabeling.
- تعيين الفاصل خلية ميكروبيدات الكاشف CD56 على الرف المواقف 1 و 2 و 3 و 4.
- حدد "posselwb" برنامج الفصل.
- حدد البرنامج "شطف" غسل.
- اضافة الى وجود حجم عينة من 1500 ميكرولتر في القائمة الفرعية "حجم" باستخدام لوحة المفاتيح الرقمية.
- حدد الخيار "أدخل" على لوحة المفاتيح.
- حدد "تشغيل" لبدء فصل الخلية.
- حدد "موافق" لتأكيد هذا المخزن غير كافية لمعالجة جميع العينات.
5. NK عدد خلايا الانفصال بعد خلية
- مباشرة بعد فصل الخلية مع فاصل الخلايا، استرداد جزء إيجابي. ترك في درجة حرارة الغرفة. يحتوي هذا الجزء النقي السكان الخلايا القاتلة الطبيعية المرجوة.
- لكل عينة على حدة، إجراء تعداد خلايا باستخدام عدادة الكريات كما في الخطوة 2.2.
- بعد الحسابات، تسجيل عدد خلايا.
6. السمسة الفحص تحضير عينة
- تحضير تسمية أنابيب 1.5 مل لكل عينة / مشارك وفقا لذلك.
- ماصة المرجوة نسبة الخلايا القاتلة الطبيعية والخلايا K562 صفت ديو-في كل أنبوب.
ملاحظة: على سبيل المثال، فإن نسبة المطلوب من الخلايا المستهدفة K562 والخلايا المستجيب NK هي 1: 5. - أجهزة الطرد المركزي لمدة 5 دقائق في 135 ز س.
- إزالة بعناية طاف دون الإخلال بيليه الخلية.
- وصفت و resuspend NK-ديو K562 خليط الخلية في 500 ميكرولتر من وسائل الاعلام الخلايا القاتلة الطبيعية دون انترلوكين 2 (IL-2) و 2 المركابتويثانول (2-ME) (غير مكتمل NK سائل الإعلام ثقافة الخلية).
ملاحظة: NK سائل الإعلام ثقافة الخلية ناقصا هو الحد الأدنى الضروري المتوسطة النسر مع بيكربونات الصوديوم، دون L-الجلوتامين، ribonucleosides وdeoxyribonucleosides. - إضافة 5 ميكرولتر من PI إلى كل أنبوب.
- أجهزة الطرد المركزي لمدة 2 دقيقة على 163 ز س.
- احتضان الخلايا عند 37 درجة مئوية لمدة 2 ساعة.
- بعد 2 ساعة الحضانة، centrifuجنرال الكتريك لمدة 2 دقيقة على 163 ز س.
- إزالة بعناية طاف دون الإخلال بيليه الخلية.
- Resuspend الخلايا في 25 ميكرولتر ناقصة وسائل الإعلام ثقافة الخلايا القاتلة الطبيعية.
7. إعداد العفوي ( "S") عينة
- ماصة 500 ميكرولتر من خلايا K562 المسمى ديو (تركيز 1 × 10 6 خلية / مل) في أنبوب 1.5 مل.
- إضافة 10 ميكرولتر من PI إلى كل أنبوب.
- أنبوب الطرد المركزي لمدة 2 دقيقة على 163 ز س.
- احتضان الخلايا عند 37 درجة مئوية لمدة 2 ساعة.
- بعد 2 ساعة الحضانة، الطرد المركزي لمدة 2 دقيقة على 163 ز س.
- إزالة بعناية طاف دون الإخلال بيليه الخلية.
- Resuspend الخلايا في 25 ميكرولتر ناقصة الأساسية المتوسطة (α-MEM) وسائل الإعلام ثقافة الخلية ألفا الحد الأدنى.
8. الحصول على البيانات مع التصوير تدفق عداد الكريات
- اضغط على الزر الأخضر داخل الباب الأمامي للتصوير تدفق عداد الكريات لتشغيل الأداة.
- بدوره على قناةأجهزة الكمبيوتر ل المرتبطة التصوير تدفق عداد الكريات.
- إطلاق تدفق التصوير الكريات البرمجيات.
- انقر فوق زر "بدء التشغيل" لطرد النظام وإعداد خط العينة.
- مرة واحدة في "بدء التشغيل" غير كاملة، وإغلاق خارج "المعايرة" نافذة.
- تعيين القنوات: في أعلى الجانب الأيسر مباشرة، انقر على كل قناة من أجل التنازل عنها.
- على الجانب الأيسر، انقر على زر مؤامرة مبعثر لإنشاء 4 scatterplots: الخام ماكس بكسل _MC_6 مقابل Area_M06، الخام ماكس بكسل _MC_2 مقابل Area_M02، الخام ماكس بكسل _MC_5 مقابل Area_M05 وFieldArea_M01 مقابل AspectRatio_M01.
- بدء تحليل العينات التي لأول مرة باستخدام "مزدوجة إيجابي" السيطرة.
- انقر على "تحميل".
- وضع أنبوب 1.5 مل مع عينة "مزدوجة إيجابي" من خطوات 3،4-3،9 في محمل العينة.
- حدد الهدف 40X تحت علامة التبويب "التكبير".
- تشغيل ميغاواط 405 و642 ليزر ميغاواط.
- بدوره على قناة "Brightfield".
- انقر على "تحديد كثافة."
- واستنادا إلى "نقرا إيجابي" عينة السيطرة، وتحديد كثافة المطلوبة ليزر 405 ميغاواط حتى لا طاقتها كاشف.
ملاحظة: على سبيل المثال، تم تعيين كثافة الأمثل لهذه التجربة في 11 ميغاواط.
- بعد تحقق المطلوب انشاء وحيازة البيانات.
- تحت علامة التبويب "اكتساب ملف"، أدخل في النص اسم الملف المخصصة. تحديد مجلد لحفظ ملف البيانات (ق).
- أدخل عدد من الخلايا لاكتساب بجانب "اجمع". وعادة ما يختلف هذا العدد بين 1000 إلى 10000.
- انقر على "اكتساب".
ملاحظة: عندما يتم الحصول على العدد المطلوب من الخلايا، يتم حفظ ملف البيانات تلقائيا في المجلد المحدد سابقا.
- بعد انتهاء الاستحواذ، تحميل عينة التحكم التالي - ديو مراقبة فقط.
- انقر على "تحميل".
- وضع أنبوب 1.5 مل مع "ديو فقط" العينة إلى محمل العينة.
- ترك الهدف 40X تحت عنوان "التكبير" علامة التبويب المحددة.
- ترك ليزر 405 ميغاواط قيد التشغيل.
- إيقاف الليزر ميغاواط 642 و قناة "Brightfield".
ملاحظة: الآن بعد أن المطلوب انشاء تم تحقيقها، يمكن الحصول على البيانات. - تحت علامة التبويب "ملف اقتناء"، أدخل في النص اسم مخصص وحدد مجلد لحفظ ملف البيانات (ق). أدخل عدد من الخلايا لاكتساب بجانب "اجمع". عادة هذا الرقم هو 1000.
- انقر على "اكتساب".
ملاحظة: عندما يتم الحصول على العدد المطلوب من الخلايا يتم حفظ ملف البيانات تلقائيا في المجلد المحدد سابقا.
- كرر الخطوة 8.10 ل "بي فقط" العينة الضابطة. العينات التجريبية هي الآن جاهزة للجمع.
- التعامل مع remainiنانوغرام العينات التجريبية، بما في ذلك "عينات عفوية 'S'" على النحو التالي:
- ترك الهدف 40X تحت عنوان "التكبير" علامة التبويب المحددة.
- بدوره على 405 ميغاواط و 642 ميغاواط ليزر.
- بدوره على قناة "Brightfield".
- انقر على "تعيين كثافة."
- تحت علامة التبويب "ملف اقتناء"، أدخل في النص اسم مخصص وحدد مجلد لحفظ ملف البيانات (ق). أدخل في النص اسم الملف المخصصة.
- أدخل عدد من الخلايا لاكتساب بجانب "اجمع".
- انقر على زر "اكتساب".
ملاحظة: عندما يتم الحصول على العدد المطلوب من الخلايا يتم حفظ ملف البيانات تلقائيا في المجلد المحدد سابقا.
- كرر الخطوة 8.12 لجميع العينات التجريبية.
- بعد أن تم جمع كافة البيانات والملفات التجريبية، انقر فوق زر "إيقاف" لتعقيم النظام.
9. IMAGINتحليل عينة ز تدفق عداد الكريات
- فتح تدفق التصوير الكريات تطبيق برامج التحليل.
- تحت عنوان "ملف"، فتح ملف .RIF التجريبية.
- بناء مصفوفة جديدة باستخدام ملفات .RIF لون واحد (ديو فقط مراقبة وضبط PI الوحيد الذي انشئ خلال الخطوات 8.10 و 8.11) عن طريق اختيار "إنشاء مصفوفة الجديد" تحت علامة التبويب التعويض في تدفق التصوير الكريات البرمجيات.
ملاحظة: سوف يقوم البرنامج يدفع لاختيار الملفات لون واحد ودمجها لإنشاء ملف مصفوفة (ملحق الملف .ctm)، وهذا هو التي سيتم اختيارها لتطبيق التعويض القناة. - خلق المؤامرات نقطة باستخدام وظيفة "لبنات البناء" من البرنامج.
- إنشاء نقطة مؤامرة (BrightFieldGradient_RMS مقابل التردد) إلى بوابة الخلايا مركزة. استدعاء بوابة "فوكوس" (الشكل 1A).
- عن طريق بوابة "التركيز"، وخلق نقطة مؤامرة من منطقة الميدان برايت مقابل الميدان برايت نسبة الارتفاع إلى ز أكل الخلايا القميص. استدعاء بوابة "واحدة" (الشكل 1B).
- استخدام بوابة "واحدة"، وخلق مؤامرة نقطة من Intensity_MC_Ch02 مقابل Intensity_MC_Ch5. استخدام هذا المخطط لتحديد وبوابة خلايا إيجابية المزدوج (الأهداف، ميتة) ديو إيجابية الخلايا فقط (الأهداف، على قيد الحياة) وPI-ديو (الشكل 1C).
ملاحظة: جميع المؤامرات وصفها في الخطوات 9.4.1، 9.4.2، 9.4.3 ويمكن إنشاؤها باستخدام وظيفة "لبنات البناء" من البرنامج.
- انقر على وظيفة إحصاءات مؤامرة نقطة للوصول إلى أرقام الهواتف المحمولة من كل باب.
- حساب النسبة المئوية من الأهداف الميتة في العينة العفوية والعينات التجريبية باستخدام الصيغة التالية:
أهداف الميتة٪ في العينة = (الأهداف #dead × 100) / (# يعيش أهداف + #dead الأهداف) - حساب السمية الخلوية باستخدام الصيغة التالية:
٪ السمية الخلوية = [(التجريبية القتلى عفوية القتلى) / (القتلى 100 العفوي)] X100
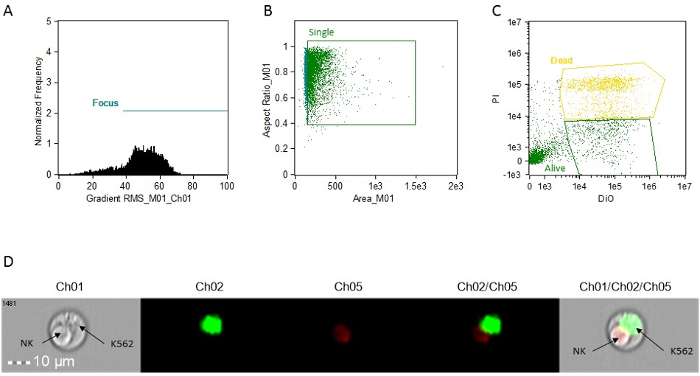
الشكل 1: رسوم بيانية التمثيلية والمؤامرات مبعثر والصور لتحليل النشاط السامة للخلايا. تحليل (أ) خلية التركيز. (ب) تحليل خلية واحدة. تحليل (C) هدف الخلية تلطيخ. كلها مصنوعة قرارات باستخدام صورة مرفقة كل حدث. هذا ويمكن الوصول إليها في برامج التحليل ببساطة عن طريق النقر على الحدث على الرسوم البيانية. (D) صورة تمثيلية لحدث صدرة، والتي تبين خلية NK أفكارك والهدف K562 الحية. CH01، Brightfield. CH02، ديو. Ch05، PI. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
تحديد عدد الخلايا القاتلة الطبيعية
وقد تم قياس تأثير تشغيل ثقيلا على عدد الخلايا القاتلة الطبيعية في الدم الكامل، وذلك باستخدام بروتوكول ممارسة موضح في الشكل (2). تم سحب عينات من الدم قبل ممارسة، وعلى الفور بعد ممارسة الرياضة، و 1.5 ساعة ?...
Discussion
الطريقة الموصوفة في هذه الدراسة يقيس بشكل مباشر على نشاط محدد من الخلايا القاتلة الطبيعية الفرد في الاستجابة للمؤثرات (في هذه الحالة بالذات، وممارسة لفترات طويلة). عادة، يتم عزل الخلايا القاتلة الطبيعية من دم واحد باستخدام تدرجات الكثافة أو الفرز الخلية باستخدام مز...
Disclosures
The authors have nothing to disclose.
Acknowledgements
This project was supported by Agriculture and Food Research Initiative Competitive Grant no. 2100-68003-30395 from the USDA National Institute of Food and Agriculture.
Materials
| Name | Company | Catalog Number | Comments |
| K-562 lymphoblasts | ATCC | CCL-243 | |
| Iscove's Modified Dulbecco's Media | ATCC | 30-2005 | High glucose, with L-Glutamine, with HEPES, Sterile-filtered |
| Alpha Minimum Essential medium | ATCC | CRL-2407 | Without ribonucleosides and deoxyribonucleosides but with 2 mM L-glutamine and 1.5 g/L sodium bicarbonate |
| Trypan Blue Solution 0.4% | Amresco | K940-100ML | Tissue culture grade |
| Propridium Iodide Staining Solution | BD Pharmingen | 51-66211E | |
| Vybranto DiO cell-labeling solution | Vybranto | V-22886 | |
| autoMACS Pro Separator | Miltenyi Biotec | 130-092-545 | |
| autoMACS Running Buffer | Miltenyi Biotec | 130-091-221 | |
| autoMACS Washing Buffer | Miltenyi Biotec | 130-092-987 | |
| autoMACS Columns | Miltenyi Biotec | 130-021-101 | |
| Whole Blood CD56 MicroBeads, human | Miltenyi Biotec | 130-090-875 | |
| ImageStream X Mark II Imaging Flow Cytometer | EMD Millipore | ||
| Speedbeads | Amnis Corporation | 400030 | |
| 0.4-0.7% Hypochlorite (Sterilizer) | VWR | JT9416-1 | |
| Coulter Clenz | Beckman Coulter | 8546929 | |
| 70% Isopropanol (Debubbler) | EMD Millipore | 1.3704 | |
| D-PBS (Sheath fluid) | EMD Millipore | BSS-1006-B (1X) | No calcium or magnesium |
| INSPIRE Software | EMD Millipore | Version Mark II, September 2013 | |
| Ideas Application Software | EMD Millipore | Version 6.1, July 2014 |
References
- Cerwenka, A., Lanier, L. L. Natural killer cells, viruses and cancer. Nat Rev Immunol. 1 (1), 41-49 (2001).
- Nieman, D. C. Exercise, infection, and immunity. Int J Sports Med. 15, 131-141 (1994).
- Romeo, J., Warnberg, J., Pozo, T., Marcos, A. Physical activity, immunity and infection. Proc Nutr Soc. 69 (3), 390-399 (2010).
- Nieman, D. C. Marathon training and immune function. Sports Med. 37 (4-5), 412-415 (2007).
- Simpson, R. J., Kunz, H., Agha, N., Graff, R. Exercise and the Regulation of Immune Functions. Prog Mol Biol Transl Sci. 135, 355-380 (2015).
- Walsh, N. P., et al. Position statement. Part one: Immune function and exercise. Exerc Immunol Rev. 17, 6-63 (2011).
- Timmons, B. W., Cieslak, T. Human natural killer cell subsets and acute exercise: a brief review. Exerc Immunol Rev. 14, 8-23 (2008).
- Westermann, J., Pabst, R. Distribution of lymphocyte subsets and natural killer cells in the human body. Clin Investig. 70 (7), 539-544 (1992).
- Boyum, A. Isolation of leucocytes from human blood. Further observations. Methylcellulose, dextran, and ficoll as erythrocyteaggregating agents. Scand J Clin Lab Invest Suppl. 97, 31-50 (1968).
- McMillan, R., Scott, J. L. Leukocyte labeling with 51-Chromium. I. Technic and results in normal subjects. Blood. 32 (5), 738-754 (1968).
- Berk, L. S., et al. The effect of long endurance running on natural killer cells in marathoners. Med Sci Sports Exerc. 22 (2), 207-212 (1990).
- McAnulty, L. S., et al. Effect of blueberry ingestion on natural killer cell counts, oxidative stress, and inflammation prior to and after 2.5 h of running. Appl Physiol Nutr Metab. 36 (6), 976-984 (2011).
- Millard, A. L., et al. Brief Exercise Increases Peripheral Blood NK Cell Counts without Immediate Functional Changes, but Impairs their Responses to ex vivo Stimulation. Front Immunol. 4, 125 (2013).
- Janeway, C. A., Travers, P., Walport, M., Shlomchik, M. J. . Immunobiology: The Immune System in Health and Disease. 5th edn. , (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved