Method Article
استخدام 3D تكنولوجيا الطباعة لدمج التصوير بالرنين المغناطيسي مع الأنسجة: بروتوكول لالدماغ باجتزاء
In This Article
Summary
ويتمثل الهدف العام من هذا البروتوكول هو محاذاة بدقة التصوير بالرنين (التصوير بالرنين المغناطيسي) مجلدات صورة المغناطيسية مع أقسام الأنسجة عن طريق إنشاء أصحاب الدماغ مطبوعة 3D حسب الطلب وصناديق تقطيع اللحم.
Abstract
Magnetic resonance imaging (MRI) allows for the delineation between normal and abnormal tissue on a macroscopic scale, sampling an entire tissue volume three-dimensionally. While MRI is an extremely sensitive tool for detecting tissue abnormalities, association of signal changes with an underlying pathological process is usually not straightforward. In the central nervous system, for example, inflammation, demyelination, axonal damage, gliosis, and neuronal death may all induce similar findings on MRI. As such, interpretation of MRI scans depends on the context, and radiological-histopathological correlation is therefore of the utmost importance. Unfortunately, traditional pathological sectioning of brain tissue is often imprecise and inconsistent, thus complicating the comparison between histology sections and MRI. This article presents novel methodology for accurately sectioning primate brain tissues and thus allowing precise matching between histology and MRI. The detailed protocol described in this article will assist investigators in applying this method, which relies on the creation of 3D printed brain slicers. Slightly modified, it can be easily implemented for brains of other species, including humans.
Introduction
In vivo MRI provides a noninvasive and sensitive measure of tissue integrity at the macroscopic level. Changes in MRI signal intensity seen in vivo are outcome measures in many ongoing clinical trials.1 While the intensity changes seen via MRI can identify areas of abnormality in the context of the whole brain, they are often not sufficiently specific to differentiate pathological processes. This is especially true of dynamic processes involving multiple pathologies. For example, in multiple sclerosis (MS) or its animal model, experimental autoimmune encephalomyelitis (EAE), inflammation, edema, myelin degradation, axonal destruction, gliosis, and neuronal death overlap. 2, 3 To obtain the necessary specificity regarding the underlying pathology, context must be taken into account, together with knowledge of the histology of the MRI-identified abnormal tissues.
However, even in well-controlled animal experiments, matching histology with in vivo MRI is fundamentally challenging for various reasons. First, the difference in dimensional scales between histology sections and MRI is of several orders of magnitude.4 Second, for proper comparison, the orientation of MRI slice plane must match the sectioning plane of the brain tissue when cut. Due to the shape of the brain, it is very difficult to make consistently straight and accurate cuts when the brain is sitting on a flat surface. Third, the large size of the brain relative to a potentially small area of interest (lesion, tumor, etc.) creates a "needle-in-a-haystack" scenario for the pathologist processing the tissue. Fourth, even when the target tissue is found, it is commonly processed in such a way as to render virtually impossible an association with the original MRI data. Finally, traditional pathological sectioning of brain tissue is often imprecise and inconsistent, further complicating the comparison between histology sections and MRI images.
Previous attempts to overcome these challenges relied on the use of deformational algorithms to coregister the data and/or placement of fiducial markers within or around the tissue as a reference.5, 6, 7, 8 The former approach requires complex computational models that are particularly susceptible to complications due to data formatting, imaging artifacts, and changes caused by tissue processing.4 On the other hand, the latter approach introduces the possibility of contaminating or otherwise harming the tissue itself.9
The approach described here improves the transition between modalities through the use of postmortem MRI to bridge the gap between in vivo MRI and histology. Postmortem MRI provides three-dimensional (3D) images of the brain at higher resolution than can be achieved in vivo and furthermore provides the data needed for producing a morphologically accurate model of the brain surface. This digital model can then be used to create a 3D-printed custom holder for the brain. With careful positioning, the brain holder allows for precise, MRI-oriented brain sectioning, reducing the need for complex mathematical algorithms, and enables a focus on specific regions for targeted sampling.
Our laboratory recently introduced new methods for creating custom brain holders and slicers using postmortem MRI and 3D-printing technology for human10 and marmoset brains.4 The two methods allow for a more accurate correlation between MRI and histology in a research setting, and ultimately allow a deeper understanding of the specific pathology underlying MRI abnormalities. Carefully designed experiments, in which the brain is sampled repeatedly over time in vivo, can provide context for interpretation of the pathology, which in turn can add specificity to interpretation of the MRI. Here, we present a modified protocol in a unified framework that can be applied to any brain tissue, whether it derive from nonhuman primates, rodents, or humans. We provide detailed instructions, and a corresponding video, for the marmoset sectioning. Although the overall protocol applies to any type of brain, due to differences in MRI acquisition and tissue size, as well as the challenges encountered when dealing with specific brain types, there are some differences in the approach depending on the type of brain being processed. In this presentation, sections with "human" will denote differences in protocol specific to the human brain.
Protocol
تم تنفيذ جميع التعامل والإجراءات المبينة في هذه الوثيقة الحيوانية وفقا لبروتوكول المعتمد من قبل المعهد الوطني للاضطرابات العصبية والسكتة الدماغية رعاية الحيوان واللجنة الاستخدام. جمعت العقول من قشة مألوفة (Callithrix jacchus) التي يسببها لتطوير EAE. تم تخزين 11 أدمغة في 10٪ من الفورمالين لمدة تتراوح بين 3 أسابيع وسنة واحدة بعد القتل الرحيم التي نضح transcardial من 4٪ لامتصاص العرق.
1. تشريح التصوير بالرنين المغناطيسي إعداد واكتساب
- القشة قرد أميركي الدماغ
- إعداد محطة عمل مع الشاش والقطن، 50 مل أنبوب الطرد المركزي، ملاعق صغيرة، ~ 30 مل من زيت المفلورة، البارافين، والدماغ القشة قرد أميركي.
- ملء أنبوب للنفط المفلورة والشاش على علامة 20 مل. ضغط الشاش لإزالة فقاعات الهواء على طول الطريق.
- الفورمالين الجافة بلطف من سطح الدماغ مع منشفة ورقية. إدراج الدماغ مع القطب الأمامي باتجاه الجزء السفلي منانبوب. تأمين بعناية الدماغ في أنبوب استخدام المزيد من الشاش حول الجانبين لتحديد موقفها. الرجوع إلى قسم تكميلي 11 لطريقة لإنشاء مهد الدماغ بالرنين المغناطيسي من أجل الإعداد لفحوصات الرنين المغناطيسي إضافية.
- ملء ما تبقى من الأنبوب مع الشاش والنفط المفلورة. إزالة بعناية فقاعات الهواء على طول الطريق. تأمين الغطاء وختم أنبوب مع البارافين.
- بمناسبة سقف تمشيا مع الشق بين نصفي المخ. التفاف أنبوب في منشفة ورقية وأدخله في لفائف مع علامة أعلى مركز.
- الحصول 2D تدور T2 الصدى. يتم إعطاء المعلمات في الجدول 1.
- فتح 10 التشريحية 150 ميكرون عمليات استحواذ weigted T2 في Mipav وسجل لاكتساب ال 6.
ملاحظة: التسجيل هو التلقائي خوارزمية تسجيل 3.5D الأمثل مع 9 درجات الحرية، إطارات الاستيفاء سينك، تطبيع عبر دالة التكاليف الارتباط، مع الدعوة خوارزمية البحث برنت في لباول. وأخذت عينات من التناوب من +106؛ إلى -10 درجة مع تناوب الخشنة تزايد 5 درجات وتناوب غرامة تزايد 1 °. ثم المتوسط الصور المسجلة: المرافق، صورة حاسبة السائبة الصور، متوسط.
- العقل البشري
- فصل الدماغ الأمامي من الدماغ باستخدام قطع على مستوى المخ الأوسط. ويمكن أيضا أن 10 نصفي الكرة الأرضية يمكن فصلها مع خفض أسفل خط الوسط.
- ضع الدماغ الأمامي في أنبوب أسطواني مع قبة نصف الكرة الغربي في نهاية واحدة وصنبور في الطرف الآخر.
- ملء الأنبوب مع النفط المفلورة من خلال صنبور. إزالة فقاعات الهواء باستخدام الشفط لطيف ل~ 30 دقيقة من خلال صنبور.
- الحصول 3D T1-MPRAGE. يتم إعطاء المعلمات في الجدول 1.
2. استخراج الدماغ السطحية: Mipav 7.2
- فتح التصوير بالرنين المغناطيسي في اتجاه الاكليلية.
- اختيار الخوارزميات، وأدوات تحول، تحويل، إعادة تجميع عينة عشوائية. تحديد حجم محدد من قبل المستخدم وإعادة تشكيل لisotvoxels ropic: 0.1 X 0.1 X 0.1 ملم. حفظ التصوير بالرنين المغناطيسي الوصله كما Brain_MRI_Resampled. الإنسان: إعادة تجميع عينة عشوائية إلى الخواص voxels 0.3 X 0.3 X 0.3 ملم.
- اختيار الخوارزميات، فلاتر (المكانية)، والحد من الضوضاء غير الخطية. استخدام الإعدادات الافتراضية، انقر فوق موافق.
- اختر عرض جدول البحث وانقر على زر عتبة المزدوج. اسحب المنزلق على الرسم البياني لتغطية كامل الدماغ.
- اختيار الخوارزميات، تجزئة، العتبة، عتبة باستخدام دقيقة / كحد أقصى. أدخل القيمة التي تقع في الزاوية اليسرى السفلى من الرسم البياني كثافة (أقل بقليل من الحجم الكبير) في مربع "الحد الأدنى". حدد "ثنائي" في لنوع الناتج صورة وإلغاء "عتبة المقلوب".
- اختيار الخوارزميات، الصرفي، ملء الثقوب. تحقق "عملية في 2.5D."
- لأن هذا هو التصوير بالرنين المغناطيسي للدماغ كامل، وهناك بعض المساحة الفارغة بين الدماغ المؤخر والقشرة التي تحتاج إلى شغلها. الدماغ البشري: تخطي هذه الخطوة.
- باستخدام خط أصوات العراق، رسم في اتصالبين الدماغ المؤخر والقشرة على جانبي الدماغ في النقطة الأكثر الجانبية. يستمر هذا من خلال الدماغ.
- اختر تحويل أصوات العراق، أصوات العراق، كل إلى قناع ثنائي. حدد الأدوات المساعدة، صورة آلة حاسبة. اختر أو من القائمة المنسدلة المشغل وحدد قناع الدماغ. حدد "تعزيز وجهة نوع الصورة"
- اختيار الخوارزميات، الصرفي، ملء الثقوب. تحقق "عملية في 2.5D"
- حفظ قناع ثنائي مثل Brain_Model.nii.
- اختيار الخوارزميات، سطح استخراج (مكعبات السير). اختر صورة القناع، باستثناء ما Brain_Model.ply.
3. تحديد المواقع شريحة: Mipav 7.2
- تحديد الأنسجة من الاهتمام أو وضع البداية. حساب سماكة البلاطة المقصود. في مارموسيت الدماغ، عد 30 شرائح التصوير بالرنين المغناطيسي في القسم، و 5 شرائح التصوير بالرنين المغناطيسي في الفجوة شفرة، ويخلق 3 أقسام مم مع وجود ثغرات شفرة 0.5 مم، مما أدى إلى ~ ألواح 3.5 مم. دماغ الإنسان: 20 شرائح التصوير بالرنين المغناطيسي في القسم، و 4 التصوير بالرنين المغناطيسي SLالثلوج في فجوة شفرة، ويخلق 6 أقسام مم مع وجود ثغرات شفرة 1.2 مم، مما أدى إلى ~ ألواح 7.2 مم.
- في الموقع من الفجوة شفرة الأولى، انقر على "مربع أصوات العراق"، ومن ثم رسم مربع على الدماغ. انقر داخل منطقة الجزاء لتحديده. نسخ ولصق كفاف لكل شريحة التصوير بالرنين المغناطيسي المقابلة لفجوة شفرة.
- القفز الى الامام من قبل عدد من شرائح التصوير بالرنين المغناطيسي المقابلة لسمك الباب ونسخ ولصق كفاف الموافق الفجوة شفرة القادمة. كرر هذه العملية من خلال الدماغ.
- حدد أصوات العراق، أصوات العراق التحويل، كل لقناع ثنائي. باستثناء ما Blade_Gaps.nii.
- اختيار الخوارزميات، مستخلصات السطحية (مكعبات السير)، صورة قناع، Blade_Gaps.ply.
4. إنشاء التصوير بالرنين المغناطيسي بليد خريطة: Mipav 7.2
- فتح Brain_MRI_Resampled والصور Blade_Gaps.nii.
- مع صورة Blade_Gaps.nii المحدد، حدد الأدوات المساعدة، صورة الرياضيات. حدد تشجيع نوع الصورة وضرب.أدخل 10،000 كقيمة.
- حدد الأدوات المساعدة، صورة حاسبة. حدد إضافة، ثم حدد الصورة Brain_MRI_Resampled من مربع صورة المنسدلة. حدد تعزيز وجهة نوع الصورة.
- حفظ هذه الصورة كما Brain_BladeMap.nii.
- بالضغط على عرض Triplanar، والمواقع التي سيتم شرائح الدماغ يمكن أن ينظر في ثلاث وجهات نظر المتعامدة.
5. استيراد الدماغ وبليد الفجوة السطوح: Netfabb المهنية
- تحديد الجزء، اضافة جزء. اختيار الملفات Brain_Model.ply وBlade_Gaps.ply
- حدد الدماغ وانقر على وضع الإصلاح. في وضع الإصلاح:
- انقر على زر اختيار قذيفة، ومن ثم انقر على الدماغ.
- انقر على زر اختيار تبديل لتحديد تنسجم أخرى. انقر على إزالة لحذف تنسجم أخرى.
- انقر على تطبيق إصلاح، وإزالة الجزء القديم.
- انقر بزر الماوس الأيمن على الدماغ. حدد الخطوة. اضغط علىلزر المنشأ. تسجيل المعلمات XYZ التي تظهر. هناك حاجة لهذه المعلمات الترجمة للحفاظ على وضع الشفرة التي أنشئت في Mipav. انقر على ترجمة. ثم أغلق النافذة. (لا تنقر ترجمة أكثر من مرة، وسوف تترجم مرة أخرى باستخدام نفس المعلمات.)
- حدد نموذج Blade_Gaps. انقر بزر الماوس الأيمن على جزء منه، واختر نقل. أدخل القيم XYZ المسجلة سابقا في صناديق المعلمات XYZ. الآن انقر على الترجمة وإغلاق النافذة.
- حدد نموذج Brain_Model وانقر على وضع إصلاح. في وضع الإصلاح:
- انقر على زر اختيار قذيفة، ومن ثم انقر على الدماغ.
- انقر بزر الماوس الأيمن واختر مثلثات السلس. أدخل 4-5 تكرارات. تحقق منع حجم الانكماش. دماغ الإنسان: 1-2 تكرارات.
- انقر على الحق، حدد الحد المثلثات. أدخل 200000 في عدد مثلث الهدف وانقر فوق تنفيذ.
- انقر على إصلاح تلقائي، وإصلاح افتراضي. ثم انقر على تطبيق إصلاح
- انقر بزر الماوس الأيمن، إعادة تسمية. إعادة تسمية الدماغ ممهدة كما Smoothed_Brain_Model.
- اختر Smoothed_Brain_Model. انقر بزر الماوس الأيمن والتصدير، STL.
6. تحرير الدماغ ملامح: Meshmixer
- استيراد Smoothed_Brain_Model إلى Meshmixer.
- استخدام النحت واختيار الأدوات اللازمة لإجراء تعديلات على الشبكة. وتشمل التعديلات:
- استخدام أدوات النحت وقوية على نحو سلس. تمهيد المنطقة المقابلة لخط VOIS. الدماغ البشري: تخطي هذه الخطوة.
- على نحو سلس سطح القشرة التي سيتم جهه لأسفل في المربع.
- سلس بعيدا ديفوتس الصغيرة التي قد تم إنشاؤها في عملية الربط والتحرير.
- اختر تحليل، المفتش، Autorepair جميع.
- تصدير Smoothed_Brain_Model كما Smoothed_Edited_Brain_Model.
7. إنشاء القطاعة صندوق الدماغ: Netfabb المهنية
- تحديد الجزء، اضافة الجزء. اختيار فيلالبريد Smoothed_Edited_Brain_Model.
- تحديد الجزء، اضافة الجزء. ثم حدد الدماغ ملف المحكمة الخاصة بلبنان القطاعة Parts_Marmoset وانقر فوق فتح. دماغ الإنسان: الدماغ القطاعة Parts_Human (ملفات كود خلفية).
- انقر على الحق في جزء، وحدد الموسعة، المصارف إلى أجزاء. حدد كل جزء على حدة، وانقر بزر الماوس الأيمن على تسميتها. (النقر على العين القادمة إلى كائن يخفي أو يجعلها مرئية.) إعادة تسمية مربع كبير الرئيسي، مربع صغير الفرعية، ومربع قطع Box_Cutout، ومسدس الشكل Blade_Holder_Main، مربع شقة صغيرة مشراح بليد، والنصفي أنبوب مهد الكائن. الدماغ البشري: لا Blade_Holder_Main، مشراح بليد، أو مهد.
- إخفاء الرئيسية، الفرعية، بليد، Blade_Holder_Main، مشراح بليد، ومهد واستخدام التحول حدد لتحديد كافة ست وBox_Cutout. فقط Box_Cutout وSmoothed_Edited_Brain_Model يجب أن تكون واضحة، ولكن لا ينبغي أن يتم اختيار Smoothed_Edited_Brain_Model.
- انقر واسحب أجزاء مختارة لضبط الموقف مربع النسبي إلى الدماغ.
- وضع الدماغ في وسط منطقة الجزاء. فدخلت الدماغ عميقة بما فيه الكفاية في المربع إلى أن يجتاح بإحكام، ولكن ليست عميقة جدا لخلق يتدلى التي تحول دون تحديد المكان المناسب.
- ضعه مرة واحدة، وكفاف مربع الدماغ يمكن اختبار ليتدلى. حدد Box_Cutout وSmoothed_Edited_Brain_Model. اختر منطقية العملية.
- انقر على Smoothed_Edited_Brain_Model لتحويله أحمر.
- اختر منطقية الطرح، وتطبيق العمليات الحسابية.
- ضع علامة في المربع الدماغ ليتدلى من شأنها أن تمنع أنسجة المخ من وضعها بأمان داخل منطقة الجزاء. إذا كانت هذه يتدلى موجودة، وضبط الدماغ لذلك هو أقل عمقا داخل منطقة الجزاء. إذا كان الدماغ هو في العمق ويتدلى المطلوبهي موجودة، راجع قسم تكميلي 10 عن حل لإزالة النتوءات.
- حدد نموذج Blade_Gaps. انقر بزر الماوس الأيمن، اختر نقل. تسجيل القيمة Z الموقف، ثم أغلق النافذة. وسوف يكون هذا الموقف من فجوة شفرة معظم الخلفية.
- حدد STL بليد التي جاءت من أجزاء الدماغ القطاعة. انقر بزر الماوس الأيمن، اختر نقل.
- اختر الترجمة المطلقة. أدخل القيمة Z من 7.8. لقيم X و Y، أدخل القيمة المقابلة من صناديق المعلمة موقف الحالية
- حدد STL بليد. انقر على الحق، انقر المكررة.
- تحقق ترتيب أجزاء. أدخل عدد من ريش العدد الكلي. أدخل نفس الرقم في مربع Z العد. أدخل سمك البلاطة إلى الفجوة Z. انقر على تكرار. إذا كانت تختلف سمك بلاطة، سوف تحتاج إلى وضعه بشكل فردي ريش. تكرار كل شفرة جديدة من السابق (الانتقال من الخلفية إلى الأمامية)مع الفجوة ض مساو لسمك الباب لهذا القسم.
- ضع أجزاء مشراح بليد في تمام نفس الفترات التي ريش في تقطيع اللحم بتكرار الخطوة 7.9 و 7.10 للمشراح بليد. الدماغ البشري: تخطي هذه الخطوة.
- اختر مشراح بليد جنبا إلى جنب مع الجزء Blade_Holder_Main وتحديد عملية منطقية.
- تحديد كافة شفرات في مشراح نصل إلى تسليط الضوء عليها باللون الأحمر. انقر على منطقية الطرح، وتطبيق العمليات الحسابية.
- حدد وضع إصلاح. إجراء إصلاح موسع. اختر تطبيق إصلاح، وإزالة الجزء القديم.
- إعادة تسمية حامل جزء بليد. تصدير جزء منها المحكمة الخاصة بلبنان.
- مفتاح Shift حدد Smoothed_Edited_Brain_Model، كل من النماذج بليد بإنشائه في الخطوة السابقة، واللجنة الفرعية والرئيسية. انقر على عملية منطقية.
- جعل جميع الأجزاء باستثناء الأحمر الرئيسي عن طريق حد ذاتهاlecting لهم والنقر على السهم ضمن المربع الأخضر لنقلها إلى الأحمر.
- اختر منطقية الطرح ثم حدد تطبيق العمليات الحسابية.
- انقر على وضع الإصلاح. في وضع الإصلاح:
- ضع علامة في المربع يتدلى ونقاط حادة. هذه يمكن أن تكون ممهدة في Netfabb أو Meshmixer.
- انقر إصلاح تلقائي، وإصلاح موسع. ثم تطبيق الإصلاح وإزالة الجزء القديم
- انقر بزر الماوس الأيمن على مربع الدماغ إصلاحه وإعادة تسميته الدماغ القطاعة صندوق. تصدير باعتبارها المحكمة الخاصة بلبنان.
8. طباعة القطاعة صندوق الدماغ على Ultimaker 2
- القشة قرد أميركي الدماغ: كورا
- استيراد القطاعة صندوق الدماغ في كورا.
- اختر تدوير وسحب الدائرة لتدوير المربع لذلك هو مسطح على السرير.
- ضبط إعدادات الطباعة: قرار طبقة 0.1 ملم، و 50٪ كثافة التعبئة، الطوافة.
- حدد حفظ أداة الطريق إلى بطاقة SD. (طباعة الوقت ~ 12 ساعة).
- حامل استيراد بليد فيإلى كورا وتناوب عليها حتى فتحات على الجانبين ووجه مسدس هو في XZ أو الطائرة YZ.
- تكرار وجوه.
- ضبط إعدادات الطباعة: قرار طبقة 0.2 مم، و 20٪ كثافة التعبئة، بريم.
- حدد حفظ أداة الطريق إلى بطاقة SD. (وقت طباعة ~ 3 ساعات)
- الدماغ البشري: كورا
- استيراد القطاعة صندوق الدماغ إلى كورا وتدوير كما هو الحال في 8.1.2.
- ضبط إعدادات الطباعة: 0.2 قرار طبقة ملم، 30-35٪ كثافة التعبئة، الطوافة.
- اختر حفظ مسار أداة لبطاقة SD. (وقت طباعة ~ 70 ساعة للمربع نصف الكرة الأرضية واحد.)
- على Ultimaker 2
- تطبيق طبقة رقيقة من الغراء الغراء العصا لبناء اللوحة.
- إدخال بطاقة SD. اختر طباعة وحدد الجزء.
9. قطع المخ
- القشة قرد أميركي الدماغ
- إعداد محطة عمل مع الدماغ ثابتة، وتقطيع اللحم الدماغ، وهما أصحاب شفرة، شفرات مشراح، 1 مل من زيت المفلورة، وملاقط خطوط الطول، والقفازات الواقية، وأشرطة الكاسيت التضمين.
- وضع شفرات مشراح جديدة في فتحات على أصحاب شفرة. تأكد من حافة مشطوف من كل شفرة يواجه في نفس الاتجاه. ارتداء القفازات الواقية عند التعامل مع شفرات مشراح.
- إزالة الدماغ من الفورمالين وجففه برفق.
- وضع الدماغ في تقطيع اللحم. بضع قطرات من زيت المفلورة يمكن تطبيقها على الدماغ وتقطيع للسماح لسهولة تحديد المواقع. تأكد من أن الدماغ هو ثابتا في مكانه.
- ضع أصحاب شفرة مع ريش في فتحات شفرة المقابلة.
- دفع حملة على أصحاب شفرة بحزم وتطبيق بطيئة ضغط التوازن لقطع طريق الدماغ.
- إزالة كل بلاطة، في وقت واحد، بدءا من الجزء الأمامي من الدماغ. فهو يساعد على إزالة شفرة مشراح أمام لوح قبل إزالة لوح نفسها. إيلاء اهتمام وثيق للتوجه الأمامي / الخلفي من كل لوح.
- التقاط صور لأحد الأماميد السطح الخلفي من كل لوح. من المرجح أن تحتوي على ألواح الخلفي قطع منفصلة، بحيث تولي اهتماما لاتجاه القطع لدمج. وضع كل لوح إلى كاسيت تضمين ووضع كل منهم في حل الفورمالين 10٪.
- العقل البشري
- بعناية اختبار نوبة من الدماغ في منطقة الجزاء.
- شريحة الدماغ بدءا من نهاية واحدة باستخدام قطع الزاوية، ببطء ولكن بثبات التقطيع. قطع الدماغ من خلال كل فجوة شفرة.
- إزالة كل لوح واحد في وقت واحد، مع إيلاء اهتمام وثيق للعدد والأمامي / الخلفي التوجه من كل لوح.
- التقاط صور للالأمامية والخلفية سطح كل لوح. وضع ألواح في مختومة أكياس الفورمالين 10٪. سيتم قطع كتل من أنسجة ألواح ووضعها في أشرطة مبنية.
10. إزالة يتدلى في الدماغ مربع (القسم التكميلي)
- سحب شرائح: Meshmixer
- استيراد Smoothed_Edited_Brain_Model.
- حدد تحرير، وجعل شرائح. في شرائح ماركة:
- حدد مرصوف 3D، Z، أدخل 1-2 مم سمك. انقر حساب. عندما تحميل الشرائح، انقر فوق قبول.
- حدد 1 أو 2 شرائح مع محيط كبيرة بالقرب من أسفل القشرة. وينبغي أن تكون هذه الشرائح دون مستوى منطقة الجزاء الفرعية.
- تصدير كل من هذه الشرائح كما Brain_Slice_ #.
- تمديد شرائح تصل إلى إزالة يتدلى: Netfabb المهنية
- استيراد Brain_Slice_ # شرائح.
- تكرار كل Brain_Slice_ # (ازل ترتيب أجزاء إذا لم محددة).
- انقر بزر الماوس الأيمن على نسخة واحدة من كل Brain_Slice_ # وحدد مقياس.
- إلغاء تحديد نسبة القياس الثابتة. ثم رفع مستوى شريحة الدماغ في الاتجاه Y بحيث يصل إلى مستوى الجزء السفلي من مربع الفرعية.
- إعادة تسمية هذه الشرائح Brain_Slice_Big_ #.
- تحقق من Y موقف سو في Brain_Slice_ # الأصلي عن طريق النقر بالزر الأيمن على جزء وخطوة اختيار. تسجيل موقف Y لكل من الأصلية Brain_Slice_ # شرائح.
- إجراء العملية الحسابية: Brain_Slice_ # [موقف ص] - (Brain_Slice_Big_ # [حجم ص] - Brain_Slice _ # [حجم ذ])
- حدد كل من Brain_Slice_Big_ # فردي، انقر بزر الماوس الأيمن واختر الخطوة.
- أدخل القيمة المحسوبة من 10.2.6 في مربع المعلمة الترجمة Y. للمعلمات X و Z الترجمة، أدخل القيم الموجودة في المربعات معلمة موقف الحالية. حدد المطلق الترجمة. انقر على ترجمة وإغلاق النافذة.
ملاحظة: سيتم طرح وBrain_Slice_Big_ # شرائح جنبا إلى جنب مع الدماغ وشفرات عندما جعل مربع.
- أدخل القيمة المحسوبة من 10.2.6 في مربع المعلمة الترجمة Y. للمعلمات X و Z الترجمة، أدخل القيم الموجودة في المربعات معلمة موقف الحالية. حدد المطلق الترجمة. انقر على ترجمة وإغلاق النافذة.
11. القشة قرد أميركي الدماغ بالرنين المغناطيسي مهد لالضوئي إضافية
- إنشاء مهد الدماغ بالرنين المغناطيسي
- تأكد من أن السطح العلوي من الكرومأديل هو في نفس الارتفاع Box_Cutout. يجب أن يكون عمق وموقف المخ في مهد الإعداد تماما كما هو الحال بالنسبة للتقطيع.
- التحول-حدد لتحديد Smoothed_Edited_Brain_Model ومهد.
- تحديد عملية منطقية. حدد الدماغ لتسليط الضوء عليه اللون الأحمر، ثم حدد الطرح منطقي. ثم تطبيق العمليات الحسابية. (أيضا تحديد Brain_Slice_Big_ # شرائح إن وجدت).
- أدخل وضع الإصلاح لإزالة أي نقطة حادة في محيط مهد كما فعلت سابقا لتقطيع اللحم. حدد إصلاح موسع. تطبيق إصلاح، وإزالة الجزء القديم.
- انقر بزر الماوس الأيمن لإعادة تسمية الجزء التصوير بالرنين المغناطيسي الدماغ مهد. حدد تصدير، STL.
- طباعة مهد: كورا
- استيراد التصوير بالرنين المغناطيسي الدماغ مهد إلى كورا وتناوب عليها بحيث الجزء المسطح مع انقطاع الدماغ هو مواجهة.
- ضبط إعدادات الطباعة: قرار طبقة 0.1 مم، 100٪ كثافة التعبئة، الطوافة.
- حدد حفظ مسار أداة لبطاقة SD. (وقت طباعة ~ 10 ساعة)
- طباعة على Ultimaker 2 كما هو موضح في 8.3.
- الحصول عالية الدقة T2 * التصوير بالرنين المغناطيسي باستخدام مهد
- الفورمالين الجافة بلطف من سطح الدماغ مع منشفة ورقية.
- وضع الدماغ في المهد كما هو موضح في تقطيع اللحم.
- حرك الدماغ ومهد في أنبوب الطرد المركزي 50 مل. ملئه حتى أسنانها مع النفط المفلورة.
- الضغط بلطف على أنبوب للسماح فقاعات هواء للهروب من الدماغ. إدراج كاب إدراج في أقحم من غطاء أنبوب لمنع فقاعات الهواء من تشكيل هناك. تأمين الغطاء، وختم أنبوب مع البارافين.
- وضع أنبوب في لفائف كما هو موضح سابقا. يتم إعطاء المعلمات 3D T2 * في الجدول 1.
- فتح 18 التشريحية 100 ميكرون T2 الاستحواذ * -weighted في Mipav وسجل لاكتساب ال 10. المعلمات تسجيل هي نفسها كما هو الحال في 1.1.7. متوسط الصور المسجلة: يوتالديها مرافق، صورة الصور حاسبة السائبة، ومتوسط.
النتائج
وتتلخص سير العمل لهذه الطريقة في الشكل 1. بمجرد شرائح الدماغ، مقارنة البصرية بين صور الرنين المغناطيسي والصور من السطوح السطحية للألواح معارض مباراة التوجه جيدة عبر ألواح متعددة (الشكل 2). بعد هي جزء لا يتجزأ من ألواح في البارافين، ومقطوع أنهم على مشراح والملون. مقارنة أكثر دقة بين ارتفاع القرار بعد الوفاة التصوير بالرنين المغناطيسي والمقاطع الأنسجة الملون توضح مباراة دقيقة ومتناسقة عبر جميع هياكل الدماغ القشة قرد أميركي (الشكل 3).
في هذا النموذج الحيواني من مرض التصلب العصبي المتعدد، والحيوانات تتطور الآفات المادة البيضاء المنتشرة في المادة البيضاء الدماغية. ويمكن الكشف عن هذه الآفات noninvasively عن طريق إجراء التصوير بالرنين المغناطيسي. يوضح الشكل (4) وقدرة هذه التقنية لتوضيح الركيزة المرضية للنتائج التصوير بالرنين المغناطيسي. الآفات الصغيرة الكشف عن المجراة التصوير بالرنين المغناطيسي يمكنيمكن تعقب على حد سواء التصوير بالرنين المغناطيسي بعد الوفاة والأنسجة. كما هو مبين في الأشكال، إزالة الميالين داخل الآفات هي واحدة من المكونات الرئيسية الدافعة للتغيير إشارة MR (hyperintensity مقارنة مع الأنسجة المحيطة بها). يمكن للعلم الأنسجة وبعد الوفاة التصوير بالرنين المغناطيسي أيضا تظهر الآفات لم يتم الرد عليها في الجسم الحي التصوير بالرنين المغناطيسي (الشكل 4).
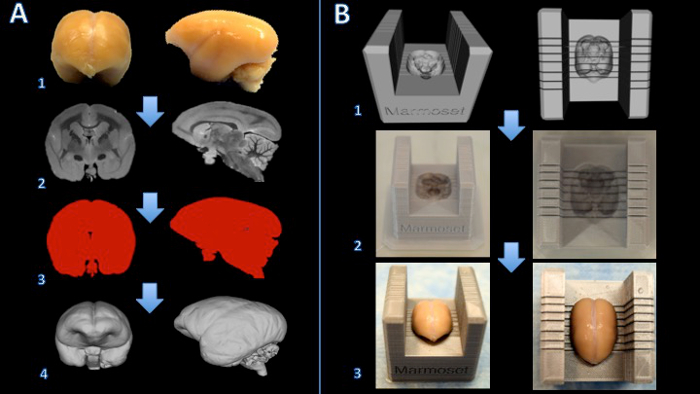
الشكل 1. سير العمل لإنشاء مربع تقطيع القشة قرد أميركي الدماغ. يتم إصلاح الدماغ مع الفورمالين (A1)، وحصلت على التصوير بالرنين المغناطيسي T2 المرجحة مع voxels الخواص من 150 ميكرون لكل حافة (A2). تتم معالجة الصور وthresholded لإنشاء قناع ثنائي (A3). ثم يتم تقديم السطح في برنامج 3D النمذجة (A4). والطرح منطقي بين قالب تقطيع اللحم ونموذج الدماغ يخلق نموذج رقمي لتقطيع الدماغ (B1). طباعة مربع تقطيع الدماغ على طابعة 3D (B2). ثم يتم وضع الدماغ بقوة في مربع تقطيع اللحم لقطع (B3). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
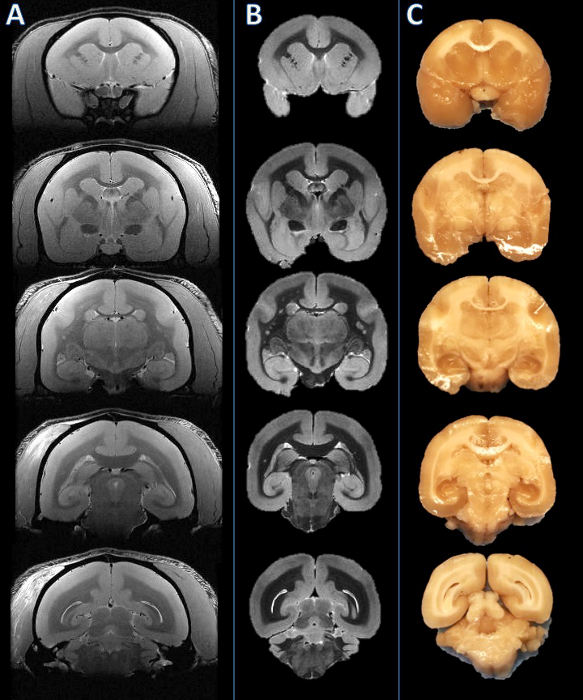
الشكل 2. من اليسار إلى اليمين: في الجسم الحي التصوير بالرنين المغناطيسي، بعد الوفاة التصوير بالرنين المغناطيسي، وصورة لوح الأنسجة. أنشئت طائرات تشريح الجثة بعد الوفاة بناء على التصوير بالرنين المغناطيسي (B) وبصريا مقارنة المقابلة في الجسم الحي التصوير بالرنين المغناطيسي شريحة (A). ثم قطع الدماغ، وعثر على ألواح مما أدى إلى أن تكون متسقة (C). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
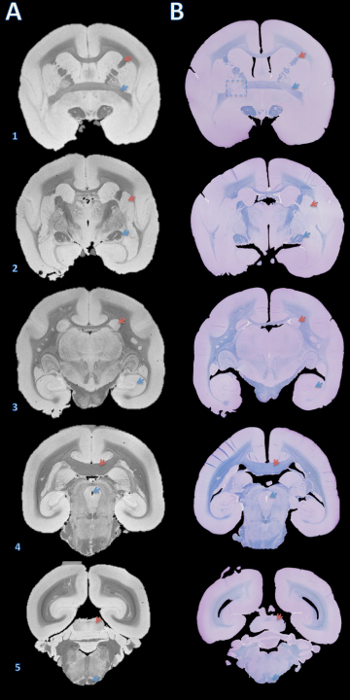
الشكل 3. عالية الدقة التصوير بالرنين المغناطيسي بعد الوفاة والأنسجةقسم مطابقة. كانت جزءا لا يتجزأ من ألواح في البارافين، وقطع مع مشراح إلى 4 ميكرون أقسام، وملطخة سريع الأزرق والبنفسجي الكريزيل (B). الأقسام ثم تم بصريا المتطابقة مع T2 100 ميكرون * -weighted التصوير بالرنين المغناطيسي على أساس هياكل الدماغ (A). تفاصيل لاكتساب هذه الصورة هي في القسم التكميلي للبروتوكول والجدول 1. هياكل الدماغ: (1) السهم الأحمر = كبسولة الداخلية، سهم أزرق = الصوار الأمامي. (2) السهم الأحمر = putamen، سهم أزرق = الجهاز البصري. (3) السهم الأحمر = المذنبة، سهم أزرق = الحصين. (4) السهم الأحمر = جسم الثفني، سهم أزرق = قناة الدماغية. (5) السهم الأحمر = أكيمة السفلي، سهم أزرق = المسالك هرمي. مربع متقطع في B1 يشير إلى وجود شريحة حيث إما أثناء قطع الدماغ أو تضمين البارافين، تسبب خطأ، تناوب طفيف حول محور Y، مما يؤدي إلى عدم تطابق الصوار الأمامي على اليسار. الرجاء انقر هنا لعرضنسخة أكبر من هذا الرقم.
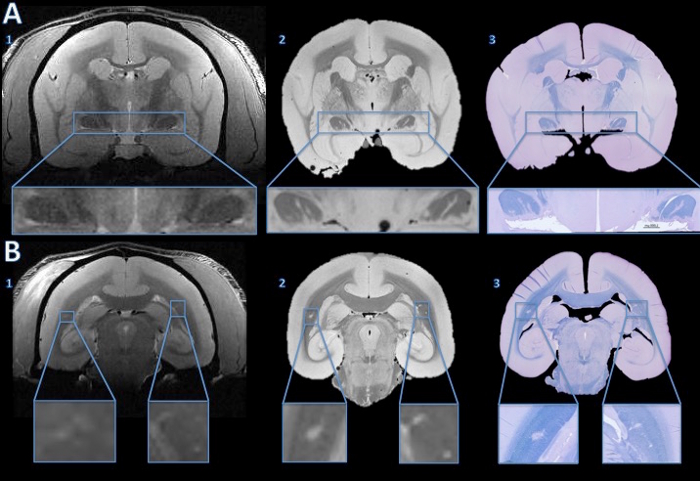
الشكل 4. تتبع الآفات من في الجسم الحي التصوير بالرنين المغناطيسي لقسم الأنسجة. أظهر التصوير بالرنين المغناطيسي في الجسم الحي لا أدلة مقنعة على إشارة hyperintensity غير طبيعية تشير إلى آفات في الجهاز إما البصري (A1). ومع ذلك، يظهر ارتفاع التصوير بالرنين المغناطيسي قرار بعد الوفاة خطوط مكثفة المفرط واضحة في كل مساحات البصرية (A2). الصيام الأزرق / البنفسجي الكريزيل صمة قسم الأنسجة 4 ميكرون تظهر أن المناطق hyperintense ينظر إليه على فيفو السابقين التصوير بالرنين المغناطيسي هي عديمة الميلين (A3). في المادة البيضاء الدماغية، وفي الجسم الحي التصوير بالرنين المغناطيسي يظهر hyperintensity خفية على المستوى الثنائي (B1، الموسع في إدراجات). المناطق hyperintense هي أكثر وضوحا على ارتفاع القرار بعد الوفاة التصوير بالرنين المغناطيسي (B2). وصمة عار LFB من قسم الأنسجة 4 ميكرون تبين أن هذه المناطق هي عديمة الميلين (B3). بعد المقارنة مع ط خط الأساسن فيفو التصوير بالرنين المغناطيسي وصمة عار hemotoxylin ويوزين، على الجانب الأيمن عازم على أن يكون شذوذ تشريحي، وليس آفة عديمة الميلين. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

خلفية ملفات التعليمات البرمجية. Brain_Slicer_Parts_Marmoset.stl: الرجاء انقر هنا لتحميل هذا الملف. Brain_Slicer_Parts_Human.stl: الرجاء انقر هنا لتحميل هذا الملف. Cap_Insert.stl: الرجاء انقر هنا لتحميل هذا الملف.
Discussion
بروتوكول المذكورة هنا يمكن إجراء مقارنة دقيقة بين التصوير بالرنين المغناطيسي وأقسام الأنسجة. ويقدم البروتوكول في شكل موحد يمكن تطبيقه على أدمغة البشر أو الحيوانات الصغيرة، مثل النسناس أو القوارض. خلافات محددة لكبير (الإنسان) والصغيرة (الرئيسيات غير البشرية والقوارض) ويسلط الضوء على العقول، وفي الفيديو والشخصيات المرافقة ونحن لشرح التطبيق في القشة قرد أميركي. على الرغم من أن نهج واضح وصريح، يتطلب طريقة العديد من الخطوات فضلا عن استخدام عدة أنواع من البرمجيات. وعلاوة على ذلك، العديد من القضايا يحتمل أن يؤثر على دقة هذه الطريقة مهمة لذكرها.
جودة الصورة في الجسم الحي التصوير بالرنين المغناطيسي هو عامل مهم. للحد من التفاوت في دقة وضوح الصورة بين التصوير بالرنين المغناطيسي والصور الأنسجة رقمية، وينبغي استخدام أصغر حجم ممكن التصوير بالرنين المغناطيسي فوكسل. وينطبق هذا المفهوم أيضا على جودة الصورة من التصوير بالرنين المغناطيسي بعد الوفاة. في حين ارتفعتاكتساب الوقت في التصوير بالرنين المغناطيسي بعد الوفاة يسمح أعلى بكثير دقة وضوح الصورة، وإعداد يمكن إدخال القطع الأثرية صورة مثل التسرب إشارة التنسيق المتعلقة فقاعات الهواء. ويمكن لهذه القطع الأثرية تحجب مجالات النسيج وكذلك يؤثر على كفاف. وعلاوة على ذلك، من المرجح أن تتأثر عملية تثبيت ومدة أبعاد الأنسجة على التصوير بالرنين المغناطيسي بعد الوفاة. بينما في الجسم الحي إلى خارج الجسم الحي مباراة التصوير بالرنين المغناطيسي يمكن أن يقترب عن كثب من خلال الاستفادة من المعالم التشريحية في الإعداد الهندسة شريحة خلال الاستحواذ، فإن التسجيل غير الخطية لا يزال ضروريا للوصول إلى درجة عالية من الدقة في مطابقة هذين صور الرنين المغناطيسي.
تصميم حامل الدماغ وتقطيع اللحم هو أيضا خطوة حاسمة. في خلق نموذج رقمي للمخ، يتم تطبيق بالمرشح الذي يوسع قليلا نموذج قريب إلى الدماغ ثابتة. وهذا يتيح الإدراج سهلة من الدماغ إلى حاملها وتقطيع اللحم ويقلل من الحواف الحادة في حامل و# 39؛ ق كفاف. ومع ذلك، إذا كان النموذج هو كبير جدا (على سبيل المثال، من خلال أكثر من 5٪)، قد ينتقل الدماغ خلال التصوير بالرنين المغناطيسي بعد الوفاة و / أو باجتزاء. نقطة أخرى مهمة هي للتكيف مع تصميم نموذج الدماغ بحيث يتم وضع المخيخ بشكل صحيح داخل الكائن 3D المطبوعة. هذا يمكن أن يكون تحديا من نوع خاص عندما تم تلف المخيخ خلال استخراج المخ في تشريح الجثة.
عند طباعة تقطيع الدماغ وحامل، نوع الطابعة 3D يجب أن يتم اختيار بعناية. تتطلب بعض الطابعات متعددة طائرة مرحلة ما بعد المعالجة باستخدام الفرن لإزالة الدعم المادي. في حين أن هذه الطابعات يمكن أن تنتج الأشياء التي هي ماء وأكثر دواما نسبيا من سطح المكتب تنصهر ترسب النمذجة (FDM) طابعات، عملية التسخين لإزالة الدعم يمكن أن تشوه قليلا مربع، وخلق الثغرات شفرة ليست عمودية تماما على كفاف الدماغ.
عملية الدماغ باجتزاء هي خطوة حاسمة أخرى. قبل قطع الالبريد الدماغ كله إلى ألواح، من المهم للتأكد من أن الدماغ هو يجلس بإحكام داخل تقطيع الدماغ: يجب أن يكون هناك حركة عندما يتم تطبيق ضغط طفيف على الدماغ. وهذا سيجعل من الممكن للشفرات لقطع طريق الدماغ في الموقع الدقيق الذي حدده المحققين. وينبغي تطبيق والضغط المتوازن المستمر على كل من أصحاب شفرة عندما قطع. اعتمادا على حدة من ريش وصلابة من الأنسجة، ويمكن طفيف عرضية قطع الحركة يكون من المفيد للحفاظ على قطع الأسطح المسطحة.
يمكن أيضا أن تكون عملية دمج البارافين مصدر الاختلال بين التصوير بالرنين المغناطيسي والأنسجة. إذا كان لوح الأنسجة لا يجلس شقة ضد الكاسيت أثناء عملية التضمين، وسوف يكون هناك ميل بين الطائرة قطع مشراح والمكان سطح البلاطة. وهذا يتطلب قطع الأجزاء غير صالحة للاستعمال لإيجاد منبسط التي تتعرض كل الأنسجة. طريقة واحدة لتصحيح الميلهو عن طريق تغيير زاوية من الطائرة عرض على تشريح التصوير بالرنين المغناطيسي عالية الخواص الدقة. ومع ذلك، وهذا هو المستحيل تقريبا على اداء في الجسم الحي التصوير بالرنين المغناطيسي الذي عادة ما يتم الحصول عليها مع قرار متباين الخواص (عادة شرائح الاكليلية سميكة).
وأخيرا، يمكن للأنسجة تجربة بعض التشوه خلال الفترة الفورمالين التثبيت وتضمينها البارافين (انكماش)، وكذلك أثناء إعداد الشرائح (قابلة للطي، وتكسير، التجاعيد). بعض هذه التشوهات يمكن تصحيحها عن طريق وضع 4-5 ميكرون المقاطع في حمام الماء قبل نقل على الشرائح. تشوهات أخرى يمكن حلها جزئيا عن طريق أداء coregistration صورة تشوه الصور الرقمية النسيجية إلى الصور التصوير بالرنين المغناطيسي بعد الوفاة. ومع ذلك، والتقليل من التشوهات مع الممارسة المتأنية والماهرة هو النهج الأكثر فعالية لمطابقة كميات التصوير بالرنين المغناطيسي لعلم الأنسجة أقسام.
في الختام، فإن منهجية قدم هنا تمكن الجردestigators إجراء تقييم دقيق لعلم الأمراض الكامنة وراء النتائج التصوير بالرنين المغناطيسي. أكثر عموما، بل هو نهج واعد لتحديد و / أو التحقق من صحة المؤشرات الحيوية التصوير بالرنين المغناطيسي الجديدة للدراسات البحثية التي تستهدف العمليات المرضية محددة، مثل التهاب أو عودة الميالين.
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
The Intramural Research Program of NINDS supported this study. We thank the NIH Functional Magnetic Resonance Imaging Facility. We thank Jennifer Lefeuvre and Cecil Chern-Chyi Yen for assistance with postmortem MRI acquisition. We thank John Ostuni and the Section on Instrumentation Core Facility for assistance with 3D printing. Figure 1 of this work used snapshots from MeshLab, a tool developed with the support of the 3D-CoForm project.
Materials
| Name | Company | Catalog Number | Comments |
| 7T/30cm USR AVIII Bruker MRI | Bruker Biospin | ||
| 38 mm Bruker Biospin volume coil | Bruker Biospin | ||
| Fomblin | Solvay Solexis | ||
| 50 ml Falcon Centrifuge Tubes, Polypropylene, Sterile | Corning | 21008-951 | |
| Fisherbrand Gauze Sponges | Fisher Scientrific | 13-761-52 | |
| Parafilm M All-Purpose Laboratory Film | Bemis | ||
| Leica RM2235 rotary microtome | Leica | ||
| Leica Disposable Blades, low profile (819) | Leica | ||
| Cresyl Violet Acetate, 0.1% Aqueous | Electron Microscopy Sciences | 26089-01 | |
| Luxol Fast Blue, 0.1% in 95% Alcohol | Electron Microscopy Sciences | 26056-15 | |
| ETOH | |||
| Ultimaker 2 Extended | Ultimaker | ||
| .75 kg Official Ultimaker Branded PLA Filament, 2.85 mm, Silver Metallic | Ultimaker | ||
| Axio Observer.Z1 | Zeiss | ||
| Zen 2 (Blue Edition) | Zeiss | ||
| Netfabb Professional 5.0.1 | Netfabb | http://www.netfabb.com/professional.php | |
| Meshmixer 10.9.332 | Autodesk | http://www.meshmixer.com/download.html | |
| Mipav 7.2 | NIH CIT | http://mipav.cit.nih.edu | |
| Cura | Ultimaker | https://ultimaker.com/en/products/cura-software |
References
- Evans, A. C., Frank, J. A., Antel, J., Miller, D. H. The role of MRI in clinical trials of multiple sclerosis: comparison of image processing techniques. Ann Neurol. 41 (1), 125-132 (1997).
- 't Hart, B. A., van Kooyk, Y., Geurts, J. J. G., Gran, B. The primate autoimmune encephalomyelitis model; a bridge between mouse and man. Ann Clin Transl Neurol. 2 (5), 581-593 (2015).
- Ontaneda, D., Hyland, M., Cohen, J. A. Multiple sclerosis: new insights in pathogenesis and novel therapeutics. Annu Rev Med. 63, 389-404 (2012).
- Guy, J. R., Sati, P., Leibovitch, E., Jacobson, S., Silva, A. C., Reich, D. S. Custom fit 3D-printed brain holders for comparison of histology with MRI in marmosets. J Neurosci Methods. 257, 55-63 (2016).
- Breen, M. S., Lazebnik, R. S., Wilson, D. L. Three-dimensional registration of magnetic resonance image data to histological sections with model-based evaluation. Ann Biomed Eng. 33 (8), 1100-1112 (2005).
- Dauguet, J., et al. Three-dimensional reconstruction of stained histological slices and 3D non-linear registration with in-vivo MRI for whole baboon brain. J Neurosci Methods. 164 (1), 191-204 (2007).
- McGrath, D. M., Vlad, R. M., Foltz, W. D., Brock, K. K. Technical note: fiducial markers for correlation of whole-specimen histopathology with MR imaging at 7 tesla. Med Phys. 37, 2321-2328 (2010).
- Schormann, T., Zilles, K. Three-Dimensional linear and nonlinear transformations: An integration of light microscopical and MRI data. Hum Brain Mapp. 6, 339-347 (1998).
- Jiang, L., et al. Combined MR, fluorescence and histology imaging strategy in a human breast tumor xenograft model. NMR Biomed. 26 (3), 285-298 (2013).
- Absinta, M., et al. Postmortem magnetic resonance imaging to guide the pathologic cut: individualized, 3-dimensionally printed cutting boxes for fixed brains. J Neuropathol Exp Neurol. 73 (8), 780-788 (2014).
- Gaitán, M. I., et al. Perivenular brain lesions in a primate multiple sclerosis model at 7-tesla magnetic resonance imaging. Mult Scler. 20 (1), 64-71 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved