A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إنتاجية عالية، في الوقت الحقيقي، اختبار مزدوج قراءات من بين الخلايا مضادات الميكروبات آخر وحقيقية النواة السمية لخلايا
In This Article
Summary
A high throughput, real-time assay was developed to simultaneously identify (1) eukaryotic cell-penetrant antimicrobials targeting an intracellular bacterial pathogen, and (2) assess eukaryotic cell cytotoxicity. A variation on the same technology was thereafter combined with digital dispensing technology to enable facile, high-resolution, dose-response, and two- and three-dimensional synergy studies.
Abstract
تعتمد المعايير التقليدية للنشاط مضادات الميكروبات داخل الخلايا والسمية لخلايا حقيقية النواة على المقايسات نقطة النهاية. وتتطلب هذه المقايسات نقطة النهاية العديد من الخطوات التجريبية الإضافية قبل قراءات، مثل تحلل الخلية، مستعمرة تشكيل وحدة المصير، أو إضافة كاشف. عند تنفيذ الآلاف من المقايسات، على سبيل المثال، أثناء فحص عالية الإنتاجية، وجهد المصب المطلوبة لهذه الأنواع من المقايسات لا بأس بها. لذلك، لتسهيل عالية الإنتاجية اكتشاف مضادات الميكروبات، قمنا بتطوير فحص في الوقت الحقيقي لتحديد وقت واحد مثبطات نمو البكتيريا داخل الخلايا وتقييم السمية لخلايا حقيقية النواة. على وجه التحديد، وتمكين الوقت الحقيقي للكشف عن نمو البكتيريا داخل الخلايا عن طريق وضع علامة السلالات البكتيرية فحص إما مع الاوبرون البكتيرية لوكس (1 شارع الجيل فحص) أو صحفيين ببروتين (2 الثانية جيل، فحص متعامد). وغير سامة، وخلية غشاء impermeant، النووي صبغ ملزم حمضوأضاف خلال العدوى الأولية الضامة. وتستبعد هذه الأصباغ من خلايا قابلة للحياة. ومع ذلك، تفقد الخلايا المضيفة غير قابلة للحياة سلامة الغشاء تسمح بدخول ووضع العلامات الفلورية من الحامض النووي (حمض النووي الريبي منقوص الأكسجين). والجدير بالذكر أن الحمض النووي ملزمة يرتبط مع زيادة كبيرة في العائد الكم الفلورسنت التي توفر قراءات الحل القائم على وفاة الخلية المضيفة. وقد استخدمنا هذا الاختبار المشترك لأداء شاشة عالية الإنتاجية في شكل صفيحة، وتقييم نمو الخلايا والسمية الخلوية بواسطة المجهر. والجدير بالذكر، أن مضادات الميكروبات تظهر التآزر التي التأثير المشترك لاثنين أو أكثر من مضادات الجراثيم عند تطبيقها معا أكبر مما كانت عليه عندما تطبق بشكل منفصل. اختبار لفي المختبر التآزر ضد مسببات الأمراض داخل الخلايا عادة مهمة هائلة كما يجب تقييم التباديل اندماجي من المضادات الحيوية بتركيزات مختلفة. ومع ذلك، وجدنا أن لدينا فحص في الوقت الحقيقي جنبا إلى جنب مع الآلي، والاستغناء عن التكنولوجيا الرقمية صermitted اختبار التآزر سطحي. باستخدام هذه الأساليب، كنا قادرين على مسح منهجي عمل لعدد كبير من مضادات الجراثيم وحده، والجمع ضد مسببات المرض داخل الخلايا، البكتيريا المستروحة.
Introduction
مسببات الأمراض التي تنمو أو يقيمون مؤقتا في حجرات داخل الخلايا صعبة للقضاء على علاجيا. إلزام أو إلزام نسبيا مسببات الأمراض داخل الخلايا مثل البكتيريا المستروحة، الكوكسيلا البورنيتية، البروسيلا النيابة. ، الفرنسيسيلة التولارية، والمتفطرة النيابة. غالبا ما تتطلب دورات من العلاج المضادة للميكروبات لفترات طويلة للعلاج والتي قد تتراوح من أشهر إلى سنوات حتى. وعلاوة على ذلك، يمكن لمسببات الأمراض خارج الخلية تحتل عابر منافذ داخل الخلايا، وبهذه الطريقة الهروب إجازته الدورات العادية العلاج المضادة للميكروبات وتظهر في وقت لاحق لبدء جولات جديدة من العدوى الخبيثة. المكورات العنقودية الذهبية (1) وuropathogenic المعوية 2،3 الالتهابات مثالين المعترف بها على نحو متزايد. ولذلك، فإن الهدف الأساسي اكتشاف المخدرات هو تحديد مضادات الميكروبات الرواية التي تخترق المقصورات داخل الخلايا. العلاج الأمثل للقضاء بسرعةالكائنات الحية داخل الخلايا ومنع تطور المقاومة من خلال التعرض للميكروبات دون كابح أمر مرغوب فيه خاصة.
تحقيقا لهذه الغاية، قمنا بتطوير تقنية فحص الإنتاجية العالية لتحديد مضادات الميكروبات، داخل الخلايا توغل تستهدف نمو الخلايا من مسببات المرض نموذج، البكتيريا المستروحة. وتشير 4 الملاحظات السريرية السابقة أن معيار اختبار الحساسية للمضادات الميكروبات لم تتنبأ بدقة في الجسم الحي الكفاءة العلاجية ضد هذا الكائن الحي. 5 على وجه التحديد، وكان هذا بسبب فئات رئيسية من مضادات الميكروبات مثل β-اكتام وأمينوجليكوزيدات، على الرغم من فعالية عالية ضد نمت axenically البكتيريا، لا تخترق بدرجة كافية في حجرات داخل الخلايا حيث تتواجد البكتيريا. اقترح 5،6 الأدلة في وقت لاحق أن المقايسات نمو الخلايا فنيا أكثر تعقيدا توقعت فعال الفعالية السريرية. 7 لسوء الحظ، كانت هذه المقايسات النهاية شاقة للغاية المقايسات، والتي تتطلب الضامة المصابة، وتعامل مع مضادات الميكروبات، أن هي lysed في أوقات مختلفة من النقاط لتشكيل مستعمرة حدة التعداد. هذه المقايسات ليست عملية للقيام على نطاق واسع وغير مناسبة لاكتشاف الأدوية الإنتاجية العالية.
لذلك، قمنا بتطوير تكنولوجيا لتحديد الوقت الحقيقي لنمو البكتيريا داخل الخلايا. 6 وقد تحقق ذلك من خلال استخدام السلالة البكتيرية المعدلة من خلال دمج إما بكتيري وسيفيراز الاوبرون 8 (أول فحص جيل، وصفت سابقا) 4 أو الفلورسنت البروتين 9 صحفيين (الجيل الثاني، فحص متعامد، وصفت هنا) في كروموسوم البكتيريا. وبهذه الطريقة، الانارة أو إشارة الفلورسنت توفر بديل، في الوقت الحقيقي قراءات من عدد البكتيريا.
ومع ذلك، هذه الصفات لا تعالج المحير رئيسيا في infectio داخل الخلاياالمقايسات ن، والآثار بعيدا عن الهدف في الخلايا المضيفة. على وجه الخصوص، وفاة الخلية المضيفة يحد بطبيعتها نمو الخلايا وتؤدي إلى تحديد هوية كاذبة من تأثير مضاد للميكروبات. كما العديد من المركبات في المكتبات الفحص هي أن الخلايا حقيقية النواة السامة، هذه ايجابيات كاذبة تطغى مضادات الجراثيم الحقيقية، مما يستلزم عددا كبيرا من المتابعة، المقايسات نقطة النهاية السمية الخلوية للقرار.
وبالتالي، كان من اهتمام كبير لتكون قادرة على تقييم بقاء الخلية حقيقية النواة ونمو الخلايا في وقت واحد. والجدير بالذكر، سمة من سمات الخلايا حقيقية النواة غير قابلة للحياة هي فقدان النزاهة غشاء الخلية. ولذا قد تحقيقات أن اختبار نفاذية غشاء الخلية أن تستخدم لتقييم قابلية الخلية. وتتميز نحن سابقا قدرة سلسلة من خلية مزعومة غشاء impermeant، فلوري، والأصباغ الحمض النووي ملزم للوصول إلى وصمة عار الحامض النووي من الخلايا الميتة. (4) في الحمض النووي ملزم النووي، هذه الأصباغ عرض زيادة كبيرة في quantuم العائد الفلورسنت مما أدى إلى زيادة إشارة على حل الخلفية مضان. على هذا النحو، وفرت هذه الأصباغ قراءات كمية من موت الخلايا حقيقية النواة. 4 والجدير بالذكر أن وجدنا أن عددا منهم كان غير سامة أنفسهم خلال فترة طويلة شارك في الحضانة مع الضامة J774. عندما تضاف أثناء الإصابة الأولية، قدموا في الوقت الحقيقي، قراءات الفلورسنت من موت الخلايا حقيقية النواة التي يمكن أن يقاس على مقياس التألق صفيحة أو احظ مجهريا.
لذلك، من خلال الجمع بين استخدام مراسل البكتيرية وغير سامة، غشاء impermeant، والأصباغ الحمض النووي ملزم، كنا قادرين على تطوير بسيط، غير مدمرة، في الوقت الحقيقي فحص لقياس كل الحمولة الجرثومية وحقيقية النواة السمية لخلايا في وقت واحد. وقد سمح هذا الاختبار لنا على الشاشة في 384 بئر شكل لوحة ~ 10،000 bioactives المعروفة بما في ذلك ~ 250 مضادات الميكروبات و> 240،000 جزيئات صغيرة مع النشاط uncharacterized وظيفيا عن القدرة على كبح نمو الخلايا منالبكتيريا المستروحة، بينما في الوقت نفسه توليد بيانات الخلية سمية الخلايا حقيقية النواة لكل مجمع. وكان 6 تحليلنا لمضادات الميكروبات المعروفة ضد نمو الخلايا من البكتيريا استكشاف أشمل من هذا النوع حتى الآن. 6
وبناء على كفاءة التنسيق فحص لدينا، ونحن أيضا استكشاف في وقت لاحق من الآثار المحتملة المستمرة للمضادات الحيوية المعروفة عند استخدامها في الجمع. واحد من الاختبارات التآزر الأكثر شيوعا، ما يسمى فحص اللوحة، يتم تنفيذ standardly من خلال تقييم الآثار اندماجي من التخفيفات المسلسل شقين اثنين أو أكثر من مضادات الميكروبات. 10 وفي هذه المقايسات، ويعرف التآزر من خلال رصد تأثير أكبر عندما يتم تطبيق اثنين أو أكثر من مضادات الميكروبات معا من مجموع آثار كل تطبيق على حدة. وتجدر الإشارة، حتى الآن، ركز فقط وأجري اختبار التآزر انتقائية ضد الخلايا المستروحة البكتيريا بسبب المجهود الكبير تشارك في المقايسات نقطة النهاية التقليدية مضروبا في التباديل اندماجي المطلوبة.
لتسهيل اختبار التآزر، التي قطعناها على أنفسنا استخدام ما لدينا في الوقت الحقيقي نمو الخلايا / حقيقيات النوى فحص السمية الخلوية في تركيبة مع الآلية التكنولوجيا الاستغناء الرقمية (6). هذا أتمتة يسمح لنا الاستغناء التخفيفات المسلسل من المركبات الذائبة في DMSO أو محلول مائي منفردة أو مجتمعة في شكل 384 أيضا. 11 وعلاوة على ذلك، فإن مثل هذه قوية تكنولوجيا معالجة السائل يسمح لنا لأداء بسهولة دقة أعلى، مربع الجذر لطفلين (بدلا من المعيار، دقة أقل، ومضاعفة) مجموعات تخفيف لتحقيق مستويات أعلى من الدقة في منطقتنا ثنائي الأبعاد، الشطرنج التآزر تحليل. وكان هذا القرار قيمة خاصة في معالجة الشواغل في مجال التآزر حول استنساخ عند استخدام شقين التخفيف سلسلة 12. وأخيرا، كان لدينا فحص الكمي وأيضا ذرefore قياس التدرج من كبت. ونتيجة لذلك، استولت على فحص مجمل المعلومات المثبطة، التعبير عنه في isobolograms isocontour التي isocontours ربط تركيزات اندماجي مع مستويات مماثلة من تثبيط النمو. 6 سمحت هذه الاستراتيجية التآمر تصور اندماجي منحنيات الاستجابة للجرعة. لتوضيح منهجية لدينا، ونحن تصف بروتوكول لدينا لأداء هذه المقايسات وتظهر نتائج ممثلة.
Protocol
1. في الوقت الحقيقي بين الخلايا النمو وخلية حقيقية النواة السمسة الفحص
- إعداد خلايا المضيف (خلايا J774A.1)
- ثقافة J774A.1 المصحف العضلة الخلايا الشبيهة بلعم معلق في RPMI 1640 بنسبة 9٪ تستكمل الحديد العجل المصل. في البداية مرور في قوارير زراعة الأنسجة. بعد الخلايا أصبحت متكدسة في 75 سم 2 الأنسجة قارورة الثقافة في 15 مل من المتوسط، وتقسيم عن طريق كشط والتخفيف إلى 65 مل مع نفس النوع من المتوسط، منها 15 مل يتم إرجاعها إلى قارورة زراعة الأنسجة و50 مل يتم نقل إلى 250 مل البكتيرية قارورة شاكر.
- لزيادتها والثقافة معلق في 250 مل و / أو 1000 قوارير البكتيرية مل شغل إلى المجلد الخامس واحد مع متوسط زراعة الأنسجة. تهوية عن طريق تحديد سرعة دوران في حوالي 120 لفة في الدقيقة. لنمو مستمر، في احتضان بالضبط 5٪ CO 2 و 37 درجة مئوية.
- خلايا الحصاد عندما تصل الكثافة في حدود 2.5 × 10 6 خلايا/ مل إلى 5 × 10 6 خلية / مل. ضمان نسبة الخلايا الميتة (يعاير بسهولة عن طريق تلطيخ التريبان الأزرق) لا تتجاوز 25٪، والخلايا الميتة سيزيد من الضوضاء في الخلفية في فحوصات السمية الخلوية.
- لوحة بيضاء، زراعة الأنسجة المعالجة، 384 جيدا microplates في 5 × 10 4 خلايا J774A.1 في 30 ميكرولتر المتوسطة زراعة الأنسجة لكل بئر. احتضان بين عشية وضحاها microplates لتحقيق 90٪ التقاء في يوم من التجربة.
- إعداد الفلورسنت أو نيون البكتيريا المستروحة
- مرور L. المستروحة (LP02 :: :: flaA لوكس 8) البكتيريا على المتوسط المناسب، أي مخزنة الفحم خلاصة الخميرة (BCYE) متوسطة. في حالة استخدام سلالة العوز الغذائي الثيميدين، تكملة المتوسطة مع 100 ميكروغرام / مل الثيميدين. إعداد بقع من البكتيريا للتجارب عن طريق نشر الكائنات غزيرا على طبق من ذهب BCYE جديدة واحتضان يوم واحد (إذا كان من ممر لوحة السابق) أو 2-3 أيام (إذا كان من الأوراق المالية المجمدة) للحصول على متكدسةنمو.
- إعداد لوحات BCYE عن طريق إذابة 10 جم خلاصة الخميرة، و 10 غرام N - (2-acetamido) حمض -2-aminoethanesulfonic، 0.35 ز ك 2 هبو 4، و 1 غرام أحادي القاعدة البوتاسيوم α كيتوغلوتارات في 950 مل من الماء منزوع الأيونات. ضبط درجة الحموضة إلى 6.9 مع هيدروكسيد البوتاسيوم (≥2.5 مل من 11.9 حل الرحى).
- إضافة 15 غراما أجار و 2 ز الفحم المنشط. وجلب إلى 1 L الحجم النهائي. إضافة شريط مغناطيسي وجهاز التعقيم. متوسطة بارد إلى 55 درجة مئوية وإضافة حلول فلتر تعقيم تحتوي على 0.4 غرام L-السيستين و 0.42 غرام الأمونيوم الحديد (III) سترات المذاب في الماء منزوع الأيونات. استخدام مغناطيس لوحة ضجة لمزيج قبل صب لوحات بيتري.
- لاختبار نمو المستروحة L. في متوسط النمو ممحوضة، وإعداد ACES وخلاصة الخميرة مرق (آي) عن طريق الجمع بين كل الكواشف الكيميائية المستخدمة لBCYE باستثناء الفحم وأجار. فلتر تعقيم واستخدام على الفور، أو تجميد للتجارب لاحقة.
- الكائنات resuspend في سالي الأنسجة مستنبت المستخدمة لخلايا J774A.1 مع 100 ميكروغرام / مل مكملات الثيميدين حسب الاقتضاء.
- مرور L. المستروحة (LP02 :: :: flaA لوكس 8) البكتيريا على المتوسط المناسب، أي مخزنة الفحم خلاصة الخميرة (BCYE) متوسطة. في حالة استخدام سلالة العوز الغذائي الثيميدين، تكملة المتوسطة مع 100 ميكروغرام / مل الثيميدين. إعداد بقع من البكتيريا للتجارب عن طريق نشر الكائنات غزيرا على طبق من ذهب BCYE جديدة واحتضان يوم واحد (إذا كان من ممر لوحة السابق) أو 2-3 أيام (إذا كان من الأوراق المالية المجمدة) للحصول على متكدسةنمو.
- العدوى بلعم
- إضافة مركبات اختبار الفائدة (مركبات الفحص، والضوابط الإيجابية والسلبية لتثبيط نمو البكتيريا وتحلل الخلايا حقيقية النواة). يفضل حل حلول السهم عند ≥500x في DMSO (سلفوكسيد ثنائي ميثيل) أو محلول مائي للسماح للتخفيف كاف من السيارة.
- على الرغم من أن الحلول الأسهم يمكن تخزينها المجمدة، وتجنب تجميد أذاب دورات للمركبات عطوب ومضادات الميكروبات.
- تمييع البكتيريا الانارة لاستهداف من 2.5 × 10 6 كفو (مستعمرة تشكيل وحدة) / م والبكتيريا المسمى مراسل الفلورسنت إلى 1.0 × 10 7 خلية / مل في مستنبت النسيج وإضافة غير سامة، غشاء impermeant، الحمضية نوكليك مناسبا صبغة ملزمة في 2.5x و تركيز الفحص النهائي.
- إضافة 20 ميكرولتر من الخليط إلى كل ثقافة J774A.1 جيدا، وحجم الفحص النهائي50 ميكرولتر، تركيز البكتيريا النهائي 1 × 10 6 خلية / مل (لوكس الاوبرون مراسل) أو 4 × 10 10 6 خلية / مل (الفلورسنت مراسل البروتين).
- احتضان عند 37 درجة مئوية لمدة 1-3 أيام في 5٪ CO 2 في 100٪ الرطوبة النسبية لمنع الآثار حافة التبخر.
- إضافة مركبات اختبار الفائدة (مركبات الفحص، والضوابط الإيجابية والسلبية لتثبيط نمو البكتيريا وتحلل الخلايا حقيقية النواة). يفضل حل حلول السهم عند ≥500x في DMSO (سلفوكسيد ثنائي ميثيل) أو محلول مائي للسماح للتخفيف كاف من السيارة.
- فحص قراءات
- قراءة نمو البكتيريا وسمية الخلايا حقيقية النواة على luminometer صفيحة ومقياس التألق بما يتناسب مع صحفيين المستخدمة.
- لتجنب الآثار الحافة المرتبطة درجة الحرارة، وتتوازن حراريا microplates قبل القراءة التلألؤ من وضع في طبقة واحدة على مقاعد البدلاء المختبر مع الأغطية مواربا لحوالي 20 دقيقة (أو في خزانة السلامة البيولوجية مع الأغطية قبالة لحوالي 10 دقيقة).
- العودة microplates إلى الحاضنة إذا هو المطلوب في الوقت الحقيقي قراءات في نقطة زمنية لاحقة.
- قراءة نمو البكتيريا وسمية الخلايا حقيقية النواة على luminometer صفيحة ومقياس التألق بما يتناسب مع صحفيين المستخدمة.
تحليل 2. البيانات
- تطبيع البيانات ليخدع الإيجابية والسلبيةمفاتيح التحكم لحساب المئة أو أضعاف لتثبيط نمو البكتيريا داخل الخلايا وفي المئة السمية الخلوية للخلايا حقيقية النواة.
- لتقييم فحص متانة، وحساب الفصل إحصائية بين الضوابط الإيجابية والسلبية على حد سواء تثبيط نمو البكتيريا والسمية الخلوية باستخدام Z-عامل (Z ') تحليل حيث Z' = 1-3 (σ ص + σ ن) / | ميكرون ص + ميكرون ن |. في هذه المعادلة، σ p و σ ن هي الانحرافات المعيارية للآبار المراقبة الإيجابية والسلبية، على التوالي؛ μ p و ميكرون ن هي القيم المتوسطة لآبار الإيجابية والسلبية السيطرة على التوالي.
- لفحوصات الكشف الإنتاجية العالية، وحساب القياسية ض عشرات (أو بديل آخر، المقاييس الإحصائية الكمية) لتقييم آثار المركبات اختبار الفائدة. بدلا من ذلك، وحساب بسيطة للحد أضعاف أو تسجيل أضعاف الحد كما يحتمل أن تكون من الناحية الفسيولوجية أكثر أهمية قياس تأثير حجم للبكتيريا تكرار هندسيا.
3. واحد ومتعدد الأبعاد (أي، التآزر) الجرعة والاستجابة اختبار وبيانات التفسير
- إعداد الضامة والبكتيريا كما هو موضح في قسم البروتوكول 1.
- فقط قبل الإصابة أو حضانة ممحوضة، إضافة مضادات الميكروبات من الفائدة التجريبية في المسلسل، ومضاعفة سلسلة التخفيف، وذلك بهدف الممتدة في نهاية عالية التركيز من شأنها أن تزيل تماما النمو (أي التركيز المثبط الأدنى أو MIC) وعلى انخفاض إنهاء الاعتقال التي لم تظهر اي نشاط واضح.
- استخدام نظام مناولة السائل الآلية لتسهيل واحدة بين الجرعة والاستجابة واندماجي إعداد اختبار التآزر من خلال المباشرة، بالإضافة الآلي من التخفيفات المضادة للميكروبات وفقا لبروتوكول الشركة المصنعة.
- النظر في استخدام التخفيفات-مضاعفة الفرعية، على سبيل المثال،841 / 54841eq1.jpg "/> - أضعاف سلسلة التخفيف، وفحص يعيد إلى زيادة دقة واستنساخ البيانات.
- للعدوى بلعم، وتمييع البكتيريا الانارة لاستهداف من 2.5 × 10 6 كفو (مستعمرة تشكيل وحدة) / مل في مستنبت الأنسجة. إضافة 20 ميكرولتر من الخليط إلى كل ثقافة J774A.1 جيدا، وحجم الفحص النهائي 50 ميكرولتر، تركيز البكتيريا النهائي 1 × 10 6 خلية / مل. واحتضان عند 37 درجة مئوية في 5٪ CO 2 في الرطوبة النسبية 100٪.
- لاختبار نمو ممحوضة، وتمييع البكتيريا الانارة لتركيز النهائي من 1 × 10 6 خلية / مل في آي المتوسطة، إضافة 50 ميكرولتر من كل بئر من 384 لوحة جيدا واحتضان عند 37 درجة مئوية في 5٪ CO 2 في الرطوبة النسبية 100٪.
- حساب مؤشر تركيز مثبط كسور لمجموعات مضادة للميكروبات التي تمنع نمو البكتيريا. لكل دواء في الجمع بين (أ، ب،.. ن) أن يؤدي إلى تثبيط كامل أو> 99٪ من البكتيريا زrowth، وحساب تركيز مثبط كسور الفردية (FIC أ، ب، ن...) على النحو التالي: اللجنة المالية و= تركيز مركب "أ" مقسوما على تركيز مثبط الحد الأدنى من "أ" في حد ذاته. . باستخدام نفس الصيغة، وحساب اللجنة المالية ب، وما إلى ذلك ثم حساب مؤشر FIC اندماجي أو
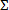 اللجنة المالية = اللجنة المالية واللجنة المالية + ب +. . .FIC ن لكل تركيبة المثبطة.
اللجنة المالية = اللجنة المالية واللجنة المالية + ب +. . .FIC ن لكل تركيبة المثبطة. - استخدام مؤشر اندماجي أن ينحرف أبعد من 1.0 إلى تقييم التآزر. النظر في قطع من ≤0.5 كمؤشر المحافظ من تأثير متناغم و≥4، لها تأثير مضاد. 12
- isobolograms المؤامرة، isobolograms isocontour، و / أو isosurface isobolograms 6 رسوما بيانية كما بديلة من آثار اندماجي.
النتائج
صفيحة فحص نمو الخلايا
البيانية الشكل 1 الخطوات الفحص. الخطوات الآلي يظهر لا يمكن أن يؤديها يدويا. ومع ذلك، ومما يسهل الإنتاجية إلى حد كبير باستخدام أنظمة مناولة السائل.
Discussion
وصفنا فحوصات في الوقت الحقيقي للكشف في وقت واحد من نمو البكتيريا داخل الخلايا والسمية لخلايا المضيف. هناك العديد من الخطوات الحاسمة في البروتوكول. أولا، لأداء فحص قوي، يجب أن يكون هناك ما يكفي من الفصل الطيفي بين قراءات البكتيرية والسمية الخلوية. هذا الفصل هو جوهري ل...
Disclosures
The authors have nothing to disclose.
Acknowledgements
وأيد دراسة نشرت في هذه المخطوطة من قبل المعهد الوطني للحساسية والأمراض المعدية التابع للمعاهد الوطنية للصحة تحت رقم جائزة R01AI099122 إلى JEK المحتوى هو فقط من مسؤولية الكتاب ولا تمثل بالضرورة وجهة النظر الرسمية للمعاهد الوطنية لل الصحة. ونود أن نشكر جنيفر سميث، ديفيد روبل، سو تشيانغ، دوغ الفيضانات، شون جونستون، جنيفر Nale، ستيوارت Rudnicki، بول يان، ريتشارد سيو، وراشيل واردن من مرفق فحص ICCB-لونجوود و / أو مختبر الفحص الوطني ل للمراكز الإقليمية لنيو إنجلاند للتميز في الدفاع البيولوجي والأمراض المعدية (بدعم من U54AI057159) للمساعدة في التنمية وأداء المقايسات فحص عالية الإنتاجية الناشئة. كما نود أن نشكر كينيث سميث لتعليقات مفيدة على المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| J774A.1 cells | American Type Culture Collection | TIB-67 | Host cell |
| ACES | Sigma-Aldrich | A9758 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Yeast extract, ultrafiltered | Becton-Dickinson/Difco | 210929 | For making buffered charcoal yeast extract agar and buffered yeast extract medium; lower grades may cause impaired growth and/or alter sensitivity of Legionella to growth inhibitors |
| Alpha-ketoglutaric acid, monopotassium salt | Sigma-Aldrich | K2000 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Sodium pyruvate | Sigma-Aldrich | P5280 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Potassium phosphate, dibasic | Thermo Fisher Scientific | P288-500 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| L-cysteine | Sigma-Aldrich | C-7755 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Ammonium iron(III) citrate | Sigma-Aldrich | F5879 | For making buffered charcoal yeast extract agar and buffered yeast extract medium; ferric pyrophosphate may be used instead but is more difficult to weigh accurately |
| Potassium hydroxide solution, concentrated | Thermo Fisher Scientific | SP236-500 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Deonized water | N/A | N/A | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Thymidine (tissue culture grade) | Sigma-Aldrich | T1895 | For supplementing both RPMI 1640 and buffered yeast extract agar/medium — lower grade thymidine may be used for the latter, but may cause impaired cell growth and/or cell death in RPMI 1640 |
| RPMI 1640, standard formulation | Corning via Thermo Fisher Scientific | 10-040-CV | For growing J774A.1 cells prior to plating; includes 2 mM L-glutamine |
| RPMI 1640 lacking phenol red | Corning via Thermo Fisher Scientific | 17-105-CV | For plating J774A.1 cells in 384 well dishes (not suitable for growth prior to plating); also lacks L-glutamine — supplement to 2 mM before use |
| L-glutamine, 200 mM in 0.85% NaCl (tissue culture grade) | HyClone via Thermo Fisher Scientific | SH30034.02 | For supplementing RPMI 1640 lacking L-glutamine, to 2 mM final concentration |
| Iron-supplemented calf serum | Gemini Bioproducts | 100-510 | For supplementing RPMI 1640, to 9.1% final concentration |
| Trypan Blue solution | Sigma-Aldrich | T8154 | For staining for J774A.1 cell death determination while counting cell density |
| SYTOX Green, 5 mM solution in DMSO | Thermo Fisher Scientific | S7020 | For staining for J774A.1 cell death determination by fluorescence reading or epifluorescence microscopy (in conjunction with orange-red or far red fluorescent bacteria). Use at 125 nM final concentration. |
| Cell culture incubator | Thermo Fisher Scientific | 13-255-26 | For incubation of J774A.1 cells (both before and after infection); can also be used for incubation of bacteria, or a standard atmosphere incubator can be used instead) |
| Orbital shaker | BellCo Glass | 7744-01010 | For shaking incubation of J774A.1 cells before infection; fits inside cell culture incubator; includes shaker base 7744-01000 and tray 7740-01010 (these are also available separately) |
| Shaker flasks (250 ml) | ChemGlass Life Sciences | CLS-2038-04 | For shaking incubation of J774A.1 cells before infection |
| Shaker clamps for flasks (250 ml) | BellCo Glass | 7744-16250 | For shaking incubation of J774A.1 cells before infection |
| Shaker flasks (1,000 ml) | ChemGlass Life Sciences | CLS-2038-07 | For shaking incubation of J774A.1 cells before infection |
| Shaker clamps for flasks (1,000 ml) | BellCo Glass | 7744-16100 | For shaking incubation of J774A.1 cells before infection |
| Sponge foam caps for flasks (250 ml-1,000 ml) | ChemGlass Life Sciences | CLS-1490-038 | For shaking incubation of J774A.1 cells before infection; reduces risk of contamination relative to standard metal caps |
| MultiDrop Combi programmable multichannel peristaltic pump | Thermo Fisher Scientific | 5840300 | For dispensing J774A.1 cells, medium, and bacterial suspension containing fluorophores to large numbers of 384 well dishes |
| Combi standard bore manifold | Thermo Fisher Scientific | 24072670 | Default predispense volume of 20 μl is insufficient to compensate for settling — increase to 80 μl |
| White 384 well dishes treated for tissue culture | Corning | 3570 | For reading luminescence and fluorescence; Greiner catalog # 781080 also tested successfully |
| DMSO (tissue culture grade, in sealed ampoules) | Sigma-Aldrich | D2650 | For dissolving positive control and test compounds |
| Azithromycin | Sigma-Aldrich | PHR1088 | Antibiotic positive control |
| Saponin (from Quillaja bark) | Sigma-Aldrich | S-4521 | Cytoxicity positive control |
| Multichannel pipettor | Thermo Fisher Scientific | Finnpipette | For transfer of fixed amounts of positive control compounds; pipettor must have digital dispensing with detents to enable repetitive fixed volume dispensing |
| Epson pin transfer robot | Epson/ICCB-L | (Custom equipment) | For transfer of fixed amounts of test compounds from library arrays |
| D300 digital dispensing system | Hewlett-Packard via Tecan | D300 | For transfer of variable amounts of test compounds ranging from 11 picoliters to 10 µl |
| T8+ cartridges for D300 digital dispensing system | Hewlett-Packard via Tecan | T8+ | For dispensing test compounds |
| Epifluorescence microscope with computer-connected digital camera | Nikon | Ti | For live cell imaging; any standard fluorescent microscope can substitute, with phase contrast or DIC optics, capable of imaging green (fluorescein), orange-red to red (Texas Red), and far-red (Cy5) fluorescence, with 100X oil objective for highest resolution |
| Glass-bottom tissue culture dishes | MatTek Corporation | P35G-1.5-20-C | For live cell imaging. Dishes such as the MatTek allow microscopic visualization at 600X or 1,000X magnification through use of an inverted epifluorescent or confocal microscope. These specific dishes are 3.5 cm nominal diameter, 3.3 cm inside diameter, with 20 mm diameter #1.5 thickness cover slips inserted into the bottoms. |
| Photoshop CS6 | Adobe | Adobe photoshop or similar programs can be used to pseudocolor and merge light microscopic and fluorescent images. | |
| Mathematica 10 | Wolfam | For generation of two-dimensioonal isocontour isobolograms and three-dimensional surface isobolograms. |
References
- Garzoni, C., Kelley, W. L. Staphylococcus aureus: new evidence for intracellular persistence. Trends Microbiol. 17 (2), 59-65 (2009).
- Rosen, D. A., et al. Utilization of an intracellular bacterial community pathway in Klebsiella pneumoniae urinary tract infection and the effects of FimK on type 1 pilus expression. Infect Immun. 76 (7), 3337-3345 (2008).
- Blango, M. G., Mulvey, M. A. Persistence of uropathogenic Escherichia coli in the face of multiple antibiotics. Antimicrob Agents Chemother. 54 (5), 1855-1863 (2010).
- Chiaraviglio, L., Kirby, J. E. Evaluation of impermeant, DNA-binding dye fluorescence as a real-time readout of eukaryotic cell toxicity in a high throughput screening format. Assay Drug Dev Technol. 12 (4), 219-228 (2014).
- Edelstein, P. H. Antimicrobial chemotherapy for legionnaires' disease: a review. Clin Infect Dis. 21 Suppl 3, S265-S276 (1995).
- Chiaraviglio, L., Kirby, J. E. High-Throughput Intracellular Antimicrobial Susceptibility Testing of Legionella pneumophila. Antimicrob Agents Chemother. 59 (12), 7517-7529 (2015).
- Pedro-Botet, L., Yu, V. L. Legionella: macrolides or quinolones?. Clin Microbiol Infect. 12 Suppl 3, 25-30 (2006).
- Coers, J., Vance, R. E., Fontana, M. F., Dietrich, W. F. Restriction of Legionella pneumophila growth in macrophages requires the concerted action of cytokine and Naip5/Ipaf signalling pathways. Cell Microbiol. 9 (10), 2344-2357 (2007).
- Chu, J., et al. Non-invasive intravital imaging of cellular differentiation with a bright red-excitable fluorescent protein. Nat Methods. 11 (5), 572-578 (2014).
- Eliopoulos, G. M., Moellering, R. C., Lorian, V. Ch. 9. Antimicrobial combinations. In: Antibiotics in Laboratory Medicin. , 330-396 (1996).
- Jones, R. E., Zheng, W., McKew, J. C., Chen, C. Z. An alternative direct compound dispensing method using the HP D300 digital dispenser. J Lab Autom. 18 (5), 367-374 (2013).
- Odds, F. C. Synergy, antagonism, and what the chequerboard puts between them. J Antimicrob Chemother. 52 (1), (2003).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat Biotechnol. 22 (12), 1567-1572 (2004).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nat Methods. 9 (10), 1005-1012 (2012).
- Berger, K. H., Merriam, J. J., Isberg, R. R. Altered intracellular targeting properties associated with mutations in the Legionella pneumophila dotA gene. Mol Microbiol. 14 (4), 809-822 (1994).
- Berger, K. H., Isberg, R. R. Two distinct defects in intracellular growth complemented by a single genetic locus in Legionella pneumophila. Mol Microbiol. 7 (1), 7-19 (1993).
- Vogel, J. P., Isberg, R. R. Cell biology of Legionella pneumophila. Curr Opin Microbiol. 2 (1), 30-34 (1999).
- Kirby, J. E., Isberg, R. R. Legionnaires' disease: the pore macrophage and the legion of terror within. Trends Microbiol. 6 (7), 256-258 (1998).
- Kirby, J. E., Vogel, J. P., Andrews, H. L., Isberg, R. R. Evidence for pore-forming ability by Legionella pneumophila. Mol Microbiol. 27 (2), 323-336 (1998).
- Vogel, J. P., Andrews, H. L., Wong, S. K., Isberg, R. R. Conjugative transfer by the virulence system of Legionella pneumophila. Science. 279 (5352), 873-876 (1998).
- Song, H., Fares, M., Maguire, K. R., Sidén, A., Potácová, Z. Cytotoxic Effects of Tetracycline Analogues (Doxycycline, Minocycline and COL-3) in Acute Myeloid Leukemia HL-60 Cells. PLoS ONE. 9 (12), e114457 (2014).
- Isberg, R. R., Falkow, S. A single genetic locus encoded by Yersinia pseudotuberculosis permits invasion of cultured animal cells by Escherichia coli K-12. Nature. 317 (6034), 262-264 (1985).
- Niles, A. L., Moravec, R. A., Riss, T. L. Update on in vitro cytotoxicity assays for drug development. Expert Opin Drug Discov. 3 (6), 655-669 (2008).
- Niles, A. L., Moravec, R. A., Riss, T. L. In vitro viability and cytotoxicity testing and same-well multi-parametric combinations for high throughput screening. Curr Chem Genomics. 3, 33-41 (2009).
- Mayr, L. M., Bojanic, D. Novel trends in high-throughput screening. Curr Opin Pharmacol. 9 (5), 580-588 (2009).
- Dunlap, P., Thouand, G., Marks, R. Biochemistry and genetics of bacterial bioluminescence. Bioluminescence: Fundamentals and Applications in Biotechnology - Volume 1. 1, 37-64 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved