Method Article
السريع العصبية تمايز الخلايا الجذعية المستحثة متعددة القدرات لقياس نشاط الشبكة على المصفوفات الدقيقة الكهربائي
* These authors contributed equally
In This Article
Summary
نحن تعديل وتنفيذ بروتوكول نشرت سابقا تصف التمايز السريع، واستنساخه، وكفاءة الناجمة عن النشاط البشري الخلايا الجذعية المحفزة (hiPSCs) في العصبونات القشرية مثير 12. على وجه التحديد، لدينا التعديل يسمح للسيطرة على كثافة الخلايا العصبية واستخدامها في صفائف الكهربائي الصغير لقياس الخصائص الكهربية على مستوى الشبكة.
Abstract
الخلايا العصبية مشتقة من فعل الإنسان الخلايا الجذعية المحفزة (hiPSCs) توفير أداة جديدة واعدة لدراسة الاضطرابات العصبية. في العقد الماضي، وقد وضعت بروتوكولات عديدة للتمييز hiPSCs إلى الخلايا العصبية. ومع ذلك، فإن هذه البروتوكولات هي غالبا ما تكون بطيئة مع تقلبات عالية، وانخفاض استنساخ، وانخفاض الكفاءة. وبالإضافة إلى ذلك، فإن الخلايا العصبية التي تم الحصول عليها مع هذه البروتوكولات وغالبا ما تكون غير ناضجة وتفتقر إلى النشاط الوظيفي الكافي على الصعيدين حيدة الخلية والشبكة ما لم الخلايا العصبية يتم تربيتها لعدة أشهر. ويرجع ذلك جزئيا إلى هذه القيود، والخصائص الوظيفية للشبكات العصبية مشتقة hiPSC-لا تزال تتميز ليس على ما يرام. هنا، علينا أن نكيف بروتوكول نشر مؤخرا أن يصف إنتاج الخلايا العصبية البشرية من hiPSCs بواسطة التعبير القسري للعامل النسخ neurogenin-2 12. هذا البروتوكول هو السريع (الغلة الخلايا العصبية الناضجة في غضون 3 أسابيع) وكفاءة، مع ما يقرب من 100٪ كفاءة التحويل من transducخلايا إد (> 95٪ من الخلايا دابي الإيجابي هي MAP2 إيجابي). وعلاوة على ذلك، فإن بروتوكول غلة السكان متجانسة من الخلايا العصبية مثير من شأنه أن يسمح التحقيق في الخلية من نوع المساهمات المحددة لاضطرابات عصبية. نحن تعديل البروتوكول الأصلي عن طريق توليد خلايا hiPSC transduced ثابت، مما يتيح لنا التحكم الصريح على العدد الكلي للخلايا العصبية. ثم يتم استخدام هذه الخلايا لتوليد الشبكات العصبية مشتقة hiPSC على صفائف الكهربائي الصغير. في هذه الطريقة، والنشاط الكهربية التلقائي للشبكات العصبية مشتقة hiPSC ويمكن قياسها وتتميز، مع الحفاظ على الاتساق interexperimental من حيث كثافة الخلية. بروتوكول المعروضة ينطبق على نطاق واسع، وخاصة بالنسبة للدراسات الميكانيكية والدوائية على شبكات الخلايا العصبية البشرية.
Introduction
تطوير الناجمة عن النشاط البشري الخلايا الجذعية المحفزة (hiPSCs) بروتوكولات التمايز لتوليد الخلايا العصبية البشرية في المختبر قدمت أداة قوية جديدة لدراسة الاضطرابات العصبية. حتى وقت قريب، وقد أعاق دراسة هذه الاضطرابات بشدة من عدم وجود نظم نموذج باستخدام الخلايا العصبية البشرية. على الرغم من القوارض يمكن استخدامها لدراسة الاضطرابات العصبية، ونتائج مثل هذه الدراسات لا يمكن ترجمتها بسهولة إلى البشر 1. ونظرا لهذه القيود، الخلايا العصبية المستمدة hiPSC-هي نموذج بديل واعد والتي يمكن استخدامها لتوضيح الآليات الجزيئية الكامنة وراء الاضطرابات العصبية وفي المختبر فحص المخدرات.
في العقد الماضي، عدة بروتوكولات لتحويل وضعت hiPSCs إلى الخلايا العصبية 2-8. ومع ذلك، هذه البروتوكولات لا تزال محدودة في نواح كثيرة. أولا، بروتوكولات غالبا ما تستغرق وقتا طويلا: توليد الخلايا العصبية مع النضج الكافي (أي synapتشكيل ذاته) ونشاط وظيفي يتطلب أشهر من إجراءات زراعة، مما يجعل الدراسات على نطاق واسع الصعبة 9. وبالإضافة إلى ذلك، hiPSC إلى الخلايا العصبية كفاءة التحويل منخفضة. بروتوكولات غالبا ما تسفر عن السكان غير متجانسة من الخلايا العصبية، وبالتالي لا تسمح دراسات فرعية معينة من الخلايا العصبية. وعلاوة على ذلك، فإن البروتوكولات ليست قابلة للتكرار، مما أسفر عن نتائج مختلفة لمختلف خطوط التوجيهية 10،11. وأخيرا، فإن مرحلة النضج والخصائص الوظيفية للخلايا العصبية الناتجة أيضا متغيرة 10.
لمعالجة هذه المشاكل، وتشانغ وآخرون. (2013) 12 وضعت البروتوكول الذي يولد بسرعة وبتكاثر الخلايا العصبية البشرية من hiPSCs التي كتبها overexpressing عامل النسخ neurogenin-2. كما ذكرت من قبل المؤلفين، يحدث التمايز بسرعة نسبيا (فقط 2 - بعد 3 أسابيع حمل تعبيرا عن neurogenin-2)، والبروتوكول هو استنساخه (خصائص الخلايا العصبية مستقلة عن الصورةtarting خط hiPSC)، وتحويل hiPSC إلى الخلايا العصبية هو كفاءة عالية (حوالي 100٪). السكان من الخلايا العصبية ولدت مع بروتوكول بهم ومتجانسة (تشبه العليا طبقة الخلايا العصبية القشرية)، مما يتيح للتحقيق في الخلية من نوع مساهمات محددة للاضطرابات العصبية. وعلاوة على ذلك، أظهرت الخلايا العصبية المستمدة hiPSC-خصائص الناضجة (على سبيل المثال، القدرة على تشكيل نقاط الاشتباك العصبي ونشاط وظيفي قوي) بعد د 20 فقط.
وصف الخصائص الكهربية للخلايا العصبية مشتقة hiPSC على مستوى شبكة شرط مسبق هام قبل التكنولوجيا hiPSC يمكن استغلالها لدراسة الأمراض التي تصيب الإنسان. لهذا السبب، وقد بدأت العديد من المجموعات البحثية مؤخرا للتحقيق في الخلايا العصبية المشتقة الخلايا الجذعية على مستوى الشبكة باستخدام مجموعة الكهربائي الصغير (MEA) الأجهزة (النظم المتعددة، ريوتلنجن، ألمانيا) 13-16. هي جزء لا يتجزأ من الأقطاب الكهربائية من الشرق الأوسط وأفريقيا في الركيزة التي الخلايا العصبية يمكن تربيتها.الاتفاقات البيئية المتعددة الأطراف يمكن استخدامها لاستكشاف الخصائص الكهربية للشبكات العصبية والتنمية في المختبر من نشاطها. حاليا، تستخدم الاتفاقات البيئية المتعددة الأطراف فقط في تركيبة مع بروتوكولات التمايز التي تستغرق عدة أشهر لانتاج شبكات ناضجة. وبالتالي، والجمع بين الاتفاقات البيئية المتعددة الأطراف مع بروتوكول التمايز السريع من شأنها أن تسهل استخدام هذه التكنولوجيا في الدراسات على نطاق واسع من الاضطرابات العصبية.
هنا، نقدم تعديل آل تشانغ وآخرون. (2013) 12 البروتوكول وتكييفه للاستخدام على الاتفاقات البيئية المتعددة الأطراف. على وجه الخصوص، بدلا من الاعتماد على تنبيغ lentiviral الحاد، ونحن بدلا من ذلك خلق خطوط hiPSC التعبير عن مستقر rtTA / Ngn2 قبل إحداث التمايز. فعلنا هذا في المقام الأول إلى السيطرة استنساخه على كثافة الخلايا العصبية، حيث أن كثافة الخلايا العصبية هو أمر حاسم لتشكيل شبكة الخلايا العصبية، والاتصال الجيد بين الخلايا العصبية والأقطاب من الشرق الأوسط وأفريقيا 17،18. الثوجح آل تشانغ وآخرون. بروتوكول فعال جدا فيما يتعلق تحويل hiPSCs transduced، فمن متغير بطبيعته فيما يتعلق العائد النهائي من الخلايا العصبية من عدد hiPSCs مطلي في البداية (انظر الشكل 2E في تشانغ وآخرون.) 12. مع خط ثابت، علينا القضاء على العديد من القضايا تسبب تقلبات، مثل سمية lentiviral وكفاءة العدوى. نحن ثم الأمثل المعلمات التي تنتج بشكل موثوق الشبكات العصبية مشتقة hiPSC على الاتفاقات البيئية المتعددة الأطراف، والحصول على نضوج شبكة (على سبيل المثال، أحداث متزامنة بين أغلبية من القنوات) في الأسبوع الثالث. هذا البروتوكول السريع والموثوق به هذا يجب تمكين مقارنات مباشرة بين الخلايا العصبية المستمدة من مختلف خطوط hiPSC (أي المريض محددة)، وكذلك توفير الاتساق القوي للدراسات الدوائية.
Protocol
أجريت جميع التجارب على الحيوانات وفقا للمبادئ التوجيهية رعاية الحيوان واستخدام وافقت لجنة رعاية الحيوان، المركز الطبي في جامعة رادبود، هولندا، (RU-ديسمبر-2011-021، البروتوكول رقم: 77073).
1. الدبقية عزل الخلايا والثقافة
ملاحظة: يعتمد بروتوكول المعروضة هنا على عمل مكارثي ودي Vellis 19، وبروتوكول مفصلة مشابهة جدا لالنجمية الماوس متاح 20. لتوليد الثقافات الأولية من الخلايا النجمية القشرية من الجنينية (E18) أدمغة الفئران، يحتاج الفئران الحوامل لا بد من التضحية، تحتاج الأجنة إلى أن تحصد من الرحم، ويحتاج إلى أن تكون معزولة من الأجنة العقول. لملء قارورة T75، لا بد من الجمع بين القشور من 2 العقول الجنينية. وكبديل لذلك، الخلايا النجمية النقاء والمجمدة المتاحة تجاريا يمكن شراؤها.
- إعداد قارورة ثقافة T75
- تمييع بولي-D-ليسين (PDL) فيمعقم، عالى النقاء المياه إلى تركيز النهائي من 10 ميكروغرام / مل. إضافة 5 مل من PDL المخفف إلى قارورة ثقافة T75. حفيف حول بلطف لترطيب سطح النمو بأكمله. ضع قارورة في ترطيب الحاضنة 37 درجة مئوية لمدة 3 ساعات.
- نضح PDL من القارورة. شطف 3X قارورة مع 5 مل ماء معقم لإزالة PDL غير منضم. نضح الماء تماما. ترك القارورة لتجف في غطاء تدفق الصفحي أو استخدامها على الفور.
- تشريح قشرات
- تجهيز 50 مل تشريح المتوسطة: Lebovitz في L-15 متوسطة مع 2٪ (ت / ت) B-27 الملحق. الحفاظ على الجليد.
- تخدير الفئران عميقا مع isoflurane في غرفة الاستقراء (صندوق زجاجي صغير) حتى يتوقف التنفس (~ 5-8 دقيقة). إزالة الفئران من غرفة تحريض والموت الرحيم على الفور من قبل خلع عنق الرحم.
- رش البطن من الفئران مع 70٪ ETOH ويمسح الزائد. كشف وإزالة الرحم من السد عبر secti القيصريةحول استخدام زوج من مقص 21.
- قطع الأجنة الفردية من الحويصلات الخاصة الذي يحيط بالجنين مع مقص، ونقل إلى طبق بتري معقمة مليئة المتوسطة تشريح الباردة، والحفاظ على الجليد.
- نقل الأجنة مرة أخرى إلى ذلك، معقم 6 سم طبق بيتري جديدة مليئة المتوسطة تشريح الباردة. استخراج العقول من الأجنة تحت المجهر ستيريو. لفضح الدماغ، قشر بلطف بعيدا الجلد والجمجمة باستخدام ملقط. حلج القطن بلطف من الدماغ بأكمله ونقل إلى 35 ملم طبق بيتري مع الطازجة والمتوسطة تشريح الباردة.
ملاحظة: العقول الجامع تشريح من الأجنة يمكن تخزينها في المتوسط تشريح على الجليد لعدة ساعات دون أن تفقد الجدوى الخلوية. - فصل نصفي الكرة الأرضية من كل الدماغ من خلال قطع خط الوسط مع مقص الربيع ذات الرؤوس غرامة أو مشرط. تجريد بعناية قبالة السحايا مع ملقط يميل غرامة على التوالي.
ملاحظة: من المهم جدا لإزالة السحايا تماما. عشرهو تلوث الخلايا الليفية يمنع من ثقافة نجمية. الخلايا الليفية هي تقسيم بسرعة الخلايا وسوف تحل محل في نهاية المطاف خلايا أخرى. - إزالة المخ الأوسط / المخطط والبصلة الشمية مع مقص الربيع أو مشرط. كما تأكد لإزالة الحصين (على شكل C-الهيكل الذي هو perimedian والذيلية فيما يتعلق القشرة) مع مقص الربيع أو مشرط. جمع نصفي الكرة الأرضية القشرية في أنبوب 15 مل الطرد المركزي مليئة 5 مل تشريح المتوسطة. الحفاظ على الجليد.
- تفكك قشرات
- إعداد 2 مل كا 2+ / المغنيسيوم 2+ خالية من هانك المتوازن محلول الملح (HBSS) مع 0.25٪ التربسين (التفكك المتوسطة). تجهيز 50 مل ارتفاع الجلوكوز Dulbecco لتعديل المتوسطة النسر (DMEM) مع 15٪ (ت / ت) مصل بقري جنيني (FBS) و 1٪ (ت / ت) البنسلين / الستربتومايسين (مستنبت) وفلتر تعقيم.
- السماح للأنسجة تترسب في قاع أنبوب الطرد المركزي. كما بعنايةقراصنة كما الكثير من المتوسط تشريح ممكن من فوق الأنسجة. غسل الأنسجة مع 5 مل كا 2+ / المغنيسيوم 2+ خالية HBSS (بدون التربسين) والسماح للأنسجة ليستقر على مستوى الجزء السفلي من الأنبوب.
- نضح بعناية HBSS. إضافة 2 مل تفارق المتوسطة ونفض الغبار الأنبوب برفق لمزج الانزيم في جميع أنحاء الأنسجة. احتضان في 37 درجة مئوية حمام الماء لمدة 5-10 دقائق. نفض الغبار الأنبوب عدة مرات خلال حضانة للتحريض على الأنسجة.
- يسحن على الفور الأنسجة باستخدام 1000 ميكرولتر ماصة. تعيين حجم pipetter إلى حوالي 800 ميكرولتر. نضح القطع وإخراج بقوة على الجانب من الأنبوب، مباشرة فوق خط السائل. ومع ذلك، في محاولة للحد من الفقاعات أو الرغوة. كرر حتى يتم فصل الأنسجة بما فيه الكفاية، حوالي 15 - 20x و. إضافة 8 مل مستنبت لإبطال نشاط التربسين. المزيج بلطف قلب الأنبوب عدة مرات.
- تمرير تعليق الخلية من خلال مصفاة الخلية 70 ميكرومتر وضعت على رأس 50 مأنبوب الطرد المركزي L. شطف أنبوب 15 مل مع مستنبت وتصفية المتوسطة من خلال مصفاة خلية لجمع المتوسط في أنبوب 50 مل مع تعليق الخلية. شطف مصفاة الخلية عدة مرات مع الثقافة المتوسطة. بعد الشطف، يجب أن يكون الحجم النهائي حوالي 20 - 25 مل.
- بيليه الخلايا في 200 x ج لمدة 10 دقيقة. بعناية نضح قدر متوسطة وقت ممكن، دون لمس بيليه الخلية. Resuspend الخلايا في 1 مل مستنبت باستخدام 1000 ميكرولتر ماصة. إضافة 11 مل مستنبت prewarmed وتخلط بلطف (لمنع الفقاعات) باستخدام ماصة 10 مل.
- شطف القارورة T75 المغلفة PDL مرة واحدة مع 5 مل مستنبت. نضح المتوسطة ونقل تعليق الخلية إلى القارورة. كل الخلايا في تعليق ومطلي، ونجد أنه لا لزوم لها عموما أن يعول عليها، لأن الخلايا النجمية لا يمكن أن تكون متباينة من الخلايا الأخرى في التعليق. ضع قارورة في ترطيب 37 درجة مئوية مع حاضنة جو من 5٪ CO 2 وأو يومين.
- توسعة وصيانة الخلايا النجمية
- استبدال المتوسطة كامل لأول مرة 2 د بعد الطلاء الأولي. استبدال المتوسطة بأكمله بعد ذلك كل 3 د. دائما prewarm وسيلة جديدة ل37 درجة مئوية قبل إضافة إلى الخلايا.
ملاحظة: الخلايا النجمية تتطلب 7-10 د لتصل إلى ما يقرب من 90٪ confluency (تظهر الخلايا النجمية كما أحادي الطبقة موزايكية المزدحمة بالسكان، مع الخلايا الدبقية الصغيرة و oligodendrocytes الكذب على رأس واختلط). - عندما تصل الخلايا النجمية ما يقرب من 90٪ confluency، هز قارورة لإزالة الخلايا الدبقية تلويث:
- إزالة قارورة من الحاضنة وإحكام الغطاء (الفينول) أو تغطية منفذ (تصفية). لإزالة الخلايا الدبقية الصغيرة، هز قارورة على منصة مدارية في 180 دورة في الدقيقة لمدة 1 ساعة. نضح في المتوسط. شطف مرة واحدة مع درجة حرارة قبل 5 مل الثقافة المتوسطة، نضح واستبدالها مع 12 مل من مستنبت.
- لازالةوقليلة التغصن، والعودة القارورة إلى منصة المدارية ويهز في 250 دورة في الدقيقة، 37 درجة مئوية لمدة لا تقل عن 7 ساعات، ولكن يفضل O / N.
- نضح في المتوسط. شطف مرة واحدة مع درجة حرارة قبل 5 مل الثقافة المتوسطة، نضح واستبدالها مع 12 مل من مستنبت. العودة القارورة إلى حاضنة.
- عندما 100٪ متموجة، تقسيم الخلايا النجمية باستخدام الإجراءات القياسية في نسبة 1: 3-1: 2 مع 0.05٪ حمض التربسين ethylenediaminetetraacetic (EDTA). وهناك قارورة T75 في 100٪ confluency عادة تنتج حوالي 4.0 × 10 6 خلايا في المجموع. وبموجب هذا الجدول الزمني، ويمكن عادة الثقافات تقسيمها مرة واحدة في الأسبوع.
ملاحظة: عندما تصل الخلايا النجمية confluency، ويمكن حصادها واستخدامها لhiPSC التمايز كما هو موضح أدناه في بروتوكول الخطوة 3.4. الخلايا النجمية يمكن تقسيم مرة واحدة على الأقل من دون خسارة ملحوظة من قدرتها على البقاء. ويمكن الحفاظ لمدة تصل إلى 2 أشهر في الثقافة. من واقع التجربة الأولية الجنينية يوم 18 النجمية الفئران progrأصبح essively متباينة عضال و / أو فقدان الجدوى بعد انفصالها المتكرر. على الرغم من أنه من الممكن تجميد الخلايا النجمية لاستخدامها في المستقبل، ونحن نفضل لعزل الخلايا النجمية من العقول الجنينية جديدة عند الحاجة.
- استبدال المتوسطة كامل لأول مرة 2 د بعد الطلاء الأولي. استبدال المتوسطة بأكمله بعد ذلك كل 3 د. دائما prewarm وسيلة جديدة ل37 درجة مئوية قبل إضافة إلى الخلايا.
2. توليد rtTA / Ngn2 -positive hiPSCs
ملاحظة: تم إنشاء وhiPSCs تستخدم لتجاربنا في المنزل من قبل تنبيغ lentiviral من الخلايا الليفية الإنسان مع إعادة برمجة عوامل cMYC، SOX2، OCT4 وKLF4.
ملاحظة: للحصول على جيل من rtTA / Ngn2 hiPSCs -positive، وتستخدم ناقلات lentiviral لدمج مستقر الجينات المحورة في جينوم hiPSCs. تم نشر بروتوكول للإنتاج الفيروسة البطيئة سابقا 22. وترد تفاصيل عن ناقلات التعبئة lentiviral التي تستخدم لإنتاج الجسيمات الفيروسة البطيئة rtTA وNgn2 في جدول المواد / المعدات. ناقلات نقل تستخدم لالفيروسة البطيئة rtTA هو pLVX-EF1α- (تيت على اساس متقدم) -IRES-G418 (R)؛ أي أن هذا ناقلات يشفر تيت أون transactivator متقدمة تحت سيطرة أحد المروجين EF1α التأسيسي ويمنح مقاومة للمضادات الحيوية G418. ناقلات نقل تستخدم لالفيروسة البطيئة Ngn2 هو pLVX- (TRE-thight) - (الماوس) Ngn2-PGK-بوروميسين (R)؛ أي أن هذا ناقلات الجينات وتشفير للneurogenin-2 الفئران تحت سيطرة أحد المروجين يسيطر تيت والجينات المقاومة بوروميسين تحت سيطرة أحد المروجين PGK التأسيسي. وبالتالي، باستخدام هذه النواقل نقل اثنين، يمكن إنشاء خط hiPSC التي التعبير عن neurogenin-2 الفئران يمكن أن يتسبب من خلال استكمال المتوسطة مع الدوكسيسيكلين. لتنبيغ من hiPSCs، يتم استخدام طاف مع الجسيمات الفيروسة البطيئة (المشار إليها باسم "تعليق الفيروسة البطيئة" في ما تبقى من النص)، أي خفة دمالحوت تركيز الجسيمات باستخدام تنبيذ فائق.
- لوحة للhiPSCs (يوم 1)
ملاحظة: وحدات التخزين التي يتم ذكرها في هذا البروتوكول تفترض أن hiPSCs ومثقف في لوحة 6 جيدا وأن الخلايا من بئر واحدة ويتم حصاد. وبالإضافة إلى ذلك، فمن المفترض أن الخلايا مطلي في وقت لاحق في 12 بئرا من لوحة جيدا 12.- إعداد 10 مل DMEM البارد / F12 مع 1٪ (ت / ت) بدروم غشاء مصفوفة (BMM) للحصول على المخفف BMM. إضافة 800 ميكرولتر المخفف BMM لكل بئر من لوحة جيدا 12. احتضان لمدة 1 ساعة على الأقل في ترطيب 37 درجة مئوية مع حاضنة جو من 5٪ CO 2. قبل الاستخدام، احتضان لوحة لمدة 1 ساعة على RT.
- دافئ 15 مل من الضروري 8 (E8) المتوسطة مع 1٪ (ت / ت) البنسلين / الستربتومايسين، 9 مل DMEM / F12 و 1 مل من محلول خلية مفرزة (CDS) إلى درجة حرارة الغرفة. تكملة المتوسطة E8 مع المرتبطة رو-بروتين كيناز (ROCK) المانع.
- نضح المتوسط أمضى من hiPSCs لد إضافة 1 مل CDS إلى hiPSCs. احتضان 3-5 دقيقة في ترطيب 37 درجة مئوية مع حاضنة جو من 5٪ CO 2. الاختيار تحت المجهر ما إذا كانت الخلايا فصل بعضها عن بعض.
- إضافة 2 مل DMEM / F12 في البئر، تعليق بلطف الخلايا مع ميكرولتر ماصة 1000 ونقل الخلايا إلى أنبوب 15 مل. إضافة 7 مل DMEM / F12 لتعليق الخلية. تدور الخلايا في 200 x ج لمدة 5 دقائق.
- نضح طاف وإضافة 2 مل من المتوسط E8 أعد. الحصول على تعليق الخلية التي تم فصلها من hiPSCs (لا تشكل كتل الخلايا) عن طريق وضع غيض من ماصة 1000 ميكرولتر ضد الجانب من الأنبوب 15 مل وإعادة التعليق الخلايا بلطف. الاختيار تحت المجهر سواء فصلها الخلايا.
- تحديد عدد الخلايا (خلية / مل) باستخدام غرفة عدادة الكريات.
ملاحظة: لوحة 6 جيدا بشكل جيد في 80 - سوف 90٪ confluency تسفر عادة 3،0-4،0 × 10 6 خلايا في المجموع. - نضحالمخفف BMM من الآبار لوحة جيدا 12. تمييع الخلايا للحصول على تعليق خلية من 3.0 × 10 4 خلية / مل. لوحة 1 مل من تعليق خلية لكل بئر من لوحة جيدا 12. وضع 12 لوحة جيدا O / N في ترطيب 37 درجة مئوية مع حاضنة جو من 5٪ CO 2.
- تنبيغ الخلايا المحفزة مع rtTA وNgn2 الفيروسة البطيئة (اليوم 2)
- دافئ المتوسطة 12 مل E8 مع 1٪ (ت / ت) البنسلين / الستربتومايسين إلى درجة حرارة الغرفة. تكملة المتوسطة E8 مع مثبط ROCK وpolybrene إلى تركيز النهائي من 8 ميكروغرام / مل إلى متوسطة E8.
- ذوبان الجليد في قسامات مع تعليق الفيروسة البطيئة. إضافة polybrene إلى تركيز النهائي من 8 ميكروغرام / مل إلى تعليق الفيروسة البطيئة. نضح المتوسط المستهلك وإضافة 1 مل من المتوسط E8 على استعداد لكل بئر.
- أداء تنبيغ مع كميات مختلفة من rtTA - وتعليق Ngn2 -lentivirus. على سبيل المثال، transduم وhiPSCs بإضافة 100 ميكرولتر من كل من -lentivirus rtTA وNgn2 تعليق -lentivirus إلى جانب واحد من لوحة جيدا 12. لآبار أخرى، استخدم 200 ميكرولتر 300 ميكرولتر 400 ميكرولتر و 500 ميكرولتر تعليق الفيروسة البطيئة بدلا من 100 ميليلتر. لا ينبغي أن transduced في hiPSCs بئرين لوحة 12 أيضا؛ أنها ستكون بمثابة الضوابط خلال التحديد.
ملاحظة: يتم تنفيذ transductions يفضل في نسختين، بحيث يمكن تقدير كفاءة ترنسدوكأيشن أكثر دقة بعد بدء اختيار (انظر بروتوكول خطوة 2.2.4). كمية تعليق الفيروسة البطيئة المطلوبة لتنبيغ بكفاءة غالبية hiPSCs يعتمد على عيار تعليق الفيروسة البطيئة وخط hiPSC الذي يتم استخدامه. في هذه الدراسة، ونحن عادة استخدام 100-500 ميكرولتر من تعليق الفيروسة البطيئة لتنبيغ من hiPSCs. - وضع لوحة جيدا 12 في ترطيب 37 درجة مئوية مع حاضنة جو من 5٪ CO2 لمدة 6 ساعات. قبل نهاية فترة الحضانة 6 ساعات، دافئ المتوسطة 12 مل E8 مع 1٪ (ت / ت) البنسلين / الستربتومايسين و 12 مل Dulbecco ومخزنة الفوسفات المالحة (DPBS) إلى RT. تكملة المتوسطة E8 مع مثبط ROCK.
- نضح المتوسطة E8 المستهلك. يغسل كل جيدا مع 1 مل DPBS. إضافة 1 مل من المتوسط E8 على استعداد لكل بئر. وضع 12 لوحة جيدا O / N في ترطيب 37 درجة مئوية مع حاضنة جو من 5٪ CO 2.
- تحديث المتوسطة E8 (اليوم 3)
- دافئ المتوسطة 12 مل E8 مع 1٪ (ت / ت) البنسلين / الستربتومايسين لRT. نضح المتوسط أمضى من الآبار لوحة جيدا 12 وإضافة 1 مل من المتوسط E8 على استعداد لكل بئر. وضع 12 لوحة جيدا O / N في ترطيب 37 درجة مئوية مع حاضنة جو من 5٪ CO 2.
- أداء التحديد مع بوروميسين وG418 (يوم 4-8)
ملاحظة: اعتمادا على معدل انقسام الخلايا في الوركخط SC وكفاءة تنبيغ lentiviral، الخلايا قد يصل إلى 70-80٪ confluency خلال فترة الاختيار، وعند هذه النقطة لا بد من تقسيم الثقافات. لأن توقيت تقسيم لا يمكن التنبؤ مسبقا، لن يتم ذكرها في البروتوكول. ومع ذلك، بدلا من تحديث المتوسطة E8 تستكمل مع تركيزات المذكورة بوروميسين وG418، يمكن للمرء أن تقسيم الثقافة hiPSC كثقافة hiPSC العادية (بما في ذلك طلاء الخلايا على لوحات المغلفة vitronectin). والاستثناء الوحيد هو أن الوسط E8 يجب أن تستكمل مع تركيزات المذكورة من المضادات الحيوية لمواصلة التحديد.- دافئ المتوسطة 12 مل E8 مع 1٪ (ت / ت) البنسلين / الستربتومايسين إلى درجة حرارة الغرفة. إضافة بوروميسين وG418 للاختيار، يتم إضافة كميات مختلفة من المضادات الحيوية خلال فترة اختيار (الجدول 1).
- تقدير كفاءة ترنسدوكأيشن عن طريق تقدير النسبة المئوية للG418- وبوروميسينخلايا مقاوم لل. لتقدير النسبة المئوية للخلايا المقاومة، وتقدير النسبة المئوية للخلايا الميتة (خلايا غير المقاومة) لظروف مختلفة (ثقافات transduced مع كميات مختلفة من تعليق الفيروسة البطيئة) وللخلايا nontransduced (الخلايا التي تشكل عنصر تحكم الاختيار). حساب النسبة المئوية للخلايا المقاومة كما [100٪ - (النسبة المئوية للخلايا الميتة)].
ملاحظة: إذا تم إجراء transductions مع كميات مختلفة من تعليق الفيروسة البطيئة في نسختين، ويمكن تقدير كفاءة ترنسدوكأيشن بشكل أكثر دقة. الشرط مع الخلايا غير transduced بمثابة السيطرة الاختيار؛ وينبغي أن تكون النسب المئوية للخلايا الميتة لثقافات transduced مع كميات مختلفة من تعليق الفيروسة البطيئة أقل. وتستخدم النسبة التقديرية للخلايا مقاومة للاختيار hiPSCs التي من المرجح إيجابية لكلا الجينات المحورة. بشكل عام، اخترنا كان hiPSCs من حالة التنبيغ> 90٪ من الخليةالصورة البقاء على قيد الحياة 5 د فترة الاختيار. - نضح المتوسط أمضى من hiPSCs وإضافة 1 مل من المتوسط E8 على استعداد للآبار. وضع 12 لوحة جيدا O / N في ترطيب 37 درجة مئوية مع حاضنة جو من 5٪ CO 2.
| تركيز النهائي من G418 | تركيز النهائي من بوروميسين | |
| اليوم 4 | 250 ميكروغرام / مل | 2 ميكروغرام / مل |
| يوم 5 | 250 ميكروغرام / مل | 2 ميكروغرام / مل |
| اليوم 6 | 250 ميكروغرام / مل | 1 ميكروغرام / مل |
| اليوم 7 | 250 ميكروغرام / مل | 1 ميكروغرام / مل |
| يوم 8 | 250 ميكروغرام / مل | 1 ميكروغرام / مل |
الجدول 1: تركيزات المضادات الحيوية خلال فترة التحديد. تركيزات بوروميسين وG418 خلال 5 د للفترة الاختيار.
- وقف اختيار والبدء في زراعة العادية (يوم 9 و في وقت لاحق)
- بعد 5 د فترة الاختيار، وثقافة rtTA / Ngn2 hiPSCs -positive كما hiPSCs العادي، باستثناء أن متوسط E8 الخلايا وتستكمل مع G418 إلى تركيز النهائي من 50 ميكروغرام / مل ومع بوروميسين إلى تركيز النهائي 0.5 ميكروغرام / مل.
ملاحظة: يمكن الآن الخلايا يتم تجميد (وفقا لبروتوكولات موحدة لحفظ البرودة من الخلايا) لتكون بمثابة نسخة احتياطية. هذا هو خطوة هامة لاستنساخ البروتوكول التمايز، لأنه يتيح استخدام نفس دفعة من rtTA / Ngn2 hiPSCs -positive للعديد من التجارب التمايز في المستقبل.
- بعد 5 د فترة الاختيار، وثقافة rtTA / Ngn2 hiPSCs -positive كما hiPSCs العادي، باستثناء أن متوسط E8 الخلايا وتستكمل مع G418 إلى تركيز النهائي من 50 ميكروغرام / مل ومع بوروميسين إلى تركيز النهائي 0.5 ميكروغرام / مل.
3. تمايز rtTA / Ngn2 hiPSCs -positive إلى الخلايا العصبية في 6 جيداالاتفاقات البيئية المتعددة الأطراف وcoverslips الزجاج
ملاحظة: في هذا البروتوكول، وتقدم تفاصيل عن التفريق rtTA / Ngn2 hiPSCs -positive على اثنين من ركائز مختلفة، أي الاتفاقات البيئية المتعددة الأطراف 6 جيدا (أجهزة مكونة من 6 آبار مستقلة مع 9 تسجيل و 1 إشارة الميكروية جزءا لا يتجزأ لكل بئر) وcoverslips الزجاج في الآبار من 24 لوحة جيدا. البروتوكولات، ومع ذلك، يمكن بسهولة أن تتكيف لركائز أكبر (على سبيل المثال، لآبار لوحات 12- أو 6 أيضا)، عن طريق التوسع في القيم المذكورة وفقا لمساحة السطح.
- إعداد الاتفاقات البيئية المتعددة الأطراف أو coverslips الزجاج (يوم 0 و 1 يوم)
- قبل يوم واحد من بدء التمايز، وتعقيم الاتفاقات البيئية المتعددة الأطراف وفقا لتوصية الشركة الصانعة.
- تمييع بروتين التصاق بولي-L-الأورنيثين (منظمة التحرير الفلسطينية) في الماء عالى النقاء المعقم إلى تركيز النهائي 50 ميكروغرام / مل. معطف منطقة القطب النشطة من الاتفاقات البيئية المتعددة الأطراف 6 جيدا من خلال وضع 100 ميكرولترإسقاط لمنظمة التحرير الفلسطينية مخففة في كل بئر. ضع لل coverslips في الآبار من 24 لوحة جيدا باستخدام ملاقط معقمة. إضافة 800 ميكرولتر من منظمة التحرير الفلسطينية مخففة في كل بئر. منع لل coverslips من العائمة التي تدفعهم إلى أسفل مع ماصة 1000 ميكرولتر.
- احتضان الاتفاقات البيئية المتعددة الأطراف 6 جيدا و 24 بئرا لوحة O / N في ترطيب 37 درجة مئوية مع حاضنة جو من 5٪ CO 2. في اليوم التالي، نضح في منظمة التحرير الفلسطينية المخفف. غسل الواجهات الزجاجية من الاتفاقات البيئية المتعددة الأطراف 6 جيدا ولل coverslips مرتين مع الماء عالى النقاء العقيمة.
- تمييع laminin في البارد DMEM / F12 إلى تركيز النهائي من 20 ميكروغرام / مل (للالاتفاقات البيئية المتعددة الأطراف 6 جيدا) و 10 ميكروغرام / مل (لcoverslips الزجاج). على الفور معطف منطقة القطب النشطة من الاتفاقات البيئية المتعددة الأطراف 6 جيدا عن طريق وضع قطرة 100 ميكرولتر في كل بئر. وبالمثل، إضافة 400 ميكرولتر من laminin مخففة في كل بئر من 24 لوحة جيدا لمعطف لل coverslips. منع لل coverslips من العائمة التي تدفعهم إلى أسفل مع ماصة 1000 ميكرولتر.
- احتضان الاتفاقات البيئية المتعددة الأطراف 6 جيدا و24 لوحة جيدا في ترطيب 37 درجة مئوية مع حاضنة جو من 5٪ CO 2 لمدة 2 ساعة على الأقل.
- لوحة للhiPSCs (يوم 1)
ملاحظة: وحدات التخزين المذكورة في الخطوات 3.2.1 - 3.2.4 تفترض أن hiPSCs -positive rtTA / Ngn2 ومثقف في لوحة 6 جيدا وأن الخلايا من بئر واحدة ويتم حصاد. وحدات التخزين التي مطلوبة من أجل طلاء الخلايا على الاتفاقات البيئية المتعددة الأطراف 6 جيدا و / أو لل coverslips يعتمد على عدد من الاتفاقات البيئية المتعددة الأطراف 6 جيدا و / أو عدد coverslips التي يتم استخدامها في هذه التجربة. الأرقام المحددة في الخطوات 3.2.6 - 3.2.8 تسمح التحجيم إلى أحجام تجربة مختلفة.- الدافئة DMEM / F12، والأقراص المدمجة والمتوسطة E8 مع 1٪ (ت / ت) البنسلين / الستربتومايسين لR / T. إضافة الدوكسيسيكلين إلى تركيز النهائي من 4 ميكروغرام / مل ومثبط ROCK إلى متوسطة E8.
- نضح المتوسط أمضى من hiPSCs -positive rtTA / Ngn2 وإضافة 1 مCDS L إلى hiPSCs. احتضان 3-5 دقيقة في ترطيب 37 درجة مئوية مع حاضنة جو من 5٪ CO 2. الاختيار تحت المجهر ما إذا كانت الخلايا فصل بعضها عن بعض.
- إضافة 2 مل DMEM / F12 في البئر، تعليق بلطف الخلايا مع ميكرولتر ماصة 1000 ونقل الخلايا إلى أنبوب 15 مل. إضافة 7 مل DMEM / F12 لتعليق الخلية. تدور الخلايا في 200 x ج لمدة 5 دقائق.
- نضح طاف وإضافة 2 مل من المتوسط E8 أعد. تنأى hiPSCs عن طريق وضع غيض من ماصة 1000 ميكرولتر ضد الجانب من الأنبوب 15 مل وإعادة التعليق الخلايا بلطف. الاختيار تحت المجهر سواء فصلها الخلايا.
- تحديد عدد الخلايا (خلية / مل) باستخدام غرفة عدادة الكريات.
ملاحظة: لوحة 6 جيدا بشكل جيد في 80 - سوف 90٪ confluency تسفر عادة 3،0-4،0 × 10 6 خلايا في المجموع. - نضح في laminin المخفف. للالاتفاقات البيئية المتعددة الأطراف 6 جيدا، وتمييع الخلايا للحصول على متعليق ليرة لبنانية من 7.5 × 10 5 خلية / مل. لوحة الخلايا عن طريق إضافة قطرة من 100 ميكرولتر من تعليق خلية في منطقة القطب النشطة في كل بئر من الاتفاقات البيئية المتعددة الأطراف 6 جيدا. للل coverslips، وتمييع الخلايا للحصول على تعليق خلية من 4.0 × 10 4 خلية / مل. لوحة الخلايا بإضافة 500 ميكرولتر من تعليق الخلية إلى الآبار من 24 لوحة جيدا.
ملاحظة: كثافة الخلية النهائية على الاتفاقات البيئية المتعددة الأطراف أعلى من على لل coverslips (الشكل 1A و B). وجدنا أن هذه الكثافة عالية الخلية كان مطلوبا لتسجيل السليم للنشاط الشبكة. في البروتوكول، وتقدم الأرقام التي تحولت إلى أن تكون الأمثل للفحوصات. - وضع الاتفاقات البيئية المتعددة الأطراف 6 جيدا و 24 لوحة جيدا في ترطيب 37 درجة مئوية مع حاضنة جو من 5٪ CO 2 ل 2 ح (الاتفاقات البيئية المتعددة الأطراف) أو O / N (24 لوحة جيدا).
- بعد 2 ساعة، إضافة بعناية 500 ميكرولتر من المتوسطة E8 على استعداد لكل بئر من الاتفاقات البيئية المتعددة الأطراف 6 جيدا. ضع-نحن 6ليرة لبنانية الاتفاقات البيئية المتعددة الأطراف O / N في ترطيب 37 درجة مئوية مع حاضنة جو من 5٪ CO 2.
- تغيير المتوسطة (اليوم 2)
- في اليوم التالي، وإعداد DMEM / F12 مع 1٪ (ت / ت) N-2 ملحق، 1٪ (V / V) الأحماض الأمينية غير الأساسية و 1٪ (ت / ت) البنسلين / الستربتومايسين. إضافة البشري المؤتلف neurotrophin-3 (NT-3) إلى تركيز النهائي من 10 نانوغرام / مل، المؤتلف المستمدة من الدماغ عامل التغذية العصبية البشرية (BDNF) إلى تركيز النهائي من 10 نانوغرام / مل، والدوكسيسيكلين إلى تركيز النهائي من 4 ميكروغرام / مل. تدفئة المتوسط إلى 37 درجة مئوية.
- إضافة laminin إلى تركيز النهائي من 0.2 ميكروغرام / مل إلى المتوسطة. تصفية المتوسطة الناتجة عن ذلك. نضح المتوسط أمضى من الآبار من الاتفاقات البيئية المتعددة الأطراف 6 جيدا و24 لوحة جيدا واستبدالها المتوسطة المعدة. احتضان الاتفاقات البيئية المتعددة الأطراف 6 جيدا و 24 بئرا لوحة O / N في ترطيب 37 درجة مئوية مع حاضنة جو من 5٪ CO 2.
- إضافة النجمية الفئران (اليوم 3)
ملاحظة: وحدات التخزين التي يتم ذكرها في هذا البروتوكول تفترض أن الخلايا النجمية الفئران يتم تربيتها في قوارير ثقافة T75. ومن الأهمية بمكان أن الخلايا النجمية الفئران التي تمت إضافتها إلى الثقافات هي من نوعية جيدة. نحن نستخدم معيارين لمعرفة ما اذا كان النجمية الفئران هي من نوعية جيدة. أولا، يجب أن تكون ثقافة نجمية الفئران قادرة على النمو متكدسة في غضون عشرة أيام بعد عزلة من أدمغة الفئران الجنينية. ثانيا، بعد تقسيم الثقافة نجمية الفئران، يجب أن تكون الخلايا النجمية الفئران قادرة على تشكيل متموجة، أحادي الطبقة موزايكية (الشكل 1C). إذا لم ثقافة الفئران نجمية تحقيق هذه المعايير اثنين، ونحن ننصح بعدم استخدام هذه الثقافة للتجارب التمايز.- دافئ 0.05٪ التربسين-EDTA لRT. تدفئة DPBS وDMEM / F12 مع 1٪ (ت / ت) البنسلين / الستربتومايسين إلى 37 درجة مئوية.
- نضح المتوسط أمضى من ثقافة الفئران نجمية. غسل الثقافة بإضافة 5 مل DPBS وحفيف حولها بلطف.
- Aspirأكل DPBS وإضافة 5 مل 0.05٪ التربسين-EDTA. حفيف التربسين- EDTA حول بلطف. احتضان في ترطيب 37 درجة مئوية مع حاضنة جو من 5٪ CO 2 ل5-10 دقيقة.
- الاختيار تحت المجهر سواء فصل الخلايا. فصل الخلايا مشاركة عن طريق ضرب قارورة عدة مرات.
- إضافة 5 مل من DMEM / F12 إلى القارورة. يسحن الخلايا برفق داخل القارورة مع ماصة 10 مل. جمع تعليق الخلية في أنبوب 15 مل. تدور الأنبوب في 200 x ج لمدة 8 دقائق.
- نضح في وطاف resuspend الخلايا في 1 مل من DMEM / F12. تحديد عدد الخلايا (خلية / مل) باستخدام غرفة عدادة الكريات.
- إضافة 7.5 × 10 4 الخلايا النجمية لكل بئر من الاتفاقات البيئية المتعددة الأطراف 6 جيدا. إضافة 2.0 × 10 4 الخلايا النجمية لكل بئر من 24 لوحة جيدا. احتضان الاتفاقات البيئية المتعددة الأطراف و24-جيدا يا لوحة / N في ترطيب 37 درجة مئوية مع حاضنة جو من 5٪ CO 2.
- تغيير المتوسطة (يوم 4)
- إعداد المتوسطة neurobasal مع 2٪ (ت / ت)-B 27 الملحق، 1٪ (ت / ت) L-ألانيل-L-الجلوتامين و 1٪ (ت / ت) البنسلين / الستربتومايسين. إضافة NT-3 إلى تركيز النهائي من 10 نانوغرام / مل، BDNF إلى تركيز النهائي من 10 نانوغرام / مل، والدوكسيسيكلين إلى تركيز النهائي من 4 ميكروغرام / مل. وبالإضافة إلى ذلك، إضافة السيتوزين β-D-arabinofuranoside إلى تركيز 2 ميكرومتر.
- تصفية المتوسطة ودافئة إلى 37 درجة مئوية. نضح المتوسط أمضى من الآبار من الاتفاقات البيئية المتعددة الأطراف 6 جيدا و24 لوحة جيدا واستبدالها المتوسطة المعدة. الحفاظ على الاتفاقات البيئية المتعددة الأطراف 6 جيدا و24 لوحة جيدا في ترطيب 37 درجة مئوية مع حاضنة جو من 5٪ CO 2.
يضاف السيتوزين β-D-arabinofuranoside إلى وسيلة لمنع انتشار الخلايا النجمية ولقتل hiPSCs المتبقية التي لم يتم التفريق في الخلايا العصبية: ملاحظة. - تحديث المتوسطة (يوم 6-28)
ملاحظة: ابتداء من يوم 6، وتجديد نصفمن المتوسطة كل يومين. من يوم 10 فصاعدا، وتستكمل المتوسطة مع FBS لدعم السلامة نجمية.- إعداد المتوسطة neurobasal مع 2٪ (ت / ت)-B 27 الملحق، 1٪ (ت / ت) L-ألانيل-L-الجلوتامين و 1٪ (ت / ت) البنسلين / الستربتومايسين. إضافة NT-3 إلى تركيز النهائي من 10 نانوغرام / مل، BDNF إلى تركيز النهائي من 10 نانوغرام / مل، والدوكسيسيكلين إلى تركيز النهائي من 4 ميكروغرام / مل. من يوم 10 وما بعده، كما تكملة المتوسطة مع 2.5٪ (ت / ت) FBS. تصفية الناتج المتوسط ودافئة إلى 37 درجة مئوية.
- إزالة نصف المتوسط أمضى من الآبار من الاتفاقات البيئية المتعددة الأطراف 6 جيدا و24 لوحة جيدا باستخدام ميكرولتر ماصة 1000 واستبدالها المتوسطة المعدة. الحفاظ على الاتفاقات البيئية المتعددة الأطراف 6 جيدا و24 لوحة جيدا في ترطيب 37 درجة مئوية مع حاضنة جو من 5٪ CO 2.
4. أكد على الملف العصبية من الخلايا العصبية المستمدة hiPSC-
ملاحظة: اثنان إلى ثلاثة أسابيع بعد فيالدرفلة الجديد من التمايز، الخلايا العصبية المستمدة hiPSC ويمكن استخدامها لتحليل المصب مختلفة. في هذا القسم، يتم إعطاء أمثلة لبعض التحليلات النهائية التي يمكن القيام بها لوضع لمحة العصبي للخلايا العصبية مشتقة hiPSC.
- تميز نشاط الشبكة العصبية باستخدام الاتفاقات البيئية المتعددة الأطراف
- سجل 20 دقيقة من النشاط الكهربية للخلايا العصبية مشتقة hiPSC مثقف على الاتفاقات البيئية المتعددة الأطراف. أثناء التسجيل، والحفاظ على درجة الحرارة عند 37 درجة مئوية، ومنع التبخر ودرجة الحموضة التغييرات في المتوسط عن طريق تضخيم ثابت، والتدفق البطيء للغاز ترطيب (5٪ CO 2، 20٪ O 2، 75٪ N 2) على الشرق الأوسط وأفريقيا .
- بعد 1200X التضخيم (MEA 1060، MCS)، أخذ عينات من إشارة في 10 كيلوهرتز باستخدام بطاقة الحصول على البيانات MCS. تحليل البيانات (السنبلة وكشف انفجر) باستخدام حزمة برامج مخصصة 23.
- تميز النشاط الكهربية وحيدة الخلية
- نقل زلات غطاء يحتوي على الثقافات العصبية مشتقة hiPSC إلى غرفة تسجيل مرحلة ثابتة غارقة في المجهر تستقيم. سجل 20 دقيقة من-أثار إمكانية العمل من تلقاء أنفسهم التيارات بعد المشبكي (sEPSC) 24. كشف الحدث متشابك باستخدام برنامج العلمي العصبي.
- تميز مورفولوجيا الخلايا العصبية والتعبير سينابسينات
- إصلاح وصمة عار على الخلايا العصبية المستمدة hiPSC لMAP2، سينابسينات-1/2، وPSD-95 22 و 24 و 25. تحديد عدد من نقاط وسينابسينات-1/2 و PSD-95 باستخدام برمجيات تحليل الصور.
النتائج
هنا قمنا بتعديل بنجاح بروتوكول الذي يتم التمييز hiPSCs مباشرة إلى الخلايا العصبية القشرية بسبب الإفراط في التعبير عن عامل النسخ neurogenin-2 12 و قمنا تكييفها للاستخدام الاتفاقات البيئية المتعددة الأطراف. هذا النهج هو سريع وفعال مما يسمح لنا للحصول على الخلايا العصبية الوظيفية ونشاط الشبكة بالفعل خلال الأسبوع الثالث بعد تحريض من التمايز.
خلال البروتوكول التمايز، بدأت الخلايا شكليا تشبه الخلايا العصبية: تم تشكيل العمليات الصغيرة وبدأت الخلايا العصبية التي تربط إلى بعضها البعض (الشكل 1A). أنشأنا الشخصي العصبي للخلايا العصبية مشتقة من خط hiPSC مراقبة صحية، من خلال قياس مورفولوجيا الخلايا العصبية وخصائص متشابك خلال التنمية. كانت ملطخة الخلايا العصبية المستمدة hiPSC لMAP2 وسينابسينات-02/01 في أيام مختلفة بعد بدءالتمايز (الشكل 2A). وتظهر الخلايا العصبية المستمدة مورفولوجيا الخلايا العصبية الناضجة بالفعل بعد 3 أسابيع من تحريض التمايز. وكان كميا عدد سينابسينات-1/2 نقاط و(مقياس لعدد من نقاط الاشتباك العصبي) على أساس / 2 stainings مناعية 1 سينابسينات. ارتفع عدد نقاط وسينابسينات-02/01 مع مرور الوقت، مما يشير إلى أن مستوى الاتصال الخلايا العصبية في تزايد أيضا (الشكل 2B). وكان عدد من سينابسينات-1/2 نقاط وبعد 23 يوما من تحريض التمايز مماثل في خطين IPS المستقلة (الشكل 2C). في 23 DIV الأكثر synapsin1 / 2 نقاط وكان محاذيا لPSD-95 نقاط و، مما يدل على نقاط الاشتباك العصبي وظيفية (الشكل 2D).
وتمشيا مع النتائج التي وصفها تشانغ وآخرون، ولدت لنا عدد سكانها الطبقة العليا العصبونات القشرية مثير، والتي أكدتها م القشرية عموم العصبية وسلالة محددة arkers مثل BRN2 وSATB2 (طبقة II / III). نحن لم تراع الخلايا العصبية التي كانت إيجابية للالخلايا العصبية طبقة عميقة CTIP2 (الطبقة الخامسة) أو FOXP2 (الطبقة السادسة) (الشكل 2E وF)
لوصف النشاط الكهربية للخلايا العصبية مشتقة hiPSC، كنا خلية كاملة التيار والجهد التسجيلات المشبك، أي الخصائص الذاتية والمدخلات مثير على قيست خلال تطوير هذه الخلايا العصبية. كانت قادرة على توليد إمكانات العمل بالفعل بعد أسبوع من التمايز ونسبة ارتفاعه الخلايا وزيادة مع مرور الوقت (الشكل 2G و H) الخلايا العصبية. وعلاوة على ذلك، تلقت الخلايا العصبية مدخلات متشابك مثير بالفعل بعد أسبوع من تحريض التمايز: ارتفع كل من التردد والسعة من مدخلات متشابك مثير خلال تنمية (الشكل 2I - K).
الإقليم الشمالي "FO: المحافظة على together.within الصفحات =" 1 "> لفهم أفضل لكيفية يجمع بين النشاط وحيدة الخلية لتشكيل وظائف على مستوى الشبكة، لا بد من دراسة كيفية عمل الخلايا العصبية في الحفل في المختبر الشبكات العصبية مثقف على الاتفاقات البيئية المتعددة الأطراف. تشكل النموذج التجريبي قيما لدراسة ديناميات العصبية. سجلنا 20 دقيقة من نشاط الشبكة الكهربية للخلايا العصبية مشتقة من خط hiPSC مراقبة صحية مثقف على 6 جيدا الاتفاقات البيئية المتعددة الأطراف (الشكل 2M). بعد أسابيع قليلة من تحريض التمايز، الخلايا العصبية المستمدة من hiPSCs مراقبة صحية شكلت الشبكات العصبية نشطة وظيفيا، والتي تبين أحداث عفوية (0.62 ± 0.05 ارتفاع / ثانية؛ الشكل 2N). وفي هذه المرحلة من التطور (أي 16 د بعد بداية التمايز) أي أحداث متزامنة تشمل كل القنوات . ليتم الكشف عن الاتفاقات البيئية المتعددة الأطراف (الشكل 2O) زاد مستوى نشاط الشبكة خلال التنمية: خلال الأسبوع الرابع بعد ر انه تحريض التمايز، وأظهرت الشبكات العصبية على مستوى عال من النشاط العفوي (2.5 ± 0.1 ارتفاع / ثانية؛ الشكل 2N) في جميع الآبار من الجهاز. شبكات عرضت أيضا رشقات نارية متزامن شبكة (4.1 ± 0.1 انفجار / دقيقة، الشكل 2O) مع مدة طويلة (2100 ± 500 مللي ثانية).
الشكل 1: hiPSC التمايز في الخلايا العصبية. ألف ثلاث نقاط وقت hiPSCs التمايز في الخلايا العصبية coverslips على. B. تصفيح من hiPSCs على الاتفاقات البيئية المتعددة الأطراف. جيم النجمية في confluency 100٪ في T75 القارورة (لاحظ أن الخلايا تشكل أحادي الطبقة موزايكية). الحانات الحجم: 150 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
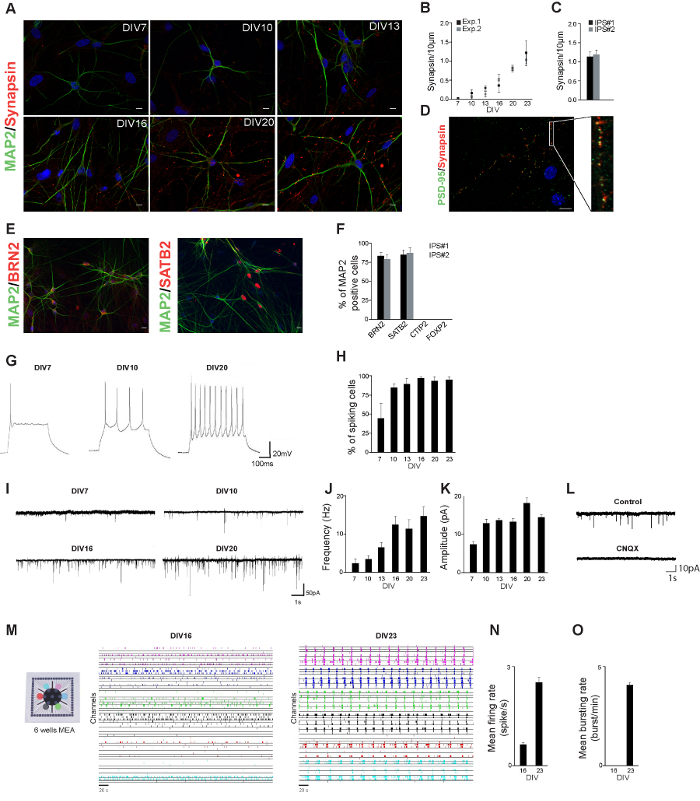
الشكل 2. hiPSC المشتقة من الخلايا العصبية توصيف. كانت ملطخة الخلايا العصبية المستمدة hiPSC-أ لMAP2 (الأخضر) وسينابسينات 1/2 (الحمراء) في أيام مختلفة بعد بدء التمايز. شريط الحجم: 10 ميكرون. B. الكمي للنقاط وسينابسينات في تجربتين مستقلة. في كل التجارب تم تحليل 10 خلايا على الاقل. جيم الكمي للنقاط وسينابسينات في DIV23 في الخلايا العصبية المستمدة من خطين IPS مستقلة. كانت ملطخة الخلايا العصبية المستمدة hiPSC-د لPSD-95 (الخضراء) و/ 2 (الحمراء) 23 أيام 1 سينابسينات بعد بداية التمايز. وجنبا إلى جنب نقاط وسينابسينات إلى PSD-95 نقاط و. كانت ملطخة الخلايا العصبية المستمدة hiPSC-هاء لMAP2 (الخضراء) وBRN2 (الحمراء) أو SATB2 (أحمر) 23 د بعد بداية التمايز. واو النسبة المئوية للخلايا إيجابية MAP2 أنكانت إيجابية للعلامات المشار إليها. G. الممثل تسجيلات المشبك الحالي تبين أن إمكانات العمل يمكن أن تتولد في وقت مبكر من 7 أيام بعد بدء التمايز. ه النسبة المئوية للخلايا في أيام مختلفة بعد تحريض من التمايز التي تظهر واحدة أو أكثر من إمكانات العمل. أولا آثار التمثيلية للالتيارات بعد المشبكي مثير (EPSCs) من خلال الخلايا العصبية المستمدة hiPSC وردت في أيام مختلفة بعد التمايز. J. التردد التيارات بعد المشبكي مثير خلال التنمية. ك السعة التيارات بعد المشبكي مثير خلال التنمية. يتتبع الممثل L. التسجيلات EPSC دون (السيطرة) ومع CNQX (CNQX). كانت M. الخلايا العصبية مشتقة من خط hiPSC واحد مثقف على الشرق الأوسط وأفريقيا 6 جيدا ويظهر نشاط الشبكة للشبكات العصبية مشتقة hiPSC 16 و 23 د بعد تحريض من التمايز. النشاط المسجلة منيشار إلى كل (معدل أخذ العينات من 10 كيلو هرتز) بشكل جيد مع لون مختلف (يتم عرض 5 دقائق من دقيقة 20 من تسجيل). N. معدل إطلاق 16 و 23 د بعد تحريض من التمايز. O. معدل انفجار 16 و 23 د بعد تحريض من التمايز. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
وبالنظر إلى النتائج، ونوعية مما أدى الخلايا العصبية المشتقة hiPSC يمكن تقييم بجعل لمحة العصبي للخلايا. وهذا هو، بعد 3-4 أسابيع من بدء المفاضلة، والتشكل، سينابسينات-02/01 التعبير والكهربية للخلايا العصبية يمكن تقييمها. في تلك المرحلة الزمنية، من المتوقع أن تظهر التشكل مثل العصبية، ليكون MAP2، سينابسينات / PSD-95 إيجابي مناعية عند تنفيذ، وexhibi الخلايا العصبية المستمدة hiPSC-ر عفوية النشاط الكهربية (سواء على وحيدة الخلية ومستوى الشبكة).
Discussion
نحن هنا قمنا بتنفيذ كفاءة بروتوكول hiPSC تمايز نشرتها تشانغ وآخرون. (2013) (12) لقياس النشاط شبكة من الشبكات العصبية مشتقة hiPSC على الاتفاقات البيئية المتعددة الأطراف. نحن تكييفها البروتوكول الأصلي عن طريق إنشاء rtTA / Ngn2 خط hiPSC -positive قبل إحداث تمايز الخلايا العصبية. هذه خطوة إضافية تتيح لنا التحكم في كثافة الخلايا العصبية في الشرق الأوسط وأفريقيا. والسيطرة على كثافة الخلايا العصبية شرطا مسبقا هاما للتكيف مع البروتوكول إلى الاتفاقات البيئية المتعددة الأطراف وضمان الاتساق. لقياس نشاط الشبكات العصبية باستخدام الاتفاقات البيئية المتعددة الأطراف، وتحتاج الخلايا العصبية لتشكيل شبكات كثيفة مباشرة على الجزء العلوي من أقطاب الشرق الأوسط وأفريقيا 17،18. وهذا يتطلب بالضرورة رقابة مشددة على كثافة الطلاء من الخلايا العصبية. وrtTA / Ngn2 خط hiPSC -positive يسمح للسيطرة على كثافة الخلايا العصبية لأن هذا التكتيك لا تعتمد على transductions lentiviral الحادة من hiPSCs قبل التمايز.وبالتالي ما يقرب من rtTA / Ngn2 خط hiPSC -positive يزيل أي تغيير في العائد النهائي بسبب، على سبيل المثال، سمية lentiviral وكفاءة عدوى متغيرة.
خطوة أخرى معارضة للإجراء التجريبي هو عدد الخلايا النجمية الفئران التي cocultured مع hiPSCs التفريق. الخلايا النجمية تسهم بفعالية في صقل تطوير الدوائر العصبية عن طريق التحكم في تشكيل المشبك، والصيانة، والقضاء، وكلها عمليات مهمة للعمل الخلايا العصبية. بروتوكول المعروضة في هذه الورقة هو غاية نجمية تعتمد: حتى يكتمل نضجها وتشكيل نقاط الاشتباك العصبي وظيفية، تتطلب الخلايا العصبية بدعم من الخلايا النجمية. عانينا من أن عدد الخلايا النجمية يجب أن تكون مساوية تقريبا لعدد من الخلايا العصبية المستمدة hiPSC لدعم نضوج الخلايا العصبية وتشكيل شبكات العصبية واظهار النشاط العفوي. منذ لدينا نجمية عوائد بروتوكول طريق مسدود خلية الأساسيتوريس مع عمر محدود، وعزل الخلايا النجمية الفئران لابد من تنفيذها بانتظام.
لدينا التكيف البروتوكول الذي نشرته تشانغ وآخرون. (2013) 12 للاستخدام مع التكنولوجيا الشرق الأوسط وأفريقيا من المرجح أن تحسن إلى حد كبير قدرتنا على دراسة النشاط شبكة من شبكات المستمدة hiPSC. سابقا، البروتوكولات المستخدمة لدراسة الشبكات العصبية مشتقة hiPSC مع الاتفاقات البيئية المتعددة الأطراف تعتمد على إجراءات المفاضلة تستغرق وقتا طويلا 13-16. البروتوكول من تشانغ وآخرون. (2013) توفر بديلا سريعا، ولدينا تعديل يزيل مصدرا للتقلب، مما يجعله الآن أكثر جدوى استخدام الخلايا العصبية المستمدة hiPSC في تركيبة مع التكنولوجيا الشرق الأوسط وأفريقيا، وخاصة في الإنتاجية العالية أو الدراسات الدوائية. وبالإضافة إلى ذلك، لأن طريقة التي نشرتها تشانغ وآخرون. (2013) 12 تعطي السكان متجانسة من الطبقة العليا العصبونات القشرية، لدينا بروتوكول تكييفها يجعل دراسات مركزة الممكنة في الشبكةctivity هذا فرعية العصبية معينة.
ومع ذلك، فإن هذا النهج له أيضا العديد من القيود. أولا، تجانس الثقافات يمكن أيضا اعتبار وضع غير مؤات، لأن الثقافات هم أقل عرضة للتشبه في الشبكات الجسم الحي، حيث فئات مختلفة من الخلايا العصبية (أي الخلايا العصبية المثبطة ومثير) تشكل شبكة غير المتجانسة. لمزيد من تعزيز استخدام الخلايا العصبية المستمدة hiPSC مع التكنولوجيا الشرق الأوسط وأفريقيا، سيكون من المهم وضع بروتوكولات التمايز (القائم على التحوير) السريع لغيرهم من السكان الخلايا العصبية. إذا أصبحت البروتوكولات المتاحة، فإن في المختبر شبكات تحاكي في الجسم الحي الشبكات بشكل وثيق. ثانيا، في الخلايا النجمية الفئران الحالية يجب أن تضاف إلى الخلايا العصبية المستمدة hiPSC لدعم النمو، وبالتالي فإن الشبكة العصبية الناتجة ليس الإنسان العصبية شبكة بالمعنى الضيق. بروتوكولات يمكن الاعتماد عليها للتمييز hiPSCs إلى الخلايا النجمية يجوز في سول في المستقبلهاء هذه المشكلة 26. ثالثا، الشبكات العصبية ثنائية الأبعاد، كما هو موضح هنا، هي نموذج محدود لدراسة ثلاثية الأبعاد في الجسم الحي الشبكات العصبية المعقدة. لحسن الحظ، والبروتوكولات واصفا الثقافات ثلاثية الأبعاد من الخلايا العصبية الأولية الفئران في تركيبة مع التكنولوجيا MEA متاحة بالفعل 27،28. مستقبلي، يجب الجمع بين البروتوكولات التمايز السريعة للحصول على الخلايا العصبية والخلايا النجمية المستمدة hiPSC مع تقنيات زراعة ثلاثية الأبعاد وتكنولوجيا MEA تعطي نظرة جديدة إلى الآليات البيولوجية الكامنة وراء الاضطرابات العصبية.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors thank Jessica Classen for performing the whole-cell patch-clamp experiments. The hiPSCs used in our experiments were kindly provided by Huiqing Zhou and Willem van den Akker from the Radboud University Nijmegen. The transfer vectors used in this protocol were kindly provided by Oliver Brüstle, Philipp Koch and Julia Ladewig from the University of Bonn Medical Centre.
Materials
| Name | Company | Catalog Number | Comments |
| Lebovitz's L-15 medium | Gibco | 11415-064 | |
| B-27 supplement | Gibco | 0080085SA | |
| Poly-D-Lysine (PDL) | Sigma-Aldrich | P6407 | |
| Ca2+/Mg2+-free HBSS | Gibco | 14175-095 | |
| 0.05% Trypsin-EDTA | Gibco | 25300-054 | |
| 2.5% Trypsin | Gibco | 15090-046 | |
| High-glucose DMEM | Gibco | 11965-092 | |
| FBS (Fetal Bovine Serum) | Sigma-Aldrich | F2442-500ML | |
| Penicillin/Streptomycin | Sigma-Aldrich | P4333 | |
| 70 µm cell strainer | BD Falcon | 352350 | |
| DPBS | Gibco | 14190-094 | |
| psPAX2 lentiviral packaging vector | Addgene | Plasmid #12260 | |
| pMD2.G lentiviral packaging vector | Addgene | Plasmid #12259 | |
| Basement membrane matrix | Gibco | A1413201 | |
| DMEM/F12 | Gibco | 11320-074 | |
| Cell detachment solution | Sigma-Aldrich | A6964 | |
| E8 medium | Gibco | A1517001 | |
| ROCK inhibitor | Gibco | A2644501 | Alternatively, ROCK inhibitors like thiazovivin can be used. |
| Polybrene | Sigma-Aldrich | H9268-5G | |
| G418 | Sigma-Aldrich | G8168-10ML | |
| Puromycin | Sigma-Aldrich | P9620-10ML | |
| Vitronectin | Gibco | A14700 | |
| 6-well MEAs | Multi Channel Systems | 60-6wellMEA200/30iR-Ti-tcr | |
| Glass coverslips | VWR | 631-0899 | |
| Poly-L-Ornithine (PLO) | Sigma-Aldrich | P3655-10MG | |
| Laminin | Sigma-Aldrich | L2020-1MG | |
| Doxycyclin | Sigma-Aldrich | D9891-5G | |
| N-2 supplement | Gibco | 17502-048 | |
| Non-essential amino acids | Sigma-Aldrich | M7145 | |
| NT-3, human recombinant | Promokine | C66425 | |
| BDNF, human recombinant | Promokine | C66212 | |
| Trypsin-EDTA | Gibco | 25300-054 | |
| L-alanyl-L-glutamine | Gibco | 35050-038 | |
| Neurobasal medium | Gibco | 21103-049 | |
| Cytosine β-D-arabinofuranoside | Sigma-Aldrich | C1768-100MG | |
| Straight fine-tipped forceps | Fine Science Tools | 11251 | |
| Fine-tipped spring scissors | Fine Science Tools | 91500-09 |
References
- Ahfeldt, T., Litterman, N. K., Rubin, L. Studying human disease using human neurons. Brain Res. , (2016).
- Zhang, S. C., Wernig, M., Duncan, I. D., Brustle, O., Thomson, J. A. In vitro differentiation of transplantable neural precursors from human embryonic stem cells. Nat Biotechnol. 19 (12), 1129-1133 (2001).
- Perrier, A. L., et al. Derivation of midbrain dopamine neurons from human embryonic stem cells. Proc Natl Acad Sci USA. 101 (34), 12543-12548 (2004).
- Wu, H., et al. Integrative genomic and functional analyses reveal neuronal subtype differentiation bias in human embryonic stem cell lines. Proc Natl Acad Sci USA. 104 (34), 13821-13826 (2007).
- Chambers, S. M., Fasano, C. A., Papapetrou, E. P., Tomishima, M., Sadelain, M., Studer, L. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Shi, Y., Kirwan, P., Livesey, F. J. Directed differentiation of human pluripotent stem cells to cerebral cortex neurons and neural networks. Nat Protoc. 7, 1836-1846 (2012).
- Espuny-Camacho, I., et al. Pyramidal neurons derived from human pluripotent stem cells integrate efficiently into mouse brain circuits in vivo. Neuron. 77 (3), 440-456 (2013).
- Maroof, A. M., et al. Directed differentiation and functional maturation of cortical interneurons from human embryonic stem cells. Cell Stem Cell. 12 (5), 559-572 (2013).
- Johnson, M. A., Weick, J. P., Pearce, R. A., Zhang, S. C. Functional neural development from human embryonic stem cells: accelerated synaptic activity via astrocyte coculture. J Neurosci. 27 (12), 3069-3077 (2007).
- Hu, B. Y., et al. Neural differentiation of human induced pluripotent stem cells follows developmental principles but with variable potency. Proc Natl Acad Sci USA. 107 (9), 4335-4340 (2010).
- Kim, H., et al. miR-371-3 expression predicts neural differentiation propensity in human pluripotent stem cells. Cell Stem Cell. 8 (6), 695-706 (2011).
- Zhang, Y., et al. Rapid single-step induction of functional neurons from human pluripotent stem cells. Neuron. 78 (5), 785-798 (2013).
- Odawara, A., Saitoh, Y., Alhebshi, A. H., Gotoh, M., Suzuki, I. Long-term electrophysiological activity and pharmacological response of a human induced pluripotent stem cell-derived neuron and astrocyte co-culture. Biochem Biophys Res Commun. 443 (4), 1176-1181 (2014).
- Odawara, A., Katoh, H., Matsuda, N., Suzuki, I. Physiological maturation and drug responses of human induced pluripotent stem cell-derived cortical neuronal networks in long-term culture. Sci Rep. 6, 26181 (2016).
- Amin, H., Maccione, A., Marinaro, F., Zordan, S., Nieus, T., Berdondini, L. Electrical Responses and Spontaneous Activity of Human iPS-Derived Neuronal Networks Characterized for 3-month Culture with 4096-Electrode Arrays. Front Neurosci. 10, (2016).
- Heikkila, T. J., et al. Human embryonic stem cell-derived neuronal cells form spontaneously active neuronal networks in vitro. Exp Neurol. 218 (1), 109-116 (2009).
- Massobrio, P., Massobrio, G., Martinoia, S. Multi-program approach for simulating recorded extracellular signals generated by neurons coupled to microelectrode arrays. Neurocomputing. 70, 2467-2476 (2007).
- Wang, L., Riss, M., Buitrago, J. O., Claverol-Tinturé, E. Biophysics of microchannel-enabled neuron-electrode interfaces. J Neural Eng. 9 (2), (2012).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85, 890-902 (1980).
- Schildge, S., Bohrer, C., Beck, K., Schachtrup, C. Isolation and culture of mouse cortical astrocytes. J. Vis. Exp. (71), e50079 (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J Vis Exp. (63), e3965 (2012).
- Ba, W., et al. ARHGAP12 functions as a developmental brake on excitatory synapse function. Cell Rep. 14 (6), 1355-1368 (2016).
- Bologna, L. L., et al. Investigating neuronal activity by SPYCODE multi-channel data analyzer. Neural Netw. 23 (6), 685-697 (2010).
- Ba, W., et al. TRIO loss of function is associated with mild intellectual disability and affects dendritic branching and synapse function. Hum Mol Genet. 25 (5), 892-902 (2016).
- Benevento, M., et al. Histone methylation by the Kleefstra syndrome protein EHMT1 mediates homeostatic synaptic scaling. Neuron. 91 (2), 341-355 (2016).
- Krencik, R., Weick, J. P., Liu, Y., Zhang, Z. -. J., Zhang, S. -. C. Specification of transplantable astroglial subtypes from human pluripotent stem cells. Nature biotechnology. 29 (6), 528-534 (2011).
- Frega, M., Tedesco, M., Massobrio, P., Pesce, M., Martinoia, S. Network dynamics of 3D engineered neuronal cultures: a new experimental model for in-vitro electrophysiology. Sci Rep. 4, 5489 (2014).
- Tedesco, M., Frega, M., Martinoia, S., Pesce, M., Massobrio, P. Interfacing 3D engineered neuronal cultures to micro-electrode arrays: an innovative in vitro experimental model. J Vis Exp. (104), e53080 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved