A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
علاج المخدرات و
In This Article
Summary
Small laboratory fish have become popular models for bone research on the mechanisms underlying human bone disorders and for the screening of bone-modulating drugs. In this report, we describe a protocol to assess the effect of alendronate on bone cells in medaka larvae with osteoporotic lesions.
Abstract
عظم تشكيل بانيات تتفاعل مع الخلايا الآكلة-resorbing العظام لتنسيق دوران مصفوفة العظام والتحكم توازن الهيكل العظمي. وتستخدم الميداكا واليرقات الزرد على نطاق واسع لتحليل سلوك الخلايا العظمية خلال تكوين العظام، انحطاط، والإصلاح. من الوضوح البصري يسمح التصور من fluorescently المسمى خلايا العظام والأصباغ الفلورية بد أن المصفوفة الهيكلية المعدنية. وقد ولدت لدينا مختبر الأسماك الميداكا المعدلة وراثيا التي تعبر عن العامل الذي يحفز مستقبلات ناقضة العظم المنشط للعامل النووي كيلوبايت يجند (RANKL) تحت سيطرة حرارة المروج صدمة محرض. التعبير خارج الرحم النتائج RANKL في تشكيل الزائد من الخلايا الآكلة تفعيلها، والتي يمكن أن تصور في خطوط مراسل التعبير nlGFP تحت سيطرة K (ctsk) المروج كاثبسين. الحث RANKL وتشكيل ناقضة العظم خارج الرحم يؤدي إلى الظواهر الشديدة مثل هشاشة العظام. مركب المعدلة وراثيا لى الميداكاالأخبار التي تعبر عن ctsk: nlGFP في الخلايا الآكلة، وكذلك mCherry تحت سيطرة (سكس) المروج osterix في بانيات المبكرة، ويمكن استخدامها لدراسة التفاعل بين كل من أنواع الخلايا. وهذا يسهل عملية المراقبة المجراة من السلوك الخلوية في ظل ظروف انحطاط العظام وإصلاح. هنا، نحن تصف استخدام هذا النظام لاختبار دواء يستخدم عادة في علاج هشاشة العظام البشرية وتصف بروتوكول للتصوير الحية. نموذج الميداكا يكمل دراسات في زراعة الخلايا والفئران، ويقدم نظام جديد للتحليل في الجسم الحي من عمل الدواء في نظام الهيكل العظمي.
Introduction
يوفر هيكل عظمي الفقاريات الدعم الهيكلي وحماية الأجهزة، ويتيح التنقل، ويخدم كمصدر للكالسيوم. في جميع مراحل الحياة، يتم تشغيل مصفوفة العظام خارج الخلية بشكل مستمر على مدى للحفاظ على الاستقرار العظام وصلابة. وهذه العملية تتطلب النشاط منسق بإحكام والتفاعل بين الخلايا بانية العظم تشكيل العظام والخلايا الآكلة-resorbing العظام. وتستمد بانيات من الأسلاف الوسيطة متعددة القدرات وإنتاج الكولاجين لتشكيل عظمية، الجزء البروتينية للمصفوفة العظام 10. بانيات تتفاعل مع الخلايا الآكلة لتحقيق النشاط متوازن لكل أنواع الخلايا، وهو مطلوب للسيطرة على العظام التوازن 7. وبسبب هذه التفاعلات التنظيمية المعقدة، والاستجابات للعلاج بالعقاقير والتوازن العظام لا يمكن فحص كامل استخدام في الدراسات المختبرية. وبالتالي، هناك طلب قوي على النماذج الحيوانية. مقارنة الإعدادات زراعة الخلايا، في النماذج الحية يمكن أن توفرمعلومات قيمة حول الشبكات متعددة الخلايا ضمن بيئة العظام.
وتوجد نماذج الماوس عديدة لمجموعة متنوعة من اضطرابات العظام البشرية بما في ذلك هشاشة العظام 16. ومع ذلك، فإن حجم وسهولة الوصول إليها من أجنة الفئران تمثل قيودا كبيرة للتصوير المباشر لعمليات والهيكل العظمي. الأسماك مكتملة العظام الصغيرة، من ناحية أخرى، بمثابة بديلا جذابا للتصوير في الجسم الحي. الزرد (دانيو rerio) والميداكا (Oryzias latipes) أصبحت نماذج حيوانية شعبية للبحث الهيكل العظمي خلال العقدين الماضيين 17 و 19 و 22 و 24. العظام في الأسماك مكتملة العظام وفي الثدييات هي مشابهة جدا، سواء على الهيكلية وعلى المستوى الفيزيولوجي، والعديد من الجينات التنظيمية الرئيسية ومسارات إشارات يتم حفظها 3. كما في الثدييات والأسماك مكتملة العظام تنظم بعناية نشاط الخلايا بانية العظم والخلايا الآكلة لتحقيق التوازن بين تكوين العظام وارتشاف 26. الأهم من ذلك، وضوح البصري فايش تسمح اليرقات استخدام للصحفيين الفلورسنت لتسمية خلايا العظام والهيكل العظمي مصفوفة متكلسة 8، 9، 12، 21، 23، مما يسهل مراقبة العمليات الخلوية في الحيوانات الحية. وبالإضافة إلى ذلك، تم إنشاء سلسلة من الأدوات الوراثية لتسهيل البحوث ذات الصلة بالطب الحيوي في الأسماك. لالميداكا على وجه الخصوص، وسائل لطفرة جينية التي تستهدفها كريسبر / Cas9 2، خلية النسب تتبع 6، وtransgenesis 14 استحدثت مؤخرا وأصبحت الآن على نطاق واسع في استخدام 15 في مواقع محددة.
وقد استخدمت مكتملة العظام اليرقات الصغيرة بنجاح للشاشات الكيميائية، والتي أدت إلى اكتشاف العديد من الأدوية ذات الصلة الصيدلانية 1، 18.
يرقات الأسماك متسامحة لتركيزات منخفضة من DMSO وقادرة على استيعاب المركبات من البيئة المائية، وذلك إما عن طريق الجلد أو عن طريق الجهاز الهضمي 1، 5. مختبرنا من قبل مندوبorted خطوط الميداكا المعدلة وراثيا التي تعبر عن صحفيين الفلورسنت في خلايا العظام تحت سيطرة مختلف osteoblast- والمروجين، ناقضة العظم معين. وتشمل هذه بانيات المبكرة (الكولاجين 10a1، col10a1، osterix، OSX) 20، 21، بانيات ناضجة (أوستيوكالسين، مكتب المنسق الخاص) 27، والخلايا الآكلة (كاثبسين K، ctsk) 24. ونحن أيضا ولدت خط المعدلة وراثيا التي تعبر عن عامل يحفز مستقبلات ناقضة العظم المنشط للعامل النووي كيلوبايت يجند (RANKL) تحت سيطرة الحرارة صدمة محرض المروج 24.
تحريض RANKL في هذا النظام يؤدي إلى تشكيل خارج الرحم من الخلايا الآكلة النشطة. وهذا يؤدي إلى زيادة ارتشاف العظام وهشاشة العظام تشبه النمط الظاهري شديدة، مع انخفاض شديد في تمعدن في الهيئات الفقري. وأظهرت لنا مؤخرا أن نشاط ناقضة العظم في هذا النموذج يمكن أن يكون قد تم حظره من قبل اتيدرونات البايفوسفونيت وأليندرونات، TWالمخدرات س تستخدم عادة في علاج هشاشة العظام البشرية، وبالتالي من صحة الميداكا كنظام نموذج مناسب لهشاشة العظام 27.
نظرا لحجمها الكبير الحضنة، والتطور السريع، وصغر حجم الأجنة، المعدلة وراثيا الميداكا اليرقات هي مناسبة فريدة لفحص على نطاق واسع من العقاقير هشاشة العظام وللتحليل في الجسم الحي من سلوك الخلايا العظمية. دراسات في الميداكا وبالتالي يمكن أن تكمل بكفاءة التجارب في مزارع الخلايا وفي الفئران التي تهدف إلى اكتشاف أهداف علاجية جديدة وعلاجات جديدة للاضطرابات العظام البشرية.
في هذه الدراسة، ونحن تصف بروتوكول لعلاج الميداكا اليرقات العظام مراسل مع المخدرات هشاشة العظام شيوعا، أليندرونات. نحن أيضا وصف بالتفصيل كيف اليرقات المعاملة هي التي شنت والمعدة للتصوير حي لمصفوفة العظام والخلايا العظمية. هذه البروتوكولات يمكن أن تتكيف بسهولة مع مركبات كيميائية الصغيرة الأخرى التي عمل إما الابتنائية العظام أو المخدرات antiresorptive.
Access restricted. Please log in or start a trial to view this content.
Protocol
أجريت جميع التجارب وفقا للبروتوكولات رعاية الحيوان المؤسسية واللجنة الاستخدام (IACUC) وافق من الجامعة الوطنية في سنغافورة (R14-293).
1. الأسماك تربية ومجموعة من الأجنة
- رفع WT، ctsk: nlGFP 24، RANKL: HSE: CFP 24، وOSX: mCherry 21 أحادية أو مركب المعدلة وراثيا الأسماك الميداكا في 26 درجة مئوية تحت دائرة الضوء للرقابة (ضوء 14 ساعة، 10 ساعة الظلام) للحث على وضع البيض.
- وضع البيض اليومي يحدث خلال 30 دقيقة الأولى بعد تحول الضوء على. البيض تلتصق ببعضها البعض من خلال خيوط ونعلق على بطن الأنثى لعدة ساعات. استخدام صافي مزجها غرامة للقبض على الإناث البالغات تحمل كتلة البيض. دع الأسماك راحة لفترة وجيزة في الشباك ثم تدليك بلطف بطن السمكة لتجريد بعناية الكتلة البويضة المخصبة من بطن الأنثى.
ملاحظة: صحية الميداكا الإناثيمكن أن تنتج 10-20 بيضة كل يوم لمدة ما يقرب من 5 أشهر. - وضع البيض إلى 60 مم البلاستيك طبق بتري. استخدام ماصة بلاستيكية لشطف الأجنة مع 5-10 مل من 0.3x Danieau والمتوسطة حل (الأسماك، 19.3 مم كلوريد الصوديوم، 0.23 ملي بوكل، 0.13 ملي MgSO 4، 0.2 ملي كا (NO 3) 2، و 1.7 ملي HEPES، ودرجة الحموضة 7.0). إضافة 1 مل من 0.25٪ (ث / ت) حل الميثيلين الأزرق الأوراق المالية إلى 2.5 L متوسطة السمك لمنع نمو الفطريات.
- لفة بلطف كتلة البيض لتشكيل عقدة من خيوط المرفق. استخدام الملقط لإزالة بعناية خيوط المرفق من كتل البيض المخصب للحصول على الأجنة الفردية (الشكل 1A).
- مرحلة الأجنة وفقا لIwamatsu 2004 13.
- الثقافة 20 - 30 الأجنة في 60 ملم البلاستيك طبق بيتري في 28 درجة مئوية الحاضنة. تغيير المتوسطة يوميا لضمان التطور الطبيعي للأجنة.
ملاحظة: المرة مرحلة الفقس (8-9 د postfertilization،DPF) أمر بالغ الأهمية خاصة بالنسبة للبقاء على قيد الحياة. إزالة chorions التعويم الحر للحفاظ على وسيلة نظيفة وضمان حسن معدلات البقاء على قيد الحياة اليرقات.
2. المعدلة وراثيا فحص الأجنة
- استخدام مجهر تشريحي مجهزة مصباح الزئبق للتصوير مضان وGFP، طلب تقديم العروض، والمرشحات CFP لفحص الأجنة وراثيا للتعبير مراسل فلوري باستخدام 40X التكبير.
- تحديد بصريا سكس: الأجنة mCherry من التعبير مراسل mCherry في وقت مبكر تشكيل عظام الجمجمة، مثل cleithrum، على كلا جانبي الرأس الخلفي (الشكل 1B، السهم)، وparasphenoid، في موقع مركزي في الجمجمة البطنية ( الشكل 1B، رأس السهم).
يبدأ التعبير مراسل من 5 DPF فصاعدا 21: ملاحظة. - تحديد ctsk: الأجنة nlGFP من التعبير nlGFP قوي في الرأس (الشكل 1C، السهم) والذيل (الشكل 1C، رأس السهم)، بدءا من6 DPF.
ملاحظة: الآكلة داخلية المنشأ تشكل إلا بعد 21 DPF. nlGFP، معربا عن الخلايا في هذه المرحلة المبكرة (6 DPF) ليست الآكلة لكن البعض، لذلك uncharacterized الآن، ctsk خلايا -positive 24. - تحديد RANKL: HSE: CFP الأجنة وراثيا قبل التعبير CFP في كل مكان بعد العلاج قصيرة حرارة صدمة لمدة 20 دقيقة في 39 ° C، التي أجريت في 2 DPF أو في وقت لاحق لأغراض الفحص.
ملاحظة: RANKL وCFP الجينات المحورة هي تحت سيطرة نفس ثنائي الاتجاه الحرارة صدمة العنصر (HSE). يشير CFP التعبير الناجح RANKL تحريض 24. - إجراء 1،5-2 ساعة المعالجة الحرارية صدمة في 9 DPF أو في وقت لاحق للحث على أعداد كبيرة من الخلايا الآكلة خارج الرحم في منطقة الجذع، والذي يؤدي بالتالي إلى النمط الظاهري مثل هشاشة العظام 24.
ملاحظة: التعبير RANKL المعدلة وراثيا التي يسببها في 9 النتائج DPF في تفعيل خارج الرحم من الخلايا ناقضة العظم السلف النائمة، التي التطور الطبيعي لا يتم تشغيلقبل 21 DPF. استخدام حمام مائي للحصول مستقرة 39 ° C الظروف. السماح للأجنة الميداكا طبق بتري تحتوي على تطفو على سطح الماء. تأكد من أن غطاء طبق بتري جافة لمنع غرق الطبق. - الأجنة الشاشة من خطوط مركب، مثل RANKL: HSE: CFP / ctsk: nlGFP انقر نقرا مزدوجا المعدلة وراثيا وOSX: mCherry / RANKL: HSE: CFP / ctsk: nlGFP وفقا للنمط التعبير عن كل التحوير الفردي الثلاثي المعدلة وراثيا.
ملاحظة: تم تمييزها الأجنة وراثيا فرداني الزيجوت ومتماثل من مستويات مضان مختلفة من التحوير مراسل. كان الأجنة متماثل كثافة مضان الذي تضاعف تقريبا مقارنة بما كان عليه من الجينات فرداني الزيجوت. وقد تم الحصول على nlGFP بتكرار incrossing على مدى عدة أجيال: خطوط المركب الذي كانوا متماثل لكلا RANKL: HSE: CFP وctsk. لالثلاثي المعدلة وراثيا سكس: mCherry / RANKL: HSE: CFP / ctsk: nlGFP الأسماك، RANKL متماثل: HSE: CFP / ctsk: شطبت الأسماك nlGFP مع OSX متماثل: ناقلات mCherry. أثيرت متخالف ذرية الثلاثي المعدلة وراثيا الناتجة عنها، وincrossed الحصول على أجنة متماثلة اللواقح بالنسبة RANKL: HSE: CFP. يجب أن يكون CFP التحوير متماثل من أجل الحصول على تحريض كفاءة الخلايا الآكلة خارج الرحم: إن RANKL: HSE.
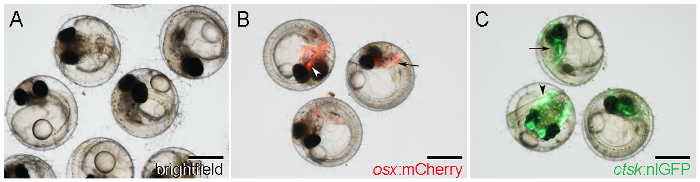
الشكل 1: WT والمعدلة وراثيا الميداكا الأجنة في 7 D Postfertilization (DPF). A. الأجنة WT احظت مع إضاءة brightfield. ب. الأجنة وراثيا تظهر سكس: التعبير mCherry حول cleithrum (السهم) وparasphenoid (رأس السهم). C. الأجنة وراثيا تظهر ctsk: التعبير nlGFP في الرأس (السهم) والذيل (رأس السهم). الحانات مقياس: 500 ميكرون.025 / 55025fig1large.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
3. البايفوسفونيت علاج الميداكا يرقات
- تحضير المحاليل التي تحتوي على تركيزات مختلفة من البايفوسفونيت (BPS) للدراسات الجرعة والاستجابة.
ملاحظة: BP النموذجية المستخدمة في هذا البروتوكول هو أليندرونات.- حل أليندرونات في متوسطة السمك في تركيز 100 ميكروغرام / مل لإعداد حل الأوراق المالية.
- استخدام خلاط دوامة لضمان حل كامل. تخزين الحل السهم عند 4 درجات مئوية.
- إعداد حلول العمل المختلفة عن طريق تمييع الحل الأسهم مع متوسط السمك لسلسلة من تركيزات (أي، 25، 37.5، 50، 62.5، و 75 ميكروغرام / مل).
ملاحظة: قد يكون عقاقير مختلفة مختلفة الامتصاص والتوزيع والتمثيل الغذائي، وإفراز المعلمات (ADME)، والتي يجب أخذها بعين الاعتبار خلال اختبار باستخدام هذا النظام اليرقات الميداكا. أيضا، والذوبان المخدرات والاستقرار قد تختلف عندماكما هو مطبق محلول مائي. قد تحتاج إلى أولا أن يذوب في المذيبات العضوية مثل DMSO المركبات أقل ذوبان في الماء. في هذه الحالة، يتم إعداد محلول المخزون في DMSO، الذي يرد بمزيد من المخفف في متوسطة السمك. نلاحظ أن الحلول التي تعمل في المياه (متوسطة السمك) يمكن تخزينها في الثلاجة لعدة أسبوع. ومع ذلك، والحلول التي تحتوي على DMSO يجب تخزينها في RT لمنع التبلور.
- نقل الميداكا اليرقات في لوحات ستة جيدا (ستة اليرقات / جيد) لشركة بريتيش بتروليوم (أليندرونات) معالجة لاحقة.
- إزالة المتوسطة السمك بعناية باستخدام ماصة بلاستيكية نظيفة وإضافة كمية صغيرة (حوالي 0.5 مل) من محلول أليندرونات إلى كل بئر.
- تجنب متوسطة السمك بقايا، باعتباره الحل BP أضاف يمكن أن تضعف، وهو أمر بالغ الأهمية لإيجاد حلول أليندرونات الأقل تركزا.
- إزالة وحدة تخزين صغيرة من محلول أليندرونات (تصل إلى 0.5 مل) من كل بئر مع ماصة بلاستيكية نظيفة واستبدالها volu أكبرلي (4 مل) من محلول أليندرونات.
- تغيير المتوسطة يوميا لضمان تنمية أجنة طبيعية.
4. تلطيخ لايف من مصفوفة تمعدن العظام
- حل 0.5 غرام من الصبغ الأحمر complexone (ALC، حمض الأليزارين-3-methyliminodiacetic) أو 0.05 غرام من calcein في 50 مل من المتوسط الأسماك لإعداد 1٪ و 0.1٪ الحلول الأسهم، على التوالي. استخدام خلاط دوامة لضمان حل كامل.
ملاحظة: متوسطة السمك بدون إضافة الميثيلين الأزرق يستخدم في هذا المجال والخطوات اللاحقة للحد من تألق ذاتي في اليرقات. - استخدام حقنة واحدة في استخدام مرشح (0.2 ميكرون) لتصفية حل تلطيخ. تخزين الحل تصفيتها في الظلام في RT.
ملاحظة: لون، واضحة الحل تلطيخ ALC تصفيتها هو الأصفر الداكن إلى البرتقالي. لون، حل calcein اضح تصفيتها مشرق الأصفر. الحلول التي يمكن أن تستخدم لعدة أشهر. - تمييع تصفيتها ALC أو الأسهم calcein حل 1:10 في متوسطة السمكواحتضان يرقات الميداكا ل1،5-2 ساعة (0.1٪ محلول ALC) أو 2-2،5 ساعة (0.01٪ حل calcein) في 28 درجة مئوية الحاضنة في حالة استخدام اليرقات بين 9 و 17 DPF. الحفاظ على عينات في الظلام.
- نقل اليرقات إلى متوسطة السمك الطازج باستخدام ماصة بلاستيكية نظيفة.
- إزالة المتوسطة السمك مع ماصة بلاستيكية نظيفة وإضافة متوسطة السمك الطازج. كرر هذه الخطوة 3-4 مرات حتى لا حل الأحمر- أو الأصفر الملون (ALC أو calcein، على التوالي) خلفها. ترك اليرقات في متوسطة السمك ل30 - 60 دقيقة قبل التركيب لهم للتصوير لتجنب epifluorescence من المتوسط.
ملاحظة: 0.1٪ حل تلطيخ ALC مضر اليرقات الميداكا لمرات التعرض الموسعة. حضانة مرات أطول من 2 ساعة تؤثر على بقاء اليرقات. وبالتالي تركيز ووقت تلطيخ تحتاج إلى أن يكون الأمثل لمراحل مختلفة من أجل تحقيق أفضل بقاء الجنين وتلطيخ النتائج.
5. لايف الإسفار التصوير P>
- تخدير اليرقات الميداكا مع 0.01٪ تريكين (إيثيل methanesulfonate 3-أمينوبنزوات) في متوسطة السمك.
ملاحظة: تخدير اليرقات تصبح يجمد بعد 5-10 دقيقة في حل تريكين وعادة الكذب إما على جنوبهم أو ظهورهم. - استخدام microloader البلاستيك لتوجيه اليرقات وفقا للمنطقة من الفائدة. توجه اليرقات المستخدمة في هذا البروتوكول هو الجانبي.
- استخدام مجهر تشريحي مع إضاءة مضان للتصوير. استخدام التكبير عالية عند التقاط الصور، مع التركيز على مناطق مختلفة من اليرقات (الرأس، والجذع الأمامي، الخلفي الجذع، والذيل). غرزة الصور الفردية معا في تداخل المناطق باستخدام برنامج لمعالجة الصور مناسبة (إدراجات في الشكل 3G).
ملاحظة: هذا يساعد على تحسين جودة الصورة من جميع أجزاء الجسم ذات الصلة في المستوى البؤري الصحيح. - العودة اليرقات إلى متوسطة السمك للانتعاش بعد التصوير.
- تخدير اليرقات مع 0.01٪ تريكين في متوسطة السمك ل5-10 دقائق حتى تصبح يجمد.
- حل المنخفضة للذوبان الاغاروز إلى 1.5٪ في المتوسط الأسماك بتسخينه في فرن الميكروويف. بارد هذا الحل إلى ما يقرب من 30 درجة مئوية.
- إضافة 0،5-1 مل من السائل 1.5٪ انخفاض ذوبان الاغاروز في متوسطة السمك إلى طبق بيتري القاع الزجاجي. نقل اليرقات تخدير في الحل باستخدام ماصة بلاستيكية نظيفة.
ملاحظة: خذ الاحتياطات الخاصة أن درجة حرارة السائل الاغاروز ذوبان منخفضة منخفضة بما يكفي لعدم الإضرار اليرقات. - قبل يتصلب الأغاروس، استخدم microloader البلاستيك لدفع اليرقات إلى الجزء السفلي من طبق بيتري وتوجيه اليرقات وفقا للمنطقة من الفائدة. توجه اليرقات المستخدمة في هذا البروتوكول هو الجانبي.
ملاحظة: عينات جاهزة للتصوير حي متحد البؤر بعد يتصلب تماما agarose. - استخدام المجهر متحد البؤر لACQصور uire.
- استخدام خط ليزر 543 نانومتر ليحلل mCherry وALC تلطيخ. استخدام خط ليزر 488 نانومتر لnlGFP ويحلل calcein تلطيخ.
- بعد التصوير، إضافة متوسطة السمك إلى طبق بتري واستخدام زوج من إبر رفيعة حقنة (27 G س 1½ ") لإزالة بعناية اليرقات من الاغاروز. نقل اليرقات مع تولي بالتبعية الاغاروز إلى طبق بيتري مع متوسطة السمك لاسترداد .
- معالجة الصور باستخدام برامج التحليل صورة 27.
Access restricted. Please log in or start a trial to view this content.
النتائج
أرقام البيض وفيرة، فضلا عن صغر حجم اليرقات، وجعل الميداكا نموذجا ممتازا لفحص المخدرات. تم استخدام لوحة ستة جيدا واحدة لثقافة ما يصل إلى 36 اليرقات، التي كانت كافية لتوفير بيانات ذات دلالة إحصائية. ميزة أخرى كبيرة من الأسماك باستخدام لتحليل الهيكل العظمي هي إمكانية ال...
Access restricted. Please log in or start a trial to view this content.
Discussion
خطوات حاسمة في إطار بروتوكول
ومن الضروري أن الظروف لعلاج الصدمة الحرارية هي متسقة ومستقرة عند مقارنة عينات مختلفة. درجات الحرارة مستقرة تضمن مستويات مماثلة من RANKL الاستقراء في اليرقات المعدلة وراثيا، وبالتالي تشكيل ناقضة العظم ق?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب تعلن أنه ليس لديهم مصالح متنافسة أو المالية.
Acknowledgements
وقد تم تمويل هذا المشروع من المنح المقدمة من سنغافورة وزارة التربية والتعليم (وزارة التربية، عدد المنح 2013 T2-2-126) والمعهد الوطني للصحة في الولايات المتحدة الأمريكية (NIH، منح عدد 1R21AT008452-01A1). تلقى تاي على منحة دراسات عليا من وزارة جامعة سنغافورة الوطنية للعلوم البيولوجية. نشكر وحدة مبائر من مركز جامعة سنغافورة الوطنية للعلوم Bioimaging (CBIS) لدعمهم المستمر.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Alendronate | Sigma | A4978 | |
| alizarin-3-methyliminodiacetic acid, Alizarin Complexone | Sigma | A3882 | |
| Calcein | Sigma | C0875 | |
| ethyl 3-aminobenzoate methanesulfonate (Tricaine) | Sigma | A5040 | |
| ImageJ (1.4.3.67) | National Institute of Health (NIH) | https://imagej.nih.gov/ij/ | |
| LSM 510 Meta confocal | Zeiss | ||
| LSM Image Browser (4.2.0.121) | Zeiss | http://www.zeiss.com/microscopy/en_de/downloads/lsm-5-series.html | |
| Micro-loader | Eppendorf | 5242956003 | Eppendorf ep T.I.P.S 20 μL |
| NIS-Elements BR 3.0 software | Nikon | ||
| Photoshop CS6 (13.0.0.0) | Adobe | ||
| SMZ1000 stereomicroscope | Nikon |
References
- Ablain, J., Zon, L. I. Of fish and men: using zebrafish to fight human diseases. Trends Cell Biol. 23 (12), 584-586 (2013).
- Ansai, S., Kinoshita, M. Targeted mutagenesis using CRISPR/Cas system in medaka. Biol Open. 3 (5), 362-371 (2014).
- Apschner, A., Schulte-Merker, S., Witten, P. E. Not all bones are created equal-using zebrafish and other teleost species in osteogenesis research. Methods Cell Biol. 105, 239-255 (2011).
- Bajoghli, B., Aghaallaei, N., Heimbucher, T., Czerny, T. An artificial promoter construct for heat-inducible misexpression during fish embryogenesis. Dev Biol. 271 (2), 416-430 (2004).
- Barrett, R., Chappell, C., Quick, M., Fleming, A. A rapid, high content, in vivo model of glucocorticoid-induced osteoporosis. Biotechnol J. 1 (6), 651-655 (2006).
- Centanin, L., Ander, J. J., Hoeckendorf, B., Lust, K., Kellner, T., Kraemer, I., Urbany, C., Hasel, E., Harris, W. A., Simons, B. D., et al. Exclusive multipotency and preferential asymmetric divisions in post-embryonic neural stem cells of the fish retina. Development. 141 (18), 3472-3482 (2014).
- Charles, J. F., Aliprantis, A. O. Osteoclasts: more than 'bone eaters. Trends Mol Med. 20 (8), 449-459 (2014).
- DeLaurier, A., Eames, B. F., Blanco-Sanchez, B., Peng, G., He, X., Swartz, M. E., Ullmann, B., Westerfield, M., Kimmel, C. B. Zebrafish sp7:EGFP: a transgenic for studying otic vesicle formation, skeletogenesis, and bone regeneration. Genesis. 48 (8), 505-511 (2010).
- Du, S. J., Frenkel, V., Kindschi, G., Zohar, Y. Visualizing normal and defective bone development in zebrafish embryos using the fluorescent chromophore calcein. Dev Biol. 238 (2), 239-246 (2001).
- Eriksen, E. F. Cellular mechanisms of bone remodeling. Rev Endocr Metab Disord. 11 (4), 219-227 (2010).
- Hockendorf, B., Thumberger, T., Wittbrodt, J. Quantitative analysis of embryogenesis: a perspective for light sheet microscopy. Dev Cell. 23 (6), 1111-1120 (2012).
- Inohaya, K., Takano, Y., Kudo, A. The teleost intervertebral region acts as a growth center of the centrum: in vivo visualization of osteoblasts and their progenitors in transgenic fish. Dev Dyn. 236 (11), 3031-3046 (2007).
- Iwamatsu, T. Stages of normal development in the medaka Oryzias latipes. Mech Dev. 121 (7), 605-618 (2004).
- Kirchmaier, S., Hockendorf, B., Moller, E. K., Bornhorst, D., Spitz, F., Wittbrodt, J. Efficient site-specific transgenesis and enhancer activity tests in medaka using PhiC31 integrase. Development. 140 (20), 4287-4295 (2013).
- Kirchmaier, S., Naruse, K., Wittbrodt, J., Loosli, F. The genomic and genetic toolbox of the teleost medaka (Oryzias latipes). Genetics. 199 (4), 905-918 (2015).
- Komori, T. Animal models for osteoporosis. Eur J Pharmacol. 759, 287-294 (2015).
- Mackay, E. W., Apschner, A., Schulte-Merker, S. A bone to pick with zebrafish. Bonekey Rep. 2, 445(2013).
- MacRae, C. A., Peterson, R. T. Zebrafish as tools for drug discovery. Nat Rev Drug Discov. 14 (10), 721-731 (2015).
- Mitchell, R. E., Huitema, L. F., Skinner, R. E., Brunt, L. H., Severn, C., Schulte-Merker, S., Hammond, C. L. New tools for studying osteoarthritis genetics in zebrafish. Osteoarthritis Cartilage. 21 (2), 269-278 (2013).
- Renn, J., Buttner, A., To, T. T., Chan, S. J., Winkler, C. A col10a1:nlGFP transgenic line displays putative osteoblast precursors at the medaka notochordal sheath prior to mineralization. Dev Biol. 381 (1), 134-143 (2013).
- Renn, J., Winkler, C. Osterix-mCherry transgenic medaka for in vivo imaging of bone formation. Dev Dyn. 238 (1), 241-248 (2009).
- Schilling, T. F., Kimmel, C. B. Segment and cell type lineage restrictions during pharyngeal arch development in the zebrafish embryo. Development. 120 (3), 483-494 (1994).
- Spoorendonk, K. M., Peterson-Maduro, J., Renn, J., Trowe, T., Kranenbarg, S., Winkler, C., Schulte-Merker, S. Retinoic acid and Cyp26b1 are critical regulators of osteogenesis in the axial skeleton. Development. 135 (22), 3765-3774 (2008).
- To, T. T., Witten, P. E., Renn, J., Bhattacharya, D., Huysseune, A., Winkler, C. Rankl-induced osteoclastogenesis leads to loss of mineralization in a medaka osteoporosis model. Development. 139 (1), 141-150 (2012).
- Wakamatsu, Y., Pristyazhnyuk, S., Kinoshita, M., Tanaka, M., Ozato, K. The see-through medaka: a fish model that is transparent throughout life. Proc Natl Acad Sci USA. 98 (18), 10046-10050 (2001).
- Witten, P. E., Huysseune, A. A comparative view on mechanisms and functions of skeletal remodelling in teleost fish, with special emphasis on osteoclasts and their function. Biol Rev Camb Philos Soc. 84 (2), 315-346 (2009).
- Yu, T., Witten, P. E., Huysseune, A., Buettner, A., To, T. T., Winkler, C. Live imaging of osteoclast inhibition by bisphosphonates in a medaka osteoporosis model. Dis Model Mech. 9 (2), 155-163 (2016).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved