A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
رسم خريطة الموقع ملزم لأبتمر على ATP عن طريق الميكروسكيل Thermophoresis
In This Article
Summary
MicroScale Thermophoresis (MST) is a sensitive technology to characterize aptamer-target interactions. This manuscript describes an MST protocol to characterize aptamer-small molecule interactions.
Abstract
Characterization of molecular interactions in terms of basic binding parameters such as binding affinity, stoichiometry, and thermodynamics is an essential step in basic and applied science. MicroScale Thermophoresis (MST) is a sensitive biophysical method to obtain this important information. Relying on a physical effect called thermophoresis, which describes the movement of molecules through temperature gradients, this technology allows for the fast and precise determination of binding parameters in solution and allows the free choice of buffer conditions (from buffer to lysates/sera). MST uses the fact that an unbound molecule displays a different thermophoretic movement than a molecule that is in complex with a binding partner. The thermophoretic movement is altered in the moment of molecular interaction due to changes in size, charge, and hydration shell. By comparing the movement profiles of different molecular ratios of the two binding partners, quantitative information such as binding affinity (pM to mM) can be determined. Even challenging interactions between molecules of small sizes, such as aptamers and small compounds, can be studied by MST. Using the well-studied model interaction between the DH25.42 DNA aptamer and ATP, this manuscript provides a protocol to characterize aptamer-small molecule interactions. This study demonstrates that MST is highly sensitive and permits the mapping of the binding site of the 7.9 kDa DNA aptamer to the adenine of ATP.
Introduction
التفاعل بين الجزيئات هو أساس الطبيعة. ومن هنا، والعلماء في العديد من مجالات البحوث الأساسية والتطبيقية محاولة لفهم المبادئ الأساسية للتفاعلات الجزيئية من أنواع مختلفة. الميكروسكيل Thermophoresis (MST) تمكن العلماء من أداء ودقيقة، وتوصيف سريع، ومراقبة الجودة فعالة من حيث التكلفة من التفاعلات الجزيئية في الحل، مع حرية اختيار المخازن. وهناك بالفعل أكثر من 1000 المنشورات باستخدام MST، اعتبارا من عام 2016 وحده، واصفا أنواع مختلفة من التحليلات، بما في ذلك عروض مكتبة، ملزمة التصديقات الحدث، فحوصات المنافسة، والتجارب مع شركاء ملزم متعددة 1-8. بشكل عام، يسمح MST دراسة المعلمات ملزمة الكلاسيكية، مثل تقارب ملزمة (بعد الظهر لملم)، رياضيات الكيمياء، والديناميكا الحرارية، من أي نوع من التفاعل الجزيئي. وهناك ميزة كبيرة من MST هي القدرة على دراسة الأحداث ملزمة مستقلة عن حجم شركاء التفاعل. حتى شالالتفاعلات lenging بين الأبتامرات الحمض النووي صغيرة (15-30 الإقليم الشمالي) وأهداف مثل الجزيئات الصغيرة، والمخدرات، والمضادات الحيوية، أو الأيض ويمكن قياس.
التكنولوجيات الحالية للدولة من بين الفن لتوصيف التفاعلات أبتمر المستهدفة هي إما مختبر مكثفة ومعقدة للغاية أو تفشل في تحديد-أبتمر صغيرة جزيء التفاعلات 9،10. السطح بلازمون الرنين (SPR) المستندة إلى فحوصات 11،12 والنهج المسعرية حقا خالية من التسمية، مثل متساوي الكالوري المعايرة (ITC) 13-15، شطف isocratic 16، التوازن فاي ltration 17،18، في خط التحقيق 19، gel- تحول المقايسات، stopped- آه فلوريدا فلوريدا uorescence الطيفي 20،21، مضان تباين (FA) 22،23، واحد جزيء فلوريدا uorescence التصوير 24،25، والحيوية طبقة التداخل (BLI) 26 هي أيضا إما غير دقيق أو غير متوافق مع جزيء صغير أبتمر التفاعلات. principa الآخرينقضايا لتر من هذه الأساليب هي حساسية منخفضة، وارتفاع استهلاك عينة، الشلل، والقيود النقل الجماعي على الأسطح، و / أو قيود العازلة. فقط عدد قليل من هذه التقنيات توفر ضوابط متكاملة لتجميع وامتصاص الآثار.
يمثل MST أداة قوية للعلماء للتغلب على هذا القيد لدراسة التفاعلات بين الأبتامرات والجزيئات الصغيرة 27-29، فضلا عن أهداف أخرى مثل البروتينات 30-33. وتعتمد هذه التقنية على حركة الجزيئات من خلال تدرجات درجة الحرارة. هذه الحركة موجهة، ودعا "thermophoresis،" تعتمد على حجم وتوجيه التهم وقذيفة الماء من جزيء 34،35. الربط ليجند للجزيء ستغير مباشرة واحدة على الأقل من هذه المعايير، مما أدى إلى التنقل thermophoretic تغييرها. بروابط مع أحجام صغيرة قد لا يكون لها تأثير كبير من حيث حجم التغيير من غير منضم إلى دولة منضمة، ولكنها يمكن أن يكون الدكتور آثار amatic على قذيفة الماء و / أو تهمة. التغييرات في حركة thermophoretic من جزيئات بعد التفاعل مع الشريك ملزم تمكن الكمي من المعلمات ملزمة الأساسية 2،7،34،36،37.
كما هو مبين في الشكل 1A، ويتكون الجهاز MST ليزر الأشعة تحت الحمراء التي تركز على العينة داخل الشعيرات الدموية الزجاج باستخدام نفس البصريات، وللكشف عن مضان. يمكن رصد حركة thermophoretic من البروتينات عن طريق uorescence فلوريدا لا يتجزأ من tryptophans 6 أو تفاعل شريك 3،8 fluorescently المسمى في حين أن الليزر يؤسس التدرج في درجة الحرارة (ΔT من 2-6 درجة مئوية). الفرق في درجة الحرارة مما أدى إلى الفضاء، ΔT، يؤدي إلى نضوب أو تراكم الجزيئات في مجال درجات الحرارة المرتفعة، والتي يمكن قياسها كميا بواسطة سوريه coef فاي cient (S T):
ز "/>
ج يمثل الساخنة التركيز في منطقة ساخنة، وج البرد هو تركيز في المنطقة الباردة الأولية.
كما هو مبين في الشكل 1B، نموذجية MST نتائج التجربة في ملف تعريف حركة MST (الوقت أثر)، ويتألف من المراحل المختلفة، والتي يمكن أن تكون مفصولة الجداول الزمنية الخاصة بكل منها. يتم قياس مضان الأولي في أول 5 ثوان في غياب التدرج في درجة الحرارة لتحديد مضان بدءا دقيقة وللتحقق ل photobleaching أو photoenhancement. الوثب درجة الحرارة (T-السريع) يمثل المرحلة التي التغييرات مضان قبل حركة thermophoretic. هذا الانخفاض الأولي في مضان يعتمد على التغييرات التي تعتمد على الحرارة من فلوريدا uorophore العائد الكم. يتبع مرحلة thermophoresis، التي ينخفض مضان (أو زيادة) نتيجة لحركة thermophoretic من الجزيئات حتى توزيع ثابتة للدولة يتم التوصل.ويمكن ملاحظة أن TJump العكس ونشر الظهر يصاحب ذلك من الجزيئات uorescent فلوريدا كما هو مبين في الشكل 1B بعد يتم فيها تشغيل الليزر قبالة. من أجل الوصول إلى معايير ملزمة الأساسية، ويتم تحليل نسب المولي مختلفة من شركاء التفاعل ومقارنة. عادة، يتم دراسة 16 نسب مختلفة في تجربة MST واحد، في حين يتم الاحتفاظ جزيء مرئية بصري مستمر ويتم توفيره مع كمية متزايدة من يجند الخالي من الملصقات. التفاعل بين الشركاء ملزم اثنين يؤدي الى تغييرات في thermophoresis، وبالتالي في uorescence فلوريدا تطبيع، F القاعدة، والذي يحسب على النحو التالي:
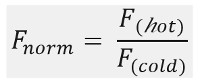
F الساخنة والباردة F تمثل متوسط كثافة uorescence فلوريدا في دي فاي نقطة زمنية نيد من آثار MST. الانتماءات الملزمة (ك د أو EC 50 القيم) ويمكن حساب من المنحنياتالبريد المناسب (الشكل 1C).
وعموما، MST هو أداة قوية لدراسة التفاعلات الجزيئية من أي نوع. تقدم هذه المخطوطة بروتوكول لوصف التفاعل تحديا بين ثلاثي صغيرة جزيء الفوسفات (ATP؛ 0.5 كيلو دالتون) و25 الإقليم الشمالي القصير ssDNA أبتمر DH25.42 (7.9 كيلو دالتون). على مدى المخطوطة، يتم تعيين موقع ملزم للأبتمر على جزيء ATP وصولا الى مجموعة الأدينين من لاعبي التنس المحترفين.
Protocol
1. إعداد المخزون العمل أبتمر
- اتبع إرشادات الشركة المصنعة وحل النوكليوتيد (5 Cy5-CCTG GGGGAGTATTGCGGAGGAAGG-3، سلسلة من مرجع 18) في الماء لتصل إلى تركيز النهائي 100 ميكرومتر.
- إعداد الحل أبتمر العمل التي تمييع الأسهم النوكليوتيد إلى 200 نيوتن متر مع العازلة ملزمة (20 ملي تريس، ودرجة الحموضة 7.6، 300 مم كلوريد الصوديوم، 5 ملي MgCl 2، 0.01٪ Tween20).
- احتضان الخليط لمدة 2 دقيقة عند 90 درجة مئوية، والسماح للعينة يبرد على الفور إلى أسفل على الجليد، واستخدام العينة في درجة حرارة الغرفة.
2. إعداد والتخفيف سلسلة يجند
- لكل يجند (أدينوسين ثلاثي الفوسفات (ATP)، ثنائي فسفات الأدينوزين (ADP)، أحادي فسفات الأدينوزين (AMP)، الأدينين، غوانوزين ثلاثي الفوسفات (GTP)، السيتوزين ثلاثي الفوسفات (CTP)، deoxyadenosine ثلاثي الفوسفات (dATP)، وميثيونين S-adenosyl (SAM) و 10 ملي الأسهم لكل منهما)، إعداد diluti مسلسل 16 خطوةعلى في 200 ميكرولتر أنابيب رد فعل الصغيرة.
ملاحظة: الطرد المركزي من أسهم يجند لمدة 5 دقائق في 14000 x ج قد تساعد على إزالة الركام. ، ينصح انخفاض حجم منخفضة أنابيب رد فعل ملزم لتجنب امتصاص الجزيئات على الجدران أنبوب. - بدء بأقصى تركيز لا يقل عن 50 مرات أعلى من النسب المقدرة والحد من تركيز يجند بنسبة 50٪ في كل خطوة التخفيف.
ملاحظة: أداة تركيز مكتشف في تنفيذ البرامج السيطرة تحاكي ربط البيانات وتساعد في العثور على الحق في مجموعة تركيز لسلسلة التخفيف. - ملء 20 ميكرولتر من الأسهم يجند (10 ملم) في أنبوب 1. إضافة 10 ميكرولتر من أبتمر العازلة ملزمة في أنابيب رد فعل الصغرى 2-16.
- نقل 10 ميكرولتر من أنبوب 1 إلى 2 أنبوب وتخلط بشكل صحيح من قبل pipetting صعودا وهبوطا عدة مرات. نقل 10 ميكرولتر إلى أنبوب التالي وكرر هذا التخفيف لأنابيب المتبقية.
- تجاهل الزيادة 10 ميكرولتر من الأنبوب الماضي. تجنب أي بuffer آثار التخفيف. يجب أن يكون المخزن المؤقت في أنبوب 1 وفي أنابيب 2-16 متطابقة.
3. إعداد مزيج رد الفعل النهائي
- إعداد ردود الفعل ملزمة الفردية مع حجم 20 ميكرولتر (10 ميكرولتر من أبتمر العمل الحل + 10 ميكرولتر من التخفيف يجند المعنية) للحد من الأخطاء pipetting ل. وبلغ حجم التداول ميكرولتر 4 فقط هو صوف فاي cient إلى الفرنسيسكان ليرة لبنانية الشعرية.
- إضافة 10 ميكرولتر من محلول العمل 200 نانومتر أبتمر إلى 10 ميكرولتر من كل تخفيف يجند وتخلط بشكل صحيح من قبل pipetting صعودا وهبوطا عدة مرات.
- احتضان هذه العينات لمدة 5 دقائق في درجة حرارة الغرفة وفاي ليرة لبنانية العينات في الشعيرات الدموية القياسية عن طريق غمس الشعيرات الدموية في العينة. قد تكون أوقات أطول الحضانة اللازمة لبعض التفاعلات. ومع ذلك، 5 دقائق كافية بالنسبة لمعظم. المس الشعيرات الدموية فقط على الجانبين، وليس على الجزء الأوسط، حيث سيتم اتخاذ القياس البصرية.
- وضع الشعيرات الدموية على عشرالبريد علبة الشعرية وبدء تشغيل الجهاز MST.
4. بدء تشغيل جهاز MST
ملاحظة: يوفر جهاز اثنين من حزم البرامج المثبتة مسبقا، و '' السيطرة "برنامج لإعداد فني من الظروف التجريبية و '' تحليل" برنامج لتفسير البيانات المنتجة.
- قبل وضع علبة الشعرية في الجهاز MST، بدء برنامج حاسوبي لمراقبة وضبط درجة الحرارة المطلوبة الشاملة عن طريق اختيار '' تمكين اليدوية التحكم في درجة الحرارة "في" "التحكم في درجة الحرارة" القائمة المنسدلة. ضبط درجة الحرارة إلى 25 درجة مئوية في هذا الطريق.
ملاحظة: وثائق MST يمكن أن يكون 22-45 درجة مئوية التحكم في درجة حرارته. - الانتظار لدرجة الحرارة للوصول إلى المستوى المتوقع ومن ثم وضع علبة الشعرية في الجهاز MST.
- تعيين القناة أدى إلى '' أحمر "لالأصباغ Cy5 وضبط الصمام السلطة لكسب فلوريدا uorescencإشارة (ه) من 300 إلى 1000 وحدة مضان في الجهاز MST مع جهاز استشعار قياسية. يستخدم 25٪ من الطاقة الصمام في هذه الدراسة.
ملاحظة: ينصح 6000 إلى 18،000 وحدة مضان لMST مع جهاز استشعار عالية الحساسية.
5. شعري المسح الضوئي
- إجراء مسح الشعرية للتحقق جوانب نوعية مختلفة من العينة عن طريق اختيار موقف شعري على برنامج "السيطرة" والنقر على "بدء المسح الضوئي كاب" قبل البدء في قياس MST.
- تفقد مسح شعري لمضان تعزيز / تبريد والآثار العالقة (قمم على شكل حرف U أو بالارض) في البرنامج.
ملاحظة: مزيد من التفاصيل حول الكشف والتعامل مع مضان والآثار العالقة يمكن العثور عليها في المناقشة.
6. قياس MST
ملاحظة: قبل البدء في قياس MST، للتأكد من استبعاد التمسك الآثار، وتعزيز / التبريد الآثار، أوأخطاء pipetting ل، والتأكد من أن مسح شعري يشير إلى أن إشارة فلوريدا uorescence هي SUF فاي cient. لمزيد من التفاصيل، انظر المناقشة.
- تعيين تركيزات يجند من سلسلة تخفيف لموقف الشعرية المعنية في مراقبة البرامج "" النظر في خطوة التخفيف من خلط أبتمر ويجند. (1: 1).
- أدخل أعلى تركيز من يجند (5 ملم) لالشعرية # 1، حدد نوع تخفيف الصحيح (هنا، 1: 1)، انقر على التركيز الأقصى، واستخدام وظيفة السحب لتعيين تركيزات المتبقية في الشعيرات الدموية # 2- تلقائيا 16. أقل تركيز هو 152.6 نيوتن متر.
- أدخل تركيز أبتمر uorescent فلوريدا (هنا، و 100 نيوتن متر) في القسم الخاص بكل من برامج التحكم.
- استخدام الإعدادات الافتراضية، التي كشف عن uorescence فلوريدا لمدة 5 ثانية، تسجيل MST لمدة 30 ثانية، وتسجيل مضان ل 5 ثانية مزيد من بعد تثبيط ر الليزر س مراقبة انتشار الخلفي من الجزيئات.
- ضبط قوة الليزر إلى 20٪ في قسم منها من برنامج التحكم.
ملاحظة: من أجل الحصول على أفضل نسبة الإشارة إلى الضوضاء ولتجنب الآثار غير محددة، فمن المستحسن قوة الليزر من 20-40٪. في حالات معينة، قد تكون هناك حاجة إلى قوة الليزر أعلى للحصول على فصل جيد من الجزيئات غير منضم وملزمة. - حفظ التجربة بعد اختيار مجلد الوجهة والبدء في قياس MST عن طريق الضغط على زر '' قياس بدء MST ".
ملاحظة: سيتم إنشاء الملف .ntp في مجلد الوجهة. باستخدام هذا الإعداد، وقياس واحد يستمر 10-15 دقيقة. - كرر الإجراء التجريبي على الأقل مرتين لتحديد أكثر دقة للقيمة EC 50.
ملاحظة: من أجل اختبار استنساخ التقني، ونفس الشعيرات الدموية يمكن فحصها عدة مرات (تكرار التقنية).
7. تحليل البيانات MST
الإقليم الشمالي "> ملاحظة: برامج التحليل يمكن تحليل البيانات على فلوريدا ذ خلال قياس وتحليل البرامج المؤامرات آثار الساعة MST والتغيرات في تطبيع فلوريدا uorescence (F القاعدة) في مقابل تركيز يجند 37.- بدء تشغيل برامج التحليل MST (تحليل MO.Affinity) وتحميل الملف .ntp من المجلد الوجهة. حدد "MST" كنوع التحليل في قائمة اختيار البيانات.
ملاحظة: في حالة الآثار مضان تعتمد على يجند، مضان الأولي ويمكن اختيار لتحليلها. - إضافة على المدى التقنية والبيولوجية منها (ق) لتحليل جديد عن طريق السحب والإفلات أو عن طريق الضغط على زر "+" أدناه على المدى التجريبية منها.
- اضغط على زر المعلومات الواردة أدناه على المدى التجريبية منها الحصول على معلومات عن خصائص التجربة، آثار MST، مسح شعري، شكل شعري، مضان الأولي، ومعدل التبييض.
ملاحظة: هذه البيانات الخام يمكن آللذلك يتعين تفتيشها في خطوات لاحقة من التحليل. - تفقد البصر آثار MST لتجميع وترسيب الآثار وظاهرة للعيان كما المطبات والمسامير.
ملاحظة: للحصول على مزيد من المعلومات حول الكشف والتعامل مع آثار التجميع، قراءة المناقشة. - تفقد البصر الفحص الشعرية والشعرية شكل غطاء لآثار الامتصاص وظاهرة للعيان كما قمم بالارض أو على شكل حرف U. تفقد البصر الفحص الشعرية ومضان الأولي للآثار مضان. تفقد البصر معدل تبيض ل photobleaching الآثار.
- التبديل إلى وضع الجرعة والاستجابة وتغيير إعداد تحليل لوضع "الخبير" عن طريق الضغط على زر منها. حدد "تي السريع" كما استراتيجية التقييم MST.
- حدد "هيل" نموذجا للtting منحنى فاي. سيتم تلقائيا تحسب المعلمات ملزم. تطبيع البيانات عن طريق اختيار نوع منها التطبيع في القائمة "مقارنة النتائج". تصديرالبيانات إما .xls أو قوات الدفاع الشعبي.
ملاحظة: يلخص الجدول أدناه الرسم البياني ملزم المعلمات ملزمة حساب.
النتائج
في هذه الدراسة، تم تطبيق MST لتميز موقع ملزم للأبتمر DH25.42 الحمض النووي 18 على ATP. وعلى النقيض من الدراسات الأخرى التي تميز تفاعل ATP أو ATP-محاكاة جزيئات صغيرة مع البروتينات وصفت بشكل عشوائي مع واحد أو أكثر من fluorophores 38-40، وتشمل هذه الدراسة نسخة ?...
Discussion
مراقبة الجودة:
غير محددة الشائكة / امتصاص مادة العينة على الأسطح، وكذلك آثار التجميع، يكون لها تأثير كبير على نوعية البيانات تقارب. ومع ذلك، سوى عدد قليل من التقنيات للدولة من بين الفن وتوفر خيارات دقيقة وسريعة لرصد وتجنب هذه الآثا...
Disclosures
م، وTS هم موظفون من 2bind محدودة، والتي توفر الخدمات التحليلية الفيزيائية الحيوية. يتم دفع رسوم النشر لهذا الفيديو المادة تكفلها 2bind GmbH المزيد.
Acknowledgements
الكتاب ليس لديهم الاعترافات.
Materials
| Name | Company | Catalog Number | Comments |
| Aptamer binding buffer | 20 mM Tris pH 7.6; 300 mM NaCl; 5 mM MgCl2; 0.01% Tween-20 | ||
| Fluorescently labeled ATP aptamer | IDT, Leuven, Belgium | sequence: DH25.42 50-Cy5-CCTGGGGGAGT- ATTGCGGAGGAAGG-3 | |
| ATP | Sigma Aldrich, Germany | A2383 | 10 mM stock solutions stored at - 20 °C |
| ADP | Sigma Aldrich, Germany | A2754 | 10 mM stock solutions stored at - 20 °C |
| AMP | Sigma Aldrich, Germany | A2252 | 10 mM stock solutions stored at - 20 °C |
| Adenine | Sigma Aldrich, Germany | A8626 | 10 mM stock solutions stored at - 20 °C |
| SAM | Sigma Aldrich, Germany | A7007 | 10 mM stock solutions stored at - 20 °C |
| dATP | Sigma Aldrich, Germany | 11934511001 | 10 mM stock solutions stored at - 20 °C |
| CTP | Sigma Aldrich, Germany | C1506 | 10 mM stock solutions stored at - 20 °C |
| GTP | Sigma Aldrich, Germany | G8877 | 10 mM stock solutions stored at - 20 °C |
| Monolith NT.115 | NanoTemper Technologies, Munich, Germany | MO-G008 | Blue/Red Channel MST device with standard detector, Monolith NT115 pico is MST device with high sensitivity detector |
| Monolith NT.115 capillaries Standard | NanoTemper Technologies, Munich, Germany | MO-K002 | |
| Eppendorf PCR tubes | Eppendorf, Germany | 30124537 | |
| Monolith control software. 2.1.33, pre-installed on the device | NanoTemper Technologies, Munich, Germany | ||
| MO.affinity analysis v2.1.1 | NanoTemper Technologies, Munich, Germany | ||
| Kaleidagraph 4.5.2 | Synergy Software |
References
- Linke, P., et al. An Automated Microscale Thermophoresis Screening Approach for Fragment-Based Lead Discovery. J Biomol Screen. 21 (4), 414-421 (2015).
- Jerabek-Willemsen, M., et al. MicroScale Thermophoresis: Interaction analysis and beyond. Journal of Molecular Structure. 1077, 101-113 (2014).
- Zillner, K., et al. Microscale thermophoresis as a sensitive method to quantify protein: nucleic acid interactions in solution. Methods Mol Biol. 815, 241-252 (2012).
- Zhang, W., Duhr, S., Baaske, P., Laue, E. Microscale thermophoresis for the assessment of nuclear protein-binding affinities. Methods Mol Biol. 1094, 269-276 (2014).
- Wienken, C. J., Baaske, P., Rothbauer, U., Braun, D., Duhr, S. Protein-binding assays in biological liquids using microscale thermophoresis. Nat Commun. 1, 100 (2010).
- Seidel, S. A., et al. Label-free microscale thermophoresis discriminates sites and affinity of protein-ligand binding. Angew Chem Int Ed Engl. 51 (42), 10656-10659 (2012).
- Seidel, S. A., et al. Microscale thermophoresis quantifies biomolecular interactions under previously challenging conditions. Methods. 59 (3), 301-315 (2013).
- Schubert, T., et al. Df31 protein and snoRNAs maintain accessible higher-order structures of chromatin. Mol Cell. 48 (3), 434-444 (2012).
- McKeague, M., Derosa, M. C. Challenges and opportunities for small molecule aptamer development. J Nucleic Acids. 2012, 748913 (2012).
- Ruscito, A., DeRosa, M. C. Small-Molecule Binding Aptamers: Selection Strategies, Characterization, and Applications. Front Chem. 4, 14 (2016).
- Chang, A. L., McKeague, M., Liang, J. C., Smolke, C. D. Kinetic and equilibrium binding characterization of aptamers to small molecules using a label-free, sensitive, and scalable platform. Anal Chem. 86 (7), 3273-3278 (2014).
- Chang, A. L., McKeague, M., Smolke, C. D. Facile characterization of aptamer kinetic and equilibrium binding properties using surface plasmon resonance. Methods Enzymol. 549, 451-466 (2014).
- Jing, M., Bowser, M. T. Methods for measuring aptamer-protein equilibria: a review. Anal Chim Acta. 686 (1-2), 9-18 (2011).
- Sokoloski, J. E., Dombrowski, S. E., Bevilacqua, P. C. Thermodynamics of ligand binding to a heterogeneous RNA population in the malachite green aptamer. Biochemistry. 51 (1), 565-572 (2012).
- Burnouf, D., et al. kinITC: a new method for obtaining joint thermodynamic and kinetic data by isothermal titration calorimetry. J Am Chem Soc. 134 (1), 559-565 (2012).
- Mannironi, C., Scerch, C., Fruscoloni, P., Tocchini-Valentini, G. P. Molecular recognition of amino acids by RNA aptamers: the evolution into an L-tyrosine binder of a dopamine-binding RNA motif. RNA. 6 (4), 520-527 (2000).
- Jenison, R. D., Gill, S. C., Pardi, A., Polisky, B. High-resolution molecular discrimination by RNA. Science. 263 (5152), 1425-1429 (1994).
- Huizenga, D. E., Szostak, J. W. A DNA aptamer that binds adenosine and ATP. Biochemistry. 34 (2), 656-665 (1995).
- Lee, E. R., Baker, J. L., Weinberg, Z., Sudarsan, N., Breaker, R. R. An allosteric self-splicing ribozyme triggered by a bacterial second messenger. Science. 329 (5993), 845-848 (2010).
- Wickiser, J. K., Cheah, M. T., Breaker, R. R., Crothers, D. M. The kinetics of ligand binding by an adenine-sensing riboswitch. Biochemistry. 44 (40), 13404-13414 (2005).
- Jucker, F. M., Phillips, R. M., McCallum, S. A., Pardi, A. Role of a heterogeneous free state in the formation of a specific RNA-theophylline complex. Biochemistry. 42 (9), 2560-2567 (2003).
- Zhao, Q., Lv, Q., Wang, H. Aptamer fluorescence anisotropy sensors for adenosine triphosphate by comprehensive screening tetramethylrhodamine labeled nucleotides. Biosens Bioelectron. 70, 188-193 (2015).
- Zhang, D., et al. A sensitive fluorescence anisotropy method for detection of lead (II) ion by a G-quadruplex-inducible DNA aptamer. Anal Chim Acta. 812, 161-167 (2014).
- Elenko, M. P., Szostak, J. W., van Oijen, A. M. Single-molecule imaging of an in vitro-evolved RNA aptamer reveals homogeneous ligand binding kinetics. J Am Chem Soc. 131 (29), 9866-9867 (2009).
- Elenko, M. P., Szostak, J. W., van Oijen, A. M. Single-molecule binding experiments on long time scales. Rev Sci Instrum. 81 (8), 083705 (2010).
- Zichel, R., Chearwae, W., Pandey, G. S., Golding, B., Sauna, Z. E. Aptamers as a sensitive tool to detect subtle modifications in therapeutic proteins. PLoS One. 7 (2), 31948 (2012).
- Baaske, P., Wienken, C. J., Reineck, P., Duhr, S., Braun, D. Optical thermophoresis for quantifying the buffer dependence of aptamer binding. Angew Chem Int Ed Engl. 49 (12), 2238-2241 (2010).
- Entzian, C., Schubert, T. Studying small molecule-aptamer interactions using MicroScale Thermophoresis (MST). Methods. 97, 27-34 (2016).
- Valenzano, S., et al. Screening and Identification of DNA Aptamers to Tyramine Using in Vitro Selection and High-Throughput Sequencing. ACS Comb Sci. 18 (6), 302-313 (2016).
- Jauset Rubio, M., et al. beta-Conglutin dual aptamers binding distinct aptatopes. Anal Bioanal Chem. 408 (3), 875-884 (2016).
- Breitsprecher, D., et al. Aptamer Binding Studies Using MicroScale Thermophoresis. Methods Mol Biol. 1380, 99-111 (2016).
- Stoltenburg, R., Schubert, T., Strehlitz, B. In vitro Selection and Interaction Studies of a DNA Aptamer Targeting Protein A. PLoS One. 10 (7), 0134403 (2015).
- Kinghorn, A. B., et al. Aptamer Affinity Maturation by Resampling and Microarray Selection. Anal Chem. 88 (14), 6981-6985 (2016).
- Duhr, S., Braun, D. Why molecules move along a temperature gradient. Proc Natl Acad Sci U S A. 103 (52), 19678-19682 (2006).
- Braun, D., Libchaber, A. Trapping of DNA by thermophoretic depletion and convection. Phys Rev Lett. 89 (18), 188103 (2002).
- Duhr, S., Arduini, S., Braun, D. Thermophoresis of DNA determined by microfluidic fluorescence. Eur Phys J E Soft Matter. 15 (3), 277-286 (2004).
- Jerabek-Willemsen, M., Wienken, C. J., Braun, D., Baaske, P., Duhr, S. Molecular interaction studies using microscale thermophoresis. Assay Drug Dev Technol. 9 (4), 342-353 (2011).
- He, K., Dragnea, V., Bauer, C. E. Adenylate Charge Regulates Sensor Kinase CheS3 To Control Cyst Formation in Rhodospirillum centenum. MBio. 6 (3), 00546 (2015).
- Brvar, M., et al. Structure-based discovery of substituted 4,5'-bithiazoles as novel DNA gyrase inhibitors. J Med Chem. 55 (14), 6413-6426 (2012).
- Pogorelcnik, B., et al. 4,6-Substituted-1,3,5-triazin-2(1H)-ones as monocyclic catalytic inhibitors of human DNA topoisomerase IIalpha targeting the ATP binding site. Bioorg Med Chem. 23 (15), 4218-4229 (2015).
- Jhaveri, S., Rajendran, M., Ellington, A. D. In vitro selection of signaling aptamers. Nat Biotechnol. 18 (12), 1293-1297 (2000).
- Khavrutskii, L., et al. Protein purification-free method of binding affinity determination by microscale thermophoresis. J Vis Exp. (78), (2013).
- Ramakrishnan, M., et al. Probing cocaine-antibody interactions in buffer and human serum. PLoS One. 7 (7), 40518 (2012).
- Chen, M., et al. Antiviral activity and interaction mechanisms study of novel glucopyranoside derivatives. Bioorg Med Chem Lett. 25 (18), 3840-3844 (2015).
- Wan, C., et al. Insights into the molecular recognition of the granuphilin C2A domain with PI(4,5)P2. Chem Phys Lipids. 186 (4,5), 61-67 (2015).
- Harazi, A., et al. The Interaction of UDP-N-Acetylglucosamine 2-Epimerase/N-Acetylmannosamine Kinase (GNE) and Alpha-Actinin 2 Is Altered in GNE Myopathy M743T Mutant. Mol Neurobiol. , (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved