Method Article
تحميل صبغ الكالسيوم إلى نهايات العصب الضفدع من خلال الجذع العصبي: تسجيل الكالسيوم العابر في الضفدع العصبي العضلي تقاطع
In This Article
Summary
هنا، نحن تصف طريقة لتحميل صبغة حساسة للكالسيوم من خلال الجذع العصب الضفدع في النهايات العصبية. كما نقدم بروتوكول لتسجيل وتحليل العابرين الكالسيوم سريع في النهايات العصبية الطرفية.
Abstract
واحدة من الطرق الأكثر جدوى لقياس مستويات الكالسيوم قبل المشبكي في محطات العصب بريسينابتيك هو التسجيل البصري. لأنه يقوم على استخدام الأصباغ الفلورية الحساسة الكالسيوم التي تغير شدة الانبعاثات أو الطول الموجي اعتمادا على تركيز الكالسيوم الحرة في الخلية. هناك العديد من الطرق المستخدمة لصبغ الخلايا مع أصباغ الكالسيوم. الأكثر شيوعا هي عمليات تحميل الأصباغ من خلال ميكروبيبيت أو قبل حضانة مع أشكال استر أسيتوكسيميثيل من الأصباغ. ومع ذلك، فإن هذه الأساليب لا تنطبق تماما على التقاطعات العصبية والعضلية (نمجس) بسبب القضايا المنهجية التي تنشأ. في هذه المقالة، نقدم طريقة لتحميل صبغة حساسة للكالسيوم من خلال الجذع العصب الضفدع العصب الضفدع في النهايات العصبية. منذ دخول الكالسيوم الخارجي في محطات العصب واللاحقة ملزمة لصبغة الكالسيوم تحدث داخل ميلي ثانية واحدة على نطاق و، فمن الضروري استخدام نظام التصوير السريع لتسجيل هذه التفاعلينانو ثانية. هنا، نحن تصف بروتوكول لتسجيل الكالسيوم عابرة مع كاميرا كسد سريعة.
Introduction
أيونات الكالسيوم (كا 2 + ) المشاركة في العديد من عمليات الإشارات العصبية، بما في ذلك بدء والصيانة، والمرونة من إطلاق سراح 1 ، 2 ، 3 ، 4 ، 5 . عند وصول إمكانات العمل، خارج الخلية كا 2 + يدخل محطة العصب ويبدأ الافراج العصبي. في بعض نقاط الاشتباك العصبي، يمكن قياس تيار الكالسيوم مباشرة بواسطة الطرق الكهربية 6 ، 7 ، 8 . في حالة تقاطع العصبية والعضلية (نمج)، لا يمكن للمرء أن استخدام المشبك التصحيح المباشر واثنين من القطب الكهربائي المشبك الجهد بسبب حجم دقيقة من النهايات العصبية.
تسجيلات كا 2 الداخل + التيارات من النهايات العصبية في نمج يمكن أن يتم عن طريق إلكتروفيس غير مباشرةطرق إيولوجية 9 ، 10 . ومع ذلك، فإن هذه الأساليب تتطلب المعالجة المسبقة من المشبك بواسطة الصوديوم والبوتاسيوم حاصرات قناة أيون. الطرق البصرية لا تتطلب الفصل الدوائي من التيارات الأيونية في محطة العصب وتسجيلات تسجيل كا 2 + تدفق، الناجمة عن إمكانات العمل، والارتفاع اللاحق من كا 2 + أيونات في الأكزوبلازم 11 ، 12 ، 13 ، 14 . وتستند هذه الأساليب على تسجيلات التغيرات في مضان محددة كا 2 + أصباغ حساسة على ملزمة خالية كا 2 + الأيونات 15 ، 16 ، 17 ، 18 ، 19 .
كا 2+ مؤشرات يمكن تحميلها في جمن خلال مجموعة متنوعة من الأساليب، اعتمادا على الغرض من التجربة. يستخدم الباحثون تطبيق حمام من أشكال صبغ غشاء نفاذية 20 ، 21 ، تحميل عبر ماصة التصحيح 22 ، أو ميكروينجكتيون 23 ، 24 ، 25 . ومع ذلك، كل هذه الأساليب لديها بعض القيود في حالة نمج بسبب خصوصياتها في الهندسة المعمارية متشابك. ل نمج، الأسلوب الأكثر ملاءمة وناجحة هو تحميل الصبغة من خلال الجذع العصب، وطريقة ملء الأمام 26 ، 27 ، 28 ، 29 . هذه التقنية يمكن استخدامها لتحميل الأصباغ مضان مختلفة في النهايات العصبية الطرفية. وقد استخدمت هذه الطريقة بنجاح لمحطات العصب ذبابة الفاكهة 28 ، العصب المحرك السحلية28 ، ومحطات العصب المحرك الضفدع 17 ، 26 ، 27 ، 30 . اعتمادا على الكائن قيد الدراسة، يمكن أن تختلف التفاصيل المنهجية. ويمكن استخدام ماصة الزجاج الصغيرة للأعصاب الصغيرة من اليرقات 28 . وقد وصف العديد من الباحثين طريقة 27 ، 28 التي يتم فيها مغمورة نهاية قطع حديثا من العصب تعصب العضلات في بئر مملوءة مسبقا مع صبغ. ثم يترك الإعداد لعدة ساعات لامتصاص الصبغة. يتم غارقة الصبغة حتى من قبل محاور عصبية ونقلها إلى محطات العصب. في هذه الورقة، ونحن تصف طريقة تحميل مؤشر مضان في محطات العصب المحرك الضفدع من خلال الجذع العصب. يستخدم بروتوكول لدينا طرف ماصة البلاستيك لحضانة الأنسجة مع صبغ. نحن أيضا وصف كيفية الحصول على تحليل كا 2 + مضان تراnsients.
Protocol
أجريت التجارب على الاستعدادات العصبية العضلية المعزولة للعضلات الجلدية العضلية من الضفدع رنا ريديبوندا . كان حجم الحيوانات من كلا الجنسين حوالي 5-9 سم. وقد أجريت الإجراءات التجريبية وفقا للمبادئ التوجيهية لاستخدام الحيوانات المختبرية من جامعة كازان الاتحادية وجامعة كازان الطبية، في الامتثال لدليل المعاهد الوطنية للصحة لرعاية واستخدام الحيوانات المختبرية. وقد استوفى البروتوكول التجريبي متطلبات توجيهات مجلس الاتحاد الأوروبي 86/609 / إيك وتمت الموافقة عليه من قبل اللجنة الأخلاقية لجامعة كازان الطبية.
1. إعداد الحلول
- إعداد حل رينغر.
- إعداد حل رينغر: 113.0 ملي كلوريد الصوديوم، 2.5 ملي بوكل، 3.0 ملي ناهكو 3 ، و 1.8 ملي كاكل 2 . ضبط درجة الحموضة إلى 7.2-7.4.
- إعداد حل رينغر مع انخفاض كا 2 + وارتفاع مغ 2+ المحتوى: 113.0 ملي كلوريد الصوديوم، 2.5 ملي بوكل، 3.0 ملي ناهكو 3 ، 6.0 ملي مغكل 2 ، 0.9 ملي كاكل 2 . ضبط درجة الحموضة إلى 7.2-7.4.
- إعداد حل الصبغة التحميل.
- إعداد الحل القائم على المياه التي تحتوي على هيبيس-نا في 10 ملم (الرقم الهيدروجيني 7.2-7.4).
- إضافة 14 ميكرولتر من الحل هيبيس إلى قارورة مع صبغ 30 .
ملاحظة: صبغ مؤشر كا 2 + يأتي في قارورة 500 ميكرولتر مع 500 ميكروغرام من مسحوق. - دوامة وتدور باستمرار إلى مزيج دقيق.
- تمييع الحل لتحقيق التركيز النهائي من مؤشر كا 2 + وصولا الى 30 ملم. تجنب التعرض للضوء ومخزن في -20 درجة مئوية.
2. صبغ التحميل الإجراء
- تشريح الجلد الصدرية العضلات مع قطعة من العصب الصدري بروبريوس .
ملاحظة: إجراء تشريح متاحفي تحميل مجاني للورقة من قبل بليوتش وآخرون. ، 1968 31 .- لإجراء تشريح، استخدم ملقط غرامة ومقص القرنية (انظر جدول المواد ). نقل الأنسجة تشريح في السيليكون المغلفة المطاط الصناعي طبق بتري قبل شغل الحل رينغر وإصلاح الأنسجة مع دبابيس الفولاذ المقاوم للصدأ غرامة بحيث يتم امتدت قليلا في الطبق.
- إعادة ملء طبق بتري مع قسامة جديدة من الحل رينغر ل. إزالة الأنسجة الضامة. لا تضر العصب.
- إعداد ماصة ملء: باستخدام شفرة حلاقة، وقطع قطعة ~ 2 ملم طويلة من الجزء المخروطية من البلاستيك القياسية 10 ميكرولتر ماصة طرف.
- إعداد قطعة من الطين النمذجة لتركيب ماصة ملء على طبق بتري.
- ربط الجزء الخلفي من ماصة ملء إلى حقنة بلاستيكية عن طريق أنابيب السيليكون والبلاستيك ربط محولات مصنوعة من نصائح ماصة.
- قبل دأنت تحميل الإجراء، وإزالة الحل رينغر من طبق بتري باستخدام ماصة بلاستيكية. تجفيف إعداد العضلات العصبية باستخدام حقنة غرامة. وهذا سيمنع التخفيف من كا 2 + صبغ على التحميل اللاحقة من ماصة التعبئة.
- إزالة قارورة مؤشر كا 2+ من الفريزر والسماح لها أن تذوب في درجة حرارة الغرفة في مكان مظلم.
- تحت السيطرة ستيريوميكروسكوب مع التكبير المنخفض (10 ×)، والكشف عن تقاطع بين العضلات والعصبية. مع ملاقط ومقص غرامة، وقطع العصب بروبريوس الصدرية قريبة من سطح العضلات (انظر الخطوة 2.1). ترك الجذع العصبي حوالي 2 مم طويلة.
- إصلاح ماصة ملء تعلق على الأنابيب والمحاقن على طبق بتري باستخدام النمذجة الطين.
- نقل غيض من إغلاق ماصة لجذع العصب.
- دون معسر، نضح بلطف الجذع العصب في غيض من ماصة ملء.
- إزالة أنابيب الشفط من بلونر نهاية ماصة التعبئة.
- إزالة بعناية الحل الزائد من ماصة ملء باستخدام حقنة مع إبرة طويلة (انظر جدول المواد ). لا قرصة الجذع العصب.
- عموديا رفع غيض من ماصة ملء قليلا، والحفاظ على جذع العصب يستنشق في الطرف.
- عزل الجزء يستنشق من الجذع العصب من الخارج من طرف ماصة ملء باستخدام هلام البترول.
- تجفيف جذع العصب معزول في ماصة ملء إذا لزم الأمر: نضح بلطف الزائدة من الحل من ماصة ملء باستخدام حقنة مع إبرة طويلة.
- رسم 0.5 ميكرولتر من محلول صبغ تحميل (انظر الخطوة 1) باستخدام ماصة مع طرف ماصة طويلة.
- إدراج بلطف غيض ماصة مع حل التحميل في ماصة التعبئة. إخراج الخليط مباشرة على الجذع العصب.
- ختم نهاية مفتوحة من ماصة ملء مع هلام البترول.
- إضافة قسامة صغيرة من قارع الأجراسحل إلى طبق بتري للحفاظ على إعداد الرطب.
- احتضان إعداد في درجة حرارة الغرفة تحت ظروف مظلمة ورطبة لمدة 5 ساعات.
- إزالة ماصة ملء مع حل التحميل، وشطف إعداد مع الحل رينغر، والحفاظ عليه بين عشية وضحاها في الثلاجة عند 8 درجة مئوية.
3. إعداد الأنسجة للمجهر
- جبل إعداد في السيليكون المطاط الصناعي المغلفة غرفة وإصلاحه مع الصلب الإبر الدقيقة بحيث يتم امتدت قليلا.
- شطف الأنسجة مع قسامة حل رينغر الطازجة.
- استخدام القطب شفط لتحفيز العصب. بناء القطب متاح من تحميل مجاني للورقة من قبل كازاكوف وآخرون. ، 2015 32 . وضع طرف القطب قريبة من نهاية قطع من العصب ونضح الجذع العصب في فتحة القطب.
- جبل غرفة إعداد على مرحلة المجهر. PLACه التحقيق في درجة الحرارة وإطلاق مداخل ومخرج في الغرفة.
- قم بتوصیل سلك الطاقة بعنصر بلتيير.
- ل سوبيرفوس إعداد، استخدام نظام يحركها الجاذبية بسيطة. لإزالة الحل الزائد، بدوره على مضخة شفط نضح.
- قم بتشغيل وحدة التحكم الحرارية.
- ضبط التحكم في درجة الحرارة إلى 20 درجة مئوية.
- جبل الدرع حماية الأشعة فوق البنفسجية.
- ربط القطب الكهربائي تحفيز إلى مشجعا الكهربائية ومراقبة تقلصات العضلات تحت المجهر مع عدسة الهدف 4x.
- ملء نظام نضح مع الحل رينغر مع منخفضة الكالسيوم 2+ وعالية مغ 2+ المحتوى.
ملاحظة: يستخدم هذا الحل لمنع تقلصات العضلات. انخفاض في تركيز الكالسيوم الخارجي وارتفاع من المغنيسيوم الخارجي نتيجة في الحد من اتساع كا 2+ العابرين.ومع ذلك، استنادا إلى الخبرة السابقة، 0.9 ملي كلوريد الصوديوم 2 و 6 ملي مغكل 2 لا تزال كافية لحل موثوق السعة كا 2 + العابرين. ومن الجدير بالذكر أن هناك بعض الطرق الأخرى لتقليل تقلصات العضلات دون الحد من تركيز الكالسيوم 2+ .على سبيل المثال، فإن استخدام د-توبوكورارين أو ألفا-بنغاروتوكسين، حاصرات محددة من مستقبلات أستيلين النيكوتين، وكتلة كليا أو جزئيا العضلات الشقوق 17 ، 27 ، 28 ، 30. ومع ذلك، فإن إضافة هذه السموم يمكن أن تؤثر أيضا على دخول الكالسيوم قبل المشبكي 33 . لتجنب هذا، μ-كونتوككسين جييا يمكن استخدامها 27 . - التبديل على مضخة والبدء في سوبيرفوسيون من إعداد مع الحل رينغر مع انخفاض كا 2 + وارتفاع مغ 2+ .
- التبديل إلى عدسة موضوعية 40 × على المجهر.
- قم بتشغيل t هو أحادي اللون (انظر جدول المواد ).
- حدد الطول الموجي الانبعاثات 488 نانومتر ووضع مستمر من الإضاءة في برنامج التحكم أحادي اللون.
- تحت التكبير عالية في وضع مضان، تأكد من أن المحطات العصبية تم تحميلها مع الصبغة.
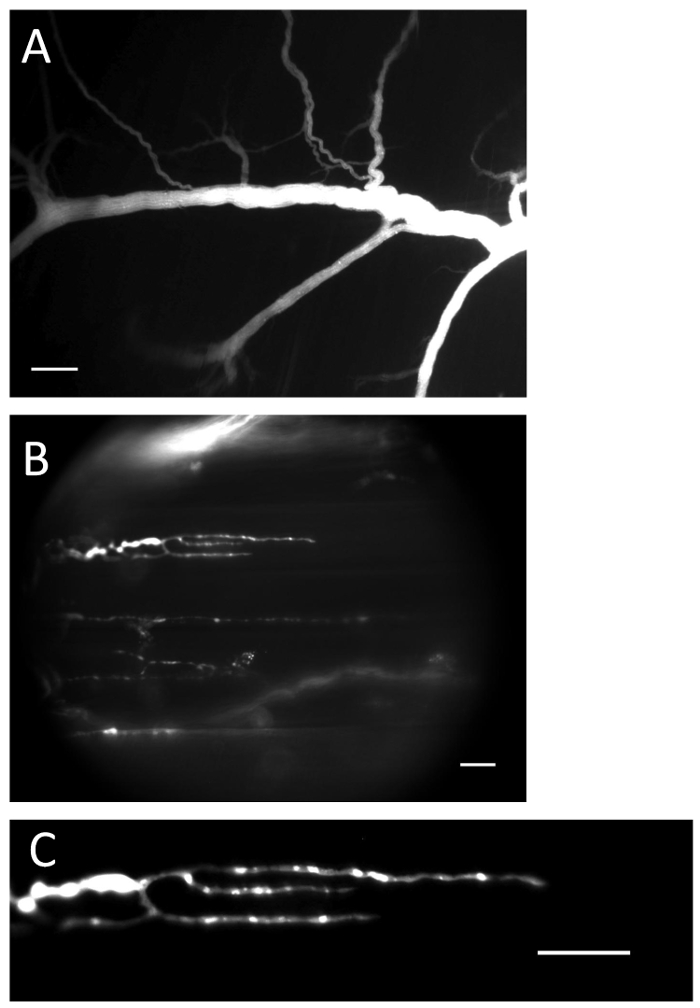
الشكل 1 : العصب ومحطات مع تحميل كا 2 + المؤشر. ( A ) العصبية مليئة كا 2 + مؤشر بعد إجراء التحميل. شريط مقياس = 200 ميكرون. ( ب ) النهايات العصبية مليئة كا 2 + المؤشر. شريط مقياس = 20 ميكرون. ( C ) كا 2 + -المعان مضان واضح للعيان في نهاية العصب. شريط مقياس = 20 ميكرون._blank "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- السماح للتحضير لتتوازن لمدة 30 دقيقة على الأقل في منخفض الكالسيوم 2+ وعالية مغ 2+ الحل.
4. التقاط الفيديو مع كاميرا كسد الرقمية
ملاحظة: تفاصيل التقاط إشارات مضان محددة لكل المجهر ونوع الكاميرا، ولكن الاعتبار الرئيسي هو سرعة التقاط الصور.
- استخدم خز 1 كحد أدنى لتكرار الالتقاط لتسجيلات عابرة كا 2+ في نمج.
ملاحظة: كاميرات كسد الرقمية السريعة ضرورية للتصوير مضان (انظر جدول المواد ). وقد تم استخدام نظام الحصول على البيانات والبرمجيات (انظر جدول المواد ) هنا لمزامنة الكاميرا، أحادي اللون، ومحفز. وباختصار، يسمح هذا البروتوكول توليد نبضات التزامن على النواتج الرقمية للبياناتونظام اكتساب لفتح مصراع الكاميرا، والتقاط إشارة الفيديو، والشروع في التحفيز. يمكن تعيين جميع المعلمات الزمنية في البروتوكولات و / أو على الأجهزة. والبروتوكول النموذجي عبارة عن سلسلة من 500 إطار تم الحصول عليها عند خز 1 (80 × 80 بكسل). الإضاءة مع الإثارة الضوء يمكن التبييض من مؤشر كا 2 + و فوتوداماج الأنسجة الخلية. وهكذا، تجنب التعرض الطويل للضوء الإثارة. في هذا البروتوكول، مصراع مفتوح فقط للوقت اللازم لالتقاط الفيديو. الحصول على سلسلة عشرين في محطة العصب محددة. والهدف هنا هو مراقبة نفس المواقع في المجموعة الضابطة وبعد تسليم الدواء. - تحت عدسة الهدف 4X من المجهر، واستخدام نظام حقل مشرق لتصور العضلات والأعصاب الفروع.
- التبديل إلى عدسة الهدف 40X، وذلك باستخدام نظام إبيفلورزنس وطول موجي الإثارة من 488 نانومتر، والبحث عن النهايات العصبية محملة صبغ. تحديد المنطقة التي تنتهي الأعصاب من الفائدة.
- على أنبوب ترينوكولار سو المجهر، حدد مستويات تبادل مسار الضوء: 100٪ ضوء للكاميرا.
- بدء برنامج اكتساب للكاميرا كسد.
- ضمن وضع "مباشر"، ابحث عن عائد الاستثمار وضبط التركيز.
- حدد القائمة "تغيير" الإعدادات.
- استخدام "التكوين الأساسي" في 1000 لقطة في الثانية (إطارا في الثانية)، مع دقة 80 × 80.
- تعيين عدد إطارات الإدخال إلى 500.
- أدخل اسم التجربة.
- اختر "الزناد الخارجي".
- تعيين وقت ما قبل الزناد إلى 10 مللي ثانية.
- تعيين عدد مرات التكرار إلى 20.
- في برنامج التحكم أحادي اللون، حدد الطول الموجي الانبعاثات من 488 نانومتر ووضع "الزناد الخارجية".
- تشغيل برنامج الحصول على البيانات.
- تحميل بروتوكول التحفيز.
- قبل تسجيل الفيديو، التقاط الإطار المظلم باستخدام برنامج اقتناء الفيديو.
- تشغيل بروتوكول التحفيز.
- حدد عائد الاستثمار والشيكk الإشارة المسجلة.
5. تحليل البيانات
ملاحظة: لتحليل البيانات، استخدم برنامج كاميرا كسد و إيماجيج. يتم تمثيل البيانات كمنحنى في برنامج جدول بيانات. في برنامج كاميرا كسد، متوسط 20 يكرر وتصدير النتائج إلى ملف دعم إيماجيج. في إيماجيج، حدد عائد الاستثمار والخلفية. اطرح الخلفية من عائد الاستثمار. تمثيل البيانات كنسبة: (ΔF / F 0 -1) × 100٪، حيث ΔF هو شدة مضان أثناء التحفيز و F 0 هو شدة مضان في الراحة.
- في برنامج اكتساب كاميرا كسد، انقر فوق ملف> متوسط الملفات. حدد الملفات ومتوسطها.
- احفظ الملف المتوسط كملف .fit بالنقر على "حفظ كملف صالح".
- تشغيل برنامج إيماجيج. قم بتنفيذ الخطوات التالية:
- انقر على الصورة> ضبط> السطوع / التباين.
- انقر على الصورة> الأكوام> الأدوات>. كومة الفرز.
- انقر على تحليل> أدوات> مدير عائد الاستثمار.
- سحب وإسقاط ملف .fit متوسط في إطار إيماجيج.
- يمكنك التكبير في النافذة للحصول على عرض أفضل.
- عن طريق تحريك المؤشر، حدد الإطار الأخير وحذفه (هذا هو الإطار المظلم)
- حدد عائد استثمار مستطيل فوق المنطقة التي يعتقد أنها الخلفية. أضفه إلى مدير عائد الاستثمار
- قم بقياس الخلفية بالنقر فوق المزيد> مولتي مياسور. لاحظ مين. انسخ البيانات وقم بتصديرها إلى برنامج جدول بيانات وحساب متوسط قيمة العتبة لنسبة.
- اطرح العتبة من الأكوام من خلال النقر على معالجة> الرئيسية> طرح. أدخل القيمة المتوسطة للعتبة.
- حدد عائد استثمار مستطيل حول محطة العصب. أضفه إلى مدير عائد الاستثمار.
- قياس عن طريق النقر فوق المزيد> قياس متعددة. لاحظ مين. نسخها وتصديرها إلى برنامج جدول بيانات.
- متوسط إزاحة الإشارات.
ملاحظة: استخدمأول عدة عشرات نقطة مما يدل على قاعدة صبغ مضان دون التحفيز. هذا هو مضان في الراحة. - تقسيم الإشارات عن طريق مضان في الراحة.
- طرح "1" وتضاعف بنسبة 100٪.
- مؤامرة إشارة وحساب السعة من كا 2 + عابرة.
النتائج
بعد تحميل الصبغة وعلى تحفيز العصب الحركي، ويمكن الكشف عن زيادة في السعة من إشارة الفلورسنت (كا 2 + عابرة) في محطات العصب (انظر الشكل 2 ). وترد في الجدول 1 معلمات كا 2+ العابرين. كميا، المعلمات من العابرين كا 2+ تقاس في دراستنا هي قريبة من البيانات التي تم الحصول عليها من قبل علماء آخرين في نقاط الاشتباك العصبي من الحيوانات ذات الدم البارد 15 ، 34 . المعلمات من كا 2+ العابرين تعتمد على معدل ملزمة من كا 2 + مع الصبغة والتفكك اللاحقة. معدل دخول كا 2+ في نهاية العصب، والتفاعل مع الصبغة، ونشرها في السيتوبلازم تؤثر جميعها على ارتفاع وقت الكالسيوم 2+ عابرة. وقت الاضمحلال من إشارة الفلورسنت يعتمد على تقارب الصبغة،وسرعة التفاعل كا 2 + مع المخازن داخل الخلايا، وإزالة بواسطة مضخات أيون 35 . تحليل السعة من كا 2+ العابرين يمكن استخدامها لدراسة تأثير المواد المختلفة على دخول الكالسيوم الذي يشارك في الافراج العصبي 33 .

الشكل 2 : متوسط كا 2 + عابرة تقاس في الضفدع نمج. تم حساب كا 2 + عابرة على أساس متوسط إشارات من 13 نمجس الضفدع. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
| قمةΔF / F (٪) | ارتفاع الوقت 20٪ -80٪ (مللي ثانية) | τ (مللي ثانية) |
| 12،6 ± 1،1 (ن = 13) | 4.6 ± 0.5 (ن = 13) | 115.3 ± 8.3 (ن = 13) |
الجدول 1: المتوسطات المتوسطة لكا 2+ العابرة. وتعرض البيانات على أنها متوسط ± سي؛ n هو عدد القياسات في نمجس متميزة. وتكون الذروة ΔF / F هي متوسط السعة ΔF / F.
Discussion
في هذه الورقة، قدمنا طريقة أداء كا 2 + -حساسية صبغ تحميل في الضفدع النهايات العصبية من خلال الجذع العصب. وبحلول نهاية إجراء التحميل، وجميع المحطات في الجزء القريب من العصب لديهم مستويات كبيرة من مضان. وقد قدر أن تركيز داخل محطة من التحقيق يختلف بين 40 و 150 ميكرومتر 17 .
يتم إجراء الحضانة في خطوتين: في درجة حرارة الغرفة ثم عند درجة حرارة أقل في الثلاجة. من المهم السيطرة على وقت حضانة الأنسجة مع الصبغة في درجة حرارة الغرفة. اعتمادا على الطول الفعلي للجذع العصب، صبغ معين، ودرجة الحرارة، قد تختلف فترة حضانة. إذا التعرض المفرط، والمحطات في الأجزاء القريبة على مقربة من الجذع العصب يمكن أن تكون مفرطة. ومع ذلك، في الجزء الأوسط من العصب، فإنه لا يزال من الممكن العثور على المحطات التي يتم تحميلها بشكل مرض. خلال ثه حضانة طويلة في الثلاجة، وتوزع الصبغة بالتساوي على النهايات العصبية.
ملاحظاتنا الخاصة 33 ، 35 ، فضلا عن البيانات من الباحثين الآخرين 30 ، تثبت عدم وجود أي تأثير ملموس من إجراءات التحميل على اتساع استجابة ما بعد المشبكي أو على وتيرة إمكانيات لوحة نهاية مصغرة. تم توثيق العمر الجيد في التحضيرات المحملة. هناك بعض النقاط الهامة التي نود لفت الانتباه إليها. فمن الضروري جدا لوضع الجذع العصب في محلول صبغ تحميل في غضون دقائق بعد الاستئصال لتمكين الصبغة للدخول في محاور عصبية قطع. والتأخير يمكن أن يسبب التحميل غير فعالة، ويفترض بسبب إعادة ختم المحاور العصبية 27 ، 36 . بعض المحققين تزج الجذع العصبي في 100 ملي إدتا (كا 2+ - و مغ 2 + -chelator) مباشرة بعد استئصال العصب لمنع محاور قطع من ختم. تتم إزالة المخزن المؤقت بعد 1-2 دقيقة واستبداله محلول صبغ تحميل 37 . استخدام البتروليوم هلام جيدا بدلا من الأنابيب البلاستيكية لإجراء التحميل يسمح استخدام أقصر العصب الجذع. أثناء استخدام هذا النهج، يتم قطع العصب بعد مغمورة في الحل هيبيس مع صبغ، والمحاور عصبية لا تختتم بسبب عدم وجود أيونات ثنائي التكافؤ في محلول صبغ 27 ، 28 .
في دراستنا، استخدمنا شكل الملح القابل للذوبان في الماء من مؤشر كا 2 + بدلا من ديكستران. ديكستران تقارن منتشر في محور عصبي أكثر ببطء من أشكال الملح. ومع ذلك، فإن استخدام مترافق ديكستران يقلل من صبغ المقصورة والمناولة من قبل العصب و نمجس. الكالسيوم الأخضر 1-3،000 ميغاواط ديكستران متقارن لديه معدل نشر جيد ويوضح انخفاض التقسيم أوب كلاس = "كريف"> 38.
من المهم جدا لتجنب فترة طويلة من الإضاءة الفلورسنت من الأنسجة، لأن هذا يؤثر على صحتها والبقاء على قيد الحياة. نحن نستخدم البصريات نومارسكي في قناة الضوء المرئي للبحث عن محطات العصب. خلال التسجيل، ونحن نحد من حقل مضيئة باستخدام الحجاب الحاجز.
ومن الجدير بالذكر أن طريقة التحميل هذه مناسبة فقط للاستعدادات التي يمكن أن تصمد أمام الحضانات الطويلة. لتقليل الوقت صبغ التحميل عندما تجري الدراسات على الأنسجة أكثر هشاشة (على سبيل المثال، نقاط الاشتباك العصبي من الحيوانات ذات الدم الحار)، فمن الضروري تقليص طول الجذع العصبي واستخدام ميكروبيبيتس لتحميل 29 ، 39 .
تقنية التحميل هذه مناسبة تماما للتغيرات التصوير في كا 2 عصاري خلوي، مع مؤشرات الفلورسنت تحت كل من التحفيز العصب واحد والنشاط متشابك الإيقاعيإف "> 17 ، 27 ، 35. يمكن استخدام تحليل السعة الكالسيوم 2+ -transient لدراسة تأثير المواد المختلفة على دخول الكالسيوم الذي يشارك في الإفراج العصبي 33 .
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
وقد أجري هذا البحث في إطار برنامج الحكومة الروسية للنمو التنافسي لجامعة كازان الاتحادية ومنحة من المؤسسة الروسية للبحوث الأساسية (16-04-01051؛ 16-34-00817؛ 15-04-02983). نشكر أربعة مراجعين مجهولين لتقديم تعليقات مفيدة على المسودات السابقة للمخطوطة. ونحن نعرب عن امتناننا ل يوليا أراتسكايا للتسجيل الصوتي. نحن ممتنون للدكتور فيكتور إليين على العديد من التعليقات المفيدة والمساعدة في تحرير النهائي للمخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| Ca2+ indicator | Molecular Probes, USA | Oregon Green 488 BAPTA-1 hexapotassium salt, O6806 | 500 μg |
| Silicone Elastomer | Dow Corning, USA | Sylgard 184 elastomer | |
| Pipette | Biohit, Russia | 720210 | 0.5-10µL |
| Pipette tip | Fisher Scientific, USA | 02-707-175 | 10µL |
| Pipette tip | Biohit, Russia | 781349 | 10µL |
| Razor Blade | Fisher Scientific, USA | 12-640 | |
| Minutien Pins | Fine scince tools, Canada | 26002-20 | |
| Corneal Mini-Scissors | MT MEDI CORP, Canada | S-1111 | |
| Jeweler Forceps | MT MEDI CORP, Canada | F-9610 | |
| Jeweler Forceps | MT MEDI CORP, Canada | F-9611 | |
| Modelling clay | local producer | can be replaced by any local producer | |
| Petroleum jelly | local producer | can be replaced by any local producer | |
| Microspin FV 2400 | Biosan, Latva | BS-010201-AAA | |
| Multi-spin MSC 3000 | Biosan, Latva | BS-010205-AAN | |
| Single-use hypodermic needles | Bbraun | 100 Sterican | 0.4×40mm |
| Syrynge | local producer | 0.5 ml | |
| HEPES | Sigma-Aldrich, USA | H0887 | 100ml |
| Microscope, BX51 | Olympus, Japan | ||
| Data acquisition system | Molecular Devices, USA | Digitdata 1550 | |
| software | Molecular Devices, USA | pClamp software, Version 10 | protocol can be download from : http://kpfu.ru/portal/docs/F_230007060/Video.capture.with. RedShirt.Neuro.CCD.camera.pro |
| Bath and bath temperature controler | Experimental Builder | can be replaced by any chamber with temperature control. For example from https://www.warneronline.com/ | |
| Monochromator | Till Photonics, Germany | Polychrome V | no longer available, can be replaced by other sutable stable light source 488 nm |
| monochromator control software | Till Photonics, Germany | Polycon | |
| Digital CCD camera | Redshirt imaging, USA | Neuro CCD SMQ | |
| Model 2100 Isolated Pulse Stimulator | A-M Systems, USA | ||
| Acquisition software for CCD camera | Redshirt imaging, USA | Turbo SM software | |
| ImageJ | National Institutes of Health, USA | http://rsb.info.nih.gov/ij/download.html | |
| Spreadsheet program | Microsoft, USA | Microsoft Office Excel |
References
- Llinás, R., Sugimori, M., Silver, R. B. Microdomains of high calcium concentration in a presynaptic terminal. Science. 256, 677-679 (1992).
- Augustine, G. J. How does calcium trigger neurotransmitter release?. Curr Opin Neurobiol. 11, 320-326 (2001).
- Burnashev, N., Rozov, A. Presynaptic Ca2+ dynamics, Ca2+ buffers and synaptic efficacy. Cell Calcium. 37, 489-495 (2005).
- Schneggenburger, R., Neher, E. Presynaptic calcium and control of vesicle fusion. Curr Opin Neurobiol. 15, 266-274 (2005).
- Pang, Z. P., Südhof, T. C. Cell biology of Ca2+-triggered exocytosis. Curr Opin Cell Biol. 22, 496-505 (2010).
- Borst, J. G., Sakmann, B. Calcium influx and transmitter release in a fast CNS synapse. Nature. 383, 431-434 (1996).
- Borst, J. G., Sakmann, B. Calcium current during a single action potential in a large presynaptic terminal of the rat brainstem. J Physiol. 506, 143-157 (1998).
- Yazejian, B., DiGregorio, D. A., Vergara, J. L., Poage, R. E., Meriney, S. D., Grinnell, A. D. Direct measurements of presynaptic calcium and calcium-activated potassium currents regulating neurotransmitter release at cultured Xenopus nerve-muscle synapses. J Neurosci. 17, 2990-3001 (1997).
- Molgó, J., Mallart, A. Effects of Anemonia sulcatatoxin II on presynaptic currents and evoked transmitter release at neuromuscular junctions of the mouse. Pflugers Arch. 405 (4), 349-353 (1985).
- Slutsky, I., Rashkovan, G., Parnas, H., Parnas, I. Ca2+-independent feedback inhibition of acetylcholine release in frog neuromuscular junction. J Neurosci. 22 (9), 3426-3433 (2002).
- Haugland, R. P., Gregory, J. Indicators for Ca2+, Mg2+, Zn2+ and other metal ions. Handbook of fluorescent probes and research products. , 771-826 (2002).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Tsien, R. Y. Fluorescent indicators of ion concentrations. Methods Cell Biol. 30, 127-156 (1989).
- Adams, S. R. How calcium indicators work. Cold Spring Harb Protoc. 2010 (3), (2010).
- DiGregorio, D. A., Vergara, J. L. Localized detection of action potential-induced presynaptic calcium transients at a Xenopus neuromuscular junction. J Physiol. 505, 585-592 (1997).
- Sabatini, B. L., Regehr, W. G. Optical measurement of presynaptic calcium currents. Biophys J. 74, 1549-1563 (1998).
- Suzuki, S. Ca2+ dynamics at the frog motor nerve terminal. Pflug Arch Eur J Phisiol. 440, 351-365 (2000).
- Sabatini, B. L., Oertner, T. G., Svoboda, K. The life cycle of Ca2+ ions in dendritic spines. Neuron. 33, 439-452 (2002).
- Luo, F., Dittrich, M., Stiles, J. R., Meriney, S. D. Single-pixel optical fluctuation analysis of calcium channel function in active zones of motor nerve terminals. J Neurosci. 31, 11268-11281 (2011).
- Regehr, W. G., Yuste, R., Konnerth, A. Monitoring presynaptic calcium dynamics with membrane-permeant indicators. Imaging in neuroscience and development: a laboratory manual. , 307-314 (2005).
- Macleod, G. T. Topical Application of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction. Cold Spring Harb Protoc. 2012 (7), 786-790 (2012).
- Eilers, J., Konnerth, A. Dye loading with Patch Pipettes. Cold Spring Harb Protoc. 2009 (4), 277-281 (2009).
- Coleman, W. L., Bill, C. A., Simsek-Duran, F., Lonart, G., Samigullin, D., Bykhovskaia, M. Synapsin II and calcium regulate vesicle docking and the cross-talk between vesicle pools at the mouse motor terminals. J Physiol. 586 (19), 4649-4673 (2008).
- Macleod, G. T. Direct Injection of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction. Cold Spring Harb Protoc. 2012 (7), 797-801 (2012).
- Talbot, J. D., David, G., Barrett, E. F., Barrett, J. N. Calcium dependence of damage to mouse motor nerve terminals following oxygen/glucose deprivation. Exp Neurol. 234 (1), 95-104 (2012).
- Peng, Y. Y., Zucker, R. S. Release of LHRH is linearly related to the time integral of presynaptic Ca2+ elevation above a threshold level in bullfrog sympathetic ganglia. Neuron. 10, 465-473 (1993).
- Tsang, C. W., Elrick, D. B., Charlton, M. P. alpha-Latrotoxin releases calcium in frog motor nerve terminals. J Neurosci. 20 (23), 8685-8692 (2000).
- Newman, Z., Malik, P., Wu, T. Y., Ochoa, C., Watsa, N., Lindgren, C. Endocannabinoids mediate muscarine-induced synaptic depression at the vertebrate neuromuscular junction. Eur J Neurosci. 25 (6), 1619-1630 (2007).
- Macleod, G. T. Forward-filling of dextran-conjugated indicators for calcium imaging at the drosophila larval neuromuscular junction. Cold Spring Harb Protoc. 2012 (7), 3440-3450 (2012).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Blioch, Z. L., Glagoleva, I. M., Liberman, E. A., Nenashev, V. A. A study of the mechanism of quantal transmitter release at a chemical synapse. J Physiol. (1), 11-35 (1968).
- Kazakov, A., Aleksandrov, M., Zhilyakov, N. V., Khaziev, E. F., Samigullin, D. V. A simple suction electrode for electrical stimulation of biological objects. Mezhdunarodnyj nauchno-issledovatel'skij zhurnal. 40 (9), 13-16 (2015).
- Khaziev, E. Acetylcholine-induced inhibition of presynaptic calcium signals and transmitter release in the frog neuromuscular junction. Front Physiol. 7 (621), 1-10 (2016).
- Bélair, E. L., Vallée, J., Robitaille, R. Long-term in vivo modulation of synaptic efficacy at the neuromuscular junction of Rana pipiens frogs. J Physiol. 569 (1), 163-178 (2005).
- Samigullin, D., Fatikhov, N., Khaziev, E., Skorinkin, A., Nikolsky, E., Bukharaeva, E. Estimation of presynaptic calcium currents and endogenous calcium buffers at the frog neuromuscular junction with two different calcium fluorescent dyes. Front Synaptic Neurosci. 6 (29), 1-10 (2015).
- Angleson, J. K., Betz, W. J. Intraterminal Ca2+ and spontaneous transmitter release at the frog neuromuscular junction. J Neurophysiol. 85 (1), 287-294 (2001).
- Shahrezaei, V., Cao, A., Delaney, K. R. Ca2+ from one or two channels controls fusion of a single vesicle at the frog neuromuscular junction. J Neurosci. 26 (51), 13240-132499 (2006).
- Troncone, L. R., et al. Promiscuous and reversible blocker of presynaptic calcium channels in frog and crayfish neuromuscular junctions from Phoneutria nigriventer spider venom. J Neurophysiol. 90 (5), 3529-3537 (2003).
- Samigullin, D. V., Khaziev, E. F., Zhilyakov, N. V., Sudakov, I. A., Bukharaeva, E. A., Nikolsky, E. E. Calcium transient registration in response to single stimulation and during train of pulses in mouse neuromuscular junction. BioNanoSci. 7 (1), 162-166 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved