Method Article
القصبات الغسل من الفئران الرئتين لتحليل التهاب تسلل خلية
In This Article
Summary
وينعكس الوضع الصحي للرئة عن طريق نوع وعدد الخلايا المناعية الموجودة في القصبات الرئوية. نحن تصف تقنية غسل القصبات التي تسمح العزلة ودراسة الخلايا غير متماثلة والعوامل القابلة للذوبان من الجهاز التنفسي السفلي من الفئران.
Abstract
القصبات القصبي (بال) هو إجراء تجريبي يستخدم لدراسة المحتوى الخلوي والخلوي من التجويف الرئة السابقين الجسم الحي للحصول على نظرة ثاقبة حالة المرض الجارية.
هنا، وصفت طريقة بسيطة وفعالة لأداء بال على الرئتين الفئران دون الحاجة إلى أدوات خاصة أو المعدات. يتم عزل السائل بال عن طريق إدخال قسطرة في القصبة الهوائية من الفئران تخدير انتهائية، من خلالها يتم غرس محلول ملحي في القصيبات. يتم سحب السائل الغرس بلطف لتعظيم استرجاع السوائل بال وتقليل قوى القص. هذه التقنية تسمح بقاء، وظيفة، وهيكل الخلايا داخل الشعب الهوائية والسوائل بال للحفاظ عليها.
ويمكن تطبيق العديد من التقنيات للحصول على مزيد من الفهم لحالة المرض من الرئة. هنا، تقنية شائعة الاستخدام لتحديد وتعداد أنواع مختلفة من الخلايا المناعية هووصفها، حيث التدفق الخلوي وجنبا إلى جنب مع لوحة مختارة من علامات محددة سطح الخلية fluorescently المسمى. ويمكن أيضا إجراء BAL المعروضة هنا أن تستخدم لتحليل العوامل المعدية، مكونات السوائل، أو الجسيمات المستنشقة داخل الرئتين الفئران.
Introduction
تواجه الشعب الهوائية العديد من الشتائم، والتي يمكن أن تؤدي إلى التهاب، غزو الممرض، أو التحول الخبيث. الخلايا الظهارية التي تشكل خط التجويف الرئة تشكل واحدة من الحواجز الرئيسية للجسم الثدييات. جنبا إلى جنب مع البلاعم السنخية، فإنها تمنع التهديدات البيئية من الدخول إلى النظام النظامي عبر الشعب الهوائية. ومن أمثلة هذه التهديدات المواد الكيميائية العضوية وغير العضوية، والبكتيريا، والفيروسات. وبالمثل، يمكن تصميم التحصينات أو التدخلات العلاجية المحددة لاستهداف الرئتين. في جميع هذه الحالات، تحليل مفصل للاستجابة أثار مهم لفهم، التدخل، أو منع العمليات البيولوجية التي تحدث داخل الجهاز التنفسي.
غسل القصبات (بال) هو وسيلة لا تقدر بثمن لتحليل هذه الردود، حيث أن العينات الناتجة تحتوي على معلومات هامة حول الاستجابات الالتهابية، وآليات المناعة، وتطور الأمراض المعديةالتي يمكن أن تحدث في الشعب الهوائية الرئوية 1 و 2. باستخدام BAL، فمن الممكن لدراسة الخلايا التسلل. وهذا يتناقض مع الرئتين هضمها، التي تعطي "أقذر" سكان الخلية، مع العديد من الخلايا الميتة ولزجة. يتم تنفيذ BAL عن طريق إدخال محلول ملحي في القصيبات الطرفية وبعد ذلك يتعافى هذا الحل. ويمكن بعد ذلك حل استردادها أن تستخدم لتحديد وتحليل ظاهريا الرئة المقيمين وتسلل الخلايا الالتهابية. في كثير من الأحيان يتم تطبيق هذا الأسلوب لدراسة تدفق الخلوي في نماذج المرض في الشعب الهوائية، مثل الربو ومرض الرئة الانسدادي المزمن (COPD)، ونماذج الأمراض المعدية. وبصرف النظر عن تكوين الخلايا، وينعكس التركيب الجزيئي في الشعب الهوائية الرئوية أيضا في السائل BAL. لتحليل هذا، انزيم مرتبط المناعي فحص (ELISA)، مناعية، والتحليل في وقت واحد من السيتوكينات متعددة من قبل مجموعة خلوى حبة يمكن أن يكونأجريت لتقييم وجود السيتوكينات و تشيموكينس.
بال هو طريقة راسخة لدراسة تدفق الخلايا الالتهابية في نماذج التهابات أمراض الجهاز التنفسي الحيوانية. مراقبة تدفق الخلوي تغير (على سبيل المثال، زيادة مستويات الخلايا الليمفاوية، الحمضات، أو العدلات) يمكن أن يؤدي إلى رؤى أفضل في المرض ويمكن أن يكون معلما موضوعيا لتقييم أداء التدخل العلاجي.
يتطلب تفسير دقيقة وقابلة للتكرار للتحليل الخلوي بال أن يتم تنفيذ بال بشكل صحيح وأنه يتم التعامل مع السوائل التي تم جمعها ومعالجتها بشكل صحيح. مصطلح "غسل الشعب الهوائية" قدم أكثر من ثمانين عاما من قبل ستيت 3 . في عام 1961، حصل ميرفيك الضامة السنخية من السائل غسل أرنب الرئتين 3 . بال هو الآن طريقة شائعة الاستخدام لتحليل ورصد الرئتين في نموذج الفأر، ولكنإعادة لا يزال لا يوجد تقرير عن إجراء بال موحدة في الأدب العلمي 4 ، 5 . وعلاوة على ذلك، هناك على الأرجح العديد من الطرق لأداء بال كما أن هناك مختبرات البحوث باستخدام تقنية 3 ، 6 ، 7 ، 8 ، 9 ، 10 ، 11 . من المهم أن البيانات التي تم الحصول عليها من بال تمثل الرئة الفئران كله، وليس فقط جزءا من الرئة. هذا النوع من التباين يعقد تفسير ومقارنة النتائج بين التجارب المختلفة.
هنا، وصفت الإجراء الأساسي وغير مكلفة، وقابلة للتكرار بال الذي يسمح جمع جزء الخلوية وقابل للذوبان الموجودة في تجويف مجرى الهواء من الفأرة. باختصار، يتم وضع قسطرة في القصبة الهوائية المكشوفة oفا تخدير الماوس مؤقتا. يتم توصيل المحاقن إلى القسطرة، ويتم إدخال محلول ملحي مخزنة تحتوي على حمض إيثيلينديامينتيتراسيتيك (إدتا) في الرئتين. يتم أخذ عينات تجويف الرئة عن طريق التنظيف المتكرر اللطيف من محلول ملحي باستخدام المكبس. الضغط السلبي المطبق خلال هذه الخطوة هو الحد الأدنى لمنع انهيار مجرى الهواء. بعد جمع، يجب أن تتم معالجتها بال مزيد من التعداد وتحديد الخلايا عن طريق التدفق الخلوي.
Protocol
وأجريت جميع التجارب على الحيوانات وصفها في هذه الدراسة وفقا ل(القانون البلجيكي 14/08/1986 و22/12/2003، البلجيكي المرسوم الملكي 06/04/2010) الوطني والتشريعات الأوروبية (توجيهات الاتحاد الأوروبي 2010/63 / EU و 86 / 609 / EEC). تمت الموافقة على جميع التجارب على الفئران وجميع البروتوكولات الحيوان من قبل لجنة الأخلاق من جامعة غنت (أرقام تصريح LA1400091 وEC2016-027).
1. إعداد
- غسل السائل
- إعداد محلول ملحي متوازن مع 100 ميكرومتر ثنائي أمين الإيثيلين رباعي حمض الخل (EDTA).
ملاحظة: لقياس مستويات البروتين في السائل BAL، فمن المستحسن أن إضافة مثبطات الأنزيم البروتيني لمنع نشاط الأنزيم البروتيني في السائل BAL.
- إعداد محلول ملحي متوازن مع 100 ميكرومتر ثنائي أمين الإيثيلين رباعي حمض الخل (EDTA).
- القسطرة
- جعل القسطرة عن طريق إدخال إبرة 23 G إلى شفاف البولي ايثيلين البلاستيكية 21 G أنابيب (القطر الداخلي: 0.58 ملم، القطر الخارجي: 0،965 ملم، وطول: 0.5 سم). ويمكن أيضا القسطرة ولم يضف استخدامها.
- Anesthetics
- إعداد مخدر المحطة، ويفضل واحد أن يسبب توقف التنفس (على سبيل المثال، والباربيتورات مثل بنتوباربيتال الصوديوم (> 100 ملغ / كلغ) حل في الفوسفات مخزنة المالحة (PBS)).
ملاحظة: من المستحسن استخدام التخدير حقن بدلا من التخدير عن طريق الاستنشاق، كما قد يكون التخدير استنشاق تأثير على محتوى السوائل بال. CO 2، على سبيل المثال لديها تأثير على درجة حموضة الدم وبالتالي على إعادة توزيع مركبات مختلفة (12).
- إعداد مخدر المحطة، ويفضل واحد أن يسبب توقف التنفس (على سبيل المثال، والباربيتورات مثل بنتوباربيتال الصوديوم (> 100 ملغ / كلغ) حل في الفوسفات مخزنة المالحة (PBS)).
- الأمونيوم كلوريد البوتاسيوم (ACK) الدم الحمراء عازلة خلية تحلل
- إعداد العازلة تحلل ACK بحل 8.29 غرام من NH 4 الكلور و 1 غرام من KHCO 3 في 1 L من H 2 O مع 100 ميكرومتر EDTA. ويمكن أيضا أن تحلل العازلة خلايا الدم الحمراء يمكن شراؤها من مصدر خارجي.
2. المسرحية والقصبات الغسل (BAL)
- إدخال قسطرة في القصبة الهوائية
- الموت ببطء الماوس عن طريق الحقن داخل الصفاق من جرعة قاتلة من المخدر قصير المفعول باربيتورات باستخدام إبرة 26 G. لتأكيد التخدير المميت السليم، قرصة مخلب الخلفي من الفأر مع ملقط للتحقق من رد الفعل القدم.
- وضع الحيوان على ظهره على لوحة الجراحية وإصلاح الماوس عن طريق تعلق أسفل أطرافه.
- رش 70٪ من الإيثانول على الرقبة لتطهير. إجراء شق في الجلد الرقبة بالقرب من القصبة الهوائية باستخدام مشرط.
- فتح الجلد لفضح الغدد اللعابية. فصل الغدد اللعابية باستخدام الدبابيس لفضح العضلات القصية اللامية. شق العضلات حول القصبة الهوائية باستخدام الكماشات لفضح القصبة الهوائية.
- وضع خيط القطن تحت القصبة الهوائية باستخدام الدبابيس.
- ثقب بعناية منتصف القصبة الهوائية يتعرض بين اثنين من حلقات الغضروف مع إبرة 26 G. الحرص على عدم إلحاق الضرر القصبة الهوائية أي أبعد من ذلك.
- إدراج القسطرة حوالي 0.5 سم في القصبة الهوائية. تأكد من أن كاثلم يتم إدخال تر بعيدا جدا إلى أسفل القصبة الهوائية، وهذا يمكن أن يؤدي إلى تلف بنية الرئة.
- استقرار القسطرة عن طريق ربط القصبة الهوائية حول القسطرة باستخدام موضوع القطن وضعت في الخطوة 2.1.5. إذا لم يتم ربط القسطرة بما فيه الكفاية، قد يتدفق محلول الملح المتوازن حقن نحو الجزء العلوي من الجهاز التنفسي بدلا من أسفل إلى الرئتين.
- جمع السائل غسل
- تحميل حقنة 1 مل مع 1 مل من محلول ملح متوازن العقيمة مع 100 ميكرومتر إدتا.
- ربط حقنة 1 مل إلى القسطرة وحقن بلطف الملح / إدتا الحل في الرئة.
- نضح الحل بلطف أثناء تدليك الصدر من الماوس. إذا كان السائل نضح غير مرئية في حقنة، وإدراج بعناية القسطرة قليلا مزيد من أسفل أو حتى القصبة الهوائية.
- إزالة الحقنة من الإبرة ونقل السوائل غسل استردادها في أنبوب 15 مل وضعت على الجليد. عادة، 700 - 900 &يتم استرداد L من BAL من 1 مل من محلول حقن، رقم 181.
- كرر الخطوات من 2.2.1 - 2.2.4 مرتين أكثر من ذلك.
ملاحظة: إذا كان الغرض هو تحليل محتوى غير الخلوية، فمن المستحسن أن تركيز العينات المجمعة عندما تكون هناك مشاكل مع حساسية.
3. جمع مكونات الخلوية وNoncellular من السائل BAL
- أجهزة الطرد المركزي السائل غسيل لمدة 7 دقائق في 400 x ج و 4 ° C.
- جمع طاف وعلى الفور استخدامها لمزيد من التحليل (على سبيل المثال، ELISA) أو تجميد في -80 ° C. الحفاظ على بيليه خلية لتحليل تدفق الخلوي في الرئتين.
- إعادة تعليق بيليه الخلية في 200 ميكرولتر من ACK عازلة الناشر.
ملاحظة: هذه الخطوة يضمن تحلل كريات الدم الحمراء مع الحفاظ على خلايا الدم البيضاء سليمة. - احتضان لمدة 2 دقيقة في RT.
ملاحظة: لتقليل التفاوت الناجم عن تحلل خلايا الدم الحمراء، لا ينبغي أن يتم تنفيذ هذه الخطوة لمدة أطول من مدة 2 دقيقة. - إضافة 1 مل من برنامج تلفزيوني الباردة لتخفيف العازلة أك ليسينغ.
- أجهزة الطرد المركزي لمدة 7 دقائق في 400 x ج و 4 درجة مئوية. تجاهل طاف وإعادة تعليق الخلايا في حجم كاف من برنامج تلفزيوني لتحليل المصب (انظر أدناه).
ملاحظة: حجم برنامج تلفزيوني يعتمد على الدراسة المصب التي سيتم تنفيذها.
4. تحليل أنواع الخلايا المختلفة في السائل بال بواسطة التدفق الخلوي
ملاحظة: احتمال واحد هو تحليل التكوين الخلوي المطلق والنسبي للسوائل بال من خلال إجراء التدفق الخلوي. والهدف من هذه الورقة هو وضع تقنية بال. التدفق الخلوي هو تقنية متخصصة من تلقاء نفسها. فمن المستحسن أن يقرأ أوراق متخصصة عن تقنية التدفق الخلوي 13 ، 14 ، 15 ، 16 ، 17 . الأجسام المضادة إلى جانب فلورفور tقبعة تعترف المستضدات السطحية (انظر الجدول 1) محددة لنوع خلية معينة (ق) يتم استخدامها. باستخدام استراتيجية النابضة، فمن الممكن لتحديد الخلايا T، الضامة، والخلايا الجذعية، والخلايا B، الحمضات، والعدلات في جزء الخلية من BAL.
| مولد المضاد | نوع من الخلايا |
| مجموعة من التمايز 3 (CD3) | وأعرب عن خلايا T |
| مجموعة من 11C التمايز (CD11c و) | التعبير عالية على معظم الخلايا الجذعية، ولكن أيضا على حيدات، الضامة، العدلات، وبعض خلايا B. |
| مجموعة من 11B التمايز (CD11b) | وأعرب على سطح العديد من الكريات البيض بما في ذلك حيدات، العدلات، الخلايا القاتلة الطبيعية، والمحببة والضامة. |
| SiglecF | االضامة السنخية والحمضات. |
| MHCII | وجدت عادة فقط على الخلايا المستضد تقديم مثل الخلايا الجذعية، البالعات وحيدات النوى والخلايا البائية. |
| CD19 | مستضد اللمفاويات B |
| لاي-6G | علامة للوحيدات، المحببة والعدلات |
الجدول 1: اختيار المستضدات سطح الخلية المناعية. يوفر هذا الجدول قائمة من الحواتم السطحية المستخدمة لتوصيف أنواع الخلايا المختلفة. وستكون هناك حاجة إلى توليفات من عدة علامات لتحديد نوع خلية معين بشكل موثوق.
| عينات | ||||
| الة النفخ | فلوريوفور أنتيجن-ليتم إضافتها إلى الخلايا | تركيز الأوراق المالية الأجسام المضادة (ملغ / مل) | تخفيف الأجسام المضادة | إجمالي حجم (ميكرولتر) |
| قابلة للصياغة قابلية للتثبيت | 0.2 | 1/1000 | 50 | |
| CD11c و | 0.2 | 1/800 | 50 | |
| SiglecF | 0.2 | 1/100 | 50 | |
| عينة X | MHCII | 0.2 | 1/200 | 50 |
| CD3 | 0.2 | 1/200 | 50 | |
| CD19 | 0.2 | 1/200 | 50 | |
| CD11b | 0.2 | 1/200 | 50 | |
| Ly6G | 0.2 | 1/200 | 50 | |
| ضوابط الجهد | ||||
| الة النفخ | فلوريوفور أنتيجن-ليتم إضافتها إلى الخلايا | تركيز الأوراق المالية الأجسام المضادة (ملغ / مل) | تخفيف الأجسام المضادة | إجمالي حجم (ميكرولتر) |
| خلايا غير ملوثين | / | / | / | 50 |
| خلايا ملطخة واحدة | قابلة للصياغة قابلية للتثبيت | 0.2 | 1/1000 | 50 |
| خلايا ملطخة واحدة | CD11c و | 0.2 | 1/800 | 50 |
| خلايا ملطخة واحدة | SiglecF | 0.2 | 1/100 | 50 |
| خلايا ملطخة واحدة | MHCII | 0.2 | 1/200 | 50 |
| خلايا ملطخة واحدة | CD3 | 00.2 | 1/200 | 50 |
| الخلايا الملون واحدة | CD19 | 0.2 | 1/200 | 50 |
| الخلايا الملون واحدة | CD11b | 0.2 | 1/200 | 50 |
| الخلايا الملون واحدة | Ly6G | 0.2 | 1/200 | 50 |
| ضوابط التعويض | ||||
| الة النفخ | مستضد fluorophore تضاف إلى الخرز | تركيز الأسهم الأجسام المضادة (ملغ / مل) | تخفيف الأجسام المضادة | اجمالى حجم (ميكرولتر) |
| حبات غير ملوثين | / | / | / | 200 |
| الخرز الملون واحدة | CD11c و | 0.2 | 1/2000 | 200 |
| الخرز الملون واحد | SiglecF | 0.2 | 1/2000 | 200 |
| الخرز الملون واحد | MHCII | 0.2 | 1/200 | 200 |
| الخرز الملون واحد | CD3 | 0.2 | 1/2000 | 200 |
| الخرز الملون واحد | CD19 | 0.2 | 1/2000 | 200 |
| الخرز الملون واحد | CD11b | 0.2 | 1/400 | 200 |
| الخرز الملون واحد | Ly6G | 0.2 | 1/200 | 200 |
الجدول 2. قائمة الضوابط الواجب تضمينها. ويبين هذا الجدول جميع الضوابط اللازمة للتفسير الدقيق للنتائج التي تم الحصول عليها.
- تلطيخ سطح الخلية
ملاحظة: فمن إمبورتانت لتشمل جميع الضوابط الحاسمة لتحليل التدفق الخلوي. وهناك حاجة إلى ثلاث مجموعات من الأنابيب (انظر الجدول 2 ): (1) أنابيب تحتوي على العينات؛ (2) أنابيب مع خلايا بال لكل الأجسام المضادة فلورفور لجعل البقع واحدة. وهذا يسمح لتحديد الفولتية لكل قناة على مقياس التدفق الخلوي. و (3) أنابيب مع الخرز لكل الأجسام المضادة فلورفور لجعل البقع واحدة. وهذا هو لتحديد مصفوفة التعويض.- جعل مزيج من الأجسام المضادة و فك كتلة (مكافحة CD16 / CD32) في برنامج تلفزيوني عند التخفيفات المناسبة (انظر الجدول 2 ). ومن الضروري تحديد التخفيف الأمثل للعمل لكل الأجسام المضادة قبل التجربة.
- ريسوسبيند الخلايا في 50 ميكرولتر من مزيج الأجسام المضادة للعينة وإضافة 50 ميكرولتر من الأجسام المضادة المخفف بشكل مناسب إلى الضوابط الحرجة.
ملاحظة: تلطيخ لا يمكن أن يؤديها في 96 جيدا، لوحة على شكل حرف U. هذا يجعل من الممكن لتقليل بسهولة حجم وصمة عار أو ندير كميات كبيرة من العينات. - احتضان لمدة 30 دقيقة في الظلام في 4 درجات مئوية.
- أجهزة الطرد المركزي لمدة 7 دقائق في 400 x ج و 4 درجة مئوية. تجاهل طاف.
- إعادة تعليق الخلايا في برنامج تلفزيوني إلى الحجم النهائي من 200 ميكرولتر.
ملاحظة: هذا الحجم النهائي يعتمد على الحد الأدنى من حجم التدفق الخلوي يمكن الوصول إليها. هذا يمكن أن تختلف قليلا بين الآلات. وبالإضافة إلى ذلك، فإن حجم القراءة يعتمد على عدد الخلايا و / أو الوقت العينة سوف تتخذ لتشغيل في مقياس التدفق الخلوي. - استخدام العينات والضوابط لتحليل التدفق سايتوميتريك.
ملاحظة: لتحديد عدد الخلايا المطلقة من السكان خلية مختلفة، يجب إضافة الخرز العد. إضافة نفس العدد من الخرز (± 25،000 الخرز) لكل عينة فقط قبل القياس. باستخدام الأمام و الجانب مبعثر، العد الخرز يمكن تحديدها بواسطة التدفق الخلوي (انظر الشكل 1 ). وفي وقت لاحق، يمكن حساب العدد المطلق للخلايا في العينة بمقارنة ثنسبة (ه) من أحداث حبة لأحداث الخلية. الصيغة التالية يمكن استخدامها: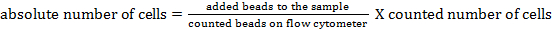
- تحليل تدفق cytometric
ملاحظة: يجب أن يتم تحليل تدفق cytometric على الفور بعد الانتهاء من بروتوكول تلطيخ. يجب استخدام قياس التدفق الخلوي مع الليزر والمرشحات للكشف عن إشارة المناسبة. ويبين الجدول 3 لمحة عامة عن الليزر والفلاتر اللازمة لدراسة وصفها في هذه المخطوطة. لمزيد من المعلومات حول تحليل cytometric تدفق، انظر عدن وآخرون. 18.- إعداد البوابات الرئيسية على أساس الأمام والجانب مبعثر، باستثناء الحطام والحلل (انظر الشكل 1).
- ضبط الجهد والتعويض عن التداخل الطيفي مع مساعدة من الخلايا وحيدة الملطخة والخرز.
ملاحظة: هذه الإعدادات المختلفة لكل قياس التدفق الخلوي ويلزم فحص قبل كل تجربة. Fأو تحليل تدفق الصحيح، وforward- والجانب مبعثر الفولتية حاسمة. A الصحيح إلى الأمام والجانب مبعثر يمكن أن تساعد في تحديد وتأكيد هوية الخلايا التي تم تحليلها. لتحديد هذه الفولتية، يجب تشغيل عينة غير ملوثين أولا. - انشاء بوابات مضان لالمستضد السطحي (انظر الشكل 1) وتحليل العينات.
| نوع الليزر | إعداد فلتر | |
| 505 ليرة لبنانية | 525/50 | |
| الأزرق (488 نانومتر) | 550 ليرة لبنانية | 575/26 |
| 100 ميغاواط | 670 ليرة لبنانية | 685/35 |
| 750 ليرة لبنانية | 780/60 | |
| البنفسجي 405 نانومتر | 450/50 | |
| 100 ميغاواط | ||
| الأحمر 633 نانومتر | 660/20 | |
| 70 ميغاواط | 750 ليرة لبنانية | 780/60 |
الجدول 3: نظرة عامة على الليزر ومرشحات من عداد الكريات تدفق المستخدمة في هذه الدراسة.
النتائج
بعد أداء بال مع 3x 1 مل من محلول الملح مخزنة، ينبغي استرداد حجم بين 2 و 3 مل. هذا السائل بال يمكن تحليلها أكثر لتوصيف محتوى الخلوية وغير الخلوية. للتحقيق في وجود السيتوكينات و تشيموكينس، إليسا 19 ، إمونوبلوت 20 ، والتحليل في وقت واحد من السيتوكينات متعددة من قبل مجموعة حبة السيتوكين 21 لا يمكن أن يؤديها. وبالإضافة إلى ذلك، يمكن تحديد الزلال ومجموع محتوى البروتين من هذا السائل 22 .
على سبيل المثال، تصف هذه المخطوطة كيفية تحليل المحتوى الخلوي للسوائل بال عن طريق التدفق الخلوي. تم جمع السائل بال تحليلها من الإناث البلب / كانكرل الفئران (عمر: 7 أسابيع) 24 ساعة بعد أن غرس داخل إنتراتراشيلي مع عديد السكاريد الشحمي. الأجسام المضادة التالية، إلى جانب فلورفور، ثتستخدم لتحديد أنواع مختلفة من الخلايا: CD11c و سيغليسف و مسيي و CD3ε و CD19 و Ly6g و CD11b (انظر الجدول 1 وجدول المواد ). كما تم استخدام صبغ قابلية للتثبيت. باستخدام استراتيجية الانطلاق على أساس التعبير التفاضلي للمستضدات على أسطح السكان الخلايا المختلفة ( الشكل 1 )، كان من الممكن تحديد الضامة والخلايا الجذعية والخلايا B والخلايا التائية، العدلات، والحمضات.
أولا، كانت الحطام والمزدوجة موصولة على أساس معلمات التشتت الأمامية والجانبية. وسهلت صبغة البقاء على قيد الحياة النابضة على الخلايا الحية. بعد ذلك، تم تحديد خلايا CD11c عالية وخلايا CD11c منخفضة. في CD11c ارتفاع السكان، والضامة والخلايا الجذعية تم تحديدها على أساس مسي و سيغليف التعبير، على التوالي. في CD11c منخفض السكان، تم تحديد الخلايا التائية والخلايا ب على أساس CD3ε و CD19 التعبير، على التوالي. في ثتم تحديد السكان الخلية المتبقية، العدلات والحمضات على أساس CD11b ولي -6G التعبير علامة، على التوالي.
تم إضافة الخرز عد لتحديد أعداد الخلايا المطلقة من السكان خلية مختلفة من خلال مقارنة نسبة الأحداث حبة لأحداث الخلية 23 . تم تحديد هذه الخرز العد على أساس خصائصها إلى الأمام والانتثار الجانبية ( الشكل 1 ). الجدول 4 يعطي لمحة عامة عن أعداد الخلايا المطلقة من السكان خلية مختلفة في السائل بال من الفأر السذاجة والماوس الذي تم تحفيز لمدة 24 ساعة مع 5 ميكروغرام من عديد السكاريد الدهني.
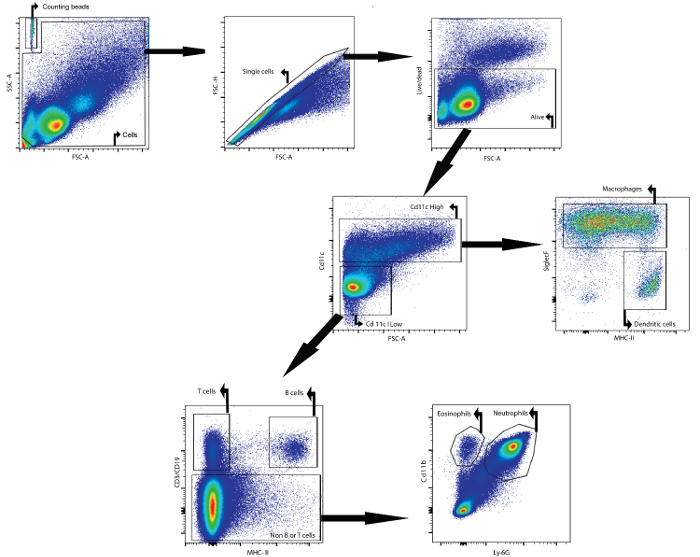
الشكل 1: استراتيجية الصابورة للكشف عن سايتوميتريك التدفق من الضامة، خلايا شجيري، خلايا T، خلايا B، العدلات، والحمضات طn بال السوائل. تم عزل الخلايا بال باستخدام بروتوكول بال وصفها. تم عزل الخلايا من الفئران 24 ساعة بعد تقطير داخل الرغامى من عديد السكاريد الشحمي. تم تحديد حبات العد والخلايا بناء على خصائص التشتت الأمامية والجانبية. في بوابة الخلية، تم التعرف على خلايا واحدة باستخدام مبعثر إلى الأمام والجانب. في هذه المجموعة السكانية الأخيرة، تم تحديد الخلايا التي كانت على قيد الحياة. ثم تم تحديد الخلايا CD11c عالية و CD11c الخلايا المنخفضة . في CD11c ارتفاع السكان، والضامة والخلايا الجذعية تم تحديدها على أساس مسي و سيغليف التعبير، على التوالي. في CD11c منخفض السكان، تم تحديد الخلايا التائية والخلايا ب على أساس CD3ε و CD19 التعبير، على التوالي. في السكان الخلية المتبقية، تم تحديد العدلات والحمضات على أساس CD11b ولي -6G التعبير، على التوالي. الرجاء انقر هنا لعرضنسخة أكبر من هذا الرقم.
| السكان الخلية | العدد المطلق للخلايا في الفئران السذاجة | العدد المطلق للخلايا في LPS حفز الفئران |
| البلاعم | 79612 | 25439 |
| الخلايا الجذعية | 495 | 671 |
| خلايا T | 45271 | 28089 |
| خلايا B | 4164 | 2926 |
| العدلات | 632 | 566716 |
| الحمضات | 3483 | 4332 |
الجدول 4: تمثيلاتاتيف نتائج تحليل التدفق الخلوي على السوائل بال من الفئران السذاجة و لس حفز.
Discussion
بال هو تقنية مفيدة للحصول على المعلومات الخلوية والبيوكيميائية ردا على العدوى أو المخدرات. في البداية، تم استخدام بال لإدارة إنتاج المخاط المفرط في المرضى الذين يعانون من سمية الفوسجين 3 . في الوقت الحاضر، يتم استخدام هذه التقنية في البشر للتحقيق المرضية الرئة، والتشخيص، والعلاجية من الأمراض 3 ، 24 . في الحيوانات المختبرية، ويشيع استخدام بال لمراقبة الاستجابات الالتهابية، وآليات المناعة، وعمليات الأمراض المعدية التي تحدث في الشعب الهوائية الرئوية 1 ، 2 .
لدراسة النمط الخلوي الالتهابي في نماذج أمراض الجهاز التنفسي، يجب أن يتبع بال من قبل العد المطلق والخلايا التفاضلية. بالإضافة إلى رقم الخلية المطلقة، أرقام الخلايا النسبية هي أيضا ذات أهمية. على سبيل المثال، تظهر نماذج الإصلاح والسرطان vريها الصغيرة ولا BAL زيادة عدد خلايا. في هذا النموذج، وتقييم التكوين الخلوي هو مفيد. باستخدام تلطيخ الخلايا جنبا إلى جنب مع المجهر الضوئي، وأنواع مختلفة من الخلايا، مثل الحمضات، العدلات، الضامة، والخلايا الليمفاوية، ويمكن التعرف على أساس التشكل 25 و 26 و 27 و 28 و 29 و 30. التدفق الخلوي يمكن استخدامها لتقييم محددة، مثل التعرف على مختلف الظواهر T-خلية 7، 31. بالإضافة إلى التعرف على مختلف السكان الخلية التسلل، وتكوين غير الخلوية من الرئة يمكن التحقيق باستخدام BAL. يتم تنفيذ أساليب مثل ELISA، مناعية، مجموعة خلوى حبة، المناعية، والكمي تفاعل البلمرة المتسلسل على BAL السائل لتحديد السيتوكينات والنموعوامل ومكونات التهابات أخرى. لتحديد الضرر الرئة، ومجموع مستويات البروتين ونازعة اكتات في السائل BAL يمكن أيضا قياس 32 و 33.
مع تطور أدوات جديدة للتشخيص، فإن التوصيف الجيني والبروتين من المكونات BAL يكون ممكنا في المستقبل القريب. والجمع بين توسيع قدرات الحسابية والتكنولوجيات التعبير الجيني الإنتاجية العالية تجعل من الممكن تحديد ملامح التعبير الجيني محددة لمختلف الحالات المرضية. ويمكن تنفيذ هذه التقنيات على BAL السائل توفير الجينات والبروتينات أنماط لتحديد جزيئات مهمة المشاركة في مراحل مختلفة من أمراض الرئة.
القيد الرئيسي للبيانات التي تم الحصول عليها من BAL السائل هو عدم وجود مقارنة بين مختلف التجارب البحثية 3 و 9. هناك درجة عالية منالتباين في تقنية غسل والتجهيز اللاحقة من السوائل بال. لتكون قادرة على مقارنة كل محاكمة بال، فمن الضروري لتوحيد نوع السائل غسل التي يتم غرس، وموقع تقطير، والجزء الذي يتم تحليلها لتكوين الخلوية وغير الخلوية. هناك اختلافات كبيرة في عدد الكسور غسل بين التجارب المختلفة، وتتراوح من واحد إلى 14 مرات 34 ، 35 ، 36 . هذا الاختلاف قد يكون له تأثير على إجمالي عدد الخلايا في الرئتين. من المهم أن تعرف أي جزء السوائل بال يحتوي على غالبية الخلايا. سونغ وآخرون. أظهرت أن ما يقرب من 70٪ من إجمالي عدد الخلايا تم استرجاعها في جزء واحد إلى ثلاثة 22 . ومع ذلك، أشارت تقارير أخرى أن الغسل الثاني يحتوي على خلايا أكثر من الخلايا الأولى 37 ، 38 . يمكننا أن نستنتج من هذه الدراسات أن غسل مع جزء واحد فقط لا يمثل الرئة بأكملها، مما يؤدي إلى سوء تفسير النتائج.
تكوين noncellular من السائل BAL يحتوي على معلومات قيمة عن الحالة الصحية للرئة 33 و 39 و 40. الاختلافات في التخفيف من السوائل BAL تسهم في الاختلاف في تقدير حجم الكسر للذوبان، وبالتالي، إلى الاختلافات في النتائج بين التجارب. أغنية وآخرون. مقارنة البروتين ومستويات اللاكتات نازعة من كل جزء غسيل وخلص إلى أن أول جزء غسيل يرد مرتين إلى ثلاث مرات أكثر من جزء الثاني.
لاسترداد عينة تمثيلية BAL للتحليل، وبعض الاعتبارات التقنية حاسمة. واحد منهم هو لأداء التخدير المناسب. من المهم جدا للتحقق من المرجع القدميكس من الماوس لضمان التخدير الطرفي. هذا ليس مهما فقط لأسباب أخلاقية، ولكن أيضا لأنه من الصعب وضع والاحتفاظ القسطرة في الموضع الصحيح إذا لم يتم تخدير الماوس بشكل صحيح.
وهناك اعتبار الفني الثاني المهم هو موقف القسطرة في القصبة الهوائية. عندما يتم إدخال القسطرة عميق جدا، يمكن أن تلحق الضرر هيكل الرئة. يجب على الطرف البعيد من القسطرة لا تصل إلى الرئتين أثناء إجراء BAL. وينبغي أيضا أن يستقر القسطرة، وتعادل قبالة مع خيط القطن. ولو لم يستقر القسطرة، قد تدفق محلول ملحي حقن صعودا إلى تجويف الأنف بدلا من أسفل إلى الرئتين. خلال الحقن وتطلع محلول ملحي، من المهم عقد القسطرة ثابتة.
البيانات التي تم الحصول عليها من السوائل BAL يجب أن يمثل الرئة الفئران كلها. ولذلك، من المهم أن غرس حجم كاف من العازلة المالحة (أي3 مل، مقسمة إلى 3 aliquots من 1 مل لكل منهما). ليست هناك علاقة خطية بين العائد الخلية والعائد السوائل بال. ومن المهم لجمع الحل بلطف بينما تدليك الصدر من الفأرة. إذا قوى القص قوية جدا، وقدرتها على البقاء، وظيفة، وهيكل الخلايا داخل السائل الهوائية وBAL يجوز المساس بها. إذا كان السائل يستنشق غير مرئي في المحقنة، نقل بعناية القسطرة أعمق أو أعلى في القصبة الهوائية.
وينبغي إيلاء إشعار خاص لجوانب محددة من معالجة BAL والتحليل. وهذا تعظيم المعلومات المدورة من العينات BAL. بعد BAL، كانت الخلايا في المياه المالحة المتوسطة الفقيرة بالمغذيات. ولذا فمن المهم جدا لمعالجة العينات في غضون 1 ساعة بعد أخذ العينات BAL. إذا التخزين لفترات طويلة أمر ضروري، لا بد من استخدام وسيلة تستكمل المواد الغذائية.
للحفاظ على بقاء الخلية، وتجنب الأنابيب التي تعزز التزام الخلية إلى السطح. تجنب مntrifugation من الايقاف الخلية بسرعات التي من المحتمل أن تعرض سلامة الخلوية أو لمنع إعادة تعليق موحد للخلايا BAL استردادها. يجب طرد BAL السائل تحتوي على خلايا في 400 x ج و 4 درجة مئوية لمدة 7 دقائق. من المهم أن نضع في اعتبارنا أن تعليق خلية ينبغي أن تعقد في 4 درجات مئوية أثناء المعالجة.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
لف هو مساعد باحث في قسم البيولوجيا الجزيئية الطبية الحيوية من جامعة غنت. ويدعم إرج من قبل ونيفاكفلو، منحة رقم 607690. ويدعم كر من قبل مشروع إيك-FP7 فلونيفاك.
Materials
| Name | Company | Catalog Number | Comments |
| Hanks' Balanced Salt Solution (HBSS) | Thermo Fisher Scientific | 14175-129 | |
| ethyleendiaminetetra acetic acid (EDTA) | Sigma-Aldrich | E6511 | irritating |
| 23 G x 1 1/4 needle | Henke Sass Wolf | 4710006030 | size: 0.60 x 30 mm |
| 26 G x 1/2 needle | Henke Sass Wolf | 4710004512 | size: 0.45 x 12 mm |
| plastic tubing | BD medical technology | 427411 | Polyethylene Tubing, I.D. 0.58 mm (0.023") O.D. 0.965 mm (0.38") 30.5 m (100') |
| sodium pentobarbital | Kela NV | 514 | |
| Phosphate-buffered Saline (PBS) | Lonza | BE17-516F | PBS without Ca2+ Mg2+ or phenol red; sterile filtered |
| 1 mL syringes | Henke Sass Wolf | 5010.200V0 | nonpyrogenic and nontoxic |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Surgical scissors | Fine Science Tools GmbH | 91460-11 | |
| centrifuge tube 50 mL | TH.Geyer | 7696705 | Free from Rnase/Dnase/endotoxin |
| centrifuge tube 15 mL | TH.Geyer | 7696702 | Free from Rnase/Dnase/endotoxin |
| microcentrifuge tube 1.5 mL | Sigma-Aldrich | 0030 120.094 | polypropylene |
| Microcentrifuge | Sigma-Aldrich | 5415R | |
| Centrifuge | Thermo Fisher Scientific | 75004030 | |
| Ammonium-Chloride-Potassium (ACK) lysing buffer | Lonza | 10-548E | sterile-filtered |
| live/dead - efluor 506 | ebioscience | 65-0866-18 | fixable viability dye |
| CD11c-PE-cy7 | eBiosciences | 25-0114-81 | |
| SiglecF-PE | BD Pharmingen | 552126 | |
| MHCII-APCefluor780 | Biolegend | 107628 | |
| CD3-PE-cy5 | VWR | 55-0031-U100 | |
| CD19-PE-cy5 | eBiosciences | 15-0193-83 | |
| CD11b-V450 | BD Pharmingen | 560455 | |
| Ly6G-AF700 | Biolegend | 127621 | |
| Absolute Counting Beads | Life Technologies Europe B.V. | C36950 | |
| anti-CD16/CD32 | BD Pharmingen | 553142 | |
| 96-well 340 µl storage plate plate | Falcon | 353263 | V-bottom, natural polypropylene |
| flow cytometer | BD Biosciences | ||
| catheter | BD Biosciences | 393202 |
References
- Stankunas, K., et al. Conditional protein alleles using knockin mice and a chemical inducer of dimerization. Mol Cell. 12 (6), 1615-1624 (2003).
- Hunninghake, G. W., Gadek, J. E., Kawanami, O., Ferrans, V. J., Crystal, R. G. Inflammatory and immune processes in the human lung in health and disease: evaluation by bronchoalveolar lavage. Am J Pathol. 97 (1), 149-206 (1979).
- Gee, J. B., Fick, R. B. Bronchoalveolar lavage. Thorax. 35 (1), 1-8 (1980).
- Tornling, G., et al. Hyaluronic acid in bronchoalveolar lavage in rats exposed to quartz. Br J Ind Med. 44 (7), 443-445 (1987).
- Henderson, R. F. Use of bronchoalveolar lavage to detect respiratory tract toxicity of inhaled material. Exp Toxicol Pathol. 57, 155-159 (2005).
- Morris, A., et al. Longitudinal analysis of the lung microbiota of cynomolgous macaques during long-term SHIV infection. Microbiome. 4 (1), 38 (2016).
- Naessens, T., et al. GM-CSF treatment prevents respiratory syncytial virus-induced pulmonary exacerbation responses in postallergic mice by stimulating alveolar macrophage maturation. J Allergy Clin Immunol. 137 (3), 700-709 (2016).
- Chockalingam, A., Duraiswamy, R., Jagadeesan, M. Bronchoalveolar lavage cellular analyses in conjunction with high-resolution computed tomography imaging as a diagnostic intervention for patients with suspected interstitial lung disease. Lung India. 33 (3), 287-291 (2016).
- Crystal, R. G., Reynolds, H. Y., Kalica, A. R. Bronchoalveolar lavage. The report of an international conference. Chest. 90 (1), 122-131 (1986).
- Baughman, R. P. The uncertainties of bronchoalveolar lavage. Eur Respir J. 10 (9), 1940-1942 (1997).
- Singletary, M. L., et al. Modification of a common BAL technique to enhance sample diagnostic value. J Am Assoc Lab Anim Sci. 47 (5), 47-51 (2008).
- Angus, D. W., Baker, J. A., Mason, R., Martin, I. J. The potential influence of CO2, as an agent for euthanasia, on the pharmacokinetics of basic compounds in rodents. Drug Metab Dispos. 36 (2), 375-379 (2008).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Inglis, H., Norris, P., Danesh, A. Techniques for the analysis of extracellular vesicles using flow cytometry. J Vis Exp. (97), (2015).
- Rubio-Navarro, A., et al. Phenotypic Characterization of Macrophages from Rat Kidney by Flow Cytometry. J Vis Exp. (116), (2016).
- Butcher, M. J., Herre, M., Ley, K., Galkina, E. Flow cytometry analysis of immune cells within murine aortas. J Vis Exp. (53), (2011).
- Noto, A., Ngauv, P., Trautmann, L. Cell-based flow cytometry assay to measure cytotoxic activity. J Vis Exp. (82), e51105 (2013).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Database, J. S. E. The ELISA method. J Vis Exp. , (2016).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Wunderlich, M. L., Dodge, M. E., Dhawan, R. K., Shek, W. R. Multiplexed fluorometric immunoassay testing methodology and troubleshooting. J Vis Exp. (58), (2011).
- Song, J. A., et al. Standardization of bronchoalveolar lavage method based on suction frequency number and lavage fraction number using rats. Toxicol Res. 26 (3), 203-208 (2010).
- Seliger, C., et al. A rapid high-precision flow cytometry based technique for total white blood cell counting in chickens. Vet Immunol Immunopathol. 145 (1-2), 86-99 (2012).
- Daniele, R. P., Elias, J. A., Epstein, P. E., Rossman, M. D. Bronchoalveolar lavage: role in the pathogenesis, diagnosis, and management of interstitial lung disease. Ann Intern Med. 102 (1), 93-108 (1985).
- Delayre-Orthez, C., Becker, J., de Blay, F., Frossard, N., Pons, F. Exposure to endotoxins during sensitization prevents further endotoxin-induced exacerbation of airway inflammation in a mouse model of allergic asthma. Int Arch Allergy Immunol. 138 (4), 298-304 (2005).
- Delayre-Orthez, C., et al. PPARalpha downregulates airway inflammation induced by lipopolysaccharide in the mouse. Respir Res. 6, 91 (2005).
- Delayre-Orthez, C., de Blay, F., Frossard, N., Pons, F. Dose-dependent effects of endotoxins on allergen sensitization and challenge in the mouse. Clin Exp Allergy. 34 (11), 1789-1795 (2004).
- Hachet-Haas, M., et al. Small neutralizing molecules to inhibit actions of the chemokine CXCL12. J Biol Chem. 283 (34), 23189-23199 (2008).
- Ble, F. X., et al. Activation of the lung S1P(1) receptor reduces allergen-induced plasma leakage in mice. Br J Pharmacol. 158 (5), 1295-1301 (2009).
- Ble, F. X., et al. Allergen-induced lung inflammation in actively sensitized mice assessed with MR imaging. Radiology. 248 (3), 834-843 (2008).
- Reber, L. L., et al. A dissociated glucocorticoid receptor modulator reduces airway hyperresponsiveness and inflammation in a mouse model of asthma. J Immunol. 188 (7), 3478-3487 (2012).
- Drent, M., Cobben, N. A., Henderson, R. F., Wouters, E. F., van Dieijen-Visser, M. Usefulness of lactate dehydrogenase and its isoenzymes as indicators of lung damage or inflammation. Eur Respir J. 9 (8), 1736-1742 (1996).
- Henderson, R. F. Use of bronchoalveolar lavage to detect lung damage. Environ Health Perspect. 56, 115-129 (1984).
- Forget, G., et al. An adherent cell perifusion technique to study the overall and sequential response of rat alveolar macrophages to toxic substances. Environ Health Perspect. 51, 131-140 (1983).
- Sung, J. H., et al. Recovery from welding-fume-exposure-induced lung fibrosis and pulmonary function changes in sprague dawley rats. Toxicol Sci. 82 (2), 608-613 (2004).
- Majetschak, M., Sorell, L. T., Patricelli, T., Seitz, D. H., Knoferl, M. W. Detection and possible role of proteasomes in the bronchoalveolar space of the injured lung. Physiol Res. 58 (3), 363-372 (2009).
- Rehn, B., Bruch, J., Zou, T., Hobusch, G. Recovery of rat alveolar macrophages by bronchoalveolar lavage under normal and activated conditions. Environ Health Perspect. 97, 11-16 (1992).
- Kelly, C. A., Ward, C., Stenton, S. C., Hendrick, D. J., Walters, E. H. Assessment of pulmonary macrophage and neutrophil function in sequential bronchoalveolar lavage aspirates in sarcoidosis. Thorax. 43 (10), 787-791 (1988).
- Eklund, A., Tornling, G., Blaschke, E., Curstedt, T. Extracellular matrix components in bronchoalveolar lavage fluid in quartz exposed rats. Br J Ind Med. 48 (11), 776-782 (1991).
- Olsen, G. N., Harris, J. O., Castle, J. R., Waldman, R. H., Karmgard, H. J. Alpha-1-antitrypsin content in the serum, alveolar macrophages, and alveolar lavage fluid of smoking and nonsmoking normal subjects. J Clin Invest. 55 (2), 427-430 (1975).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved