A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نموذج وينف - غير مكلفة و تراكتابل مصغر من المخاط توصيل القصبات لدراسة الأحياء الدقيقة من التهابات الرئة
In This Article
Summary
إن المسالك الهوائية الموصولة بالمخاط من التليف الكيسي (سف) هي بيئة مثالية لمسببات الأمراض الميكروبية لتزدهر. تصف المخطوطة طريقة جديدة لدراسة ميكروبيوم الرئة سف في بيئة تحاكي حيث تسبب المرض وكيف أن التغيرات في الظروف الكيميائية يمكن أن تدفع الديناميات الميكروبية.
Abstract
العديد من أمراض مجرى الهواء المزمن تؤدي إلى انسداد المخاط من الشعب الهوائية. الرئتين من فرد مع التليف الكيسي هي حالة مثالية حيث القصيبات متصلة المخاط خلق الموئل مواتية للاستعمار الميكروبي. العديد من مسببات الأمراض تزدهر في هذه البيئة تتفاعل مع بعضها البعض، والقيادة العديد من الأعراض المرتبطة مرض سف. ومثل أي مجتمع ميكروبي، فإن الظروف الكيميائية لموئلها لها تأثير كبير على هيكل المجتمع ودينامياته. على سبيل المثال، الكائنات الحية الدقيقة المختلفة تزدهر في مستويات مختلفة من الأوكسجين أو غيرها من تركيزات المذاب. هذا صحيح أيضا في الرئة سف، حيث يعتقد أن تركيزات الأكسجين لدفع علم وظائف الأعضاء المجتمع وهيكل. الطرق الموصوفة هنا مصممة لتقليد بيئة الرئة وتنمو مسببات الأمراض بطريقة أكثر مماثلة لتلك التي تسبب المرض. ثم يستخدم التلاعب بالمحيط الكيميائي لهذه الميكروبات لدراسة كيفية كيميستري من التهابات الرئة يحكم البيئة الميكروبية. ويستند هذا الأسلوب، ودعا نظام وينف، على البلغم الاصطناعي وأنابيب الشعرية الضيقة التي تهدف إلى توفير التدرج الأكسجين مماثلة لتلك التي توجد في القصيبات توصيل المخاط. يسمح التعامل مع الظروف الكيميائية، مثل درجة الحموضة لوسائل الإعلام من البلغم أو ضغط المضادات الحيوية، لتصور الاختلافات الميكروبيولوجية في تلك العينات باستخدام مؤشرات ملونة، ومشاهدة لإنتاج الغاز أو بيوفيلم، أو استخراج وتسلسل محتويات الحمض النووي من كل عينة.
Introduction
وتسمى الطريقة الموصوفة في هذه المخطوطة نظام وينف 1 . الهدف العام من وينف هو توفير الإعداد التجريبية قادرة على محاكاة البيئة من الشعب الهوائية الرئة مليئة المخاط المخاط. هذا سوف يسمح لنظام قابل للدراسة لدراسة مسببات الأمراض الميكروبية من أمراض الرئة مع النمط الظاهري فرط المخاط بما في ذلك التليف الكيسي (سف)، مرض الانسداد الرئوي المزمن (كوبد)، والربو وغيرها. تم تصميم هذا الإجراء خصيصا لدراسة سف، والتي تتميز الطفرات التي تسبب إفرازات الرئة لتصبح سميكة وصعبة واضحة، في نهاية المطاف ملء القصبات وغيرها من الممرات الصغيرة مع المخاط 2 . هذا الانسداد في الرئة تمنع تبادل الغاز لأن الهواء المستنشق لم يعد قادرا على الوصول إلى العديد من الحويصلات الهوائية وأيضا توفير موطن للاستعمار الجرثومي 3 ، 4 . عدم القدرة على منع نمو الميكروبات فيالإفراط في مخاط رئة يؤدي في النهاية إلى تطور العدوى المزمنة المعقدة لمجرى الهواء. هذه المجتمعات تحتوي على مجموعة متنوعة من الكائنات الحية، بما في ذلك الفيروسات والفطريات والبكتيريا مثل الزائفة الزنجارية، وكلها تتفاعل مع بعضها البعض 5 و 6 و 7 و 8. ويعتقد أن نشاط microbiome CF الرئة أن تشارك في مشاعل الأعراض تسمى التفاقم الرئوية 1 و 9 و 10 و 11. WinCF يمكن دراسة سلوك المجتمع الميكروبي حول هذه التفاقم ويجري الآن توسيعها لتكون بمثابة نظام تجريبي قاعدة لدراسة الرئة الميكروبية البيئة. تقليديا، وقد تم دراسة التفاقم من خلال التحليل المباشر للعينات المأخوذة من الرئة. العديد من العوامل المربكة تجعل التحليل المباشر للب الميكروبيةehavior في الرئتين الصعبة، مع نظام WinCF، وكثير من هذه العوامل يتم إزالتها وسلوك microbiome الرئة يمكن دراستها بصورة مباشرة، مما يسمح للتحليل أدق النشاط الجرثومي في قصيبة-توصيل المخاط.
ويوفر النظام WinCF طريقة لتنمو وتحليل البكتيريا بطريقة يحاكي البيئة بشكل فعال الرئة. الطرق التقليدية لزراعة البكتيريا الرئة عينات زراعة في كثير من الأحيان المعنية على لوحات أجار التقليدية. هذه الأساليب تترك العينات مفتوحة للأكسجين في الغلاف الجوي، إهمال لحساب ميتة وغالبا الظروف الأكسجين الموجود في القصيبات الرئوية توصيله مع مخاط 12 و 13. زراعة على أجار تحت الظروف الهوائية شيء مثل بيئة CF الرئة ويمكن تضليل الأطباء والباحثين بشأن سلوك مسببات الأمراض التي يحاولون علاج. بالإضافة إلى ذلك، العناصر الغذائية المتاحة للبكتيريا على لوحات أجارلا يختلف عن تلك المتوفرة في البلغم الفعلي، الذي استأثرت في WinCF من خلال الاستفادة من وسائل الإعلام البلغم الاصطناعي (ASM). كما يتضح من الثقافات الزائفة في Sriramulu وآخرون. 14، ويشمل ASM مجموعة محددة من المكونات التي يحاكي الموارد المتاحة للميكروبات البلغم ويعيد التناسق البدني من البلغم أيضا. لأن الرئة المريضة لديها microbiome معين، يجب دراسة هذه الكائنات الدقيقة من الناحية المثالية أن تتم في الظروف المحددة في الرئة كذلك.
النظام WinCF يمكن تحليل سريع والتلاعب سهل من الظروف التجريبية لمراقبة التغيرات الميكروبية مماثلة إلى الكيفية التي يمكن أن تحدث في قصيبة الرئة الفعلية. هذا الأسلوب يسمح للتلقيح عدد لا يحصى من أنواع عينة ذات الصلة بما في ذلك البلغم واللعاب وغيرها من إفرازات الجسم والثقافات البكتيرية نقية أو مختلطة. طبيعة الإعداد التجريبية تسمح التفسير البصري المباشر للتم تصميم سلوك المجتمع الميكروبي ولتمكين التطبيق المصب سهل من العديد من الإجراءات الميكروبيولوجية وOMICS. مثل هذه الدراسات مهمة لتغيير تركيبة المجتمع البكتيرية بناء على الظروف الفيزيائية بيئتهم. مع WinCF الظروف الكيميائية وسائل الإعلام يمكن التلاعب بها لتحليل الآثار المترتبة على النشاط البكتيري. على سبيل المثال، الحموضة وسائل الإعلام يمكن أن تتغير قبل التلقيح مع عينة. بعد مرور فترة الحضانة، والنشاط الجرثومي في كل من هذه الشروط يمكن مقارنة مباشرة، ويمكن استخلاص استنتاجات حول كيف تتصرف البكتيريا في تلك العينات البلغم ردا على تفاوت درجة الحموضة. هنا، ونحن الخطوط العريضة لإجراءات تطبيق نظام WinCF وأمثلة لكيفية الكيمياء وسائل الاعلام يمكن التلاعب بها لدراسة الآثار المترتبة على microbiome الرئة.
Protocol
1. إعداد الأسهم للالبلغم الاصطناعي وسائل الإعلام
- إنشاء 5٪ محلول موسين. إضافة 1.0 غرام من المجففة المعدة موسين الخنازير إلى 20 مل من الماء منزوع الأيونات. الأوتوكلاف الحل الناتج.
ملاحظة: سوف تعقيم موسين تدمير هيكلها الأصيل. طرق أخرى لتعقيم موسين في شكله الجاف وتشمل الأشعة فوق البنفسجية التعقيم والتشعيع. هذه الأساليب لم تستخدم على نطاق واسع لنظام وينف ولكن. - إضافة 2.2 غرام من بوكل إلى 50 مل من الماء منزوع الأيونات والسماح للحل. إضافة 5.0 غرام من كلوريد الصوديوم إلى 50 مل من الماء منزوع الأيونات والسماح للحل. الأوتوكلاف هذين الحلين.
- إضافة 100 ملغ من دنا السلمون الحيوانات المنوية إلى 10 مل من الماء منزوع الأيونات معقم. تسخين هذا الحل إلى حوالي 85 درجة مئوية في حمام مائي لبضع ساعات لضمان حل.
- إضافة 5.0 ملغ من الفيريتين إلى 5.0 مل من الماء منزوع الأيونات معقم.
2. إعداد الاصطناعي البلغم المتوسطة
- دمجالمكونات التالية: 16 مل من محلول الأسهم موسين، 2.0 مل من محلول الأسهم بوكل، 2.0 مل من محلول الأسهم كلوريد الصوديوم، 200 ميكرولتر من مستحلب صفار البيض، 5.6 مل من محلول المخزون الحمض النووي، 120 ميكرولتر من محلول الأسهم الفيرتين، 5.78 مل من الضروري ومحلول الأحماض الأمينية، و 5.78 مل من محلول الأحماض الأمينية غير الضرورية، و 2.44 مل من الماء المعقم.
- إذا ظهرت كميات صغيرة من الرواسب، هز بلطف لخلط.
- الماصة 5.0 مل من وسائل الإعلام إلى ثمانية العقيمة أنابيب 15 مل الطرد المركزي.
ملاحظة: الظروف الكيميائية من كل أنبوب يمكن التلاعب بها على النحو المطلوب. على سبيل المثال، يمكن إضافة حلول عازلة ومؤشرات الرقم الهيدروجيني إلى كل أنبوب لغرض مقارنة السلوك الميكروبي عند مستويات الرقم الهيدروجيني المتميزة. وتظهر مظاهرة من هذا في قسم النتائج ممثل مع 8 مستويات درجة الحموضة متميزة، من 5.0 إلى 8.5 في 0.5 زيادات درجة الحموضة.
- مرة واحدة يتم التلاعب الظروف الكيميائية وسائل الإعلام بنجاح، وتجميد لاستخدامها لاحقا. وستظل وسائل الإعلام مستقرةزن في -20 درجة مئوية لعدة أشهر. دوامة على الذوبان.
3. إعداد تشغيل السيطرة على شعري أنابيب
- في biohood العقيمة، وملء ثمانية أنابيب microcentrifuge العقيمة مع 250 ميكرولتر من وسائل الإعلام لكل منهما.
- الحصول على ثمانية أكثر العقيمة 15 مل أنابيب الطرد المركزي، كل أنبوب المقابلة لأنبوب microcentrifuge المذكورة في الخطوة 3.1.
- تعقيم منشفة ورقية مع 70٪ من محلول الإيثانول والسماح ليجف. مرة واحدة جافة، المسيل للدموع منشفة إلى قطع حوالي أربع بوصات مربعة لكل منهما، وجعدة كل قطعة في الجزء السفلي من أنبوب الطرد المركزي 15 مل. لأنابيب إضافية، رذاذ والجافة المناشف الورقية إضافية حسب الحاجة.
- مع أجمة واحدة من الورق في الجزء السفلي من كل أنبوب الطرد المركزي، يضعف قليلا كل أجمة رقة مع حوالي 1.0 مل من الماء المعقم لخلق بيئة رطبة.
- الحصول على ثلاثة أنابيب زجاجية الشعرية لكل أنبوب microcentrifuge أعدت في الخطوة 3.1 و كتلة من الشعيرات الدموية أنبوب المعجون sealaالإقليم الشمالي.
- لكل أنبوب ميكروسنتريفوج، وملء ثلاثة أنابيب الشعرية مع وسائل الإعلام إلى حوالي 5 ملم بعيدا عن علامة زرقاء بالقرب من الجزء العلوي من الأنبوب.
- ملء عن طريق عقد طرف واحد من الأنبوب في أنبوب ميكروسنتريفوج وإمالة نحو اتجاه أفقي، والسماح للعمل الشعري لتوجيه المتوسطة في أنبوب (انظر الشكل 1 ).
- وقف ملء عن طريق وضع بلطف إصبع قفاز على نهاية مفتوحة من الأنبوب، ومن ثم ختم الطرف الآخر من الأنبوب عن طريق الضغط عليه في كتلة تسرب.

الشكل 1: الرقم الهيدروجيني التدرج، ملء أنبوب شعري مع البلغم الاصطناعي متوسطة. ويضاف الوسيط عن طريق إدراج طرف واحد من الأنبوب في السائل والإمالة لتسهيل العمل الشعري. التلوين المتوسط في هذا المثال يرجع إلى مؤشر الرقم الهيدروجيني المضافة للمساعدة في الشيطانسترات التغييرات المحتملة في الحموضة بعد الحضانة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- وضع كل مجموعة من ثلاثة أنابيب الشعرية في 15 مل أنابيب الطرد المركزي مليئة المناشف الورقية مبلل تماما مع الماء المعقم، الجانب المعجون مختومة إلى أسفل. كاب الأنبوب والتسمية. هذه الأنابيب الشعرية الثلاثة هي لتكرار كل شرط السيطرة.
- عندما يتم تعبئة جميع أنابيب الطرد المركزي 15 مل مع أنابيب الشعرية المعينة، ووضع الأنابيب في رف عقد. ضع الرف بحيث يتم تحضين الأنابيب أفقيا (للقبض على فقاعات الغاز) (انظر الشكل 2 ). احتضان أنابيب الشعرية داخل أنابيب الطرد المركزي (التي تحتوي على كتل ورقة مبلل) عند 37 درجة مئوية لمدة 48 ساعة.
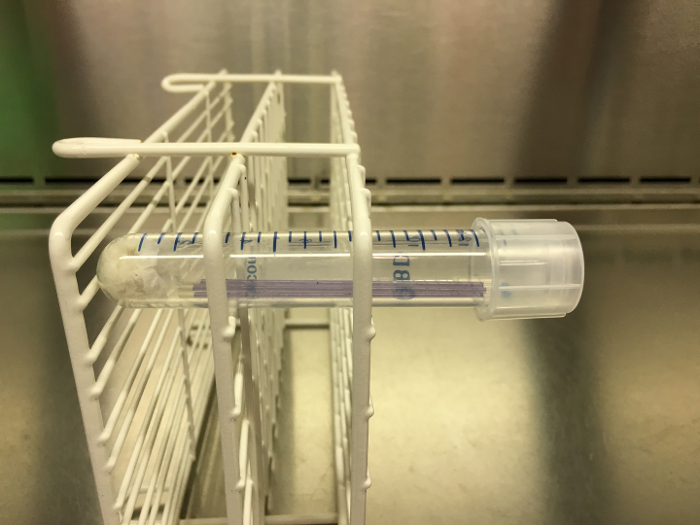
الشكل 2: مثال درجة الحموضة التدرج، شعرية أنابيب جاهزة للحضانة. وبمجرد أن يتم شغل ثلاثة أنابيب الشعرية ومختومة، يتم وضعها في أنبوب الطرد المركزي مع منشفة ورقية رطبة في القاع. ثم توج هذا الأنبوب ووضعها في رف. يجب أن يكون موجها رف جانبية أثناء الحضانة، كما في الصورة هنا، حتى أن إنتاج الغاز يمكن ملاحظتها مرة واحدة اكتمال الحضانة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
4. التصوير من التحكم شعري أنابيب بعد الحضانة
- إزالة الرف أنابيب الطرد المركزي من الحاضنة، والتأكد من الحفاظ على أنابيب أفقية. الشريحة بعناية الأنابيب الشعرية من أنابيب الطرد المركزي، وحفظ كل مجموعة من ثلاثة منفصلة عن مجموعات أخرى.
- ترتيب الأنابيب الشعرية بجانب بعضها البعض على العلبة الخفيفة، اصطف جميع بحيث محتويات الأنابيب هي فيماإبل، أيضا، أضاء أضاء. ترك فجوة كل ثلاثة أنابيب لفصل الظروف الكيميائية المختلفة.
- مع أنابيب الانحياز و ليتبوكس تشغيل، صورة من فوق مباشرة. (انظر الشكل 3 )

الشكل 3: مثال درجة الحموضة التدرج، تشغيل التحكم، قبل الحضانة، لا البلغم المضافة. البلغم الاصطناعي المتوسطة بعد أن تضاف إلى أنابيب الشعرية في مجموعات من ثلاثة، وزيادة في درجة الحموضة من اليسار إلى اليمين. مزيج من المؤشرات المضافة إلى نتيجة متوسطة في أنابيب أكثر حمضية تظهر أكثر الأصفر، في حين أن أنابيب أقل حمضية تصبح أكثر الأرجواني. يتم ترتيب الأنابيب أفقيا وتضيء من أسفل، وتصويرها من أعلاه. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- تخلص منالمواد التحكم في النفايات biohazardous.
5. التلقيح وWinCF شعري أنابيب مع عينة بصاق
- في biohood العقيمة، وملء ثمانية أنابيب microcentrifuge العقيمة مع 225 ميكرولتر من وسائل الإعلام لكل منهما.
- تجانس عينة البلغم عن طريق سحب وإخراج البلغم مرارا وتكرارا مع مل حقنة 3 (حقنة بلاستيكية بدون إبرة). القيام بذلك حتى البلغم هو من الاتساق على نحو سلس.
- إضافة 25 ميكرولتر من البلغم المتجانس إلى كل أنبوب microcentrifuge (1/10 التخفيف في وسائل الإعلام ASM) التي أعدت في الخطوة 5.1. ثم دوامة الأنابيب لمدة 30 ثانية لخلط بما فيه الكفاية.
- إضافة إلى وسائل الإعلام الأنابيب الشعرية التالية نفس الإجراء الخطوات 3.2 خلال 3.5.
6. التصوير من عينة شعري أنابيب بعد الحضانة
- بعد فترة حضانة 48 ساعة، وإزالة وصورة الأنابيب الشعرية التالية نفس الإجراء الخطوات 4.1 خلال 4.3.
- إذا فقاعات موجودة في الأنابيب، وجعلتأكد من أن الصور التي التقطت بوضوح تصور الترسيم بين الفقاعات ووسائل الإعلام في الأنابيب. إذا كان بيوفيلم موجود، تأكد من أن الصور يمكن أن تصور بوضوح وجودها كذلك.
7. إزالة وسائل الإعلام لتطبيقات المصب
- لتسهيل التحليل المصب، وإزالة وسائل الإعلام من أنابيب الشعرية بعد التصوير. وتشمل التطبيقات المحتملة زراعة وتسلسل الحمض النووي / الحمض النووي الريبي والتنميط ميتابولوميك.
الحذر: أنابيب زجاجية الشعرية مليئة مسببات الأمراض هي بيوهازارد هامة، وبالتالي، يجب أن يتم هذه الخطوات بعناية فائقة مع معدات محددة. إذا كسر أنابيب الشعرية، والتخلص في الحاوية الأدوات الحادة بيوهازارد المناسبة. - استخدام إبر حادة المنتهية من 25 قياس و 0.5 بوصة في الطول لإزالة وسائل الإعلام. إدراج إبرة حادة انتهت في نهاية موصول من أنبوب لكسر الختم.
- بعد كسر الختم، وتحويل أنبوب شعري رأسا على عقب وسوف وسائل الإعلام بالتنقيط من الجزء العلوي. أناو وسائل الإعلام لا بالتنقيط خارج بسهولة، واستخدام ماصة مع طرف 200 ميكرولتر وطرد وسائل الإعلام من الأنبوب عن طريق الضغط على أسفل على الغطاس ماصة عند إدراجها في نهاية الأنبوب الشعرية. جمع وسائل الإعلام أنبوب طرد في حاوية مناسبة (1.5 مل أنبوب الطرد المركزي).
ملاحظة: لتحليل الحمض النووي الريبي ترانسكريبتوميك أو غيرها، يمكن طرد وسائل الإعلام مباشرة إلى الحمض النووي الريبي استقرار مخازن.
8. نظام وينف فلود
ملاحظة: نظام وينكف لوادينغ لوادينغ وتيليتي (فلود) نظام هو مجموعة اختيارية من الأجهزة التكميلية المصممة لتحسين الإنتاجية من نظام وينف. يتكون نظام وينف فلود في المقام الأول من المواد القابلة للطباعة 3D. يسمح التصنيع المطبوع ثلاثي الأبعاد باستبدال المواد بسرعة وسهولة لضمان الحد الأدنى من وقت التوقف عن العمل للباحثين وكذلك الحد الأدنى من متطلبات التصنيع. تصاميم، ملفات ستل، تعليمات الطباعة 3D ودليل وينف فلود متوفرة في سوبليم على الانترنتالإقليم الشمالي.
- وسائل الاعلام التحضير لأنبوب شعري تحميل
- في biohood العقيمة، وملء ثمانية العقيمة 2 مل أنابيب microcentrifuge مع 900 ميكرولتر من المتوسط لكل منهما.
- التجانس أي عينات البلغم عن طريق سحب وإخراج البلغم مرارا وتكرارا مع مل حقنة 3 (حقنة بلاستيكية بدون إبرة). القيام بذلك حتى البلغم هو من الاتساق على نحو سلس.
- إضافة 100 ميكرولتر من البلغم المتجانس إلى كل أنبوب microcentrifuge (1/10 التخفيف في المتوسط) التي أعدت في الخطوة 8.1.1. ثم دوامة الأنابيب لمدة 30 ثانية لخلط بما فيه الكفاية.
- فتحة في أنابيب microcentrifuge شغل ومفتوحة في حامل أنبوب محور دوار الموجهة بحيث أنابيب عمودية.
- وضع الأنابيب الشعرية
- استرداد ثلاثة أنابيب الشعرية لكل أنبوب microcentrifuge في الخطوة 8.1.
- فتحة ثلاثة أنابيب في مهد المطاط بحيث أنها تتماشى مع أنابيب microcentrifuge في الطرف الآخر من الجهاز.تأكد من نهايات ملحوظ من أنابيب الوجه بعيدا عن أنابيب ميكروسنتريفوج. تناسب الثقوب الثلاثة على الجزء السفلي من المهد بشكل صحيح على الأزرار الثلاثة على حامل مهد.
- مع أنابيب الشعرية وضعها يستريح في قنوات دليل على الجهاز، وضع المطاط المطاطي على ميدسكتس بشكل آمن لمنع التحول. (انظر الشكل 4 )

الشكل 4: نظام فلود محملة بالكامل مع أنابيب الشعرية المضمونة من قبل ممسكة المطاط خلال منجزاتها. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- تحميل الوسائط في أنابيب الشعرية
- استخدام بعناية يد واحدة لفهم نهاية الجهاز حيث أنابيب الشعرية هي لوأديد، واستخدام اليد الأخرى لعقد الرف المدورة التي يتم تحميل أنابيب ميكروسنتريفوج.
- تدوير بدقة رف ميكروسنتريفوج بحيث أنابيب ميكروسنتريفوج هي أفقية تقريبا، والشروع في دفع ببطء الرف نحو أنابيب الشعرية. (انظر الشكل 5 )
- عندما نهايات الأنابيب الشعرية تجعل الاتصال مع وسائل الإعلام في أنابيب ميكروسنتريفوج، وضمان أن العمل الشعري يبدأ فورا ملء أنابيب الشعرية. لضبط معدل التعبئة ومستوى التعبئة، تدوير الجهاز بلطف. أثناء القيام بذلك، يجب الحرص على عدم تسرب وسائل الاعلام من أنابيب ميكروسنتريفوج. (انظر الشكل 6 )
- عندما يتم تعبئة الأنابيب الشعرية إلى المستويات المطلوبة، ضع مستوى الجهاز على سطح وبعناية بعد سحب بسرعة رف أنابيب ميكروسنتريفوج قبالة نهايات أنابيب الشعرية لوقف ملء. ويمكن الآن أنابيب ميكروسنتريفوج أن تتراجع في كل وسيلة العودة إلى الوضع الرأسي وأغلقت.
- ختم نهايات جاحظ من الأنابيب الشعرية عن طريق الضغط على كتلة تسرب على كل مجموعة ثلاث نسخ، وختم مجموعة واحدة في وقت واحد حتى يتم اغلاق جميع مجموعات. للحد من مخاطر التلوث، الضغط على جزء آخر من كتلة تسرب على كل مجموعة ثلاث نسخ (انظر الشكل 7).

الشكل 5: نظام FLUD مع أنابيب المتوسطة المنتشرة على التوجيه الأفقي، على استعداد لاجراء اتصالات مع شعري أنابيب. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
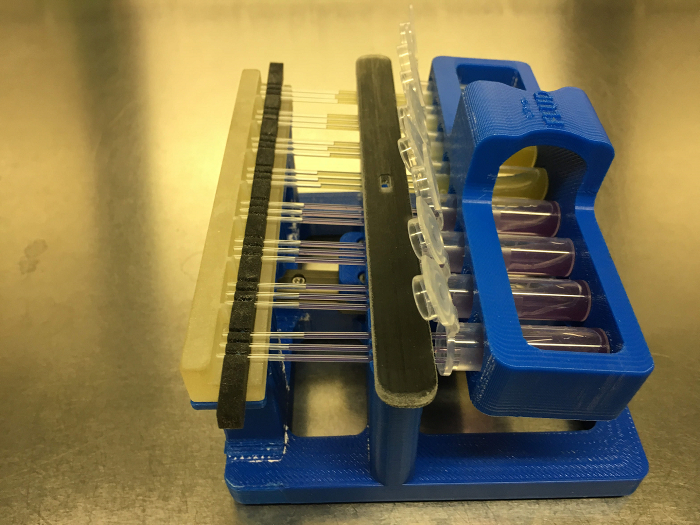
الشكل 6: نظام FLUD مع شعري أنابيب تحميل مع وسائل الإعلام عن طريق عمل شعري. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: ختم أنابيب الشعرية شغل على نظام فلود مجموعة ثلاثية واحدة في وقت واحد باستخدام كتلة تسرب. وكان هذا البلاستيك تسرب على طول الحواف التي قطعت لمنع الاتصال مع مجموعات الثلاثية المجاورة أثناء الختم. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- حضانة
- قم بإزالة الحشوة المطاطية فوق ممسحة الأنبوب وارفع حامل المطاط عن الجهاز الرئيسي. هذا ينبغي أن تأخذ جميع أنابيب الشعرية معها. الآن تعيين مهد والأنابيب التي عقدت على رف التصوير. هذا راالمسيخ ثلاثة بذرة التي تنسجم مع القاعدة، فضلا عن قنوات دليل صغيرة لوضع الأنابيب في.
- تعيين رف التصوير ككل في واضحة مربع الحضانة البلاستيك. نقع كميات صغيرة من مناشف ورقية معقمة في الماء المعقم ووضع على طول الجانبين أقصر من مربع لتوفير الرطوبة أثناء الحضانة. (انظر الشكل 8)
- إغلاق مربع تماما ومجموعة داخل الحاضنة 37 درجة مئوية، والتأكد من الحفاظ على أنابيب أفقية. احتضان لمدة 48 ساعة.
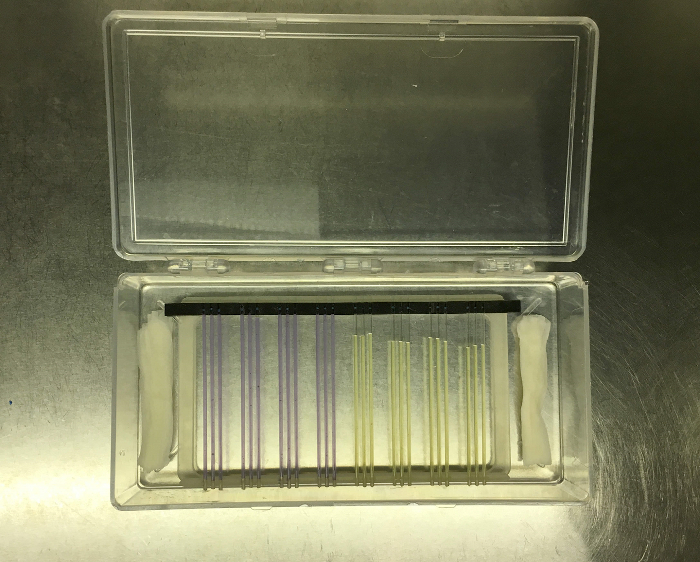
الرقم 8: شعري أنابيب المطاط في مهد المحول من نظام FLUD إلى حامل التصوير، التي وضعت في الحضانة صندوق واضح إلى جانب مناشف ورقية رطبة لتوفير الرطوبة. الرجاء انقر هنا لعرض نسخة أكبر من الهو الرقم.
- التصوير واستخراج
- إزالة رف التصوير عقد أنابيب من مربع الحضانة وضعه على العلبة الخفيفة، مضيئة من الأسفل. مع أنابيب بالفعل في رف التصوير، ومجموعات ثلاث نسخ سيتم متباعدة بشكل صحيح وعلى استعداد لصورة على الفور.
- تركيز الكاميرا على أنابيب بحيث كلها واضحة في مجال الرؤية والضوء من ضوء مربع يحقق التباين كافية وتصور اللون في الأصباغ أنبوب. صورة من فوق مباشرة.
- لاستخراج محتويات الأنابيب، وإزالة الأنابيب الشعرية من المطاط مجموعة مهد واحد من يثلث في وقت واحد. رفع بلطف الأنابيب والخروج من المهد أو الانزلاق بها.
- لكل مجموعة من يثلث، اتبع الإجراء استخراج بالتفصيل في خطوات 7.1 خلال 7.3.
النتائج
النمو الميكروبيولوجي في مختلف الظروف الكيميائية التي يسببها داخل عينات تختلف بشكل كبير في بعض الحالات وأكثر بمهارة في مناطق أخرى. وكانت العديد من التغيرات في النشاط المرئية في الطبيعة، ويجري بادية للعيان فور انتهاء فترة الحضانة. في المثال التلاعب ...
Discussion
تحتوي التركيبة الميكروبيولوجية للرئة مع سف على مجموعة كبيرة ومتنوعة من الكائنات الحية، ولكن الظروف داخل الرئة على الأرجح لها تأثير كبير على أنواع الميكروبات التي يمكن أن تعيش وتزدهر 13 ، 15 . آليات محددة من خلالها تغير هذه الظروف والآثا...
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
ويود المؤلفون أن يعترفوا بجائزة فيرتكس فارماسيوتيكالز وجائزة الابتكار في مجال التليف الكيسي للتمويل R. كوين والمعاهد الوطنية للصحة / نييد لمنحة التمويل 1 U01 AI124316-01، وهو نهج بيولوجيا النظم لمعالجة مسببات الأمراض المقاومة للأدوية المتعددة. ونود أيضا أن نشكر قسم الهندسة الميكانيكية والفضاء في جامعة كاليفورنيا أوسسد في الهندسة المعمارية العليا دورة التصميم لتسهيل التعاون مع الجوانب الهندسية لهذا العمل.
Materials
| Name | Company | Catalog Number | Comments |
| Color-Coded Capillary Tubes | Fisher Scientific | 22-260943 | |
| Cha-seal Tube Sealing Compound | Kimble-Chase | 43510 | |
| Mucin from porcine stomach | Sigma | M1778 | |
| Ferritin, cationized from horse spleen | Sigma | F7879 | |
| Salmon sperm DNA Sodium salt (sonified) | AppliChem Panreac | A2159 | |
| MEM Nonessential Amino Acids | Corning cellgro | 25-025-CI | |
| MEM Amino Acids | Cellgro | 25-030-CI | |
| Egg Yolk Emulsion, 50% | Dalynn Biologicals | VE30-100 | |
| Potassium Chloride | Fisher Scientific | P2157500 | |
| Sodium Chloride | Fisher Scientific | S271500 | |
| 15 mL centriguge tubes with Printed Graduations and Flat Caps | VWR | 89039-666 | |
| 50 mL centrifuge tubes with Printed Graduations and Flat Caps | VWR | 89039-656 | |
| 1.5 mL microcentrifuge tubes | Corning | MCT-150-R | |
| 2.0 mL microcentrifuge tubes | Corning | MCT-200-C |
References
- Quinn, R. A., et al. A Winogradsky-based culture system shows an association between microbial fermentation and cystic fibrosis exacerbation. ISME J . 9, 1024-1038 (2015).
- Quinton, P. M. Cystic fibrosis: impaired bicarbonate secretion and mucoviscidosis. Lancet. 372 (9636), 415-417 (2008).
- Harrison, F. Microbial ecology of the cystic fibrosis lung. Microbiology. 153 (Pt 4), 917-923 (2007).
- Caverly, L. J., Zhao, J., LiPuma, J. J. Cystic fibrosis lung microbiome: Opportunities to reconsider management of airway infection. Pediatr pulmonol. 50, S31-S38 (2015).
- Blainey, P. C., Milla, C. E., Cornfield, D. N., Quake, S. R. Quantitative analysis of the human airway microbial ecology reveals a pervasive signature for cystic fibrosis. Sci Transl Med. 4 (153), 153ra130 (2012).
- Willner, D., et al. Spatial distribution of microbial communities in the cystic fibrosis lung. ISME J. 6 (2), 471-474 (2012).
- Delhaes, L., et al. The airway microbiota in cystic fibrosis: a complex fungal and bacterial community--implications for therapeutic management. PloS one. 7 (4), e36313 (2012).
- Rogers, G. B., et al. D. Bacterial diversity in cases of lung infection in cystic fibrosis patients: 16S ribosomal DNA (rDNA) length heterogeneity PCR and 16S rDNA terminal restriction fragment length polymorphism profiling. J clin microbiol. 41 (8), 3548-3558 (2003).
- Stenbit, A. E., Flume, P. A. Pulmonary exacerbations in cystic fibrosis. Curr Opin Pulm Med. 17 (6), 442-447 (2011).
- Twomey, K. B., et al. Microbiota and metabolite profiling reveal specific alterations in bacterial community structure and environment in the cystic fibrosis airway during exacerbation. PloS one. 8 (12), e82432 (2013).
- Carmody, L. A., et al. Changes in cystic fibrosis airway microbiota at pulmonary exacerbation. Ann. Am. Thorac. Soc. 10 (3), 179-187 (2013).
- Worlitzsch, D., et al. Effects of reduced mucus oxygen concentration in airway Pseudomonas infections of cystic fibrosis patients. J. Clin. Invest. 109 (3), 317-325 (2002).
- Cowley, E. S., Kopf, S. H., LaRiviere, A., Ziebis, W., Newman, D. K. Pediatric Cystic Fibrosis Sputum Can Be Chemically Dynamic, Anoxic, and Extremely Reduced Due to Hydrogen Sulfide Formation. mBio. 6 (4), e00767-e00715 (2015).
- Sriramulu, D. D., Lünsdorf, H., Lam, J. S., Römling, U. Microcolony formation: a novel biofilm model of Pseudomonas aeruginosa for the cystic fibrosis lung. J. Med. Microbiol. 54 (Pt 7), 667-676 (2005).
- Quinn, R. A., et al. Biogeochemical forces shape the composition and physiology of polymicrobial communities in the cystic fibrosis lung. mBio. 5 (2), (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved