A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ل
In This Article
Summary
نحن هنا تصف طريقة التوازن السريع (ريد) غسيل الكلى لقياس المخدرات ملزمة لكازيوم من آفات السل الرئوي والتجويف. يستخدم البروتوكول أيضا مع مصفوفة مستمدة بلعم رغوي الذي هو بديل فعال ل كاسوم.
Abstract
ويتطلب القضاء على مرض السل وجود نظم أدوية يمكن أن تخترق الطبقات المتعددة من الآفات الرئوية المعقدة. توزيع المخدرات في النوى الكاحل من تجاويف والآفات هو أمر بالغ الأهمية خاصة لأنها تؤوي مجموعات فرعية من البكتيريا المتسامحة للدواء أيضا يشار إليها عادة باسم بيرسيسترس. الطرق الحالية لقياس اختراق المخدرات في الآفات السل تنطوي مكلفة وتستغرق وقتا طويلا في الدراسات الدوائية الحيوي إلى جانب تقنيات بيواناليتيكال أو التصوير. واقترح في المختبر قياس المخدرات ملزمة لجزيئات كاسيوم كبديل لهذه التقنيات منذ هذا الربط يعيق الانتشار السلبي لجزيئات الدواء من خلال الكالسيوم. التوازن السريع غسيل الكلى هو نظام سريع وموثوق بها لأداء بروتين البلازما والدراسات ملزمة الأنسجة. في هذا البروتوكول، استخدمنا جهاز غسيل الكلى السريع (ريد) لقياس المخدرات ملزمة لمجانسة من الكالسيوم وهذا هو زيسمن آفات وتجويف الأرانب المصابة بالسل. يصف البروتوكول أيضا كيفية إنشاء مصفوفة بديلة من الدهون تحميل ثب-1 الضامة لاستخدامها بدلا من الكالسيوم. هذا فحص الكالسيوم / البديل ملزمة هو أداة هامة في اكتشاف المخدرات السل ويمكن تكييفها للمساعدة في دراسة توزيع المخدرات في الآفات أو الخراجات الناجمة عن أمراض أخرى.
Introduction
علاج مرض السل الرئوي يتطلب التوزيع الفعال للأدوية إلى أنواع مختلفة من الآفات. آفات الميتة وتجاويف تحتوي على مراكز الجبني التي تأوي مجموعات سكانية فرعية من البكتيريا 'دائمة' أو متسامحة المخدرات. ويرتبط 1، 2 مرض جوفي مع معدلات الشفاء متدنية وسوء أحوال الطقس. وقد أظهرت 3 و 4 دراسات سابقة، وذلك باستخدام التقنيات الكمية والتصوير، أن القدرة على اختراق caseum تختلف بشكل كبير من الطبقة دواء واحد إلى آخر. 5، 6 هذه الطرق، ومع ذلك، تتطلب استخدام نماذج العدوى الحيوانية التي تكون بطيئة ومملة. وقد تم تصميم مقايسة في المختبر الذي يقيس المخدرات ملزمة لخارج الحي caseum. هذا الربط وجدت لربط عكسيا مع انتشار المخدرات في حبيبية الجبني، وبالتالي، هوتستخدم كأداة تنبؤية. 7
ويعتبر التوازن غسيل الكلى نهج الذهب القياسية لبروتينات البلازما الدراسات ملزمة. يوفر جهاز غسيل الكلى السريع (ريد) نظام سريع وسهل الاستخدام وموثوق به لإجراء مثل هذه المقايسات. 8 يتكون الجهاز من مكونين: واحد-- استخدام، المتاح إدراج تتألف من 2 غرف مفصولة اسطوانة عمودية من غشاء شبه-- نفاذية؛ و لوحات قاعدة يمكن إعادة استخدامها التي يمكن أن تعقد ما يصل إلى 48 إدراج في وقت واحد. غشاء غسيل الكلى لديه 8 كيلو دالتون الوزن الجزيئي قطع (موكو) التي هي مثالية للدراسات ملزمة جزيء المخدرات. ارتفاع نسبة مساحة إلى حجم وحدة من غشاء مقصورة يسمح الغسيل السريع و موازنة. وقد تم التحقق من كل من إدراج ولوحة قاعدة للحد الأدنى ملزمة غير محددة. الجمع بين الجهاز الأحمر مع تقنيات بيواناليتيكال يوفر تقديرات دقيقة للكسور غير منضم من المخدرات في صlasma. 8 ، 9
على الرغم من أن أصلا مصممة لقياس بروتين البلازما ملزمة، وقد تم استخدام الجهاز الأحمر في العديد من الدراسات ملزمة الأنسجة باستخدام التجانس. 10 ، 11 في هذا البروتوكول، نقيس المخدرات ملزمة لكاسيوم، الحطام نخرية استئصال من الآفات نخر وتجويف الأرانب المصابة بالسل. طبيعة خلوية وغير الأوعية الدموية من المواد الكاجي يجعل من السهل التجانس في تعليق متجانسة التي تتوافق مع الفحص.
وبالنظر إلى أن كاسيوم مملة لإنتاج ويصعب أن تأتي من قبل، كما تم التحقق من صحة البروتوكول لاستخدامها مع مصفوفة بديلة التي يتم إعدادها من البلاعم رغوي. وتتسبب الضامة المستمدة من خلية واحدة من ثب-1 بحمض الأوليك لتراكم أجسام دهنية متعددة تعطيها مظهرها "الرغوي". يتم حصاد هذه الخلايا محملة الدهون ومعالجتها لإنتاج مصفوفة التي نستخدمها كبديل ل كاسوم. وقد أظهرت هذه الدراسة أن المخدرات ملزمة لهذه المصفوفة البديلة يرتبط بشكل جيد مع ملزم إلى الكالسيوم، محاكاة على نحو فعال في عملية الجسم الحي الذي يعيق اختراق المخدرات في جوهر الكاحل من حبيبي وتجويف.
Access restricted. Please log in or start a trial to view this content.
Protocol
أجريت جميع الدراسات الحيوانية وفقا لدليل لرعاية واستخدام الحيوانات المختبرية للمعاهد الوطنية للصحة مع موافقة من اللجنة المؤسسية رعاية الحيوان واستخدام نيد (نيه)، بيثيسدا، مد. أجريت جميع الدراسات التي شملت M. السل في مختبر مع مستوى السلامة الاحتواء 3 (بسل-3).
1. أرنب العدوى نموذج ومجموعة كاسوم
- إصابة نيوزيلندا الأرانب البيضاء مع M. السل باستخدام نظام التعرض الهباء الأنف فقط كما هو موضح سابقا. 12 ، 13 السماح للعدوى إلى التقدم لمدة 12-16 أسابيع. يخدع الأرانب مع 35 ملغ / كغ من الكيتامين و 5 ملغ / كغ زيلازين العضل، الموت ببطء الأرانب مع 0.22 مل / كغ بينتوباربيتال الصوديوم والفينيتوين الصوديوم عن طريق الوريد والمضي قدما في نكروبسيز.
- باستخدام ملاقط ومشرط، وإزالة الرئتين من الصدر كاليفورنياvity. من كل الفص الرئة، تشريح تجاويف الفردية والأورام الحبيبية نخرية كبيرة باستخدام مشرط. كشط بعناية من كاسوم من تجويف والجدران الورم الحبيبي. وزن وتسجيل وتخزين العينات في 2 مل أنابيب المسمار المغطاة في -20 درجة مئوية حتى جاهزة للاستخدام.
- غاما-إراديت عينات الكالسيوم المعدية في 3 ميغراد على الجليد الجاف لجعلها غير مأمونة وآمنة للاستخدام في مختبر بسل-2.
2. في المختبر جيل من كيسوم بديل من خلايا ثب-1
- تنمو ثب-1 حيدات في رمي 1640 المتوسطة (2 ملي L- الجلوتامين و 10٪ مصل بقري جنيني) في T175 قوارير ثقافة الخلية (80 مل / قارورة). احتضان القوارير في 5٪ كو 2 الغلاف الجوي عند 37 درجة مئوية لمدة 3-4 أيام.
- الطرد المركزي الثقافة من قارورة T175 في اثنين 50 مل أنابيب مخروطية في 150 x ج لمدة 5 دقائق. تجاهل طاف وتعليق بيليه في 10 مل من رمي 1640 وسائل الإعلام.
- ماصة 5 ميكرولتر من هذه الثقافة إلى أنبوب 1.5 مل تحتوي على 45 ميكرولتر من رالأزرق الأزرق. مزيج جيدا بيبتينغ. نقل 10 ميكرولتر إلى عدادة الكريات وعدد عدد من حيدات ثب-1 قابلة للحياة (غير ملوثين) باستخدام المجهر الضوئي (10X التكبير). حساب عدد الخلايا القابلة للحياة لكل مل من الثقافة. تمييع ذلك مع وسائل الإعلام رمي إلى الكثافة النهائية من 1.25 × 10 6 خلايا / مل.
- تحميل 40 مل من الثقافة على لوحة زراعة الخلايا الكبيرة (50 × 10 6 خلايا / لوحة). إضافة 40 ميكرولتر من 100 ميكرومتر سلطة النقد الفلسطينية (فوربول 12-myristate13 أسيتات أعدت في الإيثانول) والسماح للخلايا على الالتزام بين عشية وضحاها في الحاضنة.
ملاحظة: تركيز النهائي من سلطة النقد الفلسطينية هو 100 نانومتر. - تمييع حمض الأوليك النقي (أوا) (0.89 غرام / مل) في الإيثانول إلى تركيز 0.1 M ( أي 31.7 ميكرولتر الزراعة العضوية في 968.3 ميكرولتر الإيثانول). تمييع هذا الحل في وسائل الإعلام رمبي قبل تحسنت جديدة إلى تركيز 10 ملم. تمييع هذا تعليق أوا إلى 0.4 ملم (تركيز العمل النهائي) في رمي المتوسطة قبل تحسنت إلى 37 درجة مئوية.
- إزالة الوسائط الموجودة وغيرخلايا -edhered من لوحات ثقافة الخلية وإضافة بلطف 40 مل من 0.4 مم الزراعة العضوية إلى الضامة ثب-1 (ثب-M). احتضان عند 37 درجة مئوية في الحاضنة بين عشية وضحاها.
- استخدام المجهر الضوئي في التكبير 40X لتأكيد بصريا وجود العديد من الشحوم الجسم الدهون في كل ثب-M. إزالة جميع المتوسطة رمي من لوحات زراعة الخلايا وغسل بلطف الخلايا الملتصقة مرتين مع الفوسفات مخزنة المالحة (بس) باستخدام ماصة 50 مل المصلية.
ملاحظة: تظهر الهيئات الدهنية هياكل صغيرة، واضحة، كروية في السيتوبلازم من ثب-M. - إضافة 40 مل من 5 ملي إثيلينديامينيتتراسيتيك حمض (إدتا) في برنامج تلفزيوني لكل لوحة. احتضان لمدة 15 دقيقة عند 37 درجة مئوية.
- فصل الضامة رغوي (فم) من قبل بيبتينغ مرارا وتكرارا صعودا وهبوطا على سطح لوحة كاملة باستخدام ماصة 10 مل المصلية. نقل تعليق خلية إلى أنبوب مخروطي 50 مل وتدور باستمرار في 150 x ج لمدة 5 دقائق.
- ريسوسبيند بيليه الخلية في 10 مل من برنامج تلفزيوني (ثالث بس غسل) أونقل إلى أنابيب مخروطية قبل وزنها 15 مل. تدور باستمرار مرة أخرى في 150 x ج لمدة 5 دقائق. نضح بعناية طاف باستخدام ماصة المصلية وتجاهل.
- موضوع الكريات فم إلى 3 دورات تجميد ذوبان الجليد إلى ليز الخلايا واحتضان لهم في 75 درجة مئوية لمدة 20-30 دقيقة لتفريق البروتينات في المصفوفة. تخزين الكريات في -20 درجة مئوية حتى جاهزة للاستخدام.
3. السريع موازنة غسيل الكلى (الأحمر) الفحص
- إعداد 10 ملي حلول الأسهم من جميع مركبات الاختبار في ثنائي ميثيل سلفوكسيد (دمسو). تمييع إلى 500 ميكرومتر حلول العمل في دمسو قبل كل فحص.
- وزن أنبوب يحتوي على الكالسيوم بديل بيليه. طرح وزن أنبوب فارغ لاستخلاص وزن بيليه وحده. إضافة 2-3 الخرز المعدنية لكل أنبوب، وذلك باستخدام الخالط الأنسجة في 1،200 السكتات الدماغية / دقيقة لمدة 1 دقيقة، وتعطيل كاسوم أو المصفوفة البديلة في برنامج تلفزيوني (1: 9 ث / ت) لتحقيق 10X تعليق المخفف من كل مصفوفة.
- ارتفاع 6.5 ميكرولتر من 500محلول ميكرومتر من مجمع الاختبار إلى 643.5 ميكرولتر من جناسة لتحقيق تركيز النهائي من 5 ميكرومتر (≤1٪ دمسو) والدوامة.
- وضع إدراج الأحمر في لوحة قاعدة. إضافة 200 ميكرولتر من المصفوفة المغطاة المخدرات في غرفة المانحة (حلقة حمراء) من كل إدراج الأحمر و 350 ميكرولتر من برنامج تلفزيوني في كل غرفة الاستقبال. إعداد 3 إدراج لكل مركب اختبار (ثلاث نسخ عينات). ختم لوحة مع ختم لوحة لاصقة واحتضان عند 37 درجة مئوية على ثيرموميكسر في 200 دورة في الدقيقة (1 زغ) لمدة 4 ساعات.
- بعد الحضانة، وخلط بلطف محتويات غرف المانحين والمتلقي من قبل بيبتينغ صعودا وهبوطا 2-3 مرات. ماصة من 20 أليكوتس ميكرولتر من جناسة من غرف المانحة وإضافة إلى 20 ميكرولتر من برنامج تلفزيوني نظيفة في أنبوب 1.5 مل (1: 1). وبالمثل، ماصة من 20 قسامة ميكرولتر من عينات بس من غرف الاستقبال وإضافة إلى 20 ميكرولتر من جناسة نظيفة (مطابقة مصفوفة). 8
ملاحظة: مصفوفة مطابقة يلغي نإد ل 2 منحنيات المعايرة منفصلة (في جناسة و بس) ليتم إجراؤها للتحليل الكمي. وقد تتسبب محتويات غرفة المانحين في الرواسب على مر الزمن. خلط بلطف محتويات بيبتينغ قبل إزالة أليكوتس.
4. لك-مس الكمي وتحليل البيانات
- إضافة 160 ميكرولتر من 1: 1 الميثانول: أسيتونتريل تحتوي على 500 نانوغرام / مل ديكلوفيناك أو 10 نانوغرام / مل فيراباميل (معيار داخلي) إلى كل أنبوب ودوامة لترسيب البروتينات. أجهزة الطرد المركزي في 10،000 x ج لمدة 5 دقائق لرسوبيات راسب ونقل سوبرناتانتس إلى 96 جيدا جيدا لوحات عميقة للتحليل اللوني السائل الطيف الكتلي (لمس) التحليل. 7
- بناء منحنيات المعايرة من 1-1،000 نانومتر لكل مجمع اختبار مع الحفاظ على نفس تكوين المصفوفة كما العينات أعلاه. تحديد تركيز مركب الاختبار في عينات من غرف المانحين والمستقبلات باستخدام طريقة لك-مس.
- احسب الجزء غير المنضم ( f u ) oو المخدرات في المصفوفة المخففة باستخدام المعادلة 1. حساب و u في مصفوفة غير مخفف باستخدام المعادلة 2 ( D = عامل التخفيف من 10). 14
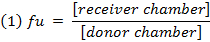
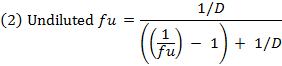
- التحقق من الانتعاش (توازن الكتلة) من كل مركب باستخدام المعادلة 3 لتحديد المركبات مع الاستقرار / الأيض / قضايا ملزمة غير محددة.
ملاحظة: الانتعاش عادة ما يتراوح بين 70٪ و 130٪. 15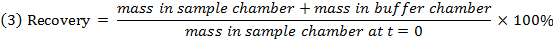
Access restricted. Please log in or start a trial to view this content.
النتائج
باستخدام هذا البروتوكول، قمنا باختبار مئات من مركبات تطوير المخدرات السل للكفاءة المتوقعة في اختراق الكالسيوم. الشكل 1 يتصور المفاهيم الأساسية للمقايسة الحمراء. غشاء غسيل الكلى من إدراج الأحمر يسمح للجزيئات الصغيرة غير منضم إلى منتشر من ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
الآفات الميتة الرئوية والتجويف في المرضى المصابين بالسل تحتوي على مجموعات سكانية فرعية من البكتيريا التي تعاد إلى العلاج من تعاطي المخدرات. النوى الحلقية لهذه الهياكل هي المسؤولة بشكل خاص عن إيواء هذه بيرسيسترس في بيئة خارج الخلية. ويعتقد أن التوزيع المواتي لعوامل ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
لا توجد مصالح مالية متنافسة.
Acknowledgements
نود أن نشكر جونسون آند جونسون، تحالف السل، أسترا زينيكا، ريب-X و تريوس العلاجية لتوفير بيداكيلين، با-824 (بريتمانيد)، AZD5847، راديزوليد و تيديزوليد، على التوالي. بريندان بريدو، ماثيو زيمرمان، ستيفن جوزوين، إيما ري جورادو، نانسي راول، ليان لي و دانيال وينر قدمت الدعم مع تحليل مالدي، أساليب التحليلية البيولوجية، وإعداد بديل الكالسيوم، التركيب الكيميائي، وعزل الكالسيوم الأرنب. وقد تم هذا العمل بتمويل من مؤسسة بيل وميليندا غيتس، وجائزة # OPP1044966 و OPP1024050 إلى V. دارتواز، المعاهد الوطنية للصحة تقاسم الأجهزة منحة S10OD018072، فضلا عن التمويل المشترك من مؤسسة بيل وميليندا غيتس و ويلكوم الثقة لمركز التميز لتحسين الرصاص لأمراض العالم النامي إلى P. وايت.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| New Zealand White Rabbits | Covance | - | |
| HN878 Mycobacterium tuberculosis | BEI Resources | NR-13647 | |
| Ketathesia (Ketamine) 100 mg/mL C3N | Henry Schein Animal Health | 56344 | |
| Anased (Xylazine) 100 mg/mL | Henry Schein Animal Health | 33198 | |
| Euthasol (pentobarbital sodium and phenytoin sodium) Solution | Virbac | 710101 | |
| THP-1 monocytic cell line | ATCC | ATCC TIB-202 | |
| 175 cm² TC-Treated Flask (T175) | Fisher Scientific | T-3400-175 | |
| RPMI 1640 media w/o glutamine | Fisher Scientific | MT-15-040-CV | |
| Hyclone Fetal Bovine Serum, Gamma irradiated | Fisher Scientific | SH3091003IR | |
| Hyclone L-glutamine, 200 mM | Fisher Scientific | SH3003401 | |
| Cellstar TC dish, 145 mm x 20 mm, vented | Fisher Scientific | T-2881-1 | |
| Phorbol 12-myristate 13-acetate (PMA) | Fisher Scientific | BP685-1 | |
| Ethylenediaminetetraacetic acid | Sigma | E6758 | |
| Oleic acid | Fisher Scientific | ICN15178101 | |
| Pierce RED Device Reusable Base Plate | Fisher Scientific | PI-89811 | |
| Pierce RED Device Inserts, 50/box | Fisher Scientific | PI-89809 | |
| Pierce RED insert removal tool | Fisher Scientific | 89812 | |
| Adhesive plate seal | Fisher Scientific | 08-408-240 | |
| PBS, pH 7.4, 10x 500 mL (Gibco) | Life Technologies | 10010-049 | |
| DMSO | Sigma | 472301 | |
| Acetonitrile | Sigma | 34998 | |
| Methanol | Sigma | 34860 | |
| Verapamil hydrochloride | Sigma | V4629 | |
| Diclofenac sodium salt | Sigma | 93484 | |
| Trypan Blue Solution, 0.4% | Fisher Scientific | 15-250-061 | |
| Ethanol, 200 proof | Fisher Scientific | 04-355-451 | |
| 2010 Geno/Grinder | SPEX SamplePrep | 2010 | |
| Bead Mill Homogenizer Accessory, Metal Bulk Beads | Fisher Scientific | 15-340-158 | |
| 484R Cobalt 60 Irradiator | JL Shepard | 7810-484-1 | |
| INCYTO C-Chip Disposable Hemacytometers | Fisher Scientific | 22-600-100 | |
| Upright Light Microscope | Leica | DM1000 | |
| Binary Liquid Chromatography system | Agilent | 1260 | Multi-compenent |
| Mass spectrometer | AB Sciex | 4000 |
References
- Sacchettini, J. C., Rubin, E. J., Freundlich, J. S. Drugs versus bugs: in pursuit of the persistent predator Mycobacterium tuberculosis. Nat Rev Microbiol. 6 (1), 41-52 (2008).
- Zhang, Y. Persistent and dormant tubercle bacilli and latent tuberculosis. Front Biosci. 1 (9), 1136-1156 (2004).
- Aber, V. R., Nunn, A. J. Short term chemotherapy of tuberculosis. Factors affecting relapse following short term chemotherapy. Bull Int Union Tuberc. 53 (4), 276-280 (1978).
- Chang, K. C., Leung, C. C., Yew, W. W., Ho, S. C., Tam, C. M. A nested case-control study on treatment-related risk factors for early relapse of tuberculosis. Am J Respir Crit Care Med. 170 (10), 1124-1130 (2004).
- Dartois, V. The path of anti-tuberculosis drugs: from blood to lesions to mycobacterial cells. Nature Rev Microbiol. 12 (3), 159-167 (2014).
- Prideaux, B., et al. The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med. 21 (10), 1223-1227 (2015).
- Sarathy, J. P., et al. Prediction of Drug Penetration in Tuberculosis Lesions. ACS Infect Dis. 2 (8), 552-563 (2016).
- Waters, N. J., Jones, R., Williams, G., Sohal, B. Validation of a rapid equilibrium dialysis approach for the measurement of plasma protein binding. J Pharm Sci. 97 (10), 4586-4595 (2008).
- Singh, J. K., Solanki, A., Maniyar, R. C., Banerjee, D., Shirsath, V. S. Rapid Equilibrium Dialysis (RED): an In-vitro High-Throughput Screening Technique for Plasma Protein Binding using Human and Rat Plasma. J Bioequiv Availab. 14, 1-4 (2012).
- Liu, X., et al. Unbound drug concentration in brain homogenate and cerebral spinal fluid at steady state as a surrogate for unbound concentration in brain interstitial fluid. Drug Metab Dispos. 37 (4), 787-793 (2009).
- Able, S. L., et al. Receptor localization, native tissue binding and ex vivo occupancy for centrally penetrant P2X7 antagonists in the rat. Br J Pharmacol. 162 (2), 405-414 (2011).
- Subbian, S., et al. Chronic pulmonary cavitary tuberculosis in rabbits: a failed host immune response. Open Biol. 1 (4), 1-14 (2011).
- Via, L. E., et al. Tuberculous Granulomas are Hypoxic in Guinea pigs, Rabbits, and Non-Human Primates. Infect Immun. 76 (6), 2333-2340 (2008).
- Kalvass, J. C., Maurer, T. S. Influence of nonspecific brain and plasma binding on CNS exposure: implications for rational drug discovery. Biopharm Drug Dispos. 23 (8), 327-338 (2002).
- Di, L., Umland, J. P., Trapa, P. E., Maurer, T. S. Impact of recovery on fraction unbound using equilibrium dialysis. J Pharm Sci. 101 (3), 1327-1335 (2012).
- Lenaerts, A. J., et al. Location of persisting mycobacteria in a Guinea pig model of tuberculosis revealed by r207910. Antimicrob Agents Chemother. 51 (9), 3338-3345 (2007).
- Prideaux, B., et al. High-sensitivity MALDI-MRM-MS imaging of moxifloxacin distribution in tuberculosis-infected rabbit lungs and granulomatous lesions. Anal Chem. 83 (6), 2112-2118 (2011).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved