Method Article
فلاش وتجميد: تقنية جديدة لالتقاط غشاء حيوية مع المجهر الإلكتروني
In This Article
Summary
قمنا بتطوير تقنية جديدة في المجهر الإلكتروني، "فلاش والتجميد" التي تمكن من تصور ديناميات الغشاء مع مللي القرار الزماني. هذا الأسلوب يجمع بين التحفيز علم البصريات الوراثي للخلايا العصبية مع ارتفاع ضغط التجمد. هنا، علينا أن نظهر للإجراءات ووصف البروتوكولات في التفاصيل.
Abstract
خلايا باستمرار تغيير بنية الغشاء وتوزيع البروتين، ولكن من الصعب للغاية تصور هذه الأحداث في القرار الزماني والمكاني بناء على أمر من مللي ونانومتر، على التوالي. لقد قمنا بتطوير تقنية وقت حل المجهر الإلكتروني، "فلاش وتجميد،" أن يدفع الأحداث الخلوية مع علم البصريات الوراثي ويتصور ديناميات غشاء الناجم عن تجميد الخلايا في نقاط زمنية محددة بعد التحفيز. وللتدليل على هذه التقنية، عبرنا عن channelrhodopsin، قناة الموجبة حساسة للضوء، في الخلايا العصبية الماوس الحصين. ومضة من الضوء يحفز نشاط الخلايا العصبية ويؤدي الافراج عن العصبي من المحطات متشابك من خلال اندماج الحويصلات متشابك. ويقترن التحفيز علم البصريات الوراثي للخلايا العصبية مع الضغط العالي تجميد لمتابعة التغيرات المورفولوجية أثناء انتقال متشابك. باستخدام أداة التجاري، ألقينا القبض على اندماج الحويصلات متشابك وانتعاش synaptic غشاء الحويصلة. لتصور تسلسل الأحداث، تم إنشاء مجموعات كبيرة من البيانات وتحليلها بصورة عمياء، منذ أن يتبع تغيرات شكلية في خلايا مختلفة على مر الزمن. ومع ذلك، ومضة وتجميد يسمح التصور من ديناميات غشاء في الميكروسكوب الإلكتروني مع مللي القرار الزماني.
Introduction
تصور الغشاء والبروتين ديناميكية داخل الخلية هو خطوة رئيسية نحو فهم بيولوجيا الخلايا لعمليات معينة. يمكن التقاط الأحداث الاتجار الديناميكي باستخدام ضوء أو مضان المجهر. ومع ذلك، فإن السياق التحت خلوية مفقود إلى حد كبير في مثل هذه الصور لأن الهياكل التحت خلوية لا يمكن تماما "رسمت" من الأصباغ أو تحقيقات الفلورسنت وحل مكانيا وطيفيا 1 و 2. من ناحية أخرى، في حين المجهر الإلكتروني يمكن أن ترسم العمارة التحت خلوية في التفاصيل الرائعة، فإنه لا يمكن التقاط ديناميات الخلوية، وذلك لأن العينات يجب أن تكون ثابتة قبل التصوير. وبالتالي، فمن عادة لا يكفي لفهم تماما ديناميات الخلوية باستخدام واحد فقط تصوير الطريقة.
للتغلب على القيود المفروضة على الضوء والمجهر الإلكتروني، فقد تم تطوير تقنيات المجهر المترابطة. متلازم الضوء والمجهر الإلكتروني(CLEM) يتصور ديناميكية داخل الخلايا باستخدام المجهر الضوئي والبنى التحت خلوية الأساسية مع المجهر الإلكتروني. في CLEM، وخلايا تعمل في مختلف العمليات، مثل الانقسام السيتوبلازمي والإلتقام 3، 4، 5، 6، ويعيش تصوير ومن ثم معالجتها لالمجهر الإلكتروني. وعلى الرغم من CLEM يلتقط بعض جوانب الديناميات داخل الخلايا، وهناك أربعة عوامل تحد من جدوى هذا النهج. أولا، هو القرار الزماني محدودة بسبب سرعة يمكن يجمد الخلايا، والتي تأخذ عادة ق - دقيقة بسبب انتشار بطيء ورد فعل مثبتات 7. آخر الثانية، لوحظ العمارة التحت خلوية الفعلي 8؛ وبالتالي، فإن التغيرات المورفولوجية الحيوية لا يمكن الحصول عليها باستخدام هذا النهج. ثالثا، الميكروسكوب مضان والإلكترون لا يمكن محاذاة على وجه التحديد بسبب ش الأنسجةrinkage الناجمة عن الجفاف خلال إعداد العينات للفحص المجهري الإلكترون 9 و 10. رابعا، أحداث مثل الانقسام السيتوبلازمي والإلتقام لا تجري في نفس الوقت في كل خلية 5، 11، وبالتالي، لا بد من التعرف على خلية معينة التي تعمل في هذا الحدث من عدد كبير من الخلايا. هذه العملية غالبا ما تكون شاقة. وبالتالي، من الضروري طريقة جديدة للحث على أحداث معينة في كل خلية وللقبض على ديناميات الخلوية الناجم عن ذلك تجميد السريع للخلايا في نقطة زمنية محددة.
مؤخرا، تم تطوير العديد من الأدوات للحث على وجه الخصوص ديناميات الخلوية باستخدام الضوء (علم البصريات الوراثي). Channelrhodopsin هو، قناة الموجبة غير انتقائية حساسة للضوء معزولة عن كلاميدوموناس reinhardtii 12 و 13. عندما يتم التعبير عن channelrhodopsin في neuronaالأغشية لتر، ومضة قصيرة من الضوء يدفع تدفق أيونات الصوديوم إلى الخلايا العصبية ويؤدي هذا العمل المحتملين 14 و 15. ثم ينتشر إمكانات العمل في محطات متشابك، حيث تلتحم الحويصلات المشبكية خلال أجزاء من الثانية 16، 17، 18 لذلك، channelrhodopsin يدفع نشاط الخلايا العصبية. لمتابعة الديناميات الغشاء في محطات متشابك، يجب أن يجمد الخلايا العصبية عند نقاط زمنية محددة بعد التحفيز مع مللي الدقة.
لالتقاط ديناميات غشاء بعد حمل نشاط الخلايا العصبية، ونحن إلى جانب التحفيز خفيفة مع ارتفاع ضغط تجميد 17 و 18 و 19. الضغط العالي تجميد يسمح لتجميد شبه لحظية من الخلايا مع انخفاض الجليد تشكيل الكريستال 20. بلورات الثلج كاليفورنيان تمزق الأغشية وتعطيل العمارة التحت خلوية 21. من خلال تغيير فترات زمنية بين التحفيز والتجميد، تم القبض على الاتجار غشاء داخل محطات متشابك بعد تحريض من إمكانات العمل.
هنا، علينا أن نظهر الإجراءات التجريبية باستخدام تجاريا الفريزر الضغط العالي أن الأزواج تحكم مللي الزمنية من التحفيز خفيفة مع ارتفاع ضغط التجمد. وخلافا لغيرها من الصكوك التي تتطلب جهاز خارجي للسيطرة على التحفيز خفيفة والتجميد، تم دمج التحفيز الضوء بالكامل في هذا النظام، ويمكن تطبيقها مع مللي الدقة 19. وتنطوي هذه العملية متعددة الخطوات. 1) الخلايا العصبية ماوس الحصين يتم تربيتها على الأقراص الياقوت والمصابة مع الفيروسة البطيئة تحمل ناقلات التعبير عن channelrhodopsin 18. 2) يتم تحفيز الخلايا العصبية وجمدت عند نقاط زمنية محددة بعد التحفيز. 3) الماء المزجج هو البديلد مع المذيبات العضوية، في حين أن الدهون والبروتينات عبر ربط بواسطة مثبتات للحفاظ على بنية الخلايا. 4) مخترقة العينات وجزءا لا يتجزأ من راتنجات الايبوكسي. 5) يتم جمعها أقسام سامسونج باستخدام مشراح مستدق. 6) يتم تصوير مقاطع رقيقة على المجهر الإلكتروني النافذ. 7) يتم تنفيذها الحصول على الصور وتحليلها بصورة عمياء فيما يتعلق بالنقاط الوقت أو المورثات. يمكن تحديد ديناميات الخلوية من خلال إعادة بناء الصور وقت حل 17 و 18. إعداد نموذج (الخطوات 2-5 أعلاه) يتطلب الأسبوع، ولكن تحليل الصور اللاحقة يتطلب أشهر إلى سنة.
Protocol
أجريت جميع التجارب وفقا لقواعد ولوائح استخدام الحيوانات من قبل المعاهد الوطنية للصحة. وتمت الموافقة على البروتوكول من قبل لجنة رعاية واستخدام الحيوان (IACUC) في كلية جونز هوبكنز للطب.
1. العزلة والثقافة من الخلايا العصبية الحصين ماوس
- تشريح القشور من يوم بعد الولادة 0 - 2 يوم (P0 - 2) مخ الفأر (18). عزل الخلايا النجمية من القشور.
ملاحظة: تم عزل مخ الفأر بعد قطع الرأس. الخلايا النجمية بمثابة طبقة المغذية للخلايا العصبية قرن آمون. - علاج القشور مع 800 ميكرولتر من 0.05٪ التربسين-EDTA لمدة 15 دقيقة عند 37 ° C لفصل الخلايا النجمية.
- ثقافة الخلايا النجمية في قارورة T-75 مع 13 مل من DMEM تحتوي على 10٪ مصل بقري جنيني (FBS) و 0.2٪ البنسلين الستربتوميسين لمدة أسبوع واحد على 37 درجة مئوية و 5٪ CO 2.
- وضع 18 ملم المؤسسة العامة الزجاج ساترة واحد حمض غسلها وتعقيمهاص بئر من لوحة ال 12 أيضا.
- غسل لفترة وجيزة قرصين الياقوت الكربون المغلفة 6 ملم في 70٪ من الإيثانول ووضعها على رأس كل ساترة الزجاج.
- إعداد بولي-D-ليسين (PDL) حل عن طريق خلط 3 مل من 17 نانومتر حمض الخليك مع 1 مل من ذيل فأر الكولاجين و 1 مل من PDL (1 ملغ / مل). تطبيق 200 ميكرولتر من محلول PDL إلى الأقراص الياقوت والزجاج coverslips لمدة 5 دقائق على RT.
- إزالة حل PDL والهواء الجاف. قبل استخدامها، وتعقيم لوحة كما أعد الخطوات 1،4-1،6 لمدة 30 دقيقة تحت ضوء الأشعة فوق البنفسجية.
- البذور الخلايا النجمية من الخطوة 1.3 في 2 مل من DMEM في كثافة 5X10 4 خلايا / جيد في لوحة كما أعد الخطوات 1،4-1،6. تنمو لهم عند 37 درجة مئوية و 5٪ CO 2 لمدة أسبوع واحد.
- إضافة 20 ميكرولتر من الفلورية deoxyuridine (تركيز النهائي: 80 ميكرومتر) إلى كل بئر لبضع ساعات على الأقل قبل زراعة الخلايا العصبية.
ملاحظة: الفلورية deoxyuridine يتوقف تقسيم نجمية. - تغيير المتوسط إلى 1.5 مل من الخلايا العصبية بسآل المتوسطة (انظر جدول المواد) التي تحتوي على 1٪ L-ألانيل-L-الجلوتامين (انظر جدول المواد)، 2٪ الملحق المصل خالية من الخلايا العصبية (انظر جدول المواد)، و 0.2٪ البنسلين الستربتوميسين .
- يعد حل غراء بإضافة 20 وحدة من غراء إلى 5 مل من محلول أنزيم (1.65 ملي سيستين، 1 ملم CaCl 2، و 0.5 ملي EDTA في DMEM). يحمض الحل عن طريق تمرير CO 2 الغاز لمدة 20 دقيقة. تصفية تعقيم مع فلتر 0.22 ميكرون.
- حصاد الدماغ من P0 - 2 الماوس 18. على الفور نقل الدماغ على الجليد الباردة متوازنة Hanks'-محلول الملح (HBSS). تشريح الحصين تحت مجهر تشريحي، والحفاظ على الأنسجة مغمورة في HBSS.
- ضع الحصين اثنين في 1 مل من محلول غراء أعدت في الخطوة 1.11. احتضان لمدة 1 ساعة على thermomixer عند 37 درجة مئوية و 750 دورة في الدقيقة.
- استبدال غراء مع 1 مل من محلول يحتوي على تعطيل2.5 ملغ من مثبط التربسين و 0.5 ملغ من الزلال في مل من DMEM. احتضان لمدة 5 دقائق عند 37 درجة مئوية. نضح قبالة الحل تعطيل.
- إضافة 200 ميكرولتر من المتوسط القاعدية الخلايا العصبية (انظر الجدول المواد) إلى الحصين معزولة. يسحن باستخدام 200 ميكرولتر ماصة لفصل الخلايا. انتظر حتى تستقر الخلايا undissociated في القاع. إزالة بعناية المتوسطة مع خلايا من أعلى.
- كرر الخطوة 1.15 3X. تجمع كل فصل الخلايا في 1.5 أنبوب جديد للطرد المركزي مل.
- حساب عدد الخلايا باستخدام عدادة الكريات. الخلايا العصبية لوحة في كثافة 6.5 × 10 4 خلايا جيدا / على رأس الطبقة نجمية أعد الخطوات 1،1-1،10.
- تصيب الخلايا العصبية مع الفيروسة البطيئة معربا عن channelrhodopsin في DIV 3 (3 د في المختبر) 18.
- أداء فلاش وتجميد DIV 14، كما هو موضح في الخطوات 2،1-2،5 أدناه.
2. فلاش لد-تجميد
- إعداد تثبيتي
- تحت غطاء الكيميائية، إضافة المواد التالية إلى أنبوب مخروطي الشكل لإعداد مثبت: 2.5 مل من غلوتارالدهيد (الأسهم 10٪ في الأسيتون)، 0.25 غرام من رباعي أكسيد الأوزميوم، 0.25 مل من الماء، و22.25 مل من الاسيتون اللامائية.
ملاحظة: يجب أن يكون تركيز النهائي من كل مكون 1٪ في الأسيتون. يضاف غلوتارالدهيد للحفاظ على الهياكل بروتين خلال تجميد تبديل. تنبيه: السمية الحادة من رباعي أكسيد الأوزميوم مرتفع. التعرض لأبخرة قد يؤدي إلى تلف القرنية من العين. وينبغي أن يكون التعامل معها فقط في غطاء الكيميائية المعتمدة. - قسامة 1 مل من تثبيتي في قوارير المبردة مرقمة (2 مل). الحفاظ على تثبيتي المجمدة في النيتروجين السائل حتى الاستخدام.
ملاحظة: رباعي أكسيد الأوزميوم وغلوتارالدهيد عبر التفاعل ويعجل. وبالتالي، ويخلط مرة واحدة، قسامة على الفور، وكأب الأنابيب، وغمر cryotubes في النتروجين السائل لتجميد مثبت. استخدام قلم رصاص لترقيم البردقارورة الجينى، يمكن الأسيتون منذ يغسل علامات.
- تحت غطاء الكيميائية، إضافة المواد التالية إلى أنبوب مخروطي الشكل لإعداد مثبت: 2.5 مل من غلوتارالدهيد (الأسهم 10٪ في الأسيتون)، 0.25 غرام من رباعي أكسيد الأوزميوم، 0.25 مل من الماء، و22.25 مل من الاسيتون اللامائية.
- إعداد المالحة الفسيولوجي
- جعل محلول ملحي الفسيولوجية عن طريق خلط HEPES (10 ملم، ودرجة الحموضة 7.5)، كلوريد الصوديوم (140 ملم)، بوكل (2.4 ملم)، والجلوكوز (10 ملم).
ملاحظة: هذه القيم هي تركيزات النهائي. لا تستخدم البرد وقاية للثقافات أحادي الطبقة. ومع ذلك، لا بد من الصحيح البرد حاصن لعينات أكثر سمكا من 5 ميكرون. ينصح عادة استخدام 20٪ BSA. ويمكن أيضا معجون الخميرة وكولاي OP50 أن تستخدم البرد وقاية ليرقات ذبابة أو C. ايليجانس. - إضافة CaCl 2 في 4 مم وMgCl 2 في 1 ملم تركيزات النهائي.
ملاحظة: تركيزات CaCl 2 و MgCl 2 تختلف باختلاف التجارب. لضمان القبض على سيطة exocytic، يتم استخدام 4 ملي الكالسيوم لهذه التجارب خاصة لزيادة احتمال الافراج عن حويصلات 18. - افحص الالأسمولية باستخدام مقياس التناضح. تأكد من أنها 300 ± 5 الميلي أسمول.
- إضافة أمبا مستقبلات (NBQX) إلى التركيز النهائي من 3 ميكرومتر وGABA مستقبلات (bicuculline) إلى تركيز النهائي من 30 ميكرومتر.
ملاحظة: يتم إضافة مضادات مستقبلات العصبي لتجنب نشاط الشبكة المتكررة التالية تحفيز الخلايا العصبية (18). - الاحماء المالحة الفسيولوجية إلى 37 درجة مئوية لاستخدامها.
- جعل محلول ملحي الفسيولوجية عن طريق خلط HEPES (10 ملم، ودرجة الحموضة 7.5)، كلوريد الصوديوم (140 ملم)، بوكل (2.4 ملم)، والجلوكوز (10 ملم).
- إعداد المتخصصة عالية الضغط الفريزر وحدة الآلي تجميد تبديل
- قبل ارتفاع ضغط التجميد، يبرد وحدة استبدال تجميد الآلي إلى -90 ° C عن طريق ملء خزان مع النيتروجين السائل.
- تهدئة الأسيتون في كوب صغير إلى -90 ° C عن طريق وضعها داخل غرفة العينة.
- ملء ديوار النتروجين السائل وديوار تخزين الثلاجة الضغط العالي (انظر الجدول المواد) مع نيترو السائلجنرال.
- إعداد بروتوكول التحفيز الضوء باستخدام شاشة العرض التي تعمل باللمس.
- اسم البرنامج من خلال النقر على "تحرير" بجانب "اسم البرنامج" في إطار التحفيز خفيفة. سوف نافذة أخرى يطفو على السطح.
- إعداد برنامج عن طريق كتابة "15000 مللي" في "مرحلة مظلمة"، "100 مللي" في "الفترة"، "10 مللي ثانية" في "نبض"، و "1" في "عدد من فترات" من أجل التحفيز واحد من 10 الآنسة. تجميد الخلايا بعد 90 مللي ثانية (الشكل 1C).
ملاحظة: "مرحلة مظلمة" تسمح للخلايا للتعافي من التعرض للضوء أثناء تحميل عينة. "الفترة" يحدد وتيرة التحفيز. على سبيل المثال، إذا كان ينبغي تطبيق التحفيز في 20 هرتز، يجب تعيين هذا العمود في 50 مللي ثانية. "نبض" يحدد مدة التحفيز خفيفة. وأخيرا، فإن "عدد الفترات" يحدد عدد من المحفزات تطبيقها. لإنشاء التحفيز عالية التردد، يرجى الاطلاع الشكل 1E.
- ل"لا التحفيز" السيطرة، اكتب "15 ثانية" في "مرحلة مظلمة"، "0 مللي" في "الفترة"، "1 مللي" في "نبض"، و "0" في "عدد الفترات" في ضوء إطار الإعداد التحفيز، كما هو موضح في الخطوة 2.3.4.
ملاحظة: افتراضيا، "نبض" يجب أن يكون على الأقل 1 مللي ثانية. - على الشاشة الرئيسية، تأكد من أن مربع لتحفيز ضوء محددا.
- إعداد بروتوكول التخزين بالنقر على "عينة التخزين" على الشاشة الرئيسية. انقر على "تحرير". في النافذة التالية، استخدم "+" أو "-" لتحديد "2" لتخزين 2 الأقراص في كل قناة (3 قنوات في المجموع). تحقق "تمكين التخزين LN2."
- تحميل العينة وتجميد في الثلاجة الضغط العالي
تتم جميع تجميع عينة والتحميل خطوات تحت مجهر تشريحي مع مجموعة 7.5-60X التكبير: ملاحظة. A tweezيستخدم إيه في الخطوات 2.4.1 - 2.4.4 لمعالجة العينات. يجب إجراء التجارب في درجة حرارة الفسيولوجية.- ضع القرص الياقوت واحد، الجانب الخلية مواجهة، في بئر السوداء، لوحة الوسطى (الشكل 1B).
- ضع حلقة هل 100 ميكرون على القرص الياقوت (الشكل 1B).
- ضع قرص فارغ الياقوت خلال حلقة هل (الشكل 1B) بعد غمس جانب واحد من القرص في محلول ملحي قبل تحسنت من الخطوة 2.2. تأكد من أن أي فقاعات الهواء محاصرون بين الأقراص الياقوت اثنين.
- ضع حلقة هل آخر 100 ميكرون وحلقة هل 400 ميكرون (الشكل 1B). إزالة السائل الزائد باستخدام ورق الترشيح.
- وضع التجمع من الخطوة 2.4.3 بين اثنين شفافة الاسطوانات نصف (الشكل 1A). إغلاق الغطاء العلوي الأحمر لبدء عملية التجميد.
ملاحظة: بروتوكول مسبقا يعمل تلقائيا بمجرد إغلاق الغطاء. يبقى عينة في نفس التوجه في غرفة التجميد، ويتم تطبيقها ومضة من الضوء من الجزء العلوي من تجميع العينة. غطاء أحمر للملوثات العضوية الثابتة النسخ الاحتياطي تلقائيا بمجرد اكتمال عملية التجميد. - تخزين العينة في ديوار التخزين.
ملاحظة: بعد تجميد، وانخفضت عينة تلقائيا إلى ديوار التخزين مليئة النيتروجين السائل وتخزينها هناك حتى مزيد من المعالجة. في ديوار تخزين ثلاث غرف، ولكل غرفة يمكن أن تعقد ما يصل إلى 3 عينات على الأكثر. عادة، يتم تجميد عينتين وفقا للشروط التحفيز نفسها، ومبرمجة من الثلاجة ذات الضغط العالي لتخزين كل في نفس الغرفة. - كرر الخطوات من 2.4.1 - 2.4.6 لكل عينة.
- انتقل إلى الخطوة 2.5 مرة واحدة كل غرف مليئة.
ملاحظة: تم تعيين الجهاز لتخزين ما يصل إلى 6 عينات في ديوار التخزين في وقت واحد. ولذلك، بعد كل عينة ال 6، الخطوة 2.5 يجب أن يؤديها. وبمجرد تفريغها، كرر الخطوات من 2.4.1 - 2.4.6.
- عينة جمع ونقل إلى وحدة الآلي تجميد إحلال
- فتح الباب أمام ديوار التخزين، والذي يقع تحت الطاولة من الثلاجة الضغط العالي. إزالة ديوار التخزين ووضعه على الفوق.
- استخدام اليدين، وإزالة غرفة عينة من ديوار وتحويلها في علبة عينة المتخصصة مليئة النيتروجين السائل. فتح مقبض الباب للافراج عن كوب العينة.
- إزالة شفافة اسطوانات نصف من الكأس العينة باستخدام زوج من ملاقط بعد ما قبل التبريد نصائح من ملاقط مع النيتروجين السائل (~ -196 ° C). نقل بعناية الوسط وحة سوداء إلى كوب صغير يحتوي على النيتروجين السائل.
ملاحظة: يجب precooled النصائح من ملاقط لدرجة حرارة النيتروجين السائل. يجب أن تبقى العينة تحت النيتروجين السائل في جميع الأوقات لمنع تشكيل الكريستال الجليد.
3. تجميد تبديل في الاتحاد الافريقيtomated تجميد إحلال وحدة
- باستخدام الملقط precooled (نصائح في ~ -196 ° C)، وسرعان ما نقل لوحة المتوسطة من الخطوة 2.5.3 لالأسيتون precooled (-90 ° C).
- فصل القرص الياقوت من لوحة المتوسطة عن طريق هز بلطف أو التنصت.
ملاحظة: أحيانا، قد يكون من الصعب فصل القرص الياقوت من لوحة الأوسط. في مثل هذا الوضع، وترك لوحة المتوسطة في الأسيتون precooled (-90 ° C) لبضع دقائق. التنصت لطيف مع ملاقط يساعد أيضا على فصل الياقوت من لوحة الأوسط. - ضع قارورة المبردة التي تحتوي على مثبتات (الخطوة 2.1) داخل غرفة عينة من وحدة تبديل. نقل القرص الياقوت إلى القارورة المبردة ووضع غطاء على القارورة.
- إعداد برنامج تجميد الاستبدال على النحو التالي: (أ) -90 درجة مئوية لمدة 5-30 ساعة، (ب) -90 - -20 ° C في 14 ساعة (5 ° C / ح) و (ج) -20 ° C لمدة 12 ساعة، و (د) -20 ° C - 20 ° C في 4 ساعات (10 ° C / ح).
ملاحظة: دويمكن أن تختلف التموينية من الخطوة الأولى في -90 ° C. تعيين المدة الإجمالية للاستبدال تجميد في مثل هذه الطريقة أن البرنامج ينتهي في الصباح (~ 1.5 د postexperiment) حول 08:00 حتى يمكن تنفيذ الخطوات اللاحقة أثناء النهار.
4. تسلل والبلاستيك التضمين مع راتنجات الايبوكسي
- وبمجرد انتهاء البرنامج، استخدم يد القفاز لنقل قوارير المبردة التي تحتوي على أقراص الياقوت من غرفة عينة من وحدة استبدال لغطاء الكيميائية.
- باستخدام ماصة، إضافة الأسيتون (درجة حرارة الغرفة) إلى كل قارورة المبردة ويغسل كل قرص الياقوت 4 - 6X عن 1-2 ساعات.
- اختياريا، واحتضان العينات في 0.1٪ خلات اليورانيل لمدة 1 ساعة إذا كانت هناك حاجة النقيض إضافية. غسل 4 - 6X مع الأسيتون خلال 1-2 ساعة.
ملاحظة: تحذير: هناك خطر المرتبطة بالتعرض الداخلي بعد استنشاق خلات اليورانيل، والذي يسبب تهيج في الجهاز التنفسي العلوي. التعرض عالية يمكن ل damagخلايا الدم ه. وينبغي أن يتم عمل مع خلات اليورانيل تحت التهوية. ويوصى ملابس واقية. - تحضير السائل المتوسطة راتنجات الايبوكسي من وزنها 6.2 غرام من الأثير الجلسرين polyglycidyl، 4.4 غرام من ثنائي الفينول-A راتنجات الايبوكسي، و 12.2 غرام من السكسينك dodecenyl (DDSA). تخلط جيدا وإضافة 800 ميكرولتر من ثنائي ميثيل أمين البنزيل (BDMA) في حين أن الاختلاط. دي الغاز لمدة 10 دقيقة.
- إعداد 30، 70، و 90٪ راتنجات الايبوكسي في الأسيتون من راتنجات الايبوكسي 100٪ أعدت في الخطوة 4.4.
- إضافة راتنجات الايبوكسي 30٪ إلى قارورة المبردة التي تحتوي على أقراص الياقوت واحتضان لمدة 2-3 ساعة عند RT في شاكر المداري في 120 دورة في الدقيقة.
- استبدال راتنجات الايبوكسي 30٪ مع راتنجات الايبوكسي 70٪ من قبل pipetting واحتضان لمدة 3-4 ساعة عند RT في شاكر المداري.
- باستخدام الملقط، ونقل كل قرص الياقوت، خلية جانب المتابعة، إلى الحد الأقصى من كبسولة التضمين. إضافة راتنجات الايبوكسي 90٪ لتصل إلى الحد الأقصى. احتضان O / N عند 4 درجات مئوية.
- في اليوم التالي، وجعل الطازجة المتوسطة راتنجات الايبوكسي، كما في الخطوة 40.4.
- نقل كل قرص الياقوت، والجانب الخلية مواجهة، إلى الحد الأقصى من كبسولة التضمين. ملء الغطاء مع الطازجة راتنجات الايبوكسي 100٪. تغيير جديد راتنجات الايبوكسي 100٪ كل ساعة 2، وتكرار ثلاث مرات.
- وضع العينات في C الفرن 60 درجة لمدة 48 ساعة لتتبلمر.
5. العينات تركيب
- ضع عينة رأسا على عقب على مجهر تشريحي بحيث يقع القرص الياقوت في الجزء العلوي من كتلة الراتنج. إزالة طبقة رقيقة من راتنجات الايبوكسي من أعلى عن طريق خدش عليه بشفرة حلاقة.
- باستخدام شفرة حلاقة، وقطع خط الضحلة على طول حافة القرص الياقوت. هذا الخط يساعد على فصل القرص الياقوت من راتنجات الايبوكسي في الخطوة 5.3.
- فصل القرص الياقوت من راتنجات الايبوكسي عن طريق غمس في النيتروجين السائل لحوالي 10 ثانية.
ملاحظة: هذه الخلايا ستبقى في راتنجات الايبوكسي. - بعد إزالة القرص الياقوت، واستخدام نطاق تشريح للعثور على المنطقة مع الخلايا (التكبير 4-10X). قطع جميع أنحاء المنطقة من اهتمام (~ 2 × 2 مم) باستخدام شفرة حلاقة (ذو حدين). للحفاظ على العينة في المكان، تنفيذ هذه الخطوة في الوقت الذي سجلت العينة على سطح المجهر.
- تركيب قطعة صغيرة من البلاستيك (~ 2 × 2 × 5 مم) التي تحتوي على الخلايا باستخدام الغراء التي تحتوي على إيثيل غراء سريع على كتلة وهمية أسطواني مصنوع من راتنجات الايبوكسي. احتضان كتلة في 60 درجة مئوية لمدة 1 ساعة.
6. باجتزاء
- استخدام مشراح مستدق إلى قسم العينة.
- تقليم سطح عينة من البلاستيك جزءا لا يتجزأ بسكين الزجاج بسرعة 3 ملم / ثانية و بسمك 200 نانومتر / القسم. قطع 4-5 المقاطع من السطح حيث توجد الخلايا النجمية.
- التبديل إلى سكين الماس والقسم بسرعة 0.8 ملم / ثانية و بسمك 40 نانومتر / القسم. قطع 20-25 أقسام.
- جمع شرائط من المقاطع على شبكات النحاس وفتحة واحدة مغطاة 0.7٪ خلات البولي فينيل (انظرجدول المواد).
7. التصوير باستخدام مجهر نقل الكترون (TEM)
- قبل تيم والتصوير، وصمة عار على الباب مع 2.5٪ خلات اليورانيل في الميثانول لمدة 5 دقائق.
- غسل 15X الشبكة في 50٪ الميثانول. ثم اغتسل في عالى النقاء 15X المياه، مع كل غسل دائم 30 ثانية.
- لفترة وجيزة الهواء الجاف القسم ووضع الشبكة إلى حامل عينة من TEM.
- صورة في 93،000X التكبير.
- الحصول على صور.
ملاحظة: التصوير عادة ما يتم الأعمى إلى نقطة زمنية أو المورثات، ويتم جمع عادة ~ 200 صورة / نقطة زمنية.
تحليل 8. صورة
- تحليل الصور باستخدام برنامج (على سبيل المثال، يماغيج) مع ماكرو العرف (واتانابي، ديفيس، ويورجنسن، غير منشورة).
ملاحظة: س / يتم تسجيل إحداثيات ص من الحويصلات، الغشاء البلازمي، الغشاء منطقة نشطة، وجميع العضيات بغشاء الأخرى في نقاط الاشتباك العصبي. في سن الفيل نصويتم تصدير العناوين التي تحتوي على معلومات لبرامج أخرى (على سبيل المثال، ماتلاب). ويتم تحليل البيانات باستخدام مزيد من البرامج المخصصة.
النتائج
باستخدام بروتوكول المذكورة أعلاه، أجرينا "فلاش وتجميد" التجارب في الماوس الخلايا العصبية الحصين معربا عن channelrhodopsin. تم تجميد هذه الخلايا العصبية إما 15 مللي ثانية أو 100 مللي ثانية بعد ظهور الضوء. لقد أظهرنا سابقا أن إيماس الإلتقام والحويصلات المشبكية تحدث في محطات متشابك في 15 مللي و 100 مللي نقاط الوقت، على التوالي 18. تم القبض على هذه الأحداث بنجاح في الأوقات المناسبة (الشكل 2)، مما يشير إلى أن التجارب فلاش والتجميد لا يمكن أن يؤديها بنجاح على متخصص الثلاجة الضغط العالي اختارت (انظر جدول المواد).
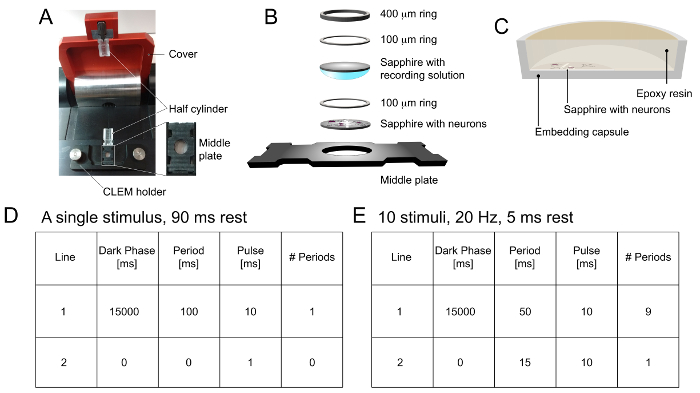
الشكل 1. تحميل عينة والبرمجة في الضغط العالي الفريزر. أ) الجدول عينة تحميل عالية فالفريزر ressure. لوحة المتوسطة، كما هو موضح في أقحم لمزيد من التفاصيل الهيكلي، يتم وضعها في حامل CLEM لعينة التحميل. يتم وضع واحدة من نصف اسطوانات في الجزء السفلي من الجدول تحميل عينة، ويرد الآخر مع مقطع لالغطاء العلوي. مرة واحدة يتم تحميل العينة، يتم الضغط على لوحة الأوسط قدما إلى أسفل نصف أسطوانات وإغلاق غطاء لبدء التجميد. B) تجميع العينات. يتم وضع القرص الياقوت تحتوي على الخلايا العصبية في بئر من لوحة المتوسطة، مع الجانب الخلية مواجهة. يتم وضع خاتم 100 ميكرون مباشرة فوق القرص الياقوت داخل البئر. ثم، يتم وضع قرص الياقوت فارغة مغموسة في محلول فسيولوجي مع الجانب حل لأسفل. يجب تجنب فقاعات الهواء. وأخيرا، يتم وضع خاتم 100 ميكرون وحلقة 400 ميكرون بشكل مريح أعلاه. تتم إزالة أي سائل اضافية مع ورق الترشيح. C) والمقطع العرضي للكبسولة تضمين مع القرص الياقوت غارقة في راتنجات الايبوكسي. في سابيتم وضع استئجار القرص في الجزء السفلي من الكبسولة، مع الجانب الخلية تواجه صعدت وغطت مع راتنجات الايبوكسي لتسلل والتضمين. D) برمجة الثلاجة الضغط العالي لواحد، والتحفيز 10 مللي ثانية. يتم تجميد العينات 90 مللي ثانية بعد نبض الضوء. E) برمجة الثلاجة الضغط العالي لمدة 10 المحفزات في 20 هرتز. يتم تجميد العينات 5 مللي ثانية بعد نبضة ضوء الماضي. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
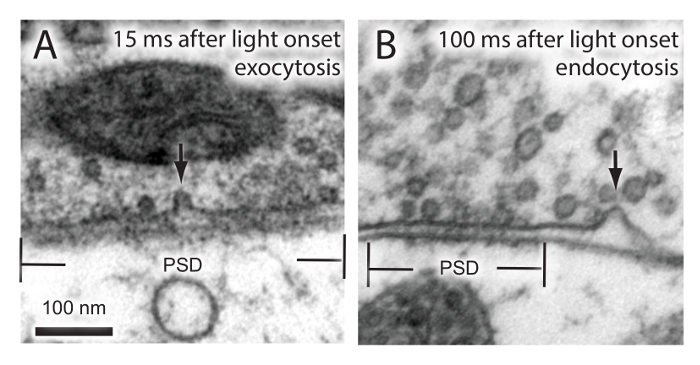
الشكل 2. تصور إيماس الإلتقام وفي ماوس الحصين الخلايا العصبية. يتم تحفيز الخلايا العصبية قرن آمون مرة واحدة وجمدت في الأوقات المحددة. تظهر الميكروسكوب الإلكتروني على إيماس من متشابك الحويصلة A) والإلتقام فائق السرعة B). PSD، كثافة بعد متشابك. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
Discussion
نهج "فلاش وتجميد" يتصور ديناميات غشاء عن طريق حفز حدث الخلوي معين مع علم البصريات الوراثي وتجميد الخلايا في نقاط زمنية محددة بعد التحفيز 19. في هذه المظاهرة، كنا channelrhodopsin، قناة الموجبة الحساسة للضوء، لتحفيز الخلايا العصبية واستولت على الانصهار والانتعاش من الحويصلات المشبكية في محطات متشابك. في السنوات الأخيرة، وقد وضعت العديد من الأدوات علم البصريات الوراثي 22، 23، وكلها متوافقة مع فلاش والتجميد. على سبيل المثال، والاتجار عضية يمكن أن يتسبب استخدام heterodimerization الناجم عن ضوء cryptochrome وCIB1 24. وبالمثل، وتكوين الدهون في غشاء البلازما يمكن تغييرها من قبل النبات الناجم خفيفة من فوسفاتاز فسفوإينوزيتيد إلى غشاء البلازما 25. وعلاوة على ذلك، ومركبات صغيرة حساسة للضوء مثل الفصل آزوبنزينالتشكل أنج اعتمادا على موجات الإضاءة. هذا التغيير متعلق بتكوين يمكن استخدامها لتنشيط قنوات بوابات يجند أو لتغيير تركيبة الدهون في غشاء 26 و 27. ويمكن أيضا أن المركبات قفص أن تستخدم للحث على النشاط الخلوي. ومع ذلك، فإن LED المستخدمة في الإعداد الحالي قد لا تنتج ما يكفي من الطاقة لuncaging. وبالتالي، تحسينات أخرى للنظام ضرورية على الأرجح. ومع ذلك، فإن تطبيق هذه الأدوات خفيفة activatable هي الأحداث الخلوية مرنة كثير يمكن أن يتسبب التي كتبها ومضة من الضوء. "فلاش وتجميد" يمكن التقاط ديناميات غشاء الناتجة عن ذلك.
هناك نوعان من القيود الرئيسية على طريقة "الفلاش والتجميد". أولا، أنه يلتقط "لقطات" من حدث معين من خلايا مختلفة. وبعبارة أخرى، فإنه ليس من الممكن لمتابعة الديناميات الغشاء في خلية واحدة على مدى فترة من الزمن. وهكذا، لإعادة بناء أي الخلوية حتىر، لا بد من اكتساب وتحليل عدد كبير من الصور من كل عينة وفي كل نقطة زمنية. وعلاوة على ذلك، في الخلايا العصبية، وهو عدد أكبر من الصور ضروري، لأن اندماج الحويصلات متشابك يستغرق سوى الأماكن في 20-30٪ من نقاط الاشتباك العصبي في الخلايا العصبية الماوس الحصين 18، 28. تحليل مثل هذه بيانات كبيرة تتطلب كميات هائلة من الوقت. في المستقبل، واقتناء الصور وتحليلها تحتاج إلى آلية لجعل نهج أكثر كفاءة 29 و 30.
وفرض القيد الثاني وفقا لطبيعة تقنية تجميد الضغط العالي. عندما تجميد الخلايا، تعيد ترتيب المياه الخلوي لتشكيل بلورات الثلج إذا كان معدل تجميد أقل من 100 K / ق 21. ويمكن لهذه بلورات الثلج اختراق أغشية أو تركز الأملاح لتغيير الضغط الاسموزي المحلي، مما أدى إلى تمزق الأغشية. لتجنب بلورات الثلج، المهزومةيتم تطبيق الضغط ح (~ 2000 أجهزة الصراف الآلي) للعينات. ويرجع ذلك إلى تأثير التبريد فائقة، وهو معدل تجميد 100 K / ثانية كافية لمنع المياه من تشكيل بلورات الجليد في هذا الضغط 21. من الناحية النظرية، عينات سميكة مثل 500 ميكرون يمكن تجميد دون بلورات الثلج، ولكن ما يقرب من 200 ميكرون من المرجح الحد العملي، كما تميل أشكال مكعبة من الجليد لتشكيل في الأنسجة السميكة، المساس التشكل. عندما عينات معالجة أكثر سمكا من 5 ميكرون، واستخدام السليم البرد حاصن، مثل BSA، أمر ضروري. ومع ذلك، فإن BSA تغيير الأسمولية من الحل وقد تؤثر على الاستجابة الفسيولوجية للخلايا. لذلك، يطلب من التجارب مراقبة واسعة النطاق للتحقق من صحة استخدام BSA في أنظمة معينة. يمكن أن بلورات الثلج أيضا أن تشكل بعد الضغط العالي تجميد إذا تم إزالة العينات عن طريق الخطأ من حمام النيتروجين السائل. وبالتالي، فمن الأهمية بمكان للحفاظ على العينات في النيتروجين السائل في جميع الأوقات، واستخدام الملقط قبل المبردة لالتلاعب بها.
عند التخطيط التجارب، ينبغي النظر في النقاط الثلاث التالية. أولا، لشدة القصوى من ضوء (خط 460 نانومتر) هو 5،5-8،0 ميغاواط / مم 2. إذا كان هذا كثافة كافية للحث على النشاط يجب التحقق مع التصوير الخلية الحية على المجهر مضان قبل التجارب فلاش والتجميد. ثانيا، يجب إجراء التجارب في درجة حرارة الفسيولوجية. وارتفعت درجة حرارة مرحلة الثلاجة الضغط العالي تصل إلى 37 درجة مئوية لمدة التجارب مع الخلايا العصبية الماوس الحصين 31. وأخيرا، فإن نقطة زمنية يجب اختيارها بعناية لالتقاط ديناميات غشاء. أشارت الدراسات الأولية إلى أن الإلتقام اكتمال بعد 100 مللي ثانية من التحفيز. وهكذا، تم فحص ثلاث نقاط زمنية إضافية (15، 30، و 50 مللي ثانية) أيضا لمتابعة ديناميات غشاء 17 و 18. وكانت هذه النقاط الزمنية اللازمة لتصور الحدث الاتجار الغشاءالصورة أثناء انتقال متشابك. ومع ذلك، فإن الحاجة إلى عدد من النقاط الزمنية تختلف في كل حدث الخلوية. ولذلك، ينبغي أخذ عينات بضع نقاط من الوقت قبل الشروع في جمع بيانات كبيرة.
Disclosures
وقد رعت نشر الوصول المفتوح من هذه المادة لايكا Mikrosysteme GmbH ل.
Acknowledgements
وأيد هذا العمل من خلال تمويل من جامعة جونز هوبكنز (SW). نشكر مدرسة جونز هوبكنز للمرفق الطب مجهر لدعمها التقني. نشكر إريك يورجنسن وكريستيان روزنموند وأعضاء مختبراتها لتطوير هذه التقنية. نشكر M. وين ديفيس لتصميم الجهاز الأولي. نشكر بول وورزينغر، كفيتا توموفا، وDelgermaa Luvsanjav للحصول على المساعدة الفنية. كما نشكر ناتالي R. هاميلتون وغرانت F كوسيك لقراءة نقدية لها من المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| Freeze-substitution and Low-temperature Embedding System for Light and Electron Microscopy -AFS II | Leica | ||
| High Pressure Freezer - EM-ICE | Leica | EM ICE is a specialized high pressure freezer that allows precise control of light stimulation and freezing. | |
| Osmometer | Gonotec | ||
| Ultramicrotome UC7 | Leica | ||
| Oven | Blue M | ||
| Razor blade | Personna | ||
| Glutaraldehyde | EMS | 16530 | |
| Osmium tetroxide | EMS | RT19132 | Toxic, open only under certified chemical hood |
| Acetone | EMS | RT10016 | |
| HEPES | Emdmillipore | 391340-250GM | |
| Glucose | Sigma | 49159-1KG | |
| KCl | Sigma | 746436-1KG | |
| NaCl | Sigma | S7653-1KG | |
| CaCl2 | Sigma | 21115-250ML | |
| MgCl2 | J.T.Baker | 2444-01 | |
| Liquid epoxy resin Eponate 12 | Ted Pella | 18028 | |
| Bisphenol A epoxy resin Araldite 502 | Ted Pella | 18028 | |
| Dodecenyl succinic anhydride (DDSA) | Ted Pella | 18028 | |
| Benzyl dimethyl amine (BDMA) | Ted Pella | 18241 | |
| Special embedding (BEEM) capsule | EMS | 70021 | |
| Copper Grid | Ted Pella | 1GC12H | |
| Polyvinyl acetate (Pioloform F) | Ted Pella | 19244 | |
| Uranyl acetate | Polysciences | 21447-25 | |
| Ethyl cyanoacrylate (Super glue) | Scotch | 170497 | |
| Trypsin-EDTA | Themo scientific | 25300-120 | |
| DMEM (Dulbecco's Modified Eagle's Medium) | Thermo scientific | 10569-044 | Should be warmed to 37 °C before use |
| FBS (Fetal Bovine Serum) | Thermo scientific | 26140-079 | |
| Pen-Strep | Thermo scientific | 15140-122 | |
| Fluoro-deoxyuridine (FUDR) | Sigma | F0503 | |
| Glass cover slip | Fisher | S175223 | Should be acid-washed |
| Sapphire disc | Technotrade | 616-100 | |
| Acetic acid | Emdmillipore | 1000631011 | |
| Poly-D-Lysine (PDL) | Sigma | P6407 | |
| Rat tail collagen | Thermo scientific | A10483-01 | |
| Neurobasal A | Fisher | 10888022 | Should be warmed to 37 °C before use |
| L-alanyl-L-glutamine (Glutamax) | Fisher | 35050-079 | |
| Seraum free supplement (B-27) | Fisher | 17504044 | |
| Hanks'-balanced Salt Solution (HBSS) | Thermo scientific | 24020117 | |
| Papain | Worthington | LS003126 | Active Unit should be calculated for each batch |
| Thermomixer | Eppendorf | Thermomixer C | |
| Trypsin inhibitor | Sigma | T9253 | |
| NBQX | Tocris | 03-731-0 | |
| Bicculine | Tocris | 01-091-0 | |
| Whatman I filter paper | GE | ||
| Transmission Electron Microscope | Philips CM20 |
References
- Li, D., et al. ADVANCED IMAGING. Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science. 349 (6251), aab3500 (2015).
- Betzig, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313 (5793), 1642-1645 (2006).
- Sjollema, K. A., Schnell, U., Kuipers, J., Kalicharan, R., Giepmans, B. N. G. Correlated light microscopy and electron microscopy. Methods Cell Biol. 111, 157-173 (2012).
- Redemann, S., Müller-Reichert, T. Correlative light and electron microscopy for the analysis of cell division. Journal Microsc. 251 (2), 109-112 (2013).
- Kukulski, W., Schorb, M., Kaksonen, M., Briggs, J. A. G. Plasma membrane reshaping during endocytosis is revealed by time-resolved electron tomography. Cell. 150 (3), 508-520 (2012).
- Kobayashi, S., Iwamoto, M., Haraguchi, T. Live correlative light-electron microscopy to observe molecular dynamics in high resolution. Microscopy (Oxford, England). 65 (4), 296-308 (2016).
- Start, R. D., Layton, C. M., Cross, S. S., Smith, J. H. Reassessment of the rate of fixative diffusion. J Clin Pathol. 45 (12), 1120-1121 (1992).
- Müller-Reichert, T., Srayko, M., Hyman, A., O'Toole, E. T., McDonald, K. Correlative Light and Electron Microscopy of Early Caenorhabditis elegans Embryos in Mitosis. Cellular Electron Microscopy. 79, 101-119 (2007).
- Bykov, Y. S., Cortese, M., Briggs, J. A. G., Bartenschlager, R. Correlative light and electron microscopy methods for the study of virus-cell interactions. FEBS Lett. 590 (13), 1877-1895 (2016).
- Casanova, G., Nolin, F., Wortham, L., Ploton, D., Banchet, V., Michel, J. Shrinkage of freeze-dried cryosections of cells: Investigations by EFTEM and cryo-CLEM. Micron. 88, 77-83 (2016).
- Kukulski, W., Schorb, M., Welsch, S., Picco, A., Kaksonen, M., Briggs, J. A. G. Correlated fluorescence and 3D electron microscopy with high sensitivity and spatial precision. J Cell Biol. 192 (1), 111-119 (2011).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proc Natl Acad Sci U.S.A. 100 (24), 13940-13945 (2003).
- Nagel, G., et al. Channelrhodopsin-1: a light-gated proton channel in green algae. Science. 296 (5577), 2395-2398 (2002).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neurosci. 8 (9), 1263-1268 (2005).
- Nagel, G., Brauner, M., Liewald, J. F., Adeishvili, N., Bamberg, E., Gottschalk, A. Light activation of channelrhodopsin-2 in excitable cells of Caenorhabditis elegans triggers rapid behavioral responses. Curr Biol. 15 (24), 2279-2284 (2005).
- Heuser, J. E., Reese, T. S. Structural changes after transmitter release at the frog neuromuscular junction. J Cell Biol. 88 (3), 564-580 (1981).
- Watanabe, S., et al. Ultrafast endocytosis at Caenorhabditis elegans neuromuscular junctions. eLife. 2, e00723 (2013).
- Watanabe, S., et al. Ultrafast endocytosis at mouse hippocampal synapses. Nature. 504 (7479), 242-247 (2013).
- Watanabe, S. Flash-and-Freeze: Coordinating Optogenetic Stimulation with Rapid Freezing to Visualize Membrane Dynamics at Synapses with Millisecond Resolution. Front Synaptic Neurosci. 8, 24 (2016).
- Moor, H. . Cryotechniques in Biological Electron Microscopy. , (1987).
- Dubochet, J. The physics of rapid cooling and its implications for cryoimmobilization of cells. Methods Cell Biol. 79, 7-21 (2007).
- Weitzman, M., Hahn, K. M. Optogenetic approaches to cell migration and beyond. Curr Opin Cell Biol. 30, 112-120 (2014).
- Niu, J., Ben Johny, ., Dick, M., E, I., Inoue, T. Following Optogenetic Dimerizers and Quantitative Prospects. Biophys J. 111 (6), 1132-1140 (2016).
- van Bergeijk, P., Adrian, M., Hoogenraad, C. C., Kapitein, L. C. Optogenetic control of organelle transport and positioning. Nature. 518 (7537), 111-114 (2015).
- Idevall-Hagren, O., Dickson, E. J., Hille, B., Toomre, D. K., De Camilli, P. Optogenetic control of phosphoinositide metabolism. Proc Natl Acad of Sci U.S.A. 109 (35), E2316-E2323 (2012).
- Kramer, R. H., Fortin, D. L., Trauner, D. New photochemical tools for controlling neuronal activity. Curr Opin Neurobiol. 19 (5), 544-552 (2009).
- Frank, J. A., Franquelim, H. G., Schwille, P., Trauner, D. Optical Control of Lipid Rafts with Photoswitchable Ceramides. J Am Chem Soc. 138 (39), 12981-12986 (2016).
- Rosenmund, C., Clements, J. D., Westbrook, G. L. Nonuniform probability of glutamate release at a hippocampal synapse. Science. 262 (5134), 754-757 (1993).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLoS Biology. 2 (11), e329 (2004).
- Knott, G., Marchman, H., Wall, D., Lich, B. Serial section scanning electron microscopy of adult brain tissue using focused ion beam milling. J Neurosci. 28 (12), 2959-2964 (2008).
- Watanabe, S., et al. Clathrin regenerates synaptic vesicles from endosomes. Nature. 515 (7526), 228-233 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved