Method Article
Glycoproteomics من مصفوفة خارج الخلية: منهج في تحليل سكري سليمة عن طريق قياس الطيف الكتلي
In This Article
Summary
وتصف هذه الورقة منهجية لإعداد عينات الأنسجة القلب والأوعية الدموية لتحليل MS التي تسمح لل(1) تحليل ECM تكوين البروتين، (2) تحديد مواقع بالغليكوزيل، و (3) توصيف التركيبي أشكال غليكان. هذه المنهجية يمكن تطبيقها، مع تعديلات طفيفة، لدراسة ECM في الأنسجة الأخرى.
Abstract
التليف هو السمة المميزة لكثير من الأمراض القلبية الوعائية ويرتبط إفراز استفحال وترسب المصفوفة خارج الخلية (ECM). استخدام البروتينات، حددنا سابقا أكثر من 150 ECM والبروتينات ECM المصاحب في أنسجة القلب والأوعية الدموية. والجدير بالذكر أن والغليكوزيلاتي العديد من البروتينات ECM. هذا التعديل بعد متعدية يؤثر البروتين للطي، والذوبان، ملزمة، وتدهور. لقد قمنا بتطوير الاستخلاص المتسلسل وطريقة تخصيب للبروتينات ECM التي تتوافق مع الطيف الكتلي السائل اللوني جنبا إلى جنب لاحقة تحليل (LC-MS / MS) من glycopeptides سليمة. وتقوم الاستراتيجية على حضانات متتابعة مع كلوريد الصوديوم، SDS لdecellularization الأنسجة، وهيدروكلوريد جوانيداين لإذابة البروتينات ECM. وتشمل التطورات الحديثة في LC-MS / MS طرق تجزئة، مثل مجموعات من الطاقة أعلى تصادم التفكك (HCD) ونقل الإلكترون التفكك (المفتشون)، والتي تسمح للالتحليل التركيبي المباشر للglycopeptides من البروتينات ECM. في هذه الورقة، ونحن تصف طريقة لإعداد ECM من عينات الأنسجة. طريقة يسمح ليس فقط لتحديد ملامح البروتين ولكن أيضا تقييم وتوصيف ارتباط بالغليكوزيل عن طريق تحليل MS.
Introduction
التليف هو السمة المميزة لكثير من الأمراض. الليفية تتكاثر وتفرق نحو الظواهر التركيبية للغاية، والتي ترتبط مع إفراز استفحال وترسب المصفوفة خارج الخلية (ECM) 1. الإفراط ECM ترسب يمكن أن تستمر، حتى بعد أن خفت حدة الإصابة الأولية، مما يؤدي إلى اضطراب وظيفي. استخدام البروتينات، حددنا سابقا أكثر من 150 ECM والبروتينات ECM المصاحب في أنسجة القلب 2 و 3. فهي ليست الوحيدة البروتينات الهيكلية، ولكن أيضا البروتينات matricellular والبروتياز التي تساهم في إعادة المستمر والتكيف الحيوي من القلب. والجدير بالذكر أن والغليكوزيلاتي العديد من البروتينات ECM 4. هذا التعديل بعد متعدية (PTM) ينطوي على إضافة مخلفات السكر لبعض المواقف من الأحماض الأمينية، وأنه يؤثر على البروتين للطي، والذوبان، ملزمة، وتدهور 5 .
هناك نوعان بالغليكوزيل الرئيسية التي تحدث في الثدييات. (1) يحدث N-بالغليكوزيل في النيتروجين carboxamido من بقايا الأسباراجين (الأسباراجين) ضمن تسلسل إجماع الأسباراجين-XAA-منتدى المجالس الرومانسية / سر، حيث XAA هو أي حمض أميني باستثناء البرولين. (2) في O-بالغليكوزيل، وبقايا السكر نعلق على سيرين وثريونين بقايا (سر، منتدى المجالس الرومانسية) أو، إلى حد أقل بكثير، لالهيدروكسي برولين وهيدروكسي ليزين. في حين يمكن أن يحدث O-بالغليكوزيل في مجموعة متنوعة من الجماعات البروتين، يتم تقييد N-بالغليكوزيل للبروتينات يفرز أو المجالات خارج الخلية من بروتينات الغشاء 5. وهذا يجعل N-بالغليكوزيل هدفا جذابا عند دراسة ECM.
يحدد البروتينات معيارا جديدا لتحليل التغيرات البروتين في المرض. حتى الآن، وقد ركزت الدراسات معظم البروتينات على البروتينات داخل الخلايا 6. ويرجع ذلك أساسا إلى الأسباب التالية هذا. أولا، البروتينات داخل الخلايا وفيرة تعيق للهوية منذfication مكونات ECM الشحيحة. هذا أمر بالغ الأهمية ولا سيما في أنسجة القلب، والتي تشكل الميتوكوندريا وخيط عضلي البروتينات لنسبة كبيرة من البروتين 7. ثانيا، البروتينات ECM متكامل هي عبر مرتبطة بشكل كبير ويصعب إذابة. وأخيرا، فإن وجود وفرة PTMs (أي بالغليكوزيل) يغير الكتلة الجزيئية، وتهمة، وخصائص الكهربي من الببتيدات، مما يؤثر على فصل وتحديد من السائل اللوني جنبا إلى جنب قياس الطيف الكتلي (LC-MS / MS). خلال السنوات الأخيرة، قمنا بتطوير وتحسين استخراج متتابعة وطريقة تخصيب للبروتينات ECM التي تتوافق مع تحليل لاحقة مطياف الكتلة (MS). وتقوم الاستراتيجية على حضانات متسلسلة.
يتم تنفيذ الخطوة الأولى مع كلوريد الصوديوم، وجود مخزن مؤقت الأيونية التي تسهل استخراج البروتينات المرتبطة ECM وECM ملزمة فضفاضة، وكذلك البروتينات ECM توليفها حديثا. هو أناالصورة المنظفات مجانا، غير تغيير طبيعة، غير مدمرة لأغشية الخلايا، وقابلة لمزيد من فحوصات البيوكيميائية 8. ثم، ويتحقق decellularization مع كبريتات الصوديوم دوديسيل (SDS). في هذه الخطوة، تركيز منخفض SDS يضمن زعزعة استقرار الغشاء والإفراج عن البروتينات داخل الخلايا ويمنع تعطيل مكونات ECM غير المدمجة أكثر قابلية للذوبان. وأخيرا، يتم استخراج البروتينات ECM مع العازلة جوانيداين هيدروكلوريد (GuHCl). GuHCl فعال في استخراج البروتينات والبروتيوغليكان بشكل كبير عبر ربط من الأنسجة مثل الأوتار 9 والغضاريف 10، سفن 11 و 12 و 13 و قلب 2 و 3. طبقنا هذا تجزئة الكيمياء الحيوية، في تركيبة مع LC-MS / MS، لاستكشاف إعادة عرض ECM في أمراض القلب والشرايين 2 و 3 و 11 و 12 و 13 و 14. وتشمل التطورات الحديثة في أساليب MS تجزئة جديدة، مثل مجموعات من الطاقة أعلى تصادم التفكك (HCD) ونقل الإلكترون التفكك (المفتشون)، والتي تسمح للتحليل المباشر للglycopeptides سليمة 3، 15.
نحن هنا وصف منهجية لإعداد ECM لتحليل MS التي تسمح لتحليل تكوين البروتين، وتحديد مواقع بالغليكوزيل، وتوصيف أشكال غليكان. بالمقارنة مع التحليلات السابقة من ECM بالغليكوزيل 16، هذه المنهجية تسمح للتقييم المباشر للتغيرات التركيبية في لمحات بالغليكوزيل بطريقة محددة الموقع باستخدام MS. لقد طبقت هذه المنهجية لأنسجة القلب والأوعية الدموية. ومع ذلك، فإنه يمكن اللهذلك أن تطبق، مع تعديلات طفيفة، لدراسة ECM في عينات الأنسجة الأخرى، ويمكن تقديم رؤى غير مسبوقة في علم الأحياء ECM.
Protocol
وتمت الموافقة على الدراسة من قبل لجنة أخلاقيات البحوث المحلية واندسوورث (الرقم المرجعي: 06 / Q0803 / 37) والموافقة المؤسسية التي وردت من مكتب البحث والتطوير. كل المرضى قدموا موافقة كتابية.
1. استخراج خارج الخلية مصفوفة البروتينات
ملاحظة: تم الحصول على الأنسجة الأذيني الإنسان المستخدمة في هذه التجارب من الزوائد الأذيني خلال المجازة القلبية الرئوية، بعد اعتقال شلل القلب للقلب. تم جمع جميع العينات في سانت جورج مستشفى، لندن، المملكة المتحدة. يجب أن تجمد جميع عينات الأنسجة في -80 ° C. لا تستخدم عينات محفوظة مع مثبتات، مثل امتصاص العرق، أن البروتينات عبر الارتباط.
- إعداد جميع مخازن استخراج مقدما من التجارب، حسب الجدول 1، وذلك لتقليل الوقت بين الخطوات الاستخراج. تنفيذ كافة حضانات في درجة حرارة الغرفة (RT) في بيئة يمكن التحكم بدرجة حرارته(أي ~ 20 ° C) لضمان الاتساق بين عمليات الاستخراج.
- وزن 20-50 ملغ من الأنسجة. إذا عدة عينات ليكون استخراجه، وقطع ووزن لهم واحدا تلو الآخر لتجنب ذوبان كامل للأنسجة. باستخدام مشرط، الزهر والأنسجة في 3-4 قطع صغيرة (أي 2-3 ملم) ووضعها معا في أنابيب 1.5 مل.
- إضافة 500 ميكرولتر من الجليد الباردة الفوسفات مخزنة المالحة (PBS، انظر الجدول 1 والجدول المواد) وتنفيذ خمسة يغسل للحد من التلوث الدم.
- استخراج الخطوة 1: الحضانة مع كلوريد الصوديوم العازلة
- بعد غسل مع PBS، وضع العينات في أنابيب 1.5 مل مع قبعات المسمار. إضافة العازلة كلوريد الصوديوم (انظر الجدول 1) في 10 مرات (ت: ث) وزن الأنسجة. دوامة الأنابيب في RT لمدة 1 ساعة على السرعة الدنيا (أي 600 دورة في الدقيقة).
ملاحظة: A سرعة الدوامة منخفضة أمر بالغ الأهمية لتجنب تعطل الميكانيكية للأنسجة خلال هذه الخطوة.استخدام محول رغوة لوضع جميع الأنابيب خلال الاستخراج. - نقل مقتطفات لأنابيب جديدة وأجهزة الطرد المركزي في 16000 x ج لمدة 10 دقيقة على 4 درجات مئوية. تخزين مقتطفات في -20 درجة مئوية حتى الاستخدام. غسل لفترة وجيزة الكريات الأنسجة المتبقية مع العازلة كلوريد الصوديوم النقي. استخدام نفس النوع من العازلة (أي 100 ميكرولتر من العازلة كلوريد الصوديوم) لغسل لمنع استخراج البروتينات الأخرى مع الذوبان مختلفة (أي البروتينات لا استخراجها مع كلوريد الصوديوم).
- بعد الغسيل، وضمان الاستئصال الكامل للعازلة لتقليل التداخل في محتوى البروتين مع خطوات استخراج اللاحقة. تجاهل المخزن المؤقت كلوريد الصوديوم تستخدم لغسل.
ملاحظة: النسبة بين حجم العازلة والوزن الأنسجة مهمة لاستخراج استنساخه. A 10: 1 نسبة (ت: ث) لاستخراج كلوريد الصوديوم وSDS و 5: 1 للخطوة GuHCl توفر كميات كافية من البروتين دون تشبع العازلة. تركيزات البروتين ما يقرب من 1-2 ميكروغرام / ميكرولتر بعد تحويلةraction.
- بعد غسل مع PBS، وضع العينات في أنابيب 1.5 مل مع قبعات المسمار. إضافة العازلة كلوريد الصوديوم (انظر الجدول 1) في 10 مرات (ت: ث) وزن الأنسجة. دوامة الأنابيب في RT لمدة 1 ساعة على السرعة الدنيا (أي 600 دورة في الدقيقة).
- استخراج الخطوة 2: Decellularization مع SDS العازلة
- إضافة SDS العازلة (الجدول 1) في عشر مرات (ت: ث) وزن الأنسجة. استخدام تركيزات منخفضة SDS (أي 0.1٪) أمر بالغ الأهمية لتجنب فقدان البروتينات ECM خلال decellularization. دوامة الأنابيب في RT لمدة 16 ساعة في السرعة الدنيا (أي 600 دورة في الدقيقة).
ملاحظة: A سرعة الدوامة منخفضة يقلل من اضطراب الميكانيكية للECM. - نقل مقتطفات لأنابيب جديدة. أجهزة الطرد المركزي في 16000 x ج لمدة 10 دقيقة في 4 درجات مئوية. تخزين في درجة حرارة -20 درجة مئوية حتى الاستخدام. غسل لفترة وجيزة الكريات الأنسجة المتبقية مع د د H 2 O لإزالة SDS. ضمان إزالة كاملة من السائل بعد الغسيل.
- إضافة SDS العازلة (الجدول 1) في عشر مرات (ت: ث) وزن الأنسجة. استخدام تركيزات منخفضة SDS (أي 0.1٪) أمر بالغ الأهمية لتجنب فقدان البروتينات ECM خلال decellularization. دوامة الأنابيب في RT لمدة 16 ساعة في السرعة الدنيا (أي 600 دورة في الدقيقة).
- استخراج الخطوة 3: الحضانة مع GuHCl العازلة
- إضافة GuHCl عازلة (الجدول 1) في خمس مرات (ت: ث) وزن الأنسجة. دوامة الأنابيب في RT لمدة 72 ساعة في أقصى سرعة (أي، 3200 دورة في الدقيقة). vortexing لقوي يسهل تعطل الميكانيكية للECM.
- نقل مقتطفات لأنابيب جديدة. أجهزة الطرد المركزي في 16000 × ز لمدة 10 دقيقة على 4 درجات مئوية، ومخزن في -20 درجة مئوية حتى الاستخدام.
2. البروتين الكمي والهطول
ملاحظة: نظرا لوجود وسائل التنظيف والمنطقة العازلة SDS غير متوافق مع تقدير البروتين المباشر على أساس قياسات الامتصاصية في 280 نانومتر. لضمان الكمي استنساخه، استخدم المقايسات اللونية لجميع مستخلصات البروتين 17.
- تحديد الكميات.
- إعداد معايير لمنحنى المعايرة باستخدام ألبومين المصل البقري (BSA) المخفف متسلسل في المنطقة العازلة استخراج المناسب (أي كلوريد الصوديوم، SDS، أو GuHCl) 17. خلال هذا الوقت، ذوبان الجليد مقتطفات العينة.
- تمييع العينات في استخراج العازلة للحصول على تركيزات داخلفي مجموعة خطية من الامتصاصية. 1:10 التخفيف (ت: ت) ينتج نتائج مرضية. تمييع عينات GuHCl مع مبلغ مساو من ده 2 O لتقدير، والفحص اللونية غير متوافق مع تركيزات> 4 M GuHCl.
- استخدام حمض bicinchoninic (BCA) المستندة فحص اللونية 17 (انظر جدول المواد)، باتباع إرشادات الشركة المصنعة لفحوصات في لوحات 96-جيدا. فمن المستحسن إجراء قياسات المكررة على الأقل.
- بعد احتضان لمدة 30 دقيقة، أخذ قراءات الامتصاصية في الطول الموجي 570 نانومتر لحساب تركيز البروتين باستخدام BSA القياسية منحنى المعايرة 17.
- البروتين الهطول
- ذوبان الجليد GuHCl مقتطفات في RT. قسامة 10 ميكروغرام من البروتين لكل عينة في أنابيب جديدة. للاطلاع على تحليل سكري المباشر، قسامة 50 ميكروغرام. إضافة 10 أضعاف حجم الإيثانول وincuباتي بين عشية وضحاها في -20 ° C.
ملاحظة: GuHCl غير متوافق مع مزيد من التفاعلات الأنزيمية ومعظم التطبيقات الكهربي. مطلوب إزالة GuHCl قبل deglycosylation والتربسين الهضم. ذوبان GuHCl في الإيثانول، وعلى العكس، فإن ذوبان منخفضة من البروتينات تسمح لإزالة فعالة من GuHCl حين تظهر ما يقرب من الانتعاش 98٪ من البروتينات 18. - الطرد المركزي العينات في 16000 × ز لمدة 30 دقيقة في 4 درجات مئوية، ونضح طاف. والحرص على عدم تعكير صفو بيليه عجلت. تجفيف حبيبات لمدة 15 دقيقة باستخدام مكثف فراغ (انظر جدول المواد) في RT.
ملاحظة: بروتوكول يمكن وقفها هنا والكريات المجففة المخزنة في -20 درجة مئوية حتى الاستخدام. - اختياريا، تشغيل الكهربائي للهلام عن مراقبة الجودة (QC، راجع طرق التكميلي).
- ذوبان الجليد GuHCl مقتطفات في RT. قسامة 10 ميكروغرام من البروتين لكل عينة في أنابيب جديدة. للاطلاع على تحليل سكري المباشر، قسامة 50 ميكروغرام. إضافة 10 أضعاف حجم الإيثانول وincuباتي بين عشية وضحاها في -20 ° C.
3. متسلسل Deglycosylation لتقييم N-بالغليكوزيل إشغال الموقع
- خلال تجفيف العينة (راجع الخطوة 2.2.2)، وإعداد عازلة deglycosylation التي تحتوي على الانزيمات مشذب deglycosylation، كما في الجدول 1. انظر جدول المواد للحصول على تفاصيل المنتج.
- إضافة 10 ميكرولتر من العازلة deglycosylation تحتوي على إنزيمات لكل عينة. ضمان إعادة تعليق بيليه المناسب عن طريق إجراء دوامة سريعة وتدور باستمرار من العينات.
ملاحظة: إزالة أحادية السكر باستخدام أنزيمات مشذب أمر ضروري لإزالة اللاحقة وكاملة من السكريات مرتبطة O معقدة ويسهل انشقاق في وقت لاحق من السكريات مرتبطة N من PNGase-F. - احتضان لمدة 2 ساعة عند 25 درجة مئوية للسماح لإزالة كبريتات heparan التي كتبها heparinase II.Increase درجة الحرارة إلى 37 درجة مئوية، واحتضان لمدة 36 ساعة مع الإثارة لطيف.
ملاحظة: نظرا لكميات رد فعل المنخفضة والأوقات الحضانة لفترات طويلة، الهزازات استخدام الحاضنة وبإحكام حزمة متعددة حوض 1.5 ملوفاق داخل أنبوب مخروطي 50 مل يميل داخل الحاضنة في حوالي 45 درجة. - بعد 36 ساعة، وأجهزة الطرد المركزي العينات لمدة 1 دقيقة في 16000 x ج وتتبخر H 2 O من العينات باستخدام مكثف فراغ في RT لمدة 45 دقيقة.
- إعادة تعليق العينات المجففة مع 10 ميكرولتر من H 2 O 18 يحتوي على 50 U / مل PNGase-F، الذي يشق كل glycans المرتبطة الهليونين في تفاعل نزع الأميد.
ملاحظة: حمض الأسبارتيك الناتجة يحمل كتلة الزائدة من 2.98 دا، مما يدل على وجود N-بالغليكوزيل خلال تحليل MS. - احتضان لمدة 36 ساعة عند 37 ° C في إطار التحريض المستمر في شاكر الحاضنة.
4. في وحل التربسين الهضم
ملاحظة: يجب أن تتم هذه الخطوة من على حد سواء (أي تستخدم لتحليل سكري المباشر) وdeglycosylated عينات غير deglycosylated (أي تستخدم لتقييم OC غليكانcupancy).
- استخدام 10 ميكروغرام من البروتين الكلي لتقييم شغل موقع N-بالغليكوزيل (كما هو موضح في الخطوة السابقة). للحصول على عينات معدة للتحليل سكري المباشر، استخدم 50 ميكروغرام من البروتين وكمية البدء.
ملاحظة: يتم وصف الخطوات التالية لمدة 10 ميكروغرام من البروتين. تصعيد evolumes عشر (أي 5 مرات لمدة 50 ميكروغرام) كما هو مطلوب. - تفسد البروتينات على كل قسامة العينة باستخدام 9 M اليوريا و 3 M ثيوريا، مع تركيزات النهائي من 6 M اليوريا و 2 M ثيوريا، على التوالي (على سبيل المثال، لعينة 10 ميكرولتر، 20 ميكرولتر من اليوريا / ثيوريا).
- الحد من البروتينات عن طريق إضافة 100 ملي dithiotreitol (DTT، 3.33 ميكرولتر، وتركيز النهائي: 10 ملم). احتضان عند 37 درجة مئوية لمدة 1 ساعة مع الإثارة في 240 دورة في الدقيقة.
- تهدئة عينات لRT قبل تنفيذ الألكلة بإضافة 0.5 M iodoacetamide (3.7 ميكرولتر، وتركيز النهائي: 50 ملم). احتضان في الظلام لمدة 1 ساعة.
- استخدام ما قبل المبردة (-20° C) الأسيتون (6 أضعاف حجم العينة) لاحتضان العينات بين عشية وضحاها في -20 ° C. يعجل بواسطة الطرد المركزي في 14000 x ج لمدة 25 دقيقة على 4 درجات مئوية.
- نضح طاف. والحرص على عدم تعكير صفو بيليه عجلت. تجفيف الكريات البروتين باستخدام مكثف فراغ لمدة 30 دقيقة في RT.
- Resuspend في 20 ميكرولتر من 0.1 M بيكربونات triethylammonium (TEAB) العازلة، ودرجة الحموضة 8.2، التي تحتوي على التربسين (0.01 ميكروغرام / ميكرولتر) وهضم ليلا 37 درجة مئوية و 240 دورة في الدقيقة.
- وقف عملية الهضم من خلال المحمضة العينات مع حمض trifluoroacetic 10٪ (TFA، 2 ميكرولتر لتركيز النهائي من 1٪ TFA).
5. الببتيد تنظيف باستخدام أعمدة C18
ملاحظة: إزالة بالتدخل الملوثات من خليط الببتيد بعد الهضم يقلل قمع أيون وتحسن نسب الإشارة إلى الضوضاء وتغطية التسلسل. يجب أن تنفذ هذه الخطوة لكل من سا غير deglycosylated وdeglycosylatedmples.
- تفعيل الراتنج على لوحة C18 تدور (انظر الجدول المواد) باستخدام 200 ميكرولتر من الميثانول لكل بئر وأجهزة الطرد المركزي في 1000 x ج لمدة 1 دقيقة.
- غسل بإضافة 200 ميكرولتر لكل بئر من 80٪ أسيتونيتريل (ACN) و 0.1٪ TFA في H 2 O. الطرد المركزي في 1000 x ج لمدة 1 دقيقة.
- تتوازن بإضافة 200 ميكرولتر لكل بئر من 1٪ ACN و 0.1٪ TFA في H 2 O. الطرد المركزي في 1000 x ج لمدة 1 دقيقة. كرر هذه الخطوة مرتين أخريين.
- تحميل العينات (وحدة التخزين بالكامل) من الخطوة 4 في الآبار التي تحتوي على الراتنج وأجهزة الطرد المركزي في 1500 x ج لمدة 1 دقيقة. تحديث من خلال تدفق للمرة الثانية وتكرار الطرد المركزي.
- غسل بإضافة 200 ميكرولتر لكل بئر من 1٪ ACN و 0.1٪ TFA في H 2 O. الطرد المركزي في 1500 x ج لمدة 1 دقيقة. كرر هذه الخطوة مرتين أخريين.
- أزل العينات مع 170 ميكرولتر لكل بئر من 50٪ ACN، 0.1٪ TFA في H 2 O. الطرد المركزي في 1500 x ج لمدة 1 دقيقة. كرر الخطوة السابقةوالجمع بين شطافة التي تم جمعها.
- تجفيف شطافة باستخدام مكثف فراغ لمدة 2 ساعة في RT. إذا لم يتم استخدامه على الفور، والحفاظ على العينات المجففة في -80 درجة مئوية حتى الاستخدام.
ملاحظة: عينات Deglycosylated المخصصة لتحديد البروتين على استعداد لاستخدامها لLC-MS / MS بعد هذه الخطوة فقط. الخطوات 6 و 7 ليست مطلوبة لهذه العينات. - ذوبان الجليد و resuspend العينات deglycosylated في 2٪ ACN و 0.05٪ TFA في H 2 O إلى تركيز البروتين النهائي من 0.5 ميكروغرام / ميكرولتر. المضي قدما في الخطوة 6 لتحليل سكري المباشر للعينات غير deglycosylated.
- اختياريا، تصفية الببتيدات قبل وضع العلامات مع به جنبا إلى جنب كتلة (TMT)؛ رؤية طرق التكميلية للfitration الببتيد.
6. وضع العلامات مع TMT (لتحليل المباشر سكري فقط)
- ذوبان الجليد و resuspend الكريات المجففة في 50 ميكرولتر من 50 ملي TEAB للحصول على تركيز من 1 ميكروغرام / ميكرولتر.
- Resusإدخال رقم التعريف الشخصي القارورة 0.8 ملغ من TMT صفر (TMT 0، انظر جدول المواد) كاشف في 41 ميكرولتر من ACN. اتبع recommendantions الشركة المصنعة لإعادة تعليق.
- تسمية عينات الببتيد في نسبة 50 ميكروغرام الببتيدات إلى 0.4 ملغ TMT 0 (أي 50 ميكرولتر من الببتيدات إلى 20.5 ميكرولتر من TMT 0). في احتضان RT لمدة 1 ساعة.
- إخماد رد فعل الوسم بإضافة 5٪ هيدروكسيل بنسبة 6: 100 (أي 4.23 ميكرولتر من 5٪ هيدروكسيل). في احتضان RT لمدة 15 دقيقة.
- تجفيف العينات الببتيد TMT 0 -labelled لمدة 1 ساعة على RT باستخدام مكثف فراغ. Resuspend في 10 ميكرولتر من DDH 2 O.
ملاحظة: نظرا لبقايا غليكان، glycopeptides عرض كتلة الجزيئية أعلى من الببتيدات غير الغليكوزيلاتي. TMT 0 يزيد من ولاية تهمة من glycopeptides. وهذا يقلل من الكتلة النسبية لتوجيه الاتهام (م / ض) النسب ويسهل تفتيت ETD.
7. سكري التخصيب
- استخدام مخازن رد الفعل المنصوص عليها في عدة (انظر جدول المواد).
- إضافة 50 ميكرولتر من العازلة ملزمة لكل عينة 10 ميكرولتر من الخطوة 6.5. دوامة الحل الراتنج glycocapture حتى يصبح متجانس. استخدام zwitterionic التفاعل ماء السائل اللوني (ZIC-HILIC) القائم على التقاط 15.
- قسامة 50 ميكرولتر من تعليق الراتنج إلى 1.5 أنابيب جديدة مل. تدور لمدة 1 دقيقة في 2500 x ج وإزالة طاف. إضافة 60 ميكرولتر من عينة (أي عينة مع العازلة ملزمة) للأنابيب تحتوي على حبيبات الراتنج. مزيج باستخدام ماصة واحتضانها في RT لمدة 20 دقيقة في التحريض على 1200 دورة في الدقيقة.
- أجهزة الطرد المركزي لمدة 2 دقيقة في 2000 x ج وطاف لنقل أنابيب جديدة. إبقاء الأنابيب. إضافة 150 ميكرولتر من غسل العازلة للأنابيب الراتنج. مزيج باستخدام ماصة واحتضانها في RT لمدة 10 دقيقة في التحريض على 1200 دورة في الدقيقة.
- تدور لمدة 2 دقيقة في 2500 ز س. تحويلطاف لنفس الأنابيب (من الخطوة 7.4). تكرار غسل الخطوات مرتين.
- إضافة 75 ميكرولتر من شطف العازلة والمزيج باستخدام ماصة. تستنهض الهمم في 1200 دورة في الدقيقة لمدة 5 دقائق على RT ثم الطرد المركزي الأنابيب لمدة 2 دقيقة في 2500 ز س. نقل supernatants إلى 1.5 أنابيب جديدة مل. كرر الخطوات الغسيل ومن ثم نقل طاف الشطافة إلى نفس الأنبوب.
- أنابيب الطرد المركزي التي تحتوي على شطافة (أي glycopeptides) لمدة 2 دقيقة في 2500 ز س. طاف لنقل أنابيب جديدة لضمان إزالة أي راتنج المتبقية من الخطوات السابقة.
- تجفيف مجموع 150 ميكرولتر من شطافة باستخدام مكثف للفراغ ما يقرب من 2 ساعة عند RT. إعادة تعليق glycopeptides المجفف إلى أسفل في 15 ميكرولتر من 2٪ ACN و 0.05٪ TFA في ده 2 O.
- الشروع في أداء LC-MS / MS باستخدام تجزئة HCD لتحليل تكوين البروتين ECM، وLC-MS / MS باستخدام HCD وتجزئة ETD لتوصيف سكري. انظر القسم 8.
- أداء LC-MS / MS باستخدام تجزئة HCD لتحليل تكوين البروتين ECM. رؤية طرق التكميلي للحصول على التفاصيل.
- أداء LC-MS / MS باستخدام HCD وتجزئة ETD لتوصيف سكري (انظر أساليب التكميلي لمزيد من التفاصيل). وينبغي مقارنة العينة المخصب إلى المدخلات المادية غير المخصب 15.
ملاحظة: وصف مفصل لطرق LC-MS / MS للتحليل غير مباشر سكري، تحليل سكري المباشر، والبحث في قاعدة البيانات يتم توفيرها في أساليب التكميلي. ويتم تشجيع الباحثين المهتمين في وصف البروتين ECM وتكوين غليكان باستخدام مطياف الكتلة للإشارة إلى المنشورات السابقة 3 و 11 و 15.
تحليل 8. الطيف الكتلي
النتائج
ويرد سير العمل التخطيطي للبروتوكول في الشكل 1.
بروتوكول استخراج ECM
يمكن رصد كفاءة الاستخراج عن طريق تشغيل أجزاء مأخوذة تشكل كل مستخلص على المواد الهلامية الأكريلاميد مكرر تريس وباستخدام تلطيخ الفضة التصور. ويبين الشكل 2A التكامل بين كلوريد الصوديوم، SDS وGuHCl مقتطفات بعد الاستخلاص المتسلسل. هذا QC تسمح لتحديد المشاكل المحتملة مع نوعية العينة مثل تدهور البروتين الزائد. بعد الاستخراج، وبروتينات سكرية ECM وفيرة في مقتطفات GuHCl (الشكل 2B).
Deglycosylation
لتقييم كفاءة deglycosylation، يجب تشغيل عنصر تحكم غير deglycosylated في السلطة الفلسطينيةrallel. مرات Deglycosylation يجب أن تكون مناسبة لتحقيق الإزالة الكاملة ومتجانسة من مخلفات السكر، كما يتضح في الشكل 3A. ويبين الشكل 3B مثال نموذجي من العينات deglycosylated بكفاءة عن طريق اضافة الانزيمات لإزالة GAG وdeglycosylation الانزيمات التي تستهدف أصغر N- وO-مرتبطة يغوساكاريدس.
Glycoproteomics
بروتوكول لتقييم إشغال sequons NXT / S يحسن بروتين تغطية تسلسل للبروتينات سكرية ECM بعد MS (الشكل 3C) ويسمح الفرز المبدئي لوجود بروتينات سكرية. وهذا يساعد على تقليل الوقت البحث عن glycopeptides، وقواعد البيانات يمكن أن تكون مخصصة لاحتواء البروتينات السكرية التي سبق تحديدها. يستخدم HCD-ETD تجزئة لتحديد وتوصيف التركيبي من يغوساكاريدس تعلق على ECM ز lycoproteins. يعرض الشكل 4A مجموعة تمثيلية تم الحصول عليها الببتيد المسمى مع 18 O بعد deglycosylation (تحليل سكري غير مباشر). الشكل 4B مثال الممثلين الطيف تم الحصول عليها بعد تحليل glycopeptides سليمة من مقتطفات ECM (تحليل سكري المباشر).
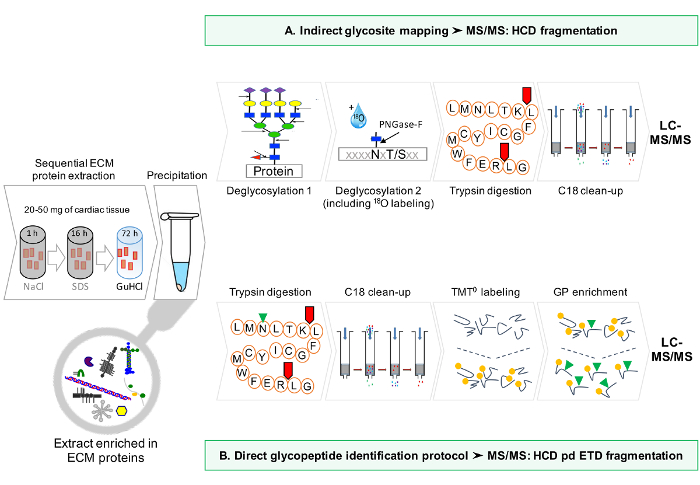
الشكل 1: طريقة نظرة عامة. (A) بعد تخصيب متسلسل للبروتينات ECM، يتم تنفيذ التحليلات LC-MS / MS على مقتطفات deglycosylated. (B) بدلا من ذلك، يتم إثراء غير مقتطفات ECM deglycosylated كذلك إلى glycopeptides. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
2 "SRC =" / ملفات / ftp_upload / 55674 / 55674fig2.jpg "/>
الشكل 2: استخراج ECM البروتينات. (A) 3 مقتطفات مختلفة من الإجراء الاستخلاص المتسلسل ( "الانجليزية خطوة سريعة") متكاملان في محتوى البروتين. في حين يتم إثراء مقتطفات SDS في البروتينات داخل الخلايا وعصائر GuHCl تحتوي معظم البروتينات ECM. هو تصور تجزئة الناجحة التي قام بها مختلف نمط الفضة تلطيخ. البروتينات (B) ECM مثل-ليسين الغنية صغير البروتيوغليكان decorin، biglycan وmimecan يتم اكتشاف معظمها في مقتطفات GuHCl، مع وجود القليل في مقتطفات SDS وكلوريد الصوديوم. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
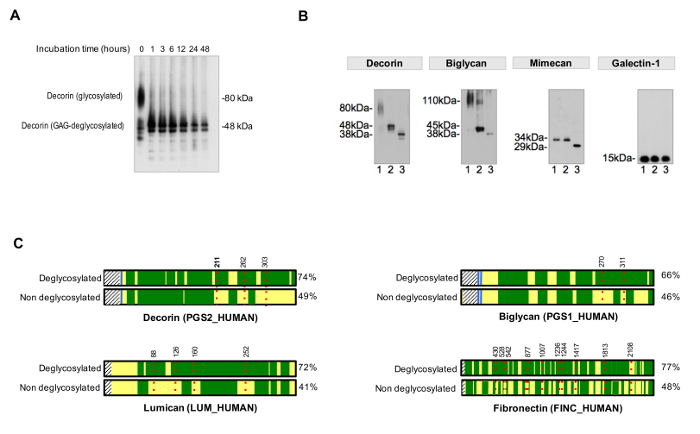
الشكل 3. تحليل Glycosylation. مطلوبة (A) مرات الحضانة المناسبة لdeglycosylation كاملة. يظهر المثال تأثير فترة حضانة خلال إزالة السلاسل جلايكان من decorin بروتين سكري. زينت بروتينات سكرية (B) ECM مع سلاسل كبيرة ومتكررة غلكسمينوغلكن وN- قصيرة ومتنوعة ويغوساكاريدس المرتبطة O. حارة 1 على كل من immunoblots يمثل مقتطفات القلب غير المعالجة. 2 لين يحتوي على مقتطفات تعامل مع الإنزيمات التي تهضم الجليكوسامينوجليكان. العينات في حارة 3 تحتوي بالإضافة إلى ذلك، الانزيمات لإزالة oligossacharides N- وO-مرتبط. لا الغليكوزيلاتي Galectin-1، وبالتالي لا يوجد أي تغيير في حجم البروتين. مقتبس من لينش M، وآخرون. 4 (C) في LC-MS / MS تحليل عينات تعامل مع PNGase-F في وجود H 2 O 18 تحقيق أفضل تغطية تسلسل (٪، على الجانب الأيمن) بالمقارنة مع عينات غير deglycosylated. دتمثل المساحات الخضراء تابوت تغطية تسلسل LC-MS / MS. و، الخطوط المنقطة الحمراء تمثل glycosites، مع الأرقام تشير إلى موقف الأحماض الأمينية. ويرد الكشف عن بالغليكوزيل من decorin في موقف الأسباراجين 211 (N، أبرز بالخط العريض) بالتفصيل على سبيل المثال في الشكل 4. يرجى النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
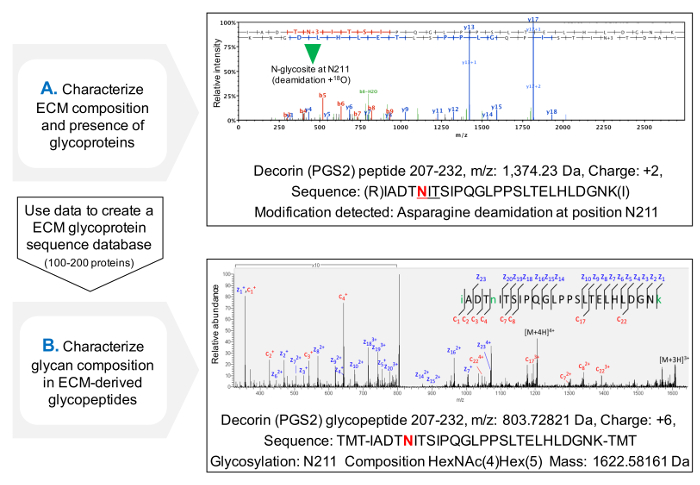
الشكل 4. تحليل سكري التي كتبها MS. (A) باستخدام نهج البروتينات طلقات نارية على ECM مقتطفات المخصب، glycopeptides يمكن تحديدها من خلال وجود asparagines deamidated داخل sequons NXT / S وصفت مع 18 O. يظهر المثال طائفة HCD MS / MS لالببتيد من decorin التي تحتوي على الغليكوزيلاتي سابقا الأسباراجين 211. البيانات التي تم الحصول عليها يمكن استخدامهالإنشاء قاعدة بيانات مخصصة من بروتينات سكرية ECM. يستخدم تجزئة (B) HCD-ETD لتحليل سكري المخصب استخراج ECM. الطيف ETD MS / MS يسمح توصيف التركيب غليكان. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
| حلول A. المالية | |
| DTT (Dithiotreitol، C 4 H 10 O 2 S 2) | 100 ملي DTT في ده 2 O. 1 |
| EDTA (ثنائي أمين الإيثيلين رباعي حمض الخل، C 10 H 16 N 2 O 8) | 250 ملي EDTA في ده 2 O، ودرجة الحموضة 8.0. |
| GuHCl (جوانيداين هيدروكلوريد، CH 6 CLN 3) | 8 M GuHCl فيده 2 O. |
| IAA (Iodoacetamide، C 2 H 4 INO) | 500 ملي IAA في ده 2 O. 1،2 |
| نا خلات (أسيتات الصوديوم، C 2 H 3 الحسابية 2) | 1 خلات M نا في [ده 2 O، ودرجة الحموضة 5.8. |
| كلوريد الصوديوم (كلوريد الصوديوم، كلوريد الصوديوم) | 1 M كلوريد الصوديوم في [ده 2 O. |
| نا فوسفات ثنائي القاعدة (الصوديوم والفوسفات، ونا 2 H 2 PO 4) | 1 M نا ثنائي القاعدة فوسفات في ي H 2 O، ودرجة الحموضة 6.8. |
| SDS (الصوديوم دوديسيل كبريتات، NAC 12 H 25 SO 4) | 1٪ SDS (35 ملم) في [ده 2 O. 3 |
| TFA (Trifluoroacetic حامض، C 2 HF 3 O 2) | 10٪ TFA (1.2 M) في [ده 2 O. |
| TEAB (Triethylammonium بيكربونات، C 7 H 17 NO 3) | TEAB 1M في في ddH2O، ودرجة الحموضة 8.5 |
| ثيوريا (ثيوريا، CH 4 N 2 S) | 3 M ثيوريا في ده 2 O. |
| تريس، حمض الهيدروكلوريك (تريس، هيدروكلوريد (NH 11 C 4 O 3 [حمض الهيدروكلوريك]) | 100 ملي تريس، حمض الهيدروكلوريك في ده 2 O، ودرجة الحموضة 7.5. |
| اليوريا (اليوريا، CH 4 N 2 O) | 9 M اليوريا في ده 2 O. |
| B. مخازن رد الفعل | |
| C18 عازلة موازنة تنظيف | 1٪ ACN، 0.1٪ TFA في ده 2 O |
| C18 تنظيف غسل العازلة العمود | 80٪ ACN، 0.1٪ TFA في H 2 O |
| C18 شطف العازلة تنظيف | 50٪ أسيتونيتريل، 0.1٪ TFA في ده 2 O |
| Deglycosylation العازلة (4X) | 600 مم كلوريد الصوديوم والفوسفات 200 ملي نا في [ده 2 O، ودرجة الحموضة 6.8. |
| عازلة GuHCl 4 | 4 M جوانيداين هيدروكلوريد، 50 ملي نا خلات و 25 ملي EDTA في ده 2 O، ودرجة الحموضة 5.8. إضافة 1: 100 (ت: ت) من مزيج من مثبطات بروتين قبل الاستخدام. |
| عازلة كلوريد الصوديوم 4 | 0.5 M كلوريد الصوديوم، و 10 ملي تريس، حمض الهيدروكلوريك و 25 ملي EDTA في ده 2 O، ودرجة الحموضة 7.5. إضافة 1: 100 (ت: ت) من مزيج من مثبطات بروتين قبل الاستخدام. |
| برنامج تلفزيوني (1X) | 1.7 ملي KH 2 PO 4، 5 مم نا 2 هبو 4، 150 مم كلوريد الصوديوم، ودرجة الحموضة 7.4. إضافة 25 ملي EDTA و 1: 100 (ت: ت) من مزيج من مثبطات بروتين قبل الاستخدام. |
| عينة العازلة (4X) | 100 ملي تريس، 2٪ SDS، 40٪ الجلسرين، 0.02٪ برموفينول الأزرق في ده 2 O، ودرجة الحموضة 6.8. إضافة 10٪ SS-المركابتويثانول قبل الاستخدام. |
| العازلة SDS 4 | 0.1٪ SDS و 25 ملي EDTA في ده 2 O. إضافة 1: 100 (ت: ت) من مزيج من مثبطات بروتين فرنكااستخدام خام. |
| C. إنزيمات | |
| Chondroitinase ABC 5 | 0.5 U / مل في المخزن deglycosylation (1X) |
| Keratanase 5 | 0.1 U / مل في المخزن deglycosylation (1X) |
| Heparinase II 5 | 0.1 U / مل في المخزن deglycosylation (1X) |
| α2-3،6،8،9-النورامينيداز (سياليداز) 5 | 0.025 U / مل في المخزن deglycosylation (1X) |
| β1،4 غالاكتوزيداز 5 | 0.015 U / مل في المخزن deglycosylation (1X) |
| بيتا-N-5 Acetylglucosaminidase | 0.25 U / مل في المخزن deglycosylation (1X) |
| إندو-α-N-acetylgalactosaminidase (O-غليكوزيداز) 5 | 0.013 U / مل في المخزن deglycosylation (1X) |
| PNGase-F (N-غليكوزيداز-F) 6 | 50 U / مل في H 2 O 18 |
| التربسين | 0.01 ميكروغرام / ميكرولتر العازلة في TEAB |
| NOTES الجدول. | |
| 1 الحفاظ على حل الأوراق المالية المجمدة في -20 ° C. | |
| يجب أن تبقى 2 IAA محمية من الضوء. | |
| 3 SDS يبلور بسهولة في <20 ° C. من أجل تسهيل الإذابة من 1٪ SDS (المحلول)، تدفئة العازلة تحت صنبور الماء الساخن. | |
| ويمكن تخزين 4 مخازن استخراج في RT. إضافة كوكتيل واسعة الطيف من مثبطات بروتين كما هو مبين قبل الاستخدام. | |
| 5 يجب أن تضاف هذه الانزيمات خلال الخطوة الأولى deglycosylation. | |
| 6-F PNGase ينبغي أن يضاف فقط خلال خطوة deglycosylation الثانية. | |
الجدول 1: حلول المالية، المخازن رد الفعل والانزيمات. يسرد هذا الجدول تكوين كل عازلة حل الأوراق المالية وردود الفعل اللازمة لاستخراج ومعالجة لاحقة (بما في ذلك الهضم الأنزيمية) من البروتينات ECM القلب قبل تحليل MS.
Discussion
وقد تم تحسين هذا البروتوكول البروتينات على مدى السنوات القليلة الماضية في مختبرنا. هنا، كنا أنسجة القلب، ولكن قد تكون هناك حاجة فقط تعديلات طفيفة لتطبيقه على الأنسجة الأخرى. على سبيل المثال، يحتاج بروتوكول استخراج لاتخاذ الخلوية للنسيج في الاعتبار. الأنسجة القلبية هي الخلوية للغاية بالمقارنة مع الأنسجة الوعائية. عند استخدام الأنسجة الوعائية، يمكن للتركيز SDS يكون أقل (أي 0،08٪)، والوقت decellularization هو أقصر (أي 4 ح) 11، 12، 13. استخدام الإنزيمات deglycosylation هو أمر حاسم لتحليل LC-MS / MS التكوين ECM. ومع ذلك، يجب أن يتم تعديلها لأنواع الأنسجة المختلفة الأوقات الحضانة. على سبيل المثال، heparinase II المطلوبة مرات حضانة تمتد على 25 ° C عند استخدام عينات مثل الجلد، والتي هي غنية في البروتينات الغشاء القاعدي (على سبيل المثال أجرين AGRIN، perlecan) (لا تظهر البيانات). يمكن إجراء تحليل سكري مباشر على وسائل الاعلام مشروط من الخلايا في الثقافة (15). قد لا تكون هناك حاجة خطوات تخصيب اليورانيوم لتحليل هذه subproteome المبسطة. على غرار مقتطفات GuHCl وعصائر كلوريد الصوديوم هي أيضا قابلة للتحليل glycoproteomics مع تعديلات طفيفة. بروتوكولات استخراج أخرى لتخصيب اليورانيوم من البروتينات ECM يمكن تكييفها لتوصيف glycopeptides ECM 19 و 20.
بالغليكوزيل هو PTM الأكثر تعقيدا 5. ويتحقق تحديد غير مباشر من glycopeptides من قبل الكشف عن deamidated الأسباراجين مع دمج 18 O في NXT / S sequon. Deamidated الأسباراجين في مواقف أخرى قد تمثل ايجابيات كاذبة. وبالمثل، يجب النظر N-بالغليكوزيل في سياق تجميعات البروتين: والبروتينات داخل الخلايا التي تحتوي على NXT / S sequon لا يمكن الغليكوزيلاتي ولكن قد تؤدي إلى ايجابيات كاذبة. كما البحث في الانترنت الحاليةخوارزميات ح لا تسمح لفحص PTMs في تسلسل محددة مسبقا فقط (أي الأسباراجين في NXT / S)، مطلوب تصفية اليدوي للبيانات. تحديد وجود / غياب بالغليكوزيل في هذه المواقف يمكن مقارنة بين عينات من الأمراض ومكافحتها. ليس هناك ما يعادلها انزيم لPNGase F لO-deglycosylation (أي إدخال التحول الشامل على ثريونين أو سيرين). لذلك، يتم تقييد تحديد O-بالغليكوزيل لتحليل سكري المباشر. ويستخدم تحليل سكري المباشر للحصول على معلومات التركيبية من السكريات تعلق على البروتينات، ولكن لا توفر المعلومات الهيكلية للغليكان. وعلاوة على ذلك، وتكوين غليكان هو نتيجة لتركيب غليكان وتجهيز بعد إفراز.
وقد سمح لنا طريقة استخراج 3 خطوات للبروتينات ECM ( "الانجليزية خطوة سريعة") 6 تميز ECM في مجموعة متنوعة من أنسجة القلب والأوعية الدموية. تجزئة النسيجإلى عدة مقتطفات مطلوب للحصول على بروتيوم ECM مبسط كما نوقش في أي مكان آخر 6. أن البروتينات داخل الخلايا يساهم ذلك إلى مجموعة ديناميكية المفرط للتركيزات البروتين داخل مقتطفات من شأنها أن تعيق تحديد البروتينات ECM أقل وفرة. وعلاوة على ذلك، والبروتينات داخل الخلايا تحمل O-glycosylations 5 التي من شأنها تعقيد ECM تخصيب سكري وتحليل MS احق. مؤلفين آخرين تطبيق منهجيات استخراج مماثلة لوصف على سبيل المثال الرئة 21 و أنسجة الغضروف 10، إلا أنها لم يتابع تحليل بالغليكوزيل. التحليل السابق لبالغليكوزيل تركز على تحديد glycosites فقط، تتطلب إزالة غليكان من صميم البروتين، ولا يمكن تقييم O-بالغليكوزيل 22 و 23. صفائف كتين وإثراء الكيميائية المتاحة للتقييم من الطرق والجسور غليكانوفاق على عينات بيولوجية تعتمد على خصوصية ملزمة، ولكن لا يمكن لهذه التقنيات تعيين أنواع غليكان إلى بروتينات معينة 24 ولا يستطيعون تقييم المواقع بالغليكوزيل.
في البداية، كنا هلام الكهربائي قبل LC-MS / MS من البروتينات ECM. على الرغم من أن فصل هلام مفيد في الحصول على أجزاء البروتين مبسطة قابلة للتحليل LC-MS / MS، أحدث الأدوات توفر سرعة المسح الضوئي بسرعة. وهكذا، فإن الخطوة الفصل الكهربي يمكن حذفها. وهذا يوفر ميزة إضافية كما يتم تحليل البروتينات ECM الكبيرة، والتي يتم الاحتفاظ بها على رأس هلام، وأكثر كفاءة. ومع ذلك، يتم فقدان المعلومات المتعلقة ميغاواط من البروتينات سليمة. الخطوة تبخر قبل PNGase F deglycosylation يضمن إزالة كاملة من العادي H 2 O للحد من السلبيات كاذبة. بقايا السكر (أي الجماهير غليكان متغير) تتداخل مع الفاصل LC وسطا تحديد الببتيد لاحق من قبل MS / MS. A صوأوصت-deglycosylation البروتوكول أيضا لتحليل البروتينات البروتينات ECM لا تركز على بالغليكوزيل.
يمكن أن البروتينات تقدم رؤى غير مسبوقة في ECM. ما وراء الدعم الهيكلي، glycans تعلق على ECM ضرورية للتفاعل المضيف الممرض والاتصالات خلية خلية والاستجابة المناعية 25، أي المزروع الرفض بعد زرع الأعضاء. سوف Glycoproteomics يكون أداة أساسية في غليكوبيولوغي.
Disclosures
لا شيء.
Acknowledgements
JBB هو زميل مؤسسة الوظيفي في مركز الملك القلب البريطانية مؤسسة. MM هو زميل أقدم في مؤسسة القلب البريطانية (FS / 13/2/29892). وأيد هذه الدراسة من قبل مبادرة التميز (مراكز الكفاءة لتقنيات ممتازة - COMET) من الوكالة النمساوية تعزيز البحوث FFG: "مركز أبحاث التميز في الأوعية الدموية الشيخوخة - تيرول، VASCage" (رقم مشروع K 843536) وبحوث الطبية الحيوية NIHR مركز مقرها في مؤسسة الخدمات الصحية الصندوق الوطني غاي وسانت توماس "وكينجز كوليدج لندن في شراكة مع مستشفى كينجز كوليدج.
Materials
| Name | Company | Catalog Number | Comments |
| A. Chemicals | |||
| Acetonitrile, MS-grade (ACN, C2H3N) | Thermo Scientific | 51101 | 5.2-5.8, 6.2, 7.11, Supp 2, 3, 4 |
| Cocktail of proteinase inhibitors | Sigma-Aldrich | P8340 | 1.3, 1.4.1, 1.5.1, 1.6.1 |
| Disodium phosphate (Na2H2PO4) | Sigma-Aldrich | S7907 | 3.1 |
| Dithiotreitol (DTT, C4H10O2S2) | Sigma-Aldrich | D0632 | 4.3 |
| Ethylenediaminetetraacetic acid (EDTA, C10H16N2O8) | Sigma-Aldrich | E9884 | 1.3, 1.4.1, 1.5.1, 1.6.1 |
| Ethanol (C2H6O) | VWR | 437433T | 2.2.1 |
| Guanidine hydrochloride (GuHCl, CH6ClN3) | Sigma-Aldrich | G3272 | 1.6.1 |
| Glycerol (C3H8O3) | Acros organics | 158920025 | Suppl 1.1 |
| H2O LC-MS Cromasolv | Sigma-Aldrich | 39253-1L-R | Throughout the protocol |
| H218O | Taiyo Nippon Sanso | FO3-0027 | 3.5 |
| Hydroxylamine (HA, H3NO) | Sigma-Aldrich | 467804 | 6.4 |
| Iodoacetamide (IAA, C2H4INO) | Sigma-Aldrich | A3221 | 4.4 |
| Phosphate-buffered Saline (PBS), 10x | Lonza | 51226 | 1.3 |
| Sodium acetate (C2H3NaO2) | Sigma-Aldrich | S7545 | 1.6.1 |
| Sodium chloride (NaCl) | Sigma-Aldrich | S9888 | 1.4.1, 3.2 |
| Sodium dodecyl sulfate (SDS, NaC12H25SO4) | Sigma-Aldrich | 466143 | 1.5.1 |
| Triethylammonium bicarbonate (TEAB, C7H17NO3) | Sigma-Aldrich | 11268 | 4.7, 6.1 |
| Trifluoroacetic acid (TFA, C2HF3O2) | Sigma-Aldrich | T62200 | 4.8, 5.2-5.8, 7.11, Supp 2, 3 |
| Thiourea (CH4N2S) | Sigma-Aldrich | T8656 | 4.2 |
| Tris-hydrochloride (Tris-HCl, NH11C4O3[HCl]) | Sigma-Aldrich | T3253 | 1.4.1, Suppl 1. |
| Urea (CH4N2O) | Sigma-Aldrich | U1250 | 4.2 |
| Name | Company | Catalog Number | Comments |
| B. Enzymes | |||
| α2-3,6,8,9-Neuraminidase (Sialidase) | EDM Millipore | 362280 (KP0012) | 3.1 |
| β1,4-Galactosidase | EDM Millipore | 362280 (KP0004) | 3.1 |
| β-N-Acetylglucosaminidase | EDM Millipore | 362280 (KP0013) | 3.1 |
| Chondroitinase ABC | Sigma-Aldrich | C3667 | 3.1 |
| Endo-α-N-acetylgalactosaminidase (O-glycosidase) | EDM Millipore | 362280 (KP0011) | 3.1 |
| Heparinase II | Sigma-Aldrich | H6512 | 3.1 |
| Keratanase | Sigma-Aldrich | G6920 | 3.1 |
| PNGase-F (N-Glycosidase F) | EDM Millipore | 362280 (KP0001) | 3.5 |
| Trypsin | Thermo Scientific | 90057 | 4.7 |
| Name | Company | Catalog Number | Comments |
| C. Reagent kits | |||
| 30 kDa MWCO spin filters | Amicon, Millipore | 10256744 | 5.9, Suppl 2 |
| Macro SpinColumn C-18, 96-Well Plate | Harvard Apparatus | 74-5657 | 5.1 |
| NuPAGE Novex BisTris Acrylamide Gels | Thermo-Scientific | NP0322PK2 | Suppl 1 |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23227 | 2.1.3 |
| ProteoExtract Glycopeptide Enrichment Kit | Merk Millipore | 72103 | 7 |
| Tandem mass tag 0 (TMT0) | Thermo Scientific | 900067 | 6.2, 6.3 |
| Name | Company | Catalog Number | Comments |
| D. Equipment and software | |||
| Acclaim PepMap100 C18 Trap, 5 mm x 300 µm, 5 µm, 100 Å | Thermo Scientific | 160454 | Suppl 3, 4 |
| Acclaim PepMap100 C18, 50 cm x 75 µm, 3 µm, 100 Å | Thermo Scientific | 164570 | Suppl 3 |
| Byonic Search Engine | Protein Metrics | Version 2.9.30 | Suppl 5 |
| Dionex UltiMate 3000 RSLCnano | Thermo Scientific | n/a | Suppl 3, 4 |
| EASY-Spray Ion Source | Thermo Scientific | ES081 | Suppl 4 |
| EASY-Spray PepMap RSLC C18, 50 cm x 75 µm, 2 μm, 100 Å | Thermo Scientific | ES803 | Suppl 4 |
| Mascot Search Engine | Matrix Science | Version 2.3.01 | Suppl 3 |
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | IQLAAEGAAPFADBMBHQ | Suppl 4 |
| Proteome Discoverer Software | Thermo Scientific | Version 2.1.1.21 | Suppl 3, 5 |
| Picoview Nanospray Source | New Objective | 550 | Suppl 3 |
| Q Exactive HF Mass Spectrometer | Thermo Scientific | IQLAAEGAAPFALGMBFZ | Suppl 3 |
| Savant SpeedVac Concentrator | Thermo Scientific | SPD131DDA | 2.2.2, 3.4, 4.6, 5.7, 6.5, 7.11 |
| Scaffold Software | Proteome Software | Version 4.3.2 | Suppl 3 |
References
- Porter, K. E., Turner, N. A. Cardiac fibroblasts: at the heart of myocardial remodeling. Pharmacol. Ther. 123 (2), 255-278 (2009).
- Barallobre-Barreiro, J., et al. Proteomics analysis of cardiac extracellular matrix remodeling in a porcine model of ischemia/reperfusion injury. Circulation. 125 (6), 789-802 (2012).
- Barallobre-Barreiro, J., et al. Glycoproteomics reveals decorin peptides with anti-myostatin activity in human atrial fibrillation. Circulation. 134 (11), 817-832 (2016).
- Lynch, M., Barallobre-Barreiro, J., Jahangiri, M., Mayr, M. Vascular proteomics in metabolic and cardiovascular diseases. J. Intern. Med. 280 (4), 325-338 (2016).
- Varki, A., Lowe, J. B., Varki, A. Biological Roles of Glycans. Essentials of glycobiology. 2nd ed. , (2009).
- Barallobre-Barreiro, J., Lynch, M., Yin, X., Mayr, M. Systems biology - opportunities and challenges: The application of proteomics to study the cardiovascular extracellular matrix. Cardiovasc. Res. , (2016).
- Agnetti, G., Husberg, C., Van Eyk, J. E. Divide and conquer: the application of organelle proteomics to heart failure. Circ. Res. 108 (4), 512-526 (2011).
- Mason, R. M., Mayes, R. W. Extraction of cartilage protein-polysaccharides with inorganic salt solutions. Biochem. J. 131 (13), 535-540 (1973).
- Vogel, K. G., Peters, J. A. Isolation of proteoglycans from tendon. Methods. Mol. Biol. 171, 9-17 (2001).
- Wilson, R., et al. Comprehensive profiling of cartilage extracellular matrix formation and maturation using sequential extraction and label-free quantitative proteomics. Mol. Cell. Proteomics. 9 (6), 1296-1313 (2010).
- Barallobre-Barreiro, J., et al. Extracellular matrix remodeling in response to venous hypertension: proteomics of human varicose veins. Cardiovasc. Res. 110 (3), 419-430 (2016).
- Didangelos, A., Yin, X., Mandal, K., Baumert, M., Jahangiri, M., Mayr, M. Proteomics characterization of extracellular space components in the human aorta. Mol. Cell. Proteomics. 9 (9), 2048-2062 (2010).
- Didangelos, A., et al. Extracellular matrix composition and remodeling in human abdominal aortic aneurysms: a proteomics approach. Mol. Cell. Proteomics. 10 (8), (2011).
- Grandoch, M., et al. Loss of biglycan enhances thrombin generation in apolipoprotein E-deficient mice: Implications for inflammation and atherosclerosis. Arterioscler Thromb. Vasc. Biol. 36 (5), e41-e50 (2016).
- Yin, X., Bern, M., Xing, Q., Ho, J., Viner, R., Mayr, M. Glycoproteomic analysis of the secretome of human endothelial cells. Mol. Cell. Proteomics. 12 (4), 956-978 (2013).
- Parker, B. L., et al. Quantitative N-linked glycoproteomics of myocardial ischemia and reperfusion injury reveals early remodeling in the extracellular environment. Mol. Cell. Proteomics. 10 (8), (2011).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Anal. Biochem. 150 (1), 76-85 (1985).
- Pepinsky, R. B. Selective precipitation of proteins from guanidine hydrochloride-containing solutions with ethanol. Anal. Biochem. 195 (1), 177-181 (1991).
- de Castro-Brás, L. E., et al. Texas 3-step decellularization protocol: looking at the cardiac extracellular matrix. J. Proteomics. 86, 43-52 (2013).
- Naba, A., Clauser, K. R., Hynes, R. O. Enrichment of extracellular matrix proteins from tissues and digestion into peptides for mass spectrometry analysis. J Vis Exp. (101), e53057 (2015).
- Decaris, M. L., et al. Proteomic analysis of altered extracellular matrix turnover in bleomycin-induced pulmonary fibrosis. Mol. Cell. Proteomics. 13 (7), 1741-1752 (2014).
- Zhang, H., Li, X. J., Martin, D. B., Aebersold, R. Identification and quantification of N-linked glycoproteins using hydrazide chemistry, stable isotope labeling and mass spectrometry. Nat. Biotechnol. 21 (6), 660-666 (2003).
- Parker, B. L., et al. Site-specific glycan-peptide analysis for determination of N-glycoproteome heterogeneity. J. Proteome Res. 12 (12), 5791-5800 (2013).
- Li, Y., et al. Simultaneous analysis of glycosylated and sialylated prostate-specific antigen revealing differential distribution of glycosylated prostate-specific antigen isoforms in prostate cancer tissues. Anal. Chem. 83 (1), 240-245 (2011).
- Rienks, M., Papageorgiou, A. P., Frangogiannis, N. G., Heymans, S. Myocardial extracellular matrix: an ever-changing and diverse entity. Circ. Res. 114 (5), 872-888 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved