A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الرقم الهيدروجيني "الكمي داخل الخلايا" الضوئية في Epithelia نبيب Malpighian melanogaster المورفولوجية مع الرقم الهيدروجيني "الفلورسنت وراثيا" ترميز مؤشر
In This Article
Summary
يمكن تقييم النقل أيون الخلوية غالباً عن طريق مراقبة درجة الحموضة داخل الخلايا (الأس الهيدروجينيأنا). وراثيا مرمز الأس الهيدروجيني-المؤشرات (جيفيس) توفر الكمي البصري لدرجة الحموضة داخل الخلايا في الخلايا سليمة. تفاصيل هذا البروتوكول التحديد الكمي لدرجة الحموضة داخل الخلايا عن طريق الخلوي السابقين فيفو العيش-التصوير للأنابيب مالباييان من melanogaster المورفولوجية مع فري، زائفة-راتيوميتريك وراثيا ترميز مؤشر الرقم الهيدروجيني.
Abstract
النقل أيون الظهارية أمر حيوي للتوازن أيون النظامية، فضلا عن الحفاظ على التدرجات الكهروكيميائية الخلوية الأساسية. PH داخل الخلايا (درجة الحموضةأنا) يتأثر بالعديد من أيون الناقلين وهكذا رصد درجة الحموضةأنا أداة مفيدة لتقييم نشاط الناقل. الحديثة "وراثيا ترميز" الأس الهيدروجيني-(جيفيس) توفر المؤشرات الضوئية الكمي لدرجة الحموضةوأنا في خلايا سليمة في نطاق الخلايا وسوبسيلولار. يصف هذا البروتوكول الكمي في الوقت الحقيقي للأس الهيدروجيني الخلويةأنا تنظيم في الأنابيب Malpighian (MTs) من melanogaster المورفولوجية عن طريق السابقين فيفو العيش-تصوير فري، جيفي زائفة-راتيوميتريك مع فك مناسبة جداً لتعقب التغييرات الأس الهيدروجيني في سيتوسول. يطير الكبار المستخرجة MTs تتألف من فروع متميزة وظيفيا وشكليا من طبقة وحيدة الخلية ابيثيليا، ويمكن أن تكون بمثابة نموذجا موجوداً وتتبعها وراثيا للتحقيق في النقل الظهارية. جيفيس تقدم العديد من المزايا التقليدية الأصباغ الفلورية حساسة لدرجة الحموضة واقطاب الأيوني الانتقائي. يمكن تسمية جيفيس السكان خلية متميزة شريطة توافر عناصر المروج المناسبة. هذه العلامات مفيدة بشكل خاص في السابقين فيفو، في فيفو، و في الموقع الاستعدادات، التي أصلاً غير متجانسة. كما تسمح جيفيس الكمي pHi في أنسجة سليمة مع مرور الزمن دون الحاجة لتخريج المعاملة أو الأنسجة صبغ المتكررة. العيب الرئيسي من جيفيس الحالي هو الميل إلى تجميع في تضمينات سيتوسوليك استجابة لتلف الأنسجة وبناء التعبير المفرط. وأظهرت أوجه القصور هذه، وحلولها، ومزايا جيفيس المتأصلة في هذا البروتوكول من خلال تقييم للنقل بروتون (H+) باسولاتيرال في الخلايا الرئيسية وتلعبه متميزة وظيفيا ذبابة المستخرجة النظام التجاري المتعدد الأطراف. التقنيات وتحليل ووصف القابلة للتكييف وفقا لمجموعة متنوعة من الأعمال التحضيرية الفقاريات واللافقاريات، ويمكن تحجيمها تطور المقايسة من تدريس مختبرات لتحديد معقدة لايون الجريان عبر الناقلين محددة.
Introduction
والهدف من هذا البروتوكول هو وصف التقدير الكمي لدرجة الحموضة داخل الخلايا (pHi) باستخدام ترميز وراثيا الأس الهيدروجيني-مؤشر (جيفي) وتبين كيف يمكن استخدام هذا الأسلوب لتقييم باسولاتيرال ح+ النقل في نموذج حشرة (د ميلانوجاستير) هيكل الكلوي، أنبوب مالباييان (طن متري). النظام التجاري المتعدد الأطراف بمثابة أجهزة مطرح ذبابة الفاكهة وتتشابه وظيفيا كليون الثدييات في عدة نواح رئيسية1. يتم ترتيب النظام التجاري المتعدد الأطراف كأزواج 2 من الأنابيب (الأمامي والخلفي) في الصدر والبطن من الطاير. يتألف أنبوب الظهارية خلية واحدة لكل طن متري النشط أيضي الخلايا الرئيسية مع متميزة قمي (لومينال) والأقطاب باسولاتيرال (هيموكول)، فضلا عن الخلايا النجمية المقحم. النظام التجاري المتعدد الأطراف الأمامية تتكون من 3 شكلياً، ووظيفيا، وشرائح متميزة تنمويا، لا سيما الأولى المتوسعة الجزء والجزء الانتقالي الافرازية الجزء الرئيسي، الذي ينضم إلى الحالب2. على المستوى الخلوي ويتم إنجاز النقل أيون عبر الظهارية في التجويف غشاء البلازما قمي الخامس-ATPase3 ومبادل قلوي-معادن/ح+ ، فضلا عن باسولاتيرال نا+-ك+-أتباسي4، القنوات إلى الداخل-مقوم ك+ 5غ+-مدفوعة Cl−/HCO− 3مبادل (NDAE1)6، و Na+-ك+-2 Cl− كوترانسبورتير (نككك؛ Ncc69)7، بينما الخلايا النجمية التوسط Cl– ، ونقل المياه8،9. ويوفر هذا النظام الفسيولوجية المعقدة لكن موجوداً فرصاً ممتازة لتحقيق آليات النقل أيون الذاتية عندما يقترن toolsets الجينية والسلوكية المتنوعة من المورفولوجية.
وكان الأساس المنطقي لهذا البروتوكول لوصف نظام طيع وراثيا لدراسة النقل أيون الظهارية مع إمكانات التكامل من الخلية إلى السلوك وتصدير أدوات لنظم نموذجية أخرى. التعبير عن فري10، جيفي المستمدة من مزيج من الأخضر حساسة لدرجة الحموضة دائرة البروج فائقة فلورين11،12 (SEpH) ومشري غير متحسسة للأس الهيدروجيني الأحمر13، في النظام التجاري المتعدد الأطراف يسمح التحديد الكمي للنقل ح+ في الخلايا طن متري واحد من خلال ارتفاع ك+/nigericin المعايرة تقنية14. كما نقل العديد من الناقلين أيون مكافئات ح+ ، التحديد الكمي لدرجة الحموضة داخل الخلاياوأنا بمثابة تمثيل وظيفية لحركة أيون عبر مجموعة متنوعة من الناقلين. كما يوفر النظام النموذجي المورفولوجية طن متري أدوات الوراثية قوية في التحوير الأنسجة على حدة15 والجيش الملكي النيبالي التدخل ([رني])16 التعبير، التي يمكن أن تكون جنبا إلى جنب مع التصوير بالهاتف الخلوي وفحوصات الجهاز الجامع17 , 18 , 19 وظيفة أنبوب لإنشاء مجموعة أدوات قوية مع التكامل الرأسي من الجزيئات للسلوك. وهذا يقف في المقابل للعديد من البروتوكولات الأخرى لتقييم البيولوجيا الظهارية، كما اعتمدت تاريخيا هذه القياسات على معقدة وشاقة والتشريح الدقيقة والمتطورة من أقطاب الأيوني الانتقائي20،21، والأصباغ غالية حساسة لدرجة الحموضة22 مع متطلبات تحميل التقييدية والفقيرة خصوصية الهاتف الخلوي في الأنسجة غير متجانسة. وقد استخدمت جيفيس لقياس درجة الحموضةوأنا في مجموعة متنوعة من أنواع الخلايا23على نطاق واسع. العمل في وقت مبكر في استغلال الملازمة للأس الهيدروجيني-الحساسية من الأخضر الفلورسنت البروتين (التجارة والنقل) لرصد درجة الحموضةأنا في الخلايا الظهارية مثقف24 ولكن خلال العقدين الماضيين شهدت جيفيس المستخدمة في الخلايا العصبية25،26من إطلاق، الفطريات27 ، والخلايا النباتية28. مزيج احتمال استهداف الخلوية الوراثية بنيات من خلال نظام التعبير GAL4/UAS15 وإمكانية الوصول إلى الفسيولوجية المورفولوجية طن متري جعل هذا إعداد مثالية للتحقيقات للأس الهيدروجينيأنا التنظيم والنقل أيون الظهارية.
تنظيم درجة الحموضةأنا درست على مدى عقود وأمر حيوي للحياة. ويوفر إعداد طن متري متطورة نموذج قوي تدريس علم وظائف الأعضاء تنظيم الأس الهيدروجينيأنا ولكن أيضا إجراء التحقيقات pHi التنظيم السابقين فيفو و في فيفو. هذا البروتوكول يصف التحديد الكمي لحركة ح+ عبر الغشاء باسولاتيرال للخلايا الظهارية من المورفولوجية استخدام NH4حمض نبض Cl تحميل تقنية21مليون طن، ولكن كمؤشر الرقم الهيدروجيني-وراثيا ترميز، هذه الأساليب وإطارها النظري يمكن تطبيقها على أي إعداد قابلة ترانسجينيسيس وتصوير العيش.
Access restricted. Please log in or start a trial to view this content.
Protocol
كافة الخطوات في هذا البروتوكول الامتثال للمبادئ التوجيهية استخدام الحيوان "كلينيك" (روتشستر، مينيسوتا).
1-يطير تربية
- رفع الذباب وتقاطع مجموعة وفقا لمعيار تربية29.
ملاحظة: التعبير مراسل الفلورسنت بنظام GAL4/UAS متناسبة مع درجة الحرارة وهكذا تربية درجة الحرارة يمكن تعديلها لتغيير مستوى التعبير. بينما مستويات عالية من التعبير غالباً ما تؤدي إلى نسبة الإشارة إلى الضوضاء أفضل هذا الشرط يرتبط أيضا بزيادة المجاميع سيتوسوليك وأورجانيلار عند استخدام التجارة والنقل للانصهار الأحمر نيون البروتين (RFP) يبني مثل فري10، 30،31. إذا كان التجميع أمر لا مفر منه، التقدير الكمي لا يزال من الممكن عن طريق إجراء نقطة التحديدات في كل تجربة وتطبيع البيانات أن يقابل نسبة الأسفار من 1.0 إلى درجة الحموضةأنا 7.0 (راجع الخطوة 7، 4 مذكرة بشأن معايرة أدناه). - تقاطع مجموعة من الذكور32 متماثل كبار GAL4متماثل الإناث العذراء10 UAS-فريو متماثل c724-GAL42 الذكور إلى الإناث العذراء UAS-فري متماثل السماح بتصوير لدرجة الحموضةوأنا في الخلايا الرئيسية والخلايا النجمية للنقل المتعدد الوسائط، على التوالي. 6 مكان UAS-فري الإناث مع الذكور GAL4 3 في قارورة جديدة من الأغذية والإجازات رفيقه في 28 درجة مئوية.
ملاحظة: ينبغي أن يكون يرقات واضحا داخل د 4 والكبار ستبدأ اكلس حول يوم 10. - جمع الذباب الإناث عند اكلوسيون وتوضع جانبا لسن د 10 في 28 درجة مئوية.
ملاحظة: يمكن ضبط توقيت التجريب لتتوافق مع أي فحوصات السلوكية التقييدية (مثل رامزي إفراز الإنزيم،من1719) التي سوف ترتبط بتصوير pH داخل الخلايا الحية. يمكن استخدام الذباب الذكور ولكن غالباً ما تكون الأنابيب من الإناث أكبر حجماً وأكثر قوة.
2-إعداد الشرائح بولي-L-يسين.
- رسم حدود 40 × 20 ملم مع قلم PAP مسعور حول الجزء العلوي من الشرائح القياسية 75 × 25 مم وتوضع جانبا لتجف لمدة 15 دقيقة في استخدام الرايت كوفيرسليبس كبيرة إذا كانت الشرائح غير متوافقة مع التصوير البصريات.
- نقل 2 مل محلول بولي-L-يسين (PLL) 0.01 ٪ الأسهم على كل شريحة وتوضع جانبا ح 1 في الرايت
- إزالة PLL الزائدة مع ماصة. حفظ الحل في قنينة 50 مل مخروطية لاستخدامها في المستقبل. مخزن في 4 درجات مئوية.
- نضح أي حل المتبقية مع خط فراغ. قم بتشغيل سطر فراغ على سطح الشريحة بأكملها لضمان أن أي حل لا يزال على الشرائح.
- تعيين الشرائح جانبا ح إضافية 1 RT قبل الاستخدام. تخزين الشرائح الجافة في RT لتصل إلى شهر واحد في كتاب شرائح قياسية.
3-إعداد تشريح طبق وقضبان الزجاج
- إضافة 0.5 مل عامل علاج الاستومر إلى 4.5 مل الاستومر قاعدة في البوليسترين 35 × 10 مم طبق بيتري في RT لإنتاج بعمق من 5 مم-ميكس مع تلميح ماصة المتاح. السماح الاستومر لعلاج O/N في الرايت
ملاحظة: يجب أن يكون الاستومر واضحة وخالية من الفقاعات. قد يتيسر إزالة الفقاعات بإبقاء لوحات الاستومر في جرة فراغ لمدة 10-15 دقيقة بعد سكب. - يعقد قضيب زجاج قطرها 5 ملم بين يديه وتذوب وسط القضيب فوق موقد بنسن مضاءة حين سحب الغايات عن بعضها البعض. كالزجاج يذوب سحب أكثر بسرعة لإنتاج رقيقة (0.1 مم) ورمح مدبب (الشكل 1).
ملاحظة: بزاوية 45 درجة في شأنك غالباً مفيدة في التعامل مع الأنابيب. يمكن تحقيق هذا عن طريق خفض يدا واحدة كما يتم سحبها شأنك (انظر الشكل 1). - كسر رمح رقيقة في الوسط مع الجانب كليلة شفرة الحلاقة المصنوعة من الصلب الكربوني واحد ذو حدين. فحص نهاية القضيب تحت نطاق تشريح للتأكد من الكسر نظيفة رقيقة.
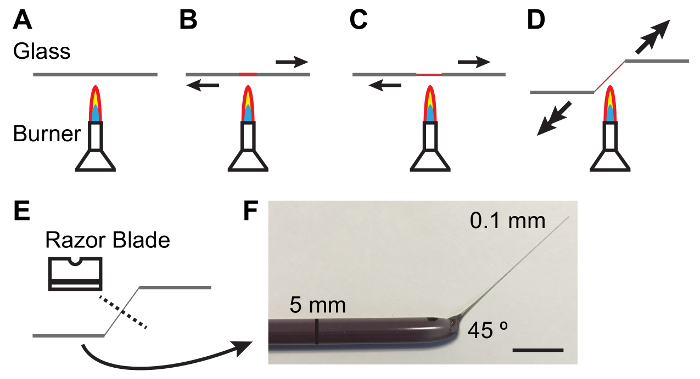
الشكل 1: اختﻻق قضبان الزجاج للتعامل مع الأنابيب مالباييان.
أ-ه. عملية التسخين وسحب قضيب زجاج لإنتاج تفتق وزاوية مناسبة للتعامل مع "الأسهم mts." تدل على اتجاه وحجم القوة التي يمكن تطبيقها. و-صورة فوتوغرافية لأداة الزجاج ملفقة على نحو ملائم. شريط مقياس = 10 مم- الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
4-إعداد نظام التروية والحلول
ملاحظة: أنظمة نضح تختلف حسب الشركة المصنعة. ويستند هذا البروتوكول حول الجاذبية 8-قناة مفتوحة خزان مع منظم معدل تدفق إدخال وتدفقا يحركها من فراغ، ولكن طريقة تركيب النظام التجاري المتعدد الأطراف كما هو موضح هنا يمكن تكييفها للعمل مع أي نظام التروية.
-
إعداد الحلول التالية:
- الكوة شنايدر المتوسطة (مل 40 إلى 50 مل قارورة مخروطية الشكل) ومخزن في 4 درجات مئوية.
- إعداد الحلول (أي الحشرات "فوسفاتيبوفيريد المالحة" (المتكاملة) ومتكاملة مع NH4Cl) في الرايت حسب الحاجة ووفقا الجدول 1). حلول الحارة ل RT قبل استخدامها في يوم تجربة.
ملاحظة: المتكاملة ومتكاملة مع 40 مم NH4Cl يمكن إعدادها بكميات كبيرة (1 لتر أو أكثر) وتخزينها في 4 درجات مئوية. - إعداد حلول المعايرة 8 في حجم 500 مل على درجة الحموضة = 5.0 و 6.0، 6.5، 7.0، 7.3، 7.6، 8.0 و 9.0 كما هو مبين في الجدول 1 ومخزن في 4 درجات مئوية. ضبط الأس الهيدروجيني لكل حل بالمعايرة مع N-الميثيل-د-جلوكاميني (نمدج) و HCl.
- اليوم من تجارب، الحارة مختبرين 5 مل من حلول المعايرة على RT وإضافة حل نيجيريسين الأسهم (20 ملم في ثنائي ميثيل سلفوكسيد ([دمس])) لإنتاج بتركيز نهائي 10 ميكرون.
تنبيه: تعامل مع نيجيريسين مع القفازات. التعامل مع جميع المعدات التي تأتي على اتصال نيجيريسين حسب المتاح. نيجيريسين ما زال على الزجاج والبلاستيك وسيتم حل وسط الاستعدادات البيولوجية إذا تم إعادة استخدام المعدات.
-
نظام التروية:
- رئيس الوزراء نظام التروية بتعبئة جميع خزانات مع ddH2س (الشكل 2). فتح قنوات واحد في وقت واحد للسماح لكافة بنود الدانية إلى منظم معدل التدفق لملء.
ملاحظة: قد يكون من الضروري لمسح جوي في الخطوط بفتح القناة المتوقفة واستخدام المكبس لتدفق محرك الأقراص من الخزان. - 2 القنوات المفتوحة وتسمح ddH2س لاستنزاف. بمجرد الخزانات الفارغة تقريبا، ملء الخزان الأولى مع متكاملة والخزان الثاني مع NH4ستوجز نابض Cl. تعيين معدل التدفق إلى الحد الأقصى مع الجهة المنظمة لمعدل التدفق والسماح لكل حل بالتدفق لمدة 1 دقيقة لملء الخطوط البعيدة، ثم وقف التدفق (الشكل 2).
- موقف 2 مجموعات لحام المشابك "يد العون" في مرحلة مجهر التصوير. وضع المشبك واحدة على كل جانب من منصة التصوير.
- الحرارة بدقة 0.5 بوصة القاصي قطعة من الزجاج الشعرية (القطر الداخلي 1.5 ملم، القطر الخارجي 0.86 ملم، طول 100 مم) فوق موقد بنسن. إنشاء منحنى 45 ° بالسماح للنهاية البعيدة لينحني بالجاذبية وإزالة الزجاج من اللهب حالما يتحقق الزاوية المطلوبة. كرر هذه العملية مع قطعة زجاج الشعرية ثانية.
- إدراج الزجاج عازمة الشعيرات الدموية في سطر في تدفق وتدفق متصل بفراغ الخط، على التوالي، وجبل لهم في "يد العون" لمواءمتها مع مرحلة التصوير المجهر (الشكل 3).
- رئيس الوزراء نظام التروية بتعبئة جميع خزانات مع ddH2س (الشكل 2). فتح قنوات واحد في وقت واحد للسماح لكافة بنود الدانية إلى منظم معدل التدفق لملء.

الشكل 2: نظام التروية والتصوير التكوين.
العناصر اللازمة لتقييم وظيفة النقل باسولاتيرال طن متري من خلال متزامنة الفسيولوجية يعيش fluorescence التصوير وسرعة تبادل الحلول. خطوط الغاز أظهرت اختيارية، ويسمح بالتوسع في تجارب لتقييم النقل HCO3– . الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
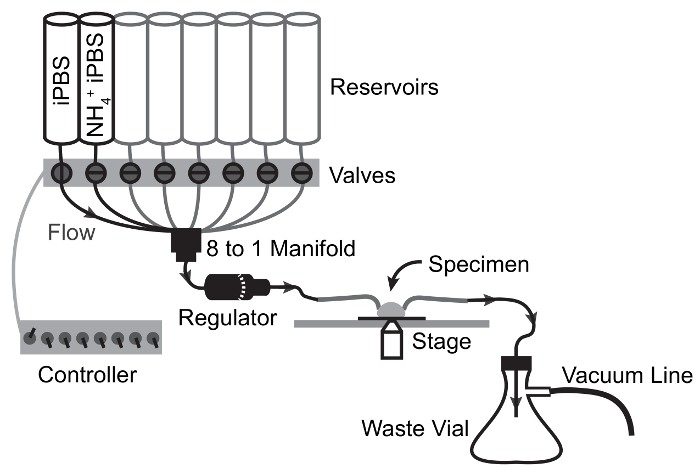
الشكل 3: تجارب التخطيطي تدفق جهاز نضح ل NH4Cl النبض.
سهام تصور مسار التدفق وصمام تحويل النقاط. الحل ينتقل من الخزان إلى العينة بتدفق الجاذبية ومستمد من قاعة العينة إلى قارورة النفايات بشفط فراغ. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
5-تشريح للأنابيب مالباييان الأمامي الكبار المورفولوجية .
- جمع الصحن التشريح وسحب الشحوم فراغ، المفرق جيدا نضح لاصقة، قطاع 4 × 2 "لختم الفيلم، قضيب الزجاج من الباب 3، شريحة المغلفة PLL من الباب 2، 2 زوجاً من #5 غرامة الملقط، ومختبرين 40 مل المتوسطة وستوجز RT المثلج شنايدر.
- انتشار الشحوم فراغ في الشريط الختم واضغط الفاصل جيدا نضح لاصقة على الشريط الأسفل مع الشحوم معطف. تقشر مقسم جيدا نضح لاصقة ووضعه الشحوم الجانب-لأسفل على أعلى شريحة مغلفة PLL. إزالة الفاصل نضح جيدا إلى ترك العينة الفردية الآبار التي تتبع في الشحوم مسعور.
- مكان 200 ميليلتر من ستوجز RT في الشحوم-طوق جيدا على الشريحة المغلفة PLL وتحريك الشريحة تحت ستيريوسكوبي.
- فيال الذباب UAS-فري/كبار-GAL4 مكان في يطير فارغة وتخدير لهم على الجليد لمدة 10 دقائق.
ملاحظة: هذه الطريقة من التخدير، على عكس CO2، يضمن أن الذباب لا يذوي. - صب المتوسطة المثلج شنايدر في طبق تشريح واستخدام الملقط غرامة لنقل ذبابة أنثى واحدة أنيسثيتيزيد في الطبق تحت ستيريوسكوبي تشريح.
- عقد الطاير بالصدر مع مجموعة من الملقط واستخدام أخرى بلطف قبضة الخلفي البطن. سحب فتح مؤخرة ذبابة باستخدام الملقط وباختصار، التماسات متعمدة. بمجرد المعي الخلفي مرئياً، قبضة نهاية القاصي ومجانا على القناة الهضمية والنظام التجاري المتعدد الأطراف من tracheoles الكامنة عن طريق سحب المعي الخلفي خارج الجسم عن طريق القاطرات قصيرة ومتكررة.
ملاحظة: النظام التجاري المتعدد الأطراف الأمامية والخلفية ستكون مرئية حيث يلتقي تقاطع الأمامي والمعي الخلفي من خلال الحالب. أول زوج من النظام التجاري المتعدد الأطراف تكون الإرادة الحرة يحتمل أن تكون الأنابيب الخلفي كما أنها محاصرة المعي الخلفي. يمكن أن تكون هذه تجاهل (الشكل 4 أ). - قرصه خارج النظام التجاري المتعدد الأطراف الأمامية في الحالب مع غرامة الملقط بعد المجموعة الثانية من النظام التجاري المتعدد الأطراف خال من البطن. وهذا فصل النظام التجاري المتعدد الأطراف الأمامي من القناة الهضمية وإغلاق الحالب.
- التقاط النظام التجاري المتعدد الأطراف الأمامية مجاناً مع قضيب الزجاج سحبت من انزلاق القضيب تحت الحالب أن الأنابيب تقع على جانبي. رفع النظام التجاري المتعدد الأطراف مباشرة من الحل.
- دورة قضيب الزجاج أن النظام التجاري المتعدد الأطراف والحالب التقيد بالجانب السفلي القضيب، وانخفاض الحالب إلى أسفل داخل الشريحة. إلصاق الحالب وختم الغايات البعيدة للنظام التجاري المتعدد الأطراف عن طريق الضغط على الحالب إلى أسفل على شريحة الزجاج (الشكل 4 باء). عدم التلاعب بالنظام التجاري المتعدد الأطراف أكثر من اللازم. النظام التجاري المتعدد الأطراف ينبغي العائمة حتى في الحل مع الحالب ترتكز إلى الشريحة.
- استخدام نهاية قضيب الزجاج غرامة لاكتساح كل أنبوب بلطف عبر سطح الشريحة. يستعدوا للقضيب ضد الشريحة لتجنب سحق أنبوب والشريحة القضيب فوق الجزء العلوي من أنبوب، تتحرك القاصي إلى الدانية، تعلق كامل طول كل أنبوب على سطح الشريحة المغلفة PLL (الشكل 4).
- ضع الفاصل جيدا نضح لاصقة مرة أخرى على الشريحة بتشكيل صغيرة مملوءة بسائل أكثر من أنبوب المحملة.
- وضع العينة على مرحلة المجهر. ضع التدفق وتدفق الشعيرات الدموية على مدخل ومخرج افتتاح نضح جيدا، على التوالي.
ملاحظة: يمكن أن تترك مقسم جيدا إذا كان هو المطلوب دائرة مفتوحة التروية. في هذه الحالة يمكن أن تكون محاذاة الشعيرات الدموية تدفق وتدفق على طرفي نقيض التصوير جيدا.
6-التحقق من صحة التصوير البروتوكول والصحة
ملاحظة: يتم تنفيذ هذا البروتوكول المعني مجهر مقلوب واسع المجال ابيفلوريسسينت بالتجارة والنقل (SEpH)، وطلب تقديم العروض (متشيري) عامل تصفية مجموعات (470/40 نانومتر الإثارة (السابقين)، 500 نانومتر نانومتر مزدوج اللون و 546/10 ت 590 nm الفلترات م، 565، 515 نانومتر الفلترات الانبعاثات (م) نانومتر مزدوج اللون)، 10 X/ 0.45 الهواء الهدف، كاميرا أحادية اللون لالتقاط الصور ويعيش، وبرامج التصوير. يمكن تكييفها تستقيم أي البروتوكول أو مقلوب مجهر مع عامل التصفية التلقائية التبديل بين التجارة والنقل، وطلب تقديم العروض البصرية والصورة اقتناء البرمجيات، على الرغم من أن تختلف أوقات التعرض الأمثل وشدة الضوء والمعلمات binning. في تحليل كافة، يجب أن يتم تحليل شدة الأسفار ككثافة بكسل يعني في منطقة الفائدة (العائد على الاستثمار)، بعد الطرح الخلفية في كل قناة باستخدام دوروا مع يحتوي على لا الأسفار المتاخمة للإشارة العائد على الاستثمار.
- قم بتشغيل المجهر، ومصدر الضوء، ونظام التصوير.
- فتح برامج التصوير المرتبطة بها.
- ننظر من خلال العدسة وضبط التركيز يدوياً حتى يصبح التجويف MT مرئية بوضوح تحت الضوء المنقولة.
- انقر فوق علامة التبويب "حيازة" في صورة تحليل البرامج وحدد "2 × 2" في القائمة المنسدلة "Binning" في المقطع "الحصول على الوضع".
- إدراج مرشح كثافة محايدة 5% في مسار الضوء تقليل إضاءة الضوء والتقليل من فوتوبليتشينج.
- انقر فوق قناة التجارة والنقل (SEpH) في قائمة "القنوات"، ثم انقر فوق "حية" لمراقبة الإشارات الفلورسنت عبر الكاميرا.
- ضبط مربع التمرير "الوقت" لتعيين وقت التعرض أن قيم بكسل ألمع في الرسم البياني شدتها حوالي 40 في المائة من الحد الأقصى للقيمة، ثم انقر فوق "إيقاف" لإيقاف الإضاءة.
- كرر الخطوات 6.6-6.7 في طلب تقديم العروض (مشري) القناة وتأكيد وجود الجزء الأول متسعة من MT الأمامي وغياب مشري سيتوسوليك مجاميع (يدل على تلف الأنسجة أو overexpression) (الشكل 4).
ملاحظة: يجب أن يكون الجزء المتوسعة الواضح كما هو الجزء الأكثر الدانية من أنبوب وقطر التجويف الداخلي لهذا الجزء هو ميكرومتر ~ 20 أكبر من الجزء الانتقالية المتاخمة. 2 × 2 binning بكسل كافية في كثير من الأحيان ولكن يمكن زيادة لزيادة خفض شدة الإضاءة المطلوبة. هناك أوقات التعرض نموذجية بين 150 و 800 مللي/القناة. استخدم كالقليل من الضوء قدر الإمكان للتقليل من فوتوبليتشينج. التقليل من فوتوبليتشينج أمر حيوي لاستخدام مؤشرات fluorophore المزدوج مثل فري كما يمكن التبييض fluorophores اثنين بشكل مستقل، وبالتالي إبطال أي معايرة نسبة. - تمكين بروتوكول الوقت الفاصل بين تصوير بواسطة النقر فوق خانة الاختيار "السلاسل الزمنية".
- ضبط "المدة" في القائمة المنسدلة في المقطع "السلاسل الزمنية" إلى 10 دقيقة والمنزلق "الفاصل الزمني" إلى 0 لتعيين وقت الالتقاط الإجمالي بمعدل اقتناء صورة كحد أقصى. غالباً ما يكفي الحصول على مجموع معدل 0.2 هرتز.
- تحقق من كل من التجارة والنقل (SEpH) وخانات طلب تقديم العروض (مشري) في المقطع "القنوات".
- فتح خط ستوجز نظام التروية بتفعيل وحدة تحكم صمام المناسبة وبدء تشغيل البروتوكول التصوير بواسطة النقر فوق "ابدأ التجربة." بعد 1 دقيقة، قم بالتبديل إلى NH4Cl نبض الحل ل 20 s بفتح صمام المناسبة وإغلاق خط متكاملة، ثم العودة إلى متكاملة عن طريق إغلاق NH4خط Cl وإعادة فتح صمام متكاملة. يسمح بروتوكول تصوير كامل لإكمال قبل إيقاف نظام التروية.
ملاحظة: ينبغي أن تكشف عن تحليل الوقت الفاصل بين إشارة متشيري مستقرة وإشارة SEpH الذي يزيد من حضور NH4Cl، ويروي عند تبييض ويتعافى تدريجيا. - القيام بمعايرة 2-نقطة.
- إزالة الفاصل جيدا إلى جانب تقشير أنه بعيداً عن الشريحة الأساسية وإزالة الشعيرات الدموية نضح والمشابك من التصوير جيدا.
- تطبيق 200 ميليلتر المعايرة المتكاملة (درجة الحموضة 7.4، 10 ميكرون نيجيريسين) للتصوير جيدا مع ماصة 200 ميليلتر. إزالة الحل من التصوير جيدا مع الماصة، ثم استبدل ميليلتر 200 آخر حل المعايرة. كرر هذه العملية 4 مرات لضمان تبادل الحل الكامل.
- احتضان الإعداد في حل المعايرة لمدة 30 دقيقة قبل التصوير. كرر البروتوكول التصوير باستخدام معلمات نفس العزم في خطوات 6.6 6.11، مع تعديل فقط 1 دقيقة للصورة التقاط.
ملاحظة: نظام التروية والشعيرات الدموية غير مطلوبة في هذه الخطوة، وينبغي أن يكون غير متصل بالتصوير جيدا لتجنب تعريض الشعيرات الدموية إلى نيجيريسين. - إضافة 200 ميليلتر المعايرة المتكاملة (pH 9.0، 10 ميكرون نيجيريسين) للتصوير جيدا مع ماصة 200 ميليلتر. إزالة الحل من التصوير جيدا مع الماصة، ثم استبدل ميليلتر 200 آخر حل المعايرة. كرر هذه العملية 4 مرات لضمان تبادل الحل الكامل.
- احتضان الإعداد في الحل المعايرة الثانية لمدة 10 دقائق قبل التصوير. تكرار التصوير البروتوكول كما هو الحال في الخطوة 6.13.3.
- استعراض المكدس الصورة التي تم التقاطها في صورة تحليل البرامج للتأكد من أن لا بكسل في قناة أما المشبعة بالنقر فوق "يعني العائد على الاستثمار" والتمرير على الرغم من المكدس الصورة مع المنزلق "الإطار" مع ملاحظة أن الإبلاغ عن أية قيم في الرسم البياني كثافة الوصول إلى الحد الأقصى لقيمة قابلة للاكتشاف. إذا كان أي إطارات تحتوي على وحدات بكسل التي تصل إلى أقصى شدتها يمكن كشفها، الحد من شدة التعرض الوقت أو الإضاءة وتكرار القسم 6.
ملاحظة: وبمجرد إنشاء لا تقم بتغيير معلمات التصوير بين تجارب أو المعايرة إذا لم تكن نقطة معايرات لاستخدامها في إعداد كل (راجع الخطوة 8.3).
- تحليل المكدس صورة الرسم في شدة الفلورسنت ونسبة الأسفار (SEpH/مشري) كدالة للزمن.
- انقر فوق "" يعني "عائد الاستثمار" وحدد الأداة شكل حر. اضغط الأيسر لتتبع طول ~ 50 ميكرون من mt. الحق انقر لإنهاء رسم العائد على الاستثمار، ثم كرر في منطقة مجاورة للنقل المتعدد الوسائط لتحديد خلفية عائد الاستثمار (الشكل 5A).
- انقر فوق "متوسط كثافة" تحت "القياسات." إنشاء جدول لقيم الكثافة بواسطة النقر فوق "تصدير > جدول البيانات > إنشاء."
- انقر على رمز الترس التكوين وإلغاء تحديد كافة المعلمات فيما عدا "تايم" و "تعني كثافة". زر الماوس الأيمن فوق علامة التبويب لجدول البيانات الذي تم إنشاؤه حديثا وحدد "حفظ باسم"، وتصدير البيانات كملف.csv.
ملاحظة: قياسات مماثلة يمكن أيضا أن استخدام البرمجيات الحرة مثل إيماجيج. - افتح جدول جدول بيانات واستيراد جدول البيانات عن طريق تحديد علامة التبويب "البيانات"، تليها "من النص".
- استخدام الدالات في جدول البيانات للطرح كثافة الخلفية SEpH من "كثافة SEpH إشارة" عند كل نقطة في الوقت. كرر هذه العملية للإشارة مشري.
- ارسم كل كثافة قناة كدالة للزمن بتحديد الأعمدة التي تحتوي على الوقت وكثافة الخلفية لتصحيح البيانات وثم النقر فوق "إدراج > مبعثر (المخططات) > مبعثر بخطوط مستقيمة" (الشكل 5 (ب)).
- استخدام دالات جدول البيانات لحساب نسبة SEpH/مشري fluorescence في كل نقطة من الزمن.
- نسبة الأسفار الأرض كدالة للزمن بتحديد الأعمدة التي تحتوي على بيانات الوقت ونسبة وثم النقر فوق "إدراج > مبعثر (المخططات) > مبعثر بخطوط مستقيمة" (الشكل 5).
7-كامل معايرة فري في الأنابيب Malpighian فيفو السابقين.
- تشريح وتركيب مجموعة جديدة من النظام التجاري المتعدد الأطراف الأمامية كما هو موضح في القسم 5.
- تبادل المتكاملة للمعايرة المتكاملة (درجة الحموضة 7.4، نيجيريسين 10 ميكرون) كما هو موضح في الخطوة 6.13.2. احتضان لمدة 30 دقيقة.
- تحديد موقع النظام التجاري المتعدد الأطراف وجمع أزواج من الصور SEpH/مشري كما هو موضح في الخطوات 6، 1-6، 11. استبدال الحل مع أسهم أخرى للمعايرة المتكاملة كما هو موضح في الخطوة 6.13.4، انتظر 10 دقائق، والصورة مرة أخرى. كرر هذه العملية حتى نسبة SEpH/مشري قد تم تصويرها في جميع الحلول. الحصول على درجة الحموضة الصور 9.0 آخر كما العينة نادراً ما يسترد من درجة الحموضة العالية.
- مؤامرة fluorescence نسبة SEpH إلى مشري من التحديدات في ثماني عينات آخر كدالة للأس الهيدروجيني المفروضأنا كما هو موضح في الخطوة 6.14.9. احتواء البيانات المعايرة مع منحنى بولتزمان للحصول على وظيفة كاملة المعايرة وفقا للمعادلة 1 (الشكل 5). إذا كانت البيانات غير متناسقة، ارسم معايرة مجموعات من كل عينة تطبيع أن يقابل نسبة الأسفار من 1.0 للأس الهيدروجينيi 7.0 وإعادة تحليل (الشكل 5E).
ملاحظة: إذا كانت العملية الأخيرة ضروري سوف تحتاج التجارب الفردية الخاصة بهم معايرات نقطة الداخلية33 (انظر الكمي الإجراء التالي (الخطوة 8.3)). -
معادلة 1
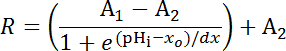
حيث R = نسبة SEpH/مشري و1،2، سسو dx المنحنى المناسب معلمات يمثلون نسبة الأسفار الحد الأدنى ونسبة الحد الأقصى الأسفار، فك، وعرض وظيفة على التوالي. xس = الظاهر فك من فري، التي يمكن أن تختلف بين 7.1 و 7.4 تبعاً لنوع الخلية وشروط المعايرة الدقيقة.
8-التحديد الكمي لقذف حمض Basolateral من السابقين فيفو أنبوب Malpighian ابيثيليا.
- معربا عن فري الرئيسي للصورة فري-الإعراب عن الخلايا النجمية والخلايا في وقت واحد.
- تشريح MTs الأمامي من ذبابة UAS-فري/كبار-GAL4 كما هو موضح في القسم 5، ولكن لا يتم نقل النظام التجاري المتعدد الأطراف من المتوسطة لشنايدر تشريح لتصوير جيدا.
- تشريح MTs الأمامي من ذبابة UAS-فري/c724-GAL4 في طبق تشريح نفسه باستخدام الإجراء المبين في القسم 5.
- نقل مجموعات 2 من النظام التجاري المتعدد الأطراف في نفس التصوير جيدا كما هو موضح في الخطوات 5.8-5.11.
ملاحظة: عندما تجتاح بالأسلحة للنظام التجاري المتعدد الأطراف وصولاً إلى الشريحة، وضع النظام التجاري المتعدد الأطراف UAS-فيري/c724-GAL4 والأنابيب UAS-فيري/كابار-GAL4 القرب من بعضها البعض حتى يمكن تصور الخلايا الرئيسية وتلعبه معربا عن فيري في (الحقل نفسه الشكل 6A).
- تطبيق NH4Cl بريبولسي كما هو موضح في الخطوة 6.12.
ملاحظة: إذا كان لا يمكن معايرة متسقة (الشكل 4 باء)، إجراء معايرة نقطة بتعيين pHi إلى 7.0 في نهاية كل تجربة المعايرة المتكاملة (pH 7.0، 10 ميكرون نيجيريسين، حضانة 30 دقيقة) بعد لاصقة تم إزالة مقسم نضح-جيدا والمعدات التروية. - معايرة آثار من الخلايا النجمية والرئيسية لمختلف قطاعات النقل المتعدد الوسائط (باستخدام نسبة مطلقة أو تم تسويتها حسب الاقتضاء) مع 2 المعادلة وتحليل مرحلة الانتعاش بعد انسحاب Cl NH4عن طريق تطبيق الدالات تحلل أسي باستخدام برامج التحليل الإحصائي، وإذ تلاحظ ثابت الانحلال (τ) (الشكل 6B).
المعادلة 2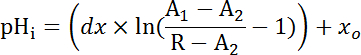
حيث R = نسبة SEpH/مشري و1،2، سسو dx منحنى معلمات المناسب يحدده المعايرة في الخطوة 7، 4 (المعادلة 1).- حساب معدل البثق حمض (JH +، راجع المعادلة 3) كدالة لدرجة الحموضةأنا لمراعاة الاختلافات في استراحة الأس الهيدروجينيأنا وحمض تحميل بين الأعمال التحضيرية34. استخدام الدوال الأسية المستمدة في خطوة 8.3 لحساب المشتقة من درجة الحموضةأنا فيما يتعلق بالوقت في الفترة الزمنية لكل.
المعادلة 3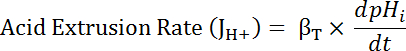
- حساب سعة التخزين المؤقت المضمنة (βi؛ المعادلة 4) من سيتوسول في درجة الحموضةأنا من بداية كل فاصل زمني في خطوة 8.3.1 استناداً إلى المؤلفات السابقة (انظر 4 المعادلة).
ملاحظة: في المورفولوجية، توصيف أدق βأنا يأتي من المحطات الطرفية الأعصاب الحركية اليرقات35 ويمكن افتراض هذه البيانات لخلايا طن متري في غياب البيانات الأخرى المتاحة.
المعادلة 4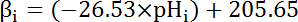
- حساب ناتج βT (من الخطوة 8.3.2)و أناdpH/dt (من الخطوة 8.3.1) لتحديد JH + (3 المعادلة).
ملاحظة: في حلول خالية من بيكربونات اسمياً مثل تلك المبينة في هذا البروتوكول، المستمدة من بيكربونات التخزين المؤقت قدرة (βب) يفترض أن تكون ~ 0 ملم. مجموع التخزين المؤقت قدرة (βT) هو مجموع βأنا βب، وهكذا βأنا = βT في غياب HCO3–/CO236. - ارسم يح + كدالة درجة الحموضةوأنا في بداية كل الفاصل الزمني كما هو موضح في الخطوة 6.14.9.
- تطبيق مهام تحلل أسي على الجزء من جميع مجموعات البيانات التي تتداخل في الأس الهيدروجينيوأنا باستخدام برامج التحليل الإحصائي. مقارنة معدلات تغير الوظائف الناتجة عن ذلك لمقارنة معدلات البثق حمض بين الخلايا وقطاعات النقل المتعدد الوسائط (الشكل 6).
ملاحظة: أنسب الدالة المستخدمة لتركيب المنحنى قد لا دائماً تكون واحد أسي. وظائف أخرى يمكن أن تكون بديلاً إذا أنها تحسن الخير صالح. - حساب حمض الجريان (انظر المعادلة 5) كدالة لدرجة الحموضةأنا لمراعاة الاختلافات في حجم الخلية والشكل.
المعادلة 5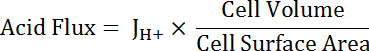
ملاحظة: أبعاد الخلية يمكن أما قياس مباشرة في الصور أو الاقتراب منها. ويمكن تمثيل الخلايا الرئيسية نصفين أنبوب مجوف مع الأبعاد التالية: القطر الداخلي 24 ميكرومتر؛ القطر الخارجي 48 ميكرومتر؛ ارتفاع 50 ميكرومتر. الانتقالية النجمية الخلايا المتغيرة ولكن يمكن أن تمثل تقريبا كالأسطوانات مع ارتفاعات من 50 ميكرومتر وأقطار من 10 ميكرون. انظر الفقرة الأخيرة من الممثل النتائج أدناه. - تطبيق مهام تحلل أسي على الجزء من جميع مجموعات البيانات التي تتداخل في الأس الهيدروجينيوأنا باستخدام برامج التحليل الإحصائي. مقارنة معدلات تغير الوظائف الناتجة عن ذلك لمقارنة تدفقات حمض بين الخلايا وقطاعات النقل المتعدد الوسائط (الشكل 6).
- حساب معدل البثق حمض (JH +، راجع المعادلة 3) كدالة لدرجة الحموضةأنا لمراعاة الاختلافات في استراحة الأس الهيدروجينيأنا وحمض تحميل بين الأعمال التحضيرية34. استخدام الدوال الأسية المستمدة في خطوة 8.3 لحساب المشتقة من درجة الحموضةأنا فيما يتعلق بالوقت في الفترة الزمنية لكل.
Access restricted. Please log in or start a trial to view this content.
النتائج
الأنسجة السليمة والتحديد السليم للنظام التجاري المتعدد الأطراف الأمامية أمران حيويان لنجاح هذا البروتوكول. أثناء التشريح، ينبغي الحرص على اتصال غير مباشر النظام التجاري المتعدد الأطراف والمؤشر الوحيد لهم الحالب كالتي تجتاح النظام التجاري المتعدد الأطراف مباشرة سوف ي...
Access restricted. Please log in or start a trial to view this content.
Discussion
نجاح التحديد الكمي لدرجة الحموضةوأنا في MTs المورفولوجية يعتمد كلياً على صحة المستخرجة من النظام التجاري المتعدد الأطراف ونوعية تركيب وتشريح (الشكل A – ج). وهكذا، المعالجة الدقيقة للأنسجة كوصف الحتمي. شرائح طازجة مغلفة في PLL إلى حد كبير المعونة MT تصاع...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
هذا العمل كان يدعمها DK092408 المعاهد الوطنية للصحة وأيد T32-DK007013 DK100227 على أجر MFR.. الكتاب نود أن نشكر الدكتور جوليان داو أ. ت. GAL4 كابار و c724-GAL4 الأرصدة المورفولوجية . ونشكر أيضا يعقوب باء أندرسون للمساعدة في الحفاظ على الصلبان الطيران التجريبي.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Poly-L-Lysine (PLL) Solution | Sigma-Aldrich | P4832 | Store at 4 °C, can be reused. |
| Nigericin Sodium Salt | Sigma-Aldrich | N7143 | CAUTION: Handle with gloves. Store as aliquots of 20 mM stock solution in DMSO at 4 °C. |
| Adhesive Perfusion Chamber Covers, adhesive size 1 mm, chamber diameter × thickness 9 mm × 0.9 mm, ports diameter 1.5 mm | Sigma-Aldrich | GBL622105 | Can be substituted as needed to match perfusion system. |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | Available from multiple vendors. |
| Helping Hands Soldering Stands | Harbor Freight Tools | 60501 | Available from multiple vendors. |
| Open Gravity-fed Perfusion System with Valve Controller, 8 to 1 Manifold and Reserviors | Bioscience Tools | PS-8S | Any comparable perfusion system can be used. |
| Flow Regulator | Warner Instruments | 64-0221 | Can be substituted as needed to match perfusion system. |
| Schneider's Medium | Fisher Scientific | 21720024 | Store at 4 °C in sterile aliquots. |
| #5 Inox Steel Forceps | Fine Science Tools | 11252-20 | Can be substituted based on experimenter comfort. |
| 35 x 10 mm polystyrene Petri dish | Corning Life Sciences | Fisher Scientific 08-757-100A | Exact brand and size are unimportant. |
| 75 x 25 mm Microscope Slides | Corning Life Sciences | 2949-75X25 | Exact brand and size can vary as long as perfusion wells are compatible. |
| Filimented Borosilicate Capillary Glass, ID 1.5 mm, OD 0.86 mm, thickness 0.32 mm | Warner Instruments | 64-0796 | Filiment not necessary, glass can be substituted to match perfusion tubing and perfusion wells. |
| Tygon Tubing, ID 1/16", OD 1/8", thickness 1/32" | Fisher Scientific | 14-171-129 | Available from multiple vendors, can be substituted to match perfusion system. |
| Vacuum Silicone Grease | Sigma-Aldrich | Z273554 | Available from multiple vendors. |
| Plastic Flow Control Clamp | Fisher Scientific | 05-869 | Available from multiple vendors, sterility not required |
| Glass rods, 5 mm diameter | delphiglass.com | 9198 | Exact size is personal preference, multiple vendors available |
| PAP Hydrophobic Pen | Sigma-Aldrich | Z377821 | Available from multiple vendors. |
| Sealing Film | Sigma-Aldrich | P7668 | Available from multiple vendors. |
| 15 mL Falcon tube | BD Falcon | 352096 | Available from multiple vendors. |
| 50 mL Falcon tube | BD Falcon | 352070 | Available from multiple vendors. |
| HEPES; 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Sigma-Aldrich | H3375 | Available from multiple vendors. |
| MES; 4-Morpholineethanesulfonic acid monohydrate | Sigma-Aldrich | 69892 | Available from multiple vendors. |
| TAPS; N-[Tris(hydroxymethyl)methyl]-3-aminopropanesulfonic acid | Sigma-Aldrich | T5130 | Available from multiple vendors. |
| 10X/0.45 Air Objective | Zeiss | 000000-1063-139 | Comparable objectives can be substituted. 40X objectives can be used for single cell imaging. |
| Dissecting Stereoscope | Zeiss | Discovery.V8 | Any dissecting stereoscope can be used. |
| UAS-pHerry transgenic Drosophila melagnogaster | Available from Romero Lab | First published: Citation 10 | |
| capaR-GAL4 driver line Drosophila melagnogaster | Available from Romero Lab | First published: Citation 32 | |
| c724-GAL4 driver line Drosophila melagnogaster | Available from Romero Lab | First published: Citation 2 | |
| Monochromatic High Sensitivity Digital Camera | Zeiss | Axiocam 506 mono | Exact brand and model can vary, can be replaced with any monochromatic high-sensitivity camera suited to live cellular imaging. |
| GFP/FITC filter set, 470/40 nm ex., 515 nm longpass em., 500 nm dichroic | Chroma | CZ909 | Any GFP/FITC filer set can be substituted. |
| RFP/TRITC filter set, 546/10 nm ex., 590 nm longpass em., 565 nm dichroic | Chroma | CZ915 | Any GFP/FITC filer set can be substituted. |
| Inverted Epifluoescent Microscope | Zeiss | Axio Observer Z.1 | Any comparable microscope with motorized filter switching can be used. Upright microscopes can be used with open perfusion baths and water-immersion objectives. |
| Statistical Analysis Software | Microcal | Origin 6.0 | Any software with comparable functionality can be substituted |
| Image Analysis Software | National Institutes of Health | ImageJ 1.50i | Any software with comparable functionality can be substituted |
| Image Acquisition Software | Zeiss | Zen 1.1.2.0 | Any software with comparable functionality can be substituted |
| Single-edged Carbon Steel Razor Blade | Electron Microscopy Sciences | 71960 | Available from multiple vendors. |
| Microscopy Slide Folder | Fisher Scientific | 16-04 | Available from multiple vendors. |
| Bunsen Burner | Fisher Scientific | 50-110-1231 | Available from multiple vendors. |
| Polystrene Drosophila Rearing Vials with Flugs | Genesee Scientific | 32-109BF | Comparable items can be substituted. |
| 2.5 L Laboratory Ice Bucket | Fisher Scientific | 07-210-129 | Available from multiple vendors. |
| NMDG; N-Methyl-D-glucamine | Sigma-Aldrich | M2004 | Available from multiple vendors. |
| 200 uL barrier pipette tips | MidSci | AV200 | Available from multiple vendors. |
| 200 μL variable volume pipette | Gilson Incorporated | PIPETMAN P200 | Available from multiple vendors. |
References
- Dow, J. A. T., Romero, M. F. Drosophila provides rapid modeling of renal development, function, and disease. Am J Physiol Renal Physiol. 299 (6), F1237-F1244 (2010).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. P Natl Acad Sci USA. 94 (10), 5207-5212 (1997).
- Davies, S. A., et al. Analysis and inactivation of vha55, the gene encoding the vacuolar ATPase B-subunit in Drosophila melanogaster reveals a larval lethal phenotype. J Biol Chem. 271 (48), 30677-30684 (1996).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. P Natl Acad Sci USA. 101 (37), 13689-13693 (2004).
- Evans, J. M., Allan, A. K., Davies, S. A., Dow, J. A. Sulphonylurea sensitivity and enriched expression implicate inward rectifier K+ channels in Drosophila melanogaster renal function. J Exp Biol. 208 (Pt 19), 3771-3783 (2005).
- Sciortino, C. M., Shrode, L. D., Fletcher, B. R., Harte, P. J., Romero, M. F. Localization of endogenous and recombinant Na(+)-driven anion exchanger protein NDAE1 from Drosophila melanogaster. Am J Physiol Cell Physiol. 281 (2), C449-C463 (2001).
- Ianowski, J. P., O'Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207 (Pt 15), 2599-2609 (2004).
- O'Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274 (4 Pt 2), R1039-R1049 (1998).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. P Natl Acad Sci USA. 111 (39), 14301-14306 (2014).
- Rossano, A. J., Kato, A., Minard, K. I., Romero, M. F., Macleod, G. T. Na+ /H+ -exchange via the Drosophila vesicular glutamate transporter (DVGLUT) mediates activity-induced acid efflux from presynaptic terminals. J Physiol. 595 (3), 805-824 (2017).
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The use of pHluorins for optical measurements of presynaptic activity. Biophys J. 79 (4), 2199-2208 (2000).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat biotechnol. 22 (12), 1567-1572 (2004).
- Thomas, J. A., Buchsbaum, R. N., Zimniak, A., Racker, E. Intracellular pH measurements in Ehrlich ascites tumor cells utilizing spectroscopic probes generated in situ. Biochemistry. 18 (11), 2210-2218 (1979).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448 (7150), 151(2007).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Hirata, T., et al. In vivo Drosophilia genetic model for calcium oxalate nephrolithiasis. Am J Physiol Renal Physiol. 303 (11), F1555-F1562 (2012).
- Schellinger, J. N., Rodan, A. R. Use of the Ramsay Assay to Measure Fluid Secretion and Ion Flux Rates in the Drosophila melanogaster Malpighian Tubule. J Vis Exp. (105), (2015).
- Caldwell, P. C. An investigation of the intracellular pH of crab muscle fibres by means of micro-glass and micro-tungsten electrodes. J Physiol. 126 (1), 169-180 (1954).
- Boron, W. F., De Weer, P. Intracellular pH transients in squid giant axons caused by CO2, NH3, and metabolic inhibitors. J Gen Physiol. 67 (1), 91-112 (1976).
- Rink, T. J., Tsien, R. Y., Pozzan, T. Cytoplasmic pH and free Mg2+ in lymphocytes. J Cell Biol. 95 (1), 189-196 (1982).
- Bizzarri, R., Serresi, M., Luin, S., Beltram, F. Green fluorescent protein based pH indicators for in vivo use: a review. Anal Bioanal Chem. 393 (4), 1107-1122 (2009).
- Kneen, M., Farinas, J., Li, Y., Verkman, A. S. Green fluorescent protein as a noninvasive intracellular pH indicator. Biophys J. 74 (3), 1591-1599 (1998).
- Raimondo, J. V., Irkle, A., Wefelmeyer, W., Newey, S. E., Akerman, C. J. Genetically encoded proton sensors reveal activity-dependent pH changes in neurons. Front Mol Neurosci. 5, 68(2012).
- Raimondo, J. V., et al. Tight Coupling of Astrocyte pH Dynamics to Epileptiform Activity Revealed by Genetically Encoded pH Sensors. J Neurosci. 36 (26), 7002-7013 (2016).
- Bagar, T., Altenbach, K., Read, N. D., Bencina, M. Live-Cell imaging and measurement of intracellular pH in filamentous fungi using a genetically encoded ratiometric probe. Eukaryot Cell. 8 (5), 703-712 (2009).
- Gjetting, K. S., Ytting, C. K., Schulz, A., Fuglsang, A. T. Live imaging of intra- and extracellular pH in plants using pHusion, a novel genetically encoded biosensor. J Exp Bot. 63 (8), 3207-3218 (2012).
- Greenspan, R. J. Fly pushing: the theory and practice of Drosophila genetics. , 2nd ed, Cold Spring Harbor Laboratory Press. (2004).
- Raimondo, J. V., et al. A genetically-encoded chloride and pH sensor for dissociating ion dynamics in the nervous system. Front Cell Neurosci. 7, 202(2013).
- Koivusalo, M., et al. Amiloride inhibits macropinocytosis by lowering submembranous pH and preventing Rac1 and Cdc42 signaling. J Cell Biol. 188 (4), 547-563 (2010).
- Terhzaz, S., et al. Mechanism and function of Drosophila capa GPCR: a desiccation stress-responsive receptor with functional homology to human neuromedinU receptor. PloS one. 7 (1), e29897(2012).
- Boyarsky, G., Ganz, M. B., Sterzel, R. B., Boron, W. F. pH regulation in single glomerular mesangial cells. I. Acid extrusion in absence and presence of HCO3. Am J Physiol. 255 (6 Pt 1), C844-C856 (1988).
- Chesler, M. The regulation and modulation of pH in the nervous system. Prog Neurobiol. 34 (5), 401-427 (1990).
- Rossano, A. J., Chouhan, A. K., Macleod, G. T. Genetically encoded pH-indicators reveal activity-dependent cytosolic acidification of Drosophila motor nerve termini in vivo. J Physiol. 591 (7), 1691-1706 (2013).
- Roos, A., Boron, W. F. Intracellular pH. Physiol Rev. 61 (2), 296-434 (1981).
- Vaughan-Jones, R. D., Wu, M. L. pH dependence of intrinsic H+ buffering power in the sheep cardiac Purkinje fibre. J Physiol. 425, 429-448 (1990).
- Buckler, K. J., Vaughan-Jones, R. D., Peers, C., Nye, P. C. Intracellular pH and its regulation in isolated type I carotid body cells of the neonatal rat. J Physiol. 436, 107-129 (1991).
- Bevensee, M. O., Schwiening, C. J., Boron, W. F. Use of BCECF and propidium iodide to assess membrane integrity of acutely isolated CA1 neurons from rat hippocampus. J Neurosci Methods. 58 (1-2), 61-75 (1995).
- Arosio, D., et al. Simultaneous intracellular chloride and pH measurements using a GFP-based sensor. Nat Methods. 7 (7), 516-518 (2010).
- Wu, Y., Baum, M., Huang, C. L., Rodan, A. R. Two inwardly rectifying potassium channels, Irk1 and Irk2, play redundant roles in Drosophila renal tubule function. Am J Physiol Regul Integr Comp Physiol. 309 (7), R747-R756 (2015).
- Schulte, A., Lorenzen, I., Bottcher, M., Plieth, C. A novel fluorescent pH probe for expression in plants. Plant Methods. 2, 7(2006).
- Shen, Y., Rosendale, M., Campbell, R. E., Perrais, D. pHuji, a pH-sensitive red fluorescent protein for imaging of exo- and endocytosis. J Cell Biol. 207 (3), 419-432 (2014).
- Johnson, D. E., et al. Red fluorescent protein pH biosensor to detect concentrative nucleoside transport. J Biol Chem. 284 (31), 20499-20511 (2009).
- Mahon, M. J. pHluorin2: an enhanced, ratiometric, pH-sensitive green florescent protein. Adv Biosci Biotechnol. 2 (3), 132-137 (2011).
- Li, Y., Tsien, R. W. pHTomato, a red, genetically encoded indicator that enables multiplex interrogation of synaptic activity. Nat Neurosci. 15 (7), 1047-1053 (2012).
- Tantama, M., Hung, Y. P., Yellen, G. Imaging intracellular pH in live cells with a genetically encoded red fluorescent protein sensor. J Am Chem Soc. 133 (26), 10034-10037 (2011).
- Matlashov, M. E., et al. Fluorescent ratiometric pH indicator SypHer2: Applications in neuroscience and regenerative biology. Biochimica et biophysica acta. 1850 (11), 2318-2328 (2015).
- Kogure, T., et al. A fluorescent variant of a protein from the stony coral Montipora facilitates dual-color single-laser fluorescence cross-correlation spectroscopy. Nat biotechnol. 24 (5), 577-581 (2006).
- Llopis, J., McCaffery, J. M., Miyawaki, A., Farquhar, M. G., Tsien, R. Y. Measurement of cytosolic, mitochondrial, and Golgi pH in single living cells with green fluorescent proteins. P Natl Acad Sci USA. 95 (12), 6803-6808 (1998).
- Poburko, D., Santo-Domingo, J., Demaurex, N. Dynamic regulation of the mitochondrial proton gradient during cytosolic calcium elevations. J Biol Chem. 286 (13), 11672-11684 (2011).
- Stornaiuolo, M., et al. KDEL and KKXX retrieval signals appended to the same reporter protein determine different trafficking between endoplasmic reticulum, intermediate compartment, and Golgi complex. Mol Biol Cell. 14 (3), 889-902 (2003).
- Makkerh, J. P., Dingwall, C., Laskey, R. A. Comparative mutagenesis of nuclear localization signals reveals the importance of neutral and acidic amino acids. Curr Biol. 6 (8), 1025-1027 (1996).
- Zacharias, D. A., Violin, J. D., Newton, A. C., Tsien, R. Y. Partitioning of lipid-modified monomeric GFPs into membrane microdomains of live cells. Science. 296 (5569), 913-916 (2002).
- McGuire, R. M., Silberg, J. J., Pereira, F. A., Raphael, R. M. Selective cell-surface labeling of the molecular motor protein prestin. Biochem Biophys Res Comm. 410 (1), 134-139 (2011).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved