A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التنبؤ الجينات إسكات من خلال التحكم المكاني الزماني من سيرنا الافراج عن نانوكاريرز البوليمرية استجابة الصورة
In This Article
Summary
نقدم طريقة الرواية التي تستخدم البوليمرات كتلة استجابة الصورة للتحكم الزماني الزماني أكثر كفاءة من إسكات الجينات مع عدم الكشف عن الآثار خارج الهدف. بالإضافة إلى ذلك، يمكن التنبؤ بالتغيرات في التعبير الجيني باستخدام مقايسات إطلاق سيرنا مباشرة ونمذجة حركية بسيطة.
Abstract
وهناك حاجة إلى مواد وطرق جديدة لتحسين السيطرة على ملزمة مقابل الافراج عن الأحماض النووية لمجموعة واسعة من التطبيقات التي تتطلب التنظيم الدقيق للنشاط الجيني. على وجه الخصوص، والمواد المحفزة استجابة جديدة مع تحسين السيطرة المكانية الزمانية على التعبير الجيني فتح منصات قابلة للترجمة في اكتشاف المخدرات وتكنولوجيات الطب التجديدي. وعلاوة على ذلك، فإن تعزيز القدرة على السيطرة على إطلاق الحمض النووي من المواد من شأنه أن يتيح تطوير أساليب مبسطة للتنبؤ فعالية نانوكارير مسبق ، مما يؤدي إلى الفحص المعجل من مركبات التسليم. هنا، نقدم بروتوكول للتنبؤ الكفاءة إسكات الجينات وتحقيق السيطرة المكانية الزمانية على التعبير الجيني من خلال نظام نانوكارير نظام استجابة وحدات. إن رنا التداخل الصغير (سيرنا) معقد مع مبيغ- b- بول (5- (3- (أمينو) بروبوكسي) -2-نيتروبنزيل ميثاكريلات) (مبيغ- ب -P (أبنبا)آرإم مستقرة نانوكاريرز التي يمكن السيطرة عليها مع الضوء لتسهيل الانضباطي، على / قبالة الإفراج سيرنا. نحن الخطوط العريضة اثنين من المقايسات التكميلية استخدام مضان ارتباط الطيفي والهلام الكهربائي لقياس الكمي الدقيق لإطلاق سراح سيرنا من حلول محاكاة البيئات داخل الخلايا. وقد تم دمج المعلومات المكتسبة من هذه المقايسات في نموذج الحركية رنا التدخل (رني) بسيط للتنبؤ ردود الفعل إسكات ديناميكية لمختلف الظروف التحفيز الصورة. في المقابل، سمحت هذه الظروف التشعيع الأمثل صقل بروتوكول جديد لمراقبة سباتوتيوتومبوري إسكات الجينات. هذه الطريقة يمكن أن تولد أنماط الخلوية في التعبير الجيني مع خلية إلى خلية القرار وليس الكشف عن آثار خارج الهدف. مجتمعة، نهجنا يوفر وسيلة سهلة الاستخدام للتنبؤ التغيرات الديناميكية في التعبير الجيني والسيطرة على وجه التحديد سيرنا النشاط في المكان والزمان. هذه المجموعة من المقايسات يمكن تكييفها بسهولة لاختبار مجموعة واسعة من أوتنظمها المحفزة استجابة من أجل التصدي للتحديات الرئيسية ذات الصلة إلى العديد من التطبيقات في مجال البحوث الطبية الحيوية والطب.
Introduction
رنا التدخل الصغيرة (سيرناس) توسط إسكات الجينات بعد النسخي من خلال مسار رني الحفاز التي هي محددة للغاية، وقوية، وقابلة للتخصيص تقريبا أي الجينات المستهدفة 1 . وقد مكنت هذه الخصائص واعدة العلاجات سيرنا للمضي قدما في التجارب السريرية الإنسان لعلاج العديد من الأمراض، بما في ذلك سرطان الجلد النقيلي والهيموفيليا 2 ، 3 . ومع ذلك، لا تزال هناك قضايا تسليم هامة عرقلت الترجمة 4 . على وجه الخصوص، يجب أن تظل مركبات التسليم مستقرة وحماية سيرناس من تدهور خارج الخلية، ولكن أيضا إطلاق حمولة في السيتوبلازم 5 . وعلاوة على ذلك، تتطلب العديد من التطبيقات رني أساليب محسنة لتنظيم إسكات الجينات في الفضاء والزمان 6 ، مما سيقلل من الآثار الجانبية في العلاجات سيرنا 7 وتمكين التحويليةدفانسس في تطبيقات تتراوح بين ميكروأرس الخلية لاكتشاف المخدرات 8 إلى تعديل ردود الخلايا في السقالات التجدد 9 . هذه التحديات تسلط الضوء على الحاجة إلى مواد وأساليب جديدة لتحسين السيطرة ملزمة مقابل الافراج عنهم في نانوكاريرز سيرنا.
واحدة من الاستراتيجيات الواعدة للسيطرة على إطلاق سراح سيرنا وتعزيز التنظيم المكاني الزماني هو استخدام المواد المحفزة استجابة 10 . على سبيل المثال، تم تصميم مجموعة واسعة من المواد الحيوية مع تقارب ارتباط الحمض النووي للتغيير استجابة لتغير الأكسدة المحتملة أو درجة الحموضة، أو المجالات المغناطيسية المطبقة، الموجات فوق الصوتية، أو الضوء 11 . على الرغم من أن العديد من هذه النظم تظهر تحسين السيطرة على نشاط الحمض النووي، واستخدام الضوء كمحفز هو مفيد بشكل خاص نظرا لاستجابتها الزمنية لحظية، الدقة المكانية دقيقة، وسهولة الانضباط 12. وعلاوة على ذلك، وقد أثبتت إمكانات التكنولوجيات الحساسة للصور لتنظيم التعبير الجيني من قبل الدولة المرتقب محفز نظم وأنظمة أوبتوجينيتيك للدولة من بين الفن؛ ومع ذلك، فإن هذه النظم تعاني من العديد من التحديات بما في ذلك قدرات محدودة لتنظيم الجينات الذاتية، وشواغل السلامة مثل المناعة، والصعوبات في تقديم الجمعيات متعددة المكونات 13 ، 14 ، 15 . صورة مناسبة استجابة نانوكاريرز سيرنا هي مناسبة بشكل مثالي للتغلب على هذه السلبيات وتوفير نهج أبسط وأكثر قوة لتعديل سباتيوتيمبورالي التعبير الجيني 16 ، 17 ، 18 . لسوء الحظ، وأساليب التنبؤ بدقة استجابة البروتين ضربة قاضية الناتجة لا تزال بعيد المنال.
التحدي الرئيسي هو أن التقييمات الكمية لإطلاق سيرنا هينادر 19 ، 20 ، وحتى عندما يتم تنفيذ هذه التقييمات، فإنها لم يقترن لتحليلات سيرنا / البروتينات دوران دوران. كل من كمية سيرنا صدر ومثابرة / عمرها هي المحددات الهامة للديناميات إسكات الجينات الناتجة. وبالتالي، فإن الافتقار إلى هذه المعلومات هو فصل رئيسي يمنع التنبؤ الدقيق للجرعة الاستجابة في رني 21 . ومن شأن التصدي لهذا التحدي أن يعجل بصياغة العلاقات المناسبة بين الهيكل والوظيفة في الحواجز النانوية، وأن يقدم معلومات أفضل عن تصاميم المواد البيولوجية 22 . وعلاوة على ذلك، فإن مثل هذه النهج تمكين تطوير بروتوكولات الجرعات سيرنا أكثر فعالية. في محاولة لفهم الاستجابة إسكات ديناميكية، وقد حققت عدة مجموعات النماذج الرياضية من رني 23 ، 24 ، 25 . وكانت هذه الأطرناجحة في توفير رؤى في التغييرات بوساطة سيرنا في التعبير الجيني وتحديد خطوات الحد من معدل 26 . ومع ذلك، تم تطبيق هذه النماذج فقط على نظم تسليم الجينات التجارية (على سبيل المثال ، ليبوفيكتامين وبولي إيثيلينيمين (بي)) التي ليست قادرة على تسيطر الإفراج سيرنا، وتعقيد النماذج قد حدت بشدة من فائدة 27 . هذه العيوب تسلط الضوء على الحاجة غير الملباة للمواد الجديدة قادرة على الافراج عن سيرنا قابل للتعديل بدقة جنبا إلى جنب مع النماذج الحركية التنبؤية مبسطة وسهلة الاستخدام.
أسلوبنا يعالج كل هذه التحديات من خلال دمج منصة حساسة للضوء نانوكارير مع أساليب مقترنة لتحديد سيرنا الحرة وديناميات نموذج رني. على وجه الخصوص، يتم التحكم في منصة لدينا سيرينا بالتحكم بدقة الإفراج 28 من قبل اثنين من الطرق التكميلية لقياس بدقة مغلفة مقابل الامم المتحدةملزمة سيرنا. يتم إدخال البيانات التجريبية من هذه المقايسات في نموذج حركي بسيط للتنبؤ الكفاءة إسكات الجينات مسبقا 29 . وأخيرا، فإن طبيعة تشغيل / إيقاف نانوكاريرز بسهولة استغلالها لتوليد أنماط الخلايا في التعبير الجيني مع التحكم المكاني على نطاق طول الخلوية. وهكذا، فإن هذه الطريقة توفر طريقة قابلة للتكيف بسهولة للسيطرة والتنبؤ إسكات الجينات في مجموعة متنوعة من التطبيقات التي من شأنها أن تستفيد من التنظيم المكاني الزماني للسلوك الخلية.
Protocol
1. صياغة سيرنا نانوكاريرز
- إعداد حلول منفصلة من سيرنا و MPEG- ب -P (أبنبا) مع أحجام متساوية المخففة في 20 ملي 4- (2-هيدروكسي إيثيل) بيبيرازين-1-إيثانسولفونيك العازلة (هيبيس) العازلة في درجة الحموضة 6.0.
- إضافة سيرنا بتركيز 32 ميكروغرام / مل إلى 20 ملي هيبيس الحل.
ملاحظة: كان سيرنا غير المستهدفة، عالمية تسلسل السيطرة السلبية. ومع ذلك، يمكن تصميم سيرنا لاستهداف أي الجينات من الفائدة. - حل MPEG- ب -P (أبنبا) البوليمرات في حل هيبيس 20 ملي. إضافة كمية مناسبة من MPEG- ب -P (أبنبا) لجعل محلول 220 ميكروغرام / مل بحيث نسبة N / P (N، مجموعات أمين على MPEG- ب -P (أبنبا)؛ P، مجموعات الفوسفات على سيرنا) هو 4.
ملاحظة: يتم الإبلاغ عن بروتوكول الاصطناعية للبوليمرات MPEG- ب -P (أبنبا) في مكان آخر 30 .
- إضافة سيرنا بتركيز 32 ميكروغرام / مل إلى 20 ملي هيبيس الحل.
- إضافة مبيغ- ب -P (أبنبا) حل قطرة قطرة إلى فولوم متساويةه من الحل سيرنا بينما خلط بلطف على آلة دوامة. استمر في دوامة لمدة 30 ثانية بعد إضافة البوليمر. احتضان العينات في الظلام في درجة حرارة الغرفة لمدة 30 دقيقة.
2. قياس سيرنا الإصدار باستخدام هلام الكهربائي
- صياغة نانوكاريرز وفقا للخطوات 1.1-1.2، وحجم أحجام لاستيعاب عدد من العينات المطلوبة.
- خلط نانوكارير مع كبريتات دوديسيل الصوديوم (سدز).
- إعداد 1 ملغ / مل حل سدز في الماء. قسامة من كمية حل سدز اللازمة لإنتاج حلول مع نسبة S / P (S، مجموعات الكبريتات على سدز؛ P، مجموعات الفوسفات على سيرنا) من 15.
ملاحظة: إذا كان الحل بوليبلكس يحتوي على 1 ميكروغرام من سيرنا، يجب إضافة 13 ميكروغرام من سدز لتحقيق نسبة S / P من 15. - إضافة حل سدز إلى كل نانوكارير حل قطرة قطرة بينما خلط بلطف على آلة دوامة. استمر في دوامة لمدة 30 ثانية بعد إضافة سدز.
- الطرد المركزي العينات في 3000 x ج لمدة 5 ثوان. احتضان العينات في الظلام في درجة حرارة الغرفة لمدة 30 دقيقة.
- إعداد 1 ملغ / مل حل سدز في الماء. قسامة من كمية حل سدز اللازمة لإنتاج حلول مع نسبة S / P (S، مجموعات الكبريتات على سدز؛ P، مجموعات الفوسفات على سيرنا) من 15.
- معايرة وتعيين ليزر الأشعة فوق البنفسجية مع مرشح نانومتر 365 إلى كثافة 200 W / م. تأكد من أن شدة الضوء تقاس من الموقع الذي سيجلس فيه الجزء السفلي من محلول العينة.
- تحميل حل نانوكارير / سدز في غرفة زجاجية تتألف من الشرائح الزجاجية مفصولة طوقا المطاط.
- قبل غسل الزجاج الشرائح في 7: 3 (v / v) الإيثانول / المياه الحل في الماء وجافة تماما. قطع حفرة (~ 2 × 3 سم مستطيل) في طوقا المطاط. ضع طوقا من المطاط على شريحة زجاجية.
- ماصة الحل نانوكارير / سدز على الشريحة الزجاجية داخل حفرة من طوقا المطاط. تحميل فائض من محلول (20 ميكرولتر في الفائض) على الشريحة الزجاجية مع تجنب الاتصال مع طوقا المطاط.
ملاحظة: سوف تفقد بعض السائل خلال الخطوات اللاحقة. - ضع الزجاج الثانيالشريحة على رأس الشريحة-- طوقا. لتجنب جيل فقاعة الهواء، وضع نهاية واحدة من الشريحة لأسفل أولا ثم ببطء خفض الطرف الآخر.
- إرفاق مقاطع الموثق على كل جانب من الغرفة الزجاجية لعقد إغلاقه.
- إشعاع العينات للطول المطلوب من الزمن (على سبيل المثال ، 0-60 دقيقة) باستخدام الليزر الأشعة فوق البنفسجية مع مرشح 365 نانومتر في شدة 200 W / م. إزالة مقاطع الموثق وفتح الغرفة.
- ماصة 25 ميكرولتر من عينات نانوكارير / سدز المشع في أنبوب ميكروسنتريفوج. احتضان الحلول في الظلام في درجة حرارة الغرفة لمدة 30 دقيقة.
- إعداد 2٪ بالوزن الاغاروز قبل الملطخة مع 0.5 ميكروغرام / مل إيثيديوم بروميد في تريس / بورات / إدتا (تب) حل مخزنة وفقا لبروتوكولات القياسية 31 . إعداد عازلة التحميل تتألف من 3: 7 (الخامس / الخامس) الجلسرين / المياه.
- إضافة 5 ميكرولتر من حل العازلة التحميل إلى 25 ميكرولتر من كل عينة نانوكارير / سدز. احتضان العينات في الظلام فيدرجة حرارة الغرفة لمدة 10 دقيقة.
- تحميل 30 ميكرولتر من كل عينة نانوكارير / سدز في هلام الاغاروز 2٪. تشغيل هلام في الظلام في 100 V لمدة 30 دقيقة. صورة هلام باستخدام نظام التصوير هلام مع مرشحات إيثيديوم بروميد. حفظ ملفات الصور هلام والمضي قدما إلى الخطوة 2.10 للكمي الفرقة الكثافة. تأكد من أن شدة الفرقة مشرقة بما فيه الكفاية لتصور بوضوح ولكن ليس مشرق جدا أن إشارات مشبعة.
- تحديد كثافة الفرقة باستخدام العلنية إيماجيج البرمجيات 32 .
- باستخدام أداة روي من إيماجيج، وتحديد كثافة مضان من العصابات سيرنا الحرة في كل حارة من خلال رسم مستطيل حول كل فرقة. رسم منحنيات شدة كل حارة، ودمج المنطقة تحت منحنيات عن طريق رسم خط أفقي عبر منحنيات شدة والنقر على عصا تتبع داخل المناطق المغلقة.
- حساب كثافة النسبية لكل حارة بقسمة المنطقة تحت سورفي من كل عينة من المنطقة تحت منحنى السيطرة الإيجابية سيرنا (لا مبيغ- ب -P (أبنبا) وأضاف وعدم إضافة سدز). الإبلاغ عن نسبة سيرنا صدر كتقيس الفرقة تطبيع كل عينة.
3. قياس سيرنا الإصدار باستخدام مضان الارتباط الطيفي (فس)
- الحصول على سيرنا المسمى مع فلورفور واحد في نهاية 5 'من حبلا الشعور.
ملاحظة: يمكن شراء سيرنا قبل صلب مع تسميات مترافق في الموقع المطلوب. وينبغي أن يكون فلورفور الصورة مستقرة واستيعاب / تنبعث بين 450 و 750 نانومتر لتجنب التبريد ضوء الأشعة فوق البنفسجية ونقل الطاقة مع MPEG- ب -P (أبنبا). - صياغة نانوكاريرز وفقا للخطوات 1.1-1.2 باستخدام سيرنا المسمى. حجم وحدات التخزين لاستيعاب عدد من العينات المطلوبة.
- احتضان الحلول في سدز و إراديات للطول المطلوب من الوقت وفقا للخطوات 2.2-2.6.
- Preparأتيون، بسبب، فس، أخذ عينة، حجرة.
- غسل شريحة زجاجية مع 7: 3 (الخامس / الخامس) محلول الإيثانول / المياه وتجفيف تماما الزجاج باستخدام مسح وتيار الهواء.
- إزالة قطعة من الورق من فاصل لاصق على الوجهين لفضح على الوجهين لاصق فاصل. إرفاق فاصل إلى ساترة الزجاج.
- ماصة الحل نانوكارير / سدز على زلة الغطاء في منتصف الحفرة من فاصل لاصق.
- وضع الشريحة الزجاجية على أعلى ساترة. دفع على الشريحة الزجاجية لضمان أن الشريحة الزجاجية و ساترة تعلق جيدا و تشكل ختم.
- استخدام المجهر مبائر لقياسات فس 33 . استخدام 40X الهدف الغمر المياه أبوكرومات مع فتحة عددية من 1.2. استخدام قناة ليزر الإثارة المناسبة (488 نانومتر) لجمع ما لا يقل عن 30 قياسات من 10 ثانية لكل عينة 34 . تأكد من أن شدة الليزر وكشف المحاذاة تبقىونفس الشيء لكل عينة.
- بالإضافة إلى العينات التجريبية، قياس الضوابط بما في ذلك: عينة فارغة دون سيرنا المسمى؛ و سيرنا عينة مجانية مع سيرنا المسمى ولكن لا MPEG- ب -P (أبنبا).
- تحليل البيانات باستخدام برامج محددة فس. تحديد معدل العد الأساس من كل عينة عن طريق تحديد معدل العد مستقرة خلال الوقت الذي لا نانوكاريرز تمر عبر حجم مبائر 29 .
- طرح معدل العد من عينة فارغة من كل عينة خط الأساس قيمة معدل العد. تطبيع القيم الناتجة إلى التحكم سيرنا مجانا لحساب نسبة سيرنا الحرة 35 .
4. النمذجة الحركية للتنبؤ إسكات الجينات
- إنشاء البرامج النصية في لغة البرمجة الرياضية باستخدام مجموعة بسيطة من المعادلات التفاضلية العادية للتنبؤ إسكات الجينات 29 -
ملاحظة: يمكن إجراء البرامج النصية المتاحة عند الطلب.- اكتب مجموعة المعادلات التفاضلية العادية على النحو التالي:
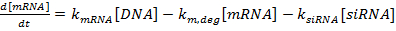 (1)
(1)  (2)
(2) 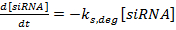 (3)
(3)
ملاحظة: بالنسبة للمعادلات 1-3، المصطلحات k مرنا ، k سيرنا ، و k بروت هي الثوابت معدل لإنتاج مرنا، سيرنا، والبروتين، على التوالي. إن المصطلحات k m و ديغ و k s و ديغ و k p، ديغ هي ثوابت معدل لتدهور مرنا، سيرنا، والبروتين، على التوالي. وتحسب ثوابت معدل التحلل على أساس عمر النصف المكون، وثوابت معدل الإنتاج هي مناسبة لضمان أن يتم التوصل إلى مرنا والبروتين قيم الحالة الثابتة في غياب سf سيرنا.- تحديد عمر النصف من مرنا والبروتين للجينات (ق) من الفائدة، إما تجريبيا كما هو موضح في المرجع 36 أو من الأدب (انظر المناقشة ). أيضا، وتحديد الوقت مضاعفة لخط الخلية. أدخل هذه القيم في تعبيرات معدل التدهور المناسبة.
- لضبط ثوابت معدل الإنتاج بحيث تبقى مستويات التعبير الجيني ثابتة في قيمة تطبيع 100 إذا لم يتم تقديم سيرنا. على وجه التحديد، اضبط [سيرنا] إلى الصفر، وتختلف قيم مرنا ك، ك سيرنا، والبروتوكول الاضافي ك الثوابت معدل الإنتاج حتى [مرنا] و [بروتين] تبقى في حدود 1٪ من قيمة تطبيع الأولية بنسبة 100٪ لمدة المحاكاة.
- باستخدام كميات النسبية من سيرنا صدر من هلام الكهربائي وصفها سابقا والمقايسات فس كما تقديرات، وضبط التركيز النسبي الأولي من سيرنا في السيناريو. على وجه التحديد، تختلف [سيرنA] أن تكون متناسبة مع المبلغ النسبي من سيرنا صدر، مع قيمة 100 المقابلة لأقصى قدر 29 .
- اكتب مجموعة المعادلات التفاضلية العادية على النحو التالي:
5. خلية الثقافة وفي المختبر سيرنا التسليم
- ثقافة المعاهد الوطنية للصحة / 3T3 الخلايا الليفية الفئران الجنينية وفقا لبروتوكولات من المورد.
- تنمو الخلايا في وسط النمو (دولبيكو تعديل النسر المتوسطة (دمم) تستكمل مع 10٪ مصل اللبن البقري الحرارة المعطل و 1٪ البنسلين الستربتومايسين). الحفاظ على الخلايا عند 37 درجة مئوية في بيئة ترطيب مع 5٪ كو 2 .
- البذور الخلايا في 6-جيدا زراعة الأنسجة لوحات المعالجة.
- اتبع الإجراء الفرعي سوبكولتورينغ من المورد. عد الخلايا باستخدام عدادة الكريات. تمييع الخلايا في وسائل الإعلام نمو تكميلية لتركيز 75،000 خلية / مل.
- إضافة 2 مل من تعليق الخلية (75،000 خليةs / مل) إلى كل بئر من لوحة 6 جيدا. السماح للخلايا تلتزم واستعادة لمدة 24 ساعة في الحاضنة.
- إعداد خلايا ترنسفكأيشن عن طريق غسل مع الفوسفات مخزنة المالحة (بس) وإضافة 1.5 مل من مصل الدم والمضادات الحيوية خالية من ترنسفكأيشن المتوسطة (انظر جدول المواد ) لكل بئر.
- صياغة نانوكاريرز سيرنا وفقا للخطوات 1.1-1.2. إضافة 25 ميكرولتر من محلول نانوكارير تحتوي على 30 بمول من سيرنا إلى كل بئر. ماصة بلطف وسائل الإعلام صعودا وهبوطا لخلط. وضع الخلايا في الحاضنة لمدة 3 ساعات.
- إزالة وسائل الإعلام ترنسفكأيشن وغسل كل بئر مع برنامج تلفزيوني. إضافة 1 مل من وسائل الإعلام النمو تستكمل ووضع الخلايا في الحاضنة للتعافي لمدة 30 دقيقة.
- لإعداد الخلايا للعلاج مع التحفيز الصورة، وإزالة وسائل الإعلام النمو تستكمل. إضافة 1 مل من وسائل الإعلام ترنسفكأيشن (دون الفينول الأحمر) إلى كل بئر.
ملاحظة: تأكد من أن وسائل الإعلام ترنسفكأيشن لا يحتوي على الفينول الأحمر. - معايرة وتعيين ليزر الأشعة فوق البنفسجية مع مرشح نانومتر 365 إلى كثافة 200 W / م. تأكد من أن شدة الضوء تقاس من الموقع الذي سيجلس فيه الجزء السفلي من لوحة الخلية.
- وضع الخلايا على طبق ساخن تعيين إلى 37 درجة مئوية. إزالة غطاء لوحة من الخلايا. إشعاع الخلايا من فوق لوحة للوقت المطلوب (تصل إلى 20 دقيقة) باستخدام الليزر الأشعة فوق البنفسجية مع مرشح 365 نانومتر في شدة 200 W م -2 .
- إزالة وسائل الإعلام ترنسفكأيشن وإضافة 2 مل من وسائل الإعلام النمو تستكمل. مكان في حاضنة حتى مزيد من التحليل (على سبيل المثال ، 24 ساعة ل قر و 48 ساعة للنشاف الغربية).
- قياس التغيرات في التعبير الجيني باستخدام مجموعة متنوعة من التقنيات مثل الغربية النشاف 37 و قر. 38 للجينات مع إشارات مرئية، مثل غفب، واستخدام المجهر مضان 29 .
ملاحظة: تقترح هذه التقنيات نظرا لسهولة استخدامها والدقةفي قياس التعبير الجيني
- قياس التغيرات في التعبير الجيني باستخدام مجموعة متنوعة من التقنيات مثل الغربية النشاف 37 و قر. 38 للجينات مع إشارات مرئية، مثل غفب، واستخدام المجهر مضان 29 .
6. السيطرة على إسكات الجينات في طريقة المكانية الزمانية
- الثقافة والبذور وخلايا ترانسفيكت وفقا للخطوات 5،1-5،7.
- إعداد الضوئية التي تمنع تماما 365 نانومتر الضوء ويقلل من الانعكاسات.
ملاحظة: في هذه الحالة، تم استخدام 10 × 10 سم قطعة من رقائق الألومنيوم وورق البناء الأسود لمنع الضوء وتقليل الانعكاسات، على التوالي. تم لصق رقائق الألومنيوم وورق البناء معا لتشكيل وحدة واحدة.- قطع / لكمة / آلة الشكل المطلوب في الضوئية. على سبيل المثال، استخدم شفرة حادة حادة ولكمة ثقب لتشكيل نمط خط مستقيم (~ 5 سم طويلة) ونمط دائري (~ 7 مم قطر) في الضوئية، على التوالي.
- الغراء الضوئية إلى الجزء السفلي من لوحة 6 جيدا مع نمط تتمحور تحت جيدا تحتوي على الخلايا مع الجانب المضادة للانعكاس (على سبيل المثال ، أسود جورقة البناء) التي تواجه لوحة. تأكد من عدم وضع الغراء بالقرب من الحافة (داخل ~ 3 مم) من النمط.
- إعداد اثنين من الحلقات تقف على بعد حوالي 25 سم وإرفاق منصة لكل موقف حلقة بحيث منصات متساوية الارتفاع. تعليق لوحة الخلية بين اثنين تقف من قبل يستريح لوحة على رأس المنصات. تأكد من أن لوحة هو المستوى.
- إشعاع الخلايا من تحت العينة للوقت المطلوب (تصل إلى 20 دقيقة) باستخدام الليزر الأشعة فوق البنفسجية مع مرشح 365 نانومتر في شدة 200 W / م 2 .
- إزالة وسائل الإعلام ترنسفكأيشن وإضافة 2 مل من وسائل الإعلام النمو تستكمل. مكان في حاضنة للتعافي لمدة 24 ساعة على الأقل. صورة الخلايا باستخدام المجهر مضان كما هو موضح 29 .
النتائج
بعد صياغة نانوكاريرز، تم إجراء مقايسات إطلاق سيرنا لإبلاغ ظروف التشعيع لاستخدامها في ترانسفكتيونس في المختبر . تم تطبيق جرعات مختلفة من الضوء لتحديد نسبة سيرنا التي تم إصدارها. استخدم الفحص الأول للهلام الكهربائي لفصل جزيئات سيرنا الحرة من جز...
Discussion
هناك خطوات قليلة في الطريقة التي تعتبر حاسمة بشكل خاص. عند صياغة نانوكاريرز، ترتيب إضافة عنصر وسرعة الخلط هما معلمات هامة تؤثر على فعالية 39 . يتطلب هذا البروتوكول أن المكون الموجبة، MPEG- ب -P (أبنبا)، يضاف إلى عنصر أنيوني، سيرنا، بطريقة قطرة بينما فورت?...
Disclosures
ويعلن المؤلفون أنه ليس لديهم مصالح مالية متنافسة.
Acknowledgements
يشكر المؤلفون المعهد الوطني للعلوم الطبية العامة في المعاهد الوطنية للصحة (نيه) على الدعم المالي من خلال جائزة التنمية المؤسسية (إيديا) بموجب المنحة رقم P20GM103541 وكذلك رقم المنحة P20GM10344615. ولا تعكس البيانات الواردة في هذه الوثيقة آراء المعاهد الوطنية للصحة. ونعترف أيضا بمعهد ديلاوير للتكنولوجيا الحيوية (ديبي) ومكتب التنمية الاقتصادية في ديلاوير (ديدو) للحصول على الدعم المالي من خلال جائزة مركز العلوم البيولوجية للتكنولوجيا المتقدمة (بيوسينس كات) (12A00448).
Materials
| Name | Company | Catalog Number | Comments |
| siRNA | Sigma-Aldrich | SIC001 | non-targeted, universal negative control |
| mPEG-b-P(APNBMA) | synthesized in our lab | N/A | photo-responsive polymer |
| HEPES | Fisher Scientific | BP310-100 | |
| sodium dodecyl sulfate | Sigma-Aldrich | 436143 | |
| rubber gasket | McMaster-Carr | 3788T21 | 0.5 mL thick |
| UV laser | Excelitas Technologies | Omnicure S2000 | collimating lens and 365 nm filter used |
| agarose | Fisher Scientific | BP160-100 | |
| ethidium bromide | Fisher Scientific | BP1302-10 | |
| siRNA labelled with Dy547 | GE Healthcare Dharmacon, Inc. | custom order | fluorophore conjugated to 5’ end of sense strand |
| microscope slide | Fisher Scientific | 12-550-A3 | pre-cleaned glass |
| Secure-Seal Spacer | Life Technologies | S24735 | double-sided adhesive |
| LSM 780 | Carl Zeiss | N/A | confocal microscope |
| ZEN 2010 | Carl Zeiss | N/A | FCS analysis software |
| MATLAB | MathWorks | N/A | programming language |
| NIH/3T3 cells | ATCC | ATCC CRL-1658 | |
| DMEM | Mediatech | 10-013-CV | growth media |
| fetal bovine serum | Mediatech | 35-011-CV | heat-inactivated |
| penicillin-streptomycin | Mediatech | 30-002-CI | |
| 6-well plates | Fisher Scientific | 08-772-1B | |
| Opti-MEM | Life Technologies | 11058021 | transfection media |
References
- Forbes, D. C., Peppas, N. A. Oral delivery of small RNA and DNA. J Control Release. 162 (2), 438-445 (2012).
- Davis, M. E., et al. Evidence of RNAi in humans from systemically administered siRNA via targeted nanoparticles. Nature. 464 (7291), 1067-1070 (2010).
- Bouchie, A. Companies in footrace to deliver RNAi. Nat Biotechnol. 30 (12), 1154-1157 (2012).
- Burke, P. A., Pun, S. H., Reineke, T. M. Advancing Polymeric Delivery Systems Amidst a Nucleic Acid Therapy Renaissance. ACS Macro Lett. 2 (10), 928-934 (2013).
- Gooding, M., Browne, L. P., Quinteiro, F. M., Selwood, D. L. siRNA Delivery: From Lipids to Cell-penetrating Peptides and Their Mimics. Chem Biol Drug Des. 80 (6), 787-809 (2012).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nat Chem Biol. 10 (3), 196-202 (2014).
- Wang, X., Chen, X., Yang, Y. Spatiotemporal control of gene expression by a light-switchable transgene system. Nat Methods. 9 (3), 266-269 (2012).
- Ziauddin, J., Sabatini, D. M. Microarrays of cells expressing defined cDNAs. Nature. 411 (6833), 107-110 (2001).
- Saltzman, W. M., Olbricht, W. L. Building drug delivery into tissue engineering. Nat Rev Drug Discov. 1 (3), 177-186 (2002).
- Mura, S., Nicolas, J., Couvreur, P. Stimuli-responsive nanocarriers for drug delivery. Nat Mater. 12 (11), 991-1003 (2013).
- Shim, M. S., Kwon, Y. J. Stimuli-responsive polymers and nanomaterials for gene delivery and imaging applications. Adv Drug Delivery Rev. 64 (11), 1046-1058 (2012).
- Kelley, E. G., Albert, J. N. L., Sullivan, M. O., Epps, T. H. Stimuli-responsive copolymer solution and surface assemblies for biomedical applications. Chem Soc Rev. 42 (17), 7057-7071 (2013).
- Weber, W., Fussenegger, M. Emerging biomedical applications of synthetic biology. Nat Rev Genet. 13 (1), 21-35 (2012).
- Konermann, S., et al. Optical control of mammalian endogenous transcription and epigenetic states. Nature. 500 (7463), 472-476 (2013).
- Shimizu-Sato, S., Huq, E., Tepperman, J. M., Quail, P. H. A light-switchable gene promoter system. Nat Biotechnol. 20 (10), 1041-1044 (2002).
- Huschka, R., et al. Gene Silencing by Gold Nanoshell-Mediated Delivery and Laser-Triggered Release of Antisense Oligonucleotide and siRNA. ACS Nano. 6 (9), 7681-7691 (2012).
- Li, H. -. J., Wang, H. -. X., Sun, C. -. Y., Du, J. -. Z., Wang, J. Shell-detachable nanoparticles based on a light-responsive amphiphile for enhanced siRNA delivery. R Soc Chem Adv. 4 (4), 1961-1964 (2014).
- Braun, G. B., et al. Laser-Activated Gene Silencing via Gold Nanoshell-siRNA Conjugates. ACS Nano. 3 (7), 2007-2015 (2009).
- Gilleron, J., et al. Image-based analysis of lipid nanoparticle-mediated siRNA delivery, intracellular trafficking and endosomal escape. Nat Biotechnol. 31 (7), 638-646 (2013).
- Wittrup, A., et al. Visualizing lipid-formulated siRNA release from endosomes and target gene knockdown. Nat Biotechnol. 33 (8), 870-876 (2015).
- Roth, C. M. Quantitative measurements and rational materials design for intracellular delivery of oligonucleotides. Biotechnol Prog. 24 (1), 23-28 (2008).
- Mao, S., et al. Influence of polyethylene glycol chain length on the physicochemical and biological properties of poly(ethylene imine)-graft-poly(ethylene glycol) block copolymer/SiRNA polyplexes. Bioconjugate Chem. 17 (5), 1209-1218 (2006).
- Raab, R. M., Stephanopoulos, G. Dynamics of gene silencing by RNA interference. Biotechnol Bioeng. 88 (1), 121-132 (2004).
- Cuccato, G., et al. Modeling RNA interference in mammalian cells. BMC Systems Biology. 5, 1 (2011).
- Varga, C. M., Hong, K., Lauffenburger, D. A. Quantitative analysis of synthetic gene delivery vector design properties. Mol Ther. 4 (5), 438-446 (2001).
- Chen, H. H., et al. Quantitative comparison of intracellular unpacking kinetics of polyplexes by a model constructed from quantum Dot-FRET. Mol Ther. 16 (2), 324-332 (2008).
- Bartlett, D. W., Davis, M. E. Insights into the kinetics of siRNA-mediated gene silencing from live-cell and live-animal bioluminescent imaging. Nucleic Acids Res. 34 (1), 322-333 (2006).
- Foster, A. A., Greco, C. T., Green, M. D., Epps, T. H., Sullivan, M. O. Light-Mediated Activation of siRNA Release in Diblock Copolymer Assemblies for Controlled Gene Silencing. Adv Healthc Mater. 4 (5), 760-770 (2015).
- Greco, C. T., Epps, T. H., Sullivan, M. O. Mechanistic Design of Polymer Nanocarriers to Spatiotemporally Control Gene Silencing. ACS Biomater Sci Eng. 2 (9), 1582-1594 (2016).
- Green, M. D., et al. Catch and release: photocleavable cationic diblock copolymers as a potential platform for nucleic acid delivery. Polym Chem. 5 (19), 5535-5541 (2014).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose Gel Electrophoresis for the Separation of DNA Fragments. J Vis Exp. (62), e3923 (2012).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Marquer, C., Leveque-Fort, S., Potier, M. C. Determination of Lipid Raft Partitioning of Fluorescently-tagged Probes in Living Cells by Fluorescence Correlation Spectroscopy (FCS). J Vis Exp. (62), (2012).
- Staaf, E., Bagawath-Singh, S., Johansson, S. Molecular Diffusion in Plasma Membranes of Primary Lymphocytes Measured by Fluorescence Correlation Spectroscopy. J Vis Exp. (120), e54756 (2017).
- Buyens, K., et al. Monitoring the disassembly of siRNA polyplexes in serum is crucial for predicting their biological efficacy. J Control Release. 141 (1), 38-41 (2010).
- Eden, E., et al. Proteome Half-Life Dynamics in Living Human Cells. Science. 331 (6018), 764-768 (2011).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad. Sci U S A. 76 (9), 4350-4354 (1979).
- Wittwer, C. T., Herrmann, M. G., Moss, A. A., Rasmussen, R. P. Continuous Fluorescence Monitoring of Rapid Cycle DNA Amplification. Biotechniques. 54 (6), 314-320 (2013).
- Cho, S. K., Dang, C., Wang, X., Ragan, R., Kwon, Y. J. Mixing-sequence-dependent nucleic acid complexation and gene transfer efficiency by polyethylenimine. Biomater Sci. 3 (7), 1124-1133 (2015).
- Liu, Y. M., Reineke, T. M. Poly(glycoamidoamine)s for gene delivery: Stability of polyplexes and efficacy with cardiomyoblast cells. Bioconjugate Chem. 17 (1), 101-108 (2006).
- Schwanhausser, B., et al. Global quantification of mammalian gene expression control. Nature. 473 (7347), 337-342 (2011).
- Greco, C. T., Muir, V. G., Epps, T. H., Sullivan, M. O. Efficient tuning of siRNA dose response by combining mixed polymer nanocarriers with simple kinetic modeling. Acta Biomater. 50, 407-416 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved