A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخراج عينة والمتزامن كوانتيتيشن الكروماتوغرافي ميتوتريكسات وج ميتوميسين عقب تسليم تركيبة المخدرات في جسيمات نانوية للفئران الحاملة للورم
In This Article
Summary
ويصف هذا البروتوكول عملية تحليلية فعالة ومريحة لاستخراج عينة والتصميم المتزامن لأدوية متعددة، ميتوتريكسات (دوكس)، ميتوميسين ج (MMC) والمستقلب دوكس سامة القلب، دوكسوروبيسينول (DOXol)، في البيولوجية عينات من طراز ورم الثدي السريري التعامل مع الصياغات نانوحبيبات من تركيبة المخدرات التآزري.
Abstract
الجمع بين العلاج الكيميائي يستخدم بشكل متكرر في العيادة لعلاج السرطان؛ ومع ذلك، قد تحد من الآثار الضارة المرتبطة بأنسجة طبيعية لها فائدة علاجية. لقد ثبت تركيبة على أساس نانوحبيبات المخدرات للتخفيف من حدة المشاكل التي تواجهها في الجمع بين العلاج بالعقاقير مجاناً. دراساتنا السابقة قد أظهرت أن المزيج من اثنين من العقاقير السرطان، ميتوتريكسات (دوكس) و mitomycin C (MMC)، وأنتج تأثير تآزري ضد كلا الفاري وخلايا سرطان الثدي البشرية في المختبر. تجاوز دوكس و MMC دهن البوليمر المشترك تحميل الهجين جسيمات نانوية (دمبلن) efflux مختلف الناقل المضخات التي تضفي مقاومة عصيات وأظهرت فعالية معززة في نماذج ورم الثدي. بالمقارنة مع أشكال الحلول التقليدية، مثل كفاءة متفوقة دمبلن يعزى إلى الدوائية متزامنة دوكس و MMC والمخدرات داخل الخلايا زيادة التوافر البيولوجي داخل الخلايا السرطانية التي مكنت من nanocarrier زلوتي.
تقييم الدوائية والبيولوجية-توزيع المشترك التي تديرها دوكس و MMC في حل الحرة وأشكال نانوحبيبات، طريقة بسيطة وفعالة لتحليل المخدرات متعددة باستخدام عكس المرحلة عالية الأداء اللوني السائل ([هبلك]) كان البلدان المتقدمة النمو. خلافا لأساليب سبق الإبلاغ عنها تحليل دوكس أو MMC منفردة في البلازما، هذا الأسلوب [هبلك] جديدة قادرة على كوانتيتاتي في نفس الوقت دوكس، MMC والمستقلب رئيسي دوكس سامة القلب، دوكسوروبيسينول (DOXol)، في مصفوفات البيولوجية المختلفة ( مثلاً، الدم كله وورم الثدي والقلب). مزدوج مسبار ماصة الفلورسنت والأشعة فوق البنفسجية. 4-ميثيلومبيليفيروني (4-مو) استخدمت كمعيار داخلي (هو) للكشف عن خطوة واحدة لتحليل المخدرات متعددة مع الكشف عن مختلف الأطوال الموجية. تم بنجاح تطبيق هذا الأسلوب لتحديد تركيزات دوكس و MMC ألقاها النهج نانوحبيبات والحل في كل الدم والأنسجة المختلفة في نموذج مورين ورم الثدي أورثوتوبيك. الطريقة التحليلية المقدمة أداة مفيدة لتحليل ما قبل السريرية للتسليم على أساس نانوحبيبات تركيبات العقاقير.
Introduction
العلاج الكيميائي طريقة معالجة الأولية للعديد من أنواع السرطان ومع ذلك فإنه كثيرا ما يرتبط مع آثار سلبية شديدة وفعالية محدودة بسبب مقاومة المخدرات وسائر العوامل1،2،3. لتحسين نتائج العلاج الكيميائي، طبقت نظم الجمع بين المخدرات في عيادة استناداً إلى اعتبارات مثل السمية غير متداخلة، آليات مختلفة لعمل المخدرات، والمخدرات غير عبر المقاومة4،5 , 6-في التجارب السريرية، ولوحظ معدل استجابة ورم أفضل كثيرا ما تستخدم في نفس الوقت تدار تركيبات المخدرات مقارنة بنظام متسلسل المخدرات تسليم7،8. ومع ذلك، سبب دون المستوى الأمثل بيو-توزيع أشكال الأدوية المجانية، حقن المخدرات متعددة متزامنة يمكن يسبب سمية أنسجة طبيعية بارزة تفوق ال10،9،التأثير العلاجي11. لقد ثبت إيصال الأدوية على أساس Nanocarrier تغيير الدوائية والبيولوجية-توزيع المخدرات مغلفة، تعزيز تراكم تستهدف استئصال ورم12،،من1314. كما استعرض في مقالاتنا الأخيرة، جسيمات نانوية شارك محملة بالمخدرات التآزري تركيبات أظهرت القدرة على التخفيف من حدة المشاكل التي تواجهها مجموعات الأدوية المجانية، وسبب إيصالها المشارك الزمنية والمكانية التي تسيطر عليها من الحصول على أدوية متعددة لانسجة الورم، مما آثار المخدرات التآزر ضد سرطان الخلايا4،،من1516. كنتيجة لذلك، ثبتت الفعالية العلاجية متفوقة وسمية منخفضة في كل الدراسات ما قبل السريرية والسريرية4،،من1718.
لدينا في المختبر الدراسات السابقة تبين أن الجمع بين اثنين من المخدرات السرطان، ميتوتريكسات (دوكس) و mitomycin C (MMC)، أنتجت أثر تآزري ضد العديد من خطوط الخلايا في سرطان الثدي، وعلاوة على ذلك، شارك تحميل دوكس و MMC ضمن جسيمات نانوية المختلطة الدهنية البوليمر (دمبلن) تغلب على مختلف افلوكس المقاومة للأدوية المتعددة المرتبطة بها مضخات (مثلاً، فبروتين سكري والبروتين مقاومة سرطان الثدي)،19،20،21. في فيفو، مكن دمبلن المكانية الزمانية تسليم المشارك دوكس و MMC لمواقع الورم وزيادة التوافر البيولوجي للمخدرات داخل الخلايا السرطانية، كما يتبين من الاعتدال لتشكيل دوكسوروبيسينول (DOXol) المستقلب دوكس22. نتيجة لذلك دمبلن المحسن ورم الخلايا المبرمج وتثبيط نمو الورم، وبقاء المضيف طويلة مجاناً تركيبة دوكس و MMC أو الاسمافرون دوكس صياغة22،،من2324، بالمقارنة 25.
تحليل المقدار الفعلي للمخدرات شارك ألقاه nanocarrier حاسمة بالنسبة لتصميم تركيبات نانوحبيبات فعالة. وقد وضعت العديد من الأساليب لتحليل مستوى البلازما واحد جرعات دوكس أو MMC باستخدام عالية الأداء اللوني السائل ([هبلك]) وحدها أو في تركيبة مع الطيف الكتلي (MS)26،،من2728 , 29 , 30 , 31 , 32 , 33 , 34-ومع ذلك، هذه الأساليب غالباً ما تكون مضيعة للوقت وغير عملي للجمع بين العلاج كما تحتاج إلى عدد كبير من العينات البيولوجية التي سيتم إعدادها بشكل منفصل لتحليل المخدرات متعددة (بما في ذلك في بعض الأحيان والايضات المخدرات). بالإضافة إلى ربط بروتين البلازما قوي دوكس و MMC، خلايا الدم الحمراء أيضا لديها قدرة كبيرة على ربط وتركز كثير من الأدوية السرطان35،36. وهكذا، قد يحجب تحليل البلازما دوكس أو MMC تركيزات المخدرات الدم الفعلية. العمل الحالي (الشكل 1) يصف بسيطة وقوية متعددة أسلوب تحليل المخدرات باستخدام عكس المرحلة [هبلك] لاستخراج في وقت واحد وكوانتيتاتي دوكس، MMC ودوكسوروبيسينول المستقلب دوكس (DOXol) من كل الدم والأنسجة المختلفة ( مثلاً، الأورام). تم تطبيقه بنجاح لتحديد الدوائية والبيولوجية-توزيع دوكس و MMC وكذلك تشكيل DOXol بعد تسليم المخدرات عن طريق الحلول الحرة أو أشكال نانوحبيبات (أي، دمبلن ودوكس الاسمافرون) في أورثوتوبيكالي مزروع ورم الثدي مورين الماوس نموذج بعد في الوريد (رابعا) حقن22.
Protocol
ووافقت "الحيوانات رعاية اللجنة لجامعة الشبكة الصحية" في معهد السرطان أونتاريو جميع التجارب على الحيوانات ثم تجري وفقا "المجلس الكندي للمبادئ التوجيهية لرعاية الحيوان"-
1-"إعداد العينات البيولوجية"
- جمع الدم كله، الأجهزة الرئيسية، والثدي ورم في نقاط زمنية محددة سلفا بعد الإدارة في الوريد (رابعا) التي تحتوي على المخدرات تركيبات (مثلاً، دمبلن، دوكس الاسمافرون)
- حقن رابعا ماوس الحاملة لورم الثدي بصيغة معدّة التي تحتوي على المخدرات-
- تخدير الماوس في نقاط زمنية معينة (مثلاً، 15 دقيقة) بإعطاء هنالك 2% إيسوفلوراني في غرفة مغلقة.
- وضع الماوس أنيسثيتيزيد على ظهرها وتضع انفها من خلال نوسيبيسي أن استمرار الإمدادات isoflurane 2%-
ملاحظة: لضمان الماوس يخضع للتخدير العميق، بلطف قرصه أطرافه الصدارة من الماوس وابحث عن أي حركة الوخز. - دقة تنظيف منطقتي الصدر والبطن استخدام الإيثانول 70% ثم قم بتنفيذ إجراء المحطة طرفية من ثقب القلب في الفئران أنيسثيتيزيد العميقة باستخدام حقنه هيبارينيزيد 1 مل وابرة ز 23- الهيبارين
- جمع الدم كله إلى صوديوم مسمى رش أنبوب بلاستيكي ودوامه على أنبوب لضمان جمع كل الدم يأتي في اتصال مع الهيبارين المغلفة جدار الأنبوبة برفق. جمع الحد أدنى من 50 ميليلتر من الدم كله. تبقى دائماً العينات على مدت
- الشريط جميع أطرافه الأربعة من الماوس لتأمينه وفتح تجويف البطن والقفص الصدري من الماوس باستخدام زوج من مقص وملقط. تحويل الأمعاء إلى الجانب ودفع الكبد التصاعدي فضح الوريد البابي بما فيه الكفاية. قطع الوريد البابي لتصريف الدم.
- نتخلل الجسم كله الماوس مع 50 مل من المثلج ملحي 0.9% من خلال قلب استخدام حقنه 10 مل بإبرة ز 25-
ملاحظة: ثني الإبرة على 90 درجة لتوجيه الحقن في الوريد البابي-
ترتيب - أجهزة الجمارك في ما يلي: القلب، الرئة، والكبد، والطحال، والكليتين. ثم فصل الورم الثدي من الأنسجة الضامة المحيطة باستخدام مقص شق في لوحة الدهون اليمين الثديية الماوس. جمع جميع أجهزة منفردة إلى 1.5 مل أنابيب البولي بروبيلين وتجميدها بسرعة في نيتروجين سائل.
ملاحظة: فصل المرارة عن الكبد. - تخزين الدم كله في 4 درجات مئوية وقصت الأنسجة في الثلاجة-80 درجة مئوية حتى وقت لاحق [هبلك] التحليل.
- استخراج دوكس، MMC و DOXol من مصفوفات البيولوجية.
- تزن كل الأنسجة تشريح المجمدة بسرعة وتحويلها إلى أنبوب مخروطي 13 مل تقريبه لأسفل. لتجنب المخدرات ممكن الأيض أو التدهور، تبقى العينات على مدت إضافة
- 1-5 مل من المخزن المؤقت لتحلل الخلية المثلج في الأنبوب.
ملاحظة: حجم المخزن المؤقت استخدام يعتمد على وزن الأنسجة استناداً إلى نسبة الأنسجة العازلة ز 1: 5 مل (w/v)؛ أجهزة صغيرة، مثل القلب والطحال، هو النسبة زاي: 1 مل 2-
استخدام - حركة من أعلى إلى أسفل المخ لمجانسة عينات الأنسجة على الجليد بسرعة 18,000 لفة في الدقيقة باستخدام يد كهربائية الخالطون.
ملاحظة: تتطلب التجانس المنجزة حوالي 3 إلى 5 تكرارات من عملية التذويب قصيرة لأقل من 15 ثانية، تليها الأنسجة التبريد فوق الجليد بين كل تجانس قصيرة. - يغسل الأسنان شهد 10 ملم التحقيق مولد الخالطون مع مقطر منزوع (DDI) ح 2 س، الإيثانول 70%، ومن ثم DDI ح 2 س بين كل عينة الأنسجة لتجنب التلوث عبر.
- نقل 50 ميليلتر من هوموجيناتي الأنسجة أو الدم كله إلى 1.5 مل البوليبروبيلين أنبوب مايكرو--أجهزة الطرد المركزي وارتفاع مع 5 ميليلتر من الداخلية القياسية (هو) 4-ميثيلومبيليفيروني (4-مو) (2000 نانوغرام/مل) في الأنبوب.
ملاحظة: أعد حل 4-مو في الميثانول هنا. - إضافة 250 ميليلتر من مذيب استخراج المثلج في أنبوب يحتوي على كل الدم أو الأنسجة هوموجيناتي.
ملاحظة: استخراج المذيبات يتكون من 60% الاسيتو الانيتريل (ACN) وخلات الأمونيوم 40% (5 مم) مع تعديل درجة الحموضة pH = 3.5 باستخدام حمض الفورميك 0.05%. استخدام نموذج (v/v) 1:5: استخراج المذيبات لنسبة الحجم. - بقوة دوامة الخليط لمدة 2 دقيقة، أجهزة الطرد المركزي في 3000 × ز النفاذ في 4 س ج 10 دقيقة وبيبيت 200 ميليلتر طافية في أنبوب مايكرو--أجهزة الطرد المركزي الطازجة مبردة قبل آخر.
- Evaporate المادة طافية في 60 درجة مئوية تحت تيار بطيء من غاز النيتروجين مع الحماية من الضوء.
- إعادة تشكيل بقايا المجففة مع 100 ميليلتر من المثلج الميثانول، شدة دوامة 30 ثانية وأجهزة الطرد المركزي في ز x 3000 عند 4 درجة مئوية لآخر دقيقة 5
- نقل المادة طافية في إدراج قنينة [هبلك] ووضع قنينات العينات في علبة أوتوسامبلير لحقن.
2. [هبلك] القياس ومعلمات العملية
- [هبلك] إعداد المرحلة المحمول مع إمكانية تكرار نتائج متسقة
- قياس 500 مل ح [هبلك]-الصف 2 س باستخدام اسطوانة تخرج.
- قياس 500 مل من الصف [هبلك] الاسيتو الانيتريل (ACN) باستخدام اسطوانة تخرج منفصلة.
- بعناية إضافة 0.5 مل حامض trifluoroacetic (تفا) (تنبيه) إلى كل من 500 مل ح 2 س وتزاول للحصول على المرحلة المتنقلة من ح 2 س وتزاول يحتوي على 0.1% تفا، على التوالي.
ملاحظة: تفا هو التآكل والسامة وينبغي التعامل معها تحت غطاء دخان مختبر. وتعد جميع المخاليط المذيبات في درجة حرارة الغرفة- - مراحل التصفية المتنقلة من خلال عامل تصفية غشاء نايلون مع 0.45 ميكرومتر المسامية الحجم وتحويلها إلى [هبلك] تنظيف الخزان زجاجات.
- [هبلك] إنشاء الأجهزة للكشف المتزامن دوكس، MMC، و DOXol، وهو 4-مو-
- التبديل على مضخة التدرج وغاسر دي، السيارات-أخذ العينات، والكاشف الضوئي الصفيف، والكاشف ومضان λ متعددة.
- إدخال الشروط الأولية لتشكيل المرحلة المحمول إلى 16.5 ٪ ح 2 س (0.1% تفا) و 83.5% تزاول (0.1% تفا) (v/v)-
- تعيين كشف الأشعة فوق البنفسجية على قناتين، واحدة في 310 نيوتن متر ل 4-مو (هو) والآخر في 360 nm ل MMC.
- تعيين الكاشف ومضان على قناتين، واحدة في λ السابقين/λ م = 365/445 نيوتن متر مو 4 والآخر في λ السابقين/λ م = 480 نيوتن متر/560 نانومتر دوكس و DOXol، على التوالي.
- تعيين معدل تدفق isocratic 1.0 مل/دقيقة
- حجته مرحلة عكس مسبقاً ج 18 عمود (4.6 ملم × 250 ملم، 5 ميكرومتر) في درجة حرارة الغرفة لمدة 10 دقائق لإنشاء خط الأساس-
- فصل المخدرات (دوكس، MMC، DOXol و 4-مو) استخدام التدرج المحمول--المرحلة الشرط.
- حقن 15 ميليلتر من العينات المستخرجة وإعادة تركيز التلقائي-أخذ العينات باستخدام- تغيير
- تدريجيا شرط المحمول--المرحلة الأولى (راجع خطوة بروتوكول 2.2.2) إلى 100% تزاول (0.1% تفا) ما يزيد على 18 دقيقة باستخدام مضخة التدرج الآلي.
ملاحظة: أثناء عملية الانفصال، وأربع قنوات (ماصة الأشعة فوق البنفسجية اثنين واثنين فلوري) تظهر في وقت واحد مع كل قناة عرض المخدرات واحد مركب (راجع خطوة بروتوكول 2.2.3 و 2.2.4). - الحفاظ على 100 ٪ تزاول (0.1% تفا) 1 دقيقة وثم العودة إلى حالة المرحلة الأولية المتنقلة ضمن الحد الأدنى 1
- شرط إعادة العمود مع المرحلة المتنقلة الأولى في معدل تدفق 1.5 مل/دقيقة لدقيقة 4 لحقن العينة التالي-
3. [هبلك] التحقق من صحة
- بإعداد معايير العمل دوكس، MMC و DOXol 4-مو (هو)-
- وزنها بشكل منفصل من 1 ملغ مسحوق المخدرات دوكس و MMC (تحذير) و 4-مو على جديدة صغيرة وزنها الورقة (2 من 3 × 3 بوصة)-
ملاحظة جميع الأدوية السرطان تعتبر خطرا على صحة التي يمكن أن تسبب موتجنيستي الخلية الجرثومية والسمية الحادة على الاستنشاق أو الابتلاع. أنها يجب أن تعالج بعناية القفازات والأقنعة. - نقل موزون دوكس، MMC و 4-مو في أنبوب فردية 1.5 مل البوليبروبيلين مايكرو--أجهزة الطرد مركزي جديدة.
- إضافة 1 مل المنهجياتanol ودوامه بإيجاز للحصول على تركيز 1 ملغ/مل من MMC ودوكس.
- إضافة 1 مل ميثانول في قنينة تحتوي على وزنه قبل 1 ملغ DOXol (تنبيه) ودوامه بإيجاز للحصول على تركيز 1 ملغ/مل من DOXol.
ملاحظة: DOXol المستقلب القلب سامة وينبغي التعامل معها بعناية. - ماصة 20 ميليلتر الحلول الأسهم استعداد دوكس، MMC، DOXol و 4-مو إلى جديد فصل أنبوب مايكرو--أجهزة الطرد المركزي البوليبروبيلين 1.5 مل وإضافة 980 ميليلتر من الميثانول للحصول على معيار عامل 20 ميكروغرام/مل من كل المخدرات-
- تمييع 20 ميكروغرام/مل دوكس، MMC و DOXol باستخدام الميثانول للحصول على معايير العمل 50 نانوغرام-20 ميكروغرام/mL دوكس MMC و DOXol و 2000 نانوغرام/مليلتر بالنسبة دربهم 4-مو-
- ختم غطاء أنبوب الحلول العامل مع قطعة ضيقة من البارافين الفيلم تغطية لمنع تبخر الميثانول، التفاف الأنبوب كامل مع رقائق الألومنيوم لتجنب التعرض للضوء المباشر ومخزن في-20 درجة مئوية.
- وزنها بشكل منفصل من 1 ملغ مسحوق المخدرات دوكس و MMC (تحذير) و 4-مو على جديدة صغيرة وزنها الورقة (2 من 3 × 3 بوصة)-
- تحديد الخطي، والدقة، ودقة دوكس، MMC و DOXol في مصفوفات البيولوجية (أي كل الدم وورم هوموجيناتي)-
- في نفس الوقت سبايك 5 ميليلتر من معايير العمل دوكس و DOXol (50 نانوغرام/ملليلتر-20 ميكروغرام/مل)، MMC (1,000 نانوغرام/ملليلتر-16 ميكروغرام/مل)، و 4-مو (2 ميكروغرام/مل) إلى 50 ميليلتر من الدم كله فارغ أو الأنسجة هوموجيناتي في أنابيب صغيرة-أجهزة الطرد المركزي البوليبروبيلين ل الحصول على منحنى تركيز قياسية تتراوح بين 5-2000 نانوغرام/ملليلتر لمركبات المخدرات و 200 نانوغرام/مليلتر بالنسبة 4-مو (هو)-
- إجراء المقايسة استخراج المخدرات المبينة في البروتوكول 1.2.
- استخدام تركيزات منخفضة ومتوسطة وعالية دوكس و DOXol (50 و 500 و 2,000 نانوغرام/ملليلتر) و MMC (100، 1000، 2,000 نانوغرام/مليلتر) الدقة داخل وبين اليوم والدقة.
ملاحظة: تعد تركيزات قياسية جديدة اليوم للتحليل-
- تحليل العينات
- ميليلتر 15 حقن العينة باستخدام السيارات-أخذ العينات-
- تغير تدريجيا في مرحلة المتنقلة أكثر 0 إلى 18 دقيقة، بزيادة تكوين تزاول عبر الفاصل.
- بعد 18 دقيقة، عقد المرحلة المحمول شرط الحد الأدنى 1
- العودة إلى الحالة الأولية خلال 2 دقيقة المقبلة، ثم إعادة توازن لمدة 4 دقيقة قبل الحقن المقبل.
- بعد كل عينة تشغيل، ملاحظة أن تظهر قمم مركبات المخدرات مع الوقت الاحتفاظ بهم كما يلي: MMC، DOXol، 4-مو (هو) ودوكس.
- إدماج منطقة الذروة تحت المنحنى (AUC) مركبات المخدرات باستخدام البرمجيات [هبلك]-
- حساب نسبة أوك بين فرادى المخدرات المركبة ودربهم (المعادلة 1) واستخدام المنحنيات القياسية المعدة تحت نفس إجراءات استخراج لتحديد تركيزات المخدرات دوكس، MMC و DOXol في صياغة دمبلن.
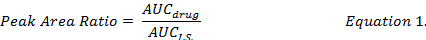
- لحساب النسبة المئوية الانتعاش المخدرات (المعادلة 2) عن طريق مقارنة التركيزات المخدرات التي أعيد تشكيلها باستخدام الميثانول من مقتطفات العينات البيولوجية ارتفعت إلى أن المعيار (" أنيق ") المخدرات الحل في الميثانول.
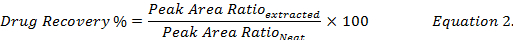
النتائج
تم الكشف عن المخدرات السرطان اثنين، دوكس و MMC، فضلا عن المستقلب دوكس، DOXol، في نفس الوقت دون أي تدخل البيولوجية بالشرط [هبلك] التدرج تطبق نفس استخدام 4-مو دربهم للأسفار وكاشفات الأشعة فوق البنفسجية على السواء. دوكس، MMC، DOXol و 4-مو كان جيدا المنفصلة عن بعضها البعض مع الاحتفاظ ب?...
Discussion
مقارنة مع أخرى طرق الكروماتوغرافي التي تمكن من الكشف عن نوع واحد من المخدرات في وقت واحد، هذا البروتوكول [هبلك] قادرة على كوانتيتاتي في وقت واحد ثلاثة مجمعات المخدرات (دوكس و MMC و DOXol) في المصفوفة البيولوجية نفسها دون الحاجة إلى تغيير مرحلة الجوال. هذا أسلوب إعداد وتحليل قد طبقت بنجاح لتحديد...
Disclosures
الكتاب قد لا يوجد تضارب المصالح المالية وتضارب المصالح.
Acknowledgements
الكتاب الاعتراف بامتنان منحة معدات من العلوم الطبيعية والبحوث الهندسية (مقدمة) المجلس من كندا [هبلك]، منحة تشغيلية من المعهد الكندي للبحوث الصحية (استوفوا) وأبحاث سرطان الثدي الكندية (كبكر) التحالف إلى وو X.Y.، ومنحة جامعة تورنتو إلى تشانغ R.X. وت. تشانغ.
Materials
| Name | Company | Catalog Number | Comments |
| Doxorubicin | Polymed Theraeutics | 111023 | Anticancer drug |
| Mitomycin C | Polymed Theraeutics | 060814 | Anticancer drug |
| Doxorubicinol (DOXol) | Toronto Research Chemicals | D558020 | Metabolite of DOX |
| 4-Methylumbelliferone sodium salt | Sigma-Aldrich | M1508 | Internal standard |
| Myristic Acid | Sigma-Aldrich | 544-63-8 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (100) Stearate | Spectrum | M1402 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (40) Stearate | Sigma-Aldrich | P3440 | Materials for poly-lipid hybrid nanoparticles |
| Pluronic F68 (PF68) | BASF Corp. | 9003-11-6 | Materials for poly-lipid hybrid nanoparticles |
| Ultrasonication (UP100H) | Hielscher, Ultrasound Technology | NA | Nanoparticle preparation |
| Water Bath (ISOTEMP 3016HS) | Fisher Scientific | NA | Nanoparticle preparation |
| Liposomal Doxorubicin (Caelyx) | Janssen | Purchased from the pharmacy Princess Margaret Hospital | Clinically-approved nanoparticle formulation |
| HPLC-graded Methanol | Caledon Chemicals | 6701-7-40 | HPLC mobile phase composition |
| HPLC-graded H2O | Caledon Chemicals | 8801-7-40 | HPLC mobile phase composition |
| HPLC-graded Acetonitrile | Caledon Chemicals | 1401-7-40 | HPLC mobile phase composition |
| Trifluoroacetic Acid | Sigma-Aldrich | 302031 | HPLC mobile phase composition |
| 0.45 μm Nylon Membrane Filter Paper | Whatman | WHA7404004 | HPLC mobile phase preparation |
| 1cc Plastic Syringes | Becton, Dickinson and Company | 2606-309659 | Treatment injection |
| 5cc Plastic Syringes | Becton, Dickinson and Company | 2608-309646 | Tissue collections |
| 30G 1/2 Needles | Becton, Dickinson and Company | 305106 | Treatment injection |
| 25G 5/8 Needles | Becton, Dickinson and Company | 305122 | Tissue collections |
| Sterile 0.9% Saline | Univeristy of Toronto House Brand | 1011 | Tissue perfusion |
| 13 ml Rounded-bottom conical tube | SARSTEDT | 62.515.006 | Prolyprolene, tissue homogenization |
| Alpha Minimum Essential Medium (MEM) | Gibco | 12571063 | Cell medium |
| 1 x Phosphate Buffer Saline | Gibco | 10010023 | Tissue homogenization |
| Triton X-100 | Sigma-Aldrich | X100-100 ML | Tissue homogenization |
| Formic acid | Caledon Chemicals | 1/5/3840 | Adjust pH for extraction solvent |
| Sodium heparin sprayed plastic tubes | Becton, Dickinson and Company | 367878 | Blood collection |
| Analytical Weigh Balance | Sartorius | CPA225D | NA |
| pH meters | Fisher Scientific | 13-637-671 | accumet BASIC |
| Vortex Mixter | Fisher Scientific | 02-215-365 | Vortexing samples at desired speed |
| 1.5 ml Microcentrifuge Tube | Fisherbrand | 2043-05408129 | Prolyprolene |
| Model 1000 homogenizer | Fisher Scientific | 08-451-672 | Tissue homogenization |
| Centrifuge 5702R | Eppendorf | 5702R | Extraction preparation |
| Heated Evaporator System | Glas-Col | NA | Sample reconstitution |
| HPLC Screw Thread Vials | DIKMA | 5320 | HPLC sample injection |
| HPLC Screw Caps with PTFE White Silicone Septa | DIKMA | 5325 | HPLC sample injection |
| HPLC Polypropylene Insert | Agilent Technologies | 5182-0549 | Maximum volume 250 μl, HPLC sample injection |
| Xbridge C18 Column | Waters Corporation | 186003117 | Drug analysis |
| Gradient pump | Waters Corporation | W600 | Drug analysis |
| Auto-sampler | Waters Corporation | W2707 | Drug analysis |
| Photodiode array detector | Waters Corporation | W2998 | Drug analysis |
| Multi λ fluoresence detector | Waters Corporation | W2475 | Drug analysis |
| EMPOWER 2 | Waters Corporation | NA | Data analysis software |
| Scientist | Micromath | NA | Pharmacokinetic analysis |
| Female Balb/c Mice | Jackson Laboratory | 001026 | In vivo |
| EMT6/WT Breast Cancer Cells | Provided by Dr. Ian Tannock; Ontario Cancer Institute | NA | In vivo |
References
- Holohan, C., Van Schaeybroeck, S., Longley, D. B., Johnston, P. G. Cancer Drug Resistance: An Evolving Paradigm. Nat. Rev. Cancer. 13 (10), 714-726 (2013).
- Szakacs, G., Paterson, J. K., Ludwig, J. A., Booth-Genthe, C., Gottesman, M. M. Targeting Multidrug Resistance in Cancer. Nat Rev Drug Discov. 5 (3), 219-234 (2006).
- Kong, A. -. N. T., Kong, A. .. N. .. T. .. ,. . Inflammation, Oxidative Stress, and Cancer: Dietary Approaches for Cancer Prevention. , (2013).
- Zhang, R. X., Wong, H. L., Xue, H. Y., Eoh, J. Y., Wu, X. Y. Nanomedicine of Synergistic Drug Combinations for Cancer Therapy - Strategies and Perspectives. J Control Release. 240, 489-503 (2016).
- Webster, R. M. Combination Therapies in Oncology. Nat. Rev. Drug. Discov. 15 (2), 81-82 (2016).
- Waterhouse, D. N., Gelmon, K. A., Klasa, R., Chi, K., Huntsman, D., Ramsay, E., Wasan, E., Edwards, L., Tucker, C., Zastre, J., Wang, Y. Z., Yapp, D., Dragowska, W., Dunn, S., Dedhar, S., Bally, M. B. Development and Assessment of Conventional and Targeted Drug Combinations for Use in the Treatment of Aggressive Breast Cancers. Curr Cancer Drug Targets. 6 (6), 455-489 (2006).
- Cancello, G., Bagnardi, V., Sangalli, C., Montagna, E., Dellapasqua, S., Sporchia, A., Iorfida, M., Viale, G., Barberis, M., Veronesi, P., Luini, A., Intra, M., Goldhirsch, A., Colleoni, M. Phase Ii Study with Epirubicin, Cisplatin, and Infusional Fluorouracil Followed by Weekly Paclitaxel with Metronomic Cyclophosphamide as a Preoperative Treatment of Triple-Negative Breast Cancer. Clin Breast Cancer. 15 (4), 259-265 (2015).
- Masuda, N., Higaki, K., Takano, T., Matsunami, N., Morimoto, T., Ohtani, S., Mizutani, M., Miyamoto, T., Kuroi, K., Ohno, S., Morita, S., Toi, M. A Phase Ii Study of Metronomic Paclitaxel/Cyclophosphamide/Capecitabine Followed by 5-Fluorouracil/Epirubicin/Cyclophosphamide as Preoperative Chemotherapy for Triple-Negative or Low Hormone Receptor Expressing/Her2-Negative Primary Breast Cancer. Cancer Chemother Pharmacol. 74 (2), 229-238 (2014).
- Carrick, S., Parker, S., Thornton, C. E., Ghersi, D., Simes, J., Wilcken, N. Single Agent Versus Combination Chemotherapy for Metastatic Breast Cancer. Cochrane Database Syst Rev. 15 (2), 003372 (2009).
- Cardoso, F., Bedard, P. L., Winer, E. P., Pagani, O., Senkus-Konefka, E., Fallowfield, L. J., Kyriakides, S., Costa, A., Cufer, T., Albain, K. S., Force, E. -. M. T. International Guidelines for Management of Metastatic Breast Cancer: Combination Vs Sequential Single-Agent Chemotherapy. J Natl Cancer Inst. 101 (17), 1174-1181 (2009).
- Alba, E., Martin, M., Ramos, M., Adrover, E., Balil, A., Jara, C., Barnadas, A., Fernandez-Aramburo, A., Sanchez-Rovira, P., Amenedo, M., Casado, A. Multicenter Randomized Trial Comparing Sequential with Concomitant Administration of Doxorubicin and Docetaxel as First-Line Treatment of Metastatic Breast Cancer: A Spanish Breast Cancer Research Group (Geicam-9903) Phase Iii. J Clinn Oncol. 22 (13), 2587-2593 (2004).
- Sadat, S. M., Saeidnia, S., Nazarali, A. J., Haddadi, A. Nano-Pharmaceutical Formulations for Targeted Drug Delivery against Her2 in Breast Cancer. Curr. Cancer Drug Targets. 15 (1), 71-86 (2015).
- Devadasu, V. R., Wadsworth, R. M., Ravi Kumar, M. N. V. Tissue Localization of Nanoparticles Is Altered Due to Hypoxia Resulting in Poor Efficacy of Curcumin Nanoparticles in Pulmonary Hypertension. Eur. J. Pharm. Biopharm. 80 (3), 578-584 (2012).
- Li, S. D., Huang, L. Pharmacokinetics and Biodistribution of Nanoparticles. Mol. Pharm. 5 (4), 496-504 (2008).
- Zhang, R. X., Ahmed, T., Li, L. Y., Li, J., Abbasi, A. Z., Wu, X. Y. Design of Nanocarriers for Nanoscale Drug Delivery to Enhance Cancer Treatment Using Hybrid Polymer and Lipid Building Blocks. Nanoscale. 9 (4), 1334-1355 (2017).
- Wang, X., Li, S., Shi, Y., Chuan, X., Li, J., Zhong, T., Zhang, H., Dai, W., He, B., Zhang, Q. The Development of Site-Specific Drug Delivery Nanocarriers Based on Receptor Mediation. J. Control. Release. 193, 139-153 (2014).
- Batist, G., Gelmon, K. A., Chi, K. N., Miller, W. H., Chia, S. K., Mayer, L. D., Swenson, C. E., Janoff, A. S., Louie, A. C. Safety, Pharmacokinetics, and Efficacy of Cpx-1 Liposome Injection in Patients with Advanced Solid Tumors. Clin Cancer Res. 15 (2), 692-700 (2009).
- Mayer, L. D., Harasym, T. O., Tardi, P. G., Harasym, N. L., Shew, C. R., Johnstone, S. A., Ramsay, E. C., Bally, M. B., Janoff, A. S. Ratiometric Dosing of Anticancer Drug Combinations: Controlling Drug Ratios after Systemic Administration Regulates Therapeutic Activity in Tumor-Bearing Mice. Mol. Cancer Ther. 5 (7), 1854-1863 (2006).
- Prasad, P., Cheng, J., Shuhendler, A., Rauth, A. M., Wu, X. Y. A Novel Nanoparticle Formulation Overcomes Multiple Types of Membrane Efflux Pumps in Human Breast Cancer Cells. Drug Deliv Transl Res. 2 (2), 95-105 (2012).
- Shuhendler, A. J., Cheung, R. Y., Manias, J., Connor, A., Rauth, A. M., Wu, X. Y. A Novel Doxorubicin-Mitomycin C Co-Encapsulated Nanoparticle Formulation Exhibits Anti-Cancer Synergy in Multidrug Resistant Human Breast Cancer Cells. Breast Cancer Res Treat. 119 (2), 255-269 (2010).
- Shuhendler, A. J., O'Brien, P. J., Rauth, A. M., Wu, X. Y. On the Synergistic Effect of Doxorubicin and Mitomycin C against Breast Cancer Cells. Drug Metabol. Drug Interact. 22 (4), 201-233 (2007).
- Zhang, R. X., Cai, P., Zhang, T., Chen, K., Li, J., Cheng, J., Pang, K. S., Adissu, H. A., Rauth, A. M., Wu, X. Y. Polymer-Lipid Hybrid Nanoparticles Synchronize Pharmacokinetics of Co-Encapsulated Doxorubicin-Mitomycin C and Enable Their Spatiotemporal Co-Delivery and Local Bioavailability in Breast Tumor. Nanomedicine. 12 (5), 1279-1290 (2016).
- Zhang, T., Prasad, P., Cai, P., He, C., Shan, D., Rauth, A. M., Wu, X. Y. Dual-Targeted Hybrid Nanoparticles of Synergistic Drugs for Treating Lung Metastases of Triple Negative Breast Cancer in Mice. Acta Pharmacol Sin. , 1-13 (2017).
- Shuhendler, A. J., Prasad, P., Zhang, R. X., Amini, M. A., Sun, M., Liu, P. P., Bristow, R. G., Rauth, A. M., Wu, X. Y. Synergistic Nanoparticulate Drug Combination Overcomes Multidrug Resistance, Increases Efficacy, and Reduces Cardiotoxicity in a Nonimmunocompromised Breast Tumor Model. Mol Pharm. 11 (8), 2659-2674 (2014).
- Prasad, P., Shuhendler, A., Cai, P., Rauth, A. M., Wu, X. Y. Doxorubicin and Mitomycin C Co-Loaded Polymer-Lipid Hybrid Nanoparticles Inhibit Growth of Sensitive and Multidrug Resistant Human Mammary Tumor Xenografts. Cancer Lett. 334 (2), 263-273 (2013).
- Rafiei, P., Michel, D., Haddadi, A. Application of a Rapid Esi-Ms/Ms Method for Quantitative Analysis of Docetaxel in Polymeric Matrices of Plga and Plga-Peg Nanoparticles through Direct Injection to Mass Spectrometer. Am. J. Anal. Chem. 6 (2), 164-175 (2015).
- Daeihamed, M., Haeri, A., Dadashzadeh, S. A Simple and Sensitive Hplc Method for Fluorescence Quantitation of Doxorubicin in Micro-Volume Plasma: Applications to Pharmacokinetic Studies in Rats. Iran. J. Pharm. Res. 14, 33-42 (2015).
- Alhareth, K., Vauthier, C., Gueutin, C., Ponchel, G., Moussa, F. Hplc Quantification of Doxorubicin in Plasma and Tissues of Rats Treated with Doxorubicin Loaded Poly(Alkylcyanoacrylate) Nanoparticles. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 887-888, 128-132 (2012).
- Al-Abd, A. M., Kim, N. H., Song, S. C., Lee, S. J., Kuh, H. J. A Simple Hplc Method for Doxorubicin in Plasma and Tissues of Nude Mice. Arch Pharm Res. 32 (4), 605-611 (2009).
- Loadman, P. M., Calabrese, C. R. Separation Methods for Anthraquinone Related Anti-Cancer Drugs. J. Chromatogr. B Biomed. Sci. Appl. 764 (1-2), 193-206 (2001).
- Zhang, Z. D., Guetens, G., De Boeck, G., Van Cauwenberghe, K., Maes, R. A., Ardiet, C., van Oosterom, A. T., Highley, M., de Bruijn, E. A., Tjaden, U. R. Simultaneous Determination of the Peptide-Mitomycin Kw-2149 and Its Metabolites in Plasma by High-Performance Liquid Chromatography. J. Chromatogr. B Biomed. Sci. Appl. 739 (2), 281-289 (2000).
- Alvarez-Cedron, L., Sayalero, M. L., Lanao, J. M. High-Performance Liquid Chromatographic Validated Assay of Doxorubicin in Rat Plasma and Tissues. J. Chromatogr. B Biomed. Sci. Appl. 721 (2), 271-278 (1999).
- Paroni, R., Arcelloni, C., De Vecchi, E., Fermo, I., Mauri, D., Colombo, R. Plasma Mitomycin C Concentrations Determined by Hplc Coupled to Solid-Phase Extraction. Clin. Chem. 43 (4), 615-618 (1997).
- Song, D., Au, J. L. Direct Injection Isocratic High-Performance Liquid Chromatographic Analysis of Mitomycin C in Plasma. J Chromatogr B Biomed Appl. 676 (1), 165-168 (1996).
- Schrijvers, D. Role of Red Blood Cells in Pharmacokinetics of Chemotherapeutic Agents. Clin. Pharmacokinet. 42 (9), 779-791 (2003).
- Colombo, T., Broggini, M., Garattini, S., Donelli, M. G. Differential Adriamycin Distribution to Blood Components. Eur. J. Drug Metab. Pharmacokinet. 6 (2), 115-122 (1981).
- Maeda, H., Nakamura, H., Fang, J. The Epr Effect for Macromolecular Drug Delivery to Solid Tumors: Improvement of Tumor Uptake, Lowering of Systemic Toxicity, and Distinct Tumor Imaging in Vivo. Adv. Drug Deliv. Rev. 65 (1), 71-79 (2013).
- Gustafson, D. L., Rastatter, J. C., Colombo, T., Long, M. E. Doxorubicin Pharmacokinetics: Macromolecule Binding, Metabolism, and Excretion in the Context of a Physiologic Model. J. Pharm. Sci. 91 (6), 1488-1501 (2002).
- Gabizon, A., Shiota, R., Papahadjopoulos, D. Pharmacokinetics and Tissue Distribution of Doxorubicin Encapsulated in Stable Liposomes with Long Circulation Times. J. Natl. Cancer Inst. 81 (19), 1484-1488 (1989).
- Motlagh, N. S., Parvin, P., Ghasemi, F., Atyabi, F. Fluorescence Properties of Several Chemotherapy Drugs: Doxorubicin, Paclitaxel and Bleomycin. Biomed Opt Express. 7 (6), 2400-2406 (2016).
- Mohan, P., Rapoport, N. Doxorubicin as a Molecular Nanotheranostic Agent: Effect of Doxorubicin Encapsulation in Micelles or Nanoemulsions on the Ultrasound-Mediated Intracellular Delivery and Nuclear Trafficking. Mol Pharm. 7 (6), 1959-1973 (2010).
- Cielecka-Piontek, J., Jelińska, A., Zając, M., Sobczak, M., Bartold, A., Oszczapowicz, I. A Comparison of the Stability of Doxorubicin and Daunorubicin in Solid State. J. Pharm. Biomed Anal. 50 (4), 576-579 (2009).
- Gilbert, C. M., McGeary, R. P., Filippich, L. J., Norris, R. L. G., Charles, B. G. Simultaneous Liquid Chromatographic Determination of Doxorubicin and Its Major Metabolite Doxorubicinol in Parrot Plasma. J. chromatogr. B Analyt. Technol. Biomed. Life sci. 826 (1-2), 273-276 (2005).
- Liu, Z. S., Li, Y. M., Jiang, S. X., Chen, L. R. Direct Injection Analysis of Mitomycin C in Biological Fluids by Multidemension High Performance Liquid Chromatography with a Micellar Mobile Phase. J. Liq. Chromatogr. Relat. Technol. 19 (8), 1255-1265 (1996).
- Zhou, Y., He, C., Chen, K., Ni, J., Cai, Y., Guo, X., Wu, X. Y. A New Method for Evaluating Actual Drug Release Kinetics of Nanoparticles inside Dialysis Devices Via Numerical Deconvolution. J. Control. Release. 243, 11-20 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved