A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحليل دقيق والفائق للنمو البكتيري
In This Article
Summary
التقييم الكمي للنمو البكتيري أمر ضروري لفهم فسيولوجيا الميكروبات كظاهرة مستوى النظم. يتم إدخال بروتوكول للتلاعب التجريبية ونهج تحليلي، مما يسمح للتحليل الدقيق، الفائق للنمو البكتيرية، التي موضع اهتمام في بيولوجيا الأنظمة رئيسية.
Abstract
النمو الجرثومي مفهوم مركزي في التنمية لفسيولوجيا الميكروبات الحديثة، وكذلك في التحقيق في ديناميات الخلوية على مستوى النظم. وأفادت الدراسات الأخيرة المتبادلة بين النمو البكتيري والأحداث على نطاق الجينوم، مثل الجينوم الترنسكربيتوم والحد من عملية إعادة التنظيم. تحليل النمو البكتيري بشكل صحيح أمر حيوي لفهم النمو تعتمد على تنسيق وظائف الجينات والمكونات الخلوية. وبناء على ذلك، مطلوب التقييم الكمي الدقيق للنمو البكتيري في طريقة الفائق. التطورات التكنولوجية الناشئة توفر الأدوات التجريبية الجديدة التي تسمح تحديثات الأساليب المستخدمة في دراسة النمو الجرثومي. البروتوكول أدخل هنا يستخدم قارئ ميكروسكوبية مع إجراء تجريبي الغاية أمثل لتقييم النمو البكتيري استنساخه ودقيقة. استخدم هذا البروتوكول لتقييم نمو عدة سبق وصف سلالات الإشريكيّة القولونية . الخطوات الرئيسية للبروتوكول على ما يلي: إعداد عدد كبير من مخزون الخلية في قارورة صغيرة للاختبارات المتكررة مع النتائج استنساخه، واستخدام لوحات 96-جيدا لتقييم النمو الفائق، والحساب اليدوي الرئيسية اثنين المعلمات (أي، الكثافة السكانية ومعدل النمو القصوى) تمثل ديناميات النمو. بالمقارنة التقليدية مستعمرة-تشكيل وحدة (زيمبابوي) المقايسة، الذي عد الخلايا التي تستزرع في أنابيب زجاجية على مر الزمن في لوحات أجار، الأسلوب الحالي هو أكثر كفاءة وتوفر السجلات الزمنية أكثر تفصيلاً لتغيرات النمو، ولكن صرامة حد الكشف في الكثافة السكانية المنخفضة. وباختصار، الأسلوب وصف مفيد لتحليل الفائق الدقة واستنساخه النمو البكتيرية، والتي يمكن أن تستخدم لاستخلاص استنتاجات مفاهيمية أو إبداء الملاحظات النظرية.
Introduction
غالباً ما تبدأ الدراسات الميكروبيولوجية مع ثقافة الخلايا البكتيرية وتقييم منحنيات النمو البكتيرية، التي تمثل ظاهرة أساسية لفسيولوجيا البكتيريا1،،من23. مبادئ الثقافة الأساسية متاحة على نطاق واسع في الأدب الأبحاث المنشورة والكتب المدرسية لأن ثقافة البكتيرية منهجية أساسية. على مستوى مقاعد البدلاء، اهتماما كبيرا ركزت تقليديا على الاستفادة المثلى من وسائط النمو واستزراع الشروط، ولكن السيطرة على معدل النمو، الذي سيوفر يرجح أن فهم أكبر لفسيولوجيا الميكروبات، لم يكن 4من درس على نطاق واسع. هو معلمة رئيسية للدولة الخلوية لزراعة البكتيريا أضعافاً مضاعفة، معدل النمو، الذي تم الإبلاغ عن أن تكون منسقة مع الجينوم، الترنسكربيتوم، والبروتين5،،من67،8 . وهكذا، التقييم الكمي للنمو البكتيري أمر حاسم لفهم فسيولوجيا الميكروبات.
تقييم النمو البكتيري، الأساليب التجريبية المستخدمة لتقدير الكتلة الحيوية راسخة9،10 وتقوم على الكشف عن المعلمات البيوكيميائية أو الفيزيائية أو البيولوجية، مثل تعكر الضوئية. وباﻹضافة إلى ذلك، الأساليب التحليلية المستخدمة لالتقاط الخصائص الديناميكية لتغيرات النمو عادة استناداً إلى النماذج غير الخطية الثابتة11،12،13، معادلات السوقي، على سبيل المثال،. عموما تكتسب ديناميات النمو بتوقيت أخذ العينات من نمو الخلايا في الثقافة بقياس التعكر الضوئية أو إجراء فحوصات وحدة (زيمبابوي) تشكيل مستعمرة. الحد من هذه الأساليب استزراع والكشف أن نقاط البيانات ليست انعكاسا حقيقيا للديناميات السكانية لأن فترات القياس غالباً في ساعات، ونظرا لحالة الثقافة (مثلاً، والتغيرات في درجة الحرارة و ويساور التهوية) في وقت أخذ العينات. يجب تحديث تقنيات الثقافة والتحليل باستخدام التطورات الأخيرة في مجال التكنولوجيا والتفاهم. التقدم الذي أحرز مؤخرا في القراء الميكروسكوبية تسمح المراقبة في الوقت الحقيقي من النمو البكتيري وانخفاض تكاليف العمالة إلى حد كبير. استخدام هذه الأجهزة المتقدمة، أفادت آخر الدراسات على النمو البكتيري الأساليب التحليلية للقياسات الفائق14،15.
والغرض من هذا البروتوكول هو تقييم ديناميات النمو دقيقة بطريقة الفائق، التي سوف تكون ذات قيمة للدراسات الكمية التي تعالج المسائل المتعلقة بكيفية تحديد معدل النمو وما هي العوامل التي تؤثر على معدل النمو في نهاية المطاف. ويتناول البروتوكول جميع العوامل التي ينبغي أن تؤخذ في الاعتبار كوانتيتيشن قابل للتكرار ودقيقة للنمو البكتيري. ويرد بالتفصيل في النص الرئيسي الأسلوب التجريبي والتحليل. هذا الأسلوب يسمح تحليل دقيق واستنساخه من النمو البكتيري في طريقة الفائق. الأطباء استخدام هذا البروتوكول لاستخلاص نتائج كمية إضافية من تلك الأدلة التجريبية. يمكن أيضا استخدام هذا البروتوكول للدراسات في بيولوجيا الأنظمة التي تسعى إلى استخلاص استنتاجات مفاهيمية أو لتحقيق نظرة نظرية للنمو.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. إعداد "متوسطة النمو"
ملاحظة: التركيب الكيميائي ل M63 متوسط الحد الأدنى على النحو التالي: 62 مم ك 2 مكتب البراءات الهنغاري 4، 39 مم خ 2 ص 4، 15 ملم (NH 4) 2 هكذا 4 1.8 ميكرومتر FeSO 4، 15 ميكرون الثيامين-HCl، 0.2 مم MgSO 4 والجلوكوز 22 ملم. M63 بخلط ثلاثة حلول الأسهم: الحل X خمسة والجلوكوز 20 ٪ ومجسو 4 الثيامين الحل. تخزين كافة الحلول في 4 ° C.
- إعداد الحل X خمسة
- لإعداد حل 4 فيسو، استخدام ماصة كهربائية وماصة مصلية المتاح لإضافة ddH 2 س إلى أنبوب 50 مل أجهزة الطرد مركزي. استخدام P-200 لإضافة 0.06 مل HCl للحصول على 0.01 M HCl. إضافة 36 ملغ فيسو 4-7 ح 2 س، وتخلط جيدا.
- قياس 160 مل ddH 2 س في اسطوانة قياس وإضافته إلى كوب 500 مل. تضاف العبارة التالية بهذا الترتيب: 10.72 ز ك 2 مكتب البراءات الهنغاري 4، ز 5.24 خ 2 ص 4، ز 2.0 (NH 4) 2 هكذا 4، و 0.5 مل الحل 4 فيسو (أعد الخطوة 1.1.1).
- باستخدام مقياس الأس الهيدروجيني دقة، ضبط درجة الحموضة 7.0 بإضافة 2 م كوه. من أجل الحل في اسطوانة قياس وإضافة ddH 2 س إلى إجمالي حجم 200 مل. تعقيم الحل باستخدام وحدة ترشيح 250 مل (PVDF، 0.22 ميكرومتر).
- إعداد الحل الجلوكوز 20 ٪
- قياس 200 مل ddH 2 س في اسطوانة قياس، ومن أجل ذلك إلى كوب 500 مل. بينما خلط استخدام محرض مغناطيسي، إضافة 50 جرام جلوكوز. تمييع الحل في اسطوانة قياس حجم إجمالي 250 مل. تعقيم الحل كما هو موضح في الخطوة 1.1.3.
- إعداد الحل الثيامين 4 مجسو
- إضافة 150 مل ddH 2 س إلى كوب 500 مل. بينما خلط مع محرض مغناطيسي، إضافة ز 1.0 من الثيامين HCl و 10 غم من مجسو 4-7 ح 2 O. ديلوت الحل في اسطوانة قياس إلى إجمالي حجم 200 مل. تعقيم الحل كما هو موضح في الخطوة 1.1.3.
- إعداد الحد الأدنى المتوسط M63
- الحل X خمسة، الحل الجلوكوز 20 ٪، الحل الثيامين 4 مجسو، ماصة إلكترونية، ماصة P-200، ونصائح ماصة 200 ميليلتر على مقاعد البدلاء نظيفة.
- قياس مل 155.8 ddH 2 س في اسطوانة قياس وأنه صب في كوب 500 مل.
- باستخدام الماصة الإلكترونية وماصة المصلية المتاح، إضافة 40 مل مل 4 20% جلوكوز حل والحل X خمسة ddH يقاس 2 o. ثم إضافة 0.2 مل مجسو 4 الثيامين الحل مع P-200. تعقيم الحل كما هو موضح في الخطوة 1.1.3.
2. إعداد "المخزون والغليسيرول"
الثقافة- خلية
ملاحظة: السلالات البكتيرية (مثلاً، W3110 وفي جينومات مخفضة) متوفرة من سلالة المنظمات المصرفية. عادة ما يتم الحصول على السلالات في شكل المستعمرات على ألواح أجار.- وضع خمسة أنابيب زجاجية معقمة مع سدادات المطاط سيليكون ماصة إلكترونية، P-1,000، نصائح ماصة 1,000-ميليلتر، P-200، 200 ميليلتر ماصة نصائح وسلالات المستهدفة (المستعمرات على ألواح) على مقاعد البدلاء نظيفة.
- فضح مصب أنبوب الزجاج موقد بنسن قبل فتح سداده المطاط سيليكون. كشف سداده المطاط سيليكون للشعلة بعد فتح الأنبوب، وطفيفة ثم ضع الغطاء مرة أخرى على أنابيب زجاجية.
- استخدام الماصة الإلكترونية وماصة المصلية المتاح لإضافة 5 مل M63 إلى واحد من أنابيب زجاجية ومل 4.5 M63 للأنابيب الأربعة الأخرى.
- استخدام تلميح P-200 لاختيار مستعمرة وتطعيم ذلك في أنابيب زجاجية تحتوي على 5 مل M63.
- دوامة الأنبوب جعل تعليق. ثم، تمييع الحل 10 إضعاف عن طريق نقل 0.5 مل من هذا الحل إلى واحدة من هذه الأنابيب الأربعة التي تحتوي على 4.5 مل M63.
- كرر العملية الموضحة في الخطوة 2.1.5 لأنابيب المتبقية. سلسلة تمييع مع خمسة تركيزات مختلفة (تخفيف من 1، 10، 100، 1000، و 000 10) جاهز الآن.
- تعقيم أفواه أنابيب زجاجية وسدادات المطاط سيليكون كما هو موضح في الخطوة 2.1.2. كاب الأنابيب مع السدادات. تجنب التلوث بعدم تجعد سدادات المطاط سيليكون.
- وضع الأنابيب الخمسة في حاضنة تهز المعالجون مسبقاً عند 37 درجة مئوية ويهز 200 لفة في الدقيقة. احتضان الثقافة بين عشية وضحاها أو 10 إلى 30 h.
- مختارة الثقافة للأسهم والغليسيرول
- مكان متوسط درجة حرارة الغرفة دافئة قبل M63، P-1,000 ونصائح ماصة 1,000 ميليلتر وومبومو المتاح من على مقاعد البدلاء نظيفة.
- إضافة 1000 ميليلتر M63 إلى ومبومو المتاح مع P-1، 000. ضع ومبومو المتاح في جهاز المطياف الضوئي، بدء تشغيل البرنامج في موجه ثابتة من 600 نانومتر، وتدبير الفارغة.
- نقل أنابيب زجاجية خمسة من حاضنة تهتز في هيئة نظيفة.
- M63 تجاهل من ومبومو المتاح وإضافة 1,000 ميليلتر الثقافة إلى ومبومو المتاح نفسه مع P-1، 000. قياس التعكر الضوئية ثقافة الخلية (OD 600) كما هو موضح في الخطوة 2.2.2.
ملاحظة: لتجنب أي تلوث وتحقيق قياس دقيق، تعرض أنابيب زجاجية وسدادات للهب كما هو موضح ودوامه الثقافة قبل أخذ العينات. ولضمان نتائج موثوقة، ينصح القياسات المتكررة، لا سيما عندما ينخفض مستوى كثافة الخلية. - الخمس خلية الثقافات، واختيار واحد الذي في مرحلة النمو الأسى المبكر (OD 600 = 0.01-0.05) للأسهم والغليسيرول.
ملاحظة: إذا كان لدى ثقافات متعددة الكثافات داخل النطاق الأمثل، واحد أقرب إلى 0.05 عادة محدداً.
- جعل الأرصدة والغليسيرول للاختبارات المتكررة.
ملاحظة: هذا هو وصف لإعداد الأرصدة العشرة. يمكن جعل كميات أكبر أو أصغر وفقا لمتطلبات التجريبية.- وضع الحل والغليسيرول 60% معقمة وعشرة تعقيم 1.5 مل microtubes، P-1,000 P-200، 1,000 و 200 ميليلتر ماصة نصائح و microtube الوقوف على مقاعد البدلاء نظيفة.
- إضافة 250 ميليلتر تعقيم 60% من محلول الجلسرين وميليلتر 750 ثقافة الخلية المحددة إلى 1.5 مل microtube ومزيج من بيبيتينج-
ملاحظة: هو متغير حجم المخزون، ولكن دائماً الحفاظ على نسبة 1:3 من والغليسيرول 60% للخلية والثقافة؛ وهذا يؤدي بتركيز نهائي والغليسيرول 15%- - مكان microtubes التسعة المتبقية في موقف microtube والاستغناء عن 100 ميليلتر من خليط إعدادها في الخطوة 2.3.2 لكل أنبوبة. وهناك الآن عشرة والغليسيرول مطابقة الأرصدة للاستخدام في المستقبل.
- تخزين المخزونات في ثلاجة العميق في-80 درجة مئوية.
3. الحصول على "منحنيات النمو"
- إعداد القارئ الميكروسكوبية.
ملاحظة: شروط سيظهر في إظهار علامات اقتباس صيغة محددة تستخدم على قارئ لوحة المستخدمة هنا (انظر الجدول للمواد).- فتح البرنامج. فتح " البروتوكولات " في " مدير المهمة " واختيار " "إنشاء جديد" ". اختر " بروتوكول قياسي ".
- فتح " الداخلي "، وقم بضبط الإعدادات. فتح " "ضبط درجة الحرارة" "، وحدد " "حاضنة في" ". تعيين " درجة الحرارة " إلى 37 درجة مئوية و " التدرج " إلى 0 ° الاختيار جيم " سخن " قبل المتابعة إلى الخطوة التالية. مفتوحة " "بدء الحركية" "، مجموعة " وقت التشغيل " 24:00:00 أو 48:00:00، و " الفاصل الزمني " 00:30:00 أو 01:00-
ملاحظة: يستغرق حوالي 1 دقيقة لقراءة لوحة 96 أكمله جيدا. - فتح " هز " وتعيين " "زعزعة الوضع" " ك " الخطي ". تحقق من " Coنستيتوشن يهز " وتعيين " التردد " في ظهور 567. فتح " القراءة "، التحقق من " امتصاص "، " نقطة النهاية/الحركية "، و " مونوتشروماتورس. " تعيين " الطول الموجي " إلى 600.
- انقر فوق " التحقق من " التأكد من أن الإجراء الصحيح. انقر فوق " حفظ " لحفظه كبرنامج جديد للاستخدام في المستقبل.
- في الوقت الحقيقي تسجيل نمو
- رسم لوحة 96-جيدا، الرسم التخطيطي (الجدول × 12 8) للإشارة إلى مواقف نماذج الثقافة الملقحين على لوحة 96-جيدا. طباعة الجدول واستخدامه كمرجع للتجربة-
ملاحظة: الآبار الواقعة على حواف ميكروسكوبية فقط التي ينبغي أن تتضمن المتوسطة فارغة بسبب التبخر. - مكان شقة 96-جيدا تعقيم أسفل الميكروسكوبية مع غطاء، P-1000، نصائح ماصة 1000 ميليلتر، P-200، 200 ميليلتر ماصة نصائح، عدة 1.5 مل microtubes، ماصة 8-متعدد الأقنية، خزان كاشف معقمة، درجة حرارة الغرفة M63 ووالغليسيرول مخزون (إعدادها في الخطوة 2، 3) على مقاعد البدلاء نظيفة. إضافة
- حوالي 25 مل M63 إلى خزان كاشف. استخدام هذا المخزون خزان لكافة الخطوات التالية-
- ميليلتر 900 إضافة M63 إلى microtubes في التحضير لإجراء تخفيف المسلسل.
- ذوبان الجليد رصيد والغليسيرول في درجة حرارة الغرفة. إضافة 900 ميليلتر M63 الأسهم والغليسيرول المذابة ودوامه. يؤدي إلى إضعاف إذ المخزون والغليسيرول الأصلي-
- نقل 100 ميليلتر لتمييع الوقت إلى آخر microtube الذي يحتوي على 900 ميليلتر M63 ودوامه. وهذا يؤدي تمييع 100-fold.
- كرر الخطوة 3.2.6 حتى يتم تحقيق العدد المطلوب من تخفيف.
- ملء الآبار على حافة الصفيحة مع 200 ميليلتر M63 استخدام ماصة 8-قناة (P-200)-
ملاحظة: يمكن استخدام هذه الآبار كالفراغ.
المخفف - حمولة 200 ميليلتر لكل نموذج أعد الخطوات 3.2.4-3.2.7 للآبار الميكروسكوبية وفقا لجدول المرجع (الخطوة 3.2.1). يختلف دوامة مسبقة عينات المخفف لتحميل وتحميل نفس العينة في آبار متعددة في المواقع على اللوحة-
- مكان الميكروسكوبية 96-جيدا على القارئ لوحة.
- فتح " "القراءة الآن" " في " مدير المهمة " واختيار البرنامج (القسم 3.1). انقر فوق " موافق " لبدء القياس. حفظ التسجيل كملف تجريبي جديد لتحليل البيانات (القسم 4)-
- رسم لوحة 96-جيدا، الرسم التخطيطي (الجدول × 12 8) للإشارة إلى مواقف نماذج الثقافة الملقحين على لوحة 96-جيدا. طباعة الجدول واستخدامه كمرجع للتجربة-
4. تحليل بيانات
- تصدير نتائج البيانات في الوقت الحقيقي من معدل النمو (القسم 3.2) إلى ذاكرة USB العصا كملف نص.
ملاحظة: سيتم عرض نتائج منسقة 96-جيدا (المنحنيات) على قارئ اللوحة في الوقت الحقيقي. يمكن تصدير السجلات كل ساعة (OD القيم) كجدول؛ الصفوف والأعمدة تمثل أعدادا جيدا (مثلاً، A1، B1) وقياس الوقت (مثلاً، 00:00:59)، على التوالي. - فتح ملف نصي مع برامج جداول بيانات.
- نسخ يقرأ OD كل ساعة على 600 من الميكروسكوبية 96-جيدا إلى ورقة عمل جديدة لمزيد من التحليل.
- طرح الخلفية يقرأ في وقت صفر من يقرأ كل ساعة من كل عينة حسنا.
ملاحظة: لمزيد من الراحة، يعني قيمة الفارغة الآبار M63 المحتوية على (الخطوة 3.2.8) يمكن أن تستخدم كقيمة أساسية- - حساب متوسط خمس متتالية OD 600 ما يلي: تقدير الكثافة السكانية القصوى.
ملاحظة: يعرف قيمة يعني أكبر من 600 OD خمس متتالية على ما يلي ك OD القصوى 600 منحنى النمو المقابل. - حساب معدل النمو، μ (ح -1)، عن طريق تطبيق المعادلة التالية لكل زوج من القيم على التوالي OD 600:
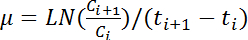
ملاحظة: في هذه المعادلة، ج أنا وجيم أنا + 1 تمثل قيم أي مرة على التوالي نقطتين (تي أنا وتي أنا + 1، 600 OD على التوالي). LN يشير إلى اللوغاريتم الطبيعي.
يقرأ - حساب التغيرات في معدل النمو مع مرور الوقت استناداً إلى كل ساعة OD 600 وفقا للخطوة 4.6. حساب المتوسط والانحراف المعياري لمعدلات النمو على التوالي خمسة لتقدير معدل النمو القصوى.
ملاحظة: يعني أكبر مع الانحراف المعياري أصغر يعرف معدل النمو القصوى لمنحنى النمو المناظرة.
5. تؤكد أن "التحيز العالمي" من 96-جيدا على ما يلي (اختياري)
ملاحظة: كل لوحة لوحة 96-جيدا الاستهلاكية والقارئ يمكن أن يسبب القياسات متحيزة. لتحقيق نتائج كمية دقيقة للغاية واستنساخه، تؤكد التحيز العالمي من لوحة 96-كذلك ينصح بشدة-
- إعداد لوحة 96-جيدا وقارئ لوحة للتحيز للاختبار كما هو موضح في المقطع 3.2.2.
- إضافة 20 مل M63 إلى أنبوب تعقيم 50 مل أجهزة الطرد مركزي. إضافة الأسهم والغليسيرول بنفس أنبوب الطرد المركزي ودوامه. نقل الحل مع وقف التنفيذ إلى خزان كاشف معقمة.
- استخدام ماصة 8 قنوات نقل 200 ميليلتر من الحل مع وقف التنفيذ إلى لوحة 96-جيدا-
- وضع لوحة 96-جيدا على القارئ لوحة وبدء القياس.
- سجل كل ساعة OD 600 قراءة وتحليل كما هو موضح في القسم 4. مقارنة نمو القصوى المحسوبة معدل والكثافة السكانية لكل بئر لتحديد التحيز المكانية من 96-جيدا على ما يلي-
Access restricted. Please log in or start a trial to view this content.
النتائج
وصف الأسلوب يوفر وسيلة لالتقاط دينامية النمو البكتيري بصورة مستمرة، والفائق باستخدام قارئ تنسيق 96-جيدا أن يأخذ قياسات الكثافة البصرية متعددة في فترات زمنية مختلفة (من دقائق إلى ساعات إلى أيام). ويمكن اكتساب منحنيات النمو لمجموعة متنوعة سلالات كولاي معربا عن مورثات ...
Access restricted. Please log in or start a trial to view this content.
Discussion
وتشمل الخطوات الحاسمة في البروتوكول إعداد الأسهم المشتركة أضعافاً مضاعفة زراعة الخلايا وتكرار نفس العينات في آبار متعددة في مختلف المواقف بشأن الميكروسكوبية. في السابق، بدأ الأطباء الثقافة من ثقافة ما قبل بين عشية وضحاها. وبينما قد يقلل هذا الأسلوب وقت تأخر النمو البكتيري، من الصعب تحقي...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ونحن نشكر تسوتشيا كوهية لتقديم المثال المقايسة زيمبابوي. هذا العمل جزئيا ماليا وأيد معونات للبحث العلمي (ج) رقم 26506003 (إلى بوي) من وزارة التربية والتعليم، والثقافة والرياضة، والعلوم والتكنولوجيا باليابان.
Acknowledgements
الكتاب ليس لها علاقة بالكشف عن.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| K2HPO4 | Wako | 164-04295 | |
| KH2PO4 | Wako | 166-04255 | |
| (NH4)2SO4 | Wako | 019-03435 | |
| MgSO4-7H2O | Wako | 138-00415 | |
| Thiamine-HCl | Wako | 201-00852 | |
| glucose | Wako | 049-31165 | |
| HCl | Wako | 080-01066 | |
| Iron (II) sulfate heptahydrate (FeSO4-7H2O) | Wako | 094-01082 | |
| KOH | Wako | 168-21815 | |
| Glycerol | Wako | 075-00611 | |
| Centrifuge tube (50 mL, sterilized) | WATSON | 1342-050S | |
| Pipette Tips, 200 µL | WATSON | 110-705Y | |
| Pipette Tips, 1,000 µL | WATSON | 110-8040 | |
| Microtube (1.5 mL) | WATSON | 131-715C | |
| 8 multichannel-pipette | WATSON | NT-8200 | |
| PASORINA STIRRER | AS ONE | 2-4990-02 | |
| Glass cylinder (200 mL) | AS ONE | 1-8562-07 | |
| Precision pH mater | AS ONE | AS800 / 1-054-01 | |
| Pipetman P-200 | GILSON | 1-6855-05 | |
| Pipetman P-1000 | GILSON | 1-6855-06 | |
| Disposable Serolocical Pipettes (10 mL) | SANPLATEC | SAN27014 | |
| Disposable Serolocical Pipettes (25 mL) | SANPLATEC | SAN27015 | |
| Microtube stand | BM Bio | 801-02Y | |
| Vortex | BM Bio | BM-V1 | |
| Corning Costar 96-well microplate with lid (Flat bottom, Clear) | Sigma-Aldrich | Corning, 3370 | |
| Corning Costar reagent reservoir (50 mL) | Sigma-Aldrich | Corning, 4870 | |
| Stericup GV PVDF (250 mL, 0.22 µM) | Merck Millipore | SCGVU02RE | |
| Pipet-Aid XP | DRUMMOND | 4-000-101 | |
| Bioshaker (BR-23UM MR) | TAITEC | 0053778-000 | |
| Disposal cell (1.5 mL) | Kartell | 1938 / 2-478-02 | |
| DU 730 Life Science UV/Vis Spectrophotometer | Beckman Coulter | A23616 | |
| EPOCH2 | BioTek | 2014-EP2-002 / EPOCH2T | |
| Beaker (500 mL) | IWAKI | 82-0008 | |
| BIO clean bench | Panasonic | MCV-B131F | |
| Glass tubes | NICHIDEN RIKA GLASS | P-10M~P-30 /101019 | |
| Silicone rubber stoppers | ShinEtsu Polymer | T-19 | |
| Bacterial strains | Strain bank organization; National Bio Resource Project (NBRP) in Japan |
References
- Kovarova-Kovar, K., Egli, T. Growth kinetics of suspended microbial cells: from single-substrate-controlled growth to mixed-substrate kinetics. Microbiol Mol Biol Rev. 62 (3), 646-666 (1998).
- Soupene, E., et al. Physiological studies of Escherichia coli strain MG1655: growth defects and apparent cross-regulation of gene expression. J Bacteriol. 185 (18), 5611-5626 (2003).
- Sezonov, G., Joseleau-Petit, D., D'Ari, R. Escherichia coli physiology in Luria-Bertani broth. J Bacteriol. 189 (23), 8746-8749 (2007).
- Egli, T. Microbial growth and physiology: a call for better craftsmanship. Front Microbiol. 6, 287(2015).
- Kurokawa, M., Seno, S., Matsuda, H., Ying, B. W. Correlation between genome reduction and bacterial growth. DNA Res. 23 (6), 517-525 (2016).
- Matsumoto, Y., Murakami, Y., Tsuru, S., Ying, B. W., Yomo, T. Growth rate-coordinated transcriptome reorganization in bacteria. BMC Genomics. 14, 808(2013).
- Nahku, R., et al. Specific growth rate dependent transcriptome profiling of Escherichia coli K12 MG1655 in accelerostat cultures. J Biotechnol. 145 (1), 60-65 (2010).
- Dai, X., et al. Reduction of translating ribosomes enables Escherichia coli to maintain elongation rates during slow growth. Nat Microbiol. 2, 16231(2016).
- Madrid, R. E., Felice, C. J. Microbial biomass estimation. Crit Rev Biotechnol. 25 (3), 97-112 (2005).
- Harris, C. M., Kell, D. B. The estimation of microbial biomass. Biosensors. 1 (1), 17-84 (1985).
- Yates, G. T., Smotzer, T. On the lag phase and initial decline of microbial growth curves. J Theor Biol. 244 (3), 511-517 (2007).
- Kargi, F. Re-interpretation of the logistic equation for batch microbial growth in relation to Monod kinetics. Lett Appl Microbiol. 48 (4), 398-401 (2009).
- Peleg, M., Corradini, M. G. Microbial growth curves: what the models tell us and what they cannot. Crit Rev Food Sci Nutr. 51 (10), 917-945 (2011).
- Sprouffske, K., Wagner, A. Growthcurver: an R package for obtaining interpretable metrics from microbial growth curves. BMC Bioinformatics. 17, 172(2016).
- Hall, B. G., Acar, H., Nandipati, A., Barlow, M. Growth rates made easy. Mol Biol Evol. 31 (1), 232-238 (2014).
- Hermsen, R., Okano, H., You, C., Werner, N., Hwa, T. A growth-rate composition formula for the growth of E.coli on co-utilized carbon substrates. Mol Syst Biol. 11 (4), 801(2015).
- Engen, S., Saether, B. E. r- and K-selection in fluctuating populations is determined by the evolutionary trade-off between two fitness measures: Growth rate and lifetime reproductive success. Evolution. 71 (1), 167-173 (2017).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved