Method Article
يعيش تصوير متبوعاً بخلية واحدة تتبع لرصد خلية علم الأحياء وتطور نسب السكان العصبية متعددة
* These authors contributed equally
In This Article
Summary
ويرد وصف بروتوكول قوية لمراقبة السكان العصبية بالفيديو-الفحص المجهري الوقت الفاصل بين تليها مرحلة ما بعد المعالجة المستندة إلى البرامج. ويمثل هذا الأسلوب أداة قوية لتحديد الأحداث البيولوجية في عدد سكان محدد أثناء تجارب التصوير الحي.
Abstract
فهم الآليات التي تتحكم في الأحداث البيولوجية الحرجة من السكان الخلايا العصبية، مثل انتشار أو التفريق أو خلية مصير القرارات، سوف تكون حاسمة بالنسبة لتصميم الاستراتيجيات العلاجية للعديد من الأمراض التي تصيب الجهاز العصبي. الأساليب الحالية لتعقب خلية السكان يعتمدون على نتائجها النهائية في الصور الثابتة وعموما فشلوا في تقديم القرار الزمنية الكافية لتحديد السمات السلوكية في الخلايا المفردة. وعلاوة على ذلك، الاختلافات في موت الخلية، تغاير السلوكية داخل سكان خلية، وتمييع، نشر، أو انخفاض كفاءة العلامات المستخدمة لتحليل الخلايا هي جميع العوائق الهامة التي سوف تؤدي إلى read-outs غير مكتملة أو غير صحيحة من النتائج. على العكس من ذلك، إجراء تصوير مباشر ووحيد الخلية تتبع ظروف ملائمة يمثل أداة قوية لرصد كل من هذه الأحداث. هنا، يتم وصف بروتوكول الوقت الفاصل بين الفحص المجهري الفيديو، تليها مرحلة ما بعد المعالجة، لتعقب السكان العصبية مع القرار خلية مفردة، باستخدام برامج معينة. الأساليب الموصوفة تمكن الباحثين من معالجة المسائل الأساسية المتعلقة بتطور علم الأحياء والنسب خلية السكان العصبية متميزة.
Introduction
من أجل تطوير استراتيجيات علاجية جديدة وأكثر فعالية لتجديد السكان العصبية، يجب علينا أولاً أن نفهم الآليات الأساسية التي تحافظ على خلايا مع احتمال العصبية التجدد. السعي إلى تحقيق هذا الهدف يتطلب معرفة شاملة بالعوامل التي تنظم التوازن بين التتابع وانتشار/التمايز، ووضع وتوقيت لشعبة، طول دورة الخلية، القدرات المهاجرة، والجدوى، إلخ. على الرغم من اتباع نهج تقنية التي استخدمت للعديد من السنوات1، يعيش التصوير والمراقبة المباشرة لا تزال أفضل خيار لرصد الأحداث المذكورة أعلاه. خلافا للعديد من النهج الأخرى التي تركز على قراءات نقطة النهاية، يعيش التصوير وخلية واحدة تتبع معلومات طوال مدة التجربة2،3،،من45، 6-وهكذا، يتيح إضافة الأزمنة موت الخلية أو سلوك الخلية غير متجانسة أو خلية مصير القرارات، فضلا عن العديد من الآخرين الأحداث الهامة اسمه أن خلاف ذلك قد يمر دون أن يلاحظها أحد. ومن الناحية المثالية، ينبغي أن ترصد هذه الميزات من الخلايا أفضل في خلية مفردة مستوى المجراة، حيث كلا الجوهرية (خلية المتمتعة بالحكم الذاتي) والخارجية العظة (الخلية المتخصصة) تؤخذ في الاعتبار.
ومع ذلك، على الرغم من أن في في المختبر أحداث حالة تحدث في بيئة لا تتكاثر على الوسط الطبيعي، الشروط الثقافة المنخفضة الكثافة المستخدمة عادة في هذه البروتوكولات أكثر مناسبة للكشف عن الخصائص الجوهرية الخلايا. وعلاوة على ذلك، عنصر تحكم مبسطة أكثر من الوسط المحيطة به، ببساطة تعديل المتوسطة النمو، قد تشكل أداة قيمة للتحقيق في دور فردية لكل عامل خارجية أن يعرف مكانة العصبية، فضلا عن العوامل البيئية التي قد أن يتسبب في الحالات المرضية7،8،9،10،11،،من1213. ولذلك، عند تكوينه بشكل صحيح، كما هو الحال في البروتوكول المقترح هنا، تصوير مباشر يوفر حلاً عمليا في المختبر لمعالجة معظم المسائل المذكورة سابقا.
وباختصار، يصف هذا البروتوكول الأجهزة والبرمجيات، وشروط الثقافة والخطوات الرئيسية المطلوبة لنجاح إجراء تجربة تصوير الحي متبوعاً بخلية واحدة فقط تتبع. ويوفر هذا النهج قيمة المعلومات التي تساعد على الكشف عن الجوانب الأساسية لعلم الأحياء وتطور النسب، السكان العصبية متعددة.
Protocol
تصف المقاطع التالية الخطوات اللازمة للقيام بتصوير لايف متبوعاً بتعقب خلية واحدة فقط من السكان العصبية متعددة (الشكل 1). نفذت جميع الإجراءات يجب أن تشمل الحيوانات المبينة في هذا البروتوكول وفقا للمبادئ التوجيهية "المجلس الدولي" لعلوم الحيوانات المختبرية (إيكلاس).
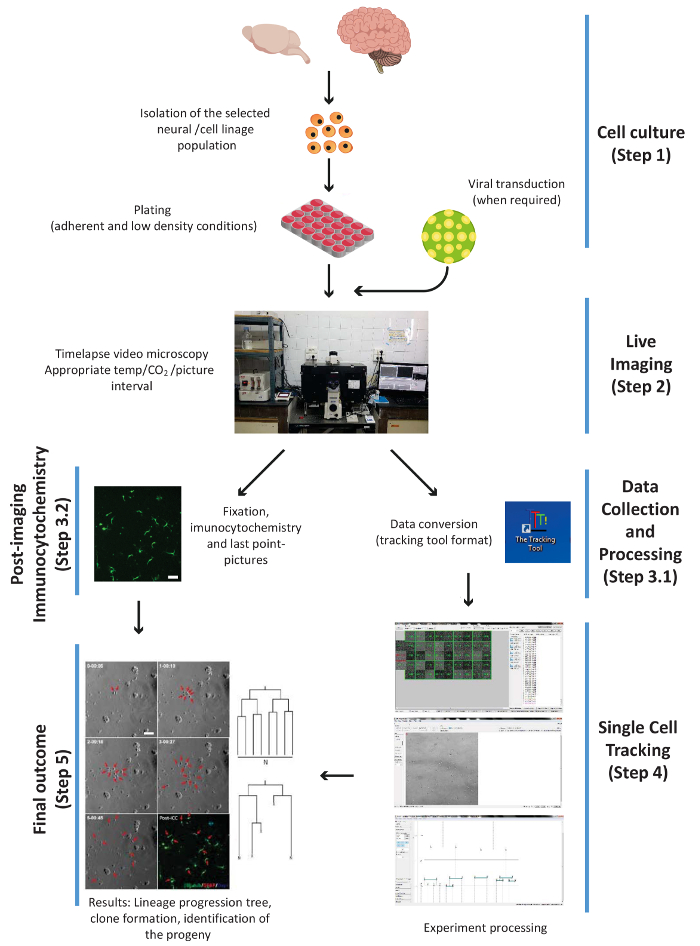
رقم 1- مخطط يوضح الخطوات التجريبية الرئيسية لهذا الإجراء، أي: خلية الثقافة والتصوير الحي ومبادئ العقود التجارية الدولية وجمع البيانات، ووحيد الخلية تتبع والنتيجة النهائية. يتم ترقيم الخطوات وفقا لتدفق العمل البروتوكول. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
1-خلية ثقافة: العزلة وتصفيح المحدد السكان العصبية أو النسب الخلية
ملاحظة: ترد أمثلة تطبيقه على السكان خلية متميزة بالتزامن مع هذا البروتوكول، للتحقق من فائدتها لتحليل بيولوجيا الخلايا العصبية. وتشمل هذه: "الخلايا الجذعية العصبية" (أنسكس) المستمدة من الماوس سوبيبينديمال المنطقة (المنطقة الاقتصادية الخاصة) (لعزل مفصل بروتوكول انظر14)؛ أستروسيتيس القشرية بعد الولادة لدراسة إعادة برمجة الخلايا العصبية (لعزل مفصل بروتوكول انظر15)؛ Astrocytes الدماغ بعد الولادة (لعزل تفصيلاً أسلوب انظر16)؛ والخط خلية Neuroblastoma العصبية-2a الماوس (N2a).
- بذور الخلايا مباشرة في بولي-د-يسين مغلفة بألواح 24-جيدا. استخدام 1 مل من الثقافة المتوسطة لكل بئر. احتضان اللوحات في 37 درجة مئوية و 8% CO2 أنسكس، أو في 37 درجة مئوية و 5% CO2 لخط أستروسيتيس/خلية ح 2 قبل التصوير مباشرة. تجنب استخدام كوفيرسليبس لمنع الحركة غير مرغوب فيها كما شرد مرحلة مجهر يجهز مما يجعل تعقب خلية مفردة غير مجد.
ملاحظة: كثافة الخلية وثقافة وسائل الإعلام المستخدمة في التجارب: 30-40,000 الخلايا/جيدا أنسكس في دولبيكو تعديل المتوسطة النسر (المتوسطة مزيج المغذيات DMEM:F12)؛ 20,000 خلايا/للخلايا N2a في متوسط "الجلوكوز عالية دميم"، 80,000 الخلايا/بئر ل astrocytes الدماغ في المتوسطة "دميم الجلوكوز عالية"؛ و 55-65,000 الخلايا/جيدا ل astrocytes بعد الولادة في مزيج المغذيات DMEM:F12 المتوسطة. - توحيد الثقافة البروتوكول عن طريق ضبط كثافة الخلية الثقافة بأقل عدد من الخلايا الممكنة. ومع ذلك، يجب أن تكون كثافة الخلايا عالية بما فيه الكفاية للحفاظ على استمرارية الثقافة.
ملاحظة: إذا كانت الخلية كثافة عالية جداً، الحطام الزائدة أو الانفصال الفقراء (كتل) قد يعيق تتبع الخلايا المفردة.
2-يعيش التصوير بالفيديو-الفحص المجهري الوقت الفاصل بين
- قم بتشغيل نظم مجهر والكاميرا والأجهزة والحضانة. ضبط درجة الحرارة والهواء الضغط إلى 37 درجة مئوية و 8% CO2 أنسكس، أو إلى 37 درجة مئوية و 5% CO2 لخط أستروسيتيس/خلية. تسمح درجة الحرارة ومستويات2 CO لتحقيق الاستقرار ح 1-2.
ملاحظة: مطلوب معدات معينة لأداء الوقت الفاصل بين تحليل أشرطة الفيديو، بما في ذلك: مشرق الميدان/المرحلة تباين/فلورية مجاهر مع المكونات الميكانيكية؛ أجهزة الحضانة التي تتحكم في درجة الحرارة، وأول أكسيد الكربون2 والرطوبة؛ وأخيراً، الحصول على أجهزة موثوقة وقوية بما فيه الكفاية وبرمجيات قادرة على اكتساب والتعامل مع حجم الصور أثناء تجارب التصوير الحي (الرجاء التحقق من الجدول للمواد). - مجرد الخلايا موصولة بحزم اللوحة (ح 2 بعد الطلاء)، استخدم قلم علامة دائمة لجعل علامة صغيرة في الجزء السفلي من بئر واحدة لن تستخدم لتعقب، أي، فضلا عن أنه لا يحتوي على خلايا.
ملاحظة: سيتم استخدام هذه العلامة كمرجع إلى الصفر إحداثيات xyz، ويمكن استخدامه في أي وقت أثناء أو بعد التجربة، أو بين التغيرات في المتوسط، إلى العودة إلى موضع صفر. - ضع اللوحة داخل غرفة الحضانة للمجهر وراسخا إرفاق اللوحة إلى مرحلة لتجنب أي حركة غير مرغوب فيها أثناء نزوح المرحلة يجهز المجهر.
- تسمح درجة الحرارة المتوسطة ثقافة الخلية إلى حجته في الدائرة لمدة حوالي 20 دقيقة. هذه الخطوة سوف تجنب فقدان التركيز أثناء التسجيل نظراً للتمدد للمكونات.
- بدء تشغيل البرنامج تصوير العيش وتحديد الوقت الفاصل بين الوحدة النمطية لإعداد هذه التجربة.
- تعيين المدة الإجمالية للتجربة ودورات اكتساب صورة في "قائمة التبويب الجدول الزمني". سبب الضيائية الملازمة المنقولة أو الضوء الفلورية المستخدمة، تحديد فاصل زمني كاف لتحقيق التوازن بين حل التحليل الزماني وموت الخلايا المحتملة.
ملاحظة: على سبيل المثال، تم اختيار ما مجموعة 120 ساعة للثقافات aNSC، الحصول على صور برايتفيلد كل دقيقة 5 النظر أن يتطلب الحصول على 120 ساعة فيلم واحد في هذا التكوين 120-150 غيغا بايت من مساحة التخزين الحرة في جهاز الكمبيوتر. - حدد الصورة ومواقف محددة بإحداثيات y، x والبعد البؤري (اﻻحداثي z) في "النقاط xyz التبويب القائمة". وتشمل النقطة المرجعية (إحداثيات xyz صفر) الموضع من أجل استرداد الإحداثيات في أي وقت.
- حدد نوع حيازة في "الطول الموجي اختيار علامة التبويب القائمة"، برايتفيلد فقط أو بالاقتران مع الإثارة ابيفلوريسسينسي عند الاقتضاء. حدد وقت التعرض. نضع في اعتبارنا أن التعرض المفرط لإرسالها، والضوء الفلورسنت خاصة، قد يعرض للخطر بقاء الخلية (كما هو مبين أعلاه).
- بالنسبة أنسكس، أستروسيتيس الدماغ، وخلايا N2a، حدد برايتفيلد (وقت التعرض 10-50 مللي ثانية).
- لتحديد astrocytes القشرية ترانسدوسيد برايتفيلد (وقت التعرض 10-50 مللي ثانية) في تركيبة مع ومضان أحمر/أخضر، تبعاً للمراسل المستخدمة للتجربة (الطول الموجي الأحمر الإثارة: 550 نيوتن متر و 400 مللي وقت التعرض؛ والإثارة الخضراء الطول الموجي: 460-500 نانومتر ووقت التعرض 100 مللي ثانية).
- قم بتعريف اسم المجلد حيث سيتم تخزين الصور والتجربة. حفظ قائمة مواقع لإعادة تحميل هذه التجربة في أي وقت، وبعد تحديد كافة الشروط، تشغيل التجربة عن طريق النقر فوق الزر "تشغيل الآن".
- إيقاف التجربة وإعادة ضبط شروط التركيز النقر فوق "الكتابة فوق زر z" مرة واحدة يوميا حتى اكتمال التجربة. إذا لزم إدخال تغييرات في المتوسط أثناء التصوير الحي، وقفه التجربة واسترداد اللوحة من الدائرة بمرور الوقت.
ملاحظة: التغيرات في درجة حموضة المتوسط بسبب موت الخلايا أو الانتشار المفرط، وكذلك الاختلافات في درجة حرارة الغرفة، قد يؤثر على تركيز المجهر على الخلايا الصحيحة. للثقافات حساسة (مثل أنسكس) نوصي باستخدام المتوسطة وتستكمل مع حمض-(2-hydroxyethyl)-1-بيبيرازينيثانيسولفونيك 4 (حبيس) (تركيز النهائي: 1 ملم).
3-بعد انتهاء التصوير إيمونوسيتوتشيميستري (مبادئ العقود التجارية الدولية)، جمع البيانات، وتجهيز
- وبمجرد الانتهاء من هذه التجربة، توقف البرنامج واسترداد لوحة للتثبيت ومبادئ العقود التجارية الدولية، كما هو موضح في الخطوات التالية.
- إجراء تثبيت الخلية: تغسل الخلايا مرة واحدة مع 1 مل الفوسفات مخزنة المالحة (PBS) وإضافة 500 ميليلتر من بارافورمالدهيد (PFA) (4 ٪ في برنامج تلفزيوني)، حضانة 10 دقيقة في درجة حرارة الغرفة (RT).
تنبيه: بارافورمالدهيد مثبت قوي ويجب معالجتها بعناية لتجنب ملامسة الجلد أو العينين. يجب أن تكون معالجته فقط داخل غطاء دخان. - تغسل الخلايا ثلاث مرات مع 1 مل من برنامج تلفزيوني وإضافة 500 ميليلتر من عرقلة الحل (برنامج تلفزيوني يحتوي على % 2 (wt/المجلد) من ألبومين المصل البقري (BSA) و 0.2 ٪ (المجلد/المجلد) من غير الأيونية خافض للتوتر السطحي). احتضان ح 1 في الرايت
- إزالة الحل حظر وإضافة 250-400 ميليلتر من الحل الأجسام الأولية. احتضان ح 2 في الرايت الحل الأجسام المضادة الأساسي يحتوي على الأجسام المضادة الأساسي المخفف في برنامج تلفزيوني يحتوي على % 2 (wt/المجلد) لجيش صرب البوسنة و 0.2% (المجلد/المجلد) من غير الأيونية خافض للتوتر السطحي. الأجسام المضادة المستخدمة في التجارب الموضحة هنا: توصيني (1: 500)، βIII-توبولين (1:1، 000) و α-توبولين (1:1، 000). هذا هو الاضطلاع مباشرة في البئر، بكميات أكبر من الحلول مطلوبة (250-400 ميليلتر) لتغطية كافة الخلايا.
- تغسل ثلاث مرات مع 1 مل من برنامج تلفزيوني وإضافة 250-400 ميليلتر من الأجسام المضادة الثانوية الحل (المخفف كما هو موضح في الخطوة 3، 4). الأجسام المضادة الثانوية المستخدمة في التجارب الموضحة هنا: الماوس لمكافحة فلوريسسين (فيتك) (1:800)، Cy3 المضادة أرنب (1: 500). احتضان ح 1 في RT في الظلام.
- يغسل ثلاث مرات في 1 مل من برنامج تلفزيوني. إبقاء الخلايا في 1 مل من برنامج تلفزيوني للخطوات اللاحقة للبروتوكول.
- ضع اللوحة مرة أخرى في مرحلة مجهر وراسخا إرفاقه إلى مرحلة لتجنب حركة غير مرغوب فيها أثناء نزوح مرحلة مجهر يجهز.
- استرداد xyz موضع صفر باستخدام العلامة في الخطوة 2، 2 وإعادة تعيين المواقع لهذه النقطة المرجعية عن طريق الضغط على زر "إزاحة كل X، Y، Z". إعادة تعيين البعد البؤري لكل موقف.
- الحصول على جولة أخيرة من الصور، وتهيئة الظروف اللازمة لانبعاث fluorescence في "الطول الموجي اختيار علامة التبويب القائمة" من أجل الكشف عن المستضدات المستهدفة سابقا في مبادئ العقود التجارية الدولية.
- بإيجاز، بالإضافة إلى برايتفيلد، تنشيط فيتك (الإثارة: 495 نيوتن متر) و Cy3 (الإثارة: 550 نانومتر) خيارات شراء البرمجيات. استخدام 10-50 مللي ثانية للتعرض برايتفيلد 400 مللي ثانية للكشف فلوروفوريس واضغط على زر "حلقة الوقت 1"، للحصول على جولة أخيرة من الصور.
ملاحظة: قد تختلف حدة الأسفار اعتماداً على نتائج مبادئ العقود التجارية الدولية. ضبط وقت المعرض بغية الحصول على جودة الصورة المثلى.
- بإيجاز، بالإضافة إلى برايتفيلد، تنشيط فيتك (الإثارة: 495 نيوتن متر) و Cy3 (الإثارة: 550 نانومتر) خيارات شراء البرمجيات. استخدام 10-50 مللي ثانية للتعرض برايتفيلد 400 مللي ثانية للكشف فلوروفوريس واضغط على زر "حلقة الوقت 1"، للحصول على جولة أخيرة من الصور.
- حدد الخيار الملفات وتصدير البرمجيات وتصدير الصور في "تنسيق ملف صورة ذات علامات" (Tiff) أو تنسيق مجموعة خبراء التصوير (Jpeg) إلى مجلد وجهة محددة مسبقاً.
- تحويل الصور تصديرها إلى تنسيق المطلوب بتتبع البرمجيات: "أداة تعقب"17 (tTt). ولتحقيق ذلك، تعريف الإدخال وإخراج المجلد في "أداة تحويل tTt" التشغيل نافذة، فضلا عن علامات تستخدم للمواقف (س ص) وقنوات (ج)، والنقاط الزمنية (t)، واضغط على زر "تحويل الصور".
ملاحظة: يجب أن يمكن إعادة تسمية الصور وفقا لإعدادات محددة ويجب تخزينها في المجلدات الفردية لكل موقف المستخدمة في التجربة. إرشادات التثبيت، المتطلبات، إعادة تسمية المناصب/الصور، واستخدام أداة التتبع غير متوفرة للتحميل في: https://www.bsse.ethz.ch/csd/software/tTt-and-qtfy.html.
4-وحيد الخلية تتبع
- بعد إعادة تسمية البيانات، قم بتشغيل برنامج tTt. حدد مجلد عمل tTt واسم مستخدم.
ملاحظة: التتبع أداة عمل مجلد ستعقد جميع البيانات تم تحليلها والنتائج التي تم تصديرها. يجب تسمية المجلد work تتيكسبورت، الذي يحتوي على مجلدات فرعية تسمى "أفييكسبورت"، "التكوينات"، "ترييكسبورت"، و "تتفيليس". - حدد التجربة إلى أن يتم تحميل في إطار "التجربة حدد المجلد"، التي تشير إلى مسار المجلد حيث يتم تخزين هذه التجربة، وثم انقر فوق الزر "تحميل التجربة".
- تشغيل المحول ملف السجل لتحويل الصور المحملة بتنسيق يمكن قراءته بواسطة برامج التتبع (لتجارب تحميلها للمرة الأولى، وهذا سيطلب تلقائياً بالبرنامج).
- حدد موضع للتعقب بالنقر فوق الرمز الخاص به (بعد التحويل، لمحة عامة عن المواقف التي سجلت خلال التجارب التي ستعرض في "إطار التخطيط لموقف"). كل موقف وسوف يمثل رمزاً تتألف في صورة الموقف ورقمه المطابق (انظر الشكل 1).
- مرة واحدة قد تم تحديد الموقف ويتم عرض قائمة من الصور المتاحة على الحق في "نافذة تخطيط الموقف"، قم بتحديدها وانقر فوق الزر "تحميل الصور".
- بمجرد اكتمال التحميل، ويظهر "نافذة محرر الخلية"، حدد الأطوال الموجية والفاصل الزمني للصورة ليتم تعقبها في "نافذة محرر الخلية". الطول الموجي 0 يتوافق مع برايتفيلد، 1 يناظر فيتك، 2 إلى Cy3، و 3 إلى DAPI. واستخدمت في التجارب الموضحة هنا، الفاصل الزمني 1، أيجميع الصور المحملة. لتوضيح، يعني فاصل 2 تحميل كل الصورة الثانية.
- بمجرد أن يتم تحميل الصور، انتقل مرة أخرى إلى "إطار تخطيط الموقف" وانقر نقراً مزدوجاً فوق الرمز الذي يمثل الموقف الذي تم تحميله مسبقاً. سوف تظهر "نافذة فيلم" التي تتيح تتبع الخلية الواحدة التي يتعين القيام بها.
- بعد تعليمات "أداة تعقب"، المضي قدما للتعقب. قم بتحديد القناة 0 (يقابل برايتفيلد)، وضبط السطوع والتباين ("ضبط غاما زر"). بدء التتبع عن طريق الضغط على المفتاح F2.
ملاحظة: أثناء تعقب، سيتبع الخلية يتم تعقبها بوضع مؤشر الماوس عليه والضغط على المفتاح "0". انقسام الخلايا والخلايا المبرمج وأزرار الخلية المفقودة متوفرة لرصد هذه الأحداث الخلية المحددة.
5. النتيجة النهائية
- مجرد خلية واحدة تتبع قد اكتملت والذرية، وحدد حفظ التجربة (التبويب نافذة محرر الخلية/ملف/حفظ الشجرة الحالية ك) والشروع في تصدير النتائج.
- تصدير أشجار النسب وبيانات الخلية في "قائمة التصدير" الموجود في "إطار محرر الخلية". وبالمثل، تصدير خلية الصور والأفلام عن طريق "تصدير القائمة" الوصول إليها من خلال "نافذة الفيلم". سيتم تصدير الصور وأشجار النسب، والبيانات، والأفلام إلى المجلد work tTt.
النتائج
تمكن الطريقة الموضحة الأسئلة الحرجة المتعلقة ببيولوجيا الخلية السكان العصبية متعددة يتعين حلها. على سبيل المثال، كان من الممكن رصد تطور نسب العصبية وأوليجوديندروجليوجينيك أنسكس،من78،،من1418. عن طريق تتبع أنسكس واحدة وذرياتهم (الشكل 2 أ، ب)، كان من الممكن إثبات أن أنسكس معزولة في المختبر الحفاظ على طابعها العصبية، معظمها توليد نيوروبلاستس، وأنها تتبع تسلسل اقترح في فيفو19 ولكن لم تكن برهنت على مستوى الخلية الواحدة. وعلاوة على ذلك، يسمح هذا النظام ثقافة الشعب خلية غير متماثل تصور لأول مرة في النسب aNSC من المناطق الاقتصادية الخاصة (الشكل 2)، تقدم نموذجا فريداً لدراسة الأمن القومي الذاتي تجديد8،14. وبالمثل، وبصرف النظر عن النسب تم تحليلها، كان من الممكن الحصول على بيانات قيمة فيما يتعلق بنمو الخلايا، والجولات لشعبة، وبقاء الخلية، أو طول دورة الخلية.
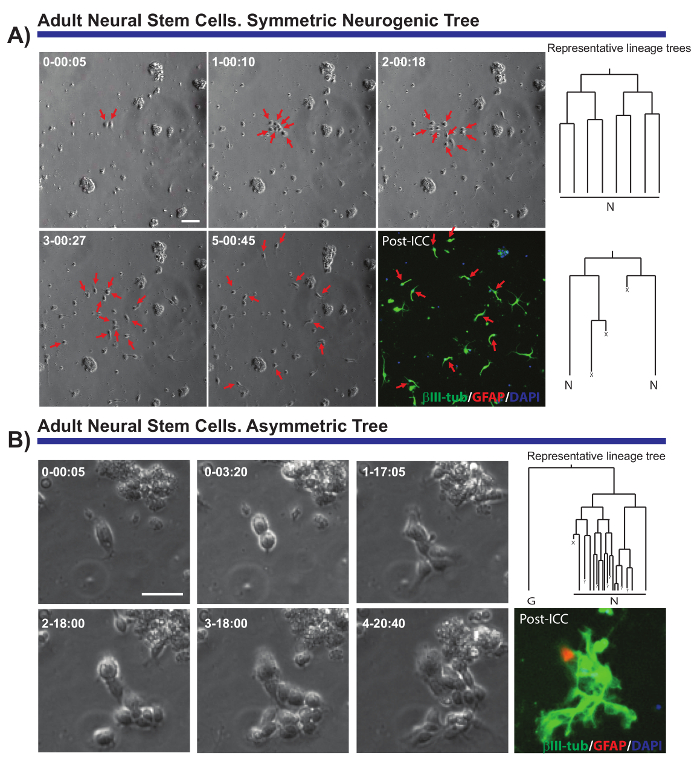
الشكل 2- مثال أنسكس معزولة عن المناطق الاقتصادية الخاصة، وتحليلها بواسطة التصوير الحي وخلية واحدة تتبع. صور التباين المرحلة تصور تقدم الاستنساخ في نقاط زمنية مختلفة (دقيقة اليوم-h:). الصورة النهائية ويناظر إيمونوسيتوتشيميستري بعد انتهاء تصوير (مبادئ العقود التجارية الدولية) الدبقية فيبريلاري الحمضية البروتين (توصيني، الأحمر)، βIII-tubulin (أخضر) و 4 ', 6-دياميدينو-2-فينيليندولي (DAPI، الأزرق). (أ) تحليل متماثل الأشجار العصبية من خلال جولات مختلفة من تضخيم الانقسامات لتوليد neuroblasts الانقسامية بعد. الأسهم الحمراء تشير إلى الخلايا المدرجة في الأشجار متماثل. على اليمين، يتم عرض أشجار النسب المقابلة لاستنساخ والتي تم إنشاؤها بواسطة برنامج tTt. (ب) مثال للسلف توليد شجرة العصبية غير متماثلة، مع فرع واحد يمر الشعب زيادة لإنتاج neuroblasts بينما تثير الأخرى هادئة توصيني الخلايا إيجابية من خلال حدث الذاتي تجديد محتملة. على اليمين، يتم عرض شجرة النسب التي تم إنشاؤها بواسطة برنامج tTt. في جميع أشجار النسب: "N" يصور neuroblasts الانقسامية اللاحقة؛ "G"، هادئة توصيني-إيجابية الخلايا؛ "X"، موت الخلية؛ و "؟" خلية المفقودة. يمثل الشريط مقياس 50 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
يعيش التصوير وخلية واحدة تتبع التحليل أيضا ينص قراءات دقيقة القدرات المهاجرة للسكان العصبية. تم الحصول على هذه المعلومات من أستروسيتيس الدماغ بعد الولادة المقدمة لجرح الصفر مقايسة20، توليد المعلومات فيما يتعلق بمتوسط المسافة سافر من قبل أستروسيتيس عند إغلاق الجرح (الشكل 3). وعلاوة على ذلك، كان من الممكن أن نرى بعض من أستروسيتيس تقسيم أثناء عملية الشفاء، بينما البعض الآخر تتغير طوال التجربة. لافت للنظر، تلك التي قسمت يبدو يحمل سلوك المهاجرة غزير أكثر من نظرائهم من غير تقسيم (السفر مرتين والآن في المتوسط). وتقترح هذه الظاهرة عدم تجانس مثيرة جداً لاهتمام في قدرة أستروسيتيس لتشكيل ندبة على الضرر الذي تم تخفيفه إلى في القراءة لتجربة تحليل نقطة النهاية الكلاسيكية.
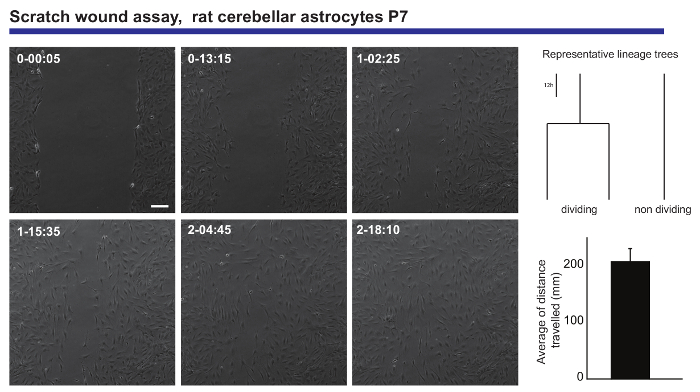
الشكل 3- تحليل سلوك المهاجرة astrocytes الدماغ بعد الولادة في الصفر الجرح المقايسة. مرحلة التباين الصور تصوير الجرح في نقاط زمنية مختلفة (دقيقة اليوم-h:). أشجار النسب، التي تم إنشاؤها بواسطة tTt البرمجيات، توضيح السلوك الممثل، من حيث تقسيم الخلية، أستروسيتيس أثناء إغلاق الجرح. ويبين الرسم البياني متوسط المسافة سافر من قبل astrocytes تحليلها بواسطة خلية واحدة تتبع (يعني ± S.E.M.). يمثل الشريط مقياس 50 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
ميزة أخرى للاهتمام الوقت الفاصل بين تجارب الفيديو-الفحص المجهري هو القدرة على مقارنة الانتشار والتفرقة بين سكان خلية. نحن اختبار خلايا N2a مطلي في ظل الظروف التي تشجع على انتشار (بحضور 10% مصل بقرى الجنين (FBS)) أو التفريق (حضور 0.5% FBS + حمض اراسيدونيك 10 ميكرومتر). كان من الممكن لمتابعة تطور نسب هذه الخلايا تحت ظروف التكاثري (الشكل 4A)، بينما لا تتكاثر خلايا مميزة، وأنها تشكل نيوريتيس (الشكل 4 باء). بشكل ملحوظ، يسمح وحيد الخلية تتبع المستعمرات مع مختلف انتشار القدرات أن تكون متميزة واستطالة نيوريتي (وتراجع) تقييمها، توفير بيانات دقيقة والكمية التي يمكن تصديرها في وقت لاحق.
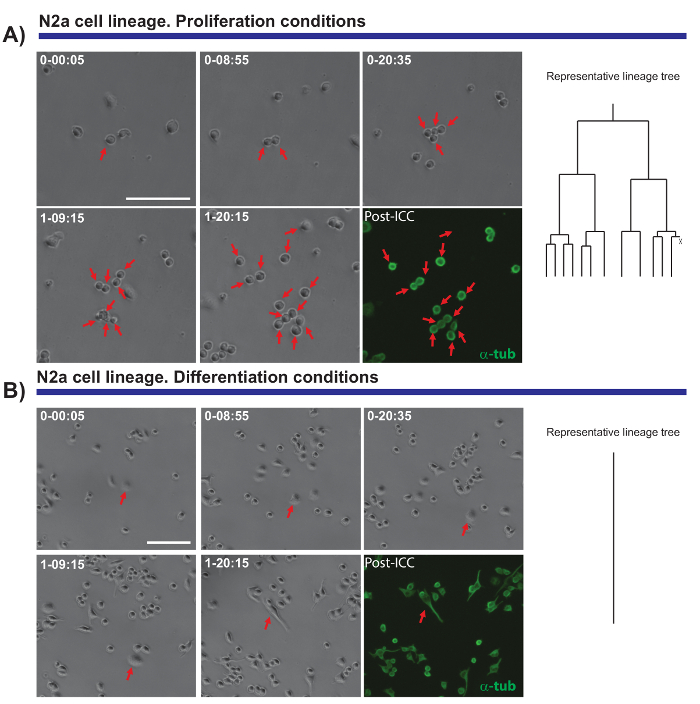
الشكل 4- رصد N2a بيولوجيا الخلية في انتشار (A) أو التمييز بين الشروط (ب). مرحلة التباين الصور تصور تقدم الاستنساخ في نقاط زمنية مختلفة (دقيقة اليوم-h:). يتوافق مع الصورة النهائية لتصوير ما بعد إيمونوسيتوتشيميستري (مبادئ العقود التجارية الدولية) ل α-tubulin (أخضر). خلية مفردة (أ) تتبع يسمح بجولات للشعبة التي يتعين رصدها، فضلا عن عدم تجانس في الاستجابة التكاثري من خلايا مختلفة. على اليمين، يوضح شجرة النسب التي تم إنشاؤها بواسطة برنامج tTt السلوك التكاثري N2a الخلايا. إنهاء دورة الخلية خلايا (ب) ظروف التمايز وتوليد نيوريتيس، عملية التي يمكن أن تقاس فعالية بتحليل ما بعد التصوير. واحدة تتبع الخلية، ممثلة بشجرة النسب على الحق، ويوضح كيف الخلايا N2a إنهاء دورة الخلية ووقف انقسام الخلايا تحت ظروف التمايز. يمثل الشريط مقياس 50 ميكرومتر.الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
أخيرا، تعيش التصوير وخلية واحدة تتبع مفيد للغاية لرصد التغيرات المورفولوجية والجزيئية عندما تقدم إلى إعادة برمجة الخلايا. تصوير مباشر من بعد الولادة أستروسيتيس ترانسدوسيد مع هومولوج أشعت-ترس 1 (Ascl1) يوفر بيانات قيمة فيما يتعلق بالتغييرات الشكلية التي تحدث أثناء إعادة برمجة أو الانسداد لانقسام الخلية عندما يجري astrocytes أعيدت برمجتها (انظر الشكل 5). وعلاوة على ذلك، عند توصيل Ascl1 يقترن بتوصيل بنية الترميز للبروتينات الفلورية الخضراء (بروتينات فلورية خضراء) تحت سيطرة المروج كورتن مزدوجة (DCX)، من الممكن تحديد النقطة الزمنية الدقيقة عند العصبية علامات محددة يبدأ بالتعبير عنها في الخلايا أعيدت برمجتها (الشكل 5). كما يسمح مجهرية الفيديو الوقت الفاصل بين عدد الخلايا التي تكمل بنجاح إعادة برمجة ليكون كمياً ومقارنة بالخلايا التي تموت أثناء هذه العملية. رصد مثل هذه الأحداث أدت إلى تحديد حاسم "نقاط التفتيش" في الخلايا التي أعيدت برمجتها بنجاح9.
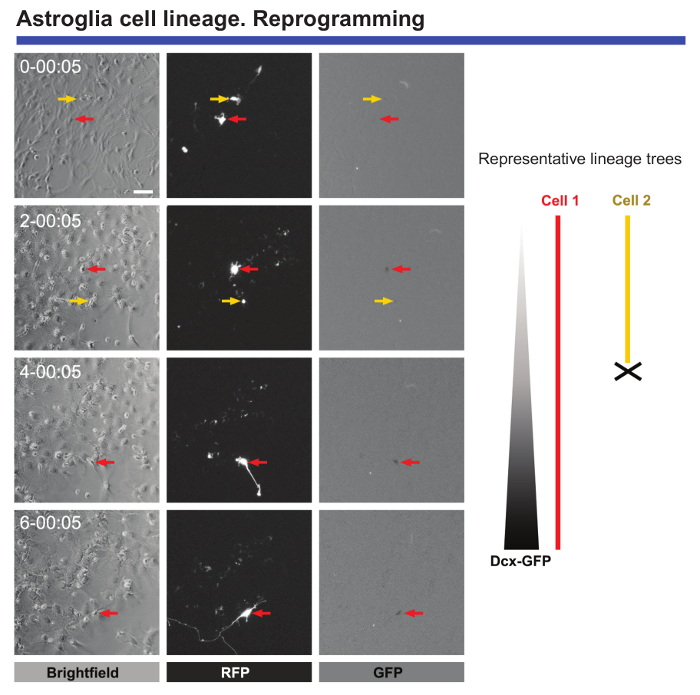
الشكل 5- تحليل astrocytes القشرية بعد الولادة يتعرض لإعادة برمجة الخلايا العصبية. إعادة برمجة حملت بتوصيل مع نواقل البروتين (RFP) Fluorescence الأحمر Ascl1 برو--العصبية. تم تحويل الخلايا العصبية تحت إشراف توصيل المشارك مع ناقل ترميز بروتينات فلورية خضراء تحت سيطرة أحد المروجين DCX. تظهر الصور التباين مرحلة التقدم لإعادة برمجة في نقاط زمنية مختلفة (دقيقة اليوم-h:). صور fluorescence التعبير طلبات تقديم العروض والتجارة والنقل، على التوالي. يعيش التصوير ويسمح وحيد الخلية تتبع الأحداث الحاسمة الواجب اتباعها، مثل التغييرات الشكلية، عدم وجود انقسام الخلايا أثناء إعادة برمجة، موت الخلية، ويمكن تعريفها بدقة الوقت عندما تبدأ الخلايا أعيدت برمجتها للتعبير عن علامات العصبية . يمثل الشريط مقياس 80 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
واحدة من أهم القيم من تصوير مباشر هو إمكانية القيام بتتبع نسب دقيقة، توضيح الجوانب الحرجة لتطور النسب في عدد سكان العصبية. يعرف بأنه تحديد النسب تعقب ورصد جميع ذرية من السلف مفردة، من مؤسس الاستنساخ لاستنساخ اللاحقة شكلت21. بشكل ملحوظ، الطرق البديلة المستخدمة للنسب التتبع (مثلاً، وتوصيل الفيروسية أو مراسل متعدد الألوان بنيات21) قد عيب حرجة، حيث يستند النتيجة النهائية ما زالت الصور وأنه لا بالضرورة وتشكل سلسلة كاملة. وهذا يعني أن موت الخلية، التباين في سلوك السكان الخلية، وتمييع، كفاءة نشر أو الفقيرة من العلامات، جنبا إلى جنب مع عوائق هامة أخرى، يؤدي إلى read-outs غير مكتملة أو غير صحيحة ل نتائج2. وعلاوة على ذلك، يتيح تصوير يعيش الباحث لتحليل السمات الهامة لبيولوجيا العصبية من السكان، مثل أسلوب وتوقيت انقسام الخلايا ونمو الخلايا، والهجرة وانتشار مقابل التمايز، ومدة دورة الخلية، نيوريتي تشكيل والتعقيد والطول، خلية تحديد مصير (التمايز)، أو التحويل (إعادة برمجة).
وبالإضافة إلى ذلك، يمكن أن تستكمل تصوير مباشر بسهولة مع التحليلات الأخرى تهدف إلى الحصول على بيانات من خلايا مفردة مثل، على سبيل المثال، تسلسل الحمض النووي الريبي. ومع ذلك، تحقيق الفائدة المشتركة من التصوير الحي وغيرها من التقنيات تتطلب تلك الخلايا التي سبق رصدها في الأفلام في وقت لاحق إعادة تحديد والتي جمعت على حدة للتحليل الثانوي. يمكن تحقيق ذلك باستخدام المجاهر التي تتضمن الإحداثيات الموضعية، بتطبيق الصحفيين الفلورسنت لخلايا معينة أو بتحليل توزيع مجموعات من الخلايا كمراجع. في الواقع، المزيج من التشكيل الجانبي الترنسكربيتوم وسلوك الخلايا الفردية قد تمثل طريقا قوية توضيح الرموز الجزيئية الجديدة تشارك في بيولوجيا الخلايا.
واحدة من المشاكل الرئيسية التي يمكن أن تنال من تجربة تصوير الحي بكثافة ثقافة خلية غير كافية. كما ذكر سابقا، في كثافة عالية الفائض من الحطام أو الانفصال الفقراء (تشكيل أجمة) قد تؤثر على نوعية والقرار المكانية للصور، مما يجعل تعقب خلية مفردة غير مجد. ولذلك، ينبغي تعديل ظروف السكان خلية متميزة تحت الدراسة بأقل عدد من الخلايا ممكن دون المساس باستمرارية ثقافة الخلية.
تكرار الحصول على الصور هي أيضا حاسمة وينبغي تعديلها بعناية، خاصة عندما يتم استخدام الإضاءة الفلورية. الإفراط في التعرض لإرسالها، ولا سيما الأسفار الضوء قد يعرض للخطر بقاء الخلية. بدلاً من ذلك، قد تتداخل تأخير زائد بين التقاط الصور مع القرار الزمني للتحليل.
خطوة حاسمة أخرى خلال التجربة الحية بالتصوير هو التعديل الدوري للتركيز. فشل في تصحيح الإعداد/إعادة-ستينغ من البعد البؤري قد يعيق تعقب خلية مفردة. وعلاوة على ذلك، من الضروري أن تحقق بعناية أن غرفة الحضانة يحافظ على درجة الحرارة المناسبة، والرطوبة، ومستويات2 CO، تعديل التغيرات غير المرغوب فيها التي قد تسبب موت الخلايا.
أخيرا، متى تم أداؤه مبادئ العقود التجارية الدولية، من المهم لاسترداد موضع xyz صفر قبل الجولة الأخيرة من الحصول على الصور بشكل صحيح. غير صحيحة إعادة تحديد xyz موضع صفر سوف تجعل من الصعب على تطابق الصور والمرحلة-على النقيض من الفلورة، إعاقة تحديد النسل الخلية.
على الرغم من أن هذا النهج له جوانب إيجابية كثيرة، ما زالت هناك بعض القيود لتصوير يعيش السكان العصبية. على سبيل المثال، الخلية منخفضة الكثافة المطلوبة للقيام بتعقب خلية واحدة ناجحة من أنسكس يجعل من المستحيل على توظيف فحوصات الكيمياء الحيوية، مثل الغربية النشاف14. بالإضافة إلى ذلك، رصد سريع تقسيم السكان مثل astrocytes الدماغ أو خلايا N2a مقيد وقتيا، غالباً ما يصعب جداً لتعقب الخلايا بالقرب من التقاء الثقافات. علاوة على ذلك، العديد من أساليب الثقافة، فضلا عن القيود المتأصلة البيولوجية المرتبطة بعزل الخلايا، غالباً ما يعرض للخطر بقاء الخلية على مدى فترات طويلة، تحد مدة تجارب التصوير الحي. وأخيراً، عزل الخلايا من بيئتها الطبيعية قد آثار إيجابية وسلبية على حد سواء. قد تفشل الخلايا المعزولة من مكانها الفسيولوجية لتلقي الإشارات الهامة التي تعدل سلوكها، في الوقت نفسه، فإنه يمثل وسيلة قوية اختبار تأثير تلك الإشارات على حدة في تطور النسب الخاصة بالعصبية والسكان.
ونظرا للقيود المذكورة أعلاه، فمن الواضح أن السيناريو منهجية مثالية القيام بتجارب تتبع الخلية التصوير وواحد يعيش تحت ظروف فيزيولوجية طبيعية في فيفو. التقنيات الحالية غير قادر على متابعة الخلايا المفردة لفترات طويلة من الزمن في المناطق العميقة من الدماغ2. ولذلك، ينبغي أن تركز مستقبل التصوير الحي على التغلب على هذا التحديد، تهدف إلى تحليل الكامل بيولوجيا الخلية من الخلايا المفردة في فيفو مع احتمال التدخل الأكثر بسيطة من البيئة الفسيولوجية3.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
ونحن نشكر جاسكون بياتريس لعملها المساعدة والفن في الشكل 1. كما نشكر الدكتور جيم نوريس لمساعدته. الأعمال المعروضة هنا أيد منح البحوث، "اكسسيلينسيا دي الأحمر مبادرة تدعيم إنجينيو الإسبانية أيون قناة" (BFU2015-70067REDC)، وزارة التعليم والعلوم (BFU2014-53654-P) وبرادي-سم (S2013/الجليد-2958)، UCM-سانتاندر (PR26/16-18 باء-3) ومؤسسة رامون برنامج منح أريسيس (PR2018/16-02). فيليبي اورتيجا تسلم y رامون كاجال برنامج وزارة الاقتصاد الإسبانية والقدرة التنافسية (MEC: تأهيل-2013-13290).
Materials
| Name | Company | Catalog Number | Comments |
| Poly-D-lysine | Sigma | P0899 | Working solution 0.02 mg mL-1 |
| 24 wells plate | Falcon | 352047 | |
| Dulbecco’s modified Eagle’s medium (DMEM): F12 Nutrient Mixture medium (-L Glutamine) | Invitrogen | 21331-020 | |
| DMEM High Glucose medium | Sigma | D6546 | |
| Bovine Serum Albumin | Sigma | A6003 | |
| Triton X-100 | Merck | 11869 | non-ionic surfactant |
| Mouse anti-β III Tubulin | Sigma | T8660 | |
| Rabbit anti-GFAP | DakoCytomation | Z0334 | |
| Mouse anti-α Tubulin | Sigma | T5168 | |
| Anti-Mouse FITC | Jackson Laboratories | 715-095-150 | |
| Anti-Rabbit Cy3 | Jackson Laboratories | 711-165-152 | |
| Brightfield/Phase contrast/fluoresence microscope | Nikon | TE-2000-E | |
| CFI PLAN FLUOR DLLL 10X objetives | Nikon | Ref 280MRH10101 | |
| CFI SUPER PLAN FLUOR ELWD AMD 20X objetives | Nikon | Ref 280MRH48230 | |
| pE-300 LED fluorescence | Cool LED | Ref Number 1981 | |
| 310M-201 Incubation system (temperature) | OKO-Lab | Serial Nº VOF007307 | |
| Pro-ScanII Motorized stage system | Prior | Serial Nº 60018 | |
| High precision microscope camera version 4.2 | ANDOR Zyla | VSC-03650 | |
| Specifc software for live imaging with timelapse module: NIS-Elements AR4.5 | Nikon | NIS-Elements AR4.5 -Hasp ID: 13CE819E | |
| OKO touch Incubation system (CO2) | OKO-lab | Serial number 1716 | |
| Murine Neuro-2a Neuroblastoma Cell line | ATCC | ATCCCCL131 | |
| HEPES buffer solution 1 M | Invitrogen | 15630-056 |
References
- Conklin, E. G. The Mutation Theory From the Standpoint of Cytology. Science. 21 (536), 525-529 (1905).
- Ortega, F., Costa, M. R. Live Imaging of Adult Neural Stem Cells in Rodents. Front Neurosci. 10, 78 (2016).
- Skylaki, S., Hilsenbeck, O., Schroeder, T. Challenges in long-term imaging and quantification of single-cell dynamics. Nat Biotechnol. 34 (11), 1137-1144 (2016).
- Schroeder, T. Tracking hematopoiesis at the single cell level. Ann N Y Acad Sci. 1044, 201-209 (2005).
- Schroeder, T. Imaging stem-cell-driven regeneration in mammals. Nature. 453 (7193), 345-351 (2008).
- Etzrodt, M., Endele, M., Schroeder, T. Quantitative single-cell approaches to stem cell research. Cell Stem Cell. 15 (5), 546-558 (2014).
- Ortega, F., et al. Oligodendrogliogenic and neurogenic adult subependymal zone neural stem cells constitute distinct lineages and exhibit differential responsiveness to Wnt signalling. Nat Cell Biol. 15 (6), 602-613 (2013).
- Costa, M. R., et al. Continuous live imaging of adult neural stem cell division and lineage progression in vitro. Development. 138 (6), 1057-1068 (2011).
- Gascon, S., et al. Identification and Successful Negotiation of a Metabolic Checkpoint in Direct Neuronal Reprogramming. Cell Stem Cell. 18 (3), 396-409 (2016).
- Karow, M., et al. Reprogramming of pericyte-derived cells of the adult human brain into induced neuronal cells. Cell Stem Cell. 11 (4), 471-476 (2012).
- Kleiderman, S., et al. Conversion of Nonproliferating Astrocytes into Neurogenic Neural Stem Cells: Control by FGF2 and Interferon-gamma. Stem Cells. 34 (12), 2861-2874 (2016).
- Bunk, E. C., et al. Prox1 Is Required for Oligodendrocyte Cell Identity in Adult Neural Stem Cells of the Subventricular Zone. Stem Cells. 34 (8), 2115-2129 (2016).
- Aravantinou-Fatorou, K., et al. CEND1 and NEUROGENIN2 Reprogram Mouse Astrocytes and Embryonic Fibroblasts to Induced Neural Precursors and Differentiated Neurons. Stem Cell Reports. 5 (3), 405-418 (2015).
- Ortega, F., et al. Using an adherent cell culture of the mouse subependymal zone to study the behavior of adult neural stem cells on a single-cell level. Nat Protoc. 6 (12), 1847-1859 (2011).
- Heinrich, C., et al. Generation of subtype-specific neurons from postnatal astroglia of the mouse cerebral cortex. Nat Protoc. 6 (2), 214-228 (2011).
- Jimenez, A. I., et al. Potentiation of ATP calcium responses by A2B receptor stimulation and other signals coupled to Gs proteins in type-1 cerebellar astrocytes. Glia. 26 (2), 119-128 (1999).
- Hilsenbeck, O., et al. Software tools for single-cell tracking and quantification of cellular and molecular properties. Nat Biotechnol. 34 (7), 703-706 (2016).
- Ortega, F., Berninger, B., Costa, M. R. Primary culture and live imaging of adult neural stem cells and their progeny. Methods Mol Biol. 1052, 1-11 (2013).
- Kriegstein, A., Alvarez-Buylla, A. The glial nature of embryonic and adult neural stem cells. Annu Rev Neurosci. 32, 149-184 (2009).
- Yu, A. C., Lee, Y. L., Eng, L. F. Astrogliosis in culture: I. The model and the effect of antisense oligonucleotides on glial fibrillary acidic protein synthesis. J Neurosci Res. 34 (3), 295-303 (1993).
- Kretzschmar, K., Watt, F. M. Lineage tracing. Cell. 148 (1-2), 33-45 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved