A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تقييم أضرار الحمض النووي في المختبر باستخدام مقايسة المذنب
In This Article
Summary
مقايسة المذنب طريقة فعالة للكشف عن وقوع أضرار الحمض النووي بما في ذلك الحمض النووي مفرد، ومزدوج-الذين تقطعت بهم السبل. يصف لنا فحوصات المذنب القلوية ومحايدة لقياس الأضرار الحمض النووي في الخلايا السرطانية لتقييم التأثير العلاجي للعلاج الكيميائي.
Abstract
أضرار الحمض النووي هو ظاهرة شائعة لكل خلية أثناء به العمر، ويعرف بأنه تغيير التركيب الكيميائي للحمض النووي. علاجات السرطان، مثل الإذاعة والعلاج الكيميائي، إدخال كمية هائلة من المزيد من الضرر الحمض النووي، مما أدى إلى توقيف دورة الخلية والمبرمج للحد من تطور السرطان. التقييم الكمي للأضرار الحمض النووي أثناء علاج السرطان التجريبية خطوة رئيسية لتبرير فعالية عامل سمية جينية. في هذه الدراسة، علينا أن نركز على خلية مفردة التفريد مقايسة، المعروف أيضا مقايسة المذنب، التي يمكن قياس واحد ويكسر مزدوجة-حبلا الحمض النووي في المختبر. مقايسة المذنب هو أسلوب القياس الكمي تلف الحمض النووي التي تتسم بالكفاءة ومن السهل القيام به، وانخفاض الوقت/الميزانية المطالب وإمكانية تكرار نتائج عالية. هنا، نحن تسليط الضوء على فائدة مقايسة المذنب لدراسة السريرية بتقييم تأثير سمية جينية للعلاج المركب أولاباريب/تيموزولوميدي إلى U251 الدبقي الخلايا.
Introduction
مقايسة المذنب تضعها لأول مرة قبل أوستلينج وجوهانسون في عام 1984 مما يدل على الهجرة من الحمض النووي وشظايا من الأنوية تحت شرط الحياد1. التقنية وضعت في وقت لاحق سينغ وآخرون، تبين أن شرط قلوية ازدادت كثيرا بخصوصية وإمكانية تكرار نتائج التحليل2. ومنذ ذلك الحين، مقايسة المذنب محايدة غالباً ما يستخدم للكشف عن فواصل الحمض النووي المزدوج-الذين تقطعت بهم السبل، بينما مزدوجة حبلا الحمض النووي فواصل، مواقع مجا القلوي، والحمض النووي DNA ومقايسة المذنب القلوية أكثر حساسية لكميات أصغر من ضرر الحمض النووي، بما في ذلك واحد أو الحمض النووي-البروتين العابرة للربط، وفواصل واحد-حبلا الحمض النووي المرتبطة بختان الإناث غير مكتملة إصلاح مواقع3،4. كلا فحوصات السماح التصور للحمض النووي مجزأة، وتوفر طريقة مباشرة لتقييم كمي تلف الحمض النووي. يعتبر أسلوب حساسة للدراسات السمية الجينية في المختبر و في فيفو مقايسة المذنب وتنطبق على مجالات بحثية مختلفة، مثل المخدرات-مرشح الاختيار المبكر والرصد البيئي والرصد البيولوجي البشري، والحريات الأساسية، البحث في ضرر الحمض النووي، وإصلاح5.
مبدأ المقايسة هو أن الحمض النووي مجزأة تحت مجال الكهربائي، يهاجر خارج الجسم نوكليويد (يعرف أيضا باسم "رأس المذنب") وتشكل وصمة عار الحمض النووي في [اغروس] هلام (يعرف أيضا باسم "ذيل المذنب"). مع تلطيخ النوكليوتيدات، يمكن قياسها كمياً مدى الضرر الحمض النووي من خلال تحليل "المذنبات" التي شكلتها هذا التفريد خلية مفردة. كذلك يمكن أن يساعد حساب لحظة الذيل مقارنة أضرار الحمض النووي من بين المجموعات التجريبية المختلفة. بالمقارنة مع الأساليب التقليدية للكشف عن تلف الحمض النووي، مقايسة المذنب المباشر وحساسة وغير مكلفة وبسيطة نسبيا.
العلاج الإشعاعي وتشيموثيرابيس، استراتيجيات مشتركة لعلاج السرطان عن طريق توليد جديلة واحدة والحمض النووي المزدوج حبلا فواصل في الكروموسومات6. التقدم الأخيرة في مثبطات إصلاح الحمض النووي يسمح له آثار سمية جينية أكثر فعالية عن طريق الجمع بين العلاج الكيميائي، وذلك، يحتمل أن يقلل من الآثار الجانبية الجهازية مثل الإصابة بفقر الدم ونخاع العظام قمع7، 8-في هذه الدراسة، ونحن أظهر التحقيق مثبط بوليميراز (تسنى) بولي (ADP-ريبوز)، أولاباريب (علا)9. تسنى بروتين النووي وفيرة وهي المسؤولة عن إصلاح الختان قاعدة الحمض النووي عن طريق تشكيل بوليمر بولي (ADP-ريبوز)10. Temozolomide (زد) هو عامل alkylating متاحة شفويا وقد استخدمت على نطاق واسع لمعالجة المرضى الدبقي. باستخدام مقايسة المذنب للتحديد الكمي للأضرار الحمض النووي، ونحن تثبت أن الجمع بين أولاباريب تيموزولوميدي عميقا يعزز تلف الحمض النووي في الخلايا الدبقي، مما يوحي بتركيبة أولاباريب/تيموزولوميدي العلاج استراتيجية فعالة لعلاج الدبقي، مقارنة مع تيموزولوميدي وحدها11.
Protocol
1-"تحضير الكواشف"
- تمييع PBS 10 x 100 مل مع مل 900 dH 2 س 1 x PBS
- وضبط ال pH إلى 7.4 باستخدام مقياس الأس الهيدروجيني. تخزين في درجة حرارة الغرفة-
- تحلل الحل (LS)
- إعداد 2.5 م كلوريد الصوديوم، يدتا ثنائية الصوديوم 100 مم وقاعدة تريس 10 ملم ومم هيدروكسيد الصوديوم 200 مل 900 dH 2 س؛ ويستغرق عادة حوالي 20 دقيقة للسماح الخليط بالكامل حل. قم بضبط درجة الحموضة إلى 10 باستخدام مقياس الأس الهيدروجيني. إضافة ساركوسيناتي سولفات الصوديوم 1% و 1% X-100 تريتون، وضبط وحدة التخزين النهائي لمل 1,000. كول إلى 4 درجات مئوية على الأقل 30 دقيقة قبل الاستخدام.
- الحل التفريد القلوية (AES)، ودرجة الحموضة > 13
- إعداد 200 ملم ثنائي هيدروكسيد الصوديوم و 1 مم يدتا في مل 800 dH 2 O. ضبط درجة الحموضة وتأكد من أن الرقم الهيدروجيني > 13. ضبط وحدة التخزين النهائي لمل 1,000. جعل الطازجة قبل الاستخدام وباردة إلى 4 درجات مئوية على الأقل 30 دقيقة قبل الاستخدام.
- سولوشن التفريد محايدة (متنوعة)
- 1,000 إعداد مل التفريد محايدة المخزن المؤقت عن طريق خلط 100 ملم خلات الصوديوم 300 ملم وقاعدة تريس لمل 1,000 dH 2 O. ضبط درجة الحموضة إلى 9.0 مع حمض الخليك الجليدية. كول إلى 4 درجات مئوية على الأقل 30 دقيقة قبل الاستخدام.
- الحل ترسيب الحمض النووي (DPS)
- إعداد المخزون خلات الأمونيوم 7.5 م 10 مل. 50 مل من الحمض النووي هطول الأمطار الحل، مزيج من خلات الأمونيوم 7.5 M مل 6.7 مع الإيثانول 95% 43.3 مل. تخزين في درجة حرارة الغرفة-
- الحل ستاينينج
- إضافة 1 ميليلتر 10,000 x وصمة عار الحمض النووي الفلورية الخضراء (مثلاً، سيبر الأخضر) في 30 مل تريس يدتا المخزن المؤقت (10 ملم تريس-HCl، يدتا ثنائية الصوديوم 1 مم، الرقم الهيدروجيني 7.4) ومخزن في 4 درجة حماية جيم من النور-
- ذوبان منخفضة 1% [اغروس]
- ذوبان منخفضة 1% يذوب [اغروس] نقطة (ز 1 في 100 مل dH 2 س) في فرن ميكروويف. دوامة [اغروس] كل 15-20 ثانية للتأكد من أن [اغروس] تماما المنصهر. ضع [اغروس] في حمام الماء 37 درجة مئوية على الأقل 20 دقيقة قبل الاستخدام.
- نصائح ماصة الحارة قبل
- قطع غايات ضيقة من نصائح ماصة P200 3 مم والحارة في 37 درجة مئوية قبل بيبيتينج [اغروس]-
2. إعداد "شرائح المذنب"
- الشريحة طلاء
- تذوب 1% [اغروس] (ز 1 في 100 مل dH 2 س) في فرن ميكروويف لمدة 2-3 دقيقة أو حتى [اغروس] تماما المنصهر. تراجع الشرائح مجهر الزجاج إلى [اغروس] والقضاء على جانب واحد من الشريحة باستخدام مسح خالية من الوبر.
- وضع الشرائح على سطح مستو أيردري أو للحرارة عند 50 درجة مئوية للتجفيف أسرع؛ وينبغي تشكيل فيلم شفافة [اغروس] بعد التجفيف. ضع الشرائح المغلفة في 37 درجة مئوية قبل الاستخدام.
- إعداد تعليق خلية مفردة
- الثقافة وعلاج الخلية الدبقي
- ثقافة الخلايا ملغ U251 في F-12 دميم-هام المتوسطة وتستكمل مع 10% FBS و 100 يو/مليلتر البنسلين والستربتوميسين ميكروغرام/مل 10 في 37 & # 176؛ ج مع شركة 5% 2-
- هضم الخلايا باستخدام التربسين 1 مل لمدة 3 دقائق، وتحييد التربسين استخدام المتوسطة F-12 دميم-هام مع FBS. جمع في أنبوب 15 مل، تدور في 300 غ x دقيقة 4 ونضح على المديين المتوسط وتعليق الخلايا في 2 × 10 5 خلية/مل في برنامج تلفزيوني 1 س.
ملاحظة: ينبغي إعداد نموذج الخلية مباشرة قبل البدء التحليل، وينبغي التعامل مع جميع العينات في بيئة مظلمة أو معتمة لمنع تلف الحمض النووي من الضوء. - الجمع بين تعليق خلية مع 1% المنصهر نقطة انصهار منخفضة [اغروس] (عند 37 درجة مئوية) بنسبة 01:10 (v/v) وتخلط بلطف من بيبيتينج صعودا وهبوطاً، وفورا "الماصة؛" 30 ميليلتر إلى شريحة. استخدام الجانب من تلميح ماصة لنشر الخليط [اغروس]/خلية لضمان تشكيل طبقة رقيقة.
- مكان الشريحة شقة في 4 درجات مئوية في الظلام 10 دقيقة زيادة وقت 30 دقيقة التبلور يحسن تقيد عينات في بيئات مرتفعة الرطوبة.
- تزج الشريحة في 4 درجات مئوية LS في الظلام ل 1 (ح) بين عشية وضحاها.
- الثقافة وعلاج الخلية الدبقي
3. واحد "التفريد خلية"
- المضي قدما إلى القلوية (الخطوة رقم 3.2) أو المذنب المحايدة (الخطوة 3، 3) الاعتداء
- مقايسة المذنب القلوية
- إزالة الشرائح بلطف من ليرة سورية واستنزاف فائض المخزن المؤقت وتزج برفق في الخدمات المعمارية والهندسية ح 1 في 4 درجة مئوية للسماح بتفكيك الحمض النووي. تبقى الشرائح في الظلام-
- AES يبرد قبل إضافة في علبة الشريحة التفريد، لا تتجاوز 0.5 سم فوق الشرائح (وهذا يعتمد على حجم الوحدات التفريد)، وضع الشرائح داخل وتغطية بحد أقصى. تعيين الجهد إمدادات الطاقة إلى 1 V/سم (الطول بين أقطاب) وتشغيل لمدة 30 دقيقة في 4 ° C.
- استنزاف الحل الكهربي الزائد من الشريحة. تزج بلطف الشرائح مرتين في dH 2 س ل 5 دقائق في درجة حرارة الغرفة-
- تزج بلطف الشرائح في الإيثانول 70% لمدة 5 دقائق في درجة حرارة الغرفة. انتقل إلى الخطوة 4.
- مقايسة المذنب محايدة
- إزالة الشرائح برفق من LS واستنزاف فائض المخزن المؤقت، وتزج برفق في الدائرة الوطنية للتوظيف لمدة 30 دقيقة في 4 ° جيم تبقى الشريحة في الظلام-
- إضافة التفريد محايدة مبردة قبل المخزن المؤقت في علبة الشريحة التفريد، لا تتجاوز 0.5 سم فوق الشرائح (وهذا يعتمد على حجم الوحدات التفريد)، وضع الشرائح داخل وتغطية بحد أقصى. تعيين الجهد إمدادات الطاقة إلى 1 V/سم (الطول بين أقطاب) وتشغيلها لمدة 45 دقيقة في 4 ° C.
- استنزاف فائض المخزن المؤقت من الشرائح. تزج بلطف الشرائح في توزيعات أرباح لمدة 30 دقيقة في درجة حرارة الغرفة-
- تزج بلطف الشرائح في الإيثانول 70% لمدة 30 دقيقة في درجة حرارة الغرفة. انتقل إلى الخطوة 4.
4. وصمة عار "الشرائح المذنب"
- الجاف للشرائح في 37 درجة مئوية لمدة 10-15 دقيقة في الظلام-
- المجففة مكان 50-100 ميليلتر أخضر نيون الحمض النووي تلطيخ محلول على كل [اغروس] ووصمة عار لمدة 15 دقيقة في درجة حرارة الغرفة في الظلام- شطف الشرائح بإيجاز في dH 2 س
- وجاف تماما عند 37 درجة مئوية في الظلام. المضي قدما للحصول على الصور والتحليل-
5. صورة اقتناء وتحليل
ملاحظة: التصور والتقدير الكمي للدنا فواصل تستند ابيفلوريسسينسي المجهري والبرمجيات مقايسة المذنب (انظر الجدول للمواد) 12 .
- بوضع الشرائح في المجهر مع حامل شريحة. كفالة [اغروس] هلام تواجه عدسة الهدف. التقاط الصور من الشرائح المذنب ملطخة باستخدام مجهر الأسفار مع عدسة هدف 10 x عشوائياً. تجنب الحواف والمناطق المحيطة بأي فقاعات الهواء-
- ضمان أفقياً توزع كل ذيل المذنب. رؤساء المذنب ينبغي أن تنبع من الذيل من اليمين واليسار-
- حفظ كل صورة في تنسيق TIF ثنائي مع مشرق الحمض النووي وصمة عار وخلفية داكنة. تحميل الصور باستخدام البرمجيات " حدد ملفات لتحليل " زر، الذي يقع على الجانب الأيمن من شريط الأدوات. يجب أن تظهر نافذة عرض صورة ( الشكل 1).
- رسم إطار قياس على الشاشة وضبط حجمه وفقا مذنب الخلية. انقر فوق " ضبط " الزر لإعداد العتبة للرأس، والمذنب، والذيل وفقا للصورة، ثم انقر فوق " بدء القياسات " زر ( الشكل 1).
- حدد خلية باستخدام الإطار وتنشيط القياس عن طريق النقر بالماوس على " الاعتداء المذنب " زر؛ وكثافة الصورة التي تظهر على " ملامح " النافذة مع معلمات القياس المحدد. يمكن حفظ النتائج بالنقر " تخزين النتيجة " زر ( الشكل 1).
ملاحظة: يحسب البرنامج المعلمات بما في ذلك طول ذيل المذنب، النسبة المئوية للحمض النووي الذيل، لحظة الذيل (TM) ولحظة ذيل الزيتون (اطم). لحظات الذيل يتم حسابها بواسطة الصيغ كما يلي:

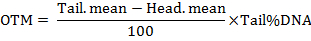
- تحليل خلايا على الأقل 50 كل العلاج.
النتائج
ويصف هذا البروتوكول سير عمل خطوة بخطوة لتنفيذ المقايسة المذنب وتحليل البيانات (الشكل 1). وأظهرت النتائج من فحوصات المذنب القلوية ومحايدة أن ذيل المذنب من الخلايا U251 معاملة ميتوتريكسات (1 ميكرومتر، ح 20) كان أطول وأعلى كثافة الحمض النووي، مما يوحي تراكم كبير...
Discussion
مقايسة المذنب أداة فعالة لقياس مفردة ومزدوجة-حبلا فواصل الحمض النووي على المستوى الخلوي. الإنزيم طبق على نطاق واسع ك "معيار ذهبي" في الدراسات بشأن السمية الجينية والرصد البيولوجي13، بدءاً من آفات قاعدة، كروسلينكس الحمض النووي وتطوير العقاقير والمواقع الحساسة القلوي. في هذه ا?...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
وأيد هذا البحث "برنامج البحوث الداخلية" للمعاهد الوطنية للصحة ولجنة التحقيق الوطنية، ومركز الحقوق الدستورية. وتلقى جميع المؤلفين "منحة بحثية داخلية" من المعاهد الوطنية للصحة، ولجنة التحقيق الوطنية، ومركز الحقوق الدستورية.
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 10x PBS(Ca++, Mg++ free) | TEKnova | P0196 | |
| NaCl | Sigma | S5886 | |
| EDTA | TEKnova | E0308 | |
| Trizma base | Sigma | T1503 | |
| NaOH | Sigma | 72068 | |
| Sodium lauryl sarcosinate | Sigma | L7414 | |
| Triton X-100 | Sigma | 93443 | |
| Sodium acetate | Sigma | 32318 | |
| Glacial acetic acid | Sigma | 695092 | |
| Ammonium acetate | Sigma | A1542 | |
| SYBR Green | Invitrogen | S33102 | |
| Low melting point agarose | Invitrogen | 16520 | |
| Agarose | Invitrogen | 16500 | |
| 95% ethanol | WARNER-GRAHAM | #64-17-5 | |
| Trypsin | GIBICO | 25300-054 | |
| Name | Company | Catalog Number | Comments |
| Consumables | |||
| Glass tissue slides | ELECTRON MICROSCOPY SCIENCES | 63422-11 | |
| Kimwipes | KIMberly-Clark | ||
| 1.5 mL Microcentrifuge Tubes | DENVILLE | ||
| Pipette Tips | SHARP | ||
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Microwave | Avanti | ||
| Waterbath | PRECISION | ||
| Horizontal electrophoresis chamber | TREVIGEN | Cometassay ES II | |
| Power supply | Bio-Rad | ||
| Incubator | Quincy Lab | Model 12-140E | |
| Fluorescent microscope | Zeiss | LSM700 | |
| Micropipettor | Eppendorf |
References
- Ostling, O., Johanson, K. J. Microelectrophoretic study of radiation-induced DNA damages in individual mammalian cells. Biochem Biophys Res Commun. 123 (1), 291-298 (1984).
- Singh, N. P., McCoy, M. T., Tice, R. R., Schneider, E. L. A simple technique for quantitation of low levels of DNA damage in individual cells. Exp Cell Res. 175 (1), 184-191 (1988).
- Tice, R. R., et al. Single cell gel/comet assay: guidelines for in vitro and in vivo genetic toxicology testing. Environ Mol Mutagen. 35 (3), 206-221 (2000).
- Shah, A. J., Lakkad, B. C., Rao, M. V. Genotoxicity in lead treated human lymphocytes evaluated by micronucleus and comet assays. Indian J Exp Biol. 54 (8), 502-508 (2016).
- Azqueta, A., Collins, A. R. The essential comet assay: a comprehensive guide to measuring DNA damage and repair. Arch Toxicol. 87 (6), 949-968 (2013).
- Goldstein, M., Kastan, M. B. The DNA damage response: implications for tumor responses to radiation and chemotherapy. Annu Rev Med. 66, 129-143 (2015).
- Gavande, N. S., et al. DNA repair targeted therapy: The past or future of cancer treatment?. Pharmacol Ther. 160, 65-83 (2016).
- Torgovnick, A., Schumacher, B. DNA repair mechanisms in cancer development and therapy. Front Genet. 6, 157 (2015).
- Weston, V. J., et al. The PARP inhibitor olaparib induces significant killing of ATM-deficient lymphoid tumor cells in vitro and in vivo. Blood. 116 (22), 4578-4587 (2010).
- Brown, J. S., O'Carrigan, B., Jackson, S. P., Yap, T. A. Targeting DNA Repair in Cancer: Beyond PARP Inhibitors. Cancer Discov. 7 (1), 20-37 (2017).
- Lu, Y., et al. Chemosensitivity of IDH1-Mutated Gliomas Due to an Impairment in PARP1-Mediated DNA Repair. Cancer Res. 77 (7), 1709-1718 (2017).
- Konca, K., et al. A cross-platform public domain PC image-analysis program for the comet assay. Mutat Res. 534 (1-2), 15-20 (2003).
- Valverde, M., Rojas, E. Environmental and occupational biomonitoring using the Comet assay. Mutat Res. 681 (1), 93-109 (2009).
- Collins, A. R. The comet assay for DNA damage and repair: principles, applications, and limitations. Mol Biotechnol. 26 (3), 249-261 (2004).
- Karbaschi, M., Cooke, M. S. Novel method for the high-throughput processing of slides for the comet assay. Sci Rep. 4, 7200 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved