A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
وعاء واحد ساعدت الميكروويف التحويل من استرات النترات أنوميريك إلى تريتشلورواسيتيميداتيس
In This Article
Summary
2-أزيدو-1-نترات-إستر يمكن تحويلها إلى المقابلة 2-أزيدو-1-تريتشلورواسيتيميداتي في إجراء واحد-وعاء. الهدف من هذه المخطوطة إثبات فائدة مفاعل يعمل بالموجات الدقيقة في توليف الكربوهيدرات.
Abstract
وهدف الإجراء التالي توفر دليلاً لتحويل وعاء واحد 2-أزيدو-1-النترات-إستر للمانحين جليكوسيل تريتشلورواسيتيميداتي. عقب أزيدو-نترته جليكال، يمكن أن تحلل إستر 2-أزيدو-1-نترات المنتج تحت إشعاع الموجات الدقيقة-وساعد. وعادة ما يتحقق هذا التحول باستخدام الكواشف بشدة تفاعلات وتمديد أوقات رد الفعل. إشعاع الميكروويف الحث على التحلل المائي، في غياب المواد الكاشفة، مع أوقات رد الفعل قصيرة. وعقب الفوريتان، يتم تحويل الكحول أنوميريك المتوسطة، في نفس البوتقة، إلى المقابلة 2-أزيدو-1-تريتشلورواسيتيميداتي.
Introduction
بسبب انتهاء الوجود المطلق في البيولوجيا الجزيئية، كانت الكربوهيدرات الأهداف الطويلة الأمد للتوليف الكيميائي. 1 , 2 , 3 لب أي حملة ناجحة الاصطناعية هو نشر ردود فعل جليكوسيليشن لبناء سلسلة oligosaccharide الصحيح. 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 وليس من المستغرب، وهناك عدد كبير من الطرق لتثبيت الروابط glycosidic. 13 , 14 كونيغز-كنور الأسلوب هو أحد أقرب الإجراءات المعروفة وينطوي على اقتران جليكوسيل كلوريد أو بروميد مع عنصر كحولية، عادة تحت التنشيط المعادن الثقيلة (الزئبق أو فضة). 15 الفلوريد جليكوسيل ذات الصلة أدخلت أولاً كجهات مانحة في عام 1981 بمجموعة Mukaiyama وقد تم العثور على التطبيق على نطاق واسع نظراً لاستقرارها الحراري والكيميائي زيادة. 16 على الطرف الآخر من الطيف مفاعليه هي اليود جليكوسيل، ورد الفعل أكبر بكثير من هاليدات الأخرى. ويرافق مفاعليه زيادة ستيريوكونترول زيادة، لا سيما عند تشكيل oligosaccharides α مرتبطة. 17 بالإضافة إلى "هالوجليكوسيديس"، ثيوجليكوسيديس قد وجدت فائدة كبيرة، في جزء منه، نظراً لسهولة تشكيل، الاستقرار في العديد من الأحوال رد الفعل، والتنشيط مع الكواشف electrophilic. 18
الأساليب المذكورة أعلاه التركيز على تحويل الكحول أنوميريك إلى "غير الأوكسجين" الذي يتضمن، كامنة في ترك المجموعة التي يتم تفعيلها والمشردين في نهاية المطاف بالكحول من جزيء يقبلون. تنشيط الأكسجين أنوميريك كما هو موضح بالمدرسة شميت، يركز على تحويل الأكسجين C1 نفسها، إلى مجموعة ترك. 19 هذا الأسلوب هو الأقوى، وتستخدم على نطاق واسع في التفاعلات الكيميائية جليكوسيليشن. وتعد سهولة المانحين تريتشلورواسيتيميداتي من تقليل السكر وتريتشلورواسيتونيتريلي وجود قاعدة مثل كربونات البوتاسيوم (K2CO3) أو [5.4.0] 1، 8-ديازابيسيكلو أونديك-7-شرق (الدنمركي). يتم تنشيط هذه الأنواع ثم استخدام أحماض لويس. 20
ومؤخرا، أبلغنا أن الجهات المانحة 2-أزيدو-1-تريتشلورواسيتيميداتي يمكن إعدادها مباشرة من جليكالس. وتنطوي العملية على رد فعل اثنين، الإجراء وعاء واحد من استرات 2-أزيدو-1-نترات. 21 هذا البروتوكول مفصلاً يهدف إلى مساعدة الممارسين في إكمال نجاح التحول في عالية الغلة. أهمية خاصة هو الخطوة الأولى في التسلسل، الذي يركز على الفوريتان الحرارية تحت الميكروويف-ساعد التدفئة. ونأمل أيضا توفير برنامج تعليمي مرئي على استخدام مفاعلات تعمل بالموجات الدقيقة في التوليف العضوي.
Protocol
1-الموجات الدقيقة الممثل-ساعد الفوريتان
- ضع إستر نترات أزيدو (1.0 equiv.، 0.2 ميللي مول) في قنينة رد فعل الموجات الدقيقة 8 مل. ويمكن زيادة حجم رد فعل إلى mmol عدة دون أي تأثير سلبي على رد فعل التقدم.
- حل إستر أزيدو-نترات في الأسيتون 20% aq. (0.1 M، 2.0 mL). إضافة بيريدين (5.0 equiv.، 0.08 مل، 1.0 مليمول) إلى وعاء التفاعل. كاب القنينة إشعاع الموجات الدقيقة ووضع وعاء التفاعل في تجويف مفاعلات تعمل بالموجات الدقيقة.
- تشعيع الحل عند 120 درجة مئوية لمدة 15 دقيقة مع التحريك ومع وقت عقد ثابت. يمثل وقت الانتظار متى سيحدث التشعيع في درجة حرارة معينة والضغط الناتجة عن ذلك. حرارة جميع ردود الفعل لدرجة الحرارة المبلغ عنها على مدى فترة تكثف بعد دقيقتين. مراقبة درجة الحرارة عن طريق جهاز استشعار الأشعة تحت الحمراء مدمج.
- وبعد 15 دقيقة، تحليل رد فعل المخلوط باستخدام طبقة رقيقة اللوني (TLC) للتأكد من استهلاك المواد البداية. استخدام 1:1 وخلات الإيثيل/هيكسانيس الوينت.
- تصور لوحة TLC استخدام الأمونيوم سيريتش موليباتى وصمة عار. Rو مادة التفاعل والمنتج سوف تختلف، ولكن الكحول مما يقلل عموما من 0.05 إلى 0.1 أقل Rو من مادة التفاعل.
2-تشكيل تريتشلورواسيتيميداتي
- عقب استهلاك المادة الانطلاق الكامل، يتبخر المذيب بوحدة خفض استخدام شركة طيران. ثم تضعف مع (الميثان) الفصل2Cl2 (1.0 مل) واستخدام المحاقن لإزالة طبقة المياه. حالما تتم إزالة طبقة المياه، تبريد المخلوط رد فعل إلى 0 درجة مئوية باستخدام حمام الماء المثلج.
- بعد ذلك إضافة الدنمركي (مكافئ 10، 0.3 مل، 1.9 mmol) و 2,2,2-تريتشلورواسيتونيتريلي (مكافئ 50، مل 1.0، 10 ميللي مول) إلى وعاء التفاعل. تتم إضافة كل الكواشف في الزائدة، وهناك حاجة إلى حد أدنى يعادل 1 من قاعدة وما يعادل 1 من 2,2,2-تريتشلورواسيتونيتريلي.
- السماح الخليط رد فعل لإثارة بينما الاحترار لدرجة الحرارة المحيطة. رصد رد فعل TLC للتأكد من استهلاك المواد البداية.
- استخدام 1:1 وخلات الإيثيل/هيكسانيس الوينت. تصور لوحة TLC استخدام الأمونيوم سيريتش موليباتى وصمة عار. وسوف تختلف Rو مادة التفاعل والمنتج.
- بعد استهلاك كاملة ابتداء من المواد، نقل الخليط رد فعل إلى قارورة انتعاش وتركيز الخليط في الخلاء في 30 درجة مئوية. وستوفر تبخر المذيبات أصفر شاحب خام للنفط براون.
- تنقية النفط الخام المنتج من هلام السليكا كروماتوغرافيا العمود مع عمود كروماتوغرافيا 1.5 سم و 1:4 وخلات الإيثيل/هيكسانيس الوينت. الشكل المادي إيميداتي سوف تختلف من جزيء إلى جزيء.
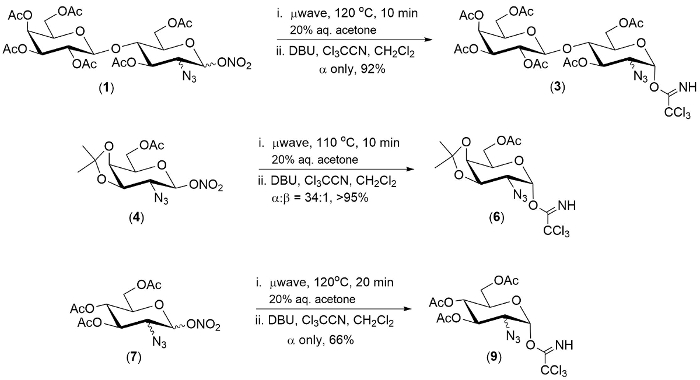
رقم 1- أمثلة لتحويل اﻻسترات 2-أزيدو-1-نترات وعاء واحد إلى 2-أزيدو-1-تريتشلورويميداتيس. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
النتائج
التكنولوجيا الموضحة هنا تجلى في مجموعة من ثلاثة 2-أزيدو-1-نترات اﻻسترات. في كل حالة كان الخطوة الأولى من رد فعل كاملة في غضون 20 دقيقة.
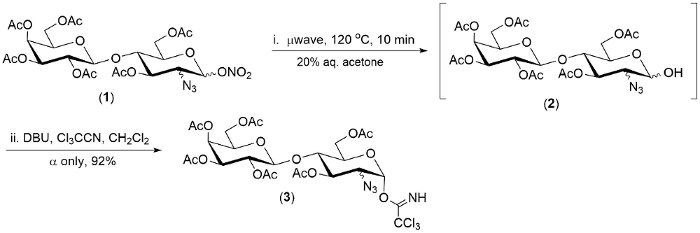
الشكل 2- مثال للتحلل المائي (1 -->2
Discussion
البروتوكول هو موضح في هذا البرنامج التعليمي يوفر طريقة لتحويل استرات النترات إلى وظيفة مفيدة، ورد الفعل. وبمعنى أوسع، تستخدم مفاعل يعمل بالموجات الدقيقة لإتمام المناورات محددة على مدى توليف الكربوهيدرات لديه القدرة على جعل التحولات الصعبة سهلة وروتينية. ويتمثل هدفنا في هذا البرنامج الت...
Disclosures
المؤلفين قد لا تضارب المصالح المالية.
Acknowledgements
ويود المؤلفون الاعتراف بجامعة فاندربيلت، ومعهد البيولوجيا الكيميائية للدعم المالي. يعترف السيد بيركلي إيليس والبروفيسور جون مكلين "الاستبانة وسائل التحليل الطيفي".
Materials
| Name | Company | Catalog Number | Comments |
| 230 400 mesh silica gel | SiliCycle Inc | R10030B | |
| TLC plates | SiliCycle Inc | TLG-R10014B-527 | |
| Ceric ammonium molybdate | Sigma-Aldrich | A1343 | |
| Solvent Still | Mbraun | MB-SPS-800 | |
| Infared spectrometer | Thermo | Thermo Electron IR100 | |
| Nuclear Magnetic Resonance | Bruker | 400, 600 MHz | |
| LC/MS | Thermo/Dionex | Single quad, ESI | |
| HRMS | Agilent | Synapt G2 S HDMS | |
| Microwave reactor | Anton Parr | Anton Parr G10 Monowave 200 | |
| DBU | Sigma-Aldrich | 139009 | |
| CCl3CN | Sigma-Aldrich | T53805 | |
| Pyridine | Sigma-Aldrich | 270970 | |
| Acetone | Fisher Scientific | A18-20 | Tech. grade |
| Phase separator | Biotage | 120-1901-A | |
| Rotary evaporator | Buchi | R-100 |
References
- Nicolaou, K. C., Mitchell, H. J. Adventures in Carbohydrate Chemistry: New Synthetic Technologies, Chemical Synthesis, Molecular Design, and Chemical Biology A list of abbreviations can be found at the end of this article. Telemachos Charalambous was an inspiring teacher at the Pancyprian Gymnasium, Nicosia, Cyprus. Angew. Chem. Int. Ed. Engl. 40 (9), 1576-1624 (2001).
- Danishefsky, S. J., Allen, J. R. From the laboratory to the clinic: A retrospective on fully synthetic carbohydrate-based anticancer vaccines. Angew. Chem. Int. Ed. Engl. 39 (5), 836-863 (2000).
- Nicolaou, K. C., Hale, C. R. H., Nilewski, C., Ioannidou, H. A. Constructing molecular complexity and diversity: total synthesis of natural products of biological and medicinal importance. Chemical Society Reviews. 41 (15), 5185-5238 (2012).
- Zhu, X., Schmidt, R. R. New principles for glycoside-bond formation. Angew. Chem. Int. Ed. Engl. 48 (11), 1900-1934 (2009).
- Danishefsky, S. J., Bilodeau, M. T. Glycals in organic synthesis: The evolution of comprehensive strategies for the assembly of oligosaccharides and glycoconjugates of biological consequence. Angew. Chem. Int. Ed. Engl. 35 (13-14), 1380-1419 (1996).
- Bongat, A. F., Demchenko, A. V. Recent trends in the synthesis of O-glycosides of 2-amino-2-deoxysugars. Carbohydr. Res. 342 (3-4), 374-406 (2007).
- Feizi, T., Fazio, F., Chai, W. C., Wong, C. H. Carbohydrate microarrays - a new set of technologies at the frontiers of glycomics. Curr. Opin. Struct. Biol. 13 (5), 637-645 (2003).
- Palmacci, E. R., Plante, O. J., Seeberger, P. H. Oligosaccharide synthesis in solution and on solid support with glycosyl phosphates. Eur. J. Org. Chem. (4), 595-606 (2002).
- Stallforth, P., Lepenies, B., Adibekian, A., Seeberger, P. H. 2009 Claude S. Hudson Award in Carbohydrate Chemistry. Carbohydrates: a frontier in medicinal chemistry. J. Med. Chem. 52 (18), 5561-5577 (2009).
- Danishefsky, S. J., Mcclure, K. F., Randolph, J. T., Ruggeri, R. B. A Strategy for the Solid-Phase Synthesis of Oligosaccharides. Science. 260 (5112), 1307-1309 (1993).
- Demchenko, A. V. Stereoselective chemical 1,2-cis O-glycosylation: From 'sugar ray' to modern techniques of the 21st century. Synlett. (9), 1225-1240 (2003).
- Fraserreid, B., Wu, Z. F., Udodong, U. E., Ottosson, H. Armed-Disarmed Effects in Glycosyl Donors - Rationalization and Sidetracking. J. Org. Chem. 55 (25), 6068-6070 (1990).
- Bohe, L., Crich, D. A propos of glycosyl cations and the mechanism of chemical glycosylation; the current state of the art. Carbohydr. Res. 403, 48-59 (2015).
- Toshima, K., Tatsuta, K. Recent Progress in O-Glycosylation Methods and Its Application to Natural-Products Synthesis. Chem. Rev. 93 (4), 1503-1531 (1993).
- Koenigs, W., Knorr, E. Ueber einige Derivate des Traubenzuckers und der Galactose. Chem. Ber. 34 (1), 957-981 (1901).
- Mukaiyama, T., Murai, Y., Shoda, S. An Efficient Method for Glucosylation of Hydroxy Compounds Using Glucopyranosyl Fluoride. Chem. Lett. (3), 431-432 (1981).
- Meloncelli, P. J., Martin, A. D., Lowary, T. L. Glycosyl iodides. History and recent advances. Carbohydrate Research. 344 (9), 1110-1122 (2009).
- Lian, G., Zhang, X., Yu, B. Thioglycosides in carbohydrate research. Carbohydr. Res. 403, 13-22 (2015).
- Schmidt, R. R., Kinzy, W. Anomeric-Oxygen Activation for Glycoside Synthesis - the Trichloroacetimidate Method. Advances in Carbohydrate Chemistry and Biochemistry. 50, 21-123 (1994).
- Schmidt, R. R., Toepfer, A. Glycosylation with highly reactive glycosyl donors: efficiency of the inverse procedure. Tetrahedron Lett. 32 (28), 3353-3356 (1991).
- Keith, D. J., Townsend, S. D. Direct, microwave-assisted substitution of anomeric nitrate-esters. Carbohydr. Res. 442, 20-24 (2017).
- Bukowski, R., et al. Synthesis and Conformational Analysis of the T-Antigen Disaccharide(B-D-Gal-(1->3)-a-D-GalNAc-OMe). Eur. J. Org. Chem. 14, 2697-2705 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved