A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التحقيق "تضر الآثار من منخفضة الضغط البلازما التعقيم" على البقاء لجراثيم Bacillus نجحت "باستخدام خلية يعيش مجهرية"
In This Article
Summary
هذا البروتوكول يوضح الخطوات المتتالية الهامة اللازمة لتقييم مدى أهمية رصد المعلمة الحيوية وعمليات إصلاح الحمض النووي في أحياء أبواغ عصيات نجحت بعد العلاج مع انخفاض ضغط البلازما بواسطة تتبع إصلاح الحمض النووي المسمى fluorescence البروتينات عن طريق الفحص المجهري [كنفوكل] حل الوقت ومسح المجهر الإلكتروني.
Abstract
التعقيم البلازما بديلاً واعداً لطرق التعقيم التقليدية لأغراض رحلات الفضاء والصناعية والطبية،. تصريف الضغط المنخفض البلازما (الطب الخاص المحدود) تحتوي على مجموعة واسعة من الأنواع النشطة، والتي تؤدي إلى المنظمة الميكروبية السريع. دراسة كفاءة والآليات للتعقيم بالطب الخاص المحدود، نستخدم جراثيم الكائن اختبار نجحت عصية بسبب مقاومتهم إجراءات التعقيم التقليدية غير عادية. يصف لنا إنتاج نجحت بوغ مونولاييرس، عملية التعقيم بالضغط المنخفض البلازما في مفاعل بلازما الحث يقترن مزدوجة لتوصيف مورفولوجيا بوغ باستخدام المسح الضوئي المجهر الإلكتروني (SEM)، تحليل للإنبات ويعتبر امتداداً للجراثيم بخلية حية مجهرية. هدفا رئيسيا للأنواع البلازما المواد الجينية (DNA) وإصلاح الحمض النووي البلازما المستحثة الآفات على أحياء بوغ أمر حاسم لبقاء الكائن الحي. هنا، علينا أن ندرس قدرة إنبات جراثيم وإصلاح دور الحمض النووي أثناء الإنبات بوغ وثمرة بعد العلاج بالطب الخاص المحدود بتتبع المسمى فلوريسسينتلي الحمض النووي إصلاح البروتينات (RecA) مع حل وقت الأسفار [كنفوكل] مجهرية. تعامل وتفعيلها لإنبات مونولاييرس بوغ غير المعالجة وتصور مع مجهر مقلوب خلية يعيش [كنفوكل] مرور الوقت لمتابعة رد فعل جراثيم فردية. لدينا الملاحظات تكشف عن أن الكسر الإنبات وتعدى جراثيم يعتمد على مدة الطب الخاص المحدود-العلاج تصل إلى الحد أدنى بعد 120 س. RecA-يفب الأسفار (الأسفار الصفراء البروتين) تم اكتشاف إلا في عدد قليل من الجراثيم وتطويرها في جميع تعدى الخلايا مع ارتفاع طفيف في المعالجة بالطب الخاص المحدود جراثيم. وعلاوة على ذلك، بعض من البكتيريا النباتية المستمدة من جراثيم المعالجة بالطب الخاص المحدود وأظهرت زيادة في السيتوبلازم، وتميل إلى ليس. يمكن أن تكون الأساليب المذكورة لتحليل جراثيم فردية مثالية لدراسة الجوانب الأخرى لإنبات بوغ وثمرة.
Introduction
هدفا رئيسيا لاستكشاف الفضاء هو البحث عن التوقيعات من أشكال الحياة والجزيئات الحيوية الأخرى الهيئات الكواكب والأقمار في نظامنا الشمسي. نقل الكائنات الدقيقة أو الجزيئات الحيوية المنشأ الأرضي للمناطق الحرجة للاستكشاف لمخاطر خاصة لتأثير التنمية وسلامة البعثات الحياة-الكشف عن هيئات الكواكب مثل المريخ وأوروبا1. فرض أنظمة صارمة على بعثات مأهولة والروبوتية إلى الكواكب الأخرى وهذه الأقمار والكويكبات والسماوية الأخرى المبادئ التوجيهية الدولية لحماية الكوكب، أنشئ بلجنة أبحاث الفضاء (كوسبار) في عام 1967، وتنظم تنظيف وتعقيم لمركبة فضائية ومكونات الأجهزة الحاسمة السابقة لإطلاق بغية القضاء على تلوث الكائنات الأرضية الدقيقة ومنع حدوث التلوث المنتقل من الإجرام السماوية2. على مدى العقد الماضي، اكتسبت تطبيق البلازما غير الحرارية اهتماما واسعاً في مجال البحوث الطبية والغذائية، وكذلك في رحلات الفضاء تطبيقات3،،من45. التعقيم البلازما بديلاً واعداً لطرق التعقيم التقليدية كما أنها توفر سرعة وكفاءة المنظمة الميكروبية6، بينما يجري لطيف الحساسة والمواد مجا الحرارة. تصريفات بلازما تحتوي على خليط عوامل المتفاعلة مثل الجذور الحرة، والجسيمات المشحونة، الذرات المحايدة/متحمس، الفوتونات في الأشعة فوق البنفسجية (الأشعة فوق البنفسجية)، وطيف الأشعة فوق البنفسجية فراغ (VUV) التي تؤدي إلى المنظمة الميكروبية السريع3. في هذه الدراسة، ونحن نستخدم الضغط المنخفض البلازما المتولدة عن مصدر بلازما الحث يقترن الضغط المنخفض (ديكب) مزدوجة7،8 لإلغاء تنشيط نجحت Bacillus اندوسبوريس توزع على سطح الزجاج الاختبار.
بكتيريا إيجابية للأسرة باسيلاسيي وتوزع على نطاق واسع في الموائل الطبيعية للتربة، والرواسب، والهواء، وكذلك كما هو الحال في بيئات غير عادية مثل مرافق غرفة نظيفة و "محطة الفضاء الدولية"9،10 ،11. الميزة الأكثر من متميزة من جنس Bacillus هو القدرة على تشكيل مقاومة عالية اندوسبوريس نائمة (يشار إليه فيما يلي الجراثيم) البقاء على قيد الحياة في ظروف غير مواتية، مثل استنفاد المغذيات12. جراثيم تقاوم عموما أكثر بكثير من نظرائهم من الخلية النباتية لمجموعة متنوعة من العلاجات، والضغوط البيئية، بما في ذلك الحرارة والأشعة فوق البنفسجية واشعاع غاما، وجفاف، اضطراب الميكانيكية والمواد الكيميائية السامة، مثل المؤكسدات القوية أو وكلاء تغيير الأس الهيدروجيني (إعادة النظر في الإشارات13،14) وبالتالي فكائنات مثالية لاختبار كفاءة أساليب المنظمة الميكروبية. نظراً للحمض النووي هدفا رئيسيا لعلاج البكتيريا15،16، إصلاح آفات الحمض النووي الناجم عن البلازما البلازما (مثل فواصل حبلا الحمض النووي المزدوج) عند بوغ أحياء أمر حاسم لبقاء البكتيريا13، 17.
وبالتالي، علينا دراسة قدرة إنبات الجراثيم ودور إصلاح الحمض النووي أثناء الإنبات بوغ وثمرة بعد علاج الجراثيم مع بلازما الأرغون الضغط المنخفض بجراثيم الفردية التالية وإصلاح التعبير عنها من الحمض النووي المسمى الأسفار بروتين RecA مع حل وقت الأسفار [كنفوكل] مجهرية. أننا نعطي تعليمات خطوة بخطوة لإعداد الجراثيم ب-نجحت في مونولاييرس لتحقيق نتائج الاختبار استنساخه، معاملة مونولاييرس سبور مع البلازما الضغط المنخفض للتعقيم، وإعداد جراثيم البلازما تعامل التقييم ultrastructural باستخدام المسح الضوئي المجهر الإلكتروني (SEM)، والتحليل المجهري خلية حية على مستوى جراثيم فردية في الحفل مع رصد الحمض النووي النشطة إصلاح العمليات التي تحدث داخل الخلية في الاستجابة للمعالجة بالبلازما.
Protocol
1- نجحت عصيات بوغ إنتاج وتنقية
- إنتاج بوغ، نقل ثقافة بين عشية وضحاها 5 مل لكل سلالة نجحت باء ، تستكمل بالمضادات الحيوية المناسبة، إلى 200 مل مزدوجة قوامها سائل شافر تبوغ المتوسطة (لكل لتر مرق ز 16 المغذيات، بوكل 2 غ، 0.5 غ مجسو 4* 7 ح2س، 2 مل م 1 Ca (لا3)2، 2 مل م 0.1 الحركة2 * • 4 ح2س، 2 مل 1 مم فيسو4، الجلوكوز 50% (w/v) 2 مل18) وزراعتها مع تهوية نشطة في 37 درجة مئوية ح 72 أو حتى > 95% من الثقافة وقد سبورولاتيد. تستخدم جراثيم السلالات التالية: نجحت ب- PY79 (نوع البرية) نجحت PY79ΔrecA:: الأجسام القريبة من الأرض (نقص البروتين إصلاح الحمض النووي RecA) PY79 (ب) نجحت recA-يفب:: القط (RecA تنصهر مع الأصفر 19من البروتينات الفلورية [يفب]).
- حصاد جراثيم بالطرد المركزي لمدة 15 دقيقة في 3,000 س ز في أنابيب 50 مل وتنقية العينات بخطوات الغسيل المتكرر (تصل إلى 15 مرة) استخدام العقيمة المقطر ح2س والاختيار لحالة النقاء والإنبات بالتباين مرحلة الفحص المجهري. ضمان أن المعلقات بوغ تتألف من الجراثيم مرحلة مشرقة (> 99 ٪) وهي خالية من الخلايا النباتية (قضبان) وإنبات الجراثيم (مظهر أسود/رمادي) وخلية الحطام، وإلا يمكن زيادة الانزعاج تجارب الفحص المجهري. تغسل العينة حتى يتم التوصل إلى النقاء المطلوب.
- بعوض عيار بوغ بالطلاء من 50 ميليلتر من تخفيف المسلسل إذ في أجار رطل (أي: استخدام 30 ميليلتر العينة + 270 ميليلتر الماء المعقم 01:10 إضعاف. يستغرق 30 ميليلتر من تمييع خاصة إلى 270 ميليلتر ح2س لإضعاف 1: 100 وما إلى ذلك) لحساب زيمبابوي (مستعمرة تشكيل وحدات) واحتضان لوحات عند 37 درجة مئوية بين عشية وضحاها. بعد تحديد زيمبابوي، وضبط العينة لجراثيم9 10 كل مل بتركيز أو تخفيفها بالماء المعقم.
2-نموذج إعداد جراثيم أودعت الهباء الجوي نجحت عصية
ملاحظة: التراكم والتداخل من جراثيم قد تؤدي إلى تظليل الآثار خلال العلاج، أدى في نهاية المطاف إلى حركية المنظمة مزورة. وللحد من هذه المشكلة، إعداد العينات بوغ تقنية ترسب الهباء الجوي20. بإيجاز، السيطرة على فوهة اثنين-مادة عالية الدقة مع جهاز توقيت كهربائي الذي ينظم سرعة النقل السائل في الحفل مع تدفق الغاز المضغوط الناقل (هنا ن2). تفريق عينة السائل المحقون عن طريق منفذ فوهة استخدام تدفق غاز النيتروجين.
- جولة كوفيرسليبس 25 مم أو مكان ناقل عينة في شكل الشرائح المجهرية معقمة (بالنسبة لبقاء حركية) (لتعقب الفلورسنت لإصلاح الحمض النووي العمليات/كلسم؛ [كنفوكل] ليزر المسح المجهري) داخل الهباء الجوي تعمل بالكهرباء الرش وحدة في محاذاة مع الفوهة. يحتاج إلى تركيز بوغ المستخدمة لتتوافق مع غاليا التركيز النهائي المطلوب.
- نقل 1 مل ثقافة بوغ إلى مدخل فوهة السوائل والشروع في عملية الرش 0.1 s عند ضغط 1.3 بار. تعليق بوغ رش (1 × 107) يشكل طبقة رقيقة على الشريحة المجهرية التي يجف سريعاً في غضون ثوان شكل أحادي الطبقة بوغ موزعة بانتظام. تخزين الناقلين نموذج المعالجة في حاوية معقمة في درجة حرارة الغرفة.
3-انخفاض ضغط البلازما العلاج
- إعداد نظام البلازما لمعالجة العينات البيولوجية وتشغيل النظام في 5 السلطة الفلسطينية مع بلازما الأرغون في 500 واط لمدة 5 دقائق. بهذا، تنظيف جميع الأسطح في النظام واستعد. وهذا يقلل الخلاف من جزيئات من الهواء المحيط، إلا وهي النيتروجين والأكسجين، والماء، بينما تنفيس النظام. بعد المعالجة المسبقة للنظام، التنفيس عن الدائرة ووضع العينات بعناية في وسط السفينة المفاعل مع مساعدة الرفوف الزجاج.
- استخدام replicates البيولوجية ثلاثة على الأقل. إغلاق الدائرة وإخلاء أدناه 2 بنسلفانيا بعد ذلك، تعبئة الغاز عملية في الدائرة. تنظيم الضغط في النظام إلى 5 السلطة الفلسطينية.
- بعد وقت عملية محددة، إيقاف الإمداد بالكهرباء والغاز، وتنفيس النظام لمنع تهب العينات من صاحب العينة بعناية. بعد التهوية، إزالة العينات ووضع النماذج للمعلمة التالية في النظام. لعناصر التحكم غير البلازما تعامل تعرض عينات فراغ فقط (5 السلطة الفلسطينية) في وجود الغاز عملية معادلة لوقت أطول من البلازما التطبيقية.
4-التأهيل والتقييم لبقاء بوغ
- تعد حلاً يعقم 10% اسيتات البولي فينيل (PVA) وتغطية الناقل العينة بعناية مع حوالي 500 ميليلتر والسماح لهم أيردري ل h. 4 قطاع قبالة طبقة بولي المجففة (الآن تحتوي على عينة بوغ) استخدام الملقط العقيمة ونقلها إلى 2 مل أنبوب رد فعل. أضف 1 مل الماء المعقم للأنبوب وحل طبقة بولي عبر فورتيكسينج. يؤدي هذا الإجراء إلى > استعادة 95% من الجراثيم ولا يؤثر على قدرة إنبات21.
- متسلسل تمييع العينة الساعة 01:10 في الماء المعقم في صفيحة 96-جيدا (أي 270 ميليلتر العقيمة ح2س + 30 ميليلتر تمييع عينة/السابقة). لوحة بها 50 ميليلتر من كل تخفيف في ليسوجيني مرق أجار المغذيات (رطل)، واحتضان لوحات عند 37 درجة مئوية بين عشية وضحاها وتعداد عدد المستعمرات نمت (زيمبابوي).
5-يعيش خلية مجهرية وتتبع عمليات إصلاح الحمض النووي في الإنبات جراثيم
- لإجراء التجارب على الإنبات، تعد وسادة رطل-أجار 1.5% سميكة 1 مم، من الغليان 700 المتوسطة ميليلتر وبيبيت إلى طبق بتري مجهرية عقيمة. بعد 10 دقيقة، قطع 8 مم × 8 مم × 1 مم أجار رطل وسادة مع مشرط معقم ونقل أجار بعناية على رأس مونولاييرس بوغ الذي يستريح في كوفيرسليبس زجاج 25 مم.
ملاحظة: هذه الخطوة الحاسمة لتصور جراثيم فردية والسماح بعد فعلها، نحو تنشيط الإنبات الناجم عن أجار المغذيات. وهكذا، رطل-أجار يخدم غرضين، (1) إلى إصلاح الجراثيم في السطح، والذي يتجنب ريلوكاليزيشن على طول السطح والخروج من التركيز البصري، و (2) لتنشيط بوغ لإنبات. - بعد تغطي العينة مع أجار، نقل ساترة الزجاج بسرعة إلى غرفة التصوير ومجهر العينات مع مجهر مسح ليزر [كنفوكل] الآلي مع البصريات مقلوب 63 X باستخدام/1.3 طائرة اللازيغيه النفط الغمر الهدف.
-
إجراء تصوير للأسفار (يفب) مع إثارة ويمكن الكشف عن الطول الموجي 514 nm والانبعاثات بين 520 و 560 نانومتر.
- سجل مشرق ميدان الصور في وضع أحد مضاعفات صور (مسار الضوء المرسلة) باستخدام المسح.
- تسجيل الوقت الفاصل بين سلسلة مع قوة ليزر من 2.6 في المائة، وتعيين الفتحة [كنفوكل] إلى 5 وحدات مهواة وعلى تردد عينة الإطار 1 كل 30 ثانية من 0 ح إلى ح 5، اعتماداً على التجربة. جدير بالملاحظة أن الجرعات العالية من أحادي اللون بالليزر الإضاءة في 514 nm تماما تمنع الإنبات (الشكل 1أ، ب).
- تبقى العينات عند 37 درجة مئوية (رطوبة الهواء المحيط) في مرحلة تدفئة أثناء عملية التصوير بالكامل. استخدام replicates البيولوجية ثلاثة على الأقل لكل حالة. في حالة تجميع بوغ، توزيع بوغ متعدد الطبقات أو التلوث بذرات الغبار، حظر المعاملة البلازما ("التظليل") قد تحدث وتمكين إنبات جراثيم مظلل (الشكل 1ج، د).
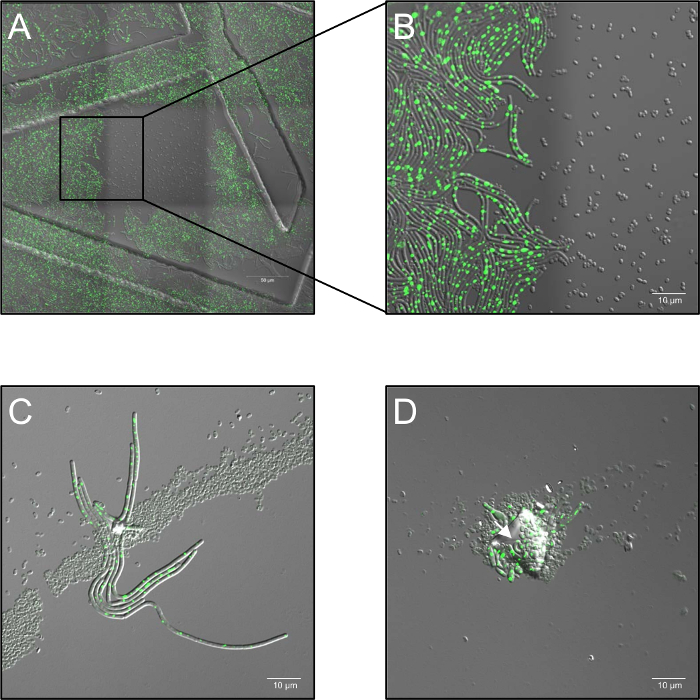
رقم 1: المشاكل المحتملة التي لوحظت خلال الخلايا الحية [كنفوكل] الأسفار مجهرية من جراثيم البلازما تعامل. (أ وب) تثبيط إنبات بوغ بجرعات عالية من أحادية اللون (514 nm) الإضاءة بالليزر. (أ) نظرة عامة (3 × 3 إطارات مخيط) من (ب) نجحت (LAS72، RecA-يفب) الجراثيم 180 دقيقة بعد بدء الإنبات. الإطار في المنتصف تعرضت في فترات s 30 لجرعات عالية من ضوء الليزر (514 nm، السلطة الليزر 70%)، بينما كانت مضاءة المناطق المحيطة بها (= إطارات) لا (الصورة المدمجة قناة مشرق الميدان والأسفار RecA-يفب؛ وأمرت بهياكل بسبب استخدام 35 ملم التصوير الأطباق مع شبكة مطبوع 500 ميكرومتر). (ب) يوضح 4 X العرض المكبرة من الحدود بين منطقة مضيئة وغير مضيئة تبين أن الجراثيم، التي تعرضت لجرعات عالية من الإضاءة الليزر أحادي اللون لا تنبت ولا تنمو، بينما الجراثيم في المناطق غير مضيئة يتعافى تماما للبكتيريا الخضري معربا عن مشرق RecA-يفب الفلورية (الإشارة الخضراء). (ج، د) جراثيم مشمولة بتلويث جسيمات أو طبقات متعددة من بوغ (الأسهم) ويبدو أن حماية الجراثيم الكامنة من المنظمة عن طريق المعالجة بالبلازما والسماح للإنبات، وثمرة ("تأثير التظليل"). جراثيم (ج) كانت تعامل البلازما 60 ثانية والمصورة 180 دقيقة بعد بدء الإنبات، أو (د) 120 s وتصويرها بعد 240 دقيقة الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
6-فحص المجهر الإلكتروني (SEM)
- استخدام المسح الضوئي المجهر الإلكتروني لتوفير ultrastructural من المعلومات حول مورفولوجية السطح من جراثيم البلازما تعامل بالمقارنة مع عناصر التحكم غير المعالجة. معطف مونولاييرس بوغ المجففة على كوفيرسليبس مع الذهب البلاديوم (3 نانومتر) باستخدام الرش-المغطى. استخدام مجهر الإلكتروني المسح الميداني-الانبعاثات لتصوير العينات، كما تعمل على 5 كيلوفولت تسريع الجهد بما في ذلك كاشف الإلكترونات الثانوية في عدسة لتكشف عن تباين التضاريس.
7-بيانات التحليل
- تحديد بقاء بوغ من حاصل N/N0, حيث N هو متوسط زيمبابوي العينات المعالجة ون0 متوسط زيمبابوي لعناصر الفراغ غير المعالجة. ارسم بوغ المنظمة بالمعاملة بلازما الأرغون كدالة للوقت (بالثواني). التعبير عن جميع البيانات المتوسطات والانحرافات المعيارية (n = 3).
- تحليل الصور التي حصلت عليها التصوير خلية حية باستخدام برامج التصوير. قياس نسبة الإنبات بوغ وتعدى بعد المعالجة بالبلازما، عد الجراثيم في إطارات الممثل في بداية التجربة وكذلك بعد ح 4. لتحديد أهمية في فحوصات بقاء بوغ، استخدام أحادي الاتجاه ANOVA-اختبارات (تحليل التباين) مع البرامج الإحصائية). قيم P < 0.05 تعتبر إحصائيا.
النتائج
البقاء على قيد الحياة للمعالجة بالبلازما ب-نجحت الجراثيم
استخدام العلاج البلازما للجراثيم ب-نجحت في هذه الدراسة تظهر انخفاضا في البقاء على قيد الحياة مع زيادة مدة العلاج البلازما (الشكل 2). جراثيم سلالة الإعراب عن...
Discussion
تعقيم أسطح باستخدام درجات الحرارة المنخفضة والضغط المنخفض البلازما بديلاً واعداً لإجراءات التعقيم بدلاً من التقليدية مثل العلاج بالمواد الكيميائية، الإشعاع المؤين (مثل الغازات مثل ح2س2 أو أكسيد الإيثيلين) أو الحرارة الجافة والرطبة23. توفير أساليب التعقيم ال...
Disclosures
وأعلن لا تضارب في المصالح.
Acknowledgements
يشكر المؤلفون شرودر أندريا لها المساعدة التقنية الممتازة خلال أجزاء من هذا العمل واولريش جيه نيكا لمساعدتها خلال تبادل لإطلاق النار الفيديو. كما نود أن نشكر سيمونز ألف إيل لأن التبرع السخي من سلالات Bacillus نجحت : LAS72 و LAS24. كان دعم هذا العمل في أجزاء من المنح من مؤسسة البحوث الألمانية (DFG) باكيتانتراج (بلاسماديكون باك 728) للسلطة الفلسطينية (فصيل عبد الواحد 7/3-1)، وجمهورية مقدونيا (2023 مو/2-1) ودلر منح الحياة المحطة الفضائية الدولية DLR-فو-صورة الصحافة، البرنامج RF-فو، تيلبروجرام 475 (إلى F.M.F، ومحمد، وجمهورية مقدونيا). F.M.F. أيده على منحة دكتوراه من "مدرسة بحوث علوم الحياة الفضائية هلمهولتز" (سباسيليفي) في الألماني (DLR) في كولونيا، ألمانيا، التي مولتها "الرابطة هلمهولتز" (هلمهولتز-نزاع) على مدى فترة السنوات الست ( رقم المنحة VH-KO-300) وحصلت على أموال إضافية من شؤون الفضاء الجوي، بما في ذلك المجلس التنفيذي الفضاء الجوي، ومعهد طب الفضاء الجوي. وستدرج نتائج هذه الدراسة في أطروحة دكتوراه فيليكس م. فوكس.
Materials
| Name | Company | Catalog Number | Comments |
| Two substance nozzle (model 970-8) | Schlick | 14,404 | 230 V, 50 Hz, D 4.484/8, 0.8 mm bore diameter |
| Luria Bertani Medium | Sigma Aldrich | 70122-100G | |
| Tube connectors | Festo | n/a | G 1/8 |
| Magnetvalve DO35-3/2NC-G018-230AC | Bosch Rexroth | 820005100 | |
| PLN Polyamid tube | Festo | 558206 | d = 6 mm |
| Glass slides | VWR | 48300-026 | |
| Electric Timer 550-2-C | Gefran | F000074 | 220 V |
| attofluor cell chamber | Menzel, Fisher Ref. | 3406816 | d=25 mm, round |
| MgSO4*7 H2O | Sigma Aldrich | 13152 | |
| Ca(NO3)2 | Sigma Aldrich | 202967 | |
| MnCl2 * 4 H2O | Sigma Aldrich | 244589 | |
| FeSO4 * 7H2O | AppliChem | 13446-34-9 | |
| Glucose | Merck | 215422 | |
| KCl | Sigma Aldrich | P9541-500G | |
| Nutrient Broth (NB) | Merck | 105443 | |
| Luria-Bertani (LB) | Merck | 110283 | |
| 96-wellplate | ThermoFisher | 243656 | |
| Zeiss LSM 780, Axio Observer Z1 | Carl Zeiss Microscopy GmbH | n/a | |
| Leo 1530 Gemini | Carl Zeiss Microscopy GmbH | n/a | |
| ZEN 2 and ZEN lite 2012 (Software) | Carl Zeiss Microscopy GmbH | n/a | |
| SigmaPlot, version 13.0 (Statistic software) | Systat GmbH, Erkrath, Germany | n/a | |
| Attofluor cell chamber | Invitrogen | A7816 | |
| µ-Dish 35 mm, high Grid-500 Glass Bottom | ibidi | 81168 |
References
- Nicholson, W. L., Schuerger, A. C., Race, M. S. Migrating microbes and planetary protection. Trends Microbiol. 17, 389-392 (2009).
- COSPAR. COSPAR Planetery Protection Policy. Space Research Today, COSPAR's Information Bulletin. 193, 1-14 (2015).
- De Geyter, N., Morent, R. Nonthermal plasma sterilization of living and nonliving surfaces. Annu Rev Biomed Eng. 14, 255-274 (2012).
- Shimizu, S., et al. Cold atmospheric plasma - A new technology for spacecraft component decontamination. Planet. Space Sci. 90, 60-71 (2014).
- Lerouge, S., Fozza, A. C., Wertheimer, M. R., Marchand, R., Yahia, L. H. Sterilization by Low-Pressure Plasma: The Role of Vacuum-Ultraviolet Radiation. Plasma Polym. 5, 31-46 (2000).
- Rossi, F., Kylián, O., Rauscher, H., Gilliland, D., Sirghi, L. Use of a low-pressure plasma discharge for the decontamination and sterilization of medical devices. Pure Appl. Chem. 80, 1939-1951 (2008).
- Halfmann, H., Hauser, J., Awakowicz, P., Koller, M., Esenwein, S. A. A double inductively coupled low-pressure plasma for sterilization of medical implant materials. Biomed Tech (Berl). 53, 199-203 (2008).
- Halfmann, H., Denis, B., Bibinov, N., Wunderlich, J., Awakowicz, P. Identification of the most efficient VUV/UV radiation for plasma based inactivation of Bacillus atrophaeus spores. J. Phys. D: Appl. Phys. 40, 5907 (2007).
- Vaishampayan, P., et al. Bacillus horneckiae sp. nov., isolated from a spacecraft-assembly clean room. Int J Syst Evol Microbiol. 60, 1031-1037 (2010).
- Mandic-Mulec, I., Stefanic, P., van Elsas, J. D. Ecology of Bacillaceae. Microbiol Spectr. 3, (2015).
- Alekhova, T. A., et al. Diversity of bacteria of the genus Bacillus on board of international space station. Dokl Biochem Biophys. 465, 347-350 (2015).
- Claus, D., Bekerley, R. C. W., Sneath, P. A. Genus Bacillus Cohn 1872. Bergey's manual of systematic bacteriology. 2, 1105-1141 (1986).
- Setlow, P. Spore Resistance Properties. Microbiol Spectr. 2, (2014).
- Setlow, P. Spores of Bacillus subtilis: their resistance to and killing by radiation, heat and chemicals. J Appl Microbiol. 101, 514-525 (2006).
- Roth, S., Feichtinger, J., Hertel, C. Characterization of Bacillus subtilis spore inactivation in low-pressure, low-temperature gas plasma sterilization processes. J Appl Microbiol. 108, 521-531 (2010).
- Roth, S., Feichtinger, J., Hertel, C. Response of Deinococcus radiodurans to low-pressure low-temperature plasma sterilization processes. J Appl Microbiol. 109, 1521-1530 (2010).
- Setlow, B., Setlow, P. Role of DNA repair in Bacillus subtilis spore resistance. J Bacteriol. 178, 3486-3495 (1996).
- Schaeffer, P., Millet, J., Aubert, J. P. Catabolic repression of bacterial sporulation. Proc. Natl. Acad. Sci. 54, 704-711 (1965).
- Simmons, L. A., et al. Comparison of responses to double-strand breaks between Escherichia coli and Bacillus subtilis reveals different requirements for SOS induction. J Bacteriol. 191, 1152-1161 (2009).
- Raguse, M., et al. Improvement of Biological Indicators by Uniformly Distributing Bacillus subtilis Spores in Monolayers To Evaluate Enhanced Spore Decontamination Technologies. Appl Environ Microbiol. 82, 2031-2038 (2016).
- Horneck, G., et al. Protection of bacterial spores in space, a contribution to the discussion on Panspermia. Orig Life Evol Biosph. 31, 527-547 (2001).
- Opretzka, J., Benedikt, J., Awakowicz, P., Wunderlich, J., Keudell, A. v. The role of chemical sputtering during plasma sterilization of Bacillus atrophaeus. J. Phys. D: Appl. Phys. 40, 2826 (2007).
- Stapelmann, K., et al. Utilization of low-pressure plasma to inactivate bacterial spores on stainless steel screws. Int. J. Astrobiol. 13, 597-606 (2013).
- Raguse, M., et al. Understanding of the importance of the spore coat structure and pigmentation in the Bacillus subtilis spore resistance to low-pressure plasma sterilization. J. Phys. D: Appl. Phys. 49, 285401 (2016).
- Pandey, R., et al. Live cell imaging of germination and outgrowth of individual Bacillus subtilis spores; the effect of heat stress quantitatively analyzed with SporeTracker. PloS one. 8, e58972 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved