A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
جمع وتجهيز العقد الليمفاوية من الحيوانات الكبيرة لتحليل الحمض النووي الريبي: التحضير للدراسات ترانسكريبتوميك العقدة الليمفاوية للأنواع الحيوانية الكبيرة
In This Article
Summary
هذا البروتوكول يوفر لمحة عامة عن إجراءات لعزل الحمض النووي الريبي للتنميط ترانسكريبتوميك من العقدة الليمفاوية الأنسجة من الحيوانات الكبيرة، بما في ذلك الخطوات في تحديد واستئصال العقد الليمفاوية من الماشية والحيوانات البرية وأخذ عينات من النهج لتوفير الاتساق عبر عدة الحيوانات، والاعتبارات بالإضافة إلى نتائج تمثيلية للحفاظ على ما بعد جمع وتجهيز لتحليل الحمض النووي الريبي.
Abstract
الحيوانات الكبيرة (تربية الماشية والحياة البرية) بمثابة خزانات هامة من مسببات الأمراض الحيوانية المنشأ، بما في ذلك البروسيلاو bovis بكتريا السالمونيلا كولاي، وهي مفيدة لدراسة نشوء المرض و/أو انتشار البكتيريا في المضيفين الطبيعية. مع الوظيفة الرئيسية الغدد الليمفاوية في الاستجابة المناعية للمضيف، تخدم أنسجة العقدة الليمفاوية كمصدر محتمل للجيش الملكي النيبالي لتحليلات ترانسكريبتوميك المتلقين للمعلومات، من أجل تقييم التغيرات الزمنية في التعبير الجيني في الخلايا على مدى العدوى. تقدم هذه المقالة نظرة عامة عملية جمع العقدة الليمفاوية، وأخذ عينات الأنسجة ورنا المتلقين للمعلومات المعالجة في الثروة الحيوانية، استخدام الماشية (بوس الثور) كنموذج، مع الأمثلة الإضافية المقدمة من البيسون الأمريكي (بيسون بيسون ). البروتوكول يتضمن معلومات حول الموقع، وتحديد وإزالة الغدد الليمفاوية من عدة مواقع رئيسية في الجسم. بالإضافة إلى ذلك، يقدم منهجية أخذ عينات خزعة تسمح لاتساق لأخذ العينات عبر الحيوانات متعددة. وتناقش عدة اعتبارات للحفاظ على عينة، بما في ذلك توليد الحمض النووي الريبي مناسبة لمنهجيات المصب مثل تسلسل الحمض النووي الريبي و RT-PCR. بسبب التأخيرات الطويلة المتأصلة في كبير الحيوان مقابل دراسات دورة الوقت الماوس، وترد نتائج الممثل من بيسون وأنسجة العقدة الليمفاوية الأبقار لوصف مسار التدهور في هذا النوع من الأنسجة، في سياق استعراض الوقت الأعمال المنهجية السابقة بشأن تدهور الجيش الملكي النيبالي في الأنسجة الأخرى. وعموما، هذا البروتوكول ستكون مفيدة لكلا الباحثين البيطرية بداية المشاريع الترنسكربيتوم على العينات الحيوانية الكبيرة والبيولوجيا الجزيئية مهتم بتعلم أساليب للمعالجة في المختبر و في فيفو عينات الأنسجة.
Introduction
ويوفر تحليل تسلسل الحمض النووي الريبي الترنسكربيتوم الليمفاوية الفرصة لتميز الاستجابة المناعية للحيوانات إلى مجموعة متنوعة من العوامل الممرضة. في حين أن هذه المنهجية قد استخدمت على نطاق واسع في الفئران، توسعت مؤخرا تحليلات في أكبر الثدييات1،2. الليمفاوية الحيوانية الثروة الحيوانية/كبيرة يمكن استخدامها لوصف استجابات المضيف لعدوى، ليس فقط لاستخدامها في اللقاح أو دراسات القابلية الوراثية وتحديد الأهداف لتطوير الدواء، ولكن أيضا كنظم نموذجية للدراسات الإنسانية على الأمراض الحيوانية المنشأ. على سبيل المثال، في حالة الحمى المتموجة (الحيوانية المنشأ بكتيرية مرض أن الآثار نصف مليون شخص حول العالم كل عام)، على الرغم من زيادة درجة كبيرة تكاليف، دراسات في الأغنام أو الماعز أكثر صلة بالعدوى البشرية واللقاحات البشرية التنمية أكثر من نماذج حيوانية في المختبر. نماذج الإصابة الماوس الخص العدوى نظام شبكي ولكن ليس علامات سريرية مميزة3.
وتنطوي العملية على أنسجة الحصاد بالضرورة في التجارب على الحيوانات الكبيرة بالمقارنة مع دراسات أجريت على الحيوانات المختبرية، تأخير أطول بين القتل الرحيم وجمع الأنسجة، الذي يمثل تحديا محتملة للحفاظ على الجيش الملكي النيبالي عالية الجودة. رنا سليمة أمر أساسي لتوليد البيانات البيولوجية ذات الصلة ترانسكريبتوميك. الجيل من الحمض النووي الريبي عالية الجودة من عينات الأنسجة حاسمة بشكل خاص للدراسات مسببات الأمراض الحيوانية الكبيرة تجري في مرافق الاحتواء. هذه الدراسات أصلاً أكثر صعوبة لأداء كما أنها لا تتطلب الموافقة على المنشآت والأفراد المدربين تدريبا عاليا فحسب بل أيضا تحمل تكاليف مالية كبيرة، الذي، اعتماداً على العمل، يمكن أن تتراوح بين عشرات ومئات الآلاف من الدولارات. وتشمل هذه الأنواع من الدراسات أيضا التعاون متعدد التخصصات والمعارف المتعددة التخصصات لإنجازها، إضافة إلى تعقيدها. ولذلك، التدريب على التنمية، والتقيد بنظام مبسط لجمع العينات وحفظها يوفر فوائد كبيرة المصب الدراسات الجزيئية للأنسجة من الحيوانات المصابة.
جمع الليمفاوية أكبر تحديات إضافية لجمع الأنسجة مقارنة بعينات مماثلة من العقد الليمفاوية مورين. ويتطلب التحضير للختان عينة فهم أساسي لتشريح العقدة الليمفاوية، بما في ذلك الهياكل الداخلية ذات الصلة. بنية العقدة اللمفاوية يتكون من الفصيصات اللمفاوية محاطة بالجيوب الأنفية مليئة الليمفاوية. هذه الهياكل هي المحاطة كبسولة ليفية، وصعبة. 4 الفصيص اللمفاوية "التشريحية والوظيفية الوحدة الأساسية للعقدة الليمفاوية" وتتألف من المسام ووحدة عميقة القشرية، والحبال النخاع والجيوب الأنفية4 (الشكل 1A). اللمفاويات B و T الصفحة الرئيسية للمسام والوحدات القشرية العميقة، على التوالي. هذه الهياكل توفير سقالة 3D وتيسير التفاعل بين الخلايا الليمفاوية ومستضد أو مستضد عرض الخلايا.
صارخ، المسام والوحدات القشرية عميقة يمكن تحديدها على سطح قطع كما أنها تحتوي على ميشوورك شبكي أكثر كثافة ويبدو أكثر قتامة من الجيوب، التي تتألف من ميشوورك شبكي أكثر حساسية وتظهر أخف (الشكل 1B). حسب الاتفاقية، الباثولوجيا تشير إلى مناطق الليمفاوية كقشرة سطحية (بصيلات)، باراكورتيكس (الوحدات القشرية العميقة) ولب (الحبال النخاع والجيوب الأنفية). فحص ملائم لجميع المناطق الثلاث قد اعتبر كأفضل ممارسة في المبادئ التوجيهية للفحص الباثولوجي الروتينية للعقد الليمفاوية5. علما بأن هناك تباين كبير في الاتساق والحجم، واللون الليمفاوية، حتى داخل حيوان مفردة. كالسن الحيوانات، سوف تميل بالغدد الليمفاوية إلى نقصان في الحجم وتصبح أكثر ثباتا من تلك الحيوانات الأصغر سنا، وعادة ما يرجع إلى زيادة في النسيج الضام بهم والحد من العادي اللمفاوية هيكل6،7.

رقم 1- تشريح العقدة الليمفاوية. (أ) هذه الصورة الكرتون يوضح تشريح العقدة الليمفاوية، تصور الهياكل الأساسية. (ب) هذا ما زالت الصورة تظهر عقده الليمفاوية بقرى قطع في المقطع العرضي. يتم تمييز الهياكل ذات الصلة/طبقات مرئية بالعين المجردة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
اعتماداً على مسألة تجريبية، سوف تكون موضع اهتمام لجمع وتحليل الغدد الليمفاوية المختلفة. العقد اللمفية الطرفية تلك الواقعة في عمق النسيج تحت الجلد. في الماشية، ويشمل العقد الليمفاوية هامشية أو سطحية غالباً ما تستخدم في الممارسة السريرية والتجريبية النكفية، اللهاة، ريتروفارينجيل، بريسكابولار، بريفيمورال (بريكرورال) وسطحية الاربية (سوبراماماري في الإناث، مطمئنين في الذكور) ( الشكل 2). الجدول 1، خصائص رئيسية الغدد الليمفاوية السطحية، كما هو موضح في نظام الماشية8، يرد. وترد بعض خطط جمع العقدة الليمفاوية المحتملة للأمراض البكتيرية المعدية من الماشية أدناه، كنقطة انطلاق للتحقيق.
بروسيلا الإجهاض/بروسيلا مالطية: معيار نيكروبسيس الإجهاض (ب)-إصابة الماشية و مالطي باء--استرداد الماعز المصابة في المركز الوطني للأمراض الحيوانية سوبراماماري، وبريسكابولار، وأنسجة العقدة اللمفية النكفية ، سواء بالنسبة لطحن للتعداد الجرثومي وإعداد الجيش الملكي النيبالي للتنميط التعبير المضيف الجيش الملكي النيبالي. (ب) الإجهاض يمكن استردادها بانتظام في كل من هذه العقد الليمفاوية في الماشية المصابة تجريبيا9. ويمكن الكشف عن وجود البكتيريا في كل نوع من أنواع هذه العقدة الليمفاوية في مالطي باء--إصابة الماعز تصل إلى مالا يقل عن تسعة أشهر بعد الإصابة باستخدام المنهجيات القائمة على الحمض النووي الريبي من دراساتنا (بوجياتو et al.، غير منشورة). السالمونيلا sp.: بريسكابولار، سوبيلياك (بريفيمورال)، وكانت مفيدة الغدد الليمفاوية المساريقي العلوي أثناء تحديد سمات الماشية المذبوحة السالمونيلا انتشار10،،من1112 و وسيكون للفائدة المحتملة للدراسات ترانسكريبتوميك. كولاي O157:H7: المساريقي العلوي الليمفاوية (في منتصف الأمعاء الدقيقة والمواقع البعيدة الأمعاء الدقيقة) يمكن أن تكون مواقع حدوث انتعاش عرضية من البكتيريا في العجول المصابة (ولكن ليس في الماشية المصابة الكبار)13. داء البريميات (Leptospira sp.): قد لوحظ استمرار مزمن من البكتيريا في العقد الليمفاوية تجفيف الغدة الثديية14. متفطره bovis : في الماشية، وكانت البكتيريا العدوى التجريبية بعد استردادها من الليمفاوية الشعاعي و tracheobronchial العجول15. بالإضافة إلى ذلك، استخدمت العقدة الليمفاوية الحمض النووي الريبي لدراسة استجابات المضيف الحيوانات الكبيرة للفيروسات، مثل فيروس متلازمة التنفسية والتناسلية الخنزير2. ويبين الشكل 2 موقع مجموعة فرعية من هذه العقد الليمفاوية الرئيسية في جسم الماشية.
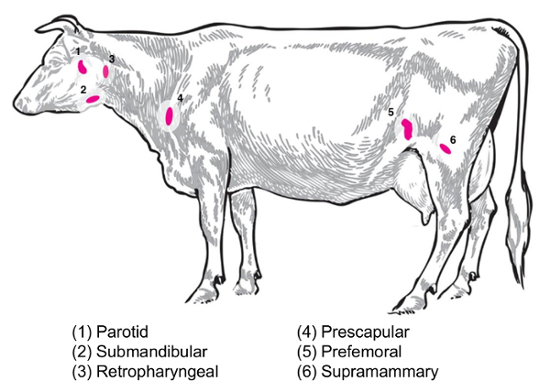
رقم 2: كارتون تصور مواقع مختارة من العقدة الليمفاوية في الثور بوس . هي مشروحة الليمفاوية ذات تعداد رقمي. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
وفي هذه الورقة والفيديو المرتبطة بها، نقدم بروتوكول لعزله كبيرة الليمفاوية الحيوان لدراسات الحمض النووي الريبي، مصممة لتكون مفيدة لعلماء البيولوجيا الجزيئية المشاركة في الدراسات ترانسكريبتوميك للعدوى الحيوانية الكبيرة. أولاً، نحن نقدم لمحة عامة عن إجراءات العزل للعقد الليمفاوية، باستخدام عينات من أنسجة الأبقار وبيسون كأمثلة. يقترن هذه التظاهرة، كما هو معروض في شريط الفيديو، سير عمل لعينات أنسجة استنساخه لعزل الحمض النووي الريبي. المقبل، ونحن تصف اعتبارات هامة للمعالجة العقدة الليمفاوية المصابة، مع تركيز على السلامة والاتساق والجودة الجيش الملكي النيبالي.
يستند إعداد الجيش الملكي النيبالي من الأنسجة مع كاشف isothiocyanate غوانيدين فينول المحمضة الأسلوب الأصلي تشومكزينسكي وساكي16،17، مع تنقية عبر الأعمدة المستندة على السليكا تدور في حضور كل من وكلاء تشاوتروبيك استناداً إلى العمل الأصلي فوجيلستين وغيليسبي18. نحن أيضا دراسة إمكانية استرداد الجيش الملكي النيبالي ترانسكريبتوميكس من الماشية الليمفاوية الاحتفاظ بطرق بديلة. وأخيراً، نستكشف أثر المتغير الوقت على نوعية الجيش النيبالي الملكي في نيكروبسيس الحيوانات الكبيرة، بما في ذلك تجربة ممثل يصور تأثير زيادة الوقت بين القتل الرحيم وأخذ العينات على شكل الجيش الملكي النيبالي المستردة من بيسون و الغدد الليمفاوية الأبقار. هذه المادة سوف يكون مفيداً ليس فقط لعلماء البيولوجيا الجزيئية ولكن الباحثون أيضا إلى الطب البيطري ابتداء من الدراسات ترانسكريبتوميك.
Protocol
الإجراءات نيكروبسي الحيوانية التي صورت هنا مشمولة ببروتوكولات IACUC المعتمدة في المركز الوطني للأمراض الحيوانية، أميس، جوعه جميع التجارب التي أجريت وفقا للمبادئ التوجيهية المعتمدة لرعاية الحيوان والرعاية الاجتماعية.
1-التخطيط المسبق قبل نيكروبسي
- قبل نيكروبسي، إعداد المواد التالية لنقل إلى جناح نيكروبسي:
- 1.5 أو 2 مل ميكروسينتريفوجي أنابيب مليئة ~ 1.0 مل من محلول الحفاظ على الحمض النووي الريبي، في حاوية حامل أو النقل. تأكد من اتباع إرشادات الشركة المصنعة نسبة حجم الحل الحفاظ على حجم الأنسجة.
- المتاح المشارط ونظيفة، ويعقم ملقط: مجموعة واحدة لتشريح الجلد ومجموعة مختلفة لجمع الليمفاوية (واحد لكل العقدة الليمفاوية، للحيوان الواحد)، وبالتالي منع من تلوث عبر الجلد والنباتات البيئية مع العقدة الليمفاوية الأنسجة.
- 3 مم لكمه خزعة أدوات وسكاكين نيكروبسي، حاوية الأدوات الحادة المشارط المستخدمة وأدوات خزعة، وألواح التقطيع أو الصواني القابل للاستخدام في تشريح العقدة الليمفاوية.
- استخدام معدات الوقاية الشخصية، بما في ذلك معدات الوقاية الشخصية اللازمة للعمل على مستوى BSL المناسبة للنظام.
- اﻷوتوكﻻف القابل لإعادة الاستخدام أدوات معدنية، بما في ذلك الملقط، في الأحواض المعدنية قبل نيكروبسي، استخدام البضائع جاف أواني إعداد.
2-تحديد وأخذ عينات من العقد الليمفاوية في الماشية وبيسون
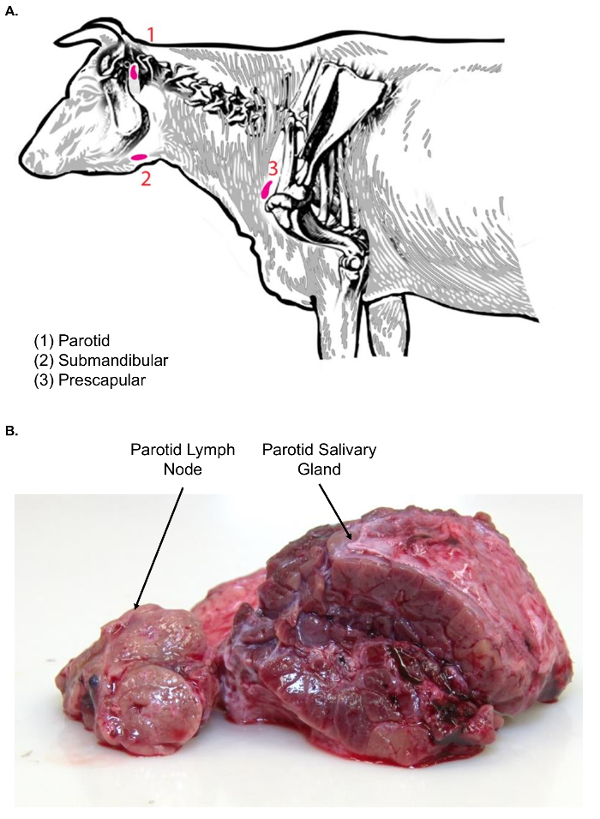
الشكل 3 . الليمفاوية من الأبقار الرأس والرقبة- (أ) هذه الصورة الكرتون يظهر العقد الليمفاوية مختارة من الرأس والرقبة من بوس الثور. (ب) يوضح هذه الصورة العقدة اللمفاوية النكفية في المقطع العرضي (يسار) بالمقارنة بالغدة اللعابية النكفية في المقطع العرضي (يمين). لاحظ الفرق بين أنواع الأنسجة اثنين في القوام. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
-
عزل بريسكابولار الليمفاوية في الماشية وبيسون
- Euthanize الحيوانات (الأبقار أو بيسون في أي سن، حسب الاقتضاء للتجربة) استناداً إلى بروتوكول إياكوك المحلية. تأكيد الوفاة بالأساليب المذكورة على وجه التحديد في البروتوكول IACUC المؤسسية، بما في ذلك نقص ضربات القلب وعدم التنفس، ونظرا لغياب منعكس القرنية. نقل الحيوانات إلى الكلمة نيكروبسي.
ملاحظة: هناك أساليب مختلفة للقتل الرحيم إنسانية المستخدمة في الممارسة المختبرية للحيوانات الكبيرة. بيد أن الإدارة عن طريق الحقن الوريدي حل الصوديوم الصوديوم بينتوباربيتال والفينيتوئين هو الأكثر شيوعاً وافق واستخدام النموذج. الرجوع إلى المبادئ "التوجيهية وبرايتون" للقتل الرحيم للحيوانات. 19
تنبيه: يرجى اتباع جميع بروتوكولات السلامة البيولوجية ذات الصلة نيكروبسي في المؤسسة المضيفة، بما في ذلك المبادئ التوجيهية للتخلص الأمن من الأدوات الحادة في وعاء مقاوم للثقب، وتطهير السكاكين المعدنية القابلة لإعادة الاستخدام والملقط. هذا البروتوكول تولد نفايات الأدوات الحادة من استخدام المشارط المتاح. ارتداء معدات الوقاية الشخصية كما تمليها المبادئ التوجيهية المؤسسية، بما في ذلك الأحذية، والمآزر، والقفازات، وحماية العين. - تحديد 3 مشاركين بالعمل على الأنسجة الحيوانية.
ملاحظة: هنا، ديسيكتور 1 سوف يكون مسؤولاً على نطاق واسع عن تقطيع الأنسجة الحيوانية المطلوب، ديسيكتور 2 سوف تسترد الليمفاوية من مختلف أقسام الحيوان، وسوف تعمل ديسيكتور 3 في جدول منفصل لعزل أجزاء من كل العقدة الليمفاوية و نقلها إلى أنابيب مع حل حافظة. - البدء بوضع الحيوان في ريكومبينسي الجانبي.
- تمديد الكتف بتحريك أطرافهم الجبهة مرة أخرى على مستوى الركبة (رسغ)؛ هذا الاقتراح سوف يعود على الكتف وتسمح ملامسة أسهل من العقدة الليمفاوية. أشعر بوجود من العقدة الليمفاوية "المقطوع".
ملاحظة: أثناء ظروف المرض، تضخم العقد اللمفية قد تكون موجودة، مما يسهل تحديد العقد الليمفاوية، ولكن أيضا يمكن أن تؤثر على هذه العملية اتساق وتكوين وبنية العقدة اللمفاوية. - متى يقع، ومع الكتف لا تزال الموسعة، استخدام سكين دون مشرط أو نيكروبسي لجعل شق جلد على طول الخطوط العريضة للكتف.
ملاحظة: لا تقيد حجم الشق، حتى إذا كانت العقدة الليمفاوية الموجودة عن طريق الجس. شق أكبر يوفر سهولة الوصول إلى الأنسجة العميقة ويجعل ختان العقدة الليمفاوية أسهل بالنسبة ديسيكتور. - استخدام زوج من الملقط، سحب الجلد لتكشف عن نقطة الكتف وعضلات الرقبة.
ملاحظة: كثيرا ما وجدت العقدة الليمفاوية بريسكابولار في الدهون تحت الجلد، وخاصة في الحيوانات أوفيركونديتيونيد. - مرة أخرى، جس موقع العقدة الليمفاوية (الشكل 3A).
ملاحظة: خلافا للدهون تحت الجلد، سوف يعقد العقدة الليمفاوية شكله عند جس. بالإضافة إلى ذلك، الغدد الليمفاوية ليست متجاورة مع أي من الأنسجة المحيطة بها، كما أنها تكون محاطة بكبسولة ليفية رقيقة. - بعد تحديد موقع العقدة الليمفاوية بريسكابولار، بعناية تشريح من الدهون تحت الجلد، باستخدام مشرط وملقط، وعزل العقدة الليمفاوية.
- ابحث عن وجود كبسولة ليفية رقيقة، كما هو مبين في الشكل 1 باء، التمييز بين العقدة الليمفاوية والأنسجة الدهنية؛ الغدد الليمفاوية ليست متجاورة مع أي الأنسجة المحيطة بها.
- نقل العقدة الليمفاوية إلى طاولة تشريح العقدة الليمفاوية، استخدام علبة بلاستيكية لنقل الأنسجة، لزيادة تمزيقها.
ملاحظة: ظهور هذه العقد الليمفاوية في بيسون مشابه. يصور الفيديو المرتبطة مظهر العقدة الليمفاوية بريسكابولار تشريح من الكتف الأيمن البيسون الأمريكي.
- Euthanize الحيوانات (الأبقار أو بيسون في أي سن، حسب الاقتضاء للتجربة) استناداً إلى بروتوكول إياكوك المحلية. تأكيد الوفاة بالأساليب المذكورة على وجه التحديد في البروتوكول IACUC المؤسسية، بما في ذلك نقص ضربات القلب وعدم التنفس، ونظرا لغياب منعكس القرنية. نقل الحيوانات إلى الكلمة نيكروبسي.
-
عزل عقد اللمفية النكفية في الماشية وبيسون
- البدء بوضع الحيوان في ريكومبينسي الجانبي في الطابق نيكروبسي. قم بتحديد موقع الصدغي (المفصل الفكي).
- إذا كان هذا من الصعب على تحديد موقع، تتحرك في الفك السفلي ببطء، وتحديد الموقع الذي تولي الفك السفلي للجمجمة؛ وهذا هو المفصل الفكي.
- بعناية باستخدام سكين دون مشرط أو نيكروبسي، جعل شق في الجلد. بدء الشق الظهرية للمشترك وتوسيعه بطنيا/عمودياً على طول jawline.
- تشريح الجلد بعيداً لتكشف عن النسيج تحت الجلد. ستكون مرئية الغدة اللعابية النكفية أولاً، نظراً لكبر حجم ومظهر السطح لوبولاتيد، وتلوين أحمر.
- استخدام الملقط ومشرط، تتحرك الغدة اللعابية النكفية جانبا للعثور على العقدة اللمفاوية النكفية يجلس فقط الجمجمة والانسي للغدة اللعابية (الشكل 3A). فحص أنسجة العقدة اللمفية النكفية للنسيج قبل إجراء مزيد من المعالجة.
ملاحظة: الغدد الليمفاوية في الوجه (النكفية واللهاة) المرتبطة بالغدد اللعابية، والتي يمكن الخلط بين عزل العقدة الليمفاوية. بالمقارنة بالعقد الليمفاوية، الغدد اللعابية أكبر بكثير، ولها مظهر سطح لوبولاتيد. وعلاوة على ذلك، على السطح، وقطع الغدد اللعابية متجانسة في طبيعتها، ولا يحمل الكلاسيكية النمط المعماري القشرية والنخاع الليمفاوية (الشكل 3B). - المكوس في الغدة مع مشرط. أنه نقل إلى الجدول تشريح العقدة الليمفاوية، باستخدام علبة بلاستيكية لنقل الأنسجة، لزيادة تمزيقها.
- البدء بوضع الحيوان في ريكومبينسي الجانبي في الطابق نيكروبسي. قم بتحديد موقع الصدغي (المفصل الفكي).
-
عزل سوبراماماري الغدد الليمفاوية في الأبقار الإناث وبيسون
- وضع الحيوان في ريكومبينسي الجانبي.
- رفع الساق الخلفية تعريض المنطقة الاربية، والعثور ضرع.
ملاحظة: حيوان صحية، غير المرضعات، ملامسة لهذه الغدد الليمفاوية لا يمكن. في حيوان المرضعات، قد تكون هذه الغدد الليمفاوية ملموسا على الحدود والذيلية لقاعدة ضرع. - استخدام مشرط، جعل شق الظهرية فقط إلى ضرع، يعمل على طول ساقه، لفضح الغدد سوبراماماري.
- تشريح الأنسجة تحت الجلد، والعثور على العقدة الليمفاوية سوبراماماري جزءا لا يتجزأ من طبقة رقيقة من الدهون تحت الجلد. إذا كان لا يمكن تمييزها بصريا، جس الأنسجة المعرضة لوجود بنية راسخة داخل الدهون تحت الجلد.
- استخدام الملقط ومشرط، تشريح بعناية إلى العقدة الليمفاوية من الدهون. أنه نقل إلى الجدول تشريح العقدة الليمفاوية، باستخدام علبة بلاستيكية لنقل الأنسجة، لزيادة تمزيقها.
3-تقطيع وتخزين للعقد اللمفية
- تمرير الليمفاوية معزولة من ديسيكتور 2 ديسيكتور 3 على طاولة تشريح مجاورة إلى الفضاء نيكروبسي الرئيسي. ضع كل العقدة الليمفاوية في مقطع جديد لقطع المجلس. قبل تسمية ألواح التقطيع في الفروع من العقدة الليمفاوية، تيسيرا لاستلام العقد الليمفاوية متعددة بالتتابع. للعينات المعدية، تستخدم الصواني المتاح.
- استخدام الملقط وسكين دون مشرط أو نيكروبسي المتاح، إزالة قسم من العقدة الليمفاوية. باستخدام سكين حادة، جعل قطع السهمي لفتح العقدة الليمفاوية.
- دراسة المناطق داخلية العقدة الليمفاوية، لا سيما في عينات من الحيوانات المصابة، وتبحث عن عدم التماثل، الآفات والاختلافات اللون، إلخ تسجيل الملاحظات.
-
(الخيار 1) مقاطع صغيرة من الأنسجة
- استخدام المشارط المتاح للمكوس قطع كل العقدة الليمفاوية التي هي أقل من 5 مم في السمك ونقل كل قطعة إلى أنبوب مع حلاً حفظها الجيش الملكي النيبالي ملقط نظيف.
-
(الخيار 2) العقدة اللمفية خزعة أو تمزيقها المنهجيات
ملاحظة: خزعات أو تقطيع المنهجيات، عند تطبيقها على أقسام العقدة الليمفاوية موازية عبر العقد المختلفة، والحيوانات، وتوفير الاتساق في عينات الأنسجة لإجراء تحليل الحمض النووي الريبي الجزء الأكبر.-
آسفين أسلوب تقطيع
- وبعد دراسة المقطع السهمي التقاط الخلايا عبر التشكيل الجانبي للعقدة الليمفاوية، والمكوس آسفين على شكل دائري من العقدة الليمفاوية، من مركز للكبسولة الخارجي. لعقدة 2 سم في العرض (الحجم القياسي) (انظر الجدول 1)، قطع آسفين إلى المركز الذي 4 مم في طول القوس الخارجي وسيكون 5 مم في السمك وزن رطب من ~ 100 مغ.
- استخدام المبضع، قطع الاسفين إلى قطع صغيرة، لا أكثر سمكا من 5 مم، وحوالي 50-100 مغ كل في الوزن الرطب الأنسجة.
ملاحظة: للاتساق، معالجة جميع القطع آسفين من عقده الليمفاوية واحدة في دفعة واحدة أو في أنابيب منفصلة متبوعاً بالحمض النووي الريبي تجميع لتوفير ملف تعريف الحمض النووي الريبي ممثل من العقدة الليمفاوية للفائدة. - ضع قطع الأنسجة بالملقط في الأنابيب التي تحتوي على وحدات تخزين 10 على الأقل من الجيش الملكي النيبالي الحفاظ على الحل، بالمقارنة مع حجم الأنسجة.
-
أسلوب خزعة لكمه
- حدد أداة خزعة لكمه إذا كان الهدف جمع أقسام محددة، مثل المسام محددة من العقدة. حدد أداة متسقة مع حجم العينة المطلوب لجمع. تتوفر أدوات خزعة لكمه في طائفة من الأحجام، من 1 إلى 8 ملم في القطر.
- بصريا تحديد المناطق ذات الأهمية للعينة في العقدة الليمفاوية.
- استخدم أداة خزعة لكمه للمكوس فروع المصلحة والضغط وتحول الأداة في الأنسجة لإنشاء نواة. نقل قطعة النسيج مع الملقط إلى أنبوب يحتوي على وحدات تخزين 10 على الأقل من الجيش الملكي النيبالي الحفاظ على الحل. إذا كان أكثر سمكا من 5 مم، استخدام الملقط ومشرط كذلك تقسيم الأنسجة إلى أجزاء أصغر.
-
آسفين أسلوب تقطيع
- متى تم نقل العينات إلى الحفاظ على الحل (مثلاً.، رنالاتير)، نقلها إلى المختبر في درجة حرارة الغرفة.
- تخزين العينات في 4 درجات مئوية بين عشية وضحاها السماح لاختراق الأنسجة.
- وفي اليوم التالي من أجل إيقاف الحل حافظة الحمض النووي الريبي الزائدة وتخزين عينات الأنسجة في-80 درجة مئوية. إزالة حافظة قدر ممكن قبل تجميد العينات. استخدام تلميح ميكروبيبيتي P1000 و/أو P200 إزالة حل حافظة الجيش الملكي النيبالي تتسم بكفاءة.
تنبيه: تجاهل الحل الحفاظ على وفوجازارو على نحو ملائم، استناداً إلى خصائص المعدية الممرض المستخدمة فضلا عن مخاطر الحل الحافظة كما هو محدد في "ورقة بيانات السلامة" الكيميائية والبيئية.
ملاحظة: تقدم المبادئ التوجيهية المقدمة هنا للحل الحفاظ على الحمض النووي الريبي الموصوفة في الجدول للمواد. راجع إرشادات الشركة المصنعة إذا كان استخدام الحلول البديلة الحفاظ على.
4-تجهيز من الحمض النووي الريبي الليمفاوية
تنبيه: ارتداء معطف مختبر، والقفازات، وحماية العين السليم لخطوات المعالجة.
ملاحظة: الكاشف تستند الفينول المستخدم هنا هو المبين في الجدول للمواد (وهو البروتوكول استناداً إلى إرشادات الشركة المصنعة)20. قد يتطلب استخدام الكواشف بديلة تستند الفينول تعديل الإجراء، استناداً إلى توصيات الشركة المصنعة للمنتج المحددة التي تم شراؤها.
- قبل الوصول إلى العينات، قاسمة قبل الكاشف تستند الفينول المثلجة (4 درجة مئوية) إلى أنابيب التجانس (1.5 مل/أنبوب)، استخدام ماصة.
تنبيه: هو الفينول السامة وقابلة للتآكل، وخطرا على صحة. وهو كلوروفورم السامة وخطرا على صحة. إكمال خطوات المعالجة 4.1-4.9 في غطاء الأبخرة الكيماوية، وارتداء قفازات لمنع أي اتصال مع المواد الكيميائية. في الولايات المتحدة، كلوروفورم نفاية خطرة؛ التخلص من الأنابيب التي تحتوي على نفايات خطرة طبقاً للمبادئ التوجيهية المحلية والمؤسسية. عملية عينات الأنسجة من الحيوانات المصابة بمسببات الأمراض تحت المقابلة BSL-2، BSL-3، أو BSL 4 المبادئ التوجيهية. - متى يمكن خففت عينة من أنابيب ميكروسينتريفوجي مع الملقط نظيفة، نقل على الفور حوالي 50-100 مغ الأنسجة المحفوظة إلى تجانس الأنبوب الذي يحتوي على الكاشف تستند الفينول.
- تحد من ذوبان الجليد قبل الإضافة إلى الكاشف تستند الفينول. استخدام التخزين على الثلج الجاف عندما تتم إزالة عينات متعددة من الثلاجة للمعالجة.
- أحكام كاب الأنبوب ووضعه على الخالطون ومجانسة العينة مع الخالطون أنسجة ساكنة دوار في الكاشف تستند الفينول. إكمال التجهيز في درجة حرارة الغرفة. عند إكمال، تحقق لظهور خفيف لضمان نجاح كان تجانس العينة؛ ينبغي أن تكون متفرقة الأنسجة إلى تعليق الملبدة بالغيوم.
ملاحظة: يتم استخدام إعداد استخراج 2 دقيقة بالحمض النووي الريبي (الإعداد RNA_02_1 المحددة مسبقاً الخالطون الموصوفة في الجدول للمواد؛ وصممت للأنسجة المجمدة). الدوار-الساكنة المحددة في هذا البروتوكول (انظر الجدول للمواد) كبير المسننة وتكييفها لتجانس مجموعة من أنواع الأنسجة، بما في ذلك المواد الليفية. الإعداد RNA_02_01 مصمم خصيصا لتجميد (على عكس الطازجة) الأنسجة. الليمفاوية لديها مكونات النسيج الضام الليفي، ينصح الخالطون ساكنة دوار وبالمثل أمثل لتحقيق الانفصال فعالية. انظر "المعهد الوطني لعلوم الصحة البيئية"21 للحصول على معلومات إضافية حول توصيات التجانس.- إذا كانت لا تزال أجزاء كبيرة من الأنسجة بعد التجانس، كرر الإجراء التجانس. بغية استعادة كفاءة الجيش الملكي النيبالي، يجب أيضا فصل الأنسجة.
- لقطع العقدة الليمفاوية الليفي أكثر، استخدم ملقط ومقص لقبل فرم قطعة العقدة الليمفاوية إلى عدة قطع أصغر قبل نقل إلى أنبوب التجانس. كما ورد في المقدمة، قد تكون العقدة الليمفاوية الأنسجة من الحيوانات الأكبر سنا أكثر ليفية.
ملاحظة: إذا كان المطلوب هو إجراء تحليل مزدوج للمضيف والممرض الجيش الملكي النيبالي، قد يكون العلاج إضافية (مثل التجانس حبة) اللازمة لاسترداد رنا البكتيرية، خاصة إذا كانت إيجابية من مسببات الأمراض موجودة في الأنسجة.
- فورا إزالة عينة المتجانس من الأنابيب وتحويلها إلى أنابيب ميكروسينتريفوجي خالية من رناسي (مل 2.0 في الحجم) مع ميكروبيبيتي P1000.
- الطرد المركزي العينة لمدة 5 دقائق في 12,000 س ز عند 4 درجة مئوية إزالة أي بقايا العينة. استخدام تلميح ميكروبيبيتي P1000، نقل المادة طافية على أنبوب ميكروسينتريفوجي جديدة، تاركين بيليه.
- احتضان المادة طافية لمدة 5 دقائق في درجة حرارة الغرفة. تقسيم كل عينة بين أنابيب ميكروسينتريفوجي 1.5 اثنين.
- إضافة 0.2 مل كلوروفورم كل 1 مل الكاشف تستند الفينول (أي، 0.3 مل عينة 1.5 مل)؛ عكس ذلك من جهة لمدة 1-2 دقيقة خلط المراحل، ولكن لا دوامة لا العينة. تبني عليه لمدة 2 دقيقة في درجة حرارة الغرفة.
- الطرد المركزي أنه لمدة 15 دقيقة في 12,000 س ز في 4 درجات مئوية.
- بعناية إزالة المرحلة العليا، مائي واضح مع تلميح ميكروبيبيتي (P1000 أو P200) سوف تشكل الطبقة العليا، دون الإخلال بطبقة كلوروفورم الفينول الأحمر أو في الطور البيني. أنه نقل إلى أنبوب ميكروسينتريفوجي جديدة.
- مزجها مع حجم متساوية من الإيثانول 100%؛ مزيج دقيق بعكس الأنبوب 4-5 مرات. غالباً ما تظهر الأنبوب الملبدة بالغيوم.
- مع تلميح ميكروبيبيتي، نقل السائل إلى عمود دوران تجاري القائم على السليكا، لزيادة تنقية والوت الجيش الملكي النيبالي، اتباع إرشادات الشركة المصنعة22. الوت المتولدة من الجيش الملكي النيبالي ~ 50 مغ أنسجة إلى 50-100 ميليلتر من المياه خالية من رناسي.
ملاحظة: بينما يزيل كاشف تستند الفينول الاستخراج الحمض النووي في المرحلة العضوية، من أجل استخدام المتلقين للمعلومات من الحمض النووي الريبي في PCR قرت و/أو التطبيقات تسلسل الحمض النووي الريبي، ينصح إجراء معالجة إضافية لعينات الحمض النووي الريبي مع الدناز. - قاسمة الجيش الملكي النيبالي التيد لفصل أنابيب لاستخدامها في تقييم الكمي، ونوعية، للحد من أي تجميد ذوبان عينة الحمض النووي الريبي الرئيسية. نقل الأنابيب إلى-80 درجة مئوية للتخزين.
- في حالة عينات العقدة الليمفاوية المستمدة من الحيوانات المصابة بمسببات الأمراض الحيوانية المنشأ، لا سيما على مستوى الاحتواء BSL-3، التحقق من صحة عينة الحمض النووي الريبي الناتجة عن عدم وجود مسببات الأمراض إذا كان سيتم نقل العينة إلى منطقة احتواء مستوى السلامة السفلي لتحليل نوعية RT-PCR و/أو إعداد مكتبة تسلسل الحمض النووي الريبي.
ملاحظة: من المهم النظر في اللوائح المحلية، وفي حالة مركز السيطرة على الأمراض (مراكز السيطرة على الأمراض والوقاية) المبادئ التوجيهية المنظمة للعمل مع العوامل المختارة، من الضروري التحقق من صحة جميع الإجراءات المنظمة في الموقع المحلي للباحث.- إزالة 1/10th حجم كل عينة الحمض النووي الريبي التيد من الخطوة 4، 12 (أي، 5 ميليلتر من 50 ميليلتر من الجيش الملكي النيبالي إجمالي). باستخدام تقنية معقمة، مزيج من العينة مع 100 ميليلتر من مرق النمو البكتيري في أنبوب ميكروسينتريفوجي معقم 1.5 مل. استخدام الناشرة بلاستيك عقيمة، ينتشر الخليط مرق الجيش الملكي النيبالي عبر سطح صفيحة أجار.
ملاحظة: حدد مرق نوع واجار صفيحة تمشيا مع نمو مسببات المرض الذي طعن في الحيوانات. - احتضان لوحة أجار تحت ظروف محددة لنمو مسببات المرض الذي طعن في الحيوانات. التحقق من عدم وجود البكتيريا المستردة قبل إزالة العينات من احتواء BSL-3.
ملاحظة: رنا التيد الناتجة عن ذلك، بعد التقييم الكمي، واختبارات السلامة، مناسبة للتطبيقات المتلقين للمعلومات، بما في ذلك إجراء تسلسل الحمض النووي الريبي وتحليل RT-PCR.
- إزالة 1/10th حجم كل عينة الحمض النووي الريبي التيد من الخطوة 4، 12 (أي، 5 ميليلتر من 50 ميليلتر من الجيش الملكي النيبالي إجمالي). باستخدام تقنية معقمة، مزيج من العينة مع 100 ميليلتر من مرق النمو البكتيري في أنبوب ميكروسينتريفوجي معقم 1.5 مل. استخدام الناشرة بلاستيك عقيمة، ينتشر الخليط مرق الجيش الملكي النيبالي عبر سطح صفيحة أجار.
- تقييم الانتعاش الجيش الملكي النيبالي ونقاء باستخدام جهاز المطياف الضوئي. لتقييم نوعية الجيش الملكي النيبالي، تحميل 1-2 ميليلتر من العينة جهاز المطياف الضوئي لتحليل الحمض النووي الريبي التيد. تسجيل طائفة من العينة في نطاق الأشعة فوق البنفسجية (الأشعة فوق البنفسجية).
- من طيف الأشعة فوق البنفسجية، تسجيل نسبة280 &/A260ألف ونسبة230 &/A260ألف وقيمة260 ألف للعينة (A = امتصاص).
- كما الحمض النووي الريبي المفرد-الذين تقطعت بهم السبل في تركيز من 40 ميكروغرام/مل امتصاص 1.0 في 260 nm، حساب تركيز الحمض النووي الريبي (ميكروغرام/مل) بضرب A260 x 40 للعينات النقية.
- كطريقة سريعة لتقييم سلامة الحمض النووي الريبي، لاستبعاد أي عينات المتدهورة من مزيد من التحليل، مزيج 2 ميليلتر لكل عينة من الحمض النووي الريبي مع 4 ميليلتر لصبغ 1.5 x formamide تحميل [95% منزوع ميثلامين، بروموفينول 0.025% (w/v) الأزرق، زايلين زيلين نفط 0.025% (w/v)، 5 ملم يدتا (pH 8.0)، 0.025% (w/v) الحزب الديمقراطي الصربي] في 1.5 مل أنابيب ميكروسينتريفوجي23،24.
- حرارة الأنابيب عند 70 درجة مئوية لمدة 1 دقيقة، وثم نقل هذه الأنابيب الجليد لمدة 1 دقيقة.
- تحميل العينات إلى 1% [اغروس] هلام أعدت في 1 x TBE (للحصول على وصف كامل من الأصلية [اغروس] هلام التفريد للحمض النووي الريبي، انظر نيلسين وحنون، ريو والابن آريس)24. تفصل العينات بأساليب التفريد هلام القياسية وتأكيد وجود عصابات الرنا الريباسي 28S و 18S.
- متابعة التفريد هلام مع أساليب التحليل الكمي لتحديد سلامة الحمض النووي الريبي [مثلاً، إجراء تحليل (عدد سلامة الحمض النووي الريبي) بيواناليزير ورين] كما هو موضح في نتائج الممثل ومولر، سين وآخرون. 25 وشرودر، ألف- et al. 26.
5. طريقة استخراج بديل من الفورمالين--الثابتة، الأنسجة جزءا لا يتجزأ من البارافين (FFPE)
ملاحظة: على الرغم من أن الحفاظ على الأنسجة FFPE لا تمثل الأسلوب الأكثر قوة للحفاظ على الحمض النووي، البروتوكول الواردة أدناه يمكن أن يكون وسيلة لدراسة بعض التغيرات النسخي عندما الأنسجة المحفوظة الأخرى غير متوفرة.
- إعداد الكواشف الفورمالين لحفظ الأنسجة بالاستغناء عن الفورمالين في حاويات بلاستيكية. ينبغي الحفاظ على الأنسجة في الفورمالين بنسبة 20:1 الفورمالين: الأنسجة الحجم والوزن، على التوالي.
تنبيه: فورمالين مسرطن بشري معروف وعلى الرغم من عدم سمية حادة، التعرض المزمن (عادة من خلال استنشاق الأبخرة) يمكن أن يمثل خطرا كبيرا على صحة. التهوية ومعدات الوقاية الشخصية (أي، استخدام قفازات النتريل، إلى تغيير حدود 15 دقيقة بعد التعرض الأولى) المطلوبة للتقليل من المخاطر الصحية. تشير إلى "معيار OSHA فورمالدهايد" (29 CFR 1910.1048) للحصول على معلومات إضافية حول تقييم التعرض للمخاطر ورصد.
ملاحظة: باستخدام الفورمالين القليل جداً يمكن أن تؤثر على قدرة الأنسجة يصبح الحفاظ عليها تماما عندما أغرقت في حافظة. - بعد عزل أنسجة اهتمام، بعناية تقليم الأنسجة إلى أقل من 5 مم في السمك.
- بعناية باستخدام الملقط، تغرق الأنسجة قلصت في الفورمالين لتقليل أي الرش.
ملاحظة: الأنسجة ينبغي أن يكون تماما غارقة في الفورمالين للسماح بتثبيت كاملة. من الأهمية بمكان أن جميع أسطح الأنسجة مغطاة تماما من الفورمالين.
- بعناية باستخدام الملقط، تغرق الأنسجة قلصت في الفورمالين لتقليل أي الرش.
- بمجرد قد تم غمر الأنسجة في الفورمالين، السماح لتثبيت الأنسجة يحدث على الأقل 24 ساعة في درجة حرارة الغرفة.
ملاحظة: تخترق الفورمالين الأنسجة ببطء، بمعدل 1 مم كل ساعة من جميع الأسطح27،28. ولذلك، الحفاظ على سمك الفروع الأنسجة إلى أقل من 5 مم النتائج في تثبيت سريع للأنسجة كاملة. - بعد تثبيت البرنامج، نقل الأنسجة كاشف مناسب لتضمين البارافين.
ملاحظة: على سبيل المثال، تم نقل الأنسجة درست في هذه المخطوطة إلى إيثانول 70% قبل التضمين. - تضمين الأنسجة في البارافين. 29
- قسم الأنسجة إلى 10-80 ميكرون بسمك (استخدام 10-20 ميكرومتر إذا ميرنا هو المطلوب لاستخراجها)29.
- استخدام المبضع، والملقط، إزالة قطعة نسيج 40 مغ من كل عينة معالجتها ووضعها في أنبوب عقيم وخالية من نوكلاس [ميكروفوج].
- استخدام مجموعة أدوات تجارية مصممة ديبارافينيزيشن واسترداد الحمض النووي من عينات الأنسجة FFPE لاستخراج الحمض النووي الريبي من العينات التي تم الحفاظ عليها.
ملاحظة: هذه المجموعة المشار إليها في الجدول للمواد يستخدم زيلين نفط ويغسل الإيثانول لإزالة البارافين وخطوة علاج مبطلات وعامل تصفية ألياف زجاجية لتنقية الحمض النووي الريبي.
النتائج
استخدام الاعتبارات المعروضة في هذه المقالة (الخطوات 1-4 من البروتوكول) سيساعد في استعادة الجيش الملكي النيبالي من العينات الحيوانية الكبيرة التي مناسبة لإجراء تحليل المتلقين للمعلومات في دراسات التعبير الجيني المضيف. يتم تقييم نوعية الحمض النووي الريبي للتطبيقات المصب بتدابير موحدة متع?...
Discussion
معظم الدراسات ترانسكريبتوميك والبروتوكولات المرتبطة بها التركيز على العينات البشرية الماوس أو الفئران، أو بعد الوفاة. بيد أن التحقيقات في الثروة الحيوانية والحياة البرية تقدم مجموعة واسعة من الفرص لوصف استجابة مناعية للمرض، سواء عند الاقتضاء للطب البيطري، وفيما يتعلق بالأمراض الحيوان...
Disclosures
الكتاب قد لا يوجد تضارب في الكشف عن. جميع البحوث تمول بأموال داخلية من "وزارة الزراعة الأميركية"، دائرة البحوث الزراعية. جميع الإشارات إلى منتجات محددة هي المقدمة لغرض إمكانية تكرار نتائج تجريبية ولا تمثل أي مصادقة من هذه المنتجات من الحكومة الاتحادية.
Acknowledgements
المؤلف يود أن يشكر الدين جيمس على عمله الممتاز في جميع بالفيديو ومعالجة الفيديو؛ مايكل مارتي على عمله الممتاز في توليد الصور الرقمية الماشية؛ فالتر ليليا لمساعدة لها مع استخراج الحمض النووي الريبي ويدير بيواناليزير؛ ميتش بالمر وكانيبي كارلي لاستعراض مفيدة وردود الفعل على صور العقدة الليمفاوية؛ ورعاية الحيوان وموظفي الطب البيطري في المركز الوطني للأمراض الحيوانية لكل العمل الشاق والمساعدة في تربية الحيوانات وإعداد نيكروبسيس.
Materials
| Name | Company | Catalog Number | Comments |
| RNA preservation solution (we used RNALater for all experiments) | ThermoFisher | AM7020 | |
| 1.5 ml or 2 ml polypropylene microcentrifuge tubes | Fisher Scientific | 05-408-129 | |
| Disposable scalpels | Daigger Scientific | EF7281 | |
| Tissue forceps, rat tooth | Fisher Scientific | 12-460-117 | Other tissue forceps available including curved tip, tapered edge, etc. , depends on user preference |
| 3 mm punch biopsy needles | Fisher Scientific | NC9949469 | |
| Sharps container (small and transportable for necropsy) | Stericycle | 8900SA | 1 qt. size shown here |
| Cutting boards or disposable trays | Fisher Scientific | 09-002-24A | Available in a variety of sizes, depends on user preference |
| Personal protective equipment | Varies with pathogen (gloves, respirator masks, goggles, etc.) | ||
| Phenol-based RNA extraction reagent (we used TRIzol Reagent for all experiments) | ThermoFisher | 15596026 | |
| Silica column-based RNA extraction kit (we used the PureLink RNA Mini kit for all experiments) | ThermoFisher | 12183018A | Designed for up to 100 mg tissue |
| 100% Ethanol (200 proof for molecular biology) | Sigma-Aldrich | E7023 | |
| Tissue homogenizer with enclosed homogenization tubes (we used the gentleMACS dissociator for all experiments) | Miltenyi Biotec | 130-093-235 | |
| Agarose (General, for gel electrophoresis) | Sigma-Aldrich | A9539 | |
| 1X TBE | Fisher Scientific | BP24301 | Can also make from scratch in the laboratory |
| Deionized formamide | EMD Millipore | S4117 | |
| Sodium dodecyl sulfate | Sigma-Aldrich | L3771 | |
| Bromophenol blue | Sigma-Aldrich | 114391 | |
| Xylene cyanol | Sigma-Aldrich | X4126 | |
| EDTA (Ethylenediaminetetraacetic acid) | Sigma-Aldrich | EDS | |
| UV-Vis Spectrophotometer (we used the NanoDrop Spectrophotometer) | ThermoFisher | ND-2000 | |
| Device for quantitative RNA assessment (we used the Bioanalyzer, with associated components and protocols) | Agilent | G2939BA | |
| FFPE RNA extraction kit (we used the RecoverAll Total Nucleic Acid Isolation Kit for Formalin Fixed, Paraffin Embedded Tissue) | ThermoFisher | AM1975 | |
| Plastic spreader (L-shaped spreader) | Fisher Scientific | 14-665-231 | Only needed for sterility testing for samples from infected animals |
| Necropsy knives | Livestock Concepts | WI-0009209 |
References
- Tizioto, P. C., et al. Immunological response to single pathogen challenge with agents of the bovine respiratory disease complex: an RNA-sequence analysis of the bronchial lymph node transcriptome. PLoS One. 10 (6), e0131459 (2015).
- Miller, L. C., et al. Analysis of the swine tracheobronchial lymph node transcriptomic response to infection with a Chinese highly pathogenic strain of porcine reproductive and respiratory syndrome virus. BMC Veterinary Research. 8, 208 (2012).
- Silva, T. M. A., Costa, E. A., Paixao, T. A., Tsolis, R. M., Santos, R. L. Laboratory animal models for brucellosis research. Journal of Biomedicine and Biotechnology. 2011, 518323 (2011).
- Willard-Mack, C. L. Normal structure, function, and histology of the lymph nodes. Toxicologic Pathology. 34, 409-424 (2006).
- Elmore, S. A. Histopathology of the lymph nodes. Toxicologic Pathology. 34 (5), 425-454 (2006).
- Luscieti, P., Hubschmid, T. h., Cottier, H., Hess, M. W., Sobin, L. H. Human lymph node morphology as a function of age and site. Journal of Clinical Pathology. 33 (5), 454-461 (1980).
- Hadamitsky, C., et al. Age-dependent histoarchitectural changes in human lymph nodes: an underestimated process with clinical relevance?. Journal of Anatomy. 216 (5), 556-562 (2010).
- Sisson, S., Grossman, J. D., Getty, R. . Sisson and Grossman’s The Anatomy of Domestic Animals, Volume 1. , (1975).
- Olsen, S. C., Johnson, C. Comparison of abortion and infection after experimental challenge of pregnant bison and cattle with Brucella abortus strain 2308. Clinical and Vaccine Immunology. 18 (12), 2075-2078 (2011).
- Brichta-Harhay, D. M., et al. Microbiological analysis of bovine lymph nodes for the detection of Salmonella enterica. Journal of Food Protection. 75 (5), 854-858 (2012).
- Samuel, J. L., O’Boyle, D. A., Mathers, W. J., Frost, A. J. Isolation of Salmonella from mesenteric lymph nodes of healthy cattle at slaughter. Research in Veterinary Science. 28 (2), 238-241 (1980).
- Arthur, T. M., et al. Prevalence and characterization of Salmonella in bovine lymph nodes potentially destined for use in ground beef. Journal of Food Protection. 71 (8), 1685-1688 (2008).
- Cray, W. C., Moon, H. W. Experimental infection of calves and adult cattle with Escherichia coli O157:H7. Applied and Environmental Microbiology. 61 (4), 1586-1590 (1995).
- Thiermann, A. B. Experimental leptospiral infections in pregnant cattle with organisms of the Hebdomadis serogroup. American Journal of Veterinary Research. 43 (5), 780-784 (1982).
- Palmer, M. V., Waters, W. R., Whipple, D. L. Investigation of the transmission of Mycobacterium bovis from deer to cattle through indirect contact. American Journal of Veterinary Research. 65 (11), 1483-1489 (2004).
- Chomczynski, P. A reagent for the single-step simultaneous isolation of RNA, DNA, and proteins from cell and tissue samples. BioTechniques. 15 (3), 532-537 (1993).
- Chomczynski, P., Sacchi, N. Single step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Vogelstein, B., Gillespie, D. Preparative and analytical purification of DNA from agarose. Proceedings of the National Academy of Sciences of the United States of America. 76 (2), 615-619 (1979).
- . . AVMA Guidelines for the Euthanasia of Animals. , (2013).
- . . TRIzol Reagent Manual. , (2016).
- . . Disruption and Homogenization of Tissue for the Extraction of RNA. , (2014).
- . . PureLink RNA Mini Kit Protocol . , (2012).
- . . RNA Gel-loading Buffer. , (2006).
- Rio, D. C., Ares, M., Hannon, G. J., Nilsen, T. W. Nondenaturing Agarose Gel Electrophoresis of RNA. Cold Spring Harbor Protocols. , (2010).
- Mueller, O., et al. A microfluidic system for high-speed reproducible DNA sizing and quantitation. Electrophoresis. 21 (1), 128-134 (2000).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Molecular Biology. 7 (3), (2006).
- Suvarna, K. S., Layton, C., Bancroft, J. D. . Bancroft’s Theory and Practice of Histological Techniques. , (2012).
- Medawar, P. B. The rate of penetration of fixatives. Journal of Microscopy. 61 (1-2), 46-57 (1941).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods in Enzymology. 533, 225-233 (2013).
- Fleige, S., Pfaffl, M. W. RNA integrity and the effect on the real-time qRT-PCR performance. Molecular Aspects of Medicine. 27, 126-139 (2006).
- Fajardy, I., et al. Time course analysis of RNA stability in human placenta. BMC Molecular Biology. 10 (21), (2009).
- Bahar, B., et al. Long-term stability of RNA in post-mortem bovine skeletal muscle, liver and subcutaneous adipose tissues. BMC Molecular Biology. 8, 108 (2007).
- Yamagishi, A., et al. Gene profiling and bioinformatics analyses reveal time course differential gene expression in surgically resected colorectal tissues. Oncology Reports. 31 (4), 1532-1538 (2014).
- Choi, S., Ray, H. E., Lai, S. H., Alwood, J. S., Globus, R. K. Preservation of multiple mammalian tissues to maximize science return from ground based and spaceflight experiments. PLoS One. 11 (12), e0167391 (2016).
- Almeida, A., Thiery, J. P., Magdelenat, H., Radvanyi, F. Gene expression analysis by real-time reverse transcription polymerase chain reaction: influence of tissue handling. Analytical Biochemistry. 328 (2), 101-108 (2004).
- Lee, S. M. L., Schelcher, C., Thasler, R., Schiergens, T. S., Thasler, W. E. Pre-analytical determination of the effect of extended warm or cold ischaemia on RNA stability in the human ileum mucosa. PLoS One. 10 (9), e0138214 (2015).
- Kap, M., et al. The influence of tissue procurement procedures on RNA integrity, gene expression, and morphology in porcine and human liver tissue. Biopreservation and Biobanking. 13 (3), 200-206 (2015).
- Hong, S. H., et al. Effects of delay in the snap freezing of colorectal cancer tissues on the quality of DNA and RNA. Journal of the Korean Society of Coloproctology. 26 (5), 316-325 (2010).
- Lee, S. M., et al. RNA stability in human liver: comparison of different processing times, temperatures and methods. Molecular Biotechnology. 53 (1), 1-8 (2013).
- Morrison, P. K., et al. Post-mortem stability of RNA in skeletal muscle and adipose tissue and the tissue-specific expression of myostatin, perilipin and associated factors in the horse. PLoS One. 9 (6), e100810 (2014).
- Seear, P. J., Sweeney, G. E. Stability of RNA isolated from post-mortem tissues of Atlantic salmon (Salmo salar L.). Fish Physiology and Biochemistry. 34 (1), 19-24 (2008).
- Marchuk, L., Sciore, P., Reno, C., Frank, C. B., Hart, D. A. Postmortem stability of total RNA isolated from rabbit ligament, tendon, and cartilage. Biochimica et Biophysica Acta. 1379 (2), 171-177 (1998).
- Inoue, H., Kimura, A., Tuji, T. Degradation profile of mRNA in a dead rat body: basic semi-quantification study. Forensic Science International. 130 (2-3), 127-132 (2002).
- Micke, P., et al. Biobanking of fresh frozen tissue: RNA is stable in nonfixed surgical specimens. Laboratory Investigation. 86 (2), 202-211 (2006).
- Srinivasan, M., Sedmak, D., Jewell, S. Effect of fixatives and tissue processing on the content and integrity of nucleic acids. The American Journal of Pathology. 161 (6), 1961-1971 (2002).
- Ahmed, A. M., et al. Variation in the ovine abomasal lymph node transcriptome between breeds known to differ in resistance to the gastrointestinal nematode. PLoS One. 10 (5), e0124823 (2015).
- Russell, G. C., et al. Host gene expression changes in cattle infected with Alcelaphine herpesvirus 1. Virus Research. 169 (1), 246-254 (2012).
- Avraham, R., et al. A highly multiplexed and sensitive RNA-seq protocol for simultaneous analysis of host and pathogen transcriptomes. Nature Protocols. 11, 1477-1491 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved