A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
النسخ المتماثل لمطلوب، "مكتبة نونريدوندانت" من سلالة الزّنجاريّة Pseudomonas PA14 ينقول طفرات الإدراج
* These authors contributed equally
In This Article
Summary
أسباب الإصابة الزائفة الزّنجاريّة الاعتلال كبيرة في المضيفين الضعيفة. المكتبة متحولة الإدراج ينقول نونريدوندانت P. الزّنجاريّة سلالة PA14، عينت مجموعة PA14NR، يسهل تحليل وظيفة الجينات في عمليات عديدة. قدم هنا وضع بروتوكول لإنشاء نسخ عالية الجودة من المكتبة متحولة تعيين PA14NR.
Abstract
الزائفة الزّنجاريّة بكتيريا سلبية الغرام متنوعة وقابلة للتكيف فينوتيبيكالي وجينوتيبيكالي في كل مكان في البيئات البشرية. P. الزّنجاريّة قادرة على تشكيل الأغشية الحيوية وتطوير المقاومة للمضادات الحيوية وإنتاج عوامل الفوعة وتتطور سريعاً أثناء وجود عدوى مزمنة. وهكذا P. الزّنجاريّة يمكن أن يسبب الحادة والمزمنة، صعوبة في علاج الالتهابات، نتج عنه اعتلال كبير في قطاعات معينة من السكان المريض. هو سلالة P. الزّنجاريّة PA14 عزل سريرية بشرية مع بنية جينوم مصانة التي تصيب مجموعة متنوعة من المضيفين الثدييات ونونفيرتيبراتي مما يجعل PA14 عبئا جذابة لدراسة هذه العوامل الممرضة. في عام 2006، تم إنشاء مكتبة متحولة إدراج ينقول نونريدوندانت تحتوي على طفرات 5,459 المقابلة للجينات PA14 تنبأ 4,596. ومنذ ذلك الحين، وقد يسمح بتوزيع المكتبة PA14 مجتمع البحوث لتحسين فهم وظيفة الجينات الفردية ومسارات معقدة من P. الزّنجاريّة. ويتطلب الحفاظ على سلامة المكتبة من خلال عملية النسخ المتماثل تقنيات التعامل السليم والدقيق. تحقيقا لهذه الغاية، يعرض هذه المخطوطة البروتوكولات التي تصف بالتفصيل الخطوات التي تشارك في النسخ المتماثل مكتبة ومكتبة مراقبة الجودة والتخزين السليم لطفرات الفردية.
Introduction
الزائفة الزّنجاريّة بكتيريا سلبية الغرام متنوعة وقابلة للتكيف فينوتيبيكالي وجينوتيبيكالي موجودة في التربة، والمياه، وبيئات معظم البشرية، فضلا عن تبدل الجلد. مقارنة بالعديد من أنواع الجراثيم، وقد P. الزّنجاريّة جينوم كبيرة نسبيا من 5.5-7 Mbp مع ارتفاع G + C المحتوى (65-67%). وعلاوة على ذلك، نسبة كبيرة من الجينات، يشاركون في التكيف الأيضي وهي جزء من شبكات تنظيمية، مما يتيح مرونة كبيرة في الاستجابة للإجهاد البيئي1. P. الزّنجاريّة يعرب عدد كبير عوامل الفوعة ويسلك نزوع إلى نموذج الأغشية الحيوية، وتمتلك القدرة على تنسيق الاستجابة من خلال النصاب متعددة الاستشعار عن مسارات ويعرض قدرة ملحوظة على تطوير المقاومة للمضادات الحيوية والتسامح2،3،4،،من56،،من78. هذه السمات تحديات كبيرة لعلاج الالتهابات التي تسببها P. الزّنجاريّة.
المزمن يمكن أن تحدث التهابات P. الزّنجاريّة في العديد من الحالات المرضية. التليف الكيسي (CF)، أمراض وراثية الناجمة عن تحور الجين التليف الكيسي Transmembrane الموصلية منظم (CFTR) ، ينتج إفرازات يسهل أو المصابة داخل مجرى الهواء، والقصبات التدريجي، في نهاية المطاف، الموت من9من فشل في الجهاز التنفسي. قبل بلوغ سن الرشد، أغلبية المرضى الذين يعانون من التليف الكيسي مصابون بأمراض مزمنة P. الزّنجاريّة، الذي يلعب دوراً رئيسيا في الإصابة بالأمراض والوفيات المرتبطة بهذا المرض10. بالإضافة إلى ذلك، المرضى الذين يعانون من حروق شديدة إصابات11، تراتشيوستوميس12، الاستبدالات المشتركة13أو نائحين القسطرة14 هم عرضه للإصابة P. الزّنجاريّة تتصل بقدرة هذه البكتيريا على شكل الأغشية الحيوية والهروب استضافة الردود الملتهبة15. علاوة على ذلك، يحدث الاستعمار دون منافسة بعد تحديد عدد سكان مقاومة للمضادات الحيوية متعددة أو التسامح من خلال العلاج مضادات الجراثيم واسعة الطيف، متسلسلة12،،من1617 , 18-تحسين فهم الآلية المرضية من P. الزّنجاريّة سيكون لها آثار هامة على العديد من الحالات المرضية.
وقد درست عدة P. الزّنجاريّة يعزل السريرية، بما في ذلك سلالات PAO1، PA103، PA14، وباك، على نطاق واسع للتحقيق ميزات مختلفة من P. الزّنجاريّة المرضية. من سلالة PA14 عزل سريرية التي ينتمي إلى واحدة من المجموعات الاستنساخ الأكثر شيوعاً في جميع أنحاء العالم19،20 ولا باساجيد على نطاق واسع في المختبر. PA14is ضراوة شديدة في نماذج الفقاريات من العدوى، مع الذيفان ملحوظة الشخصية21، بيلي هيكل22، جزر الإمراضية23، اكتب ثالثا إفراز نظام (TTSS)، سيتوتوكسيسيتي نحو الثدييات خلايا24 و التشكيلات الجانبية للمضادات الحيوية المقاومة واستمرار25. وعلاوة على ذلك، PA14 أيضا ضراوة شديدة في العديد من النظم النموذجية الممرض المضيف، بما في ذلك أوراق النبات نماذج تسلل26،27، نماذج الإصابةايليجانس كاينورهابديتيس 28، 29والحشرات نماذج31من30،، فضلا عن الالتهاب الرئوي الماوس نماذج32،33 وحرق الجلد نماذج34.
مكتبات المسخ على نطاق الجينوم هي مجموعات من اسوي طفرات في الجينات غير الأساسية التي تشكل أدوات قوية للغاية لفهم علم الأحياء لكائن حي بالسماح بتحليل وظيفة الجينات على نطاق الجينوم. اثنين ينقول قرب تشبع الإدراج متحولة المكتبات التي شيدت في P. الزّنجاريّة متاحة حاليا للتوزيع. مواقع الإدراج ترانسبوزونات وقد حددت لكل المكتبات. هذه المكتبات نونريدوندانت ما يسمى تيسير دراسات المجين على نطاق المنظومة من السلالات البكتيرية بتناقص إلى حد كبير في الوقت والتكاليف المتكبدة في الفحص أونتشاراكتيريزيد طفرات ينقول عشوائي. P. الزّنجاريّة PAO1 ينقول متحولة المكتبة، التي شيدت في MPAO1 عزل من سلالة PAO1 باستخدام ترانسبوزونات هوفوا/ها وهولاكز/ها35، هو تنسيق بمختبر مانويل، وجامعة واشنطن. المكتبة يتكون من مجموعة التحقق من تسلسل من طفرات ينقول 9,437 التي توفر تغطية واسعة الجينوم ويشمل اثنين من طفرات لمعظم الجينات36. تتوفر معلومات حول مكتبة متحولة ينقول PAO1 P. الزّنجاريّة في موقع المعمل مانويل الجمهور، ويمكن الوصول إليها عن طريق شبكة الإنترنت في http://www.gs.washington.edu/labs/manoil/libraryindex.htm. سلالة P. الزّنجاريّة PA14 ينقول نونريدوندانت الإدراج متحولة مكتبة (مجموعة PA14NR) التي شيدت في سلالة PA14 باستخدام ترانسبوزونات MAR2xT7 و Tnفوا37 توزع حاليا بقسم طب الأطفال مستشفى ماساشوستس العام. وتضم مجموعة من طفرات أكثر من 5,800 مع الملاحق ينقول واحدة في الجينات غير الضروريين37تعيين PA14NR. تفاصيل حول بناء مجموعة PA14NR موصوفة في http://pa14.mgh.harvard.edu/cgi-bin/pa14/home.cgi?section=NR_LIB العامة، ويمكن الوصول إليها عن طريق شبكة الإنترنت في الموقع، الذي يحتوي أيضا على مجموعة متنوعة من أدوات البحث على الإنترنت لتيسير استخدام PA14NR تعيين.
وتتألف طفرات 5,459، مختارة من مكتبة شاملة لحوالي 34,000 ينقول عشوائي الإدراج طفرات، تتوافق مع جينات PA14 تنبأ 4,596 تمثل 77 في المائة من جميع الجينات PA14 توقع37مجموعة PA14NR الأصلي. أضيفت منذ بناء المكتبة في عام 2006 طفرات جديدة، وتعيين PA14NR ويشمل حاليا طفرات 5,800 أكثر من38 التي تمثل ما يقرب من جينات PA14 4,600. غالبية طفرات ينقول PA14 تم إنشاؤها في الخلفية نوع البرية37. تتوفر التفاصيل المتعلقة بكل عضو مكتبة متحولة، بما في ذلك الخلفية الوراثية، أما من خلال البحث في قاعدة البيانات على الإنترنت، أو عن طريق تحميل "مكتبة نونريدوندانت" جدول البيانات، كل الميزات المتوفرة على موقع PA14 (http:// pa14.mgh.harvard.edu/cgi-bin/pa14/home.cgi). غالبية طفرات تم إنشاؤها باستخدام في MAR2xT7 ينقول (MrT7)، مع مجموعة صغيرة تم إنشاؤها باستخدام ينقول تنفوا (فوا)37. وقد كل ينقول كاسيت مقاومة للمضادات الحيوية، مما يسمح للمسخ التحديد باستخدام الجنتاميسين (MrT7) أو كاناميسين (فوا). مجموعة PA14NR من طفرات المخزنة في لوحات 96-جيدا ثلاثة وستون، ويشمل اثنين التحكم 96-بئر إضافية تلقيح لوحات، والتي تتكون من نوع البرية PA14 وآبار أونينوكولاتيد أولمبية صيفية في نموذج سابق الإعداد. يسهل تنسيق لوحة 96-جيدا المقترنة مع أدوات البحث على شبكة الإنترنت إلى حد كبير تطوير مخصص لفحص الاختبارات التي تسمح للمستخدمين بسهولة تحديد الجينات المرتبطة بالمسخ تعمل. أدوات البحث على الإنترنت أيضا تسهيل البحث واختيار طفرات ذات الصلة إضافية المطلوبة لإجراء المزيد من الدراسات.
مكتبات متحولة ينقول PA14 و PAO1 موارد عالمية هامة جداً للمجتمع العلمي، وأنها تكمل بعضها البعض في التحقق من وظيفة الجينات غير معروف ومسارات لهذا الممرض الجرثومي. مصادفة، منذ تشييد المكتبات طفرة ينقول PAO1 و PA14، أظهر تحليل تسلسل الحمض النووي الجينوم الكامل للعديد من P. الزّنجاريّة يعزل أن PAO1 و PA14 تنتمي إلى سوبكلاديس رئيسية مختلفة من الزّنجاريّة ص ونساله7،39،،من4041. تم العثور على سبب السريرية P. الزّنجاريّة يعزل موزعة في جميع أنحاء نسأله، حقيقة أن PAO1 و PA14 ينتمون إلى مختلف P. الزّنجاريّة أفرقة فرعية يعزز قيمة المكتبتين الطفرة ينقول للمقارنة الدراسات.
منشورات تصف البناء وفحص مكتبات متحولة البكتيرية، بما في ذلك، P. الزّنجاريّة المكتبات3537،42، متوفرة بسهولة في الأدب. ومع ذلك، على حد علمنا، لا المنشورة بروتوكولات تصف إجراءات مفصلة والتقنيات المستخدمة للنسخ المتماثل، الصيانة، والتحقق من صحة من مكتبات متحولة البكتيرية متوفرة.
ويصف المنهجية المبينة في هذه النشرة مجموعة من البروتوكولات الثلاثة التي تسهل استخدام وصيانة لمجموعة PA14NR. البروتوكول الأول يصف النسخ المتماثل للمكتبة كما أوصى إلى المستلمين من مجموعة PA14NR. البروتوكول الثاني يتضمن المبادئ التوجيهية streaking والمتنامية، وتخزين طفرات الفردية وحدد استخدام مجموعة PA14NR. البروتوكول الثالث يصف تقنيات مراقبة الجودة، بما في ذلك [بكر] تضخيم أجزاء من طفرات ينقول وتسلسل اللاحقة لتأكيد هوية متحولة. هذه المجموعة من البروتوكولات يمكن تكييفها للنسخ المتماثل وصيانة المكتبات متحولة البكتيرية أو مجموعات أخرى أيضا. النسخ المتماثل لمكتبات متحولة البكتيرية أو مجموعات ينصح بدرجة عالية الحفاظ على سلامة "النسخة الرئيسية" (النسخة الأصلية الواردة). النسخ المتماثل من عدة نسخ من مجموعة PA14NR للاستخدامات المختبرية الروتينية يقلل من احتمال تلوث إينتيرويل للنسخة الرئيسية.
Protocol
تنبيه: تستخدم تدابير السلامة BSL-2 القياسية عند التعامل مع P. الزّنجاريّة، مسببات الأمراض بشرية. إذا كنت فرد المناعة أو أي حالة طبية أن الزيادات الخاصة بك أكثر عرضه للعدوى البكتيرية، أخذ الحيطة والحذر خاصة عند العمل مع ص الزّنجاريّة. استشارة مكتب السلامة الأحيائية في المؤسسة الخاصة بك، والحصول على موافقة الطبيب قبل العمل مع تعيين NR PA14 أو مكتبات متحولة من مسببات الأمراض البكتيرية.

رقم 1: تعيين نظرة عامة على "البروتوكول الأول:" النسخ المتماثل PA14NR- يوم 1: تكرار الثقافات متحولة المجمدة من "نسخة رئيسية" لتعيين PA14NR إلى وسائل الإعلام أجار رطل وتنمو طفرات بين عشية وضحاها في 37 درجة مئوية. يوم 2: نقل النمو متحولة من وسائل الإعلام أجار رطل إلى "العميق أيضا كتل" تحتوي على مرق LB السائل، تنمو بين عشية وضحاها في 37 درجة مئوية مع الهز 950 لفة في الدقيقة. اليوم الثالث: مزيج بين عشية وضحاها رطل الثقافات مع الجلسرين، ثم نقل إلى لوحات الوجهة 96-جيدا للتخزين على المدى الطويل. لوحات جيدا مكان 96 شقة في الثلاجة-80 درجة مئوية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
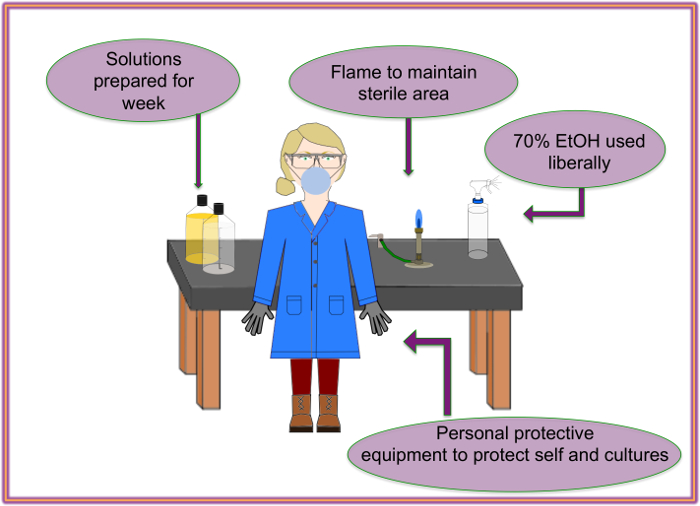
رقم 2: أوصى الإعداد. ينبغي الاحتفاظ بالعقم وسلاسة سير العمل من خلال استخدام الاحتياطات الملائمة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
1-البروتوكول الأول: مجموعة النسخ المتماثل PA14NR
ملاحظة: يمكن النسخ المتماثل للمكتبة بتقسيم مجموعة PA14NR في أربع مجموعات فرعية من لوحات ستة عشر كل التي يمكن معالجتها في أربعة أسابيع متتالية. جيل من 1 إلى 6 نسخ تتمسك بسير العمل الأسبوعية المبينة في الجدول 1، بينما يتبع توليد أكثر من 6 نسخ أسبوعية سير العمل المبينة في الجدول 2. لإنشاء 12 نسخة من مجموعة PA14NR، تطعيم فرعية PA14NR نفسه في سائل الإعلام رطل في اليوم 2 ومرة أخرى في اليوم 3 (من نفس مجموعة من لوحات أجار تكرارها في 1 يوم)، ونقل بين عشية وضحاها الثقافات متحولة إلى لوحات نسخة في اليوم 3 و 4 اليوم على التوالي.
| اليوم 0 | 1 يوم | 2 يوم | 3 يوم |
| اليوم الإعدادية | نمو طفرات تعيين PA14NR على وسائط أجار رطل | نمو PA14NR تعيين طفرات في وسائل الإعلام LB السائل | نقل الثقافات متحولة تعيين PA14NR إلى لوحات الوجهة |
1 الجدول: الجدول الزمني للنسخ المتماثل من 1-6 نسخ من مجموعة PA14NR. النسخ المتماثل لعدد صغير من النسخ قد تلتزم بسير عمل أسبوعية.
| اليوم 0 | 1 يوم | 2 يوم | 3 يوم | 4 يوم |
| اليوم الإعدادية | نمو طفرات تعيين PA14NR في أجار رطل | تنمو طفرات تعيين PA14NR في وسائل الإعلام LB السائل | نقل 3 يوم الثقافات متحولة إلى توليد المجموعة الأولى من 6 نسخ من مجموعة PA14NR | نقل 4 يوم الثقافات متحولة إلى توليد المجموعة الثانية من 6 نسخ من مجموعة PA14NR |
| نمو PA14NR تعيين طفرات في وسائل الإعلام LB السائل |
الجدول 2: الجدول الزمني للنسخ متماثل نسخ يصل إلى 12 من مجموعة PA14NR. يتطلب النسخ المتماثل عدد أكبر من النسخ طبقات ضمن سير عمل أسبوعية.
- يوم 1: نمو النسخة الرئيسية تعيين PA14NR على لوحات أجار رطل
- ارتداء القفازات، ومعطف مختبر وقناع للتعامل مع مجموعة PA14NR.
- إلغاء مقاعد البدلاء ومسح السطح مع الإيثانول 70%.
- إعداد رطل أجار وسائل الإعلام43 وتعقيمها في اﻷوتوكﻻف لوسائط باردة الحد الأدنى 25 إلى 55 درجة مئوية في المياه حمام وإضافة أما الجنتاميسين 15 ميكروغرام/مل، لطفرات تتضمن الملاحق ينقول MAR2xT7 ، أو 200 ميكروغرام/مل كاناميسين، لطفرات تتضمن Tnفوا الملاحق.
- صب المنصهر رطل أجار في لوحات مستطيلة باستخدام حوالي 60 مل من وسائط الإعلام للوحة الواحدة. لوحات الجافة في غطاء عقيمة لما يقرب من 1 ح قبل استخدامها. تأكد من أن هناك لا التكثيف المياه على السطح لاجار. تخزين لوحات عند 4 درجة مئوية، إذا لزم الأمر.
- قم بإنشاء حقل عقيمة مع موقد بنسن على مقاعد البدلاء مسحت الإيثانول أعلى وإعداد الحاويات مع حلول مناسبة لتعقيم دبوس وحدة النسخ المتماثل (راجع الخطوة 1.1.9). استخدام فتح الحاويات البلاستيكية (5.25 بوصة L x 4.25 "W x 1.75" ح الحجم التقريبي) للتعقيم طرف النسخ المتماثل. اﻷوتوكﻻف الحاويات البلاستيكية قبل الاستخدام.
ملاحظة: إنشاء حرارة لهب الموقد بنسن الحراري حالية، التي تسخن الفضاء فوق اللهب ويرفع أي الجسيمات في الهواء لأعلى وبعيدا عن برودة الجو تحتها، حفظ مساحة العمل العقيمة. - إزالة حد أقصى أربع لوحات رئيسية تعيين PA14NR من الثلاجة-80 درجة مئوية (لتجنب ذوبان الجليد لا داعي لها)، ووضعها على الثلج الجاف في عموم الجليد 4 لتر.
- تأخذ لوحة 96-البئر الرئيسي تكرارها من الثلج الجاف ووضعه على مقاعد البدلاء للسماح لذوبان الجليد موجزة، الذي سوف يستغرق سوى الوقت اللازم لتعقيم دبابيس وحدة النسخ المتماثل (حوالي 3-4 دقيقة) (راجع الخطوة 1-1-8). وضع علامة على موضع لتنسيق A1 على لوحة أجار قبل ختم. قم بمحاذاة اللوحة الرئيسية وطبق أجار مع تنسيق A1 كلا لوحات في الزاوية اليسرى العليا.
- تعقيم وحدة النسخ المتماثل "دبابيس" عن طريق اتباع الخطوات الموضحة أدناه. انقر فوق النسخ المتماثل قليلاً بعد كل خطوة لإزالة السائل الزائد.
- تزج دبابيس في 250 مل من 0.3-0.5% هيبوكلوريت الصوديوم (10% التبييض المنزلية) لمدة 30 ثانية. إلى تقليل الاتصال مع الحل تحت كلوريت الصوديوم، كما أنه يمكن أن يؤدي إلى تلف من دبابيس. تزج دبابيس في 250 مل ddH العقيمة2س أو الماء المعقم عالي النقاوة لمدة 10 ثوان، ثم في 250 مل إيثانول 70% لمدة 30 ثانية، ثم في 250 مل من الإيثانول 95% لمدة 2 دقيقة.
- لهب تعقيم دبابيس وحدة النسخ المتماثل قبل إجراء النسخ المتماثل عمودياً للهب الموقد بنسن، تقترب ببطء اللهب حتى يشعل الإيثانول، ثم سحبه فورا من اللهب. سيتم إطفاء الشعلة مرة واحدة كل من بيرنز الإيثانول قبالة. الحفاظ على الغطاء أو حاوية مماثلة قريبة لخنق حرق الإيثانول، إذا لزم الأمر.
ملاحظة: استخدام الحذر عند العمل مع الإيثانول بالقرب لهب. لا تعقد وحدة النسخ المتماثل مباشرة عبر اللهب. - بارد دبابيس التي تعلق على صفيحة مستطيلة عقيمة غير مستخدمة التي تحتوي على وسائط رطل أجار لمدة 30 ثانية.
- بإيجاز ختم الألومنيوم الحار من سيد PA14NR تعيين لوح بيدك قبل أن يسقط. القيام بذلك أثناء التبريد أطراف النسخ المتماثل. إزالة الختم الألومنيوم بعناية للحيلولة دون إعادة لمس اللوحة الختم. استخدام الملقط تقشر أي مخلفات من ختم الألومنيوم.
- إدراج أطراف النسخ المتماثل إلى لوحة الرئيسية، ودفع برفق والنسخ المتماثل يتأرجح في جميع الاتجاهات الأربعة ضمان أن دبابيس الاتصال مع الثقافات البكتيرية المجمدة في كل من 96-الآبار. إيلاء اهتمام إضافي للآبار الموجودة في الحافة الخارجية اللوحة عن طريق دفع النسخ المتماثل دبابيس ضد الثقافات المجمدة في الآبار التي تقع على حافة اللوحة.
- بلطف ضع أطراف النسخ المتماثل على سطح لوحة أجار. نقل وحدة النسخ المتماثل في حركة دائرية خفيفة على شكل ميني-المروج لحوالي 4-5 ملم لكل سلالة متحولة. تجنب إمكانية التي قد تتداخل مع ميني-المروج، لتجنب التلوث المتبادل.
- ختم PA14NR تعيين لوحة رئيسية مع ختم ألومنيوم عقيمة جديدة. لا تلمس الجانب لاصق الختم الألومنيوم في أي نقطة لتفادي التلوث. تأكد من أن كل بئر وحواف لوحة مختومة تماما باستخدام الرول لوحة. لوحة عودة 96-جيدا الجليد الجاف.
- كرر الإجراء لكل لوحة رئيسية.
- مسح أسفل جميع أسطح العمل مع الإيثانول 70% بعد التعامل مع تعيين PA14NR.
- نقل لوحات أجار المنسوخة نسخاً متماثلاً إلى حاضنة 37 درجة مئوية واحتضان بين عشية وضحاها.
- يوم 2: نمو النسخة الرئيسية تعيين PA14NR في مرق LB السائل
- إعداد رطل مرق السائل43 تتضمن أما الجنتاميسين 15 ميكروغرام/مل، لطفرات تتضمن الملاحق ينقول MAR2xT7 ، أو 200 ميكروغرام/مل كاناميسين، لطفرات تتضمن الملاحقفوا تينيسي.
- مسح هود الاندفاق الصفحي المعدات غير الضرورية وتشغيل منفاخ هود للحد أدنى من 10 دقيقة قبل البدء بالعمل. مسح أسفل غطاء السطوح وأي العناصر التي توضع في غطاء محرك السيارة باستخدام الإيثانول 70%.
- ملء 2 مل الآبار العميقة كتل مع 525 ميليلتر من رطل مرق السائلة التي تحتوي على المضادات الحيوية المناسبة في هود الاندفاق الصفحي استخدام 50-1200 12-قناة ميليلتر ماصة إلكترونية. ثم قم بنقل كتل الآبار العميقة المليئة بوسائل الإعلام إلى أعلى مقاعد البدلاء مسحت الإيثانول. إعادة استخدام تلميحات طالما تتم المحافظة على ظروف معقمة.
- ارتداء القفازات ومعطف مختبر قناع للتعامل مع مجموعة PA14NR.
- إلغاء مقاعد البدلاء ومسح السطح مع الإيثانول 70%.
- إحضار لوحات أجار مع سلالات متحولة نمت بين عشية وضحاها إلى هيئة أعلى.
- قم بإنشاء حقل عقيمة مع موقد بنسن على مقاعد البدلاء مسحت الإيثانول أعلى وإعداد الحاويات مع حلول مناسبة لتعقيم دبوس وحدة النسخ المتماثل (انظر الخطوة التالية).
- تعقيم النسخ المتماثل "دبابيس" اتباع الخطوات الموضحة أدناه. انقر فوق النسخ المتماثل قليلاً بعد كل الغمر لإزالة السائل الزائد.
- تزج دبابيس في 250 مل من 0.3-0.5% هيبوكلوريت الصوديوم لمدة 30 ثانية. إلى تقليل الاتصال pin وحدة النسخ المتماثل مع الحل تحت كلوريت الصوديوم، كما أنه يمكن أن يؤدي إلى تلف من دبابيس. ثم تزج دبابيس في 250 مل ddH العقيمة2س أو ماء عالي النقاوة لمدة 10 ثوان، ثم في 250 مل إيثانول 70% لمدة 30 ثانية، ثم في 250 مل من الإيثانول 95% لمدة 2 دقيقة.
- لهب تعقيم دبابيس وحدة النسخ المتماثل، ثم دبابيس بارد بتعلق في لوحة مستطيلة غير المستخدمة التي تحتوي على وسائط رطل أجار لمدة 30 ثانية.
ملاحظة: استخدام الحذر عند العمل مع الإيثانول بالقرب لهب (انظر 1.1.8).
- بلطف ضع دبابيس وحدة النسخ المتماثل على لوح أجار تحتوي على النمو متحولة وتحقق من أن دبابيس على اتصال مع جميع طفرات 96 على طبق أجار، ثم تغرق دبابيس في الآبار العميقة التي تحتوي على مرق LB السائل. تجنب لمس الجانبين من الآبار مع الدبابيس.
- ختم كتلة عميق جيدا مع غشاء ختم تنفس عقيمة. استخدام الرول طبق لضمان أن كل فرد جيدا بشكل صحيح هو مختومة.
- كرر الإجراء لكل لوح أجار.
- مسح أسفل جميع أسطح العمل مع الإيثانول 70% بعد التعامل مع تعيين PA14NR.
- تنمو الثقافات السائل الملقحين ح 15-16 في 37 درجة مئوية 950 لفة في الدقيقة باستخدام شاكر عالية سرعة، إذا كانت متوفرة.
ملاحظة: إذا لم يتوفر شاكر عالية سرعة، الممكن الحضانة لكتل عميقة جيدا في شاكر 250-300 لفة في الدقيقة. ومع ذلك، هناك فرصة أكبر لمستعمرة صغيرة المتغيرات (سكفس)25 الناشئة في ظل ظروف انخفاض الأوكسجين. ولذلك، فإنه من المستحسن جداً أن تبقى الحضانة الأوقات دون سن 15-16 ح عندما تنمو الثقافات في كتل عميقة جيدا سرعات شاكر أقل. يمكن أن يغير الانتشار غير المرغوب فيها من سكفس في الآبار متحولة متحولة تعمل عند استخدام المكتبة لأداء شاشات الجينية.
بعض الآبار في تعيين PA14NR تحتوي على طفرات النمو/غير-النمو البطيء، استنساخ، في عداد المفقودين أو تحتوي على وسائل الإعلام أونينوكولاتيد. وقد سجلت الموقع من هذه الآبار ويمكن العثور في ملف "تعيين معلومات آبار PA14NR تكميلية" المضمنة مع هذا المنشور.
- يوم 3: نقل الثقافات بين عشية وضحاها تعيين PA14NR إلى لوحات الوجهة
- مسح هود الاندفاق الصفحي وتشغيل منفاخ هود للحد أدنى من 10 دقيقة قبل البدء بالعمل. مسح أسفل غطاء السطوح وأي العناصر التي توضع في غطاء محرك السيارة باستخدام الإيثانول 70%.
- طباعة تسميات لاصقة مقاومة للماء (انظر الملف "التكميلي PA14NR تعيين تسميات" للقالب). التفاف إزالة 96-جيدا لوحات من البلاستيك داخل غطاء الاندفاق الصفحي. قشر قبالة لوحة التسمية ووضعه على طول الحافة في اللوحة الأقرب إلى A1 إلى الآبار H1 لصفيحة وجهة. قليلاً رفع غطاء لوحة الوجهة ووضع التسمية في الحافة السفلي لعرض التسمية عند لوحة مغطاة بغطاء.
- إعداد 3.5 L والغليسيرول 60% (v/v)، وتعقيم 20 دقيقة في اﻷوتوكﻻف.
- ارتداء القفازات ومعطف مختبر قناع للتعامل مع مجموعة PA14NR. إزالة كتل عميقة جيدا من شاكر عالية السرعة أو شاكر العادية.
- نقل كتل الآبار العميقة إلى هود الاندفاق الصفحي العقيمة وإزالة غشاء ختم تنفس بعناية. استبدال ختم الألومنيوم. زيادة ونقصان لأسفل كتل الآبار العميقة بسرعة منخفضة جداً لجمع التكثيف (30 ثانية في ز x 50-150، ثم يتباطأ quicky بوجود أجهزة الطرد المركزي الفرامل على).
- نقل كتل الآبار العميقة إلى هود العقيمة واستخدام 50-1200 12-قناة ميليلتر ماصة إلكترونية ونصائح العقيمة التي تمت تصفيتها إضافة ميليلتر 525 من مزيج المرق السائل والغليسيرول/رطل (أجزاء متساوية LB السائل مرق و 60% والغليسيرول حل) لكل بئر. المزيج بلطف بيبيتينج 300 ميليلتر صعودا وهبوطاً 3 مرات مع الماصة الإلكترونية. لمسة نصائح إلى الجانب من البئر قبل إخراج نصائح لمنع نازف. إخراج نصائح وتواصل مع الصف التالي حتى القيام به مع كتلة عميق جيدا بأكملها.
- باستخدام 12-قناة إلكترونية ماصة المتكررة والنصائح التي تمت تصفيتها، لمنع التلوث إينتيرويل أثناء اليقوتينج، سحب ما يصل إلى 900 ميليلتر للثقافة متحولة والاستغناء عن 150 ميليلتر في كل لوحات الوجهة 96-جيدا لإنشاء نسخ 6 من لوحة المكتبة. منع تقطر بلمس جدار الآبار مع نصائح قبل البدء في نقل الثقافة إلى لوحات الوجهة. في حالة توفر لا تكرار ماصة، استخدام ماصة الأقنية إلى الاستغناء عن 150 ميليلتر في كل واحدة من ست لوحات 96-جيدا، واستخدام الأسلوب الموصوفة أعلاه لمنع نازف.
- استخدام الأختام الألومنيوم العقيمة لتغطية اللوحات واستخدام اسطوانة لوحة ختم لوحة الحواف تماما وجميع الآبار. تأكد من عدم تغطية معرف التسمية بختم الألومنيوم. لا تهز اللوحات، كما يمكن دفقة الثقافة على الجانبين من الآبار أو على ختم الألومنيوم.
- إزالة لوحات مختومة من لوحات هود ومكان في شقة، حتى سطحية في الثلاجة-80 درجة مئوية.
- مسح أسفل جميع أسطح العمل مع الإيثانول 70% بعد التعامل مع المكتبة.
- إجراء تدقيقات مراقبة الجودة بعد النسخ المتماثل لمكتبة وبعد استخدام المكتبة لأداء شاشات الجينية (انظر البروتوكول الثالث).
2-البروتوكول الثاني: المناولة والتخزين من طفرات الفردية من مجموعة PA14NR
-
يوم 1: الانتصارات متحولة للفائدة
- التعرف على مكان المسخ الفائدة من خلال http://pa14.mgh.harvard.edu/cgi-bin/pa14/search.cgi?searchType=SEARCH_PLATE_POSITIONS وصلة PA14NR تعيين أو استخدام الملف Library.xls نونريدوندانت تحميلها من الرابط http:// pa14.mgh.harvard.edu/cgi-bin/pa14/downloads.cgi). دون ملاحظة عن المضادات الحيوية اللازمة لتحديد كل المسخ خاصة (الجنتاميسين أو كاناميسين).
- تحضير الوسائط أجار رطل وتعقيمها في اﻷوتوكﻻف لمدة 20-25 دقيقة، وبارد إلى 55 درجة مئوية في حمام الماء. إضافة 15 ميكروغرام/مل الجنتاميسين لطفرات تتضمن الملاحق ينقول MAR2xT7 ، و 200 ميكروغرام/مل كاناميسين لطفرات تتضمن Tnفوا ينقول الملاحق. صب رطل أجار وسائط الإعلام على ألواح (صفائح مستديرة أو مستطيلة تكفي). لوحات الجافة في هود العقيمة لما يقرب من 30 دقيقة إلى ح 1 قبل استخدامها.
- اﻷوتوكﻻف جميع بلاستيكواري واللوازم غير معقمة قبل استخدامها.
- ارتداء القفازات ومعطف مختبر قناع للتعامل مع مجموعة PA14NR. إلغاء مقاعد البدلاء ومسح السطح مع الإيثانول 70% قبل العمل مع تعيين PA14NR.
- قم بإنشاء حقل عقيمة مع موقد بنسن.
- إزالة تعيين PA14NR لوحة 96-جيدا مع المسخ فائدة من الثلاجة-80 درجة مئوية ووضعه على الثلج الجاف وتأخذ حاوية الثلج الجاف لمقاعد البدلاء وإيجاز مكان لوحة 96-جيدا على رأس هيئة المحكمة السماح طفيف ذوبان الجليد (حوالي 1-2 دقيقة).
ملاحظة: الاحتفاظ بسجل لكل مجموعة PA14NR 96-جيدا لوحات الوصول إلى طفرات الانتصارات الفردية، كما يرتبط بزيادة فرص الوصول إلى لوحات مكتبة مع أكبر خطر لتلوث إينتيرويل. - ختم الألومنيوم الحار باليد قبل يسقط عليه، مع الحرص على الحيلولة دون إعادة لمس اللوحة الختم. استخدام الملقط تقشر أي مخلفات من ختم الألومنيوم.
- تحديد موقع متحولة للفائدة على لوحة 96-جيدا. استخدام عصا خشبية العقيمة أو تلميح ماصة معقمة لاختيار كمية صغيرة من الثقافة المجمدة من الفرد كذلك تحتوي على المسخ للفائدة.
- خط تجميد الثقافة على طبق أجار للمستعمرات متحولة واحدة على النحو التالي: بلطف انتشار البكتيريا على جزء من اللوحة لإنشاء خط 1، استخدام الطازجة والعقيمة خشبية عصا أو ماصة تلميح، اسحب عبر خط 1 وتنتشر البكتيريا في قسم ثاني من اللوحة، لإنشاء خط 2. استخدام تلميح عصا أو ماصة خشبية ثالثة عقيمة، اسحب عبر خط 2 وتنتشر البكتيريا في القسم الأخير من اللوحة، لإنشاء خط 3.
- ختم المصدر لوحة مع ختم ألومنيوم عقيمة جديدة. لا تلمس الجانب لاصق الختم الألومنيوم في أي نقطة لتفادي التلوث. تأكد من أن كل بئر وحواف الصفيحة هي مختومة تماما باستخدام الرول لوحة. لوحة عودة 96-جيدا للثلج الجاف ومن ثم الثلاجة-80 درجة مئوية.
- احتضان بلايت أجار في حاضنة 37 درجة مئوية بين عشية وضحاها.
- مسح أسفل جميع أسطح العمل مع الإيثانول 70% بعد التعامل مع المكتبة.
-
يوم 2: النمو متحولة من اهتمام مرق LB السائل
- إعداد مرق LB السائل تحتوي على 15 ميكروغرام/مل الجنتاميسين أو 200 ميكروغرام/مل كاناميسين، وفقا للإدراج ينقول.
- ارتداء القفازات ومعطف مختبر قناع للتعامل مع P. الزّنجاريّة.
- إلغاء مقاعد البدلاء ومسح السطح مع الإيثانول 70%. قم بإنشاء حقل عقيمة مع موقد بنسن.
- نقل 3-5 مل مرق LB مع المضادات الحيوية المناسبة في أنبوب الثقافة العقيمة مع غطاء.
- استخدام قضيب عقيمة أو تلميح ماصة معقمة، اختيار مستعمرة واحدة من سلالة متحولة وتطعيم ذلك إلى وسائل الإعلام رطل.
- احتضان ثقافات LB السائل في 37 درجة مئوية في شاكر 225-250 لفة في الدقيقة بين عشية وضحاها.
- مسح أسفل جميع أسطح العمل مع الإيثانول 70% بعد معالجة P. الزّنجاريّة.
-
يوم 3: تخزين متحولة فائدة في الثلاجة-80 درجة مئوية
- قم بتسمية كريوفيال باسم متحولة، المضادات الحيوية إضافة إلى مرق رطل وتاريخ التخزين.
- إعداد 500 مل من 50% (v/v) والغليسيرول وتعقيمها في اﻷوتوكﻻف.
- ارتداء القفازات ومعطف مختبر قناع للتعامل مع P. الزّنجاريّة.
- إلغاء مقاعد البدلاء و/أو هود الفيضانات الصفحي ومسح السطح مع الإيثانول 70%.
- إزالة أنبوب يحتوي على ثقافة متحولة من شاكر.
- إعداد وعاء صغير مع الثلج الجاف.
- استخدام غطاء الاندفاق الصفحي أو قم بإنشاء حقل عقيمة على مقاعد البدلاء مسحت الإيثانول أعلى مع موقد بنسن.
- إضافة كميات متساوية من ثقافة البكتيرية والجلسرين 50% إلى كريوفيال المسمى باستخدام ظروف معقمة، وتخلط برفق مع ماصة (الحجم النهائي 1-2 مل/فيال تبعاً لحجم كريوفيالس المستخدمة). ضع كريوفيال على الثلج الجاف كويكفريزي.
- ضع كريوفيال في المربع المسمى في الثلاجة-80 درجة مئوية.
- مسح أسفل جميع أسطح العمل مع الإيثانول 70% بعد معالجة P. الزّنجاريّة.
3-البروتوكول الثالث: مراقبة الجودة من مجموعة PA14NR
- حدد مجموعة عشوائية من طفرات من لوحات منسوخة حديثا للكشف عن التلوث المحتمل إينتيرويل (اختبار من 30-40 ويوصي بطفرات).
ملاحظة: في الحالات حيث من الضروري تأكيد هوية متحولة المستخدمة لتوصيف جين معين، يوصي بإجراء PCR إيضاحات مسهبة باستخدام كبسولة تفجير الجينات محددة مصممة للتسلسل المعروفة من الجينات التي تحتوي على ينقول الإدراج. على الرغم من أن أكثر تحديا، فوائد استخدام التعسفي [بكر] كبسولة تفجير بدلاً من الجينات الخاصة PCR الإشعال عند أمبليفينج الحمض النووي وشظايا من طفرات ينقول تشمل سهولة تأكيد المسخ على نطاق واسع، والقدرة على الكشف عن وجود إمكانات الملوثات. لأغراض مراقبة الجودة، أنه ليس من اللازم للحصول على بيانات تسلسل PCR عالية الجودة لجميع عشوائياً طفرات سليكتيد، طالما يتم فحص عدد كاف من طفرات لتقييم معدل خطأ. - اتبع "البروتوكول الثاني" متتالية وزراعة سلالات متحولة.
- اﻷوتوكﻻف جميع بلاستيكواري واللوازم غير معقمة قبل استخدامها.
- عزل الحمض النووي عن طريق الأسلوب المفضل. واستخدمت مجموعة عزل دنا جينومي لتحليل ووصف في هذا العمل، عقب بروتوكولات الشركة المصنعة. وقد حلل سلالات متحولة متعددة في وقت واحد.
- قياس تركيز الحمض النووي الجينوم باستخدام جهاز المطياف الضوئي ميكروفولومي. ضبط تركيز الحمض النووي الجينومي لحوالي 100 نانوغرام/ميليلتر.
- استخدام الحمض النووي كقالب لتشغيل رد فعل "PCR1" كما هو موضح في الخطوة 1 من الجدول 3، تولد الشظايا بكر Arb1 (الشكل 3). وترد في الجدول 4 كبسولة تفجير لهذه الخطوة.
- إضافة 0.5 ميليلتر من 10 × تحميل المخزن المؤقت إلى 5 ميليلتر من رد فعل PCR1 وتحميل إلى 1.5-2% [اغروس] هلام وتشغيل الهلام في الخامس 80-150.
ملاحظة: طول جزء معين أو طائفة معينة بلغة غير المتوقع، والفرقة واحد أو أكثر قد يكون موجوداً كما التمهيدي التعسفي قد ربط إلى مواقع متعددة. - استخدام الحمض النووي من رد فعل PCR1 كقالب لتشغيل رد فعل "PCR2" كما هو موضح في الخطوة 2 من الجدول 3، تولد الشظايا بكر Arb2 (الشكل 3). وترد في الجدول 4 كبسولة تفجير لهذه الخطوة.
- إضافة 0.5 ميليلتر من 10 × تحميل المخزن المؤقت إلى 5 ميليلتر من رد فعل PCR2 وتحميل إلى 1.5-2% [اغروس] هلام، وتشغيل الهلام في الخامس 80-150.
ملاحظة: طول جزء معين أو طائفة معينة بلغة غير المتوقع، والفرقة واحد أو أكثر قد يكون موجوداً كما التمهيدي التعسفي قد ربط إلى مواقع متعددة. - إرسال رد فعل PCR2 جنبا إلى جنب مع المناسبة الخاصة ينقول التمهيدي للتسلسل.
- أناليزي بيبلاستينج نتائج يسلسل لهم ضد الجينوم PA14 كاملة باستخدام الارتباط انفجار المقدمة على موقع مكتبة PA14NR (http://pa14.mgh.harvard.edu/cgi-bin/pa14/blast.cgi) أو بواسطة التفجير منهم مباشرة ضد تسلسل جينات محددة متحولة للفائدة.
ملاحظة: يمكن الاطلاع على معلومات عن طفرات المحدد بالبحث في موقع مجموعة PA14NR (http://pa14.mgh.harvard.edu/cgi-bin/pa14/search.cgi?searchType=SEARCH_PLATE_POSITIONS البحث أو تحميل ملف Library.xls نونريدوندانت من http:/الارتباط /pa14.mgh.harvard.edu/cgi-bin/pa14/downloads.cgi).
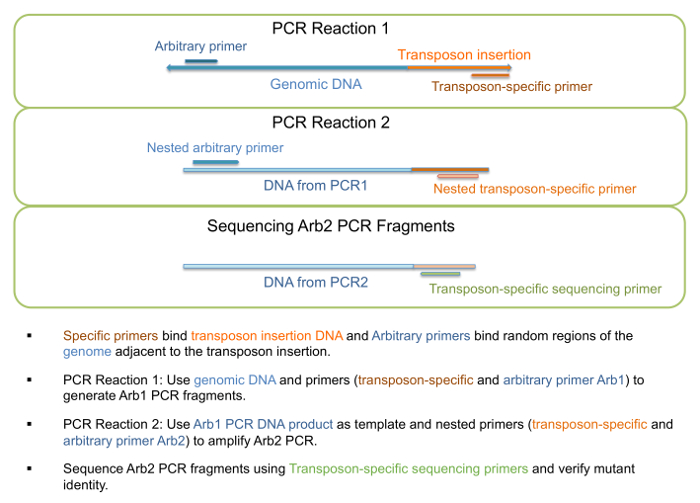
الشكل 3: بكر التضخيم وتسلسل طفرات الإدراج ينقول. عرض التخطيطي لخطوات تسلسل للتحقق من هوية متحولة وتشارك في التضخيم PCR. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
| إنشاء تفاعل PCR | |
| الخطوة 1 | الخطوة 2 |
| رد PCR1 : | رد PCR2 : |
| المياه 23.25 ميليلتر (البيولوجيا الجزيئية الصف) | المياه 19.15 ميليلتر (البيولوجيا الجزيئية الصف) |
| 3µL 10 x [تق] [بولمرس] المخزن المؤقت | 5 ميليلتر 10 × المخزن المؤقت [تق] [بولمرس] |
| 0.5µL [تق] [بولمرس] | ميليلتر 0.6 [تق] [بولمرس] |
| 0.625 ميليلتر 20 ميكرومتر التمهيدي Arb1D (الجدول 4) | 0.625 ميليلتر 20 ميكرومتر التمهيدي Arb2A (الجدول 4) |
| ميليلتر 0.625 20 ميكرومتر محددة ينقول التمهيدي (بمفلجم. 3a غيغابايت أو Tn5Ext) (الجدول 4) | 0.625 مل 20 ميكرومتر محددة ينقول التمهيدي (بمفلجم. 2 ألف غيغابايت أو Tn5Int2) (الجدول 4) |
| 1 دنتبس ملم 10 ميليلتر | 1 دنتبس ملم 10 ميليلتر |
| 1 ميليلتر المجينية الحمض النووي، 100 نانوغرام | 5 ميليلتر PCR1 الرد |
| حجم رد الفعل النهائي 30 ميليلتر | حجم رد الفعل النهائي 30 ميليلتر |
| [بكر] رد فعل الإعدادات | |
| PCR1 شروط ثيرموسيكلير: | PCR2 شروط ثيرموسيكلير: |
| 95 درجة مئوية – 2 دقيقة | 95 درجة مئوية – 2 دقيقة |
| كرر 5 دورات: | تكرار دورات 30: |
| 95 درجة مئوية – 30 ثانية | 95 درجة مئوية – 30 ثانية |
| 30 درجة مئوية – 1 دقيقة | 54 درجة مئوية – 30 ثانية |
| 72 درجة مئوية – 1 دقيقة | 72 درجة مئوية – 1.5 دقيقة |
| تكرار دورات 30: | 72 درجة مئوية--10 دقيقة |
| 95 درجة مئوية – 30 ثانية | 4 درجة مئوية – عقد |
| 45 درجة مئوية – 30 ثانية | |
| 72 درجة مئوية – 1 دقيقة | |
| 72 درجة مئوية--10 دقيقة | |
| 4 درجة مئوية – عقد |
الجدول 3: بكر رد فعل الإنشاء وثيرموسيكلير الشروط المستخدمة "بكر التعسفي". التعسفي PCR تفاعلات تتم تسلسلياً، والشظايا التي تم إنشاؤها أثناء رد فعل PCR1 تستخدم كقالب في رد فعل PCR2. يتم استخدام إعدادات ثيرموسيكلير محددة لكل مجموعة من ردود الفعل.
| اسم الدليل | تسلسل التمهيدي |
| الإشعال الخاصة ينقول MAR2xT7 | |
| بمفلجم. جيجا بايت-3a | تاكاجتتاكجاككجاكاجك |
| بمفلجم. جيجا بايت-2a | تجتكاكتججتكجتجككتكاتككج |
| MAR2xT7 ينقول تسلسل التمهيدي | |
| بمفلجم. جيجا بايت-4a | جاككجاجاتاججتجاجتج |
| كبسولة تفجيرفوا محددة ينقول تينيسي | |
| Tn5Ext | جاكجتاككاتجتاجاجتك |
| Tn5Int2 | جاجتكاكاتجاجتكاجاتككتج |
| تينيسيفوا "ينقول تسلسل التمهيدي" | |
| Tn5Int | كججااجتككجتكاجاكجك |
| كبسولة تفجير التعسفي | |
| ARB1D | جككاجككتجكاجاتجاتجنننننننننجتات |
| ARB2A | جككاجككتجكاجاتجاتج |
الجدول 4: قائمة بأجهزة الإشعال المستخدمة في مراقبة الجودة التجارب. كبسولة تفجير يستخدم للتضخيم بكر وتسلسل ينقول الإدراج طفرات لتأكيد هوية متحولة.
النتائج
تم تكرارها اثنا عشر نسخ جديدة من مجموعة PA14NR باستخدام البروتوكول الأول، وإجراء تقييم مراقبة الجودة للنسخ الجديدة التي تم إنشاؤها وأجريت باستخدام "البروتوكول الثالث".
PA14NR مجموعة لوحات متحولة جنبا إلى جنب مع "لوحات التحكم"، والذي يتألف من ن?...
Discussion
ف. الزّنجاريّة PA14NR يقع موردا قيماً للمجتمع العلمي. ووفقا dataset مارس 2017 من تحليلات كلاريفاتي قاعدة بيانات "مؤشرات العلوم الأساسية"، ليبيراتي et al. (2006) في المرتبة 37، الذي يصف تشييد مجموعة PA14NR، في أعلى من 1 ٪ من منشورات علم الأحياء المجهرية. باحث جوجل تقارير الاستشهادا...
Disclosures
واضعي التقرير لا تضارب المصالح المالية. اليانا درينكارد وفردريك أوسوبيل شارك في إنشاء المكتبة متحولة ينقول نونريدوندانت PA14. بريان هيرلي ويونكير ﻻل حاليا البيت وتوزيع المكتبة متحولة كجزء من قسم طب الأطفال في مستشفى ماساشوستس العام.
Acknowledgements
نود أن أشكر ليزا فيلبوتس Treadwell MGH المكتبة الظاهرية لتوجيهاتها في البحث عن قاعدة البيانات. هذا العمل كان تدعمه مؤسسة التليف الكيسي (YONKER16G0 و HURLEY16G0) والمعاهد الوطنية للصحة نييد (بف و ADE: R01 A1095338).
Materials
| Name | Company | Catalog Number | Comments |
| Materials for Library Replication | |||
| Sterile 96-well Tissue-culture treated, case of 50 | Corning Life Sciences | 353072 | via Fisher Scientific |
| Sterile 96 Well Clear V-Bottom 2000μL Deep Well Plates, case of 25 | Corning Life Sciences | 3960 | via Fisher Scientific |
| Nunc OmniTray (rectangular plates), case of 60 | Thermo Scientific Rochester | 242811 | via Fisher Scientific |
| Rectangular Ice Pan, Midi (4L) | Corning Life Sciences | 432104 | via Fisher Scientific |
| Secure-Gard Cone Mask, case of 300 | Cardinal Health | AT7509 | via Fisher Scientific |
| AluminaSeal, pack of 100 | Diversified Biotech | ALUM-100 | via Fisher Scientific |
| Breathe-Easy membrane, pack of 100 | Diversified Biotech | BEM-1 | via Sigma-Aldrich |
| Sterile, individually wrapped, 50mL Solution Trough/Reagent Reservoir, case of 100 | Sorenson | S50100 | via Westnet Incorporated |
| Plate roller | VWR | 60941-118 | via VWR |
| Cryo Laser Labels - CRYOLAZRTAG 2.64" x 0.277", pack of 16 sheets | GA International | RCL-11T1-WH | via Labtag.com (template for printing also available from Labtag.com) |
| 96-well replicator | V & P Scientific, Inc. | Custom 407C, 3.18mm pin diameter, 57mm long | via V & P Scientific, Inc. |
| Multitron Pro, 3mm Shaking incubator | Infors HT | l10003P | via Infors HT |
| Picus 12 Channel 50-1200μL Electronic Pipette | Sartorius | 735491PR | via Sartorius |
| Filter Tips 50-1200μL, pack of 960 | Biohit | 14-559-512 | via Fisher Scientific; use electronic multichannel-compatible tips |
| Dry Ice | User-specific vendor | ||
| Materials for Individual Mutant Storage | |||
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-130 | via Fisher Scientific |
| Pipettes (P1000, P200, P20, P2) | Gilson | F167370 | via Gilson |
| Materials for Quality Control PCR | |||
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-130 | via Fisher Scientific |
| NanoDrop | Thermo Scientific | ND-2000 | via ThermoFisher |
| PCR Thermocycler | |||
| Omnistrips PCR Tubes with domed lids | Thermo Scientific | AB0404 | via Fisher Scientific |
| ART Barrier low-retention pipette tips (10 uL, 100 uL, 1000 uL) | Molecular BioProducts, Inc. | Z676543 (10 uL), Z676713 (100 uL), Z676802 (1000 uL) | via Sigma-Aldrich |
| Pipettes (P1000, P200, P20, P2) | Gilson | F167370 | via Gilson |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-130 | via Fisher Scientific |
| MasterPure DNA Purification Kit | Epicentre | MCD85201 | via Epicentre Technologies Corp |
| GeneRuler 1 kb Plus DNA Ladder, ready-to-use | Thermo Scientific | SM1333 | via ThermoFisher |
| RediLoad Loading Buffer | Invitrogen | 750026 | via ThermoFisher |
| Chemicals | |||
| Chemicals for Library and Individual Mutant Storage | |||
| Glycerol MB Grade, 1L | Sigma Aldrich | G5516 | via Sigma-Aldrich |
| LB Broth | Per 1L dH2O: 10g tryptone, 5g yeast extract, 5g NaCl, 1ml 1N NaOH (Current Protocols in Molecular Biology. Wiley, 1994.) | ||
| Tryptone | Sigma Aldrich | T7293 | via Sigma-Aldrich |
| Yeast Extract | Sigma Aldrich | Y1625 | via Sigma-Aldrich |
| Sodium Chloride | Sigma Aldrich | S7653 | via Sigma-Aldrich |
| Sodium Hydroxide | Sigma Aldrich | S8045 | via Sigma-Aldrich |
| LB agar | See preparation above, add 15g Bacto Agar | ||
| Bacto Agar | Sigma Aldrich | A5306 | via Sigma-Aldrich |
| Gentamicin sulfate, 10g | BioReagent | 1405-41-0 | via Sigma-Aldrich |
| Kanamycin sulfate | Gibco | 11815024 | via ThermoFisher |
| Ethanol, 190 proof | Decon | 04-355-221 | via Fisher Scientific |
| Chemicals for Quality Control PCR | |||
| Primers | User-preferred vendor | See primers listed in Table 3 | |
| Corning cellgro Molecular Biology Grade Water | Corning | 46000CV | via Fisher Scientific |
| Taq Polymerase Buffer | Invitrogen | 10342020 | via ThermoFisher |
| Taq DNA Polymerase, recombinant | Invitrogen | 10342020 | via ThermoFisher |
| dNTPs | Invitrogen | 10297018 | via ThermoFisher |
| Agarose | Sigma | A9539 | via Sigma-Aldrich |
References
- Moradali, M. F., Ghods, S., Rehm, B. H. Pseudomonas aeruginosa lifestyle: A paradigm for adaptation, survival, and persistence. Front Cell Infect Microbiol. 7, 39 (2017).
- Bleves, S., et al. Protein secretion systems in Pseudomonas aeruginosa: A wealth of pathogenic weapons. Int J Med Microbiol. 300 (8), 534-543 (2010).
- Breidenstein, E. B., de la Fuente-Nunez, C., Hancock, R. E. Pseudomonas aeruginosa: all roads lead to resistance. Trends Microbiol. 19 (8), 419-426 (2011).
- Flynn, K. M., et al. Evolution of ecological diversity in biofilms of Pseudomonas aeruginosa by altered cyclic diguanylate signaling. J Bacteriol. 198 (19), 2608-2618 (2016).
- Hazan, R., Maura, D., Que, Y. A., Rahme, L. G. Assessing Pseudomonas aeruginosa persister/antibiotic tolerant cells. Methods Mol Biol. 1149, 699-707 (2014).
- Klockgether, J., et al. Genome diversity of Pseudomonas aeruginosa PAO1 laboratory strains. J Bacteriol. 192 (4), 1113-1121 (2010).
- Mathee, K., et al. Dynamics of Pseudomonas aeruginosa genome evolution. Proc Natl Acad Sci U S A. 105 (8), 3100-3105 (2008).
- Taylor, P. K., Yeung, A. T., Hancock, R. E. Antibiotic resistance in Pseudomonas aeruginosa biofilms: towards the development of novel anti-biofilm therapies. J Biotechnol. 191, 121-130 (2014).
- Flume, P. A., Van Devanter, D. R. State of progress in treating cystic fibrosis respiratory disease. BMC Med. 10, 88 (2012).
- . Cystic Fibrosis Foundation Patient Registry 2015 Annual Data Report Available from: https://www.cff.org/Our-Research/CF-Patient-Registry/2015-Patient-Registry-Annual-Data-Report.pdf (2016)
- Church, D., Elsayed, S., Reid, O., Winston, B., Lindsay, R. Burn wound infections. Clin Microbiol Rev. 19 (2), 403-434 (2006).
- Sadikot, R. T., Blackwell, T. S., Christman, J., Prince, A. Pathogen-host interactions in Pseudomonas aeruginosa pneumonia. Am J Respir Crit Care Med. 171 (11), 1209-1223 (2005).
- Song, Z., et al. Prosthesis infections after orthopedic joint replacement: the possible role of bacterial biofilms. Orthop Rev (Pavia). 5 (2), 65-71 (2013).
- National Nosocomial Infections Surveillance, S. National Nosocomial Infections Surveillance (NNIS) System Report, data summary from January 1992 through June 2004, issued October 2004. Am J Infect Control. 32 (8), 470-485 (2004).
- Cohen, T. S., Parker, D., Prince, A. . Pseudomonas aeruginosa Host Immune Evasion. 7, 3-23 (2014).
- Fernandes, A., Dias, M. The microbiological profiles of infected prosthetic implants with an emphasis on the organisms which form biofilms. J Clin Diagn Res. 7 (2), 219-223 (2013).
- Khosravi, A. D., Ahmadi, F., Salmanzadeh, S., Dashtbozorg, A., Montazeri, E. A. Study of Bacteria Isolated from Orthopedic Implant Infections and their Antimicrobial Susceptibility Pattern. Res J of Microbiol. 4 (4), 6 (2009).
- Roemhild, R., Barbosa, C., Beardmore, R. E., Jansen, G., Schulenburg, H. Temporal variation in antibiotic environments slows down resistance evolution in pathogenic Pseudomonas aeruginosa. Evol Appl. 8 (10), 945-955 (2015).
- Fischer, S., et al. Intraclonal genome diversity of the major Pseudomonas aeruginosa clones C and PA14. Environ Microbiol Rep. 8 (2), 227-234 (2016).
- Wiehlmann, L., et al. Population structure of Pseudomonas aeruginosa. Proc Natl Acad Sci U S A. 104 (19), 8101-8106 (2007).
- Lam, J. S., Taylor, V. L., Islam, S. T., Hao, Y., Kocincova, D. Genetic and functional diversity of Pseudomonas aeruginosa lipopolysaccharide. Front Microbiol. 2, 118 (2011).
- Choi, J. Y., et al. Identification of virulence genes in a pathogenic strain of Pseudomonas aeruginosa by representational difference analysis. J Bacteriol. 184 (4), 952-961 (2002).
- He, J., et al. The broad host range pathogen Pseudomonas aeruginosa strain PA14 carries two pathogenicity islands harboring plant and animal virulence genes. Proc Natl Acad Sci U S A. 101 (8), 2530-2535 (2004).
- Mikkelsen, H., McMullan, R., Filloux, A. The Pseudomonas aeruginosa reference strain PA14 displays increased virulence due to a mutation in ladS. PLoS One. 6 (12), e29113 (2011).
- Drenkard, E., Ausubel, F. M. Pseudomonas biofilm formation and antibiotic resistance are linked to phenotypic variation. Nature. 416 (6882), 740-743 (2002).
- Rahme, L. G., et al. Common virulence factors for bacterial pathogenicity in plants and animals. Science. 268 (5219), 1899-1902 (1995).
- Rahme, L. G., et al. Use of model plant hosts to identify Pseudomonas aeruginosa virulence factors. Proc Natl Acad Sci U S A. 94 (24), 13245-13250 (1997).
- Kirienko, N. V., Cezairliyan, B. O., Ausubel, F. M., Powell, J. R. Pseudomonas aeruginosa PA14 pathogenesis in Caenorhabditis elegans. Methods Mol Biol. 1149, 653-669 (2014).
- Mahajan-Miklos, S., Tan, M. W., Rahme, L. G., Ausubel, F. M. Molecular mechanisms of bacterial virulence elucidated using a Pseudomonas aeruginosa-Caenorhabditis elegans pathogenesis model. Cell. 96 (1), 47-56 (1999).
- Limmer, S., et al. Pseudomonas aeruginosa RhlR is required to neutralize the cellular immune response in a Drosophila melanogaster oral infection model. Proc Natl Acad Sci U S A. 108 (42), 17378-17383 (2011).
- Miyata, S., Casey, M., Frank, D. W., Ausubel, F. M., Drenkard, E. Use of the Galleria mellonella caterpillar as a model host to study the role of the type III secretion system in Pseudomonas aeruginosa pathogenesis. Infect Immun. 71 (5), 2404-2413 (2003).
- Coleman, F. T., et al. Hypersusceptibility of cystic fibrosis mice to chronic Pseudomonas aeruginosa oropharyngeal colonization and lung infection. Proc Natl Acad Sci U S A. 100 (4), 1949-1954 (2003).
- Pazos, M. A., et al. Pseudomonas aeruginosa ExoU augments neutrophil transepithelial migration. PLoS Pathog. 13 (8), e1006548 (2017).
- Maura, D., Hazan, R., Kitao, T., Ballok, A. E., Rahme, L. G. Evidence for direct control of virulence and defense gene circuits by the Pseudomonas aeruginosa quorum sensing regulator, MvfR. Sci Rep. 6, 34083 (2016).
- Jacobs, M. A., et al. Comprehensive transposon mutant library of Pseudomonas aeruginosa. Proc Natl Acad Sci U S A. 100 (24), 14339-14344 (2003).
- Held, K., Ramage, E., Jacobs, M., Gallagher, L., Manoil, C. Sequence-verified two-allele transposon mutant library for Pseudomonas aeruginosa PAO1. J Bacteriol. 194 (23), 6387-6389 (2012).
- Liberati, N. T., et al. An ordered, nonredundant library of Pseudomonas aeruginosa strain PA14 transposon insertion mutants. Proc Natl Acad Sci U S A. 103 (8), 2833-2838 (2006).
- Feinbaum, R. L., et al. Genome-wide identification of Pseudomonas aeruginosa virulence-related genes using a Caenorhabditis elegans infection model. PLoS Pathog. 8 (7), e1002813 (2012).
- Stewart, L., et al. Draft genomes of 12 host-adapted and environmental isolates of Pseudomonas aeruginosa and their positions in the core genome phylogeny. Pathog Dis. 71 (1), 20-25 (2014).
- Thrane, S. W., et al. The widespread multidrug-resistant serotype O12 Pseudomonas aeruginosa clone emerged through concomitant horizontal transfer of serotype antigen and antibiotic resistance gene clusters. MBio. 6 (5), e01396-e01315 (2015).
- van Belkum, A., et al. Phylogenetic Distribution of CRISPR-Cas Systems in Antibiotic-Resistant Pseudomonas aeruginosa. MBio. 6 (6), e01796-e01715 (2015).
- Lewenza, S., et al. Construction of a mini-Tn5-luxCDABE mutant library in Pseudomonas aeruginosa PAO1: a tool for identifying differentially regulated genes. Genome Res. 15 (4), 583-589 (2005).
- . . Current Protocols in Molecular Biology. , (1994).
- Breidenstein, E. B., Khaira, B. K., Wiegand, I., Overhage, J., Hancock, R. E. Complex ciprofloxacin resistome revealed by screening a Pseudomonas aeruginosa mutant library for altered susceptibility. Antimicrob Agents Chemother. 52 (12), 4486-4491 (2008).
- Musken, M., Di Fiore, S., Dotsch, A., Fischer, R., Haussler, S. Genetic determinants of Pseudomonas aeruginosa biofilm establishment. Microbiology. 156 (Pt 2), 431-441 (2010).
- Schurek, K. N., et al. Novel genetic determinants of low-level aminoglycoside resistance in Pseudomonas aeruginosa. Antimicrob Agents Chemother. 52 (12), 4213-4219 (2008).
- Oumeraci, T., et al. Comprehensive MALDI-TOF biotyping of the non-redundant Harvard Pseudomonas aeruginosa PA14 transposon insertion mutant library. PLoS One. 10 (2), e0117144 (2015).
- Yeung, A. T., et al. Swarming of Pseudomonas aeruginosa is controlled by a broad spectrum of transcriptional regulators, including MetR. J Bacteriol. 191 (18), 5592-5602 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved