A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحقيق قوة مباشرة لقياس التكامل الميكانيكية بين النواة وسيتوسكيليتون
In This Article
Summary
في هذا البروتوكول، يصف لنا طريقة ميكروبيبيتي لمباشرة تطبيق قوة الخاضعة للرقابة على النواة في خلية حية. ويسمح هذا الفحص الاستجواب للخصائص الميكانيكية النووية في الخلية الحية، وملتصقة.
Abstract
تحديد الخواص الميكانيكية للنواة ردها إلى القوات الميكانيكية المتولدة في الخلايا. نظراً لأن النواة جزيئيا المستمر مع سيتوسكيليتون، يلزم أساليب التحقيق سلوكها الميكانيكي في الخلايا ملتصقة. وهنا نناقش المسبار القوة المباشرة (منسقي) كأداة لتطبيق القوة مباشرة إلى النواة في خلية حية ملتصقة. أننا نعلق ميكروبيبيتي ضيقة على السطح النووي مع الشفط. وتترجم في ميكروبيبيتي بعيداً عن النواة، الذي يسبب النواة تشوه وترجمة. عند استعادة قوة مساوية لقوة الشفط، النواة يفصل ويرتاح الاستيكالي. لأن الضغط شفط هو يعرف على وجه التحديد، المعروف قوة على السطح النووي. هذا الأسلوب وكشفت أن قوات نانو الحجم كافية لتشوه وترجمة النواة في خلايا ملتصقة، وحددت العناصر سيتوسكيليتال التي تمكن النواة مقاومة القوات. يمكن استخدامها منسقي تشريح مساهمات المكونات الخلوية والنووية للخصائص الميكانيكية النووية في الخلايا الحية.
Introduction
الأمراض مثل السرطان تنطوي على تعديلات على الشكل النووي وهيكل1،2، التي تقترن عادة ب 'تليين'3،نواة4. المقاومة النووية إلى تشوه الميكانيكية اتسمت عموما بتطبيق قوة على نواة معزولة5.
النواة في الخلايا متصل جزيئيا cytoskeleton "رابط نوكليوسكيليتون" وسيتوسكيليتون (اللغوي) مجمع6،7،،من89. نتيجة لذلك تم دمج النواة ميكانيكيا مع سيتوسكيليتون، ومن خلال خلية التحتية الالتصاقات، المصفوفة خارج الخلية. ميكانيكيا السبر النواة داخل الخلايا ملتصقة يمكن أن توفر نظرة ثاقبة هذا التكامل الميكانيكية. وتشمل أساليب التلاعب بالنوى في الخلايا الحية ميكروبيبيتي تطلع10،11، والقوة الذرية مجهرية12،،من1314. ونحن مؤخرا وصف قوة مباشرة تحقيق (منسقي) الذي ينطبق على القوات الميكانيكية مباشرة على النواة في خلية ملتصقة معيشة15.
هنا، فإننا مخطط الإجراء المتعلق باستخدام نظام microinjection التي تتوفر عادة في مرافق الفحص المجهري لتطبيق قوة ميكانيكية نانو نطاق معروفة، مباشرة إلى النواة في زنزانة ملتصقة. فيمتوتيب (القطر ميكروبيبيتي نصيحة 0.5 ميكرومتر) شنت ومتصلا بالنظام microinjection بأنبوب. تلميح، المتمركزة بزاوية 45 درجة بالنسبة إلى سطح الطبق الثقافة، خفضت حتى المتاخمة لسطح النووية. ثم قطع الأنبوب وفتحه في الغلاف الجوي، مما يخلق ضغط شفط سلبي على السطح النووي والأختام نصيحة ميكروبيبيتي ضد السطح النووية. من خلال ترجمة طرف ميكروبيبيتي، النواة مشوهاً وفي نهاية المطاف (تبعاً لحجم القوة المطبقة)، بعيدة عن ميكروبيبيتي. هذه المفرزة عند تساوي القوى (مقاومة) استعادة، تمارسه خلية ونواة قوة الشفط تطبقها ميكروبيبيتي. يمكن إجراء التحليل بقياس تشريد النواة، سلالة طول (المعادلة 1)، أو سلالة المنطقة (الشكل 1A).
Protocol
1. إعداد الخلايا للتصوير
ملاحظة: يمكن استخدام المسبار القوة المباشرة (منسقي) لأي نوع من الخلايا ملتصقة. هنا، والمعاهد الوطنية للصحة 3T3 الماوس الليفية تستخدم كخط الخلية النموذجية لهذا البروتوكول.
- الثقافة المعاهد الوطنية للصحة 3T3 تنتجها الخلايا الليفية الخلايا في المتوسطة (دميم "تعديل النسر" دولبيكو) وتستكمل مع المصل البقري المانحة 10% و 1% ستربتوميسين البنسلين في أسفل زجاج 35 مم طبق حتى كونفلوينسي المطلوب. الحفاظ على الخلايا في 37 درجة مئوية و 5% CO2.
- من المؤكد أن معطف جميع الأطباق أسفل الزجاج 35 ملم مع 5 ميكروغرام/مل فيبرونيكتين (أو بروتين ECM مماثلة)، قبل البذر الخلايا 3T3 المعاهد الوطنية للصحة للتصوير.
ملاحظة: الخلايا يجب أن يكون كاملا تنتشر وملتصقة على الطبق للتجربة. لا توجد أي قيود من حيث كونفلوينسي لمنسقي أسلوب للعمل.
- من المؤكد أن معطف جميع الأطباق أسفل الزجاج 35 ملم مع 5 ميكروغرام/مل فيبرونيكتين (أو بروتين ECM مماثلة)، قبل البذر الخلايا 3T3 المعاهد الوطنية للصحة للتصوير.
- فورا قبل التجربة، غسل الخلايا مرتين مع برنامج تلفزيوني تليها يغسل واحدة مع متوسط النمو الكامل.
- أضف 3 مل متوسط النمو الكامل للطبق أسفل الزجاج.
2-الفحص المجهري، والحصول على الصور
ملاحظة: المقلوب fluorescence المجهر (أو ما يعادلها) مع ميكرومانيبولاتور مثبتة على الذراع الجانب، وفقا لتوصيات الشركة المصنعة. كما يمكن تجهيزه المجهر دائرة البيئة للإبقاء على درجة حرارة 37 درجة مئوية، وأول أكسيد الكربون2 مستوى 5%. مطلوب أيضا ميكرومانيبولاتور وميكروينجيكتور تعلق بالمجهر. زيت غمر x 40/1.3 60 x أو NA/1.49 NA (أو ما يعادل أهداف) ينصح للتجارب. وينبغي أن شنت المجهر على طاولة عزل الاهتزازات.
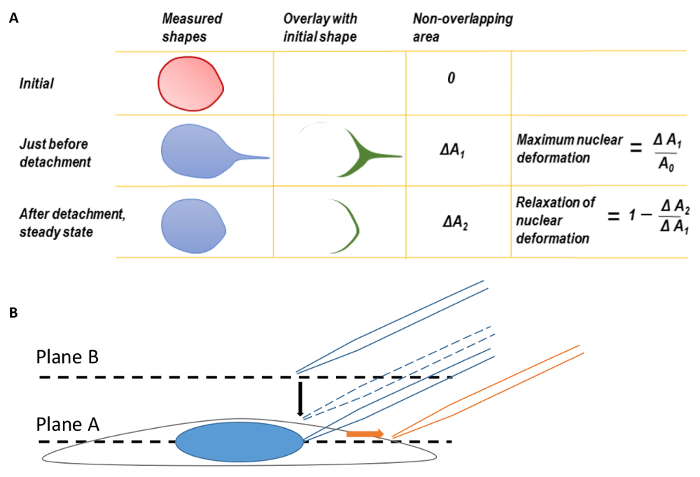
الشكل 1 . التشوه النووية وتركيز المجهر
أ أقصى تشوه النووية وتخفيف التشوه النووية. قبل حساب الحد الأقصى تشوه النووية، كانت أولاً تزامن حواف الأشكال النووية مرة أخرى لتصحيح لترجمة نواة مشوه. كان مضافين على شكل النواة في هذه لحظة مفرزة نصيحة ميكروبيبيتي على شكل النووية الأولى قبل أن تنسحب. وتم قياس الفرق بين الشكلين في المنطقة ك Δ1. وعرف أنه Δأ1 مقسوماً على المجال النووي الأصلي تشوه النووية الحد الأقصى. وبالمثل، معلمة ثانية، Δأ2، يمكن تعريف التي تتراكب الشكل النهائي ثابت الدولة النووية بعد مفرزة ميكروبيبيتي على الشكل النووي الأصلي. باء-التركيز الخلية عند بالطائرة، ثم قم بنقل المستوى البؤري يصل إلى الطائرة ب للبحث عن هذه المعلومة ميكروبيبيتي. أثناء التصوير، وقد ترجم في ميكروبيبيتي إلى اليمين (باتجاه السهم البرتقالي). وقد تم تعديل هذا الرقم من نيلام et al. 15- الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
- قم بتشغيل ميكروينجيكتور في البروتوكول الخاص بالشركة المصنعة.
- استخدام قطارة زيت غمر، تطبيق قطره واحدة من زيت الغمر أعلى العدسة الهدف.
- المشبك الطبق محكم في حامل الطبق وتحميل صاحب الطبق على خشبة المسرح.
ملاحظة: يجب المحافظة على الخلايا في 37 درجة مئوية و 5% CO2 طوال التجربة. - ضبط ارتفاع الهدف لإحضار الخلايا إلى التركيز (بالطائرة، الشكل 1B).
- نقل مرحلة مجهر للعثور على خلية للفائدة.
- قم بتدوير عصا التحكم في ميكرومانيبولاتور لنقل صاحب بيبيت إلى المرتبة الأولى. تحميل ميكروبيبيتي نصيحة قطرها 0.5 ميكرومتر على حامل بيبيت.
- لتجنب التصاق الخلية إلى ميكروبيبيتي، قبل علاج نصيحة ميكروبيبيتي مع 0.3 ملغ/مل الحل PLL-ز-شماعة ح 1 في درجة حرارة الغرفة. اختبار الالتصاق بلمس ميكروبيبيتي إلى النواة دون أي ضغط الشفط ومن ثم ترجمة ميكروبيبيتي بعيداً عن النواة. ويمكن تمييز نظراً لعدم التصاق من انعدام تام لتشوه النووية والترجمة.
ملاحظة: الرجاء اتباع اقتراحات صنعها لفتح الحزمة.
- لتجنب التصاق الخلية إلى ميكروبيبيتي، قبل علاج نصيحة ميكروبيبيتي مع 0.3 ملغ/مل الحل PLL-ز-شماعة ح 1 في درجة حرارة الغرفة. اختبار الالتصاق بلمس ميكروبيبيتي إلى النواة دون أي ضغط الشفط ومن ثم ترجمة ميكروبيبيتي بعيداً عن النواة. ويمكن تمييز نظراً لعدم التصاق من انعدام تام لتشوه النووية والترجمة.
- رفع المستوى البؤري موضوعي أعلاه بالطائرة والجزء العلوي من الخلية إلى "ب الطائرة" عن طريق ضبط عنصر التحكم غرامة (الشكل 1B، راجع الخطوة 2، 4).
- تعيين ميكرومانيبولاتور للتحكم ردئ . جلب ميكروبيبيتي وصولاً إلى "الطائرة ب" ببطء عن طريق لمشاهدة صورة ظلية ميكروبيبيتي، حتى ميكروبيبيتي يأتي تماما في التركيز.
- مجرد نصيحة ميكروبيبيتي في التركيز، تعيين في ميكرومانيبولاتور للمراقبة الدقيقة .
- أدنى الهدف للطائرة الاستوائي للخلية (ألف طائرة، الشكل 1B) وأقل ميكروبيبيتي إلى حوالي 15 ميكرون فوق الطائرة A (الشكل 1B، ميكروبيبيتي متقطع).
- تعيين الضغط التعويض (فج) في ميكروينجيكتور للضغط المطلوب؛ انتظر عدة ثوان للضغط من أجل تحقيق الاستقرار.
ملاحظة: هذه النقطة مجموعة الضغط الأمثل يعتمد على نوع الخلية والأهداف المحددة لهذه التجربة. لمعظم الحالات، سيكون 300 hPa نقطة انطلاق جيدة. - ضمان أن لا انسداد في ميكروبيبيتي باستخدام الإعداد نظيفة على لوحة ميكرومانيبولاتور والتحقق للتأكد من ظهور فقاعات الهواء من طرف ميكروبيبيتي.
- إدراج التلميح في الخلية بخفض تدريجيا في ميكروبيبيتي حتى التلميح طفيفة لمس السطح النووية.
ملاحظة: عند تخفيض ميكروبيبيتي، سوف تصبح صورة ظلية طرف ميكروبيبيتي واضح أنها تأتي إلى التركيز. قبل ميكروبيبيتي تلامس النواة، زيادة التركيز الموضوعي ومحاذاة الحافة ميكروبيبيتي مع نواة (إحداثيات س ص نفس، أعلى z-طائرة). إرجاع التركيز إلى الطائرة الاستوائية من النواة (ألف طائرة، الشكل 1B) وتدريجيا أقل نصيحة ميكروبيبيتي. - إنشاء ختم بين نصيحة ميكروبيبيتي والغشاء النووي عن طريق قطع أنابيب الإمداد بضغط من النظام microinjection، مما يفتح نهاية الأنبوب ميكروبيبيتي في الغلاف الجوي. هذه الخطوة بإنشاء ضغط سلبي يساوي فج على السطح النووي.
- الحصول على الصور مع برنامج جمع الصور مجاهر. إقامة أفي-اقتناء (فيديو) أو nd-اقتناء (صور) في برنامج جمع الصور.
ملاحظة: لتصوير أي الحصول على البرمجيات، قم بإعداد تصوير الفيديو في الوقت الحقيقي أو امتلاك الوقت الفاصل بين الصورة مع فاصل زمني قصير. - تبديل إلى فلوري المقابلة التصوير قناة (أي التجارة والنقل، طلب تقديم العروض، إلخ) والبدء في التصوير.
- ترجمة نصيحة ميكروبيبيتي بعيداً عن جسم الخلية (بالحق، الشكل 1B) حتى ينفصل النواة من ميكروبيبيتي.
ملاحظة: سحب الحافة على طول x-الاتجاه الإيجابي (إلى اليمين في طريقة العرض للحقل). معدل سحب يمكن برمجتها والتحكم بجهاز الكمبيوتر أو يمكن نقل مقبض التحكم يدوياً. أننا لم نجد أي علاقة متبادلة بين سحب معدل وتشوه النووية15 تشير إلى استجابة مرنة أساسا إلى القوة.
3-بيانات التحليل
- القيام بتحليل الصورة مع أي برنامج معالجة الصور الأساسية المتاحة. يمكن قياس مدى تشوه النووية سلالة طول (Ɛ) أو سلالة المنطقة (الشكل 1A). التحديد الكمي لسلالة طول استخدام المعادلة 1، حيث L و L0 تمثل أطوال النواة في تشوه الحد الأقصى والموقف المبدئي، على التوالي.
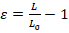 (المعادلة 1)
(المعادلة 1)
النتائج
ويبين الشكل 2 ألف إرغام المعاهد الوطنية للصحة 3T3 الماوس تنتجها الخلايا الليفية نواة. كما تتم ترجمة نصيحة ميكروبيبيتي إلى اليمين، النواة تبعثر ويفصل في نهاية المطاف من طرف ميكروبيبيتي. ويعتبر سلالة طول نواة يزيد مع زيادة قوة الشفط (الشكل 2). ...
Discussion
قياس تكامل الميكانيكية نواة مع سيتوسكيليتون تحد للأساليب الأكثر حداثة، مثل ميكروبيبيتي تطلع16، لأنها تتطلب أما نواة معزولة (حيث النواة decoupled من cytoskeleton) أو النواة في الخلايا مع وقف التنفيذ (حيث توجد القوات خارج الخلية، مثل قوي الجر،). طبق النواة القوة عن طريق تطبيق سلالة بياكسي?...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
وأيد هذا العمل EB014869 R01 المعاهد الوطنية للصحة.
Materials
| Name | Company | Catalog Number | Comments |
| FluoroDish | WPI | FD35 | |
| SYTO 59 | ThermoFisher Scientific | S11341 | |
| Femtotips | Eppendorf | 930000043 | |
| InjectMan NI2 | Eppendorf | NA | discontinued, current equivalent model: InjectMan 4 |
| FemtoJet | Eppendorf | NA | Current model FemtoJet 4i |
| Plan Fluor oil immersion 40x | Nikon | NA | |
| Apo TIRF oil immersion 60x | Nikon | NA | |
| Donor Bovine Serum (DBS) | ThermoFisher Scientific | 16030074 | NIH 3T3 serum |
| Dulbecco's Modification of Eagle's (DMEM) | Mediatech cellgro | MT10013CVRF | NIH 3T3 medium |
| Penicillin-Streptomycin | Mediatech | MT30004CIRF | NIH 3T3 medium supplement |
| Immersion Oil Type LDF Non-Fluorescing | Nikon | 77007 | Immersion oil for objective lens |
References
- Chow, K. H., Factor, R. E., Ullman, K. S. The nuclear envelope environment and its cancer connections. Nature Reviews Cancer. 12 (3), 196-209 (2012).
- Zink, D., Fischer, A. H., Nickerson, J. A. Nuclear structure in cancer cells. Nature Reviews Cancer. 4 (9), 677-687 (2004).
- Bank, E. M., Gruenbaum, Y. The nuclear lamina and heterochromatin: a complex relationship. Biochemical Society Transactions. 39 (6), 1705-1709 (2011).
- Lammerding, J., et al. Lamins A and C but not lamin B1 regulate nuclear mechanics. Journal of Biological Chemistry. 281 (35), 25768-25780 (2006).
- Dahl, K. N., Engler, A. J., Pajerowski, J. D., Discher, D. E. Power-law rheology of isolated nuclei with deformation mapping of nuclear substructures. Biophysical Journal. 89 (4), 2855-2864 (2005).
- Crisp, M., et al. Coupling of the nucleus and cytoplasm: role of the LINC complex. Journal of Cell Biology. 172 (1), 41-53 (2006).
- Sosa, B. A., Rothballer, A., Kutay, U., Schwartz, T. U. LINC complexes form by binding of three KASH peptides to domain interfaces of trimeric SUN proteins. Cell. 149 (5), 1035-1047 (2012).
- Tapley, E. C., Starr, D. A. Connecting the nucleus to the cytoskeleton by SUN-KASH bridges across the nuclear envelope. Current Opinion in Cell Biology. 25 (1), 57-62 (2013).
- Arsenovic, P. T., et al. Nesprin-2G, a Component of the Nuclear LINC Complex, Is Subject to Myosin-Dependent Tension. Biophysical Journal. 110 (1), 34-43 (2016).
- Rowat, A. C., Lammerding, J., Ipsen, J. H. Mechanical properties of the cell nucleus and the effect of emerin deficiency. Biophysical Journal. 91 (12), 4649-4664 (2006).
- Rowat, A. C., Foster, L. J., Nielsen, M. M., Weiss, M., Ipsen, J. H. Characterization of the elastic properties of the nuclear envelope. Journal of the Royal Society Interface. 2 (2), 63-69 (2005).
- Pagliara, S., et al. Auxetic nuclei in embryonic stem cells exiting pluripotency. Nature Materials. 13 (6), 638-644 (2014).
- Liu, H., et al. In situ mechanical characterization of the cell nucleus by atomic force microscopy. ACS Nanotechnology. 8 (4), 3821-3828 (2014).
- Krause, M., Te Riet, J., Wolf, K. Probing the compressibility of tumor cell nuclei by combined atomic force-confocal microscopy. Physical Biology. 10 (6), 065002 (2013).
- Neelam, S., et al. Direct force probe reveals the mechanics of nuclear homeostasis in the mammalian cell. Proceedings of the National Academy of Sciences of the United States of America. 112 (18), 5720-5725 (2015).
- Pajerowski, J. D., Dahl, K. N., Zhong, F. L., Sammak, P. J., Discher, D. E. Physical plasticity of the nucleus in stem cell differentiation. Proceedings of the National Academy of Sciences of the United States of America. 104 (40), 15619-15624 (2007).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. Journal of Clinical Investigation. 113 (3), 370-378 (2004).
- Chancellor, T. J., Lee, J., Thodeti, C. K., Lele, T. Actomyosin tension exerted on the nucleus through nesprin-1 connections influences endothelial cell adhesion, migration, and cyclic strain-induced reorientation. Biophysical Journal. 99 (1), 115-123 (2010).
- Neelam, S., Dickinson, R. B., Lele, T. P. New approaches for understanding the nuclear force balance in living, adherent cells. Methods. 94, 27-32 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved