A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
اختﻻق الكلي لحاء خارج الخلية المستمدة من مصفوفة المائية
In This Article
Summary
نقدم هنا بروتوكولا لاختلاق بها المائية المستمدة من المصفوفة خارج الخلية الكلي لحاء الاحتفاظ بتكوينها الهيكلي والبيوكيميائية المصفوفة خارج الخلية (ECM) الكلي الأصلي. ويرد وصف عملية التصنيع وتطبيقاتها. وأخيراً، تناقش منظورا بشأن استخدام هذه المائية لدعم تجديد الخلايا والأنسجة الخاصة بالكلى والهندسة الحيوية.
Abstract
المصفوفة خارج الخلية (ECM) توفر الرموز الفيزيائية والكيميائية الحيوية الهامة للحفاظ على التوازن الأنسجة. الهلاميات المائية الاصطناعية الحالية تقديم دعم قوي ميكانيكية في المختبر خلية ثقافة لكنها تفتقر إلى تكوين البروتين ويجند اللازمة للحصول على السلوك الفسيولوجية من الخلايا. هذه المخطوطة وصف أسلوب تصنيع للمائية المستمدة من إدارة المحتوى في المؤسسة قشرة الكلي مع المتانة الميكانيكية السليم وتكوين البيوكيميائية داعمة. المائية مختلق ميكانيكيا المجانسة وسولوبيليزينج قشرة الكلي البشرية ديسيلولاريزيد إدارة المحتوى في المؤسسة. المصفوفة يحافظ على نسب البروتين اللحاء المحتوى الكلي الأصلي بينما تمكن أيضا من جيليشن إلى ستيفنيسيس الميكانيكية الفسيولوجية. المائية بمثابة ركيزة عند الكلي التي يمكن الحفاظ على الخلايا المستمدة من اللحاء تحت الظروف الفسيولوجية. وعلاوة على ذلك، يمكن التلاعب بها تكوين المائية نموذج بيئة مريضة التي تمكن الدراسة المستقبلية لأمراض الكلي.
Introduction
المصفوفة خارج الخلية (ECM) توفر الرموز الفيزيائية والكيميائية الحيوية الهامة للحفاظ على التوازن الأنسجة. معقدة التركيب الجزيئي ينظم الخصائص الهيكلية والوظيفية على حد سواء من الأنسجة. تزويد الخلايا بالوعي المكاني البروتينات الهيكلية والسماح ل الالتصاق والهجرة1. يغاندس منضم تتفاعل مع مستقبلات سطح الخلية للتحكم في سلوك الخلية2. الكلي ECM يحتوي على عدد كبير جزيئات التي تكوينها وهيكلها يختلف اعتماداً على موقع التشريحية ومرحلة النمو والمرض الدولة3،4. أتصدى الطابع المعقد لإدارة المحتوى في المؤسسة أحد جوانب رئيسية في دراسة الخلايا المستمدة من الكلي في المختبر.
المحاولات السابقة لتكرار ميكرونفيرونمينتس إدارة المحتوى في المؤسسة ركزت على ديسيلولاريزينج الأنسجة كاملة لإنشاء السقالات قادرة على ريسيلولاريزيشن. وقد أجريت ديسيلولاريزيشن مع المنظفات الكيماوية مثل دوديسيل كبريتات الصوديوم (SDS) أو المنظفات غير الأيونية، وأنه يستخدم أما الجهاز كله نضح أو الغمر والانفعالات أساليب5،6،7 ،،من89،10،11،،من1213. الحفاظ على السقالات المعروضة هنا العظة الهيكلية والبيوكيميائية الموجودة في الأنسجة الأصلية إدارة المحتوى في المؤسسة؛ وعلاوة على ذلك، قد ريسيلولاريزيشن مع الخلايا الخاصة بالجهات المانحة أهمية سريرية في جراحة14،،من1516،،من1718، 19. ومع ذلك، تفتقر إلى المرونة الهيكلية هذه السقالات وبالتالي فهي غير متوافقة مع العديد من الأجهزة الحالية المستخدمة للدراسات في المختبر . للتغلب على هذا التحديد، العديد من المجموعات قد كذلك تجهيز ECM ديسيلولاريزيد الهلاميات المائية20،،من2122،،من2324. هذه الهلاميات المائية متوافقة مع حقن صب وبيوينك والتحايل على القيود المكانية مقياس ميكرومتر التي ديسيلولاريزيد مكان السقالات في الخلايا. وعلاوة على ذلك، يتم الاحتفاظ بالتركيب الجزيئي والنسب الموجودة في المحتوى الأصلي3،25. هنا نظهر أسلوب لاختلاق المائية المستمدة من قشرة الكلي ECM (كيكم).
والغرض من هذا البروتوكول هو إنتاج المائية التي يتطابق المكروية المنطقة القشرية الكلي. أنسجة قشرة الكلي هو ديسيلولاريزيد في حل الحزب الديمقراطي الصربي 1% تحت التحريض المستمر لإزالة هذه المسألة الخلوية. الحزب الديمقراطي الصربي يستخدم عادة ديسيلولاريزي الأنسجة بسبب قدرته على إزالة المواد الخلوية المناعية6،،من79،26بسرعة. كيكم يخضع ثم التجانس الميكانيكية وليوفيليزيشن5،،من69،،من1126. سولوبيليزيشن في حمض قوي مع بيبسن النتائج في20،أسهم حل نهائي المائية27. دعم البروتينات كيكم الأصلية التي هامة للهيكلية وإشارة يتم الاحتفاظ بتوصيل3،25. يمكن أيضا أن تبلور المائية إلى داخل النظام واحدة من حيث الحجم الكلي البشرية الأصلية اللحاء28،،من2930. هذه المصفوفة يوفر بيئة فسيولوجية التي تم استخدامها للحفاظ على التتابع الخلايا الخاصة بالكلى مقارنة الهلاميات المائية من البروتينات مصفوفة أخرى. وعلاوة على ذلك، تكوين مصفوفة يمكن التلاعب بها، وعلى سبيل المثال، عن طريق إضافة الكولاجين-الأول، إلى بيئات المرض نموذج للدراسة من التليف الكلوي وغيرها31،أمراض الكلي32.
Protocol
تم عزل الكلي البشرية بشمال غرب ليفيسينتير اتباع المبادئ التوجيهية الأخلاقية التي وضعتها "رابطة المنظمات شراء الجهاز". ويتبع هذا البروتوكول الحيوان التوجيهية ثقافة الرعاية وخلية المبينة بجامعة واشنطن.
1-إعداد الأنسجة البشرية الكلي
- إعداد حل ديسيلولاريزيشن
- تعقيم كوب مل 5000 وبار ضجة 70 × 10 مم.
- منزوع ميكس 1: 1000 (الوزن: حجم) دوديسيل كبريتات الصوديوم (الحزب الديمقراطي الصربي) في يعقم المياه في الكأس. اترك الحل على طبق ضجة في حوالي 200 في الدقيقة 24 ساعة أو حتى يذوب تماما الحزب الديمقراطي الصربي.
ملاحظة: عادة، 2500 مل من محلول مخزونات النشر الاستراتيجي 1% غير كافية ديسيلولاريزي الكلي بشرية واحدة. - نقل الحل إلى عامل تصفية 500 مل فراغ عقيمة وتصفيته في حاويات يمكن إغلاقها بشرط معقمة.
- التجهيز لانسجة الكلي
- المياه والصرف الصحي والاوتوكلاف زوج من الملقط، هما هيموستات المشابك، الخدمات العامة الصف مقص، اثنين من مقابض شفرة المبضع، 1000 مل كوب مغطاة برقائق الألومنيوم، وبار ضجة 36 × 9 ملم.
- خط غطاء زراعة الأنسجة مع أونديرباد. ضع الكأس وطبق استنبات الأنسجة معقمة (150 × 25 مم) والجهاز الكلوي كله إلى غطاء محرك السيارة. ملء الكأس مع 500 مل من محلول مخزونات النشر الاستراتيجي 1%.
ملاحظة: وردت الكلي البشرية على الجليد من الشمال الغربي ليفيسينتير. - وضع الكلي في طبق استنبات الأنسجة المعقمة (الشكل 1A). إزالة جميع بيريرينال الدهون باستخفاف حلق حول كبسولة الكلي مع مشرط (الشكل 1B).
- جعل شق ضحلة 8-10 سم بدون مشرط، العمق الكافي كسر فتح الكبسولة الكلوي دون إلحاق الضرر بالانسجة الكامنة وراء اللحاء، عبر نهاية متفوقة الكلي. إزالة الكبسولة الكلوي تقشير أنه بعيداً عن نسيج اللحاء مع اثنين هيموستات المشابك (الشكل 1).
- تقسم الكلي على طول الطائرة الاكليلية باستخدام المبضع على طول الجانب الأفقي الكلي (الشكل 1). عزل نسيج اللحاء من كلا نصفي بنحت خارج منطقة ميدلر مع مشرط (الشكل 1E) والنرد أنسجة اللحاء إلى 0.5 سم3 قطع (الشكل 1F). قم بإزالة أي سفن كبيرة مرئية.
- عزل مصفوفة خارج الخلية
- في غطاء زراعة الأنسجة، ملء كوب 1000 مل مع 500 مل من محلول مخزونات النشر الاستراتيجي 1%. وضع شريط قشرة مكعبات الأنسجة وآثاره في الكأس التي تحتوي على حل الحزب الديمقراطي الصربي. تغطية الكأس برقائق الألومنيوم يعقم ووضعه على لوحة ضجة حوالي 400 لفة في الدقيقة خارج هود زراعة الأنسجة.
- بعد أنسجة اللحاء على اللوحة إثارة ح 24، تحقيق الكأس غطاء زراعة الأنسجة وإضافة مصفاة خلية عقيمة 40 ميكرومتر المصنوعة من النايلون شبكة. ملء كوب مل 1000 منفصلة مع 200 مل التبييض ووضعه في هود زراعة الأنسجة.
- "الماصة؛" حل الحزب الديمقراطي الصربي من خلال مصفاة الخلية في كوب يحتوي على التبييض. "الماصة؛" جميع مخزونات النشر الاستراتيجي الحل حتى تبقى الأنسجة ديسيلولاريزيد ومصفاة الخلية فقط في الكأس.
ملاحظة: مصفاة خلية ينبغي منع أي الأنسجة إزالة أثناء الشفط الحل. - اترك مصفاة الخلية في الكأس والتعبئة مع 500 مل الطازجة إلى حل الحزب الديمقراطي الصربي. تغطية الكأس برقائق الألومنيوم نفسه ووضع على لوحة ضجة بنفس السرعة قبل.
- كرر الخطوات 1.3.1-1.3.3 كل 24 ساعة مع حل الحزب الديمقراطي الصربي الطازجة لمدة خمسة أيام.
- شطف ديسيلولاريزيد الأنسجة مع يعقم المياه دي كل 24 ساعة لمدة 3 أيام الكلية، عقب هذه التقنية المبينة في الخطوات 1.3.1-1.3.3.
- شطف الأنسجة ديسيلولاريزيد مع خلية ثقافة الصف المياه كل 24 ساعة لمجموع أيام 2، عقب هذه التقنية المبينة في الخطوات 1.3.1-1.3.3.
- كرر الخطوات 1.3.1-1.3.2. نقل الأنسجة ديسيلولاريزيد (يشار إلى كيكم من هذه النقطة على) في 30 مل بذاتها الأنبوبة المخروطية وملئه بخلية ثقافة الصف المياه حتى يتم غمر كل الأنسجة.
2-تلفيق الحل المخزونات المائية
- معالجة ميكانيكية للأنسجة ديسيلولاريزيد
- في غطاء زراعة الأنسجة، ميكانيكيا تجانسه كيكم داخل الأنبوبة المخروطية مع الخالطون أنسجة لمدة 2 دقيقة.
ملاحظة: يجب أن يشابه كيكم المتجانس حلاً كامد مع لا قطعة مرئية لإدارة المحتوى في المؤسسة. - غمر الأنبوبة المخروطية التي تحتوي على كيكم في النتروجين السائل حتى الغليان المحيطة بالانبوب لم يعد قائما. تخزين كيكم في ˚C-4 بين عشية وضحاها.
- في غطاء زراعة الأنسجة، ميكانيكيا تجانسه كيكم داخل الأنبوبة المخروطية مع الخالطون أنسجة لمدة 2 دقيقة.
- ليوفيليزيشن أنسجة ديسيلولاريزيد المجمدة
- قليلاً قم بفك غطاء الأنبوبة المخروطية للسماح بتبادل الغازات ووضع الأنبوب في جهاز ليوفيليزيشن. ليوفيليزي كيكم لمدة ثلاثة أيام أو حتى أنه يشبه مسحوق أبيض ناعم. مخزن في ˚C-4.
- الهضم الكيميائي و solubilization هلام
- اﻷوتوكﻻف قنينة التﻷلؤ 20 مل وكاب وحانة ضجة 15.9 x 7.9 ملم، وزوج واحد من الملقط نصيحة الجميلة.
- تزن كيكم المجففة بالتبريد وحساب حجم HCl، وكتلة من بيبسن اللازمة لجعل كيكم لحل 3% (30 ملغ/مل) باستخدام المعادلات التالية، حيث mبيبسن هو كتلة بيبسن، مالأنسجة هو كتلة الأنسجة المجففة بالتبريد، و الخامسHCl هو حجم 0.01 N HCl:
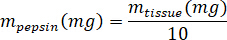
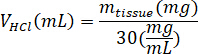
- في غطاء زراعة الأنسجة، إضافة بيبسن المعدة الخنزير، 0.01 N HCl، وشريط إثارة إلى القنينة التﻷلؤ وترك الأمر على صفيحة ضجة في حوالي 500 دورة في الدقيقة حتى قد حلت جميع محيط. نقل كيكم المجففة بالتبريد إلى القنينة التﻷلؤ وترك الحل على طبق ضجة حوالي 500 لفة في الدقيقة لمدة ثلاثة أيام.
3-Hydrogel جيليشن
- إعداد هيدروجيل الكلي إدارة المحتوى في المؤسسة
- هلام المائية بخلط الحل المخزونات المائية كيكم مع هيدروكسيد الصوديوم N 1، 10 × الملحق الإعلامي (M199)، والخلية ثقافة وسائل الإعلام. الاحتفاظ بكافة الحلول على الجليد.
ملاحظة: استخدمت تركيزات جل النهائي 7.5 ملغ/مل لثقافة الخلية. 1 مل جل كيكم كان كافياً لخلية ثقافة التجارب عرضت. - تحديد حجم جل عملي كيكم المنتجة وحجم هيدروجيل كيكم الأسهم المطلوبة باستخدام المعادلة التالية، حيث الخامسالنهائي هو حجم جل إنشاء، Vكيكم الأسهم وحجم الأسهم كيكم المائية اللازمة، جكيكم الأسهم هو تركيز المائية كيكم الأسهم، و جالنهائي هو تركيز جل النهائي:
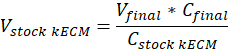
- تحديد حجم لتحييد الكواشف اللازمة باستخدام المعادلات التالية، حيث Vهيدروكسيد الصوديوم هو حجم هيدروكسيد الصوديوم N 1، V10 X هو حجم M199 الملحق 10 X وسائط الإعلام، و الخامس1 X حجم الخلية ثقافة وسائل الإعلام:
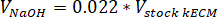
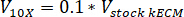
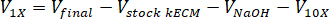
- في غطاء زراعة الأنسجة، "الماصة؛" الكواشف تحييد (هيدروكسيد الصوديوم، M199، وخلية ثقافة وسائل الإعلام) إلى عقيمة 30 مل الأنبوبة المخروطية قائمة بذاتها. مزيج الحل كاشف تحييد مع ميكروسباتولا.
- استخدام المحاقن معقمة 1 مل لنقل حجم الأسهم كيكم المائية المناسبة لتحييد الحل كاشف. استخدام ميكروسباتولا المزيج بلطف الحل حتى يتم الحصول على متجانسة في الألوان المائية الحل.
ملاحظة: تجنب إدخال فقاعات الهواء عن طريق التحريك ببطء لطف. - لدمج الخلايا في هيدروجيل كيكم، استقطاع 10 ميليلتر من خلية ثقافة وسائل الإعلام (V1 X) من تحييد الحل حجم الحسابات في خطوة 3.1.1.3.
- تعليق الخلايا إلى 10 ميليلتر من خلية ثقافة وسائل الإعلام. تحديد عدد الخلايا أن يوقف العمل باستخدام المعادلة التالية، حيث يعني #الخلايا عدد الخلايا بتعليق والخامسالنهائي هو حجم جل إنشاؤها:
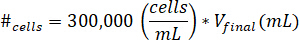
ملاحظة: 300,000 خلايا/مل هو تركيز الخلايا المستخدمة في جل كيكم. - "الماصة؛" 10 ميليلتر لحل تعليق خلية في جل كيكم النهائي بعد حل الأسهم كيكم مختلطاً مع تحييد الحل كاشف. يقلب الحل مع ميكروسباتولا حتى الخلايا وتوزع بالتساوي.
- تعليق الخلايا إلى 10 ميليلتر من خلية ثقافة وسائل الإعلام. تحديد عدد الخلايا أن يوقف العمل باستخدام المعادلة التالية، حيث يعني #الخلايا عدد الخلايا بتعليق والخامسالنهائي هو حجم جل إنشاؤها:
- هلام المائية بخلط الحل المخزونات المائية كيكم مع هيدروكسيد الصوديوم N 1، 10 × الملحق الإعلامي (M199)، والخلية ثقافة وسائل الإعلام. الاحتفاظ بكافة الحلول على الجليد.
- استخدم حقنه 1 مل لملء جهاز ثقافة خلايا المطلوب مع hydrogel كيكم.
- السماح هلام لتعيين في ˚C 37 ح 1 قبل نقل أو طلاء الخلايا.
النتائج
يوفر هيدروجيل كيكم مصفوفة لزراعة الخلايا الكلي مع التركيب الكيميائي مماثلة المكروية الكلي الأصلي. إلى افتعال المائية، نسيج قشرة الكلي معزولة ميكانيكيا من الجهاز كله الكلي ومكعبات (الشكل 1). ديسيلولاريزيشن مع منظفات كيميائية (الشكل 2A....
Discussion
مصفوفات توفير إشارات الميكانيكية والكيميائية الهامة التي تحكم سلوك الخلية. الهلاميات المائية الاصطناعية قادرة على دعم الزخرفة 3 الأبعاد المعقدة، لكنهم فشلوا في تقديم العظة خارج الخلية المتنوعة الموجودة في مصفوفة الفسيولوجية ميكرونفيرونمينتس. الهلاميات المائية المستمدة من إدارة المحت?...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
ويود المؤلفون الاعتراف بلين ومختبر التصوير غارفي مايك في معهد للخلايا الجذعية والطب التجديدي، وشمال غرب ليفيسينتير. أنها أيضا تود أن تقر بالدعم المالي لمنح "المعاهد الوطنية للصحة"، TR000504 UH2/UH3 (إلى J.H.) و DP2DK102258 (إلى Y.Z.)، T32 المعاهد الوطنية للصحة التدريب منحة DK0007467 (R.J.N.) وهدية غير مقيد من مراكز الكلي الشمال الغربي معهد أبحاث الكلي.
Materials
| Name | Company | Catalog Number | Comments |
| Preparation of Kidney Tissue | |||
| 5000 mL Beaker | Sigma-Aldrich | Z740589 | |
| Sodium Dodecyl Sulfate (SDS) | Sigma-Aldrich | 436143 | |
| Sterile H2O | Autoclaved DI H2O | ||
| Stir Bar (70 x 10 mm) | Fisher Science | 14-512-128 | |
| 500 mL Vacuum Filter | VWR | 97066-202 | |
| Stir Plate | Sigma-Aldrich | CLS6795420D | |
| 1000 mL Beaker | Sigma-Aldrich | CLS10031L | |
| Forceps | Sigma-Aldrich | F4642 | Any similar forceps may be used |
| Scissor-Handle Hemostat Clamp | Sigma-Aldrich | Z168866 | |
| Dissecting Scissors | Sigma-Aldrich | Z265977 | |
| Scalpel Handle, No. 4 | VWR | 25859-000 | Any similar scalpel handle may be used |
| Scalpel Blade, No. 20 | VWR | 25860-020 | Any similar scalpel blade may be used |
| Stir Bar (38.1 x 9.5 mm) | Fisher Science | 14-513-52 | |
| Absorbent Underpad | VWR | 82020-845 | |
| Petri Dish (150 x 25 mm) | Corning | 430597 | |
| Autoclavable Biohazard Bag | VWR | 14220-026 | |
| Sterile Cell Strainer (40 um) | Fisher Science | 22-363-547 | |
| Cell Culture Grade Water | HyClone | SH30529.03 | |
| 30 mL Freestanding Tube | VWR | 89012-778 | |
| Fabrication of ECM Gel | |||
| Tissue Homogenizer Machine | Polytron | PCU-20110 | |
| Freeze Dryer | Labconco | 7670520 | |
| 20 mL Glass Scintillation Vials and Cap | Sigma-Aldrich | V7130 | |
| Stir Bar (15.9 x 8 mm) | Fisher Science | 14-513-62 | |
| Pepsin from Porcine Gastric Mucosa | Sigma-Aldrich | P7012 | |
| 0.01 N HCl | Sigma-Aldrich | 320331 | Dilute to 0.01 N HCl with cell culuture water |
| Kidney ECM Gelation | |||
| 1 N NaOH (Sterile) | Sigma-Aldrich | 415413 | Dilute to 1 N in cell culture grade water |
| Medium 199 | Sigma-Aldrich | M4530 | |
| 15 mL Conical Tube | ThermoFisher | 339651 | |
| Cell Culture Media | ThermoFisher | 11330.032 | Dulbecco's Modified Eagle Medium: Nutrient Mixture F-12 (DMEM/F12) |
| Fetal Bovine Serum (FBS) | Gibco | 10082147 | |
| Antibiotic-Antimycotic 100X | Life Technologies | 15240-062 | |
| Insulin, Transferrin, Selenium, Sodium Pyruvate Solution (ITS-A) 100X | Life Technologies | 51300-044 | |
| 1 mL Syringe | Sigma-Aldrich | Z192325 | |
| Microspatula | Sigma-Aldrich | Z193208 |
References
- Lelongt, B., Ronco, P. Role of extracellular matrix in kidney development and repair. Pediatric Nephrology. 18 (8), 731-742 (2003).
- Yue, B. Biology of the Extracellular Matrix: An Overview. Journal of Glaucoma. 23, S20-S23 (2014).
- Miner, J. H. Renal basement membrane components. Kidney International. 56 (6), 2016-2024 (1999).
- Petrosyan, A., et al. Decellularized Renal Matrix and Regenerative Medicine of the Kidney: A Different Point of View. Tissue Engineering Part B. 22 (3), 183-192 (2016).
- Caralt, M., et al. Optimization and Critical Evaluation of Decellularization Strategies to Develop Renal Extracellular Matrix Scaffolds as Biological Templates for Organ Engineering and Transplantation. American Journal of Transplantation. 15 (1), 64-75 (2015).
- Nakayama, K. H., Batchelder, C. A., Lee, C. I., Tarantal, A. F. Decellularized rhesus monkey kidney as a three-dimensional scaffold for renal tissue engineering. Tissue Engineering Part A. 16 (7), 2207-2216 (2010).
- Nakayama, K. H., Lee, C. C. I., Batchelder, C. A., Tarantal, A. F. Tissue Specificity of Decellularized Rhesus Monkey Kidney and Lung Scaffolds. Public Library of Science ONE. 8 (5), (2013).
- Orlando, G., et al. Production and implantation of renal extracellular matrix scaffolds from porcine kidneys as a platform for renal bioengineering investigations. Annals of Surgery. 256 (2), 363-370 (2012).
- Sullivan, D. C., et al. Decellularization methods of porcine kidneys for whole organ engineering using a high-throughput system. Biomaterials. 33 (31), 7756-7764 (2012).
- Choi, S. H., et al. Development of a porcine renal extracellular matrix scaffold as a platform for kidney regeneration. Journal of Biomedical Materials Research Part A. 103 (4), 1391-1403 (2015).
- Ross, E. A., et al. Mouse stem cells seeded into decellularized rat kidney scaffolds endothelialize and remodel basement membranes. Organogenesis. 8 (2), 49-55 (2012).
- Nagao, R. J., et al. Decellularized Human Kidney Cortex Hydrogels Enhance Kidney Microvascular Endothelial Cell Maturation and Quiescence. Tissue Engineering Part A. 22 (19-20), 1140-1150 (2016).
- Gupta, S. K., Mishra, N. C., Dhasmana, A. Decellularization Methods for Scaffold Fabrication. Methods in Molecular Biology. , 1-10 (2017).
- Hudson, T., et al. Optimized Acellular Nerve Graft is Immunologically Tolerated and Supports Regeneration. Tissue Engineering. 10 (11), 1641-1651 (2004).
- Atala, A., Bauer, S. B., Soker, S., Yoo, J. J., Retik, A. B. Tissue-engineered autologous bladders for patients needing cystoplasty. Lancet. 367 (9518), 1241-1246 (2006).
- Ott, H. C., et al. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Uygun, B., et al. Organ reengineering through development of a transplantable recellularied liver graft using decellularized liver matrix. Nature Medicine. 16 (7), 814-820 (2010).
- Nagao, R. J., et al. Preservation of Capillary-beds in Rat Lung Tissue Using Optimized Chemical Decellularization. Journal of Materials Chemistry B. 1 (37), 4801-4808 (2013).
- Song, J. J., et al. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Medicine. 19 (5), 646-651 (2013).
- Freytes, D. O., Martin, J., Velankar, S. S., Lee, A. S., Badylak, S. F. Preparation and rheological characterization of a gel form of the porcine urinary bladder matrix. Biomaterials. 29 (11), 1630-1637 (2008).
- Wolf, M. T., et al. A hydrogel derived from decellularized dermal extracellular matrix. Biomaterials. 33 (29), 7028-7038 (2012).
- Fisher, M. B., et al. Potential of healing a transected anterior cruciate ligament with genetically modified extracellular matrix bioscaffolds in a goat model. Knee Surgery, Sports Traumatology, Arthroscopy. 20 (7), 1357-1365 (2012).
- Ghuman, H., et al. ECM hydrogel for the treatment of stroke: Characterization of the host cell infiltrate. Biomaterials. 91, 166-181 (2016).
- Rijal, G. The decellularized extracellular matrix in regenerative medicine. Regenerative Medicine. 12 (5), 475-477 (2017).
- Lennon, R., et al. Global Analysis Reveals the Complexity of the Human Glomerular Extracellular Matrix. Journal of the American Society of Nephrology. 25 (5), 939-951 (2014).
- Bonandrini, B., et al. Recellularization of Well-Preserved Acellular Kidney Scaffold Using Embryonic Stem Cells. Tissue Engineering Part A. 20 (9-10), 1486-1498 (2014).
- O'Neill, J. D., Freytes, D. O., Anandappa, A. J., Oliver, J. A., Vunjak-Novakovic, G. V. The regulation of growth and metabolism of kidney stem cells with regional specificity using extracellular matrix derived from kidney. Biomaterials. 34 (38), 9830-9841 (2013).
- Streitberger, K. -. J., et al. High-resolution mechanical imaging of the kidney. Journal of Biomechanics. 47 (3), 639-644 (2014).
- Bensamoun, S. F., et al. Stiffness imaging of the kidney and adjacent abdominal tissues measured simultaneously using magnetic resonance elastography. Clinical Imaging. 35 (4), 284-287 (2011).
- Moon, S. K., et al. Quantification of Kidney Fibrosis Using Ultrasonic Shear Wave Elastography. Journal of Ultrasound in Medicine. 34, 869-877 (2015).
- Genovese, F., Manresa, A. A., Leeming, D. J., Karsdal, M. A., Boor, P. The extracellular matrix in the kidney: a source of novel non-invasive biomarkers of kidney fibrosis?. Fibrogenesis & Tissue Repair. 7 (1), (2014).
- Hewitson, T. D. Fibrosis in the kidney: is a problem shared a problem halved?. Fibrogenes & Tissue Repair. 5 (1), S14 (2012).
- Wolf, M. T., et al. Polypropylene surgical mesh coated with extracellular matrix mitigates the host foreign body response. Journal of Biomedical Materials Research Part A. 102 (1), 234-246 (2014).
- Faulk, D. M., et al. ECM hydrogel coating mitigates the chronic inflammatory response to polypropylene mesh. Biomaterials. 35 (30), 8585-8595 (2014).
- Jeffords, M. E., Wu, J., Shah, M., Hong, Y., Zhang, G. Tailoring Material Properties of Cardiac Matrix Hydrogels To Induce Endothelial Differentiation of Human Mesenchymal Stem Cells. ACS Applied Materials & Interfaces. 7 (20), 11053-11061 (2015).
- Kim, M. -. S., et al. Differential Expression of Extracellular Matrix and Adhesion Molecules in Fetal-Origin Amniotic Epithelial Cells of Preeclamptic Pregnancy. Public Library of Science ONE. 11 (5), e0156038 (2016).
- Paduano, F., Marrelli, M., White, L. J., Shakesheff, K. M., Tatullo, M. Odontogenic Differentiation of Human Dental Pulp Stem Cells on Hydrogel Scaffolds Derived from Decellularized Bone Extracellular Matrix and Collagen Type I. Public Library of Science ONE. 11 (2), e0148225 (2016).
- Viswanath, A., et al. Extracellular matrix-derived hydrogels for dental stem cell delivery. Journal of Biomedical Materials Research Part A. 105 (1), 319-328 (2017).
- Uriel, S., et al. Extraction and Assembly of Tissue-Derived Gels for Cell Culture and Tissue Engineering. Tissue Engineering Part C Methods. 15 (3), 309-321 (2009).
- Saldin, L. T., Cramer, M. C., Velankar, S. S., White, L. J., Badylak, S. F. Extracellular matrix hydrogels from decellularized tissues: Structure and function. Acta Biomaterialia. 49, 1-15 (2017).
- Faust, A., et al. Urinary bladder extracellular matrix hydrogels and matrix-bound vesicles differentially regulate central nervous system neuron viability and axon growth and branching. Journal of Biomaterials Applications. 31 (9), 1277-1295 (2017).
- Pouliot, R. A., et al. Development and characterization of a naturally derived lung extracellular matrix hydrogel. Journal of Biomedical Materials Research Part A. 104 (8), 1922-1935 (2016).
- Pati, F., et al. Printing three-dimensional tissue analogues with decellularized extracellular matrix bioink. Nature Communications. 5, 3935 (2014).
- Pati, F., et al. Biomimetic 3D tissue printing for soft tissue regeneration. Biomaterials. 62, 164-175 (2015).
- Wang, R. M., Christman, K. L. Decellularized myocardial matrix hydrogels: In basic research and preclinical studies. Advanced Drug Delivery Reviews. 96, 77-82 (2016).
- Jang, J., et al. 3D printed complex tissue construct using stem cell-laden decellularized extracellular matrix bioinks for cardiac repair. Biomaterials. 112, 264-274 (2017).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (Pt 24), 4195-4200 (2010).
- Mouw, J. K., Ou, G., Weaver, V. M. Extracellular matrix assembly: a multiscale deconstruction. Nature Reviews Molecular Cell Biology. 15 (12), 771-785 (2014).
- Bonnans, C., Chou, J., Werb, Z. Remodelling the extracellular matrix in development and disease. Nature Reviews Molecular Cell Biology. 15 (12), 786-801 (2014).
- Hinderer, S., Layland, S. L., Schenke-Layland, K. ECM and ECM-like materials - Biomaterials for applications in regenerative medicine and cancer therapy. Advanced Drug Delivery Reviews. 97, 260-269 (2016).
- Uriel, S., et al. The role of adipose protein derived hydrogels in adipogenesis. Biomaterials. 29 (27), 3712-3719 (2008).
- Singelyn, J. M., et al. Naturally derived myocardial matrix as an injectable scaffold for cardiac tissue engineering. Biomaterials. 30 (29), 5409-5416 (2009).
- Medberry, C. J., et al. Hydrogels derived from central nervous system extracellular matrix. Biomaterials. 34 (4), 1033-1040 (2013).
- Loneker, A. E., Faulk, D. M., Hussey, G. S., D'Amore, A., Badylak, S. F. Solubilized liver extracellular matrix maintains primary rat hepatocyte phenotype in-vitro. Journal of Biomedical Materials Research Part A. 104 (4), 957-965 (2016).
- Hill, R. C., Calle, E. A., Dzieciatkowska, M., Niklason, L. E., Hansen, K. C. Quantification of extracellular matrix proteins from a rat lung scaffold to provide a molecular readout for tissue engineering. Molecular & Cellular Proteomics. 14 (4), 961-973 (2015).
- Li, Q., et al. Proteomic analysis of naturally-sourced biological scaffolds. Biomaterials. 75, 37-46 (2016).
- Tanaka, T., Yada, R. Y. N-terminal portion acts as an initiator of the inactivation of pepsin at neutral pH. Protein Engineering. 14 (9), 669-674 (2001).
- Ligresti, G., et al. A Novel Three-Dimensional Human Peritubular Microvascular System. Journal of the American Society of Nephrology. 27 (8), 2370-2381 (2016).
- Mozes, M. M., Böttinger, E. P., Jacot, T. A., Kopp, J. B. Renal expression of fibrotic matrix proteins and of transforming growth factor-beta (TGF-beta) isoforms in TGF-beta transgenic mice. Journal of the American Society of Nephrology. 10 (2), 271-280 (1999).
- Romanowicz, L., Galewska, Z. Extracellular matrix remodeling of the umbilical cord in pre-eclampsia as a risk factor for fetal hypertension. Journal of Pregnancy. 2011, 542695 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved