Method Article
قياس الإنتاجية العالية من ماكروبينوسيتوسيس ديسكويديوم ديكتيوستيليوم "التدفق الخلوي"
In This Article
Summary
من المهم ماكروبينوسيتوسيس، امتصاص السوائل غير محددة على نطاق واسع، في العديد من مجالات البيولوجيا السريرية بما في ذلك أمراض المناعة والعدوى والسرطان والأعصاب. هنا، قد كيفت للسماح بالقرار الفائق، خلية واحدة قياس ماكروبينوسيتوسيس في ماكروبينوسيتوسيس طراز الكائن الحي ديسكويديوم ديكتيوستيليوم باستخدام التدفق الخلوي التقنيات الموجودة.
Abstract
امتصاص السوائل غير محددة واسعة النطاق ماكروبينوسيتوسيس مهم لانتشار بعض الخلايا السرطانية مستضد أخذ العينات وغزو الخلية المضيفة وانتشار أمراض الأعصاب. وقد السلالات المختبرية المستخدمة عادة من الاميبا ديسكويديوم ديكتيوستيليوم معدلات عالية للغاية من امتصاص السوائل عندما نمت في المتوسط المغذيات، أكثر من 90% منها بسبب ماكروبينوسيتوسيس. وبالإضافة إلى ذلك، العديد من المكونات الأساسية المعروفة للثدييات ماكروبينوسيتوسيس موجودة أيضا، مما يجعل من نظام نموذجا ممتازا لدراسة ماكروبينوسيتوسيس. هنا، الأسلوب القياسي لقياس السوائل المدخلة باستخدام ديكستران فلوري كتسمية يتكيف مع شكل لوحة 96-جيدا، مع العينات التي تم تحليلها بالتدفق الخلوي باستخدام ملحق الفائق أخذ عينات (HTS).
ويتم تغذية الخلايا ديكستران الفلورية غير قوينتشابل لمدة محددة سلفا من الوقت، غسلها بالانغماس في المخزن المؤقت المثلج وفصل استخدام أزيد الصوديوم 5 مم، التي توقف الرقابة أيضا. ثم يتم تحليل خلايا في كل بئر بالتدفق الخلوي. الأسلوب كما يمكن تكييفها لقياس امتصاص الغشاء والبلعمه من الخرز الفلورسنت أو البكتيريا.
هذا الأسلوب صمم للسماح لقياس امتصاص السوائل ديكتيوستيليوم بطريقة تتسم بكفاءة العالية الإنتاجية والعمالة والموارد. أنه يسمح بمقارنة متزامنة لسلالات (مثل خروج المغلوب طفرات الجينات) وشروط متعددة (مثل الخلايا في وسائل الإعلام المختلفة أو تعامل مع تركيزات مختلفة من المانع) بالتوازي ويبسط الدورات الزمنية.
Introduction
امتصاص السوائل غير محددة واسعة النطاق ماكروبينوسيتوسيس مهم في عدة سياقات البيولوجية1، بما في ذلك أخذ العينات مستضد بالمناعة الخلايا2، دخول الممرض المضيف الخلايا3، سرطان الخلية الانتشار4 انتشار أمراض بريون5. وفي الثدييات وخلايا ديكتيوستيليوم ، PI أكتين6،7،9،،من8ف-3 (3,4,5)10 (على الرغم من أن الطبيعة الدقيقة للمادة الدهنية تختلف بين اثنين11)، وتنشيط رأس12،13و14،راك المنشط15 هامة لكفاءة امتصاص السوائل ماكروبينوسيتوسيس، على الرغم من أنه لا تزال هناك العديد من الأسئلة دون إجابة حول كيف يتم التصحيح ماكروبينوسيتيك تشكيل المنظمة والمدخلة في نهاية المطاف. اكتشاف البروتينات أكثر أهمية بالنسبة ماكروبينوسيتوسيس، وفيما بعد، تحديد كيف أنها هامة في مختلف السياقات البيولوجية، سوف تعطي فهم أكثر شمولاً من ماكروبينوسيتوسيس ومن المحتمل أن يسمح تطوير واستهدفت علاجات لمجموعة من الشروط.
ديكتيوستيليوم نظام نموذج مثالي لدراسة ماكروبينوسيتوسيس. مستوى عال من ماكروبينوسيتوسيس التأسيسي في سلالات المختبر القياسية يعني أن امتصاص السوائل هو ما يزيد على 90 في المائة بسبب ماكروبينوسيتوسيس6. وهذا ما يسمح ماكروبينوسيتوسيس أن يقاس فقط بتحديد امتصاص السوائل، وخلافا لخلايا الثدييات حيث أن نسبة امتصاص السوائل بسبب ماكروبينوسيتوسيس أقل بكثير. ماكروبينوسيتوسيس يعرف جيدا جداً، ويقدم بسهولة تصور12 في هذا النظام وبالمثل مزايا واضحة للتحقيق الأساسية مكونات مصانة ماكروبينوسومي على النظم الأخرى حيث قد يكون هناك إشارات تنظيمية متعددة 16 , 17.
هذه التقنية القياسية المستخدمة لقياس ماكروبينوسيتوسيس بخلايا الثدييات ينطوي على تحديد الخلايا بعد النبض مع ديكستران لفترة قصيرة من الوقت متبوعاً بالفحص المجهري لتحديد منطقة الخلية التي تحتلها الحويصلات ديكستران إيجابية18. هذا الأسلوب لا تمثل مع ذلك إمكانية ماكروبينوسوميس تقلص عند دخول الخلية، التي سجلت في ديكتيوستيليوم19، ويأخذ في الحسبان سوى الطائرات وحيدة الخلية، بمعنى أن حجم استيعابه وليس واضحا. أسلوب بديل، لإحصاء عدد ماكروبينوسوميس في وقت معين، قد سلبيات نفس20. استخدام ديكتيوستيليوم تجنب هذه القضايا؛ ومع ذلك، التقنيات الموجودة لقياس امتصاص السوائل ديكتيوستيليوم نسبيا كمية العمل المكثف، باستخدام كبير للخلايا وديكستران21. يتم هز الخلايا في كثافة عالية في ديكستران الفلورسنت وإزالتها في نقاط زمنية مختلفة لتحديد الأسفار المدخلة فلوريميتير باستخدام عينات. يمكن تحليل الخلايا التي أعدت هذه الطريقة بالتدفق الخلوي للحصول على خلية واحدة، بدلاً من مستوى السكان،22من القرار، على الرغم من أن هذه تظل منخفضة الإنتاجية.
هنا، الأسلوب القياسي لقياس السوائل المدخلة باستخدام ديكستران فلوري كتسمية يتكيف مع شكل لوحة 96-جيدا، مع العينات التي تم تحليلها بالتدفق الخلوي باستخدام ملحق الفائق أخذ عينات (HTS). ويتم تغذية الخلايا ديكستران الفلورية غير قوينتشابل لمدة محددة سلفا من الوقت، غسلها بالانغماس في المخزن المؤقت المثلج وفصل استخدام أزيد الصوديوم 5 مم، التي توقف الرقابة أيضا. ثم يتم تحليل خلايا في كل بئر بالتدفق الخلوي. تم تصميم هذا الأسلوب التغلب على أوجه قصور الأساليب المذكورة أعلاه وتسمح بمقارنة متزامنة لامتصاص السوائل عدد كبير من سلالات/الظروف أثناء استخدام موارد أقل، والحد من العمال المعنيين.
Protocol
1-إعداد الخلايا والمواد
- زراعة الخلايا أما في لوحات أجار SM بالاقتران مع البكتيريا مثل الكلبسيله الغازية، أو في المتوسط المغذيات مثل HL5 ك وصف23.
ملاحظة: تنمو طفرات الضربة القاضية التي كانت ناقصة في ماكروبينوسيتوسيس على البكتيريا يساعد على منع تراكم الطفرات الثانوية التي قد تزيد من معدل ماكروبينوسيتوسيس. الاحتفاظ بعدد مرور أقل من 4 بعد طلاء الخلايا من مخزونات للحصول على أفضل النتائج. يجب تخزين طفرات الأرصدة المجمدة بأسرع بعد عزلة. - لزراعة الخلايا على لوحات أجار SM، تنمو الغازية ك لالتقاء في المتوسط SM. إضافة 200-300 ميكروليتر من البكتيريا على صفيحة أجار SM وتنتشر. تأخذ حلقة عقيمة من الخلايا (عند نقل من آخر لوحة البكتيرية) وانتشرت في حافة واحدة اللوحة. احتضان عند 22 درجة مئوية لتصل إلى أسبوع.
- حل تترا-الميثيل-والرودامين ديكستران isothiocyanate (-تريتك) إلى 50 ملغ/مل في المياه والتصفية باستخدام مرشحات ميكرومترات 0.22 إلى مختبرين 1 مل وتخزينها في-20 درجة مئوية. يمكن أن تظل مختبرين إلى أجل غير مسمى.
ملاحظة: كاتشين 155 هو حجم النموذجية المستخدمة مع هذا الأسلوب، كما أنه يمكن شراؤها بأسعار زهيدة بكميات كبيرة، ولكن ديكسترانس أصغر قياس ماكروبينوسيتوسيس فقط بشكل فعال في ديكتيوستيليوم24. ديكسترانس غير قوينتشابل مختلفة، مثل الأزرق تتالي أو أليكسا-647، بدائل إذا لزم فلوروفوريس مختلفة.
2-تحويل القياسات النوعية في الكمية (اختياري)
-
إجراء مقايسة امتصاص السوائل استخدام الخلايا في التعليق.
- بيليه الخلايا أكسينيكالي المتزايد في ز 300 x لمدة 3 دقائق وتجاهل المادة طافية وريسوسبيند في المتوسط 1 × 107 خلايا/مل والمغذيات. إضافة ديكستران تريتك إلى 0.5 ملغ/مل ويهز 180 لفة في الدقيقة، 22 درجة مئوية.
- تمييع 0.8 مل عينات إلى 0.7 مل من المثلج2 الساعة 0، 30، 60، 90، 120 دقيقة أغسل مرة واحدة في 1.5 مل من المثلج2 المخزن المؤقت23 في الطرد مركزي benchtop، ريسوسبيند إلى 1 مل في المخزن المؤقت لنفس وتخزينها على الجليد.
ملاحظة: الغسيل فورا أو مجرد جميع العينات قد جمعت غلة نتائج متكافئة.
-
تحديد حجم السائل استيعابه بالخلايا.
- تعيين فلوريميتير لقياس الفلورية استخدام الطول موجي إثارة للطول الموجي نانومتر والانبعاثات 544 من 574 شمال البحر الأبيض المتوسط مع فتحه 10 نانومتر. إعداد سلسلة تخفيف من ديكستران تريتك واستخدامها لقياس الأسفار لوحدات التخزين من ديكستران. إنشاء منحنى معايرة.
- قياس fluorescence استيعابه بالخلايا الموجودة في الفرع 2-1 استخدام 0.9 مل تعليق خلية. حساب حجم السائل تستوعب كل خلية باستخدام منحنى المعايرة24.
- تمييع ما تبقى الخلايا من نقطة الوقت كل على حدة إلى 0.5 مل الجليد الباردة2. التصفية من خلال مصفاة خلية 70 ميكرومتر إلى 5 مل البوليستيرين التدفق الخلوي أنابيب. تعيين cytometer تدفق حيث أن خلايا من كل نقطة الوقت تختلف عن بعضها البعض وتسجيل هذه الأسفار (انظر الفرعين 3.4 و 3.5).
- قياس الأسفار حبات المعايرة في سيتوميتير التدفق باستخدام الإعدادات أعلاه وتسجيله.
ملاحظة: هذا هو المرجع لجميع القياسات الأسفار مستقبلا على cytometer تدفق: قبل استخدام مرة أخرى تشغيل الخرز وضبط الإعدادات بحيث لديهم الأسفار نفسها. وهذا سيعطي ذروة محددة ضيقة جداً. وضع بوابة حول ذروة الأسفار ويمكن جعل هذا أسهل. - كرر ثلاث مرات ورسم البيانات fluorescence الخلية التي تم الحصول عليها في الأبواب 2.2 و 2.3 ضد بعضها البعض. ارسم خط لتناسب أفضل واستخدام المعادلة لتحويل البيانات النوعية من قياس التدفق إلى وحدات الكمية.
3-قياس امتصاص السوائل
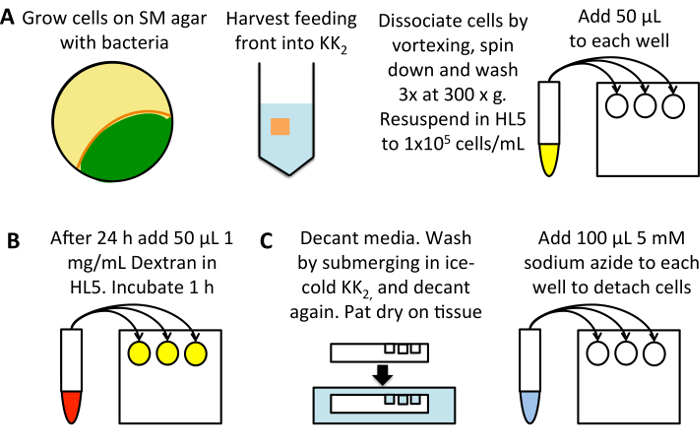
رقم 1: التخطيطي لقياس الإنتاجية العالية من ماكروبينوسيتوسيس. (أ) النمو ديكتيوستيليوم على صفيحة SM المصنف مع البكتيريا الغازية ك. (أصفر). حصاد الخلايا من الجبهة التغذية (برتقالي)، تجنب الخلايا التي يتم تطويرها بالفعل (الأخضر)، إلى 25 مل2 المخزن المؤقت. دوامة أن تنأى، بيليه بالطرد المركزي 3 دقيقة في 300 س ز، ثم أغسل 3 مرات في 50 مل2 المخزن المؤقت، مع تجاهل المادة طافية في كل مرة. ريسوسبيند إلى 1 × 105 خلايا/مل في HL5 النمو المتوسطة وإضافة 50 ميليلتر في ثلاثة آبار كل عينة لوحة مسطحة القاع 96-جيدا. احتضان عند 22 درجة مئوية ل 24 h. مخفف (ب) تريتك ديكستران إلى 1 مغ/مل في HL5 النمو المتوسطة من حل أسهم من 50 ملغ/مل. إضافة 50 ميليلتر لكل عينة (باستثناء آبار مراقبة الامتصاص 0 دقيقة)، واحتضان عند 22 درجة مئوية ل 1 ح، بعد الذي إضافة ديكستران إلى عنصر تحكم امتصاص 0 دقيقة. (ج) صب مباشرة في وسائل الإعلام، وبات لوحة على أنسجة إزالة الزائدة المتوسطة وتغرق في حمام من المثلج المخزن المؤقت2 ، سد الآبار لغسل. صب المخزن المؤقت وبات الجافة مرة أخرى. إضافة 100 ميليلتر من 5 مم أزيد الصوديوم المذابة في2مولودية لفصل الخلايا. أن تدفق سيتوميتير لقياس fluorescence المدخلة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
-
إعداد لوحة مغلوطاً 96-جيدا-زراعة أنسجة (الشكل 1A). استخدام الخلايا التي نمت على البكتيريا وتحويلها إلى HL5 المتوسطة (التي تحتوي على 100 ميكروغرام/مل ديهيدروستريبتوميسين، 100 ميكروغرام/مل الأمبيسلّين وكاناميسين 50 ميكروغرام/مل) 24 ساعة قبل الفحص؛ وهذا ما يسمح ماكروبينوسيتوسيس أن يكون upregulated من مستويات منخفضة في الخلايا المزروعة في البكتيريا24. وبدلاً من ذلك، يؤدي إلى تمييع الخلايا مباشرة من الثقافة أكسينيك، وتفرخ ل 24 ساعة قبل الفحص، للحد من الأخطاء بسبب الخلايا التي تضعف من كثافات مختلفة.
- حصاد الخلايا من الجبهة التغذية إلى 25 مل2 في أنبوب الطرد مركزي 50 مل. فصل الخلايا من فورتيكسينج وبيليه في 300 x ز لمدة 3 دقائق. تجاهل المادة طافية، ريسوسبيند بيليه ويغسل 3 مرات في 300 x ز لمدة 3 دقيقة في 50 مل2، مع تجاهل المادة طافية في كل مرة لإزالة البكتيريا.
- تحديد كثافة الخلية (باستخدام هيماسيتوميتير أو خلية أخرى عد النظام) ويضعف في المضادات الحيوية التي تحتوي على HL5 إلى 1 × 105 خلايا/مل. "الماصة؛" 50 ميكروليتر في كل بئر، باستخدام ثلاثة آبار لكل حالة. احتضان عند 22 درجة مئوية ل h. 24 تذكر لإعداد عنصر تحكم امتصاص 0 دقيقة.
ملاحظة: بديل متوسطة، مثل سيح، VL6 يمكن استخدامها بدلاً من ذلك.
-
تحميل خلايا مع تريتك-ديكستران (الشكل 1B).
- تمييع ديكستران إلى 1 مغ/مل في الوسيلة المستخدمة (وهذا يمكن زيادة إلى 2.5 – 5 ملغ/مل عند تقييم الخلايا بامتصاص منخفضة جداً). إضافة 50 ميكروليتر لكل بئر (إعطاء تركيز نهائي من 0.5 ملغ/مل تريتك-ديكستران) وإرجاع اللوحة إلى 22 درجة مئوية ح 1، كما يسمح هذا التراكم ديكستران كبيرة ولكن الرقابة ديكستران لم تبدأ بعد.
ملاحظة: ماصة مكرر تسمح هذه الخطوة يمكن القيام به أكثر سرعة، الحد من الأخطاء.
- تمييع ديكستران إلى 1 مغ/مل في الوسيلة المستخدمة (وهذا يمكن زيادة إلى 2.5 – 5 ملغ/مل عند تقييم الخلايا بامتصاص منخفضة جداً). إضافة 50 ميكروليتر لكل بئر (إعطاء تركيز نهائي من 0.5 ملغ/مل تريتك-ديكستران) وإرجاع اللوحة إلى 22 درجة مئوية ح 1، كما يسمح هذا التراكم ديكستران كبيرة ولكن الرقابة ديكستران لم تبدأ بعد.
-
إعداد الخلايا للتدفق الخلوي (الشكل 1).
- مباشرة قبل الغسيل، إضافة الوسائط التي تحتوي على ديكستران 50 ميكروليتر إلى عناصر امتصاص 0 دقيقة.
- صب المتوسطة وبات الجافة في أنسجة. أغسل بغمر اللوحة في المثلج2، ثم صب.
ملاحظة: قد تصبح فصل بعض السلالات بعيوب التقيد أثناء هذه الخطوة، مثلاً بالضربة قاضية لكلا هومولوجس تالين (تالا-/بور-)25. كن حذراً عند العمل مع خطوط الخلايا إرفاق سيئة ونضح الوسائط إذا لزم الأمر. - إضافة 100 ميكروليتر من المثلج 5 مم أزيد الصوديوم المذابة في2مولودية (2 + 2 مم MgSO4 و 100 ميكرومتر كاكل2).
تنبيه: أزيد الصوديوم بالغة السمية. استخدام قناع غبار ونظارات السلامة عند العمل مع المسحوق. دائماً ارتداء القفازات ومعطف المعمل. تجنب الحرارة ولا تخلط مع حمض.
ملاحظة: فصل الخلايا سريعاً، والرقابة منعت24. يمكن استخدام مجهر للتحقق من ذلك.
-
امتصاص السوائل قياس التدفق الخلوي
- إذا كان التخطيط لتحويل القيم النسبية لتلك المطلقة، استخدام الخرز لمعايرة إعدادات cytometer تدفق (انظر القسم 2). بدلاً من ذلك، استخدام الخلايا محملة ديكستران كما هو الحال في الفرع 2 لضمان أن مبعثر إلى الأمام ومبعثر الجانب يتم تعيين بشكل مناسب لعزل الخلايا (الشكل 2A)، ضمان الجهاز غير محظور، (الشكل 2) وضبط معلمات قياس fluorescence المدخلة (الشكل 2).
- إرفاق نظام أخذ العينات الفائق وإضافة لوحة. قم بإعداد بروتوكول لقياس الأسفار (تريتك-ديكستران استخدام ليزر الأصفر والأخضر لإثارة وقياس في القناة نانومتر 582 أو ما شابه) ليصل إلى 65 ميكروليتر من تعليق خلية والتشغيل.
-
تحليل نتائج التدفق الخلوي
- بوابة في الخلايا باستخدام مبعثر إلى الأمام والجانب مبعثر (الشكل 2A). حساب الأسفار الوسيط للخلايا باستخدام الخيار الإحصاءات. تعيين هذه المعلمات باستخدام عينة واحدة وتطبق على جميع العينات.
ملاحظة: يمكن أن تختلف الملامح مبعثر جانبية المبعثر إلى الأمام بين العينات عند استخدام طفرات مختلفة أو مثبطات. - تحديد متوسط ثلاث آبار لكل شرط وطرح 0 دقيقة امتصاص عنصر التحكم. أما تحويل القيم الكمية باستخدام المعادلة المحددة في المادة 2 أو تطبيع لعنصر التحكم.
- بوابة في الخلايا باستخدام مبعثر إلى الأمام والجانب مبعثر (الشكل 2A). حساب الأسفار الوسيط للخلايا باستخدام الخيار الإحصاءات. تعيين هذه المعلمات باستخدام عينة واحدة وتطبق على جميع العينات.
4-القيام بامتصاص السوائل وقت-الدورات
- قم بإعداد الخلايا كما هو الحال في الفرع 3، مع ثلاثة آبار لكل نقطة الوقت وإجهاد/الشرط.
- إضافة ديكستران توسم المتوسطة إلى الآبار المختلفة تسلسلياً. دورة وقت نموذجي يقيس امتصاص السوائل في 0، 30، 60، 90، 120 و 180 دقيقة إضافة المتوسطة المحتوية على ديكستران للآبار نقطة الوقت 180 دقيقة، أعقبتها 60 دقيقة بعد إضافته إلى الآبار لنقطة الوقت 120 دقيقة، إلخ (الشكل 3A).
- 0 دقيقة، تضاف 50 ميكروليتر المحتوية على ديكستران المتوسطة وصب فورا وغسل اللوحة كما هو الحال في القسم 3.3. تحليل كما هو موضح في القسم 3.5.
5-جرعة منحنيات الاستجابة
- إعداد الخلايا كما هو موضح في القسم 3، مع ثلاثة آبار لكل سلالة والشرط.
- تمييع مجمع الفائدة إلى المتوسطة التي تحتوي على 1 ملغ/مل ديكستران في ضعف التركيز النهائي المطلوب الأقصى في المجمع. إعداد أنبوب ثان يتضمن المتوسطة مع ديكستران مع نفس نسبة المركبات كالأول. دوامة المزيج.
- إنشاء سلسلة تمييع لمجمع الفائدة في 200 ميكروليتر ديكستران تحتوي على متوسط كل عينة (الشكل 4 أ). دوامة المزيج. إضافة 50 ميكروليتر من المتوسط لكل نموذج جيد ح 1.
- أغسل وتحليلها كما هو موضح في القسم 3.3 فصاعدا.
6-البلعمه، وامتصاص الغشاء
- لقياس امتصاص الغشاء، إعداد الخلايا كما هو موضح في القسم 3. إضافة 50 ميكروليتر من المتوسط الذي يحتوي على 20 ميكرو FM 1-43 لتركيز نهائي 10 ميكرومترات. بعد التحميل وغسل وإعداد الخلايا للتدفق الخلوي كما هو الحال في القسم 3.3. قياس في القناة 585 نانومتر أو ما شابه، باستخدام ليزر أزرق لإثارة.
ملاحظة: كالاتجار بغشاء أكثر سرعة من مرحلة السائل، 10 دقيقة نقطة وقت أكثر ملاءمة استخدام أكثر من 1 ح26. ويمكن استخدام الأصباغ البديلة التي فلوريس فقط عندما أدرجت في الغشاء بدلاً من ذلك. -
استخدام الخرز المسمى فلوريسسينتلي أو البكتيريا لقياس البلعمه. لا يمكن استخدام الخميرة الفلورسنت، كما أنها جزء لا يتجزأ من ديكتيوستيليوم من الأمام والجانب مبعثر24. إعداد الخلايا كما هو موضح في القسم 3 وتحليلها ك وصف27.
- لقياس إضافة البلعمه خرز الأصفر والأخضر المسمى الخرز كما هو موضح في المقطع 3.2 إلى تركيز نهائي من 5 × 107 حبات مليلتر (1.75 و 2 ميكرومتر) أو 1 × 108 حبات مليلتر (1 و 1.5 ميكرومتر) ح 1 قبل الغسيل والتحضير للتدفق الخلوي كما في قسم 3.3. قياس في القناة شمال البحر الأبيض المتوسط 525 أو ما شابه، باستخدام ليزر أزرق لإثارة.
ملاحظة: سيؤدي تركيزات أعلى إلى مفرزة الخلية. - لقياس البلعمه البكتيريا، إضافة تكساس الأحمر المسمى بيوبارتيكليس الإشريكيّة القولونية كما هو موضح في المقطع 3.2 إلى 1 x 108 البكتيريا/مليلتر بالنسبة ح 1 قبل الغسيل والتحضير للتدفق الخلوي كما هو الحال في القسم 3.3. قياس في القناة 610 نيوتن متر أو ما شابه، باستخدام ليزر الأصفر والأخضر لإثارة.
- لقياس إضافة البلعمه خرز الأصفر والأخضر المسمى الخرز كما هو موضح في المقطع 3.2 إلى تركيز نهائي من 5 × 107 حبات مليلتر (1.75 و 2 ميكرومتر) أو 1 × 108 حبات مليلتر (1 و 1.5 ميكرومتر) ح 1 قبل الغسيل والتحضير للتدفق الخلوي كما في قسم 3.3. قياس في القناة شمال البحر الأبيض المتوسط 525 أو ما شابه، باستخدام ليزر أزرق لإثارة.
النتائج
مجرد التقنية قد أنجز وخلايا محملة ديكستران وجاهزة للتحليل (الشكل 1)، ضمان cytometer التدفق غير محظور وضبط التشكيل الجانبي مبعثر مبعثر/الجانب الأمامي لتبدو وكأنها الخلايا هو مبين في الشكل 2 ألف. إذا تم حظر الجهاز، سوف تبدو أكثر مثل ما هو مبين في الشكل 2 (ب) ويجب أن تكون ممنوعة قبل المتابعة. كفالة المعلمات إظهار عنصر التحكم أكسينيك الخلايا يكون الفلورية العالية ديكستران المدخلة في نقاط زمنية أطول وانخفاض الأسفار المدخلة في أقصر منها (الشكل 2).
عندما تبحث عن الاختلافات بين طفرات، فمن المحتمل أنه سوف يكون هناك واحد من ثلاثة تعمل. طفرات يمكن أن يكون امتصاص السوائل العادية، يمكن أن يكون عيب في جزئية، أو امتصاص السوائل ويمكن إلغاؤها تماما. ويبين الشكل 2D سلالة مع امتصاص السوائل العادية، في هذه الحالة سلالة المختبر القياسية Ax2، متحولة مع ~ 50% انخفاض في امتصاص السوائل (Ax2 راسج-14) وواحدة مع إلغاء امتصاص السوائل (Ax3 جيفب-28). الحصول على امتصاص السوائل متوسط متوسط (قسم 3.5) واستخدامها لحساب حجم السائل مستوعبة (كما هو الحال في الشكل 3) أو مقارنة البيانات إلى عنصر تحكم (كما هو الحال في الشكل 4 باء و 4 ج).
عند أداء دورة وقت امتصاص السوائل، كما هو الحال في الشكل 3 ألف، ينبغي زيادة الأسفار المدخلة ل 60 – 90 دقيقة، بعدها يبدأ ديكستران يكون اكسوسيتوسيد وهو التوصل إلى هضبة (الشكل 3B). استخدام 60 دقيقة كنقطة الوقت القياسي عندما تسمح مقارنة ماكروبينوسيتوسيس في طفرات/ظروف مختلفة ولذلك إشارة جيدة أن يتحقق، ولا توجد إشارة فقدت بسبب الرقابة. طفرات حيث يتم عرقلة الرقابة شديدة قد يستغرق وقتاً أطول للوصول إلى هضبة29.
عند معالجة الخلايا مع مثبطات فعالة ضد ماكروبينوسيتوسيس في ديكتيوستيليوم (إعداد كما هو الحال في الشكل 4A)، ديكستران المنضوية في ح 1 سوف تذهب وصولاً إلى لا شيء تقريبا على أعلى تركيزات مثبط في معظم الحالات (الشكل 4 باء). قد لا تكون بعض مثبطات 100% فعالة، بيد مثل نوكودازولي يمنع فقط تصل إلى 50% لامتصاص السوائل التي ماكروبينوسيتوسيس عند إضافة حادة (الشكل 4). إذا لم تكن فعالة مثبطات، الخلايا سيتم استيعاب كمية مماثلة من ديكستران كعنصر التحكم، ولن ينظر انخفاض في الأسفار. يسمح هذا الأسلوب طائفة كبيرة من الموانع المختلفة، وتركيزات مثبط يكون صاحبها للآثار على امتصاص السوائل ماكروبينوسيتوسيس بسرعة كبيرة، تقليل الوقت الذي يقضيه في تحسين علاج مثبط.
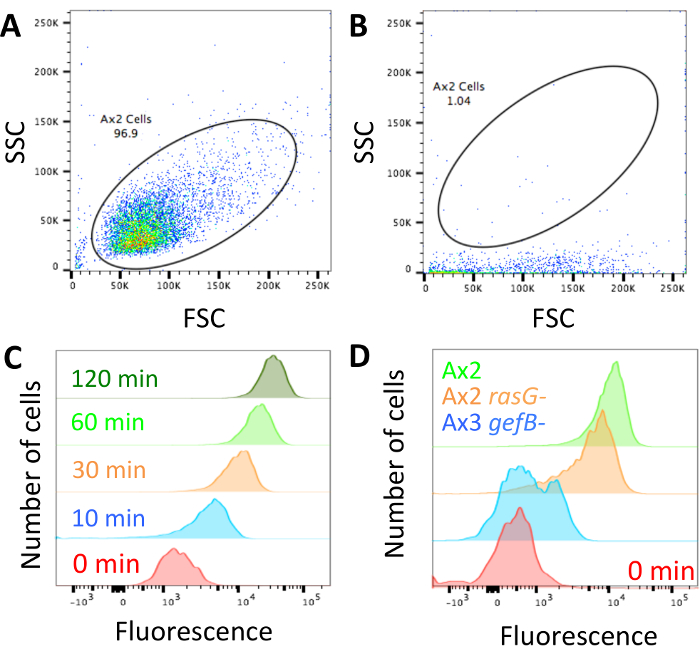
رقم 2: إعداد تدفق البيانات سيتوميتير والممثل. (أ) يجب تعيين الأمام مبعثر (FSC) والجانب مبعثر (SSC) لمحات من الخلايا حيث يمكن بسهولة تمييز الخلايا. يظهر مثال عن كيفية ظهور الخلايا Ax2. (ب) إذا تم حظر cytometer التدفق، كما في هذا المثال، يكون الخلايا مبعثر الجانب منخفضة جداً. الليزر سوف لا تثير في فلوروفوريس بشكل صحيح، وينبغي أن يكون الجهاز غير المحظورة قبل المتابعة. يجب أن يتم تجاهل أية بيانات تم الحصول عليها في حين تم حظره بالجهاز. (ج) الأسفار يجب تعيين حيث يحتوي نموذج امتصاص 0 دقيقة الفلورية منخفضة، مما يزيد عند الخلايا قد تم المحتضنة لأطول في الأجل المتوسط الفلورسنت، كما هو موضح في هذا المثال مأخوذ من ويليامز & كاي 201824. (د) أمثلة للخلايا التي قد تم المحتضنة مع ديكستران تريتك ح 1 مع ماكروبينوسيتوسيس العادي (Ax2، الخضراء)، لتخفيض ماكروبينوسيتوسيس (Ax2 راسج-HM172614، البرتقالي) وإلغاء ماكروبينوسيتوسيس (Ax3 جيفب-، HM177628, الأزرق). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
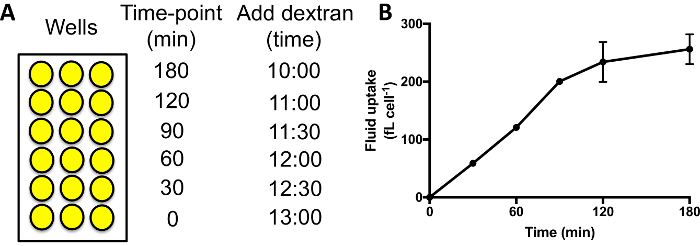
الشكل 3: أداء امتصاص السوائل وقت-دورات في لوحات 96-جيدا. (أ) ديكستران ينبغي أن تضاف إلى كل مجموعة من عينات تسلسلياً، مع نفس وقت الانتهاء. ثم تغسل الآبار وفصل وقياس fluorescence المدخلة بالتدفق الخلوي. يتم عرض مثال مرات إضافة ديكستران هنا. (ب) أداء امتصاص السوائل وقت دورة الخلايا Ax2 في لوحات 96-جيدا. مأخوذة من ويليامز & كاي 201824، تظهر أشرطة الخطأ الخطأ القياسي لثلاث تجارب مستقلة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 4: منحنيات الاستجابة جرعة امتصاص السوائل. (أ) إضافة مجمع الفائدة، في هذه القضية PI3K المانع LY294002، إلى HL5 التي تحتوي على 1 ملغ/مل تريتك-ديكستران في مضاعفة التركيز الأقصى النهائية المرجوة. مزيج مع متوسط النمو HL5 + 1 ملغ/مل ديكستران المحتوية على المركبات وحدها بنسب مختلفة لتوليد سلسلة تخفيف من 200 ميليلتر المتوسطة كل حالة. إضافة إلى الآبار كالمعتاد ح 1 قبل الغسيل وقياس fluorescence المدخلة. (ب) منحنى استجابة جرعة امتصاص السوائل للخلايا Ax2 المحتضنة مع المتوسطة المحتوية على LY294002 من أ. مقتبس من ويليامز & 2018 كاي24. هو تطبيع امتصاص السوائل إلى عنصر تحكم غير معالجة. وتظهر أشرطة الخطأ الخطأ القياسي لثلاث تجارب مستقلة. (ج) امتصاص السوائل جرعة منحنى استجابة للخلايا Ax2 المحتضنة مع نوكودازولي. مقتبس من ويليامز & 2018 كاي24. هو تطبيع امتصاص السوائل إلى عنصر تحكم غير معالجة. وتظهر أشرطة الخطأ الخطأ القياسي لثلاث تجارب مستقلة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
بينما أساليب أخرى لتقدير امتصاص السوائل منخفضة الإنتاجية، غسل الخلايا في الموقع ، واستخدام أزيد الصوديوم لفصل الخلايا هي الخطوات الحاسمة في هذا الأسلوب، والتي تسمح بقياس الإنتاجية العالية من ماكروبينوسيتوسيس، امتصاص الغشاء، أو البلعمه من ديكتيوستيليوم. كما يتم إرفاق الخلايا إلى سطح وليس المتوسط، يمكن غادر تعلق بينما المتوسط حولهم هو أولاً خلعت وثم تغيرت بالانغماس في المخزن المؤقت وخلعت مرة أخرى. أزيد الصوديوم، مما يستنزف ATP الخلوي و الغشاء30ديبولاريزيس، ثم يستخدم لفصل الخلايا، وأيضا يمنع الرقابة دون التأثير على الخلية صلاحية24.
بينما استخدام التدفق الخلوي لقياس ماكروبينوسيتوسيس من ديكتيوستيليوم يعطي مقياسا دقيقا جداً لامتصاص السوائل بسرعة كبيرة، تحديد السبب لماذا غيرت سلالة معينة أو شرط امتصاص السوائل، زيادة استخدام التحقيق المجهر هو المطلوب24. كما تجدر أن أظهرت النتائج المنشورة سابقا، في بعض الحالات، فرقا في امتصاص السوائل من سلالات متحولة نمت أما على سطح (كما هو الحال في هذه الحالة)، أو في الهز تعليق (كما هو الحال في بروتوكول قياسي)31. باستخدام هذا الأسلوب قد يعني أنه، في حالات نادرة، هي غاب العيوب الواضحة امتصاص السوائل. بالإضافة إلى ذلك، عند قياس البلعمه، يمكن أن تستخدم فقط بتركيزات منخفضة من الجسيمات. الحد الأقصى لمعدل البلعمه التي يمكن تحديدها مع هذا الأسلوب أقل بكثير من الحد الأقصى الحقيقية، على الرغم من أنه لا يزال من الممكن قياس الاختلافات ذات الصلة بين السلالات وظروف24في البلعمه. لتحديد الحد الأقصى لمعدل البلعمه، يجب أن يقاس امتصاص في الهز تعليق ب بروتوكول بديلة27. الخلايا التي قد فاجوسيتوسيد الخرز زادت مبعثر الجانب، حيث ينبغي تصحيح هذا لبناء على ذلك عند إعداد cytometer التدفق.
يمكن استخدام التدفق الخلوي لقياس امتصاص السوائل في خلايا الثدييات32، لكن نسبة أعلى من السوائل المرحلة الإقبال بمسارات أخرى اندوسيتيك من ينظر في ديكتيوستيليوم مصدر قلق. وبالإضافة إلى ذلك، يتم فصل الخلايا عادة استخدام التربسين في 37 درجة مئوية، مما يتيح مواصلة التقدم اندوسيتيك من ديكستران المدخلة. أزيد الصوديوم المثلج لا تسبب الضامة لفصل من سطح (ويليامز، والمراقبة غير منشورة)، مما يجعل هذا الأسلوب لا ينطبق على خلايا الثدييات دون مزيد من التحسين.
قياس الإنتاجية العالية من ماكروبينوسيتوسيس لديه القدرة على استخدامها على الشاشة بسرعة وبتكاليف زهيدة لتأثيرات مثبطات، والطفرات الوراثية أو الجينات ضربة قاضية على الخلايا ديكتيوستيليوم . وينبغي دائماً مقارنة طفرات للوالدين المباشر فقط. إذا كان القارئ ليس لديه تفضيل مسبق لسلالة ديكتيوستيليوم ، سلالات غير أكسينيك مثل DdB أو NC4 أكثر "البرية من نوع" من تلك التي أكسينيك ويمكن معالجته فعالية كسلالات أكسينيك33. وإلا فهي سلالات Ax2 أكسينيك سلالات مع أقل عدد الجينوم الازدواجية34، في حين أن العديد من سلالات Ax4 تالين بالضربة القاضية وينبغي أن تكون تجنبها إذا أمكن23. يمكن طلب معظم سلالات المنشورة سابقا من مركز الأسهم ديكتي35.
هذا الأسلوب يتيح إمكانيات التحقيق أكبر مما كان ممكناً في السابق إلى آثار الظروف المختلفة، ومثبطات والطفرات في ماكروبينوسيتوسيس من ديكتيوستيليوم.
Disclosures
الكتاب قد لا يوجد تضارب في الكشف عن.
Acknowledgements
ونحن نشكر "مجلس البحوث الطبية" المملكة المتحدة للتمويل (U105115237) إلى ررك الأساسي.
Materials
| Name | Company | Catalog Number | Comments |
| LSR_II flow cytometer | BD Biosciences | - | Other Flow cytometers can also do this role, e.g. the LSRFortessa by BD |
| TRITC-dextran (155 kDa) | Sigma-Aldrich | T1287 | Other non-quenchable dextrans, and other sizes are also fine |
| HL5 medium | Formedium | HLGCFG | |
| 96-well tissue culture plate | Corning | 3596 | Any flat-bottom tissue culture treated 96-well plate will work |
| Dihydrostreptomycin sulfate | Sigma-Aldrich | PHR1517 | |
| Ampicillin sodium | Formdium | AMP50 | |
| Kanamycin monosulfate | Sigma-Aldrich | 60615 | |
| Sodium azide | VWR | 103694M | |
| Magnesium sulfate hydrate | VWR | 25169.295 | |
| Calcium chloride dihydrate | VWR | 1.02382.0250 | |
| Potassium dihydrogen phopshate | VWR | 1.04877.1000 | |
| Di-potassium hydrogen phosphate | VWR | 1.05104.1000 | |
| Fluorimeter | Perkin-Elmer | LS 50 B | |
| FM1-43 | Thermofisher | T35356 | |
| Fluoresbrite YG-carboxy microspheres 1.00 µm | Polysciences | 15702-10 | |
| Fluoresbrite YG-carboxy microspheres 1.50 µm | Polysciences | 09719-10 | |
| Fluoresbrite YG-carboxy microspheres 1.75 µm | Polysciences | 17687-5 | |
| Fluoresbrite YG-carboxy microspheres 2.00 µm | Polysciences | 09847-5 | |
| Texas Red E. coli bioparticles | Thermofisher | E2863 | |
| Flow-set fluorospheres | Beckman Coulter | 6607007 | Calibration Beads |
| SM agar | Formedium | SMACFG | |
| 0.22 µm syringe filter | Elkay Laboratory Products | E25-PS22-50S | |
| 10 mL Syringe | Becton Dickinson | 302188 | |
| Round-bottom polystyrene tubes | Corning | 352058 | Use a tube that will fit onto your flow cytometer. |
| 70 µm cell strainer | Falcon | 352350 | |
| 50 mL centrifuge tube | Sarstedt | 62.547.004 | |
| Repeating pipette | Eppendorf | M4-SK | |
| 5 mL repeating pipette tips | Eppendorf | 30089650 | |
| DMSO | Sigma-Aldrich | D2650-100ML | |
| LY294002 | Cayman Chemical Company | 70920 | |
| Nocodazole | Sigma-Aldrich | M1404-2MG |
References
- Bloomfield, G., Kay, R. R. Uses and abuses of macropinocytosis. Journal of Cell Science. 129 (14), 2697-2705 (2016).
- Sallusto, F., Cella, M., Danieli, C., Lanzavecchia, A. Dendritic cells use macropinocytosis and the mannose receptor to concentrate macromolecules in the major histocompatibility complex class II compartment: downregulation by cytokines and bacterial products. Journal of Experimental Medicine. 182 (2), 389-400 (1995).
- Hardt, W. D., Chen, L. M., Schuebel, K. E., Bustelo, X. R., Galan, J. E. S. typhimurium encodes an activator of Rho GTPases that induces membrane ruffling and nuclear responses in host cells. Cell. 93 (5), 815-826 (1998).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Munch, C., O'Brien, J., Bertolotti, A. Prion-like propagation of mutant superoxide dismutase-1 misfolding in neuronal cells. Proceedings of the National Academy of Sciences of the United States of America. 108 (9), 3548-3553 (2011).
- Hacker, U., Albrecht, R., Maniak, M. Fluid-phase uptake by macropinocytosis in Dictyostelium. Journal of Cell Science. 110, 105-112 (1997).
- Dowrick, P., Kenworthy, P., McCann, B., Warn, R. Circular ruffle formation and closure lead to macropinocytosis in hepatocyte growth factor/scatter factor-treated cells. European Journal of Cell Biology. 61 (1), 44-53 (1993).
- Buczynski, G., et al. Inactivation of two Dictyostelium discoideum genes, DdPIK1 and DdPIK2, encoding proteins related to mammalian phosphatidylinositide 3-kinases, results in defects in endocytosis, lysosome to postlysosome transport, and actin cytoskeleton organization. Journal of Cell Biology. 136, 1271-1286 (1997).
- Araki, N., Johnson, M. T., Swanson, J. A. A role for phosphoinositide 3-kinase in the completion of macropinocytosis and phagocytosis by macrophages. Journal of Cell Biology. 135 (5), 1249-1260 (1996).
- Araki, N., Egami, Y., Watanabe, Y., Hatae, T. Phosphoinositide metabolism during membrane ruffling and macropinosome formation in EGF-stimulated A431 cells. Experimental Cell Research. 313 (7), 1496-1507 (2007).
- Clark, J., et al. Dictyostelium uses ether-linked inositol phospholipids for intracellular signalling. The EMBO Journal. 33 (19), 2188-2200 (2014).
- Hoeller, O., et al. Two distinct functions for PI3-kinases in macropinocytosis. Journal of Cell Science. 126, 4296-4307 (2013).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Veltman, D. M., et al. A plasma membrane template for macropinocytic cups. Elife. 5, e20085(2016).
- West, M. A., Prescott, A. R., Eskelinen, E. L., Ridley, A. J., Watts, C. Rac is required for constitutive macropinocytosis by dendritic cells but does not control its downregulation. Current Biology. 10 (14), 839-848 (2000).
- West, M. A., Bretscher, M. S., Watts, C. Distinct endocytotic pathways in epidermal growth factor-stimulated human carcinoma A431 cells. Journal of Cell Biology. 109, 2731-2739 (1989).
- Canton, J., et al. Calcium-sensing receptors signal constitutive macropinocytosis and facilitate the uptake of NOD2 ligands in macrophages. Nature Communications. 7, 11284(2016).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Clarke, M., Kohler, J., Heuser, J., Gerisch, G. Endosome fusion and microtubule-based dynamics in the early endocytic pathway of Dictyostelium. Traffic. 3, 791-800 (2002).
- Pacitto, R., Gaeta, I., Swanson, J. A., Yoshida, S. CXCL12-induced macropinocytosis modulates two distinct pathways to activate mTORC1 in macrophages. Journal of Leukocyte Biology. 101 (3), 683-692 (2017).
- Rivero, F., Maniak, M. Quantitative and microscopic methods for studying the endocytic pathway. Methods in Molecular Biology. , 423-438 (2006).
- Bacon, R. A., Cohen, C. J., Lewin, D. A., Mellman, I. Dictyostelium discoideum mutants with temperature-sensitive defects in endocytosis. Journal of Cell Biology. 127, 387-399 (1994).
- Basu, S., Fey, P., Jimenez-Morales, D., Dodson, R. J., Chisholm, R. L. dictyBase 2015: Expanding data and annotations in a new software environment. Genesis. 53 (8), 523-534 (2015).
- Williams, T. D., Kay, R. R. The physiological regulation of macropinocytosis during Dictyostelium growth and development. Journal of Cell Science. 131 (6), (2018).
- Tsujioka, M., et al. Overlapping functions of the two talin homologues in Dictyostelium. Eukaryotic Cell. 7 (5), 906-916 (2008).
- Aguado-Velasco, C., Bretscher, M. S. Circulation of the plasma membrane in Dictyostelium. Molecular Biology of the Cell. 10, 4419-4427 (1999).
- Sattler, N., Monroy, R., Soldati, T. Quantitative analysis of phagocytosis and phagosome maturation. Methods in Molecular Biology. 983, 383-402 (2013).
- Wilkins, A., Chubb, J., Insall, R. H. A novel Dictyostelium RasGEF is required for normal endocytosis, cell motility and multicellular development. Current Biology. 10, 1427-1437 (2000).
- Thomason, P. A., King, J. S., Insall, R. H. Mroh1, a lysosomal regulator localized by WASH-generated actin. Journal of Cell Science. 130 (10), 1785-1795 (2017).
- van Duijn, B., Vogelzang, S. A., Ypey, D. L., van der Molen, L. G., van Haastert, P. J. M. Normal chemotaxis in Dictyostelium discoideum cells with a depolarized plasma membrane potential. Journal of Cell Science. 95, 177-183 (1990).
- Novak, K. D., Peterson, M. D., Reedy, M. C., Titus, M. A. Dictyostelium myosin I double mutants exhibit conditional defects in pinocytosis. Journal of Cell Biology. 131, 1205-1221 (1995).
- Mercer, J., Helenius, A. Vaccinia virus uses macropinocytosis and apoptotic mimicry to enter host cells. Science. 320 (5875), 531-535 (2008).
- Paschke, P., et al. Rapid and efficient genetic engineering of both wild type and axenic strains of Dictyostelium discoideum. PLoS One. 13 (5), e0196809(2018).
- Bloomfield, G., Tanaka, Y., Skelton, J., Ivens, A., Kay, R. R. Widespread duplications in the genomes of laboratory stocks of Dictyostelium discoideum. Genome Biology. 9 (4), R75(2008).
- Fey, P., Dodson, R. J., Basu, S., Chisholm, R. L. One stop shop for everything Dictyostelium: dictyBase and the Dicty Stock Center in 2012. Methods in Molecular Biology. 983, 59-92 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved