A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التصوير في الوقت الحقيقي والتحديد الكمي للتنمية بيوفيلم الفطرية باستخدام نظام تدفق دائرية ذات مرحلتين
In This Article
Summary
يصف لنا الجمعية العامة، عملية، وتنظيف جهاز تدفق تهدف إلى تكوين بيوفيلم الفطرية الصور في الوقت الحقيقي في حين ظل تدفق. ونحن أيضا تقديم ومناقشة خوارزميات الكمية المراد استخدامه على الصور المكتسبة.
Abstract
في داء المبيضات المكنسية، يجب التقيد بأعضاء جنس المبيضات وتنمو على سطح الغشاء المخاطي الشفوي في حين ظل آثار تدفق اللعاب. بينما تم تطوير نماذج للنمو في ظل تدفق، العديد من هذه النظم غالية الثمن، أو عدم السماح بالتصوير في حين الخلايا قيد التدفق. قمنا بتطوير جهاز رواية التي تسمح لنا بصورة نمو وتطور الخلايا المبيضات البيض في ظل تدفق وفي الوقت الحقيقي. هنا، نحن تفاصيل البروتوكول للجمعية واستخدام هذا الجهاز التدفق، فضلا عن التحديد الكمي للبيانات التي يتم إنشاؤها. نحن قادرون على تحديد المعدلات التي نعلق على الخلايا، وفصل من الشريحة، فضلا عن تحديد مقياس للكتلة الأحيائية على الشريحة مع مرور الوقت. هذا النظام اقتصادا وتنوعاً، وتعمل مع العديد من أنواع المجاهر الخفيفة، بما فيها مجاهر benchtop غير مكلفة، على حد سواء، وقادر على تمديد التصوير مرات مقارنة بغيرها من نظم تدفق. عموما، هذا هو نظام منخفضة الإنتاجية التي يمكن أن توفر معلومات مفصلة للغاية في الوقت الحقيقي على نمو بيوفيلم الأنواع الفطرية تحت التدفق.
Introduction
المبيضات البيض (المبيضة) هو الممرضات فطرية انتهازية من البشر التي يمكن أن تصيب العديد من أنواع الأنسجة، بما في ذلك الأسطح المخاطية الفموية وتسبب داء المبيضات المكنسية ونتج عنه انخفاض نوعية حياة للأفراد المتضررين1. تشكيل بيوفيلم سمة هامة للآلية المرضية المبيضة، وقد أجريت دراسات عديدة على تكوين ووظيفة المبيضة الأغشية الحيوية2،،من34، 5، أجريت الكثير منها ثابت (لا التدفق) في المختبر باستخدام النماذج. ومع ذلك، المبيضة يجب التقيد وتنمو حضور تدفق اللعاب في تجويف الفم. وقد وضعت العديد من نظم تدفق للسماح لخلية يعيش التصوير6،،من78،9،10. وقد صممت هذه الأنظمة تدفق مختلفة لأغراض مختلفة، وذلك كل نظام مختلف نقاط القوة والضعف. وجدنا أن العديد من تدفق النظم الملائمة المبيضة كانت مكلفة، المعقدة المطلوبة ملفقة أجزاء، أو يمكن عدم تصويرها أثناء تدفق وكان أن توقفت قبل التصوير. ولذلك، قمنا بتطوير جهاز تدفق رواية لدراسة المبيضة بيوفيلم تشكيل إطار تدفق11. أثناء تصميم جهازنا التدفق، تابعنا هذه الاعتبارات الرئيسية. أولاً، أننا نريد أن تكون قادرة على قياس جوانب متعددة من بيوفيلم النمو والتنمية في الوقت الحقيقي دون الحاجة إلى استخدام خلايا الفلورسنت (مما يسمح لنا لدراسة سلالات متحولة ويعزل السريرية غير معدلة بسهولة). ثانيا، كنا نريد جميع أجزاء لتكون متاحة تجارياً مع قليل من لا تعديلات (أي.، لا تلفيق مخصصة)، والسماح للآخرين بأكثر بسهولة إعادة إنشاء نظامنا، والسماح للتصليح سهلة. ثالثا، أردنا أيضا للسماح بتمديد التصوير مرات في معدلات التدفق مرتفعة بشكل معقول. وأخيراً، أردنا، بعد فترة من الخلايا إرفاق الركيزة تحت التدفق، لتكون قادرة على رصد النمو بيوفيلم على مدى فترة طويلة دون إدخال خلايا جديدة.
هذه الاعتبارات أدت بنا إلى تطوير نظام تدفق تدوير قارورة اثنين هو موضح في الشكل 1. قوارير اثنين تسمح لنا بتقسيم هذه التجربة إلى مرحلتين، مرحلة مرفق يستمد من قارورة مرفق المصنف الخلية، ومرحلة نمو التي تستخدم وسائل الإعلام الحرة خلية على مواصلة نمو بيوفيلم دون إضافة خلايا جديدة. صمم هذا النظام للعمل مع غرفة حضانة للمجهر، مع الشريحة والأنابيب السابقة لها (2 إلى 5، الشكل 1) يتم وضعها داخل الحاضنة، وتوضع جميع المكونات الأخرى في حاوية كبيرة ثانوي خارج المجهر. بالإضافة إلى ذلك، يتم استخدام محرض هوتبلت مع مسبار درجة حرارة مرفقة الحفاظ على الخلايا الفطرية في قارورة المرفقات عند 37 درجة مئوية. كما أنه يتم تعميم، هذا النظام قادر على تصوير مستمر أثناء تدفق (يمكن أن يكون أكثر من 36 ح تبعاً للظروف)، ويمكن استخدامها على المجاهر الأكثر القياسية، بما في ذلك مجاهر benchtop رأسي أو مقلوب. هنا، نحن مناقشة الجمعية العامة، عملية، وتنظيف جهاز تدفق، كذلك كما تقدم بعض الخوارزميات ImageJ الكمية الأساسية لتحليل أشرطة الفيديو بعد تجربة.
Protocol
1-تجميع جهاز تدفق
- تكوين أجزاء مدرجة في الجدول للمواد حسب التخطيطي في الشكل 1 مع الاعتبارات التي نوقشت أدناه.
ملاحظة: لمزيد من الراحة، الجانب تدفق الأجهزة ينقسم إلى الجانبين، الجانب الأخضر (كل شيء المنبع الشريحة إلى قوارير وسائل الإعلام)، والبرتقال (كل شيء المصب الشريحة إلى قوارير وسائط الإعلام).- التأكد من أن كل جهاز تدفق الهواء ضيقة لمنع تسرب، مع استثناء وحيد هو قوارير وسائط الإعلام (الشكل 1، 1). ولتحقيق ذلك، تطبيق السباكين الشريط إلى أي خيوط الذكور قبل تجميع باستثناء يستمتع نبض (PD) وزجاجة التصفية ميكرومتر 2 (إف ب)، التي لا تتطلب السباكين الشريط كما حشايا المطاط إبقائهم محكم.
- ينطبق الإذن المشابك في كل مناسبة الشائكة التي تحت ضغط إيجابي أثناء التشغيل العادي (أي، المصب مضخة).
- استخدام لون ترميز الأشرطة مختبر لتسمية المواقع صمام مع A أو G (للحجز والنمو، على التوالي)، موقع المضخة ومواقع اتصال الشريحة والاتصال فلتر 0.2 ميكرون.
- تحديد طول الأنابيب التي يمكن استخدامها استناداً إلى المسافة بين نظام التدفق والمجهر، مع الأخذ في الاعتبار أن كل جهاز تدفق المصب مضخة لقوارير (أغلبية الجانب البرتقالي) ينبغي في احتواء الثانوية. إضافة مسافة 1 متر من أنابيب إضافية المنبع للشريحة (ويفضل أن يكون ذلك في فخ فقاعة) مكان داخل قاعة حضانة المجهر، كما يضمن ذلك أن تكون جميع وسائل الإعلام الوصول إلى الشريحة في درجة الحرارة الصحيحة.
- مكان فخ فقاعة أقرب وقت ممكن معقول للشريحة، يفضل أن تكون داخل غرفة الحضانة خلال تجربة (فقاعات غالباً من النموذج على طول الجدار الأنابيب)؛ ومع ذلك، نضع في اعتبارنا أن يجب أن يكون متصلاً بفراغ العمل.
- تأكد من أن الأنبوب بين FB و 0.2 ميكرومتر تصفية المتاح حوالي 0.5 مترا.
- إضافة حوالي 2 سم إثارة المغناطيسية شريط لكل قارورة وسائط الإعلام.
- الحصول على بعض أشكال المشابك أنابيب بمثابة إغلاق الصمامات (يمكن استخدام هيموستاتس).
- لسهولة الاستخدام، إبقاء جهاز التدفق في سلة أوتوكلافابل. يمكن أن تكون مفيدة سلة أصغر ثانية في أكبر واحد للسماح بسهولة الفصل بين جانبي الأخضر والبرتقالي.
- لقارورة مرفق، استخدام قليلاً 4 مم، وحفر حفر فتحه إضافية في سداده مطاطية لاستيعاب المسبار الحراري (رعاية لا الذهاب من خلال ثقب آخر). للحصول على الأنابيب من خلال المنافذ، دفع الأنبوب عن طريق الملقط؛ مرة واحدة عن طريق المشبك الأنابيب إلى أنه عقد في مكان، ومن ثم سحب التراجع الملقط.
ملاحظة: إذا كان ليس من الممكن إضافة فتحه إضافية لسداده المطاط، قد تعمل زجاجة المسمار الفم واسعة مع سداده ملولبة الميناء أربعة بدلاً من سداده قارورة والمطاط.
- بمجرد تم تجميع نظام التدفق الكامل، إغلاق صمامات قوارير نمو الجانب الأخضر والبرتقالي على حد سواء. استخدام المياه مع أنابيب قارورة المرفق واسطوانة لمعايرة مضخة تمعجية وفقا لإرشادات الشركة المصنعة.
2-إجراء تجربة
- قبل التجربة، اليوم بدء التسخين الأولى قاعة حضانة المجهر إلى 37 درجة مئوية، وتعد ثقافة بين عشية وضحاها من سلالة فطرية (الأسفار غير مطلوب).
- جمع مكونات تستخدم مرة واحدة، ومضخة، ومجلس الوزراء بوضع في السلامة الأحيائية عقيمة.
- إزالة فخ فقاعة ودرجة الحرارة التحقيق من جهاز التدفق، ووضع هذه في مجلس الوزراء السلامة الأحيائية.
- ديتانجلي وتنظيم الأنابيب، إذا لزم الأمر.
- اﻷوتوكﻻف جهاز التدفق، بما في ذلك الحانات ضجة، لمدة 30 دقيقة التأكد من العقم؛ عند الانتهاء من نقل للسلامة الأحيائية مجلس الوزراء.
- نعلق في فخ فقاعة، ومسبار درجة الحرارة، وجميع مكونات تستخدم مرة واحدة (باستثناء الشريحة) كما هو مبين في الشكل 1.
- لفلتر 0.2 ميكرون (الشكل 1، 11)، إزالة المكبس من المحاقن 1 مل جعلها بمثابة "محول". قوة الأنبوب من إف إلى هذه الغاية، وإرفاق فلتر 0.2 ميكرون للأنبوب مما أدى إلى قارورة النمو.
- تطبيق الشحوم سيليكون فراغ حول بارب محول الشريحة (رعاية لا للحصول على أي الشحوم في الداخل) قبل الاتصال، كما أن هذا يساعد على منع تسرب الهواء في النظام.
- ملء قارورة مرفق مع 100 مل من استخراج الخميرة 1% (w/v)، ببتون 2% (w/v)، ونسبة 2% (w/v) الجلوكوز (YPD)، وملء قارورة النمو مع 200 مل YPD. التأكد من أن أنابيب الجانب الأخضر يصل إلى وسائل الإعلام في كل قارورة.
- التأكد من أن جميع الصمامات مفتوحة. نعلق في فخ فقاعة على فراغ، وتتصل المضخة الأنابيب الجانب الأخضر المصب من فخ فقاعة.
- ضخ السائل بمعدل تدفق 3.3 مل/دقيقة تماما ملء الجانب الأخضر، ثم الاستغناء عن وتجاهل حوالي 1 – 2 مل من وسائط الإعلام لأول زوجين من ملليلتر غالباً ما تحتوي على خلايا ميتة أو الحطام عشوائي. ضمان أن الجانب الأخضر الأنابيب مليء بوسائل الإعلام، ولا فقاعات المصب من فخ فقاعة قبل المتابعة.
- تعبئة الشريحة القناة والخزان مع YPD، مع الحرص على عدم إدخال فقاعات.
- قم بتوصيل الشريحة إلى جهاز التدفق، ومضخة أكثر مرونة لإنشاء مخزن مؤقت بحوالي 0.5 متر على الجانب البرتقالي. وهذا لمنع بطريق الخطأ الجوية الملائمة في الشريحة في حالة الدفق.
- إعداد جهاز تدفق للنقل بالمجهر: المشبك أغلقت مداخل ومخارج فخ فقاعة، والمشبك الأخضر والبرتقالي الجانب مرفق قارورة صمامات مغلقة. التأكد من وجود الأغطية اللولبية لشعبة المشتريات و FB ضيق كما أنها يمكن أن تخفف من خلال التعقيم.
- قطع المضخة من الأنابيب لتسهيل النقل. قم بنقل كافة المكونات، بما في ذلك محرض هوتبلت، في حاوية ثانوية قرب المجهر.
- إعداد جهاز تدفق للتصوير.
- إرفاق مسبار درجة الحرارة إلى محرض هوتبلت والبدء بتدفئة قارورة مرفق إلى 37 درجة مئوية. إثارة وسائل الإعلام 300 لفة في الدقيقة، والحفاظ على هذا للتجربة كلها.
- جبل الشريحة على المجهر، واستخدم الشريط إذا لزم الأمر لأحكام ضمان الحصول عليها.
- نعلق في فخ فقاعة على فراغ (لا تراجع المشبك حتى الآن).
- قم بتوصيل المضخة جهاز التدفق في الموقع المشار إليه في الشكل 1.
- بدء تشغيل المضخة بمعدل تدفق 3.3 مل/دقيقة والسماح بتشغيلها لحوالي 5-10 ق ثم إزالة المشبك مدخل/مخرج فخ فقاعة.
- السماح للمضخة لمواصلة تشغيل بينما يسخن قارورة مرفق. مرة واحدة وقد عممت وسائل الإعلام في جميع أنحاء النظام تدفق، تحقق للتشغيل العادي.
- التحقق من تجهيزات للهواء تسرب في المنبع مضخة (تشكيل فقاعة بعض أمر طبيعي)، أو السوائل التي تتسرب مجرى النهر.
- تحقق من قارورة وسائط النمو و PD FB جميع وسائل الإعلام نازف من أنبوب مدخل (إذا لم، قد يشير هذا إلى عامل تصفية انسداد، أو المشبك إذن أوفيرتايتينيد).
- استخدام المجهر، تحقق من الخلايا المرفقة أو المتداول على الشريحة القناة. عدد زائد من الخلايا قد يشير إلى التلوث أثناء الإعداد، أو أن الغشاء تترافلوروايثيلين (PTFE) فقاعة فخ يحتاج إلى استبدال.
- مرة واحدة وكلاهما قاعة مرفق قارورة والحضانة عند 37 درجة مئوية، إضافة كافية الثقافة بين عشية وضحاها من الخلايا الفطرية لقارورة مرفق تصل إلى 1 × 106 خلايا/مل.
ملاحظة: يمكن حساب حجم لإضافة في ميليلتر باستخدام هذه الصيغة: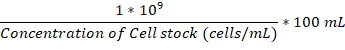
- انتظر 15 دقيقة للسماح للخلايا ليتأقلم.
- فتح صمامات قارورة مرفق الجانب الأخضر والبرتقالي على حد سواء أثناء إغلاق الصمامات قارورة النمو على حد سواء لبدء تدفق الخلايا.
- انتظر حوالي 5 دقائق للسماح بالوصول إلى الشريحة الخلايا، والسماح للتركيز الأولى المجهر (هذا الوقت قد تحتاج إلى تعديلها تبعاً لطول الأنابيب الجانب الأخضر). وخلال هذا الوقت، ضبط المجهر لنفس المعلمات التصوير المستخدمة في التجارب السابقة. إذا كان هذا هو أول تشغيل، اتبع الخطوات التالية:
- قم بالتبديل إلى هدف تضخم منخفض جوي.
- العثور على والتركيز على الخلايا المرفقة أو خلية صغيرة في مهدها.
- تكوين مكثف لإنارة كوهلر، ثم قم بالتبديل إلى الساحة المظلمة.
- تعيين وقت التعرض إلى 300 مرض التصلب العصبي المتعدد.
- ضبط شدة الإضاءة حتى خلية صغيرة هي قاتمة حتى الآن واضحة للعيان على خلفية (إشارة إلى خلفية نسبة حوالي 7 – 8 لخلية ابنه مهدها قيمة معقولة). ملاحظة/مارك كثافة منيرا للتجارب المقبلة.
- تكوين البرنامج للحصول على صورة كل 2 دقيقة بما يزيد على 2 ح.
- البدء في الحصول على الصور لمرحلة مرفق. التحقق مرة أخرى بعد ما يقرب من 5 و 10 دقيقة للتأكد من أن التركيز قد أبقى. أن لم يكن، في محاولة لضبط التركيز فورا بعد أن يتم الحصول على الصورة التالية.
- فورا بعد الانتهاء من مرحلة مرفق، قم بحفظ الملف، وثم فتح صمامات قارورة نمو الجانب الأخضر والبرتقالي على حد سواء أثناء إغلاق الصمامات قارورة كل مرفق. الحرص على عدم عثرة المرحلة إذا كان أي الصمامات داخل غرفة الحضانة.
- قم بإلغاء توصيل المجس الحرارة من محرض هوتبلت.
- إزالة قارورة مرفق من محرض هوتبلت وقارورة النمو في مكانها.
- تكوين البرنامج للحصول على صورة كل 15 دقيقة أكثر من 22 ح والبدء في الحصول على الصور لمرحلة النمو. إعادة التركيز يجب أن لا يكون ضروريا، ولكن يوصي بشدة للتحقق من جهاز تدفق بعد بضع ساعات.
- التحقق من تجهيزات للهواء تسرب في المنبع مضخة (مرة أخرى بعض تشكيل فقاعة أمر طبيعي)، أو السوائل التي تتسرب مجرى النهر
- الاختيار أن قارورة وسائط النمو و PD FB كلها تتساقط وسائط الإعلام (إذا لم، قد يشير هذا إلى عامل تصفية انسداد أو المشبك أوفيرتايتينيد إذن تسد في تركيب الشائكة إذا فلوككولاتي الخلايا المستخدمة).
- فحص مستوى السائل في إف. إذا كانت وسائط الإعلام يقترب من الجزء العلوي من الزجاجة (ما يزيد على 1.5 سم فوق الجزء العلوي من عامل التصفية)، تشديد كلا screwcaps (لا تخفف منها، كما هذا قارورة تحت الضغط). إذا أنها ستشدد ليس كذلك، مواصلة التجربة (على الرغم من أن هذا قد يؤدي إلى تسرب)، واستبدالها حشايا المطاط PD و FB بعد التنظيف القادم.
- عند الانتهاء من اقتناء مرحلة النمو، قم بحفظ الملف، ثم ثم افتح الصمامات قارورة مرفق الجانب الأخضر والبرتقالي مما قد يجعل من ضوضاء النشرات الضغط على الجانب البرتقالي. اسحب الأنبوب الجانب الأخضر القادمة من قوارير وسائل الإعلام على حد سواء حتى أنهم سنتيمتر على الأقل عدة أعلاه وسائط الإعلام. تشغيل المضخة بسرعة عالية (حوالي 100 مل/دقيقة أو اضغط على زر التقديم السريع على المضخة) لإزالة جميع وسائل الإعلام من الأنابيب، الأمر الذي يجعل عملية التنظيف أسهل بكثير. عندما تفرغ، قم بقطع اتصال جهاز تدفق من المضخة، وإزالته من المجهر.
3-تنظيف جهاز تدفق
- إزالة كافة المكونات غير أوتوكلافابل (مكونات تستخدم مرة واحدة وفخ فقاعة، ومسبار درجة الحرارة)، وتستخدم مكونات تستخدم مرة واحدة، مسبار نظيفة مع الإيثانول 70%، اﻷوتوكﻻف أجهزة تدفق 30 دقيقة تجاهل جانبا فخ فقاعة.
- بعد الانتهاء من التعقيم، تجاهل وسائل الإعلام، وشطف وجانبا قوارير وسائط الإعلام. ثم إعادة الاتصال في فخ فقاعة، الاتصال على شريحة قناة عبدي لاستخدامها للتنظيف (القابل لإعادة الاستخدام)، والاتصال نظام تدفق المضخة في الموقع هو موضح في الشكل 1.
- المشبك إغلاق صمام قارورة نمو الجانب البرتقالي.
- ضع حوالي 200 مل التبييض غير مخفف في كوب. ضع سدادات مطاطية في المبيض، ومن ثم بدء تشغيل المضخة بسرعة عالية تعميم التبييض في جميع أنحاء جهاز تدفق (باستثناء كافة عوامل التصفية). مرة واحدة مليئة بالتبييض، تتوقف المضخة لأنه ترك المضخة على بسرعة عالية ويمكن ارتداء وكسر الأنابيب.
- بعد التبييض لمدة 15 دقيقة، عقد سدادات مطاطية أعلاه الكأس وبدء تشغيل المضخة مرة أخرى لإزالة المبيض من جهاز التدفق.
- كرر الخطوات من 3-4 و 3.5 مرتين مع المياه الزائدة بدلاً من التبييض شطف نظام التدفق. خلال هذا الوقت، تنظيف مرشحات فقط مع المياه نظراً لعوامل التنظيف الأخرى سوف تتآكل أو تسد عوامل التصفية.
- ضع الأنبوب الذي سيربط عادة إلى تصفية وسائل الإعلام 0.2 ميكرون (قادمة من ميكرومتر 2 إف) في كوب الماء بسدادات مطاطية من الخطوة 3، 6.
- قطع الأنابيب المرفقة إلى المدخل للتصفية المضمنة 20 ميكرومتر، التي يمكن عادة سحب عن بعضها بسهولة على الرغم من المشبك الإذن.
- استخدام قارورة تصفية فراغ ومقطع طويل من الأنابيب من خلال سداده ثقب 3 قطع غيار لإنشاء نظام فراغ يمكن الاتصال بجهاز التدفق.
- توصيل هذا النظام الفراغ إلى مدخل مدخل تصفية 20 ميكرومتر، والبدء في الفراغ؛ وهذا سوف تسحب المياه من خلال المرشحات في الاتجاه العكسي وإزالة الخلايا الميتة.
- سحب على الأقل 200 مل من الماء من خلال مرشحات، ثم إزالة الأنبوب من الماء إلى إفراغ خطوط تصفية المياه.
- فصل نظام فراغ من عامل تصفية 20 ميكرومتر، وإعادة عامل التصفية الأنابيب العادية.
4-التحديد الكمي لأشرطة الفيديو
ملاحظة: جميع الملفات تحتاج إلى تحويلها إلى تنسيق الملف (TIF) صورة العلامة للعمل. بالإضافة إلى ذلك، مقارنة بين التجارب، من المهم اتخاذ جميع الصور بالمجهر نفسه ومعلمات التصوير، كما نوقش أعلاه.
- تنزيل وتثبيت إيماجيج إذا لم تكن بالفعل تثبيت.
- تحميل الملف الماكرو التكميلية، ووضعه في المجلد ImageJ\macros.
- تعديل الماكرو المتوفرة:
- فتح رصة صور من تجربة سابقة في إيماجيج، وحدد نقطة وقت مع الخلايا الحالية.
- حدد من القائمة عن طريق "صورة | نوع | 8-بت ".
- حدد من القائمة عن طريق "صورة | ضبط | عتبة ". حدد المربع "الخلفية المظلمة" . تعيين القائمة المنسدلة الجانب الأيمن إلى اللون الأحمر.
- ضبط القيمة الأدنى حتى يتم تغطية كافة الخلايا باللون الأحمر مع الحد الأدنى من الضجيج الزائد (بعض التنقيط غير الخلية على ما يرام وسيتم تجهيزها بواسطة الماكرو). جعل علما بقيمة أقل من هذا.
- قم بإغلاق الإطار العتبة وفتح الصورة.
- حدد من القائمة عن طريق "الإضافات | وحدات الماكرو | تحرير ". عندما تتم مطالبتك بفتح ملف: "تحريك لأعلى مستوى مجلد واحد"، ثم حدد المجلد وحدات الماكرو وفتح الملف الماكرو الكمي بيوفيلم التدفق.
- قم بتغيير القيمة 15 في كافة مثيلات "سيتثريشولد (15، 255)؛" إلى القيمة المحددة في الخطوة 4.3.4. قم بحفظ الملف وإغلاق هذا الإطار.
- حدد من القائمة عن طريق "الإضافات | وحدات الماكرو | تثبيت "وحدد ملف الكمي بيوفيلم التدفق.
- الآن، تحت "الإضافات | وحدات الماكرو " تظهر القائمة، ستة خيارات جديدة لمختلف كوانتيفيكيشنز الفيديو. تشغيل تحليل كامل وحدد ملفات الفيديو المرفق والنمو عند مطالبتك بإجراء جميع التحليلات المتاحة على البيانات المكتسبة وتلقائياً بإنشاء ملفات الإخراج.
النتائج
الممثل صور عادية بين عشية وضحاها الوقت الفاصل بين تجربة استخدام البرية من نوع المبيضة يمكن رؤية الخلايا عند 37 درجة مئوية في الشكل 2ألف و التكميلي فيديو 1. وقد الصور التباين المحسن لتحسين الرؤية. تم إجراء القياس الكمي للبيانات الأصلي...
Discussion
باستخدام نظام تدفق كما هو مبين أعلاه يسمح لتوليد كمية من أشرطة الفيديو الوقت الفاصل بين بيوفيلم الفطرية في النمو والتنمية. للسماح بإجراء مقارنات بين التجارب أنها ذات أهمية حاسمة لضمان بقاء المعلمات التصوير نفسه. وهذا يشمل ضمان أن يتم إعداد المجهر لإنارة كوهلر لكل تجربة (أدلة كثيرة على شبك...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
الكتاب يود أن ينوه الدكتور واد سيجوردسون لتقديم مساهمة قيمة في تصميم جهاز التدفق.
Materials
| Name | Company | Catalog Number | Comments |
| Pump | Cole Parmer | 07522-20 | 6 |
| Pump head | Cole Parmer | 77200-60 | 6 |
| Tubing | Cole Parmer | 96410-14 | N/A |
| Bubble trap adapter | Cole Parmer | 30704-84 | 3 |
| Bubble trap vacuum adapter for 1/4” ID vacuum line | Cole Parmer | 31500-55 | 3 |
| In-line filter adapter (4 needed) | Cole Parmer | 31209-40 | 8,9 |
| Orange-side Y | Cole Parmer | 31209-55 | 7 |
| Green-side Y | ibidi | 10827 | 2 |
| * Slides | ibidi | 80196 | 4 |
| * Slide luers | ibidi | 10802 | 4 |
| Vacuum assisted Bubble trap | Elveflow/Darwin microfluidics | KBTLarge - Microfluidic Bubble Trap Kit | 3 |
| Media flasks | Corning | 4980-500 | 1 |
| 0.2 µm air filter | Corning | 431229 | 1 |
| Threaded glass bottle for PD and filter flask (2 needed) | Corning | 1395-100 | 5,10 |
| Ported Screw cap for PD and filter flask (2 needed) | Wheaton | 1129750 | 5,10 |
| Screwcap tubing connector | Wheaton | 1129814 | 5,10 |
| Tubing connector beveled washer | Danco | 88579 | 5,10 |
| Tubing connector flat washer | Danco | 88569 | 5,10 |
| Clamps for in-line filters and downstream Y (7 needed) | Oetiker/MSC Industrial Supply Company | 15100002-100 | 7,8,9 |
| Clamp tool | Oetiker/MSC Industrial Supply Company | 14100386 | N/A |
| 20 μm in-line media filter | Analytical Scientific Instruments | 850-1331 | 8 |
| 10 μm in-line media filter | Analytical Scientific Instruments | 850-1333 | 9 |
| 2 μm inlet media filter | Supelco/Sigma-Aldrich | 58267 | 10 |
| * 0.22 µm media filter | Millipore | SVGV010RS | 11 |
| * 0.22 µm media filter “adapter” | BD Biosciences | 329654 | 11 |
| Rubber stopper | Fisher Scientific | 14-131E | 1 |
| Hotplate stirrer with external probe port | ThermoFisher Scientific | 88880006 | N/A |
| Temperature probe | ThermoFisher Scientific | 88880147 | N/A |
References
- Pankhurst, C. L. Candidiasis (oropharyngeal). BMJ clinical evidence. 2012, 1304 (2012).
- Ramage, G., Vandewalle, K., Wickes, B. L., López-Ribot, J. L. Characteristics of biofilm formation by Candida albicans. Revista iberoamericana de micología. 18 (4), 163-170 (2001).
- Nobile, C. J., Mitchell, A. P. Regulation of cell-surface genes and biofilm formation by the C. albicans transcription factor Bcr1p. Current biology: CB. 15 (12), 1150-1155 (2005).
- Blankenship, J. R., Mitchell, A. P. How to build a biofilm: a fungal perspective. Current opinion in microbiology. 9 (6), 588-594 (2006).
- Araújo, D., Henriques, M., Silva, S. Portrait of Candida Species Biofilm Regulatory Network Genes. Trends in microbiology. 25 (1), 62-75 (2017).
- Lane, W. O., et al. Parallel-plate flow chamber and continuous flow circuit to evaluate endothelial progenitor cells under laminar flow shear stress. Journal of visualized experiments. (59), e3349 (2012).
- Bakker, D. P., van der Plaats, A., Verkerke, G. J., Busscher, H. J., van der Mei, H. C. Comparison of velocity profiles for different flow chamber designs used in studies of microbial adhesion to surfaces. Applied and environmental microbiology. 69 (10), 6280-6287 (2003).
- Zhang, W., Sileika, T. S., Chen, C., Liu, Y., Lee, J., Packman, A. I. A novel planar flow cell for studies of biofilm heterogeneity and flow-biofilm interactions. Biotechnology and bioengineering. 108 (11), 2571-2582 (2011).
- Uppuluri, P., Lopez-Ribot, J. L. An easy and economical in vitro method for the formation of Candida albicans biofilms under continuous conditions of flow. Virulence. 1 (6), 483-487 (2010).
- Diaz, P. I., et al. Synergistic interaction between Candida albicans and commensal oral streptococci in a novel in vitro mucosal model. Infection and immunity. 80 (2), 620-632 (2012).
- McCall, A., Edgerton, M. Real-Time Approach to Flow Cell Imaging of Candida albicans Biofilm Development. Journal of fungi. 3 (1), 13 (2017).
- Zhang, B., Zerubia, J., Olivo-Marin, J. -. C. Gaussian approximations of fluorescence microscope point-spread function models. Applied optics. 46 (10), 1819-1829 (2007).
- Tati, S., et al. Candida glabrata Binding to Candida albicans Hyphae Enables Its Development in Oropharyngeal Candidiasis. PLoS pathogens. 12 (3), 1005522 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved