A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التلقائي القائم علي الصورة الكمية من الفخاخ العدلات خارج الخلية باستخدام NETQUANT
In This Article
Summary
هنا ، نقدم بروتوكولا لتوليد الفخاخ العدلات خارج الخلية (الناموسيات) وتشغيل NETQUANT ، وهو خيار البرمجيات التلقائي بالبالكامل للقياس الكمي من الناموسيات في الصور المناعية.
Abstract
الفخاخ خارج الخلية العدلات (الناموسيات) هي علي شبكه الإنترنت مثل الهياكل المضادة للميكروبات التي تتكون من الحمض النووي والحبيبية البروتينات المضادة للميكروبات. المجهر المناعي وطرق التحديد الكمي المستندة إلى الصورة لا تزال أدوات هامه لتكميم الخلايا العدلات تشكيل فخ. ومع ذلك ، هناك قيود رئيسيه علي الأساليب القائمة علي المناعي المتاحة حاليا لقياس الشبكات. الطرق اليدوية للقياس الكمي NET المستندة إلى الصورة غالبا ما تكون ذاتية ، عرضه للخطا ومملة للمستخدمين ، وخاصه المستخدمين غير المتمرسين. كما ان خيارات البرمجيات المتاحة حاليا للقياس الكمي هي اما شبه تلقائية أو تتطلب تدريبا قبل التشغيل. هنا ، ونحن نظهر تنفيذ طريقه القياس التلقائي القائم علي المناعي الصورة لتقييم تشكيل NET تسمي NETQUANT. البرنامج هو سهل الاستخدام ولها واجهه مستخدم رسوميه صديقه للمستخدم (GUI). وهي تعتبر المعلمات ذات الصلة بيولوجيا مثل زيادة في المساحة السطحية والحمض النووي: صافي نسبه البروتين علامة ، وتشوه الذرية لتحديد تشكيل NET. وعلاوة علي ذلك ، تم بناء هذه الاداه باعتبارها التطبيق المتاحة بحريه ، ويسمح للقياس الكمي دقه الخلية الواحدة والتحليل.
Introduction
العدلات هي وسطاء حاسمه من الاستجابات الدفاع المضيف الفطرية ضد مجموعه واسعه من مسببات الامراض الميكروبية1. يقومون بتنفيذ وظائفهم المضادة للميكروبات عن طريق الإفراج عن حبيباتهم التي تحتوي علي مجموعه واسعه من البروتينات المضادة للميكروبات2، وإنتاج أنواع الأكسجين التفاعلية (ROS) و هيبوكلويد1، ومن خلال كثرة الكريات3. الاضافه إلى ذلك ، برينجمان وآخرون. 4 وصفت الفخاخ العدلات خارج الخلية (الشباك) كاليه جديده من قبل التي العدلات فخ والقضاء علي مسببات الامراض الغازية. منذ اكتشافها ما يزيد قليلا علي عقد من الزمان4, وقد تورطت الناموسيات في مجموعه واسعه من المعدية5,6 وغير المعدية7 الاعتلالات. تكوين NET هو عمليه نشطه والنتائج في قذف الحمض النووي الكروماتين المغلفة مع الحبيبية المشتقة من البروتينات المضادة للميكروبات8. وتشمل بعض التغييرات الرئيسية في المورفولوجية الخلوية والنووية المرتبطة بالتشكيل الصافي فقدان المورفولوجية النووية ، وتفكيك الكروماتين ، وتعبئة البروتينات الحبيبية من السيتوبلاسما إلى النواة وزيادة في القطر النووي والخلوي8،9.
الشبكة مثل شبك, اي يمكن ظهرت كبنيه منتشرة قليلا كبيره من الخلية أو بما ان بني عده أوقات كبيره من [العدلات] وحيده اعتبرت كمؤشرات من [نيسس]5,10. باستخدام المجهر الفلوري ، يمكن الكشف عن الناموسيات عن طريق التحقق من الحمض النووي مع مسبار الفلورسنت مثل 4 ' ، 6-diamidino-2-فينيلانديول (DAPI) وتلطيخ المناعي ضد البروتينات صافيه ملزمه مثل اللدائن المرنة. يحدد القياس الكمي للمناطق المتداخلة من تلطيخ الحمض النووي والبروتينات المربوطة بالناموسيات المساحة الاجماليه تحت الشباك في صوره11.
وهناك عدد من خيارات تحليل الصور المتاحة لأداء القياس الكمي القائم علي الصورة من الشباك11,12. ولكن هذه الخيارات البرمجيات الحالية القيود في عدم ان تكون سهله الاستخدام و/أو مؤتمتة بالبالكامل. في هذه المقالة ، ونحن نظهر تشغيل NETQUANT13، وهو التطبيق المتاحة بحريه التي يمكن ان تؤدي غير متحيزة بالبالكامل المجهرية المناعية صوره المجهر القائم علي الصور NET. التطبيق لديه واجهه رسوميه سهله الاستخدام (GUI) ويمكن اجراء تحليل خليه واحده. البرنامج ثبت قيمه netosis في صوره عن طريق الكشف عن التغييرات المورفولوجية في منطقه الحمض النووي-صافي-ملزمه علامة ، الكروماتين تفكيك المرتبطة تشوه النواة وزيادة في الحمض النووي: صافي-نسبه البروتين. ومعا ، تسمح معايير التعريف المتعددة NET بالتحديد الكمي الصارم لصافي المعلومات عبر عده مجموعات من البيانات بطريقه غير متحيزة.
Protocol
وافقت لجنه الأخلاق في جامعه لوند علي جمع الدم الوريدي من المتطوعين الأصحاء وفقا لإعلان هلسنكي (2013/728). وقدم جميع المتطوعين موافقتهم الكتابية المستنيرة.
1. عزل العدلات الدم المحيطي باستخدام الكثافة-التدرج طرد
- جمع الدم الوريدي البشري في أنابيب تحتوي علي الهيبارين والسماح للأنابيب للوصول إلى درجه حرارة الغرفة.
ملاحظه: مطلوب ما لا يقل عن 16 مل من الدم من متبرع صحي لإنتاج بيليه خليه كبيره بما فيه الكفاية. - خلط الدم مع حجم واحد من 2 ٪ ديكسسين في المالحة (0.9 ٪ كلوريد الصوديوم) والسماح لرواسب في درجه حرارة الغرفة لمده 30 دقيقه في أنبوب الطرد المركزي المخروطية 50 mL معقمه.
- يستنشق ماده طافي في العقيمة 50 mL أنبوب الطرد المركزي المخروطية والطرد المركزي في 200 x ز لمده 10 دقيقه في 4 ° c.
- من هذه الخطوة فصاعدا مواصله العزلة في 4 درجه مئوية أو علي الجليد.
- أعاده تعليق بيليه في 5 مل من المياه المالحة الباردة الجليد وطبقه علي راس 5 مل من التدرج عزل الكريات البيضاء (9.1 ٪ diatrizoate الصوديوم مع 5.7 ٪ ديكسدان ، ث/v) في معقمه 15 مل أنبوب الطرد المركزي المخروطية.
- الطرد المركزي لمده 30 دقيقه في 400 x ز في 4 درجه مئوية.
- يستنشق العملاق ويتخلص منه.
- Lyse خلايا الدم الحمراء عن طريق أعاده تعليق بيليه في 3 مل من الماء المثلج لمده 30 ثانيه. فورا أضافه 1 مل من 3.6 ٪ كلوريد الصوديوم ومن ثم تملا مع 10 مل من الجليد الباردة المالحة.
- الطرد المركزي تعليق الخلية لمده 10 دقيقه في 350 x ز.
- أزاله supernatant ، وجمع بيليه الخلية وأعاده التعليق عليه في 1 مل من المحلول الملحي. نضع جانبا 10 μL في أنبوب الطرد المركزي لتقييم رقم الخلية والقدرة علي البقاء باستخدام التريكان الأزرق في غرفه بركر.
- أضافه 10 μL من تعليق الخلية إلى 90 μL من 0.4 ٪ التريكان الحل الأزرق. خذ 10 μL من تعليق الخلية في غرفه بركر. عد الخلايا في المربعات 4 ملزمه بثلاثه أسطر في كل ركن من أركان الغرفة. الخلايا التي تظهر باللون الأزرق الداكن لامتصاص الصبغة غير قابله للاستمرار ، وتستبعدها من إجمالي رقم الخلية.
- التعبير عن رقم الخلية كخلايا/مل كما هو محدد في المعادلة أدناه.
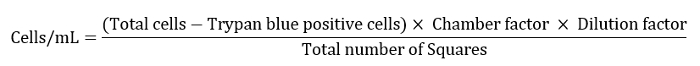
ملاحظه: كان عامل الغرفة هنا 10,000 ، وكان عامل التخفيف 10 وكان العدد الإجمالي للمربعات 4. - تمييع تعليق الخلية المتبقية إلى 10 مل لخطوه الغسيل النهائي.
- الطرد المركزي لمده 5 دقائق في 200 x ز.
- أعاده التعليق العدلات في RPMI-1640 مع 2 ملغ/مل الحرارية المصل الإنسان الزلال (HSA) في تركيز 5 × 105 خلايا/مل.
2. اعداد الشفتين وتحفيز العدلات
- وضع واحد كوفيرسليب (10 ملم ، #1) في كل بئر من 12 بئر لوحه ومعطف كوفيرسليب عن طريق أضافه 200 μl من 0.01 ٪ بولي-L-يسين حل وترك الأمر عند 37 درجه مئوية بين عشيه وضحيها.
- غسل الشفتين مع 300 μL الفوسفات العازلة المالحة (تلفزيوني) مره واحده وترك لتجف.
- أضافه 400 μL من 5 × 105 العدلات/مل لكل بئر واحتضان في درجه حرارة الغرفة لمده 15 دقيقه.
- نقل لوحه تحتوي علي العدلات إلى حاضنه في 37 درجه مئوية مع 5 ٪ CO2 لمده 15 دقيقه.
- أزاله الفائقة. أضافه 400 μL من الحرارة المسبقة RPMI-1640 المتوسطة مع 2 ملغ/مل HSA إلى الضوابط. أضافه 300 μL قبل الحرارة RPMI مع 20 نانومتر phorbol 12-myristate 13-خلات (نقدا) للتحفيز.
- تحفيز العدلات ل 150 دقيقه في 37 درجه مئوية مع 5 ٪ CO2.
3. تصور الشباك
- أزاله ماده طافي وغسل العينات 2x مع 200 μl من تلفزيوني.
- إصلاح العينات عن طريق أضافه 200 μL من 4 ٪ بارافورمالدهيد (PFA) في الاذاعه التلفزيونية لمده 20 دقيقه في 37 درجه مئوية.
ملاحظه: PFA السامة ويجب التعامل معها بعناية. - غسل عينات 3x مع 200 μL من تلفزيوني.
- يتخلل العينات باضافه 50 μL من 0.5% تريتون X-100 لمده 30 ثانيه.
- غسل العينات 3x مع 200 μL من تلفزيوني.
- منع العينات مع 5 ٪ مصل الماعز في الاذاعه التلفزيونية لمده 1 ساعة في 37 درجه مئوية.
- أضافه 300 μL من الأرنب الابتدائي المضادة للإنسان العدلات المرنة في منع الحل في التخفيف من 1:500 لمده 90 دقيقه في 37 درجه مئوية.
- غسل العينات 3x مع 300 μL من تلفزيوني.
- أضافه 300 μL من الماعز الثانوية المضادة لأرنب الجسم الأجسام الفلورية في تخفيف 1:1000 لمده 90 دقيقه في 37 درجه مئوية.
- غسل الشفتين 3x مع 300 μL من تلفزيوني.
- أزاله الشفتين من الآبار وجبل coverslips مع 10 μL المتوسطة المتصاعدة التي تحتوي علي DAPI. يخزن بين عشيه وضحيها في درجه حرارة الغرفة في الظلام لتجفيف العينات.
ملاحظه: تلطيخ الحمض النووي مع DAPI هو بالتاكيد خطوه حاسمه في هذه الطريقة. يمكن للمستخدمين أيضا استكشاف الأخطاء وإصلاحها عن طريق أضافه حل DAPI الخارجية في نطاق تركيز نهائي من 0.1 \ u 20120.5 ميكروغرام/مل لمده 2 \ u20123 دقيقه ، تليها 3 خطوات الغسيل مع 300 μL. - الحصول علي الصور مع مجهر الحقل واسعه باستخدام هدف 20X.
4-تحليل وتقدير كميات الناموسيات باستخدام NETQUANT
ملاحظه: NETQUANT يمكن تحميلها عن طريق النقر علي ملف التثبيت الموجودة علي الأرشيف جيثب Zenodo أو الموقع الكتروني للمختبر Nordenfelt (https://nordlab.med.lu.se/?page_id=34).
- استيراد مجموعات البيانات للتحليل وتسميه القناات وتحويل الصور
- افتح علامة التبويب "اعداد " في NETQUANT.
- اختر المجلد المصدر للتحليل بالنقر فوق الخيار الحصول علي المسار في القائمة المصدر وحدد المجلد الذي يحتوي علي تسلسلات الصور التي سيتم تحليلها.
- انقر فوق الخيار الحصول علي مسار في القائمة الهدف وحدد المجلد لحفظ البيانات التالية تحليل الصورة.
- اسم القناات بحيث "قناه الحمض النووي" يتوافق مع تلطيخ الحمض النووي (عليسبيل المثال، الحمض النووي أو dapi) و "صافي قناه" يصور تلطيخ البروتين صافي (عليسبيل المثال، صافي ، اللدائن المرنة) في الصور. لسلاسة أداء البرنامج ، (مستحسن) اسم المجلد الذي يحتوي علي ملفات صوره التحكم ك "السيطرة".
ملاحظه: تشير قناه NET إلى تلطيخ علامة البروتين الحبيبية الصافية فقط. - أطعم بيانات تعريف الصورة في البرنامج بالنقر علي زر معلومات تحميل الصور علي القائمة الفرعية لمعلومات الصورة.
- حدد ترتيب القناة الصحيح الموجود في الصور في القائمة الفرعية لترتيب القناة . تم تضمين هذا الخيار كامان للفشل لمنع حالات عدم التطابق العرضية.
- الحصول علي خصائص الصورة الاساسيه من البيانات الاوليه وتحويل الصور بالنقر فوق زر اعداد البيانات. تظهر الصور المحولة في القائمة الفرعية لنوع النموذج . انقر علي قائمه نوع العينة لعرض وتحديد كافة مجموعات البيانات التي تم الحصول عليها للتحليل.
- حدد صوره من القائمة الفرعية نوع نموذج وانقر علي زر بيانات الصورة العرض لعرض الصور تنقسم إلى الحمض النووي وقناه NET علي التوالي.
- تقسيم الخلايا في قناه الحمض النووي وقناه NET
- حدد طريقه التقسيم عن طريق النقر علي القائمة الفرعية أسلوب في كل من قناه الحمض النووي وقناه NET.
ملاحظه: يتم تعيين الأسلوب الافتراضي للتقسيم إلى التكيف وهو الاعداد الموصي به. خيارات أخرى متاحه أيضا بما في ذلك العالمية, حافه وتشان-Vese. كما يتم تضمين خيار مستجمعات المياه للمساعدة في التمييز بين الخلايا الموضوعة بشكل وثيق أو الشبكات. - ادخل علامة التبويب تجزئه لتقسيم خلايا عنصر التحكم أولا في كلا القناتين بالنقر فوق الخيار عينات عنصر تحكم المقطع .
- حدد نقدا من نموذج القائمة الفرعية نوع وانقر علي الخيار الدفعي (مستحسن) لبدء تجزئه جميع الصور المدرجة في مجموعه البيانات. حدد الصور في القائمة نوع العينة وانقر علي زر بيانات الصورة العرض لتصور والتحقق من صحة أقنعه الصورة الثنائية (قناع الحمض النووي وقناع NET) التي تم إنشاؤها بعد تقسيم.
- حدد طريقه التقسيم عن طريق النقر علي القائمة الفرعية أسلوب في كل من قناه الحمض النووي وقناه NET.
- تحليل الخلية الواحدة للخصائص القابلة للتحديد
- ادخل علامة التبويب تحليل وتحليل عينات التحكم بالنقر فوق الزر تحديد العتبة .
- تغيير نوع نموذج إلى نقدا وانقر علي الزر الحصول علي خصائص الخلية لإكمال تحليل العينات المحفزة.
- حدد صوره من نوع نموذج القائمة الفرعية وانقر علي زر بيانات صوره العرض لعرض التراكب وعدد الخلايا و NET تشكيل الخلايا في الصورة.
- مقارنه خصائص الخلية للتعرف علي خلايا التشكيل الصافي
- حدد عينه من نموذج نوع القائمة الفرعية وانقر علي زر تحليل الشباك لاستكمال التحليل. يمكن تحديد الصور الفردية من القائمة الفرعية لنوع العينة للتحليل أو يمكن تحليل مجموعه الصور بالبالكامل عن طريق تحديد خيار الدفعة (مستحسن).
- اضبط معايير NET يدويا للحصول علي أفضل النتائج لعينه معينه. قارن بين الشباك المحددة والصور الاصليه لتقييم نوعيه الهوية.
ملاحظه: يمكن بعد ذلك استخدام معايير NET عبر جميع الصور في مجموعه البيانات. يتم تطبيق إيه تغييرات في معايير NET في نفس الوقت عبر كافة عينات التحكم. وهذا يحد من امكانيه حدوث اي اختلافات محتمله قد تنشا بسبب الإفراط في تركيب بارامترات شبكه الإنترنت. يمكن تعديل الإعدادات في معايير NET وفقا لمتطلبات المستخدم. وقد تم استكشاف العلاقة بين معدلات الاكتشاف الزائفة و NETQUANT في السابق13. النطاقات النموذجية لزيادة المساحة هي 2 \ u20124 ، دائريه لتكون 0.7 \ u 20120.9 ونسبه الحمض النووي الصافي إلى 0.6-2.0. - افحص ملخص البيانات في القائمة الفرعية لبيانات الخلية حيث يتم عرض عدد الصور وتعداد الخلايا لكل صوره والنسبة المئوية للشباك لكل صوره.
ملاحظه: يتم عرض النسبة المئوية الاجماليه للشباك في مجموعه البيانات بأكملها بواسطة "المقياس الصافي". إجمالي عدد الصور ، عدد الخلايا ، النسبة المئوية للشباك في العينة (الناموسيات) ويتم عرض شبك +آت% في عينه التحكم في جدول إحصائيات التلخيص أسفل مقياس الشبكة. نوصي بان يتم الإبلاغ عن بيانات التحكم إلى جانب البيانات التي تم الحصول عليها من العينات المحفزة.
- مخرجات النتائج
- ادخل علامة التبويب إخراج لتحديد مخرجات النتائج وعرضها.
- استكشاف ومقارنه مخرجات البيانات المختلفة المتولدة من تحليل السيطرة وسلطه النقد المعنية عن طريق اختيار شكل الإخراج والنقر علي زر نتائج المخرجات .
ملاحظه: يتم حفظ كافة البيانات التي تم إنشاؤها بعد التحليل لكل من عناصر التحكم والتحفيز في مجلد التحليل كما تم اختياره في القائمة الفرعية المستهدفة. يتم حفظ البيانات اما بتنسيقات .csv أو .pdf. - تشغيل ملف الأسلوب للحصول علي إصدار البرنامج والمعايير الصافية المستخدمة للتحليل (ليتم تضمينها في قسم الأساليب لأغراض النشر).
- انقر فوق جدول بيانات النتائج لتصور نقاط البيانات الفردية في عينه معينه.
- تصور توزيع صافي المنطقة ونسبه الحمض النووي: NET في العينات. يشير الخط الأحمر إلى قيمه العتبة في الرسوم البيانية.
- تحديد منطقه NET مقابل شكل الحمض النووي عن طريق النقر علي ملف توزيع Bivariate .
- تحميل التحليل السابق ودفعه كل الخطوات
- تحميل إعدادات التحليل الناجحة سابقا في NETQUANT باستخدام زر التحليل السابق تحميل .
- استخدم الزر الدفعي كافة الخطوات المضمنة في قائمه الاعداد لتشغيل الخطوات 5 \ u201212 (الشكل1، الشكل 2، الشكل 3، الشكل 4، الشكل 5) مباشره للحصول علي الإخراج النهائي.
النتائج
5 × 105 العدلات/مل تم المصنفة علي الشفتين وضعت في لوحه 12 بئر وحفز مع اما 20 نانومتر النقد الأبيض أو اليسار غير المحفزة لمده 150 دقيقه. وكانت العينات ثم الملطخة باستخدام الرئيسية الأرانب المضادة للإنسان الأضداد اللدائن المرنة ، والماعز الثانوية المضادة لأرنب فلوكوفيري م...
Discussion
التشكيل الصافي هو أضافه حديثه نسبيا إلى المتنوعة العدلات ارمينتماريوم4 وكان هناك طفرة ملحوظة من الفائدة لدراسة اثار الشباك في مجموعه واسعه من مجالات البحث5,7,14,15. اقتناء الصور باستخدام المجهر المناعي والكم...
Disclosures
TM و PN لديها براءات الاختراع المعلقة المتعلقة الخوارزميات المستخدمة في NETQUANT.
Acknowledgements
وتم تمويل العمل من قبل مؤسسه كرافورد (TM و PN) ، ومنحه البحوث الحكومية السويدية (PN ، TM) ، ومجلس البحوث السويدي (PN) ومؤسسه غروشنسكي (TM ، PN).
Materials
| Name | Company | Catalog Number | Comments |
| BD Vacutainer Heparinised plastic tubes | BD Biosciences | 367885 | |
| Lymphoprep | Axis-Shield | 114547 | |
| RPMI-1640 with L-Glutamine | Gibco | 11835-030 | |
| 50mL conical flasks | Sarstedt | 62.547.004 | |
| 15mL conical flasks | Sarstedt | 62.554.002 | |
| 12-well Tissue culture plates | Falcon | 10626491 | |
| #1 Coverslips 10mm | Menzel Glaser | CS10100 | |
| Glass slides | Menzel Glaser | 631-0098 | |
| Primary anti-human elastase | DAKO | DAKO rabbit 1373, contract immunization | |
| Secondary fluorophore conjugated goat anti-rabbit | Life technologies | A-11072, A-11070 | |
| PROLONG-Gold Antifade reagent with DAPI | Life technologies | P36930 | Mounting medium |
| Goat serum | Sigma-Aldrich | G9023 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma-Aldrich | 79346 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Nikon Ti-E Epifluorescence microscope | Nikon | ||
| CCD camera | Andor Zyla | ||
| Plan Apochromat 20x, 40x objectives | Nikon | ||
| Windows 10 | Microsoft | Operating system | |
| macOS Sierra 10.12 | Apple | Operating system | |
| MATLAB | Mathworks |
References
- Nauseef, W. M., Borregaard, N. Neutrophils at work. Nature Immunology. 15 (7), 602-611 (2014).
- Borregaard, N., Cowland, J. B. Granules of the human neutrophilic polymorphonuclear leukocyte. Blood. 89 (10), 3503-3521 (1997).
- Nordenfelt, P., Tapper, H. Phagosome dynamics during phagocytosis by neutrophils. Journal of Leukocyte Biology. 90 (2), 271-284 (2011).
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- Sorensen, O. E., Borregaard, N. Neutrophil extracellular traps - the dark side of neutrophils. Journal of Clinical Investigation. 126 (5), 1612-1620 (2016).
- Yipp, B. G., Kubes, P. NETosis: how vital is it?. Blood. 122 (16), 2784-2794 (2013).
- Jorch, S. K., Kubes, P. An emerging role for neutrophil extracellular traps in noninfectious disease. Nature Medicine. 23 (3), 279-287 (2017).
- Fuchs, T. A., et al. Novel cell death program leads to neutrophil extracellular traps. J Cell Biol. 176 (2), 231-241 (2007).
- Mohanty, T., et al. A novel mechanism for NETosis provides antimicrobial defense at the oral mucosa. Blood. 126 (18), 2128-2137 (2015).
- Hakkim, A., et al. Activation of the Raf-MEK-ERK pathway is required for neutrophil extracellular trap formation. Nature Chemical Biology. 7 (2), 75-77 (2011).
- Brinkmann, V., Goosmann, C., Kuhn, L. I., Zychlinsky, A. Automatic quantification of in vitro NET formation. Frontiers in Immunology. 3, 413 (2012).
- Coelho, L. P., et al. Automatic determination of NET (neutrophil extracellular traps) coverage in fluorescent microscopy images. Bioinformatics. 31 (14), 2364-2370 (2015).
- Mohanty, T., Sorensen, O. E., Nordenfelt, P. NETQUANT: Automated Quantification of Neutrophil Extracellular Traps. Frontiers in Immunology. 8, 1999 (2017).
- Kaplan, M. J., Radic, M. Neutrophil extracellular traps: double-edged swords of innate immunity. Journal of Immunology. 189 (6), 2689-2695 (2012).
- Cedervall, J., Olsson, A. K. Immunity Gone Astray - NETs in Cancer. Trends in Cancer. 2 (11), 633-634 (2016).
- Ginley, B. G., et al. Computational detection and quantification of human and mouse neutrophil extracellular traps in flow cytometry and confocal microscopy. Scientific Reports. 7 (1), 17755 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved