Method Article
مقايسة الامتصاص الكولسترول استخدام الخلايا الحية التصوير التحليل مع خلية المراقبة الصحية
* These authors contributed equally
In This Article
Summary
يوفر هذا البروتوكول نهج فعالة لقياس امتصاص الكوليسترول LDL مع معدلات تدفق الوقت الحقيقي باستخدام خلية يعيش التصوير النظام في مختلف أنواع الخلايا. هذا الأسلوب يوفر منبرا الشاشة النشاط الدوائي للمركبات التي تؤثر على تدفق LDL في حين رصد مورفولوجيا الخلايا وسيتوتوكسيسيتي المحتملة ومن ثم.
Abstract
تنظيم امتصاص الكوليسترول LDL من خلال وساطة لدلر الالتقام مجالاً هاما للدراسة في مختلف الأمراض الرئيسية بما في ذلك الاضطرابات الأيضية وأمراض القلب والأوعية الدموية، وأمراض الكلي. حاليا، لا يوجد أي أسلوب متاح لتقييم امتصاص LDL بينما رصد في الوقت ذاته على صحة الخلايا. ويعرض الدراسة الحالية بروتوكول، باستخدام نظام تحليل تصوير خلايا حية، للحصول على القياسات المسلسل LDL التدفق مع الرصد المتزامن لصحة الخلية. يتم اختبار هذه التقنية الجديدة في ثلاثة خطوط الخلايا البشرية (الكبد, كلوي أنبوبي الشريان الظهارية، والشريان التاجي خلايا بطانية) مر وقت أربع ساعات. وعلاوة على ذلك، يتم التحقق من حساسية هذا الأسلوب مع معروفة مثبطات امتصاص الكولسترول وديناسوري والمؤتلف بروتين PCSK9، وكذلك مروج امتصاص الكولسترول، سيمفاستاتين. أخذت معا، هذا الأسلوب يوفر منبرا متوسطة إلى عالية إنتاجية لفحص النشاط الدوائي في وقت واحد، فضلا عن رصد مورفولوجيا الخلايا، ومن ثم سيتوتوكسيسيتي مركبات التي تنظم تدفق LDL. يمكن استخدام التحليل مع مختلف نظم التصوير والبرامج التحليلية.
Introduction
الالتقام LDL منخفض الكثافة Lipoprotein مستقبلات لدلر بوساطة مجالاً هاما للدراسة منذ تعميم مستويات الكولسترول LDL لب1من أمراض القلب والأوعية الدموية، وأمراض الكلي2 ، فضلا عن مجموعة متنوعة من الالتهابات 3 من الأمراض والاضطرابات الوراثية مع الطفرات في نسبة الكولسترول في الدم نقل الجينات4،5،،من67. وقد أدت الدراسات في تدفق الكوليسترول لدلر بوساطة لتحديد أدوات البحث متعددة، مثل مثبطات دينامين بما في ذلك الكيميائية دينسور8،،من910، فضلا عن تنظيم LDL اكتب البروتينات مثل كونفيرتاسي بروبروتين سوبتيليسين/كيكسن11،(PCSK9) 912.
ويبدأ المسار الالتقام LDL-لدلر عزل المجمع LDL-لدلر على سطح الخلية في حفر مكسوة كلاثرين13. ثم تتشكل حويصلات من إينفاجينيشن لغشاء الخلية السطحية استيعاب المجمع LDL-لدلر في فاكوليس للنقل داخل الخلية. نضوج حويصلة المشكلة في اندوسوميس المبكرة والمتأخرة ثم قطرات درجة الحموضة داخل دخلول الراحل، مما تسبب في عدم اقتران LDL من مستقبلات لها14. في الماضي، تعتمد أساليب القياس الكمي لتدفق LDL على المسمى الإذاعة 125-LDL حضانة المشارك مع الخلايا واستخراج اللاحقة من البروتين المسمى الإذاعة من الخلايا لتحديد مقدار15. هذا وكان ثم الاستعاضة عن استخدام المسمى فلوريسسينتلي LDL بروتينات مثل دي-LDL، وإيمونوستينينج اللاحقة أو استخراج البروتين لقراءات الفلورسنت باستخدام جهاز المطياف الضوئي أو لوحة15،قارئ16. فلوريسسينتلي المسمى LDL أيضا استخدمت في خلية تنشيط Fluorescence الفرز (نظام مراقبة الأصول الميدانية) لتحليل للاستيعاب الكولسترول والخلايا السطحية LDL ملزمة17. بينما تسمح هذه الطرق لجمع البيانات بعد المعالجة، رصد جدوى الخلايا أثناء العلاج لا يمكن.
الرقم الهيدروجيني الحمضية في دخلول الراحل يسمح باستخدام مجس LDL الفلورسنت تنشيط الأس الهيدروجيني مثل فرودو LDL الأحمر التي فلوريسسيس بعد استيعاب18،19. تتيح هذه الخاصية لدورة وقت مستمرة لتقييم امتصاص الكولسترول في الخلايا الحية. ولذلك، يستخدم هذا البروتوكول فرودو الأحمر-LDL fluorescence التصوير في تحليل خلية حية لقياس LDL في الإقبال على التسلسل مع الرصد المتزامن لصحة الخلية. وتشير النتائج إلى موثوقية هذه التقنية الجديدة كما تم اختبارها على مدى دورة وقت أربع ساعات في ثلاثة خطوط الخلايا البشرية المختلفة والخلايا البشرية سرطان الكبد (HepG2)، والخلايا الكلوية البشرية الظهارية (HK2) والشريان التاجي الشرياني غشائي الخلايا البشرية (هكايك ). هذه الخطوط الخلية مهمة سريرياً الكولسترول تطهير20،21،،من2223،24،25،26،27 ، الكلي المرض28،29،،من3031، و32،أمراض القلب33، على التوالي. بالإضافة إلى رصد تدفق LDL، يتضمن هذا البروتوكول المعالجة بمثبطات امتصاص الكولسترول المعروفة اثنين، هيدرات دينسور والمؤتلف PCSK9 البروتين، فضلا عن محفز ستاتين التعبير لدلر وامتصاص الكولسترول، سيمفاستاتين. دينسور المؤتلف PCSK9 كل العمل من خلال مسارات مختلفة للحد من امتصاص الكولسترول.
دينسور مثبط جزيء صغير من دينامينس10 ويقلل من امتصاص الكولسترول بحجب الالتقام كلاثرين-تعتمد على LDL-لدلر معقدة10،34. PCSK9 المؤتلف، من ناحية أخرى، هو عضو peptidase S8 الأسرة التي تربط بين لدلر ويحول دون إعادة تدويرها إلى سطح الخلية بعد الإفراج عن LDL من المجمع المدخلة عن طريق حظر التغييرات المطلوبة كونفورماشونال35،36 . خلية انخفاض الكثافة لدلر السطحية يؤدي في النهاية إلى انخفاض امتصاص الكولسترول بالخلية. Statins، حين وقف مباشرة 3-هيدروكسي-3-ميثيلجلوتاريل-إنزيم إنزيم ريدكتيز (حكومة صاحبة الجلالة-CoA) ومن ثم تخليق الحيوي الكولسترول، من المعروف أيضا أن أوبريجولاتي التعبير عن لدلر25،38 مما يؤدي إلى زيادة امتصاص LDL. يتم التحقق من حساسية هذا البروتوكول عن طريق الكشف عن تخفيضات كبيرة في تدفق الكولسترول في الخلايا البشرية ذات الصلة سريرياً ثلاثة خطوط، HK2، HepG2 وهكايكس، ديناسوري و/أو المؤتلف PCSK9، وزيادة ملحوظة في امتصاص الكولسترول في الخلايا HepG2 قبل سيمفاستاتين في مسلك وقت أربع ساعات مع رصد للخلية مورفولوجيا/الصحة. أخذت معا، هذا الأسلوب يوفر منبرا متوسطة إلى عالية إنتاجية للفحص في نفس الوقت على النشاط الدوائي وسيتوتوكسيسيتي من مركبات تنظم امتصاص الكولسترول في الخلايا الحية.
Protocol
1-زرع الخلايا في صفيحة 24-جيدا
- نضح وسائل الإعلام خارج الخلايا وغسل الخلايا مع 5 مل من دوبيلكو "الفوسفات مخزنة المالحة" (دببس)، ونضح دببس. للخلايا HepG2 في طبق 100 مم، استخدم 1.5 مل من 0.25% التربسين/يدتا، وبالنسبة HK2 استخدام الخلايا أو هكايكس 1.5 مل من محلول التربسين/يدتا 0.05% لفصل الخلايا.
- احتضان اللوحة في حاضنة 37 درجة مئوية لمدة 4 دقائق أو حتى يتم فصل الخلايا. تحييد التربسين بعد حضانة 4 دقائق بإضافة 3 مل من وسائل الإعلام كاملة ل HepG2 و HK2 أو 3 مل من التربسين تحييد الحل، بالإضافة إلى 5% مصل بقرى الجنين (FBS)، دببس للخلايا حكاك.
- نقل الخلايا في أنابيب مخروطية الشكل 15 مل والطرد المركزي في 250 g x لمدة 5 دقائق ونضح وسائط الإعلام، وإعادة تعليق بيليه الخلية في وسائل الإعلام كاملة.
- تصفية تعليق خلية بلطف من خلال مصفاة مش 40 ميكرومتر تفتيت كتل الخلية. عدم غسل الخلايا من خلال المصفاة.
- عد الخلايا، ولوح لهم كثافة أمثل. على سبيل المثال، تؤدي الخلايا 5,000 كل من HepG2 الخلايا أو الخلايا 10,000 الواحدة من الخلايا HK2 أو هكايكس جيدا في صفيحة 24-جيدا جيدا لتحقيق أفضل النتائج.
- احتضان لوحة بين عشية وضحاها في 37 درجة مئوية السماح بإرفاق الخلايا.
- في اليوم التالي، تغيير الوسائط المحمولة قاعدة الوسائط لخط الخلية (بدون FBS) بالإضافة إلى 5% مصل ليبو بروتين ناقص (لبدس) أو منخفضة (2%) FBS وسائل الإعلام تبعاً للمعاملة (انظر 1.7). ثم تستمر الحضانة ح 24 لتجويع الخلايا. استخدام 500 ميكروليتر من مجموع وسائل الإعلام كل بئر في لوحة 24-جيدا.
- علاج الخلايا في واحدة من ثلاث طرق: إضافة 10 ميكروغرام/مل rPCSK9 (أو مركبة) والعودة الخلايا للحاضنة 37 درجة مئوية لمدة ساعة واحدة، إضافة 40 ميكرومتر دينسور هيدرات (أو مركبة، ثنائي ميثيل سلفوكسيد) والعودة الخلايا للحاضنة 37 درجة مئوية لمدة 10 دقائق ، أو إضافة 1 ميكرومتر سيمفاستاتين (أو المركبات، ثنائي ميثيل سلفوكسيد) وإعادة الخلايا إلى حاضنة 37 درجة مئوية لمدة 12 أو 18 أو 24 ساعة. استخدام وسائل الإعلام مع 5% لبدس rPCSK9 أو علاجات دينسور. استخدام منخفضة (2%) FBS وسائل الإعلام أو وسائل الإعلام مع العلاجات "سيمفاستاتين لبدس" 5%.
ملاحظة: علاج الخلايا مع المركبات المطلوبة قد يتم في وقت تغيير الوسائط للبروتين الدهني المجاعة (الخطوة 1.6) لإجراء التجارب على المدى الطويل، أو قبل التحليل لإجراء التجارب على المدى القصير. بدلاً من ذلك، قد اختار أوقات مخصصة في المعاملة على أساس النوع والغرض من هذه التجارب. - بعد ذلك إضافة 5 ميليلتر من فرودو الأحمر المسمى LDL (الأوراق المالية 1 ملغ/مل) لكل بئر للحصول على تركيز نهائي 10 ميكروغرام/مل. ثم، بعناية إزالة أي فقاعات من الآبار.
2-يعيش خلية التحليل
- فورا بعد إضافة LDL توسم، ضع اللوحة في الحاضنة نظام تحليل الخلية الحية (انظر الجدول للمواد) وتسمح اللوحة حجته لمدة 15 دقيقة لتقليل التكثيف في اللوحة.
- وفي الوقت نفسه، فتح البرنامج وجدولة التفحص بإضافة السفينة عقد اللوحة. صور صورة 16 كل بئر على فترات 1 ساعة في 10 X 4 ساعات استخدام قنوات الأحمر والمرحلة.
- إنشاء "مخطط لوحة" لاستخدامه لمعالجة البيانات.
- انقر فوق علامة التبويب خصائص اختيار خريطة لوحة. إدخال نوع الخلية والعلاجات في التبويب المركبات .
- انقر فوق علامة التبويب المناطق وحدد كل مجموعة من replicates وحفظ كمناطق.
3-إعداد "معلمات التحليل"
- بمجرد اكتمال تشغيل تجريبي إنشاء "تعيين الصورة" في البرنامج تدريب الكمبيوتر للتحديد الكمي لكل معلمة تضمينها في مجموعة العد.
- في البرنامج، فتح طريقة عرض لوحة، ثم في المربع التحليل الوظيفي المرافق اختر إنشاء أو إضافة إلى "مجموعة الصور".
- حدد مجموعة الصور الجديدة، اكتب اسماً لمجموعة الصور، واختر قنوات الأحمر و مرحلة التحقق من المربعات بجوار القنوات.
- حدد 5 مزيد من الصور وإضافة إلى مجموعة الصور بإضافة إلى جمع الصورة الحالية.
- إنشاء "تعريف المعالجة" للخلايا. ويتضمن الجدول 1 المعلمات للخلية HepG2، HK2، وحق تجهيز تعريفات لهذا البروتوكول تدفق LDL.
- في مربع التحليل الوظيفي المرافق ، اختر تعريف جديد للمعالجة. اختر "مجموعة الصور" المسماة في الخطوة 2.1.2 من القائمة المنسدلة. إدخال المعلمات لنوع الخلايا في الجدول 1.
- في مربع المعاينة، استخدم القائمة المنسدلة لتحديد جميع المعاينة.
- في المربع قناع التحليل ، تحقق التقاء القناع ومربعات القناع الأحمر الكائن لعرض منطقة المدرجة في التحليل المتعلق بتعريف المعالجة. انظر الشكل 1.
- قم بالتمرير من خلال مجموعة الصور لضمان إدراج الخلايا والكولسترول في القناع. حدد الملف و حفظ تعريف المعالجة.
- تحليل المجموعة من الصور من التشغيل التجريبي.
- فتح التجربة في لوحة العرض. في المربع التحليل الوظيفي المرافق ، اختر بدء عمل تحليل جديد. حدد "تعريف تجهيز" المحفوظة.
- اسم وظيفة التحليل، واختر النطاق الزمني للتحليل، وتسليط الضوء على آبار تجريبية لتحليل. انقر فوق الزر بدء .
4-تحليل ومعالجة البيانات
- بمجرد اكتمال "مهمة التحليل"، تصدير البيانات:
- حدد التحليل المكتملة واضغط على العرض. في المرافق القائمة، اختر تصدير متري/الرسم البياني.
- في قائمة المناطق ، اختر جميع الآبار، وفي قائمة الفريق ، للحصول على القيم الوسطية لكل مجموعة من الآبار كمجموعة، اختر يتطابق والمصدرة لاختيار القيم الفردية لكل بئر بلا.
- في قائمة "كائن الأحمر" متري ، اختر الكائن الأحمر مجموع كثافة المتكاملة (وحدة x µm2/image). هذه المعلمة يشير إلى مجموع أوقات الشدة (في وحدة التنسيق الإقليمية) إشارة حمراء فيما يتعلق بإشارة حمراء (في2من ميكرومتر) في جميع الصور عبر كل بئر، الذي يقابل امتصاص LDL مجموع الخلايا.
- انقر فوق الزر تصدير البيانات . تحقق من تقسيم البيانات إلى الصور الفردية. البيانات يتم نسخها تلقائياً على حافظة ويمكن لصقه إلى ملف جدول بيانات جديد.
- في قائمة "كائن المرحلة" متري ، اختر التقاء (%). تحقق من تقسيم البيانات إلى الصور الفردية. انقر فوق الزر تصدير البيانات . البيانات يتم نسخها تلقائياً على حافظة، ويمكن نسخها إلى ملف جدول البيانات الذي يحتوي على بيانات "الكائن الأحمر مجموع كثافة المتكاملة".
- تطبيق تحويل التقاء النسبة المئوية للمساحة الكلية بالمعادلة التالية.
مجموع "المرحلة في المنطقة" (/image2ميكرومتر) = التقاء (%) × (× "ارتفاع الصورة" (بكسل) القرار) × (× "عرض الصورة" (بكسل) القرار)
ملاحظة: المعلمة التقاء (%) يشير إلى النسبة المئوية التقاء منطقة المرحلة الواحدة والصورة التي تتوافق مع مجال الخلايا في كل بئر. هذا القياس ينبغي أن يتحول إلى منطقة التخلص التدريجي الكامل لكل فرد الصورة المصدرة مرة واحدة. يمكن الاطلاع على مواصفات الصورة للقناة المرحلة (ارتفاع الصورة والعرض والقرار) ليتم استخدامها مع الصيغة المذكورة أعلاه لكل سفينة تجريبية بالإشارة إلى خصائص السفينة تحت قنوات الصورة. - تطبيع "مجموع الأحمر الكائن كثافة متكاملة" "إجمالي مساحة المرحلة" محسوبة في 4.1.6 باستخدام الصيغة التالية لكل صورة فردية للقضاء على التفاوت في كثافة الخلية عبر الآبار.
- تقسيم قيم الكائن الأحمر مجموع الكثافة المتكاملة (وحدة x µm2/image) لكل صورة بالمقابل المرحلة المساحة الإجمالية (/image2ميكرومتر) للحصول على قيم امتصاص LDL (وحدة) كل صورة.
- ثم، متوسط البيانات امتصاص LDL (وحدة) لكل الصور لكل بئر الحصول على امتصاص LDL متوسط في كل بئر وثم متوسط قيم جميع الآبار نسخ متماثل للحصول على مجموعة وسائل امتصاص LDL. هذه البيانات هي قيم امتصاص LDL النهائي وقد تستعمل للتوضيح والتحليل الإحصائي باستخدام برمجيات الاختيار.
النتائج
يعيش خلية التصوير يسمح بمراقبة موثوقة الصحة الخلية أثناء الدراسات تدفق الكولسترول في ثلاثة خطوط الخلايا البشرية
علينا التحقق من صحة الفحص لدينا في ثلاثة خطوط الخلايا البشرية في الكولسترول الذي التوازن لائحة دوراً رئيسيا الفيزيولوجية المرضية، بما في ذلك الخلايا البشرية سرطان الكبد (HepG2) والخلايا الكلوية البشرية الظهارية (HK2)، والخلايا البطانية البشرية الشريان التاجي (هكايكس). استخدمنا نظام تصوير لخلية حية لإجراء مقايسة الامتصاص LDL في مسلك وقت ح 4 مع القياسات المسلسل على فترات ح 1. نتائجنا تشير إلى أن جميع أنواع الخلايا اختبار متوافقة مع هذه التقنية الجديدة والنتيجة في المنحنيات التي تشير إلى امتصاص LDL المستمر طوال فترة الدراسة تدفق مع ح 4.33 كنقطة نهائية (الشكل 2). تم الحصول على تدفق البيانات المبينة في الشكل 2 بتطبيع فرودو مجموع الأسفار الأحمر المسمى LDL (مجموع كثافة الكائن الأحمر المتكاملة لكل صورة في وحدة x µm2/الصورة) إلى منطقة خلية الإجمالي في كل صورة لكل بئر (المرحلة كائن المجال كل صورة في μ /image2م) للقضاء على التفاوت في كثافة الخلية عبر الآبار. وعلاوة على ذلك، للتحقق من صحة حساسية تحليل تدفق LDL غرض فحص المركبات التي تؤثر على امتصاص الكوليسترول LDL، استخدمنا عنصري تحكم الإيجابية المعروفة لتحول دون تدفق LDL، دينسور و rPCSK9، ومراقبة إيجابية واحدة معروفة لحمل LDL الامتصاص، سيمفاستاتين. كما أقرها نتائجنا، بعد العلاج مع دينسور و rPCSK9، اختبار كل ثلاثة خطوط الخلايا البشرية (HepG2 و HK2 وحكاك) أظهرت انخفاضات كبيرة في تدفق LDL على مدى دورة وقت ح 4 (الشكل 2أ-ج). على سبيل المثال، يوضح الشكل 2 أن تدفق LDL ينخفض في الخلايا HepG2 مع معاملة دينسور على مر الوقت، مقارنة بالخلايا تعامل مع [دمس]؛ بينما [دمس] كعنصر التحكم المركبة ديناسوري عنصر التحكم قد أي تأثير كبير على تدفق الكولسترول مقارنة بمجموعة التحكم غير المعالجة. وعلاوة على ذلك، أظهرت النتائج التي توصلنا إليها زيادة ملحوظة في امتصاص الكولسترول من الخلايا HepG2 بعد العلاج مع سيمفاستاتين (الشكل 3)، ودعم حساسية هذا الأسلوب للكشف عن تغييرات كبيرة في تدفق LDL. في حول نقطة الوقت ح 4.5، ونقطة وقت نموذجي في دراسات امتصاص الكولسترول، تدفق LDL إلى حد كبير انخفاض مع العلاج دينسور أو rPCSK9، وزادت بعلاج سيمفاستاتين (الشكل 4).
وميزة رئيسية لاستخدام الخلية الحية التصوير لدراسات امتصاص LDL هو أن هذا النظام يوفر الوقت الحقيقي صور من الخلايا في كل بئر التي يمكن استخدامها لرصد سيتوتوكسيسيتي المحتملة لفحص المركبات. وتوضح الأرقام 5-7 الصور التمثيلية خلية ثلاثة خطوط التحقيق في المرة الأولى نقطة (0.33 ح) ونقطة النهاية النهائية (4.33 ح) كمرجع مرئي لصافي تدفق LDL. وتؤكد الصور عادية مورفولوجية الخلايا بعد العلاجات دينسور أو rPCSK9، مما يشير إلى الفعالية والسلامة من هذه المركبات.
موثوقة الكولسترول الكمية المسلسل يعطي تحليل الخلية الحية تدفق القياسات مع العلاجات المختلفة
وميزة رئيسية لاستخدام هذا البروتوكول مع خلية يعيش نظام التصوير هو القدرة على جمع البيانات طوال الوقت ومقارنة تدفق LDL في نقاط زمنية متعددة بدلاً من نقطة واحدة فقط في المرة الأخيرة كالعادة القيام به. باستخدام هذا البروتوكول، نحن قادرون على حساب تدفق ريدوكتيونين نسبة الكولسترول في نقطة الوقت المحطة الطرفية وكذلك فترات ح 1 طوال الوقت. ويلخص الجدول 2 الحد من تدفق LDL في ثلاثة خطوط الخلايا البشرية اختبار بعد 10 دقيقة قبل المعالجة مع 40 ميكرومتر ديناسوري أو ما قبل المعالجة مع 10 ميكروغرام/مل rPCSK9 ح 1. في 4.33 ح كنقطة نهاية الدراسة النهائية، المعاملة مع دينسور في 40 ميكرومتر انخفاض كبير في تدفق LDL في HepG2 الخلايا والخلايا HK2 وهكايكس من 53%، 68% و 54 في المائة، على التوالي (الجدول 2 ألف-ج) والعلاج مع rPCSK9 في 10 ميكروغرام/مل أسفر عن تخفيض 55% في LDL تدفق في HK2 الخلايا (الجدول 2 باء). بالإضافة إلى التحديد الكمي لهذه النقطة الطرفية الوقت كما هو الحال في الاختبارات التقليدية، نحن قادرون على القيام بتحليل كمي في الحد تدفق LDL سبب العلاج في كل نقطة وقت التجربة. على سبيل المثال، يبين الجدول 2 باء أن المعاملة مع rPCSK9 في HK2 الخلايا أدى إلى انخفاض امتصاص الكولسترول من 79% في ح 1.33، 67% في ح 2.33، 59% في ح 3.33 بعد العلاج مقارنة مع الخلايا غير المعالجة. يوفر هذا البروتوكول طريقة موثوقة للتحليل الكمي لتدفق LDL بعد العلاج.
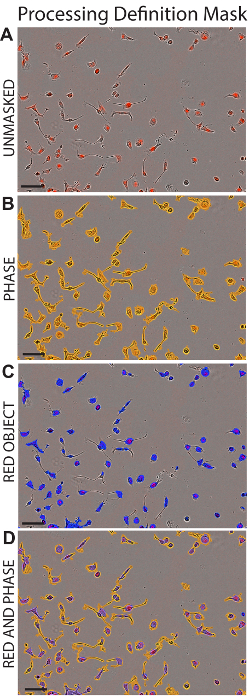
الشكل 1 : معالجة تعريف قناع. يصور صور الممثل من الخلايا HK2 بعد تطبيق تعريف المعالجة المناسبة (مفصلة في الجدول 1). تظهر الخلايا areHK2 دون إخفاء (A)، مع "ماسكابليد المرحلة" (ب)، مع الأحمر الكائن تطبيق "قناع" (ج)، أو مع كل مرحلة والكائن الأحمر الأقنعة المطبقة (د). شريط المقياس = 100 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
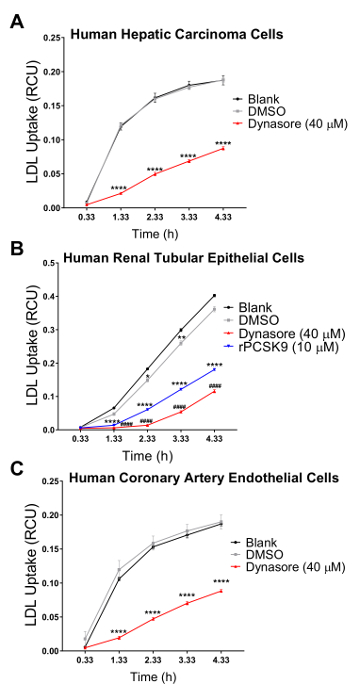
الشكل 2 : خفض LDL الإقبال على استخدام لايف خلية نظام التصوير مر وقت 4.33 ح. يعيش خلية التحليل يستخدم نظام لقياس تدفق الكولسترول في الخلايا البشرية سرطان الكبد (HEPG2) (A) والبشرية كلوي أنبوبي (HK2) الخلايا الظهارية (ب)، والشريان التاجي البشري خلايا بطانية (حق) (ج). الخلايا تعامل مع دينسور (10 دقيقة قبل التشغيل) أو rPCSK9 (ح 1 قبل التشغيل) كعناصر إيجابية. [دمس] استخدمت كوسيلة لعلاج ديناسوري. عناصر إيجابية تناقص تدفق LDL في كل خلية 3 خطوط. تم الحصول على قيم التدفق LDL بتطبيع كثافة الكائن الأحمر الكلية المتكاملة (RCUxµm2/image) إلى منطقة الكائن المرحلة الإجمالية (/image2ميكرومتر). البيانات mean±SEM-N = 6 آبار/المجموعة. البيانات هي الممثل للتجارب المستقلة 2 أو 3. ف < 0.0001 مقابل فارغة، و # # #ف < 0.0001 مقابل [دمس]، استخدام ANOVA ثنائي الاتجاه. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
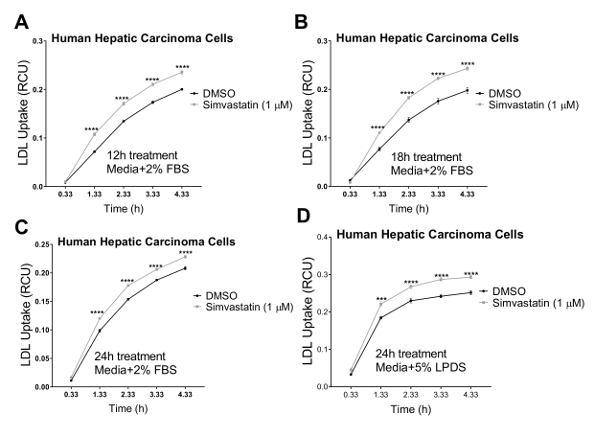
الشكل 3 . زيادة في امتصاص LDL استخدام الخلية الحية نظام التصوير مر وقت ح 4.33. يعيش خلية التحليل يستخدم نظام لقياس تدفق الكولسترول في الخلايا البشرية سرطان الكبد (HEPG2). امتصاص LDL هو زيادة كبيرة بعد العلاج مع سيمفاستاتين ح 12 ()، ح 18 (ب)، أو ح 24 (ج) استخدام الوسائط التي تحتوي على نسبة 2% FBS. نقطة الوقت 24 ساعة أجرى أيضا مع الوسائط التي تحتوي على 5% لبدس (دون FBS). [دمس] كمراقبة سلبية. تم الحصول على قيم التدفق LDL بتطبيع كثافة الكائن الأحمر الكلية المتكاملة (وحدة x µm2/image) إلى منطقة الكائن المرحلة الإجمالية (/image2ميكرومتر). البيانات mean±SEM-N = 6 آبار/المجموعة. البيانات هي الممثل لتجربة مستقلة واحدة. ف < 0.0001 مقابل [دمس]، باستخدام الاختبار t للطالب. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
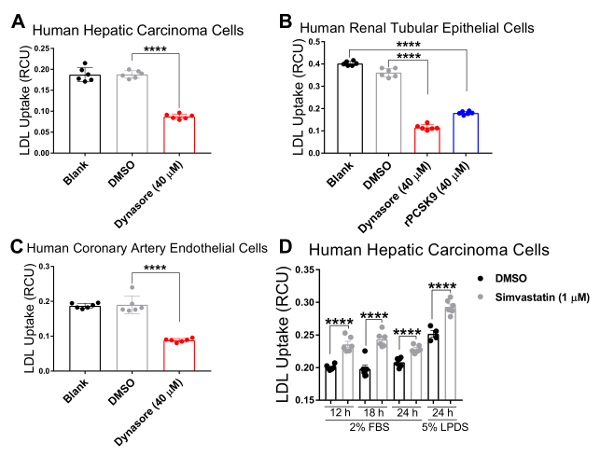
الشكل 4 . انخفاض كبير في تدفق LDL وكلاء خفض امتصاص LDL في وقت ح 4.3 نقطة. تدفق LDL هو إلى حد كبير في الخلايا البشرية سرطان الكبد (HepG2) (A) والبشرية كلوي أنبوبي (HK2) الخلايا الظهارية (ب)، والشريان التاجي البشري (حق) خلايا بطانية (ج) بعد العلاج مع امتصاص LDL مثبطات دينسور 10 دقيقة أو rPCSK9 لمدة ساعة واحدة. ملحوظة يزداد تدفق LDL سيمفاستاتين في الخلايا HepG2 بعد العلاجات h 12 أو 18 أو 24 (د). البيانات mean±SEM-N = 6 آبار/المجموعة. البيانات هي الممثل للتجارب المستقلة 2 أو 3. ف < 0.0001 استخدام ANOVA ثنائي الاتجاه. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
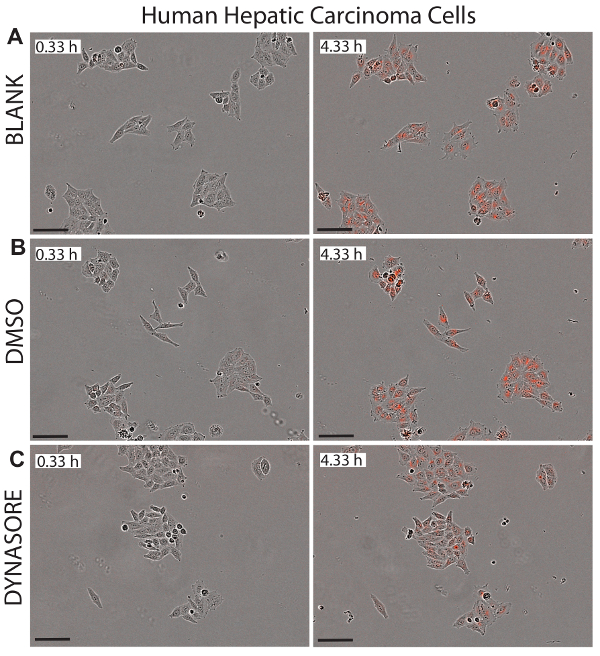
الشكل 5 . انخفاض تدفق LDL في خلايا سرطانه الخلية الكبدية (HepG2) بعامل تخفيض امتصاص LDL، دينسور. يصور الصور التمثيلية للمرحلة وكائن الأحمر للخلايا HepG2 في ح 0.33 (لوحات الأيسر) وإظهار ح 4.33 نقطة النهاية (لوحات الحق) مركز صحي للخلايا. 40 ميكرومتر دينسور، معروفة للحد من امتصاص الكولسترول الضار، كمراقبة إيجابية (ج). صور أخذت في 10 X التكبير. شريط المقياس = 100 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الرقم 6 . انخفاض تدفق LDL في البشرية كلوي أنبوبي (HK2) الخلايا الظهارية من عوامل خفض امتصاص LDL دينسور و rPCSK9- صور الممثل المرحلة وكائن الأحمر للخلايا HK2 يصور ح 0.33 (لوحات الأيسر) وح 4.33 نقطة النهاية (لوحات الحق) تظهر الحالة السليمة للخلايا. 40 ميكرومتر ديناسوري (ج)، أو 10 ميكروغرام/مل rPCSK9 (د)، المعروف لتقليل امتصاص الكوليسترول LDL، واستخدمت كمراقبة إيجابية. يتم أخذ صور في 10 X التكبير. شريط المقياس = 100 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
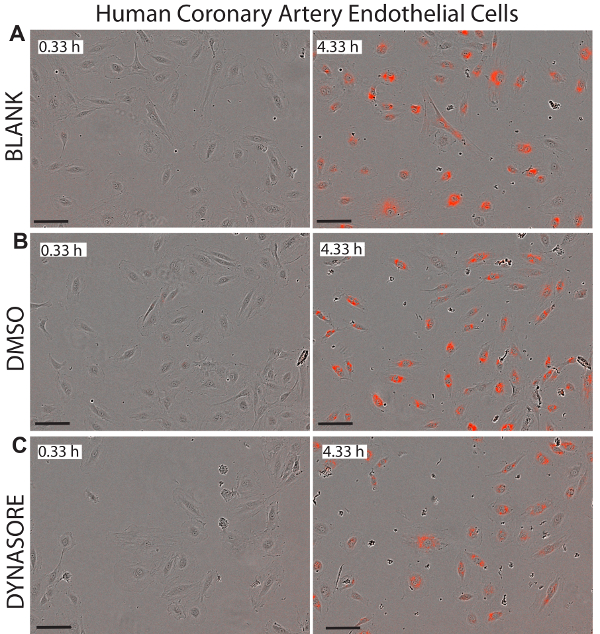
الشكل 7 . انخفاض تدفق الكولسترول في الشريان التاجي البشري خلايا بطانية (هكايكس) بعامل تخفيض امتصاص LDL، دينسور. صور الممثل المرحلة وكائن أحمر هكايكس يصور ح 0.33 (لوحات الأيسر) وح 4.33 نقطة النهاية (لوحات الحق) تظهر الحالة السليمة للخلايا. 40 ميكرومتر دينسور، معروفة للحد من امتصاص الكولسترول الضار، كمراقبة إيجابية (ج). صور أخذت في 10 X التكبير. شريط المقياس = 100 ميكرومتر. البيانات mean±SEM-N = 6 آبار/المجموعة. البيانات هي الممثل للتجارب المستقلة 2 أو 3. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
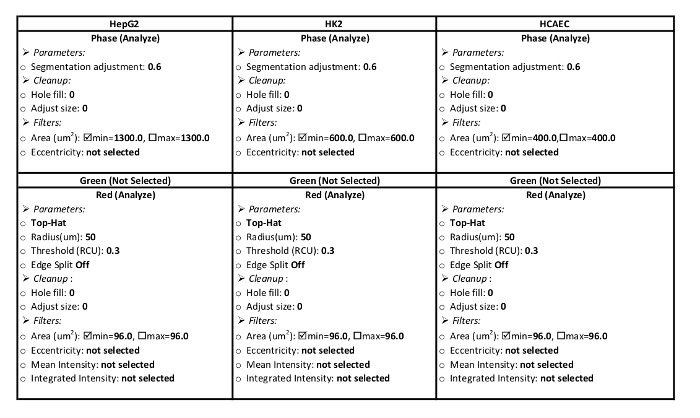
الجدول 1: تعريف معلمات معالجة. هذه المعلمات محددة لنظام التحليل المستخدمة في هذا البروتوكول. وينبغي إعداد المعلمات لتحليل ومنطقة حمراء في القناة الحمراء الخلية في القناة المرحلة. إعدادات المعلمة ل HepG2، HK2، يتم عرض خطوط الخلايا هكاي.
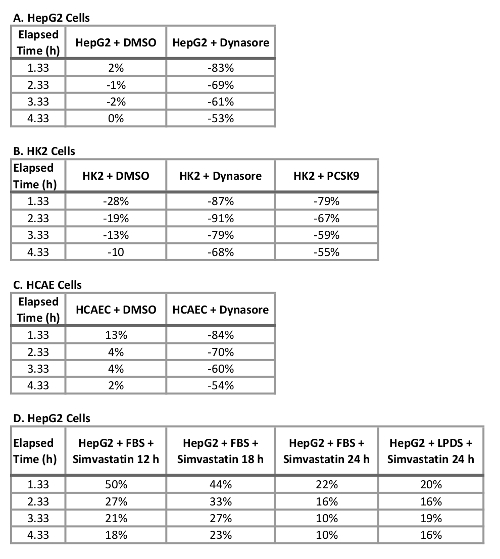
الجدول 2: تغير النسبة المئوية في تدفق الكولسترول في الخلايا HepG2، HK2، وحق التعامل مع دينسور، أو rPCSK9، أو سيمفاستاتين في 4.3 h. (أ) HepG2 الخلايا والخلايا HK2 (ب) وحق (ج) الخلايا والخلايا HepG2 (د).
Discussion
في البروتوكول الحالي، ندلل على الاستفادة تصوير الخلية الحية كطريقة جديدة وأكثر فعالية لقياس الوقت الحقيقي LDL الإقبال مر وقت في خطوط الخلايا البشرية المختلفة. ويشيع استخدام الخلايا البشرية سرطان الكبد (HepG2) في دراسات فحص الكولسترول المداواة21،،من2223،24،،من2526، 39،40. لذلك، اخترنا هذا النوع الخلية لاختبار قدرة نظام التصوير خلية حية للدراسات تدفق LDL. نتائجنا تشير إلى أن الخلايا HepG2 متوافقة مع هذه التقنية الجديدة والنتيجة في منحنى سينية مثل يشير إلى امتصاص LDL مستمرة طوال مدة الفحص تدفق حتى ح 4.33 كنقطة نهائية (الشكل 2 ألف و 3 الرقم ).
التوازن الكولسترول يلعب دوراً رئيسيا في الفسيولوجيا المرضية لمختلف نيفروباثيس. والواقع أن تراكم الكولسترول في الأنسجة الكلوية مساهما رئيسيا في التليف الكلوي مما يؤدي إلى أمراض الكلي المزمنة وهو علم أمراض رئيسية في مختلف نيفروباثيس28،،29،،من3031. ومن ثم، قمنا بفحص أسلوبنا في الخلايا الكلوية البشرية الظهارية (HK2) كخط خلية شعبية ويعول عليها تستخدم في مجال أمراض الكلي. لدينا بيانات تؤيد أيضا جدوى نظام التصوير بخلية حية لقياس تدفق الكولسترول في الخلايا HK2. كما هو مبين في الشكل 2ب، والخلايا HK2 تناول الكولسترول خطيا طوال مدة الدراسة تدفق (4 ساعات).
وبسبب أهمية استقلاب الكولسترول في التنمية والتقدم لتصلّب الشرايين32،،من3341، السبب الرئيسي لأمراض القلب والأوعية الدموية، الذي بدوره هو القاتل رقم واحد في العالم 42، نحن تهدف إلى التحقق من صحة أسلوبنا في نوع خلية ذات صلة بتصلب الشرايين. كنا "التاجية الشرايين غشائي الخلايا البشرية" (هكايكس)، أن هذه أحد أنواع الخلية الأولى للتعرض لإهانة الكولسترول في تجويف الشريان التاجي لمريض تصلب الشرايين. البيانات المتوفرة لدينا هو مبين في الشكل 2ج يشير إلى أن هذا الأسلوب تدفق LDL تعمل أيضا بفعالية مع هكايكس. الرسم البياني الناتج منحنى سينية مثل مماثلة لتلك الخلايا HepG2.
لاختبار صلاحية وحساسية هذه المقايسة تدفق LDL محسنة لفحص المركبات التي تؤثر على امتصاص الكوليسترول LDL، استخدمنا ثلاثة عناصر وعوامل خفض امتصاص LDL دينسور و rPCSK9 والمنشط تدفق LDL سيمفاستاتين. هنا، علينا التعامل مع ما ورد أعلاه المذكورة خطوط الخلايا (HepG2 و HK2 وهكايكس) بتركيزات الأمثل من دينسور أو rPCSK9 قبل فحص التدفق. وأظهرت النتائج التي توصلنا إليها أن كل ثلاثة خطوط الخلية اختبار رد على العلاجات مع تخفيضات كبيرة في تدفق LDL مر وقت 4 ساعة (الشكل 2). على سبيل المثال، في ح 4.33 نقطة الوقت النهائي، المعاملة مع دينسور في 40 ميكرومتر يقلل بدرجة تدفق LDL في HepG2 الخلايا والخلايا HK2 وهكايكس من 53 في المائة، ونسبة 68 في المائة و 54 في المائة، على التوالي (ف < 0.0001؛ الشكل 2 أ-ج و الجدول 2 ألف-ج). وباﻹضافة إلى ذلك، تسبب rPCSK9 في 10 ميكروغرام/مل 55% انخفاض ملحوظ في تدفق الكولسترول في الخلايا HK2 (ف < 0.0001؛ الشكل 2 ب و الجدول 2 باء). وعلاوة على ذلك، أظهرت النتائج التي توصلنا إليها أن علاج الخلايا HepG2 مع سيمفاستاتين أدى إلى زيادة ملحوظة في امتصاص LDL (الشكل 3)، دعم حساسية هذا الأسلوب للكشف عن تغييرات كبيرة في تدفق LDL. الدراسات المتعلقة بالمعاملة مع rPCSK9 في خلايا HepG2 وحكاك غير مدرجة في هذا البروتوكول كما rPCSK9 يستخدم كعلاج تحكم إضافية مع النتائج الموثقة توثيقاً جيدا، ولكن مكلف بشراء كميات صغيرة. ولذلك لا يستخدم إلا rPCSK9 للتحقق من صحة هذا البروتوكول في الخلايا HK2.
يعيش خلية التصوير التحليل، جنبا إلى جنب مع قياس التدفق LDL، يسمح للرصد المستمر للصحة ومورفولوجيا الخلايا الوظيفية، وفي الوقت المناسب. ويمكن اكتشاف هذه الميزة كفاءة سيتوتوكسيسيتي المحتملة من المركبات التطبيقية، مما يجعل هذا الأسلوب أسلوباً مثاليا في نفس الوقت رصد النشاط الدوائي وسيتوتوكسيسيتي. الأرقام 5-7 توضيح الصور التمثيلية لثلاثة خطوط الخلية تم اختبارها في نقطة النهاية النهائية (4.33 ح) كمرجع مرئي لتأثير العلاجات على صافي تدفق LDL ويظهر أيضا مورفولوجية صحية من الخلايا التالية تم اختبارها العلاجات. ونحن نوصي التفتيش البصري لجميع الصور من كل بئر ﻹعطاء مورفولوجية حياتي من الخلايا لمدة الدراسة. على سبيل المثال، في البيانات التي لم تظهر عند الصور HepG2 الخلايا تعامل مع 80 ميكرومتر وتم تفتيش دينسور، لاحظنا مؤشرات على الخلية المفرزة حواف الخلايا فيما يبدو أن رفع قبالة اللوحة، مما يشير إلى خلايا مفرزة في تركيزات أعلى من ديناسوري. وعلاوة على ذلك، تركيزات عالية من سيمفاستاتين (3-10 ميكرومترات) أدى أيضا إلى تغير مورفولوجيا يشير إلى فعل المبرمج المبلغ عنها بالنسبة لجرعات عالية من statins45. وكان استخدام هذا البروتوكول للقيام معايرة معاملة دينسور في 20-80 ميكرومتر، وسيمفاستاتين بتركيز 0.5-10 ميكرومترات، عقب الصور خلية كانت تستخدم لتحليل صحة الخلايا وتحديد كتوتوكسيسيتي المحتملة من العلاجات في تركيزات مختلفة. النتائج اقترح استخدام 40 ميكرومتر دينسور و 1 ميكرومتر سيمفاستاتين التركيزات المثلى.
وأخيراً، فإننا نقترح إجراء دراسة معايرة كثافة خلية إذا كان خط خلية آخر اختبار باستخدام هذا الأسلوب من أجل تحديد العدد الأمثل الخلية الواحدة وكذلك للحصول على نتائج متسقة. وأظهرت دراستنا الأمثل كثافة الخلية أن 10,000 الخلايا/بئر في صفيحة 24-جيدا يؤدي إلى LDL تدفق نتائج متسقة للخلايا HK2، وحق. من المهم أن نلاحظ أن لهذه الخلية الحية نظام التصوير باستخدام مقايسة تدفق LDL، أحادي الطبقة خلايا غير روافد موزعة بالتساوي على الآبار مرغوب فيه ككتل من الخلايا يمكن أن تؤدي إلى أخطاء في القيم تدفق LDL تم تسويتها النهائية. السبب في ذلك هو أن لتطبيع تدفق البيانات، مساحة الكائن المرحلة يستخدم كمقياس لكثافة الخلية وهذه المعلمة يمكن أن تتأثر سلبا عندما تتشكل كتل الخلية. لاحظنا أن الخلايا HepG2 لديهم ميل إلى كتل النموذج عندما تبذر في كثافة أعلى من 000 5 خلايا/جيدا مما تسبب في تدفق تتعارض النتائج؛ ولذلك، نحن كخلايا 5,000 كل بئر في لوحة 24-جيدا الكثافة المثلى للخلايا HepG2.
جماعياً، لدينا أسلوب يوفر منبرا متوسطة إلى عالية إنتاجية لفحص النشاط الدوائي وسيتوتوكسيسيتي من المركبات التي تنظم تدفق LDL في نفس الوقت. يمكن أن يكون هذا الأسلوب يسهل تطويعها للاستخدام مع غيرها يغاندس المسمى فلوريسسينتلي الذي أدخل حجرة الليزوزومية تقييم امتصاص يجند في الوقت الحقيقي. بينما يقدم هذا البروتوكول مواصفات إينكوسيتي يعيش التصوير وتحليل النظام، البروتوكول يمكن تكييفها لنظم التصوير البديلة مثل سيلوميكس.
Disclosures
الكتاب يعلن أن لديهم لا تضارب المصالح المالية.
Acknowledgements
هذا العمل كان يدعمها المنح التالية لجامعة الدول العربية: المعهد الوطني للصحة (R56HL132209 و 1R01HL140468) ومعهد بحوث القلب في ميامي. KY مستلم جمعية القلب الأمريكية زمالة بريدوكتورال (18PRE33960070). وقدم الدكتور إيمانويل توماس، جامعة ميامي ميلر مدرسة الطب46،،من4748يرجى HepG2 الخلايا.
Materials
| Name | Company | Catalog Number | Comments |
| pHrodo Red-LDL | ThermoFisher Scientific | L34356 | |
| HepG2 cells | E. Thomas Lab, U. Miami | HB-8065 | |
| MEM | Sigma | M0325 | |
| Sodium Pyruvate | Sigma | P5280 | |
| L-Glutamine 200 mM solution | Sigma | G7513 | |
| FBS | Atlas Biologicals | FP-0500-A | |
| HK2 cells | ATCC | CRL-2190 | |
| Keratinocyte SFM media kit | Gibco | 17005-042 | |
| Primary Coronary Artery Endothelial Cells | ATCC | PCS-100-020 | |
| Vascular Cell Basal Medium | ATCC | PCS-100-030 | |
| Endothelial Cell Growth Kit-VEGF | ATCC | PCS-100-041 | |
| Human Lipoprotein Deficient Serum | Millipore | LP4 | |
| PBS | Sigma | D8537 | |
| Trypsin-EDTA (0.25%) | Gibco | 25200056 | |
| Trypsin-EDTA (0.05%) | Gemini Bio-Products | 400-150 | |
| Trypsin Neutralizing Solution | ATCC | PCS-999-004 | |
| 24 well plate | Falcon | 353226 | |
| 40 μM mesh cell strainer | VWR | 10199-654 | |
| 15 mL conical tubes | VWR | 89039-666 | |
| 50 mL conical tubes | VWR | 89039-658 | |
| Trypan Blue Staining (0.4%) | Life Technologies | T10282 | |
| Counting Slides | Bio-Rad | 145-0011 | |
| Incucyte Zoom | Sartorius | Zoom | Imaging and analysis platform |
| Dynasore Hydrate | Sigma | D7693 | |
| PCSK9 Recombinant Protein | Cayman Chemicals | 20631 |
References
- Baigent, C., et al. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins. Lancet. 366 (9493), 1267-1278 (2005).
- Trevisan, R., Dodesini, A. R., Lepore, G. Lipids and renal disease. Journal of the American Society of Nephrology. 17 (4), Suppl 2 145-147 (2006).
- Tall, A. R., Yvan-Charvet, L. Cholesterol, inflammation and innate immunity. Nature Reviews Immunology. 15 (2), 104(2015).
- Dedoussis, G. V., Schmidt, H., Genschel, J. LDL-receptor mutations in Europe. Human Mutation. 24 (6), 443-459 (2004).
- Sasaki, K., et al. ATP-binding cassette transporter A subfamily 8 is a sinusoidal efflux transporter for cholesterol and taurocholate in mouse and human liver. Molecular Pharmaceutics. , (2018).
- Storch, J., Xu, Z. Niemann-Pick C2 (NPC2) and intracellular cholesterol trafficking. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1791 (7), 671-678 (2009).
- Jansen, P. J., et al. Absence of ApoE upregulates murine brain ApoD and ABCA1 levels, but does not affect brain sterol levels, while human ApoE3 and human ApoE4 upregulate brain cholesterol precursor levels. Journal of Alzheimer's Disease. 18 (2), 319-329 (2009).
- Girard, E., et al. The dynamin chemical inhibitor dynasore impairs cholesterol trafficking and sterol-sensitive genes transcription in human HeLa cells and macrophages. PLoS One. 6 (12), 29042(2011).
- Robinet, P., et al. Dynamin is involved in endolysosomal cholesterol delivery to the endoplasmic reticulum: role in cholesterol homeostasis. Traffic. 7 (7), 811-823 (2006).
- Macia, E., et al. Dynasore, a cell-permeable inhibitor of dynamin. Developmental Cell. 10 (6), 839-850 (2006).
- Benjannet, S., et al. NARC-1/PCSK9 and its natural mutants: zymogen cleavage and effects on the LDLR and LDL-cholesterol. Journal of Biological Chemistry. , (2004).
- Qian, Y. -W., et al. Secreted PCSK9 downregulates low density lipoprotein receptor through receptor-mediated endocytosis. Journal of Lipid Research. 48 (7), 1488-1498 (2007).
- Brown, M. S., Goldstein, J. L. A receptor-mediated pathway for cholesterol homeostasis. Science. 232 (4746), 34-47 (1986).
- Goldstein, J. L., Brown, M. S. History of discovery: the LDL receptor. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (4), 431(2009).
- Stephan, Z. F., Yurachek, E. C. Rapid fluorometric assay of LDL receptor activity by DiI-labeled LDL. Journal of Lipid Research. 34 (2), 325-330 (1993).
- Fisher, T. S., et al. Effects of pH and low density lipoprotein (LDL) on PCSK9-dependent LDL receptor regulation. Journal of Biological Chemistry. 282 (28), 20502-20512 (2007).
- Atrahimovich, D., Khatib, S., Sela, S., Vaya, J., Samson, A. O. Punicalagin induces serum low-density lipoprotein influx to macrophages. Oxidative Medicine and Cellular Longevity. 2016, (2016).
- Xu, M., et al. δ-Tocopherol reduces lipid accumulation in Niemann-Pick type C1 and Wolman cholesterol storage disorders. Journal of Biological Chemistry. 112, (2012).
- Bonilla, D. L., et al. Autophagy regulates phagocytosis by modulating the expression of scavenger receptors. Immunity. 39 (3), 537-547 (2013).
- Guo, M., et al. Apelin-13 Decreases Lipid Storage in Hypertrophic Adipocytes In vitro Through the Upregulation of AQP7 Expression by the PI3K Signaling Pathway. Medical Science Monitor : International Medical Journal of Experimental and Clinical Research. 20, 1345-1352 (2014).
- Guillemot, J., Asselin, M. C., Susan-Resiga, D., Essalmani, R., Seidah, N. G. Deferoxamine stimulates LDLR expression and LDL uptake in HepG2 cells. Molecular Nutrition & Food Research. 60 (3), 600-608 (2016).
- Javitt, N. B. Hep G2 cells as a resource for metabolic studies: lipoprotein, cholesterol, and bile acids. The FASEB Journal. 4 (2), 161-168 (1990).
- Mullen, P. J., Lüscher, B., Scharnagl, H., Krähenbühl, S., Brecht, K. Effect of simvastatin on cholesterol metabolism in C2C12 myotubes and HepG2 cells, and consequences for statin-induced myopathy. Biochemical Pharmacology. 79 (8), 1200-1209 (2010).
- McNutt, M. C., et al. Antagonism of secreted PCSK9 increases low density lipoprotein receptor expression in HepG2 cells. Journal of Biological Chemistry. 284 (16), 10561-10570 (2009).
- Scharnagl, H., et al. Effect of atorvastatin, simvastatin, and lovastatin on the metabolism of cholesterol and triacylglycerides in HepG2 cells. Biochemical Pharmacology. 62 (11), 1545-1555 (2001).
- Scharnagl, H., et al. The effects of lifibrol (K12. 148) on the cholesterol metabolism of cultured cells: evidence for sterol independent stimulation of the LDL receptor pathway. Atherosclerosis. 153 (1), 69-80 (2000).
- Chan, J. C., et al. A proprotein convertase subtilisin/kexin type 9 neutralizing antibody reduces serum cholesterol in mice and nonhuman primates. Proceedings of the National Academy of Sciences. 106 (24), 9820-9825 (2009).
- Ding, W., et al. Osteopontin deficiency ameliorates Alport pathology by preventing tubular metabolic deficits. JCI Insight. 3 (6), (2018).
- Herman-Edelstein, M., Scherzer, P., Tobar, A., Levi, M., Gafter, U. Altered renal lipid metabolism and renal lipid accumulation in human diabetic nephropathy. Journal of Lipid Research. 55 (3), 561-572 (2014).
- Su, H., et al. Lipid Deposition in Kidney Diseases: Interplay Among Redox, Lipid Mediators, and Renal Impairment. Antioxidants & Redox Signaling. 28 (10), 1027-1043 (2018).
- Agrawal, S., Zaritsky, J. J., Fornoni, A., Smoyer, W. E. Dyslipidaemia in nephrotic syndrome: mechanisms and treatment. Nature Reviews Nephrology. 14 (1), 57(2018).
- Babiak, J., Rudel, L. L. Lipoproteins and atherosclerosis. Baillieres Clinical Endocrinology and Metabolism. 1 (3), 515-550 (1987).
- Wang, H. H., Garruti, G., Liu, M., Portincasa, P., Wang, D. Cholesterol and Lipoprotein Metabolism and Atherosclerosis: Recent Advances in Reverse Cholesterol Transport. Annals of Hepatology. 16 (1), 28-42 (2018).
- Preta, G., Cronin, J. G., Sheldon, I. M. Dynasore-not just a dynamin inhibitor. Cell Communication and Signaling. 13 (1), 24(2015).
- Horton, J. D., Cohen, J. C., Hobbs, H. H. Molecular biology of PCSK9: its role in LDL metabolism. Trends in Biochemical Sciences. 32 (2), 71-77 (2007).
- Abifadel, M., et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nature Genetics. 34 (2), 154(2003).
- Goldstein, J. L., Brown, M. S. Regulation of the mevalonate pathway. Nature. 343 (6257), 425(1990).
- Dong, B., Wu, M., Cao, A., Li, H., Liu, J. Suppression of Idol expression is an additional mechanism underlying statin-induced up-regulation of hepatic LDL receptor expression. International Journal of Molecular Medicine. 27 (1), 103-110 (2011).
- Song, K. H., Kim, Y. H., Im, A. -R., Kim, Y. H. Black Raspberry Extract Enhances LDL Uptake in HepG2 Cells by Suppressing PCSK9 Expression to Upregulate LDLR Expression. Journal of Medicinal Food. , (2018).
- Chan, J. C., et al. A proprotein convertase subtilisin/kexin type 9 neutralizing antibody reduces serum cholesterol in mice and nonhuman primates. Proceedings of the National Academy of Sciences of the United States of America. 106 (24), 9820-9825 (2009).
- Tabas, I., Williams, K. J., Borén, J. Subendothelial lipoprotein retention as the initiating process in atherosclerosis: update and therapeutic implications. Circulation. 116 (16), 1832-1844 (2007).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2017 update: a report from the American Heart Association. Circulation. 135 (10), 146-603 (2017).
- Brown, M. S., Goldstein, J. L. The SREBP pathway: regulation of cholesterol metabolism by proteolysis of a membrane-bound transcription factor. Cell. 89 (3), 331-340 (1997).
- Horton, J. D., Goldstein, J. L., Brown, M. S. SREBPs: activators of the complete program of cholesterol and fatty acid synthesis in the liver. The Journal of Clinical Investigation. 109 (9), 1125-1131 (2002).
- Tavintharan, S., et al. Reduced mitochondrial coenzyme Q10 levels in HepG2 cells treated with high-dose simvastatin: A possible role in statin-induced hepatotoxicity. Toxicology and Applied Pharmacology. 223 (2), 173-179 (2007).
- Thomas, E., et al. HCV infection induces a unique hepatic innate immune response associated with robust production of type III interferons. Gastroenterology. 142 (4), 978-988 (2012).
- Thomas, E., Liang, T. J. Experimental models of hepatitis B and C-new insights and progress. Nature Reviews Gastroenterology & Hepatology. 13 (6), 362(2016).
- Yoneda, M., et al. Hepatitis B Virus and DNA Stimulation Trigger a Rapid Innate Immune Response through NF-κB. The Journal of Immunology. , 1502677(2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved