Method Article
عزل واحد المجتمعات البكتيرية داخل الخلايا التي تم إنشاؤها من نموذج موريني لعدوى المسالك البولية لتحليل خلية واحدة أسفل المجرى
In This Article
Summary
ويصف هذا البروتوكول طريقة بسيطة لعزل الخلايا الظهارية واحد، وإصابة المثانة من طراز مورين من عدوى المسالك البولية.
Abstract
في هذه المقالة، نحن مخطط إجراء المستخدم لعزل فرادى المجتمعات البكتيرية داخل الخلايا من ماوس التي قد أصيبوا بالعدوى تجريبيا في المسالك البولية. يمكن تقسيم البروتوكول إلى ثلاثة أقسام: العدوى، وحصاد الخلايا الظهارية المثانة، والفم ميكروبيبيتينج لعزل الخلايا الظهارية المصابة الفردية. الخلية الظهارية معزولة تحتوي على خلايا جرثومية قادرة على البقاء وتقريبا خالية من تلوث البكتيريا خارج الخلية، مما يجعله مثاليا لتحليل خلية واحدة أسفل المجرى. الوقت المستغرق من بداية الإصابة للحصول على مجتمع البكتيريا داخل الخلايا واحد حوالي 8 ساعات. غير مكلفة لنشر هذا البروتوكول ويستخدم مواد متاحة على نطاق واسع، ونحن نتوقع أنها أيضا يمكن أن تستخدم في نماذج أخرى من العدوى عزل الخلايا المصابة واحدة من الخلائط الخلية حتى لو كانت تلك الخلايا المصابة نادرة. ومع ذلك، نظراً لخطر محتمل في الفم ميكروبيبيتينج، هذا الإجراء لا ينصح للعوامل المعدية جداً.
Introduction
التهابات المسالك البولية (UTIs) واحدة من حالات العدوى البكتيرية الأكثر شيوعاً. من المتوقع أن تجربة واحدة على الأقل عدوى المسالك البولية (UTI) خلال بهم العمر1ما يقدر 40-50 ٪ من النساء. أحد العوامل الرئيسية ل UTI أوروباثوجينيك كولاي (أبيك)، التي تمثل أكثر من 70% من غير معقدة يوتيس2. وعلاوة على ذلك، سوف يكون الربع تقريبا من أولئك الذين لديهم UTI عدوى متكررة، غالباً بسبب نفس السلالة، على الرغم من العلاج بالمضادات الحيوية المناسبة3. ارتفاع عدد حالات UTI يمثل عبئا كبيرا على أنظمة الرعاية الصحية، تكلف أكثر من $ 2 بیلیون في السنة في الولايات المتحدة4. وعلاوة على ذلك، يؤدي استخدام المضادات الحيوية لعلاج يوتيس أيضا إلى ارتفاع معدلات المقاومة للمضادات الحيوية، وهو قلق رئيسيا لصحة العامة5.
ولذلك، وضعت جهدا كبيرا في فهم الآليات التي يصيب أبيك المسالك البولية، فضلا عن قدرته على تسبب التهابات متكررة6،،من78. على وجه الخصوص، قد استخدمت نموذج الفأر من العدوى لدراسة خصائص البكتيريا والمضيفة التي تسهم UTI8. هذا نموذج الفأر قد يعود بالنفع قابلة للتطبيق لسلالات السريرية غير معدلة المعزولة من المرضى البشر. كما أدى هذا النموذج إلى اكتشاف مسارات البكتيرية دروجابل محتملة هامة لإنشاء UTI، مثل النوع 1 الهياكل9 والحديد اقتناء نظم10.
بالمقارنة مع هذه النجاحات في دراسة الأحداث المبكرة في UTI، معرفة الآليات الكامنة وراء UTI المتكررة تزال مفتقدة11. فرضية واحدة هي أن أبيك يتهرب من العلاج بالمضادات الحيوية، ويسبب التهابات متكررة في المثانة عن طريق تشكيل المجتمعات داخل الخلايا البكتيرية (الحاويات) داخل الخلايا الظهارية المثانة. الحاويات قد حددت في نماذج مورين من العدوى وفي البشرية UTI المرضى12،13. ارتبط وجود حاويات السوائب الوسيطة في عينات البول من المرضى UTI الأطفال مع ارتفاع معدلات تكرار14،15. ومع ذلك، عزل حاويات السوائب الوسيطة ودراسة البكتيريا داخلها قد ثبت أن تحديا من الناحية التقنية نظراً لندرة بهم؛ يقدر أن مثانة مورين مصابة عادة فقط لديها 10 100 حاويات السوائب الوسيطة16. وعلاوة على ذلك، تكون الخلايا الظهارية المثانة كبيرة نسبيا (50-120 ميكرومتر)17، مما يجعل من تحدي لنشر الأسفار بمساعدة الخلية الفرز (نظام مراقبة الأصول الميدانية) نظراً لأن نموذجية نظام مراقبة الأصول الميدانية فوهات مصممة مع أقطار 70 ميكرومتر أو 100 ميكرومتر. وبالتالي، غالباً ما تتم إزالة خلايا كبيرة مثل الخلايا الظهارية المثانة عن طريق الترشيح من قبل نظام مراقبة الأصول الميدانية لتجنب انسداد في فلويديكس.
ووصف لدينا مختبر مؤخرا طريقة عامة واقتصادا لعزل الخلايا المصابة نادرة من الخلائط مثل كشط الخلايا الظهارية من المثانة18. لعزل فعال حاويات السوائب الوسيطة، استخدمنا بيبيتينج الفم التقليدية. ميكروبيبيتينج الفم هو أسلوب الذي تم استخدامه منذ وقت طويل ميكرومانيبوليشن من الخلايا المفردة والأجنة لأغراض التحليل المصب19،20،21،،من2223، 24 , 25-بيبيتينج الفم التقليدية كميات سائلة كبيرة (في ملليلتر) كثيرا ما كان السبب المختبرية المتعلقة بالحوادث، والتقنية قد تم منبوذة عن حق بكثير من مجتمع البحث خارج علم الأجنة التقليدي و تطبيقات خلية مفردة. لدينا بروتوكول مستوحاة من الإصدارات خلية واحدة فقط من هذا الأسلوب19،20، التي تخفف من المخاطر بتوفير مخزن كبير (> 2 مل) نقل جوي بين الباحث وعينه مقارنة بحجم السائل (< 1 ميليلتر). يأخذ هذا الأسلوب أيضا ميزة التحكم غرامة هذا الفم ويوفر ميكروبيبيتينج، الذي يترجم إلى وحدة تخزين نهائي منخفضة المحيطة بالحل نقل ودرجة نقاء عالية من الخلايا المعزولة. الأسلوب الذي يستخدم مواد غير مكلفة (< 50 دولار)، وهكذا ينبغي أن يكون ممكناً تنفذ في جميع مختبرات.
ويصف هذا البروتوكول البصرية لدينا تقنية عزل الحاوية، توفير مرجع لمساعدة الباحثين الآخرين تسعى إلى تكرار هذا الأسلوب. الباحث بحاجة للوصول إلى مجهر تشريح الفلورسنت (أو معدات مماثلة) التي يمكن استخدامها لوضع تصور الخلايا الظهارية الفردية والبكتيريا الفلورسنت أثناء التصوير الحي، مع مرحلة تصوير مفتوحة ويمكن الوصول إليها من أجل ميكروبيبيتينج (انظر الجدول للمواد للاطلاع على تفاصيل المجهر المستخدمة، على الرغم من أن نماذج يعادل أداة أخرى يمكن أن تستخدم أيضا). بينما سيركز هذا البروتوكول على الحاويات في نموذج مورين UTI، ينبغي أن تكون أساليب مماثلة تنطبق على عزل الخلايا المصابة من تعليق خلية في نماذج أخرى من العدوى.
Protocol
عليها جميع الأساليب الموصوفة هنا فيما يتعلق بالتعامل مع الحيوانات "رعاية الحيوان المؤسسية" واستخدام اللجنة (إياكوك) من معهد الجينوم بسنغافورة ومركز الموارد البيولوجية للوكالة للعلوم والتكنولوجيا والبحوث، وسنغافورة.
1-الماوس العدوى
-
إعداد الشعيرات الزجاجية
- ضوء مصدر لهب المكشوف (موقد بنسن أو موقد الكحول).
- عقد زجاج الشعرية مع اثنين من الأيدي معسر بقوة كلا الطرفين، ثم حرارة في منتصف الأنبوب بالتساوي حتى يذهب لينة الزجاج. تدوير شعري بلطف ذهابا وإيابا على طول محورها، للمساعدة في تدفئة حتى من الزجاج.
- إزالة شعري الزجاج من مصدر الحرارة وفورا سحب يديه عن بعضها البعض، مع الحفاظ على قبضة على طرفي الأنبوب. طول شعري سحبت النهائي المثالي 3-5 سم أطول من شعري أونبوليد ضمان قطرها داخلي مناسب لعزل الخلايا الظهارية المثانة واحد.
تنبيه: الأنبوب لا تزال ساخنة للغاية لفترة من الزمن، حتى جانبا الشعرية على سطح الحرارة الآمنة لبضع دقائق لتبرد قبل المتابعة إلى الخطوة التالية. - تحقق لمعرفة إذا كان قد أصبح منتصف شعري الزجاج أضيق (الشكل 1أ)، وأن الجزء الداخلي الأنبوب ما زال جوفاء (الشكل 1ب). لمزيد من العزلة للحاويات، تتحمل حجم 200-400 ميكرون قابل للاستخدام.
- اختر واحدة من نهاية شعري سحبت يد واحدة. عقد زوج من الملقط باليد الأخرى، واستخدامه لالتقاط الزجاج سحبت شعري في أضيق نقطة. ضمان أن تكون تمارس الملقط مع ما يكفي من القوة لقبضة شعري بشدة دون سحق.
- تستخدم حركة اللف سريع من جهة عقد الملقط انجذاب الشعرية سحبت في أضيق نقطة لإنشاء فم ميكروبيبيتينج الشعرية.
ملاحظة: استخدام الأصابع بدلاً من الملقط أيضا مقبولة، طالما يتم استخدام الحماية الكافية من شظايا الزجاج. - كرر الخطوات 1.1.2-1.1.6 على الأقل 4 x أكثر لإنتاج الشعيرات الدموية ميكروبيبيتينج قطع الغيار الكافية وتوفير طائفة من أقطار لعزل الحاوية. إذا كان من المتوقع أكثر من الإصابة بمجموعة، إعداد 5 الشعيرات الدموية ميكروبيبيتينج إضافية لكل مجموعة إضافية من الإصابة.
تنبيه: لا تنسى أن إيقاف اللهب المكشوف. - ضع الشعيرات الدموية سحبت في 100 مم طبق بيتري ويعرض الطبق للأشعة فوق البنفسجية لمدة 30 دقيقة لتعقيم الشعيرات الدموية.
- استبدال الغطاء على طبق بيتري بعد الأشعة فوق البنفسجية تعقيم وتخزين طبق بيتري مع الشعيرات الدموية في درجة حرارة الغرفة.
-
إعداد القسطرة قبل الإصابة
- إعداد القسطرة البولية للإصابة كما هو موضح في هونغ et al.8 وكونوفر et al.26 يوم واحد على الأقل قبل الإصابة.
-
إعداد الفلورسنت أوروباثوجينيك كولاي الثقافة
- تنمو أوروباثوجينيك الإعراب عن fluorophore المحدد البكتيرية سلالة وفقا للبروتوكولات المعمول بها.
ملاحظة: خيارات الضغط و fluorophore يعتمد إلى حد كبير على المجهر والسلالات المتوفرة في مختبرات الفردية. في هذا المثال، أننا نستخدم سلالة مشتقة من UTI89، وعزل سريرية أصلاً من مريض مع التهاب المثانة المتكررة. وهذا الضغط، سلك-638، يحمل بلازميد (بسلك-77) الذي يعبر عن المقاومة فسفجفب-9 وكاناميسين18. 638-سلك يزرع في مرق LB عند 37 درجة مئوية وتستكمل مع 50 ميكروغرام/مل كاناميسين. - خط سلالة سلك-638 على لوريا بيرتاني (رطل)-لوحة أجار تستكمل مع 50 ميكروغرام/مل كاناميسين. احتضان لوحة عند 37 درجة مئوية بين عشية وضحاها.
- (اختياري) عرض اللوحة على مجهر تشريح لتأكيد التعبير عن علامات مضيئة قبل اختيار مستعمرة.
- استخدام حلقة تلقيح البكتيري، نقل المستعمرة المحدد قارورة مخروطية الشكل 125 مل مع 10 مل مرق LB تستكمل مع 50 ميكروغرام/مل كاناميسين. احتضان قارورة بشكل ثابت في 37 درجة مئوية ح 24.
- ثقافة فرعية تكمل البكتيريا من هذا قارورة بأخذ 10 ميليلتر للثقافة من قارورة واذابته في 10 مل مرق LB مع 50 ميكروغرام/مل كاناميسين في قارورة جديدة 125 مل (تخفيف 1: 1000). احتضان هذا قارورة الثانية بشكل ثابت في 37 درجة مئوية لآخر 24 ساعة.
- تدور أسفل ثقافة البكتيرية لمدة 5 دقائق في 5,000 س ز و 4 درجة مئوية.
- صب المادة طافية وريسوسبيند بيليه البكتيرية في برنامج تلفزيوني الباردة OD600 من 0.5.
ملاحظة: على الرغم من أنها يمكن أن تختلف من ثقافة إلى ثقافة، يعطي 1 مل الثقافة ثابتة عادة حوالي 4-5 مل OD600 = 0.5 ثقافة البكتيرية. الحجم الإجمالي للعدوى البكتيرية اللازمة لكل سلالة يمكن حسابها كما يلي: 50 ميليلتر مطلوب لكل الماوس ومطلوب 50 ميليلتر لملء رأس إبرة. ينصح إضافي 10-20 ٪ (الحد الأدنى من 50 ميليلتر) للعدوى لحساب حجم القتلى في المحاقن. - استخدام خليط البكتيرية المتبقية لتحديد عيار الإصابة كما هو موضح في هونغ et al.8.
ملاحظة: هذه الخطوة قد يتأخر لعدة ساعات عن طريق تخزين الخليط البكتيرية في 4 درجات مئوية.
- تنمو أوروباثوجينيك الإعراب عن fluorophore المحدد البكتيرية سلالة وفقا للبروتوكولات المعمول بها.
-
نموذج مورين من عدوى المسالك البولية
- تصيب الفئران كما وصفها هونغ et al.8، مع مجموعة تجريبية واحدة لكل سلالة كولاي الفلورسنت مثقف في الفرع 1-3.
ملاحظة: انظر أيضا كونوفر et al.26 للمساعدة البصرية. - ملاحظة وقت التلقيح البكتيري للماوس أو قفص.
- تكرار الالتهابات للمجموعة التجريبية بأكملها.
ملاحظة: يمكن إعادة استخدام القسطرة العدوى لجميع الفئران في نفس المجموعة. - كرر الخطوات 1.4.1-1.4.3 لكل مجموعة تجريبية المخطط، ضمان أن القسطرة الطازجة وهلام زيوت التشحيم الجديدة مستعدة لكل مجموعة.
ملاحظة: للتجارب مع عدد كبير من الحيوانات، فمن الأفضل لتقسيم الحيوانات إلى مجموعات من خمسة ومذهلة العدوى مثل أن كل مجموعة إصابة حوالي 30 دقيقة إلى ح 1 عن بعضها البعض. وهذا سيوفر الوقت الكافي للخطوات التالية (المادتان 2 و 3).
- تصيب الفئران كما وصفها هونغ et al.8، مع مجموعة تجريبية واحدة لكل سلالة كولاي الفلورسنت مثقف في الفرع 1-3.
2-المثانة الخلايا الظهارية الحصاد للحصول على تعليق خلية
-
الحصاد وعكس قربه موريني
- إعداد ثلاثة أنابيب مخروطية 50 مل مليئة 45 مل إيثانول 70% لتعقيم المعدات الجراحية.
- إلى اثنين من أنابيب إعدادها في الخطوة 2.1.1، ضع مقص وزوج من الملقط كل. ضع اثنين من أزواج من الملقط (واحد يفضل أن يكون أضيق ومع تلميح مدورة، لانعكاس المثانة) في الأنبوب الثالث.
ملاحظة: سيتم استخدام الأدوات الموجودة في الأنبوب الأول في المنطقة الخارجية، سيتم استخدام الأدوات في الثاني في حصاد المثانة، واثنين من الأزواج من الملقط في أنبوب آخر سوف تستخدم في انعكاس المثانة. - في ح 6 بعد الإصابة، euthanize الفئران المصابة وفقا للبروتوكولات IACUC المعمول بها في المؤسسة.
ملاحظة: لدينا بروتوكول IACUC تدعو للقتل الرحيم عبر عنق الرحم التفكك إجراء بينما الفأر تحت التخدير (إيسوفلوراني). - وضع الحيوانات مسطحة على ظهورهم واستخدام زجاجة رذاذ مليئة الإيثانول 70% لتعقيم منطقة البطن.
- استخدام زوج من ملقط ومقص جراحي من الأنبوب الأول (تم إعداده في الخطوة 2.1.2)، فتح جعل شق عرضية صغيرة على الجلد حوالي 1 سم فوق الاحليل. قم بتوسيع شق قطرياً نحو أطرافه العلوية من الماوس، خلق قطع على شكل V على طول الكامل الأمامي من الماوس الذي يعرض محتويات الصفاق. ضمان أن المقص أثناء هذه العملية، لا تقطع عن طريق الأمعاء للماوس (الشكل 2أ، ب).
- قم بالتبديل إلى المجموعة الثانية من الأدوات (أعد الخطوة 2.1.2). استخدام شفرات مقص أو مهاوي الملقط، دفع برفق أسفل على منصات الدهون قرب منطقة الحوض من الماوس.
ملاحظة: هذه الخطوة الأسباب المثانة نتا إلى الخارج، ويضمن الرؤية للحصاد. - قبضة المثانة عرضه على القمة مع زوج من الملقط (الشكل 2-ج).
- حفظ من أحكام قبضتهم على قمة المثانة مع الملقط، قص والمثانة من بقية الحيوانات (قطع الحالب والإحليل بعيداً) مجاناً باستخدام المقص الجراحي. لا الملقط عقد المثانة بعد الإفراج.
- التبديل من المقص إلى الملقط مدورة أضيق من الثالثة المخروطية أنبوب (من الخطوة 2.1.2)، وإدراج غيض شافت واحد من الملقط مدورة في افتتاح المثانة حيث أنه كان مجرد قص في الخطوة السابقة (الشكل 2د). مع طرف الملقط مدورة إدراجها بأمان في افتتاح المثانة، إطلاق سراح زوج الملقط تجتاح تتويجا للمثانة وإعادته إلى الأنبوب مخروطية الشكل الثاني.
- استخدام الزوج الثاني من الملقط من الأنبوب الثالث، بلطف بدوره المثانة "الداخل إلى الخارج"، أولاً سحب نهاية خارج من فم المثانة بعيداً عن الملقط مدورة (الشكل 2د، السهم 1) وتوجيه ذلك حولها وعلى طرف آخر ملقط مدورة (الشكل 2د، السهم 2).
ملاحظة: ويمكن تشبيه الإجراء إلى إزالة جورب من قدم واحدة وسحبه على الآخر.- أثناء عملية انعكاس، الحفاظ على الزوج تقريب أولى الملقط مغلقة تماما تقريبا. هذا يوفر ما يكفي حرية الحركة لسحب المثانة من المنجم الأول لتقريب الملقط، ولكن أيضا يجلب رمح الثانية من الملقط تقريب أقرب إلى الأول ويسمح للمثانة يمكن نقلها بسهولة. النتيجة النهائية لهذه الخطوة أن تنتهي المثانة حتى يجري مقلوب وعلى طرف الفتحة الثانية للزوج الأول من الملقط (الشكل 2ه).
- استخدام الزوج الثاني من الملقط، بلطف إقناع المثانة المقلوب الملقط في 1 مل من برنامج تلفزيوني الباردة.
ملاحظة: (اختياري) وهذا هو الوقت المناسب لالتقاط صور لكامل مقلوب، المثانة المصابة لمراقبة التردد العام وتوزيع الحاويات، إذا كان هناك أي.
- كرر الخطوات 2.1.1-2.1.10 لكل المثانة في المجموعة التجريبية (بحد أقصى خمس الحيوانات).
-
إلغاء الخلايا الظهارية المثانة
- استخدام اثنين تنظيف أزواج من الملقط، وكشط بلطف خارج المثانة المقلوب (وهي طبقة الخلايا الظهارية الداخلية). يجب أن تظهر برنامج تلفزيوني المحيطة غموضاً كإلغاء العائدات وتطلق الخلايا الظهارية في حل برنامج تلفزيوني.
- (اختياري) بصريا وتؤكد أن إلغاء المثانة قد أطلق الخلايا إلى الحل باستخدام مجهر تشريح. الشكل 3 أ، ب.) يجب أن تظهر برنامج تلفزيوني غائم بالعين المجردة، ويمكن رؤية المثانة الفردية كشط الخلايا الظهارية في 10 x التكبير.
- كرر الخطوات 2.2.1-2.2.2 لكل المثانة المقطوع من الخطوة 2، 1.
3-داخل الخلايا عزلة المجتمع البكتيرية (IBC): "بيبيتينج الفم للحاويات"
ملاحظة: وقد خضع جميع الأساليب الموصوفة في هذا المقطع تقييم مخاطر مؤسسية. بيبيتينج الفم يحمل الخطر الملازم لابتلاع الحل الذي يجري نقله. هو تخفيف هذا الخطر إلى حد كبير خلال نانولتر وحدات التخزين التي تستخدم هذا البروتوكول، ومن المستحسن أن كافة المستخدمين من الدفع لبروتوكول تصغي إلى النهج الوقائي وتلاحظ الممارسة المذكورة هنا، وفي المناقشة.
-
وقد تم كشط بعد الخلايا في برنامج تلفزيوني، قم بإعداد الجهاز ميكروبيبيتينج الفم (الشكل 3ج).
- إدراج نهاية أكثر سمكا من الزجاج سحبت الشعرية (نهاية أونبوليد) في سد المطاط (نهاية بيضاء) أنبوب المضخة.
- إدراج نهاية ضيقة من طرف ماصة 1 مل في الآخر (أحمر) فتح أنبوب المضخة، ضمان أن يكون هناك تناسب ضيق.
- إدراج نهاية 2 مل يسفط ماصة في نهاية مفتوحة، أوسع من طرف ماصة 1 مل الضيقة، ضمان مرة أخرى أن هناك ضيق صالح.
ملاحظة: يسمح الإعداد الناتجة الباحث بالفم ماصة من نهاية ماصة يسفط بإنشاء قوة شفط لطيف من نهاية الأنبوبة الشعرية في الجانب الآخر جهاز الضيقة أوسع وفتح. - اختبار جهاز ميكروبيبيتينج الفم النهائي باستخدام طبق بيتري 100 ملم التي تحتوي على المياه العذبة. ينبغي زيادة مستوى السائل في شعري إجراء شفط طفيف في النهاية المفتوحة ماصة يسفط (مشابهة ليحتسي على مشروب من خلال القش)، ولكن لا تتسبب المياه تجاوز السعة في أنبوب المضخة. استخدام يدا واحدة للتحكم في الأنبوبة الشعرية، بينما تستخدم اليد الأخرى لضبط موضع طبق بيتري.
ملاحظة: سوف تختلف قوة الشفط اللازمة للفم بيبيتينج الحَوسة واحدة بين الباحثين. ومع ذلك، من المستحسن أن كل باحث يحاول هذا الأسلوب تبدأ شفط ضعيفة وزيادة ببطء إذا كان يتدفق السائل لا يصل الشعرية. ليس هناك حاجة لقوة أكبر من مص على القش للشرب. إذا لم يظهر شعري التقاط السائل أثناء الاختبار في الخطوة 3.1.4، من الممكن أن الشعرية أو أنبوب يسفط هو تغطي ويحتاج إلى استبداله. من المستحسن كذلك أن جميع الباحثين أول الممارسة الجديدة التحكم بالشفط في الجهاز بيبيتينج الفم باستخدام تعقيم المياه. بالإضافة إلى ذلك، لاحظ أن عنصر التحكم لوحدة التخزين بجهاز بيبيتينج الفم، عن طريق استخدام اللسان للباحث. اللسان يمكن ناعما ضبط قوة الشفط تطبيقها، فضلا بمثابة توقف لحالات طوارئ. - بعد تحقيق نجاح امتصاص السائل، اختبار القدرة على طرد من شعري واسطة النفخ برفق في النهاية المفتوحة ماصة يسفط. ضمان أن يتم إنشاء لا فقاعات عملية طرد السائل لمنع تلوث الحاويات الوسيطة خلال الخطوة 3.5.
ملاحظة: كما ستختلف مع الشفط، قوة الضغط الإيجابي التي يطبقها الباحث بطرد الحَوسة في أنبوب الطرد المركزي بين الباحثين. من المستحسن للباحثين جديدة إلى هذا البروتوكول إلى ممارسة الخطوة 3.1 بضعة أيام قبل الإصابة الفعلية. اقتراح واحد لممارسة الفم ميكروبيبيتينج ممارسة نقل كميات صغيرة من الماء المعقم مختلطة مع بضع قطرات من صبغة الطعام (للرؤية) باستخدام جهاز ميكروبيبيتي الفم.
- وضع تعليق خلية كشط تحت مجهر تشريح وتحديد الحاويات الوسيطة كمجاميع الفلورسنت كبيرة (الشكل 3أ، ب). نطاق التكبير المثالي هو x 20-40. تراجع نهاية غرامة من الزجاج الشعرية في أنبوب جديد لبرنامج تلفزيوني عن 1 s لتقليل امتصاص حجم غير المرغوب فيها من خلال عمل شعري.
- ابحث عن طريق المجهر، تحديد الحاوية للفائدة وجلب النهاية المفتوحة للأنبوبة الشعرية تجاه الحَوسة ببطء. استخدام نهاية الزجاج الشعرية الجميلة لاكتساح خلايا إضافية قرب كل الحَوسة لمنع تطلع خليتين أو أكثر، أو لكسر عدا المجاميع أكبر من الخلايا.
- بينما كانوا يبحثون عن طريق المجهر، تطبيق قوة شفط صغيرة جداً في نهاية بكثير (يسفط ماصة) جهاز ميكروبيبيتينج الفم لإرشاد الحَوسة إلى الشعرية الزجاج.
- بعد التقاط الحاوية، نقل الشعرية إلى أنبوب الطرد مركزي فارغة 1.5 مل وتطبيق ضغط إيجابي طفيف طرد الحبرية والحاوية في أنبوب الطرد المركزي (الشكل 3د).
- كرر الخطوات من 3، 3، 3-6 في العديد من حاويات السوائب الوسيطة اللازمة من المثانة الحالية، قبل الشروع في المثانة القادم. تغيير يسفط الماصات والشعيرات الدموية في كثير من الأحيان لمنع تراكم اللعاب.
تنبيه: عند العمل مع سلالات البكتيريا المعدية (أو السريرية)، باستمرار رصد مستوى الحل في شعري. لا تدع مستوى السائل يجري تجاوز بيبيتيد من الحافة من شعري في أنبوب المضخة. في حالة حدوث ذلك، فورا قم بالتبديل إلى أنبوب المضخة مختلفة، وتجاهل المجموعة السابقة حتى. - كرر الخطوات 3.2-3.6 على جميع الخزانات المقطوع، أو حتى تم جمع عدد كاف من العينات البيولوجية للمجموعة التجريبية.
- (اختياري) كرر الخطوات من 3.6 و 3.7 حتى جميع تجريبية مجموعات (أو الفئران) قد تم euthanized وعينات بيولوجية كافية قد تم حصادها من كل مجموعة.
النتائج
وبصرف النظر عن تأكيد وجود الحَوسة معزولة وحيدة في أنبوب جمع عبر مجهر تشريح (الشكل 3د)، يمكن أيضا تأكيد نقاء الحَوسة معزولة بالفحص المجهري [كنفوكل]. كما هو موضح في الشكل 4أ، الخلايا المعزولة أن وصمة عار لكل من كولاي وأوروبلاكين، والحجم المتوقع للحاويات (50-120 ميكرومتر)17. وعلاوة على ذلك، تلطيخ كولاي غير موجودة في السائل المحيطة بها. استناداً إلى البيانات المتوفرة لدينا، أكثر من 90% خلايا المعزولة بهذا الأسلوب هي حاويات السوائب الوسيطة18. بعد عزل، يمكن تأكيد وجود وبقاء الخلايا البكتيرية في الحاوية الفردية عن طريق مستعمرة تشكيل وحدة (زيمبابوي) التعداد (الشكل 4ب) أو الكمية تفاعل البوليميراز المتسلسل (qPCR) لمعادلات الجينوم ( الشكل 4 ج). كما يوضح الشكل 4ج أن الخلايا الظهارية مصابة معزولة مع البروتوكول نفسه لا تملك المبالغ القابلة للقياس الكمي للبكتيريا. استناداً إلى هذه البيانات، فإننا نقدر أن طائفة كفوس في الحَوسة واحد هو 102-103 في نموذج مورين من عدوى المسالك البولية. أحد الأهداف الرئيسية لواحد الحَوسة العزلة إجراء تحليلات المصب مثل تسلسل الحمض النووي الريبي. للتحقق من أن لدينا طريقة العزل غير قادرة على الحصول على الحمض النووي الريبي من البكتيريا في حاويات السوائب الوسيطة للتحليل، أجرينا النسخ العكسي الكمية بوليميريز سلسلة من ردود الفعل (قرة-PCR) التحديد الكمي للجينات الثلاثة (16S و سيوب، و فردا) مجموعة من الحاويات منفردة معزولة والمجمعة (الشكل 4د). تم تكييف جميع البيانات المبينة في الشكل 4 بإذن من دوريسوامي et al.18. نظرة عامة تخطيطي لدينا بروتوكول العزلة الحَوسة يتبين في الشكل 5، الذي يرد من دوريسوامي et al.18.

الشكل 1 : سحبت يد الشعيرات الدموية الاحتفاظ الفتحات الضيقة. يتم عرض عينات (A) من الأنابيب الشعرية سحبت يده على خلفية سوداء للتباين. من أسفل إلى أعلى، شعري أونبوليد الشعرية التي سحبت لا بدرجة كافية، تظهر الشعرية التي يمكن أن تستخدم لحصاد المثانة وحيدة الخلية الظهارية، والشعرية التي تم سحب رقيقة جداً (وهكذا المنفصلين إلى قطعتين). يتم وضع مسطرة 15 سم في الجزء السفلي من الصورة للحجم. يتم الإشارة إلى هذه النقطة المقدرة لالتقاط قبالة الشعرية قابلة للاستخدام على الرقم السهم الأحمر. (ب) صورة يؤخذ مع مجهر تشريح يؤكد قطرها الداخلي جوفاء شعري سحبت (أسفل). يتم وضع أونبوليد الشعرية أعلاه تثبت الفرق الحجم النسبي الشعيرات الدموية اثنين. شريط المقياس = 4.0 مم. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
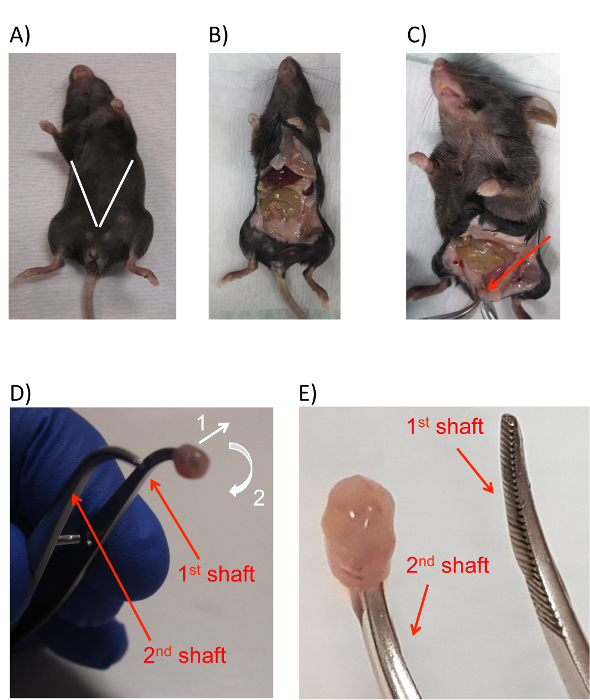
الشكل 2 : تشريح للماوس لحصاد الخلايا الظهارية المثانة. (أ) صورة لماوس مع خطوط بيضاء إضافة للإشارة إلى موقع المقدرة وزاوية من شقوق لكشف التجويف الصفاقى مورين والمثانة. (ب) صورة من يتعرض الماوس التجويف الصفاقى بعد انتهاء الشق. (ج) صورة من يتعرض المثانة (السهم الأحمر) بارزة بين منصات الدهون. (د) صورة من المثانة موريني بطرف الملقط إدراجها في التجويف، مع أسهم تشير إلى اتجاه الحركة اللازمة لعكس المثانة. يتم أولاً سحب المثانة قليلاً إلى الخارج، ثم حول وخارج المنجم الأول الملقط. بناء على توجيهات الحركة لكل الإجراءات كما هو مبين بالأسهم البيضاء المرقمة 1 و 2. (ه) صورة تبين الموقف النهائي من المثانة المقلوب إدراجه في الفتحة الثانية الملقط. تتم تسمية في مهاوي الملقط في كلا الفريقين د وه مع الأسهم الحمراء والنص. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
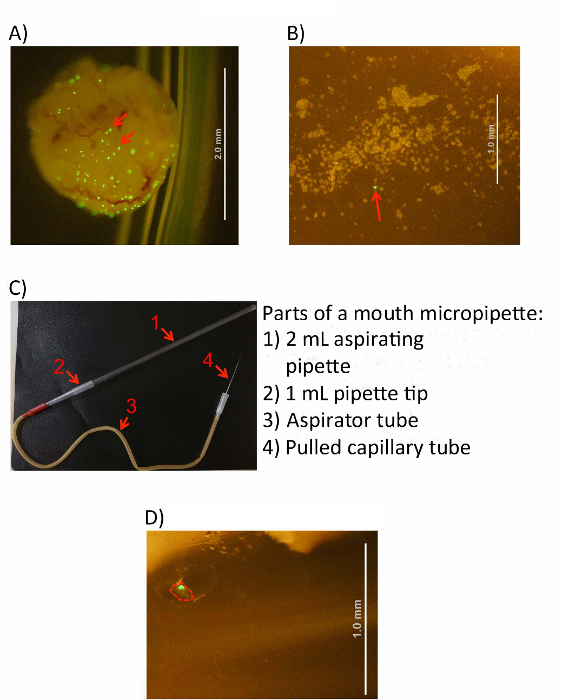
الشكل 3 : IBC الحصاد من خلايا المثانة. (أ) مثانة المصابة ومقلوب في حل برنامج تلفزيوني الباردة قبل إلغاء الخلية. (ب) صورة تبين كشط خلايا المثانة كما يرى تحت مجهر. يمكن التعرف على الحاويات المجاميع الفلورية الخضراء الكبيرة في كلا الصورتين (انظر الأسهم الحمراء). (ج) صورة من المكتملة الفم ميكروبيبيتينج الجهاز. يتم تعريف ماصة يسفط ونصيحة ماصة، أنبوب المضخة، وسحبت أنبوب شعري مع الأسهم المرقمة كما هو مبين على الحق. (د) صورة وحيدة معزولة الحَوسة داخل أنبوب جمع 1.5 مل (المشار إليها باللون الأحمر). أشرطة مقياس (كما هو موضح) هي ممثلة بخطوط بيضاء في لوحات ألف باء ودال الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
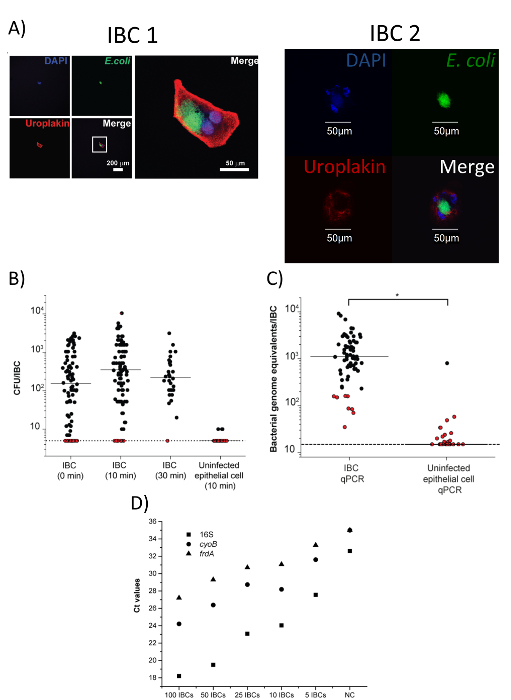
الشكل 4 : IBCs المقطوع نقية، ويمكن أن تستخدم لتحليل المتلقين للمعلومات- لقد تم تعديل هذا الرقم مع إذن من دوريسوامي et al18. (أ) الصور من خليتين من بروتينات فلورية خضراء-الإيجابية المعزولة التي كانت ملطخة بمكافحة أوروبلاكين ومضادات الأجسامالقولونية . الخلية الأولى (IBC 1) صور قنوات الفردية (في التكبير المنخفض) على اليسار، وصورة مدمجة عالية التكبير على الحق. الخلية الثانية (IBC 2) يرد في تضخم عالية في القنوات المدمجة والفردية. أشرطة مقياس كما هو مبين. الحمض النووي هو الملون مع 4, 6-دياميدينو-2-فينيليندولي (DAPI) والممثلة في القناة الزرقاء. مضاداتكولاي هي ملطخة بجسم ثانوي مترافق إلى fluorescein isothiocyanate (فيتك)، وتمثل في قناة الأخضر. مكافحة--أوروبلاكين هو ملطخة بجسم ثانوي يضاف إلى تيتراميثيلرهوداميني isothiocyanate (تريتك)، وتمثل في القناة الحمراء. (ب) "كفوس البكتيرية" من الحاويات المعزولة. حاويات السوائب الوسيطة كانت معالجتها فورا، أو المحتضنة في 0.1% تريتون-X ل 10 أو 30 دقيقة التهم "زيمبابوي المجمعة" من الحاويات الفردية المعزولة من n = 3 يبين تجارب منفصلة. الحد الأقصى لكشف = 0.7 سجل10 كفوس/الحاوية. تبين نقاط حمراء المرسومة في الحد من الكشف عن العينات التي تم انتشال لا المستعمرات. جميع العينات المحتوية على الحَوسة لا تختلف اختلافاً كبيرا (p > 0.05، اختبار مان-ويتني)؛ الخلايا الظهارية مصابة تختلف اختلافاً كبيرا عن البيانات الحاوية (10 دقيقة) (ف < 0.001، اختبار مان-ويتني). (ج) qPCR الكمي للبكتيريا على الحاويات الفردية والخلايا الظهارية مصابة بعد حضانة 10 دقيقة في 0.1% تريتون العاشر (*، ف < 0.0001، اختبار مان-ويتني، n = 4). الحد الأقصى لكشف = 1.18 سجل10 الجينوم البكتيري مكافئات/الحاوية. تشير النقاط الحمراء إلى العينات التي تم انتشال لا المستعمرات في تيتيرينج في لوحة (ب) (د) الكمي للجينات الرنا الريباسي، سيوب، و فردا 16S لإعداد متفاوتة من الحاويات منفردة معزولة والمجمعة (n = 1 التجربة؛ وكل تشير إلى متوسط 3 replicates التقنية). NC = أي سيطرة الحمض النووي سلبية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
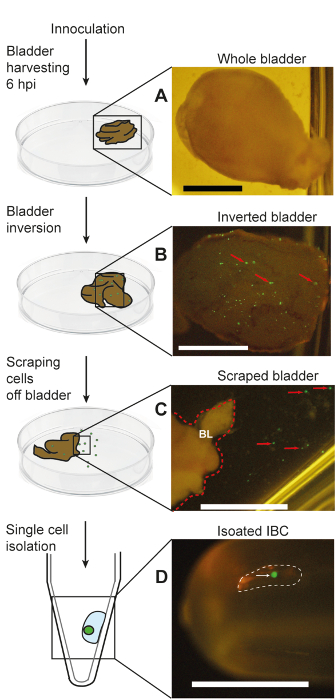
الشكل 5 : تخطيطي والصور المرتبطة به يمثل عزل الحاويات عن طريق الفم ميكروبيبيتينج من قربه الفئران المصابة. ويرد هذا الرقم من دوريسوامي et al.18. (أ) بحصاد المثانة كاملة؛ (ب) المقلوب المثانة كله تعريض بروتينات فلورية خضراء معربا عن الحاويات؛ (ج) عن قرب من حافة المثانة كشط عرض الحاويات الفردية في تعليق في المخزن المؤقت المتاخمة؛ (د) وحيدة معزولة الحَوسة بيبيتيد في أنبوب. الأسهم الحمراء في لوحة ب الإشارة إلى أمثلة من الحاويات الحاملات للتجارة والنقل على سطح لومينال المثانة. خط منقط أحمر في لوحة ج يشير إلى الحد الأيمن للمثانة مقلوب (المشار إليها بوصفها "BL")؛ وتبين الأسهم الحمراء في لوحة ج الظاهر الفردية بروتينات فلورية خضراء-إيجابية الخلايا الظهارية التي قد تم كشط قبالة سطح المثانة. يشير الخط المنقط أبيض في لوحة د معالجة تجميعية ميكروليتير فرعية ميكروبيبيتيد التي تحتوي على حاوية وسيطة للسوائب معزولة، يشار بشكل سهم أبيض. تغيير حجم أشرطة = 2 مم- الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
يسمح البروتوكول التي وصفناها لعزل للسوائب واحدة من طراز مورين من UTI. يعزل هذا البروتوكول الحاويات التي تحتوي على البكتيريا داخل الخلايا قابلة للحياة، والتي يمكن التحقق منها باستزراع لزيمبابوى. نتائج البروتوكول في البكتيريا داخل الخلايا من الحاويات مع القليل من التلوث بالبكتيريا خارج الخلية، مما يتيح لمزيد من الوصف لكل البكتيريا واستضافة الخلية من الحاويات الوسيطة للسوائب (الشكل 4ج). نحن نبين أيضا أن البكتيريا من الحَوسة واحدة يمكن استخدامها في تطبيقات المصب مثل قبكر (الشكل 4ج)، مما يوحي بأن لدينا تقنية يمكن استخدامها لعملية الحاويات لغيرها من التحليلات المختبرية. عن طريق تجميع البكتيريا تحصد من عدد قليل من 5 حاويات السوائب الوسيطة، كذلك نظهر قدرتنا على القيام بتحليل qRT PCR على ثلاثة جينات البكتيريا، مما يوحي بأن الجيش النيبالي الملكي نوعية جيدة يمكن أن تحصد من البكتيريا في أعمالنا الحاويات المعزولة (الشكل 4د). وتشير البيانات أننا أظهرنا جنبا إلى جنب، إلى أن إجراء تحليل الحمض النووي الريبي على نطاق الجينوم (مثل تسلسل الحمض النووي الريبي) على الحاويات واحد قد يكون من الممكن استخدام هذه التقنية العزلة.
في هذا البروتوكول، ركزنا على هذه النقطة مرة ح 6 لأن ذلك عندما أرقام الحَوسة ذروة في أكياس الفئران 6 أسود بالعدوى عن طريق UTI8927. وعلاوة على ذلك، استخدمنا أيضا نظام ثقافة بكتيرية ثابتة لتعزيز مستوى التعبير الهياكل نوع 1 في UTI89. التعبير عن الهياكل نوع 1 أمر حاسم كولاي إرفاقه وتصيب المثانة الخلايا الظهارية28. بيد أن هذا التعبير هو محكم التنظيم29 ومنبهات البيئية معروفة لتغيير ذلك30. من أجل الحفاظ على النمط الظاهري العدوى متسقة وعدد كاف من الحاويات، نوصي باستخدام ثقافة بكتيرية ثابت ح 2 × 24 (معدلة قليلاً من هونغ et al.8) والنقطة وقت الإصابة ح 6 عند العمل مع سبق اختباره كولاي سلالات مثل NU14 و UTI89،من2829. ومع ذلك، من الممكن أن هذه المتغيرات سوف تحتاج إلى تعديل في سلالات UTI الأخرى أو في غيرها سلالات الفئران للحصول على العدد المثالي للحاويات من كل عدوى.
بينما يستخدم البروتوكول من هونغ et al.8 فقط من الفئران الإناث، كانت البروتوكولات الأخرى المتبعة لوضع عدوى المسالك البولية في الفئران الذكور عنها31. في هذا النموذج، التهاب المثانة في الفئران الذكور أيضا يتبع مسار الحاوية. كما قربه الفئران الذكور والإناث متشابهة في الحجم، فإننا نتوقع أن بروتوكولنا العزلة الحَوسة يمكن أن تستخدم في ذكور الفئران المصابة، وكذلك.
كما يضمن بسيطة نسبيا التكنولوجيا المستخدمة في هذا البروتوكول أن يمكن نشرة في معظم المختبرات. واحدة من الخطوات الرئيسية التي تنطوي عليها في هذا البروتوكول هو سحب الشعيرات الزجاجية لإنشاء ميكروكابيلاريس لتحديد نوع الخلية للفائدة. هذه الخطوة تسمح بالمرونة في أقطار ميكروكابيلاريس التي تم إنشاؤها، وهكذا الأسلوب يمكن أن تمتد إلى أنواع متعددة من الخلايا المستهدفة المختلفة. بيد سبب الاختلاف المتأصل في خلق هذه الشعيرات الدموية، يجب الحرص على التأكد من أن القطر النهائي في مجموعة قابلة للاستخدام. إذا كانت الشعيرات الدموية ضيقة جداً، فشلوا في التقاط خلية الاهتمام، ولكن إذا كانت واسعة جداً، ويمكن تحديد عدة خلايا في محاولة واحدة. وعلاوة على ذلك، استخدام اللهب المكشوف خلال عملية سحب شعري يحمل خطر كامن للحروق والحريق، حيث ينبغي أن تأخذ الرعاية الباحث محاولة إنشاء ميكروكابيلاريس لمنع حدوث مثل هذه الأحداث. للحد من التفاوت، فضلا عن خطر الحرائق المفتوحة شاركوا في صنع هذه الشعيرات الدموية، الباحث يمكن أن تجعل استخدام ميكروبيبيتي التقليدية سحب الجهاز، مثل تلك المستخدمة للتجارب الكهربية (مثل PC-100، مجموعة ناريشيجي). كما تجعل هذه الآلات من الجاذبية أو منصات الروبوتية لسحب الشعيرات الدموية، وأنها يمكن أن تكون مصممة لتلبية احتياجات طراز العدوى. بيد أن مجموعة واسعة من ميكروبيبيتي سحب الآلات المتاحة سوف يعني أن الباحث الفردية سوف تحتاج إلى الذهاب من خلال بعض التجربة والخطأ لتحديد القطر الشعرية النهائية المناسبة للاستخدام مع هذا البروتوكول.
عرض البروتوكول يجعل استخدام البكتيريا معربا عن علامة نيون بصريا تحديد الحاوية. وبالتالي، يقتصر هذا الأسلوب الباحثين القدرة على تعديلها وراثيا للكائن الحي المعدية. على وجه التحديد لابيك، سلالات تشكيل الحَوسة مثل CFT073 و NU14 قد نجحت في تحويل مع الإعراب عن بروتينات فلورية خضراء والبلازميدات32،،من3334؛ ولذلك ينبغي أن تكون هذه قابلة للاستخدام في البروتوكول نفسه. استناداً إلى منطقة المثانة (70 مم2) الماوس35وطول الخلايا الظهارية الفردية (50-120 ميكرومتر)17، وتواتر الحاويات في مثانة واحد16، تقدير متحفظ للإصابة بالحاويات عن 1 في 1,000 الخلايا (أو 0.1%). ويعرض هذا التقدير فائدة بروتوكولنا عزل الخلية لاستهداف الأحداث النادرة. دقة تحديد الخلية من خلال موقعنا البروتوكول ومجموعة واسعة من أقطار الشعرية التي يمكن سحبها تشير إلى أنه يمكن استخدام هذا البروتوكول لعزل البكتيريا داخل الخلايا من نماذج أخرى في المختبر والمجراه في العدوى. وفي الواقع، نحن استخدمت بنجاح هذا الأسلوب لعزل الخلايا الظهارية المصابة المثانة المستزرعة (البيانات لا تظهر).
واحدة من أكثر تحديا من الناحية التقنية خطوات في البروتوكول هو عكس المثانة للكشف عن الخلايا الظهارية لإلغاء. وقد وجدنا أن من الممكن أيضا جعل شق على المثانة تباعد لإلغاء. ومع ذلك الواجب ينبغي الحرص على تقليل الأضرار بالخلايا الظهارية من المثانة خلال عملية قطع أنها مفتوحة؛ ومن الناحية المثالية ينبغي أن تستخدم قطع واحد تباعد فتح المثانة. بالإضافة إلى ذلك، ينبغي الخفض في برنامج تلفزيوني الباردة، لمنع الفقدان العرضي للخلايا أو أنسجة المثانة أثناء العملية.
الفم بيبيتينج للحاويات في هذا البروتوكول يوفر مزيدا من السيطرة على عملية اختيار الخلية، فضلا عن الحد من الحجم النهائي للحل نقل جنبا إلى جنب مع الخلية. مراقبة غرامة وفصل كبير من حل من الفم الباحثين أيضا تكبير سلامة الباحث، نظراً للكميات المنقولة داخل نانولتر لمجموعة ميكروليتير. على النقيض من ذلك، أن تجربتنا مع ميكروبيبيتي الحديث أنه يميل إلى نقل المزيد من السائل المحيطة والخلايا مع الحَوسة، يحتمل أن تؤدي إلى تلوث بالبكتيريا لومينال خارج الخلية. كما أبلغ لنا الاستنتاج أن الفم بيبيتينج يوفر أداء أعلى على خلية واحدة أخرى أساليب العزل بأخرى مختبرات22،،من2324. وبصرف النظر عن عزل خلية مفردة، بيبيتينج الفم حتى استخدمت في خلية واحدة انهانسر للخلايا العصبية25، مما يدل على زيادة الفائدة والسيطرة الدقيقة التي يمكن تحقيق باحث مدربين مع التقنية. بيد أن السلامة من الأهمية ونقترح التدابير الإضافية المحتملة التي يمكن اتخاذها تبعاً لمسببات الأمراض المستخدمة: (ط) تمديد المخزن المؤقت الجوي بين الباحث والمواد البيولوجية، على سبيل المثال باستخدام يسفط ماصة بحجم أكبر (مثلاً، 5 مل)، أو (الثاني) إضافة عامل تصفية الجسدية مثل القطن والصوف إلى ماصة يسفط بمثابة عقبة إضافية.
وفي الحالات التي يؤدي فيها تقييم لمخاطر إلى الاستنتاج بأن بيبيتينج الفم لا تزال محفوفة بالمخاطر أيضا، يمكن الجمع بين الأجهزة الروبوتية المتاحة تجارياً (مثل تلك المستخدمة في نانوينجيكشنز) مع الأقسام الأخرى من لدينا تقنية لتوفير وسيلة أكثر أماناً عزل الخلايا المصابة من المختلطة السكان. تجدر الإشارة إلى أن تجربتنا مع استخدام ميكرومانيبولاتور روبوتية أظهر انخفاض معدل عزل الحَوسة مقارنة بيبيتينج الفم، كما أن التباين داخل تجريبية كبيرة في حجم الخلية الظهارية المثانة يجعلها صعبة للمستخدم الذراع الروبوتية لتحديد القوة المطلوبة لالتقاط واحدة من الحاويات. ومع ذلك، يبقى خياراً قابلاً للتطبيق، على الرغم من أن تكلفة، لأولئك الذين يعملون مع وكلاء المرض المعدي.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
هذا البحث كان تدعمها "المؤسسة الوطنية للبحوث"، مكتب رئيس الوزراء، سنغافورة، ضمن "مخططها زمالة بحثية جبهة الخلاص الوطني" (جبهة الخلاص الوطني جائزة لا. NRF-RF2010-10)؛ المجلس الوطني للبحوث الطبية سنغافورة التابعة لوزارة الصحة (نمرك-سيرج/1358/2013)؛ وفي معهد الجينوم بسنغافورة (GIS)/وكالة العلوم والتكنولوجيا والبحوث (A * ستار).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL eppendorf tube | For static bacterial culture and OD measurement | ||
| 100% ethanol | For Alcohol Burner | ||
| 15 mL conical tube | For static bacterial culture and OD measurement | ||
| 1 mL Tuberculin Syringe | BD Biosciences | 302100 | |
| 3% Bacterial Agar | For static bacterial culture and OD measurement | ||
| 70% ethanol | For static bacterial culture and OD measurement | ||
| Aesculap anatomic forceps | Braun/Kruuse | BD222R | For initial dissection of mouse (skin, fascia) |
| Alcohol Burner | Wheaton | 237070 | |
| Aspirating pipette | BD Biosciences | 357558 | |
| Aspirator tube | Sigma-Aldrich | A5177 | |
| Bacterial loops | For static bacterial culture and OD measurement | ||
| Benchtop centrifuge | Eppendorf | 5424 | Any centrifuge for 1.5ml eppendorf tubes |
| Conical flasks | For static bacterial culture and OD measurement | ||
| Digital camera for microscope | Olympus | DP71 | For image capture and harvesting of IBCs. Any other fluorescent microscope with a GFP channel will suffice |
| Glass Capillaries | Kimax | 6148K07 | |
| Iris Scissors STR SS 110MM | Braun | BC110R | |
| Isoflurane (Isothesia) | Henry Schein Animal Health | 29405 | |
| Kanamycin Sulfate | Calbiochem | 420311 | For static bacterial culture and OD measurement |
| LB broth (Miller) | Thermo/Gibco | 10855021 | For static bacterial culture and OD measurement |
| Light source unit for microscope | Olympus | LG-PS2 | For image capture and harvesting of IBCs. Any other fluorescent microscope with a GFP channel will suffice |
| Lubricant | KY | Any similar commercial medical lubricant will suffice | |
| Macro fluorescence microscope | Olympus | MVX10 | For image capture and harvesting of IBCs. Any other fluorescent microscope with a GFP channel will suffice |
| Micropipette + micropipette tips | For static bacterial culture and OD measurement | ||
| PBS 1x | For static bacterial culture and OD measurement | ||
| Pipette controller + Pipettes | For static bacterial culture and OD measurement | ||
| Polyethylene Tubing | BD Intramedic | 427401 | |
| Precision Glide needle 30 G | BD Biosciences | 305107 | Possibly under new catalogue number (305106) |
| Splinter forceps curved | Braun | BD312R | |
| Spray bottle (for ethanol) | For static bacterial culture and OD measurement | ||
| Square cuvettes | Elkay | 127-1010-400 | For static bacterial culture and OD measurement |
| Sterilgard III Advance Safety Cabinet | Baker | SG403 | Any biosafety cabinet with a UV irridiator |
| Sterilin 90mm Standard Petri Dish | Thermo | 101VR20 | Any sterile petri dish |
| Stevens, vascular and tendon scissors, curved, delicate, 110 mm | Braun | OK366R | Recommended for harvesting of bladder |
| Surgical Scissors STR S/B 105MM | Braun | BC320R | |
| Tabletop Centrifuge | Eppendorf | 5810R | Any refridgerated centrifuge for 15ml conicals |
| WPA C08000 cell density meter | Biowave (Biochrom) | 80-3000-45 | For static bacterial culture and OD measurement |
References
- Barber, A. E., Norton, P. J., Spivak, A. M., Mulvey, M. A. Urinary Tract Infections: Current and Emerging Management Strategies. Clinical Infectious Diseases. 57 (5), 719-724 (2013).
- Flores-Mireles, A. L., Walker, J. N., Caparon, M., Hultgren, S. J. Urinary tract infections: epidemiology, mechanisms of infection and treatment options. Nature Reviews Microbiology. 13, 269-284 (2015).
- Foxman, B. Recurring urinary tract infection: incidence and risk factors. American Journal of Public Health. 80, 331-333 (1990).
- Foxman, B., Barlow, R., D'Arcy, H., Gillespie, B., Sobel, J. D. Urinary tract infection: self-reported incidence and associated costs. Annals of Epidemiology. 10 (8), 509-515 (2000).
- Zowawi, H. M., et al. The emerging threat of multidrug-resistant Gram-negative bacteria in urology. Nature Reviews Urology. 12, 570-584 (2015).
- Silverman, J. A., Schreiber, H. L., Hooton, T. M., Hultgren, S. J. From physiology to pharmacy: developments in the pathogenesis and treatment of recurrent urinary tract infections. Current Urology Reports. 14, 448-456 (2013).
- Sivick, K. E., Mobley, H. L. T. Waging war against uropathogenic Escherichia coli: winning back the urinary tract. Infection and Immunity. 78, 568-585 (2010).
- Hung, C. -S., Dodson, K. W., Hultgren, S. J. A murine model of urinary tract infection. Nature Protocols. 4, 1230-1243 (2009).
- Cusumano, C. K., et al. Treatment and prevention of urinary tract infection with orally active FimH inhibitors. Science Translational Medicine. , (2011).
- Alteri, C. J., Hagan, E. C., Sivick, K. E., Smith, S. N., Mobley, H. L. T. Mucosal Immunization with Iron Receptor Antigens Protects against Urinary Tract Infection. PLoS Pathogens. , (2009).
- Mysorekar, I. U., Hultgren, S. J. Mechanisms of uropathogenic Escherichia coli persistence and eradication from the urinary tract. Proceedings of the National Academy of Sciences of the United States of America. , (2006).
- Hunstad, D. A., Justice, S. S. Intracellular lifestyles and immune evasion strategies of uropathogenic Escherichia coli. Annual Review of Microbiology. 64, 203-221 (2010).
- Rosen, D. A., Hooton, T. M., Stamm, W. E., Humphrey, P. A., Hultgren, S. J. Detection of intracellular bacterial communities in human urinary tract infection. PLoS Medicine. , (2007).
- Robino, L., et al. Detection of intracellular bacterial communities in a child with Escherichia coli recurrent urinary tract infections. Pathogens and Disease. 68 (3), 78-81 (2013).
- Robino, L., et al. Intracellular bacteria in the pathogenesis of Escherichia coli urinary tract infection in children. Clinical Infectious Diseases. 59 (11), 158-164 (2014).
- Schwartz, D. J., Chen, S. L., Hultgren, S. J., Seed, P. C. Population dynamics and niche distribution of uropathogenic Escherichia coli during acute and chronic urinary tract infection. Infection and Immunity. 79, 4250-4259 (2011).
- Keshtkar, A., Keshtkar, A., Lawford, P. Cellular morphological parameters of the human urinary bladder (malignant and normal). International Journal of Experimental Pathology. 88, 185-190 (2007).
- Duraiswamy, S., Chee, J. L. Y., Chen, S., Yang, E., Lees, K., Chen, S. L. Purification of Intracellular Bacterial Communities during Experimental Urinary Tract Infection Reveals an Abundant and Viable Bacterial Reservoir. Infection and Immunity. , (2018).
- Kurimoto, K., Yabuta, Y., Ohinata, Y., Saitou, M. Global single-cell cDNA amplification to provide a template for representative high-density oligonucleotide microarray analysis. Nature Protocols. 2, 739-752 (2007).
- Tang, F., et al. Deterministic and stochastic allele specific gene expression in single mouse blastomeres. PLoS One. , (2011).
- Wells, J. M., Melton, D. A. Early mouse endoderm is patterned by soluble factors from adjacent germ layers. Development. 127, 1563-1572 (2000).
- Guo, H., et al. Profiling DNA methylome landscapes of mammalian cells with single-cell reduced-representation bisulfite sequencing. Nature Protocols. 10 (5), 645-659 (2015).
- Zhao, R., et al. The establishment of clonally derived chicken embryonic fibroblast cell line (CSC) with high transfection efficiency and ability as a feeder cell. Journal of Cellular Biochemistry. , (2018).
- Tang, F., et al. RNA-Seq analysis to capture the transcriptome landscape of a single cell. Nature Protocols. 5 (3), 516-535 (2010).
- Wiegert, J. S., Gee, C. E., Oertner, T. G. Single-Cell Electroporation of Neurons. Cold Spring Harbor Protocols. , (2017).
- Conover, M. S., Flores-Mireles, A. L., Hibbing, M. E., Dodson, K., Hultgren, S. J. Establishment and Characterization of UTI and CAUTI in a Mouse Model. Journal of Visualized Experiments. (100), 52892(2015).
- Justice, S. S., et al. Differentiation and developmental pathways of uropathogenic Escherichia coli in urinary tract pathogenesis. Proceedings of the National Academy of Sciences of the United States of America. 101 (5), 1333-1338 (2004).
- Mulvey, M. A., et al. Induction and Evasion of Host Defenses by Type 1-Piliated Uropathogenic Escherichia coli. Science. 282 (5393), 1494-1497 (1998).
- Zhang, H., Susanto, T. T., Wan, Y., Chen, S. L. Comprehensive mutagenesis of the fimS promoter regulatory switch reveals novel regulation of type 1 pili in uropathogenic Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 113 (15), 4182-4187 (2016).
- Gally, D. L., Bogan, J. A., Eisenstein, B. I., Blomfield, I. C. Environmental regulation of the fim switch controlling type 1 fimbrial phase variation in Escherichia coli K-12: effects of temperature and media. Journal of Bacteriology. 175 (19), 6186-6193 (1993).
- Olson, P. D., Hruska, K. A., Hunstad, D. A. Androgens Enhance Male Urinary Tract Infection Severity in a New Model. Journal of the American Society of Nephrology. 27 (6), 1625-1634 (2016).
- Garofalo, C. K., et al. Escherichia coli from Urine of Female Patients with Urinary Tract Infections Is Competent for Intracellular Bacterial Community Formation. Infection and Immunity. 75 (1), 52-60 (2007).
- Berry, R. E., Klumpp, D. J., Schaeffer, A. J. Urothelial cultures support intracellular bacterial community formation by uropathogenic Escherichia coli. Infection and Immunity. 77 (7), 2762-2772 (2009).
- Holden, N., Totsika, M., Dixon, L., Catherwood, K., Gally, D. L. Regulation of P-fimbrial phase variation frequencies in Escherichia coli CFT073. Infection and Immunity. 75 (7), 3325-3334 (2007).
- Jost, S. P. Postnatal growth of the mouse bladder. Journal of Anatomy. 143, 39-43 (1985).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved