Method Article
تشريح المحلية Ca2 + الإشارات في الخلايا المستزرعة بالمؤشرات المستهدفة للغشاء Ca2 +
In This Article
Summary
وهنا يقدم بروتوكول ل Ca2 + التصوير في الخلايا العصبية والخلايا الدبقية، الذي يتيح لتشريح Ca2 + إشارات في القرار سوبسيلولار. هذه العملية لا تنطبق على جميع أنواع الخلايا التي تسمح للتعبير عن وراثيا المرمزة Ca2 + المؤشرات.
Abstract
أيون الكالسيوم (Ca2 +) هو جزيء رسول عالمي داخل الخلايا التي تحرك مسارات إشارات متعددة، مما يؤدي إلى نواتج البيولوجية المتنوعة. التنسيق بين اثنين من Ca2 + إشارة المصادر – "Ca2 + تدفق" من خارج الخلية وتخزين "Ca2 + الإصدار" من داخل الخلايا Ca2 + هيولى (ER) – يعتبر أن تكمن وراء أنماط الزمانية المتنوعة من كاليفورنيا 2 + الإشارات التي تسبب متعددة الوظائف البيولوجية في الخلايا. والغرض من هذا البروتوكول هو وصف Ca2 + تصوير أسلوب جديد يتيح الرصد من اللحظة الأولى من "Ca2 + تدفق" و "Ca2 + الإصدار". OER GCaMP6f مؤشرا وراثيا مرمزة Ca2 + (جيتشي) تتألف من GCaMP6f، التي تستهدف الغشاء الخارجي ER. ويمكن رصد OER-GCaMP6f Ca2 + الإصدار بدقة الزمانية أعلى من GCaMP6f التقليدية. جنبا إلى جنب مع جيسيس المستهدفة لغشاء البلازما، يمكن وصف الزمانية Ca2 + إشارة النقش بدقة سوبسيلولار. سوبسيلولار استهدفت Ca2 + المؤشرات الموضحة هنا، من حيث المبدأ، متاح لجميع أنواع الخلايا، حتى المجراة في التصوير ايليجانس كاينورهابديتيس الخلايا العصبية. في هذا البروتوكول، إدخال Ca2 + تصوير في الخلايا من خطوط الخلايا والخلايا العصبية والخلايا الدبقية في الثقافات الأولية منفصلان، ووصف إعداد الأوراق المالية المجمدة للفئران الخلايا العصبية القشرية.
Introduction
Ca2 + إشارات تمثل برفع Ca2 + تركيز داخل الخلايا. Ca2 + هو الرسول الثاني العالمي للخلايا حقيقية النواة. استخدام Ca2 +, خلايا تعمل عبر مسارات الإشارات داخل الخلايا المتنوعة وحمل النواتج البيولوجية المختلفة. على سبيل المثال، في الخلايا العصبية، الإصدار حويصلة متشابك في محطة presynaptic، التعبير الجيني في نواة، وتحريض اللدونة متشابك في بوستسينابسي ينظمها Ca2 + إشارات مميزة التحديد تنشيط المناسبة المصب الإنزيمات في المواقع الصحيحة، ومع التوقيت الدقيق1.
أنماط الزمانية المكانية محددة من Ca2 + إشارات تنشيط الإنزيمات المتلقين للمعلومات المحددة. Ca2 + إشارات يتم إنشاؤها بواسطة التنسيق بين Ca2 + مصدرين مختلفين: Ca2 + تدفق من الفضاء خارج الخلية و Ca2 + الإصدار من هيولى (ER)، الذي يخدم كمرجع مصدق Ca داخل الخلايا2 + تخزين. معنى الزمانية المكانية Ca2 + مما يشير إلى نمط للحث على وظيفة خلية محددة أيضا معتمد من قبل نانودومينس من 10-100 ميكرون Ca2 + التي تم إنشاؤها بالقرب من Ca2 + قنوات في غشاء البلازما أو ER الغشاء2. الأهم من ذلك، مصدر Ca2 + إشارات واحد من أهم العوامل المحددة للإنتاج البيولوجي المتلقين للمعلومات. في الخلايا العصبية، قد Ca2 + تدفق و Ca2 + الإفراج عن آثار عكسية على تجميع حمض غاما – أمينوبوتيريك (GABA) مستقبلات (GABAAR) عند نهايات جابايرجيك، المسؤولة عن تثبيط 3من استثارة الخلايا العصبية. Ca2 + تدفق مصحوبة بالإثارة العصبية الضخمة يؤدي إلى تشتت متشابك GABAAR الكتل، وبينما كاليفورنيا مستمرة2 + الإصدار لائحة يشجع تجميع غابا متشابكألفروبية. مجموعات أخرى كما أفاد أن ضبط اتجاه النمو والأقماع اعتماداً على المصدر من Ca2 + الإشارة: Ca2 + تدفق يدفع النفور، بينما Ca2 + الإفراج عن أدلة الجاذبية لنمو الخلايا العصبية مخروط4. ولذلك، من المهم أن نفهم تماما Ca2 + إشارات المسارات الأساسية لنواتج محددة الخلوية، تحديد مصدر Ca2 + الإشارات بوصف Ca2 + إشارات في القرار سوبسيلولار.
في هذا البروتوكول، يصف لنا Ca2 + تصوير أسلوباً تقرير Ca2 + إشارات في القرار سوبسيلولار، الذي يسمح تقدير Ca2 + إشارة المصادر (الشكل 1). Ca2 + ميكرودومينس تحت غشاء البلازما فقط بنجاح تحت مراقبة مرمزة وراثيا Ca2 + مؤشرات (جيسيس) يستهدف غشاء البلازما عن طريق إلحاق إشارة التعريب غشاء البلازما لك داخل Src كيناز إلى N-تيرميني جيسيس5. للكشف عن نمط Ca2 + إشارة قرب لائحة بأفضل دقة المكاني والزماني، مؤخرا وضعنا OER-GCaMP6f، في أي GCaMP6f6 أهداف لائحة الغشاء الخارجي، استخدام البروتين transmembrane ER. يمكن تقرير OER-GCaMP6f إحساس مرهف Ca2 + الإصدار لائحة بأفضل دقة الزمانية المكانية من GCaMP6f نونتارجيتيد التقليدية في كوس-7 خلايا7 و الخلايا HEK2938، بتجنب نشر Ca2 + وجيسيس . أكدنا أيضا أن عفوية Ca2 + الارتفاع في astrocytes هيبوكامبال مثقف عنها OER-GCaMP6f أظهرت نمطاً الزمانية المكانية مختلفة مقارنة بالتي ترصدها GCaMP6f المستهدفة لغشاء البلازما (لك-GCaMP6f)7 ،9، مما يشير إلى أن Ca2 + التصوير مع OER-GCaMP6f في تركيبة مع GCaMP6f لك يسهم في تشريح Ca2 + إشارات في القرار سوبسيلولار لتحديد مصادرها.
في الوقت الحاضر، نحن تفاصيل البروتوكول المتعلق بتشريح Ca2 + الإشارات في خلايا هيلا والعصبية-astrocyte مختلطة الثقافات مطلي على الزجاج كوفيرسليبس. Ca2 + التصوير تقنية مع جيسيس المبين هنا، لك-GCaMP6f، مستهدفة من قبل غشاء البلازما RCaMP210 (لك-RCaMP2)، وقابلة للتطبيق على كافة الخلايا التي يمكن التعبير عن هذه جيسيس OER-GCaMP6f (الشكل 1).
Protocol
جميع التجارب الموضحة هنا أقرتها لجنة السلامة بتبريد والحيوان تجربة اللجنة، طبقاً للمبادئ التوجيهية الصادرة عن وزارة التعليم والثقافة، والرياضة، والعلوم والتكنولوجيا اليابانية.
1-إعداد الخلايا
- إعداد بولي (اثيلينيميني)--المغلفة كوفيرسليبس
ملاحظة: ينصح بطلاء Poly(ethyleneimine) (بي) للجهاز الزجاج، كما أنه يسمح للخلايا العصبية و astrocytes لإرفاق أحكام كوفيرسليبس دون منع تطورها. ومع ذلك، أساليب طلاء أخرى (مثل ornithine بولي وبولي L-يسين، laminin طلاء) تتوفر أيضا، إذا لزم الأمر، للاطباق أسفل الزجاج.- ضع ساترة زجاجية قطرها 18 مم في كل من لوحة 12-جيدا جيدا. إعداد 0.04% بي الحل (12.5 مل/12-بئر لوحة) باستخدام الماء المعقم.
- أضف 1 مل محلول بي 0.04% لكل بئر. التأكد من أن هناك لا فقاعات تحت كوفيرسليبس.
- احتضان اللوحات في حاضنة2 CO بين عشية وضحاها في 37 درجة مئوية.
- وفي اليوم التالي يغسل كوفيرسليبس المغلفة 3 x مع 1 مل من الماء المعقم. إزالة الحل بي مع المضخة وإضافة 1 مل من الماء المعقم لكل بئر ويهز لوحة 12-جيدا حيث أنه يمكن أن تغسل بالحل بي بين اللوحة وساترة دقة. كما بي المتبقية السامة للخلايا، ضمان أن الماء بعد الغسيل النهائي ويستنشق تماما.
- تجفيف وتعقيم كوفيرسليبس داخل غطاء محرك السيارة مع الأشعة فوق البنفسجية (الأشعة فوق البنفسجية) خفيفة لمدة 15 دقيقة على الأقل. ويمكن تخزين الطبق المغلفة بي عند 4 درجة مئوية لمدة تصل إلى شهرين. إلقاء الضوء على الأطباق مع الأشعة فوق البنفسجية الخفيفة لمدة 15 دقيقة قبل الاستخدام.
- إضافة 5 مل ماء المقطر المعقم في المسافة بين الآبار لمنع تبخر المتوسطة الثقافة.
- طلاء خطوط الخلايا
ملاحظة: وينص هذا البروتوكول مجرد مثال واحد تعداء في الخلايا من خطوط خلايا الثدييات، مثل خلايا هيلا وخلايا كوس-7. يمكن للمستخدمين تطبيق البروتوكولات تعداء الأخرى التي هي الأمثل للتجارب التي تقوم بها. في هذا القسم، وسوف يصف لنا البروتوكول ثقافة الخلية هيلا، الذي ينطبق أيضا على خلايا كوس-7.- في اليوم قبل تعداء، ثقافة الخلايا في طبق ثقافة 10 سم حتى بلوغهم التقاء 70%-90%.
- بريوارم المتوسط الثقافة (انظر الجدول للمواد) إلى 37 درجة مئوية.
- تغسل الخلايا 2 x مع الفوسفات مخزنة المالحة دون Ca2 + و Mg2 + (برنامج تلفزيوني [-]).
- نضح في PBS(-) وإضافة 1 مل من الإيثيلين التربسين 0.5% حمض (يدتا) الحل واحتضان الخلايا عند 37 درجة مئوية ل 90 ثانية حتى بلوغهم شكل دائري.
- إضافة مل 9 من بريوارميد الثقافة المتوسطة لوقف تريبسينيزيشن. تمييع الخلايا مع الثقافة المتوسطة بنسبة 1:6.
- البذور 1 مل مخففة الخلايا المغلفة بجزيرة الأمير إدوارد كوفيرسليبس في لوحات 12-جيدا.
- إعداد الثقافة هيبوكامبال astrocyte العصبية مختلطة من الجرذان أو الفئران
ملاحظة: الأقسام 1.3 و 1.4 يجب أولاً إعادة النظر ووافق رعاية الحيوان مؤسسية واستخدام اللجنة ويجب أن تتبع الإجراءات المعتمدة رسميا لرعاية واستخدام الحيوانات المختبرية. ويرد المخطط الانسيابي للبروتوكول ثقافة العصبية في الشكل 2.- إعداد جميع الكواشف تحت غطاء محرك السيارة الاندفاق الصفحي. مم الثقافة المتوسطة النسر تعديل "مكان دولبيكو" (دميم) إلى 100 اثنين الأطباق (حوالي 20 مل/طبق) الموجودة في ثلاجة.
- إعداد 50 مل من تشريح متوسطة تتألف من دميم وحمض-(2-hydroxyethyl)-1-بيبيرازينيثانيسولفونيك عيار 20 ملم 4 (حبيس) (انظر الجدول للمواد)، والاستغناء عن المتوسط إلى ثلاثة أطباق الثقافة 60 مم (حوالي 7 مل/طبق) وثمانية من 35 مم أطباق الثقافة (حوالي 2 مل/طبق). وضع الأطباق في الثلاجة آخر.
- إعداد 50 مل من المحلول الملحي الحضانة، تتألف من الحل الملح المتوازن هانكس تستكمل مع 20 مم حبيس (انظر الجدول للمواد)، ومكان 8 مل من المحلول الملحي في أنبوب مخروطي 15 مل على الجليد.
- إعداد متوسطة الطلاء مع الحد الأدنى الأساسية المتوسطة (MEM) تستكمل مع B-27، الجلوتامين والبنسلين والستربتوميسين (انظر الجدول للمواد). الحفاظ على هذه الوسيلة في درجة حرارة الغرفة (20-28 درجة مئوية).
- تعقيم الأدوات الجراحية مع الإيثانول 70%.
- ضع منشفة ورقية في وعاء زجاجي مع غطاء و 1 مل من إيسوفلوراني. واسمحوا isoflurane تتبخر لمدة 1 دقيقة.
- ضع الفئران حوامل أو ماوس في جرة المعدة وفقا للخطوة 1.3.6 وإبقاء الحيوان في الجرة حتى أنه تم تخديره من عميق (حوالي 30 ثانية إلى 1 دقيقة).
- يأخذ هذا الحيوان أنيسثيتيزيد من الجرة وتطهير الحيوان ومعدات تشريح بالرش لهم مع الإيثانول 70%. قطع خط الوسط البطني مع مقص تشريح القياسية وملاقط واستخراج الرحم من الفئران الحوامل أو الماوس.
- استخراج الأجنة E18 – 19 من الرحم الفئران الإناث تخديره أو الماوس، استخدام مقص تشريح دقيق، ثم وضع الأجنة المستخرجة مع ملقط خاتم إلى دميم المثلج في صحن 10 سم للتخدير البارد.
- قطع رأس الجنين مع مقص تشريح غرامة ووضع رأسه في دميم المثلج في صحن 10 سم.
- استخراج المخ من كل الجنين بالملقط سيمكين 13 سم منحنى والملقط مع نصائح الجميلة. الحفاظ على الدماغ في الأجلين المتوسط وتشريح المثلج في صحن 60 ملم.
- إزالة هيبوكامبي، استخدام الملقط اثنين مع نصائح الجميلة، على المديين المتوسط وتشريح المثلج في الأطباق 35 ملم والحفاظ على الأنسجة المعزولة في حضانة المحلول الملحي توضع في أنبوب مخروطي 15 مل على الجليد.
- أغسل هيبوكامبي مع المالحة الاحتضان واحتضان مع التربسين (1.25 ملغ/مل) والدناز أنا (0.25 مغ/مل) في المياه المالحة الحضانة لمدة 5 دقائق عند 37 درجة مئوية. حجم حاضنات الموصى به 2.7 مل من المحلول الملحي حضانة و 150 ميليلتر من 20 x التربسين الأسهم 150 ميليلتر من الأسهم x 20 الدناز (انظر الجدول للمواد).
- أغسل هيبوكامبي 3 x مع المالحة المثلج الحضانة.
- نضح المياه المالحة الاحتضان وإضافة 1 مل الوسط الطلاء الذي يحتوي على الدناز أنا (10 ميليلتر من حل الأسهم؛ انظر الجدول للمواد). تعليق الأنسجة العاشر لا يزيد عن 20 بيبيتينج وقياس كثافة خلايا قابلة للتطبيق، باستخدام عداد الخلية والمقايسة تريبان الأزرق.
- تمييع الخلايا هيبوكامبال لكثافة 1.4 × 105 صالحة خلايا/مل للفئران و 2.5 × 105 قابلة للحياة الخلايا/مليلتر بالنسبة للفئران. البذور 1 مل تعليق خلية المخفف على كوفيرسليبس المغلفة بجزيرة الأمير إدوارد في لوحات الثقافة 12-جيدا.
- الحفاظ على الخلايا عند 37 درجة مئوية في CO2 حاضنة لمدة 2 – 3 أيام.
- إزالة المتوسطة والطلاء. لا تدع الخلايا تجف. بلطف وبسرعة إضافة المتوسطة صيانة بريوارميد (انظر الجدول للمواد).
- إعداد ثقافة العصبية-أستروسيتي القشرية مختلطة الفئران والخلايا المجمدة، وإحياء الثقافات المجمدة
ملاحظة: وكان أسلوب نعد للخلايا القشرية previously11 وصف. ويرد هنا، تعديل بروتوكول التي يمكن تخزين الخلايا القشرية في-80 درجة مئوية لمدة 3 أشهر على الأقل. ويبين الشكل 2المخطط الانسيابي لهذا البروتوكول.- إعداد دميم والمتوسطة تشريح والمالحة الاحتضان وتصفيح المتوسطة كما هو مبين في الخطوات 1.3.1–1.3.4، و جدول للمواد.
- إعداد المتوسطة الغسيل يشكل دميم وإبطال الحرارة الجنين المصل البقري والبنسلين والستربتوميسين (انظر الجدول للمواد)، إذا لزم الأمر.
- استخراج الأجنة E18 – 19 من الرحم الفئران الإناث تخديره أو الماوس، استخدام مقص التشريح الدقيق، واستخدام الملقط الدائري لوضع كل الأجنة المستخرجة في دميم المثلج للتخدير البارد.
- إزالة الأدمغة الأجنة والاحتفاظ بها في تشريح المثلج المتوسطة. إزالة كورتيكسيس والحفاظ عليها في المياه المالحة حضانة توضع في أنبوب مخروطي 15 مل على الجليد.
- أغسل كورتيكسيس مع المالحة الاحتضان واحتضان كورتيكسيس مع التربسين (1.25 ملغ/مل) والدناز أنا (0.25 مغ/مل) في المحلول الملحي الحضانة لمدة 5 دقائق عند 37 درجة مئوية. حجم حاضنات الموصى بها كورتيكسيس 12 مل 5.4 المالحة حضانة و 300 ميليلتر من 20 x التربسين الأسهم 300 ميليلتر من 20 x الأسهم الدناز أنا.
- أغسل كورتيكسيس 3 x مع المالحة المثلج الحضانة.
- إزالة المادة طافية وإضافة 2 مل متوسطة الطلاء تستكمل مع 150 ميليلتر من الدناز أنا الأسهم. فصل الخلايا من بيبيتينج أقل من 20 السكتات الدماغية، وتصفية الخلايا باستخدام مصفاة خلية مع حجم مسام 70 ميكرون.
- أغسل مصفاة الخلية مع 20 مل الوسط والطلاء لطلاء. لإعداد مخزون الخلايا المجمدة، تغسل الخلايا مع 20 مل المتوسطة يغسل (انظر الجدول للمواد)
- قياس كثافة الخلايا قابلة للتطبيق، باستخدام عداد خلية واﻷسلوب تريبان الأزرق.
- تمييع الخلايا القشرية لكثافة 1.4 × 105 قابلة للحياة خلايا/مل مع المتوسطة والطلاء وإضافة 1 مل تعليق خلية المخفف كوفيرسليبس المغلفة بجزيرة الأمير إدوارد في لوحات الثقافة 12-جيدا.
- الحفاظ على الخلايا عند 37 درجة مئوية في حاضنة2 CO لمدة 2 – 3 أيام وتغيير الثقافة المتوسطة إلى المتوسطة الصيانة.
- بعد خطوة 1.4.9، إعداد مخزون الخلية القشرية المجمدة من سينتريفوجينج الخلايا في 187 س ز 3 دقيقة، باستخدام دوار سوينغ.
- نضح المادة طافية وإضافة المتوسطة للواسمات (انظر الجدول للمواد) أبقى في 4 درجات مئوية، للحصول على كثافة خلية 1 × 107 خلايا/مل. 1 مل الكوة من تعليق خلية في أنابيب التبريد.
- وضع الأنابيب في خلية تجميد حاوية بمعدل تجميد-1 درجة مئوية/دقيقة، حتى يتم التوصل إلى درجة حرارة-80 درجة مئوية، ونقل الحاوية التجميد في ثلاجة-80 درجة مئوية. ويمكن تخزين الخلايا لمدة 3 أشهر على الأقل في-80 درجة مئوية.
- لإحياء خلايا مجمدة، بريوارم بغسل المتوسطة (حوالي 13 مل لكل أنبوبة المبردة) والصيانة المتوسطة للخلايا القشرية المجمدة (انظر الجدول للمواد).
- ذوبان الجليد الخلايا المجمدة سريعاً في 37 درجة مئوية في حمام مائي.
- تمييع الخلايا المذابة بلطف مع المتوسطة بريوارميد المياه والصرف الصحي. الطرد المركزي الخلايا في 187 س ز 3 دقيقة، باستخدام دوار سوينغ.
- تعليق بيليه في 1 مل من غسل المتوسطة وقياس كثافة خلايا قابلة للحياة.
- تمييع الخلايا مع الصيانة المتوسطة للخلايا القشرية المجمدة تسفر عن كثافة خلية 3.0 x 105 خلايا/مل قابلة للاستمرار، والبذور 1 مل تعليق خلية في لوحات 12-جيدا المغلفة بجزيرة الأمير إدوارد.
2-التعبير عن جيسيس المستهدفة للغشاء
-
تعداء الخلايا
- إضافة 250 نانوغرام بلازميد جيتشي (أي، GCaMP6f لك أو لك-RCaMP2 OER-GCaMP6f مع المروج CMV)7,8,9 إلى 100 ميليلتر من المصل انخفاض المتوسط (انظر الجدول للمواد) كل بئر. كوترانسفيكشن لك RCaMP2 و OER-GCaMP6f، استخدام 250 نانوغرام لكل بلازميد في 100 ميليلتر من المصل انخفاض متوسط في كل بئر.
- إضافة 0.5 ميليلتر من تعداء كاشف (انظر الجدول للمواد) الواحدة وكذلك في المخلوط المتوسط خفض بلازميد المصل. بالنسبة كوترانسفيكتيون لك RCaMP2 و OER GCaMP6f، إضافة 0.5 ميليلتر من تعداء كاشف كل بئر.
- احتضان هذا الخليط لمدة 30 دقيقة في درجة حرارة الغرفة (20-28 درجة مئوية).
- إضافة 100 ميليلتر من الخليط لكل ساترة بطريقة دروبويسي.
- احتضان الخلايا ح 48 – 72 في حاضنة2 CO في 37 درجة مئوية للسماح بالتعبير عن جيسيس.
-
تعداء والإصابة بعدوى الفيروس المرتبط بالغدد الخلايا العصبية هيبوكامبال أو القشرية
ملاحظة: تعداء لمدة 3 – 5 أيام في المختبر (DIV) يؤدي ارتفاع معدل تعداء الخلايا العصبية. تعداء في الدرجة 6 – 8 المفضل للتعبير الأمثل عن جيسيس في أستروسيتيس. للتعبير عن جيسيس في الثقافة منفصلان الخلايا العصبية بعد 9 DIV، يوفر عدوى نواقل الفيروسات المرتبطة بالغدة (إف) كفاءة أفضل تعبير. استخدام HEK293 الخلايا الناقلة إف للتعبير عن GCaMP6f لك ولك-RCaMP2 OER-GCaMP6f تحت EF1a المروجين أعدت كما هو موضح سابقا،12 (انظر الجدول للمواد).- تعداء 3 – 8 أيام بعد الطلاء، تسمية اثنين أنابيب، واحدة للحمض النووي بلازميد والآخر لكاشف تعداء.
- إضافة 50 ميليلتر من المصل انخفاض المتوسط (انظر الجدول للمواد) كل بئر لكل أنبوبة.
- إضافة 0.5 ميكروغرام من بلازميد الحمض النووي كل ساترة وميليلتر 1 الملحق مصحوبا بكاشف تعداء للخلايا العصبية (انظر الجدول للمواد) الواحدة وكذلك إلى الأنبوب بلازميد الحمض النووي. كوترانسفيكشن لك RCaMP2 و OER-GCaMP6f، تختلط 0.5 ميكروغرام لكل بلازميد وميليلتر 1 من الملحق في 50 ميليلتر من المصل انخفاض متوسط كل بئر.
- أضف 1 ميليلتر من تعداء كاشف (انظر الجدول للمواد) كل بئر في الأنبوب كاشف تعداء. يتم استخدام نفس الكمية من تعداء كاشف كوترانسفيكتيون.
- دوامة كل أنابيب ل s 1 – 2.
- إضافة خليط كاشف تعداء (من الخطوة 2.2.4) إلى خليط الحمض النووي (من الخطوة 2.2.3). مزيج من بيبيتينج برفق واحتضان الخليط (100 ميليلتر كل ساترة) لمدة 5 دقائق في درجة حرارة الغرفة.
- تحميل هذا الخليط على الخلايا بطريقة دروبويسي.
- احتضان الخلايا في حاضنة2 CO 2-3 أيام حتى يتم التعبير عن البروتينات ماركر.
- لعدوى إف، إضافة 3 ميليلتر من إف كل بئر لثقافة astrocyte العصبية مختلطة. المزيج بلطف هزاز الطبق. للعدوى المزدوجة لك-RCaMP2 و OER-GCaMP6f، هو عرض 3 ميليلتر من كل إف كل بئر. في حالة إعداد الخلايا معربا عن جيسيس غير كافية، ينبغي أن تحدد مقدار إف الأمثل للعدوى.
- الحفاظ على الثقافة لمدة 1 – 2 أسابيع حتى يتم التعبير عنها جيسيس.
3-Ca2 + تصوير
-
التصوير المتزامن للخلايا معربا عن RCaMP2 لك و OER-GCaMP6f
ملاحظة: إلى السجل في نفس الوقت إشارات لك-RCaMP2 و OER-GCaMP6f، تقسيم الصورة البصريات مطلوبة. البصريات تمكين الفصل بين RCaMP2 و GCaMP6f وعلى الإسقاط على نفس الإطار الصور الفوتوغرافية من الكاميرا (الشكل 3A). التصوير متزامنة أيضا يتطلب مصادر (1) الخفيفة التي يمكن أن تنبعث في نفس الوقت الإثارة الخفيفة باللون الأزرق (450-490 نانومتر) ويعين أطياف الأخضر (500 – 560 نانومتر)، وتصفية (2) مزدوجة النطاق مرآة مزدوج اللون في المجهر، والانبعاثات (3) مرشحات ل RCaMP2 و GCaMP6f. لمزيد من التفاصيل، أرجع إلى الجدول للمواد.- قم بتشغيل أجهزة التصوير وأجهزة الكمبيوتر على الأقل 30 دقيقة قبل التسجيل. بريوارم المجهر تدفئة الغرفة إلى 37 درجة مئوية. قم بإعداد الجهاز تقسيم الصورة، عوامل التصفية، ومصدر الضوء. قم بمحاذاة البصريات تقسيم الصورة بحيث يظهر نفس الحقل للعرض على الكاميرا. اختر عدسة الهدف المناسب (انظر الجدول للمواد).
- جبل ساترة تحتوي على الخلايا transfected مع RCaMP2 لك و OER-GCaMP6f في دائرة التسجيل، أضف المتوسطة التصوير المناسبة أو المخزن المؤقت (400 ميليلتر كوفيرسليبس 18 ملم) في الدائرة، ووضعه على المسرح المجهر. ضع غطاء على غرفة تسجيل لتجنب تبخر المتوسط.
- تحديد موقع الخلايا معربا عن RCaMP2 لك و OER-GCaMP6f بالتصوير الفلورسنت. التقليل من حدة الإثارة الخفيفة لمنع فوتوبليتشينج والضيائيه.
- إزالة الغطاء وبدء تسجيل الوقت الفاصل بين الساعة 10 هرتز. خلال هذا التسجيل، إضافة مؤثر إلى الدائرة لاستحضار Ca2 + ردود (مثلاً، الهيستامين لخلايا هيلا، ATP للخلايا كوس-7).
- حفظ بيانات الوقت الفاصل في محرك الأقراص الثابتة (HDD).
- تحليل البيانات باستخدام برنامج تحليل الصور.
-
تسجيل أنشطة تلقائية astrocytes الإعراب عن RCaMP2 لك و OER-GCaMP6f
ملاحظة: دون تقسيم الصورة البصريات، يمكن رصد Ca2 + الإشارات في غشاء البلازما والمحيطين لائحة في نفس الخلية. ويرد هنا، تسجيل متسلسل لك-RCaMP2 و OER-GCaMP6f في أستروسيتيس نفس. هدف نفط-غمر مع فتحه عددية أكبر من 1.3 ينصح بشدة لعفوية Ca2 + النشاط.- قم بتشغيل المجهر، الكاميرا، ومصدر الضوء، والتدفئة مجهر الدائرة على الأقل 30 دقيقة قبل أن يسجل.
- جبل ساترة تحتوي على خلايا transfected مع RCaMP2 لك و OER-GCaMP6f في قاعة تسجيل وإضافة 400 ميليلتر للتصوير المتوسط. ضع غطاء على رأس الدائرة.
- اختر عامل التصفية بتعيين GCaMP6f ومصدر الضوء (الضوء الإثارة، مثل 470– 490 الأزرق نانومتر؛ انظر الجدول للمواد). حدد موقع أستروسيتيس الإعراب عن OER-GCaMP6f.
- اختر مجموعة تصفية ومصدر الضوء ل RCaMP2 (أخضر الإثارة الخفيفة، مثلاً، 510 – 560 نانومتر؛ انظر الجدول للمواد) وتأكيد ما إذا كان يتم التعبير عن RCaMP2 لك في astrocytes نفس. تجنب التعرض الطويل لمصدر الضوء لمنع فوتوبليتشينج.
- حفظ سجل الوقت الفاصل بين صور لك-RCaMP2 في 2 هرتز للحد الأدنى 2 بيانات التصوير على القرص الصلب.
- قم بتغيير عامل التصفية المحددة لذلك ل GCaMP6f. سجل الوقت الفاصل بين صور OER-GCaMP6f في مجال الرؤية نفسها، في 2 هرتز لمدة دقيقة 2 حفظ البيانات على القرص الصلب.
- تحليل البيانات باستخدام برنامج تحليل الصورة.
-
تسجيل نشاط الخلايا العصبية عفوية والمستحثه Ca2 + ارتفاع في الخلايا العصبية
ملاحظة: مجهر الإعداد لتصوير الخلايا العصبية هو نفسه الذي هو موضح في القسم 3.2. ويرد هنا، تصوير Ca2 + الارتفاع الناجم عن تفعيل مجلور بسبب OER GCaMP6f وعفوية Ca2 + الارتفاع بسبب GCaMP6f لك.- لتسجيل نشاط الخلايا العصبية عفوية، جبل ساترة تحتوي على خلايا معربا عن GCaMP6f لك في قاعة التسجيل وإضافة 400 ميليلتر للتصوير المتوسطة. ضع غطاء على رأس الدائرة.
- تعيين عامل التصفية ومصدر الضوء (الأزرق الإثارة، مثلاً 470 – 790 نانومتر؛ انظر الجدول للمواد) إلى تلك المتعلقة GCaMP6f. البحث عن الخلايا العصبية معربا عن GCaMP6f لك وعرض النشاط العفوي.
- الحصول على الصور في 2 هرتز أو أسرع. حفظ البيانات على القرص الصلب.
- تحليل البيانات باستخدام برنامج تحليل الصورة.
- لتسجيل Ca2 + الارتفاع المستحث، جبل كوفيرسليبس تحتوي على خلايا معربا عن OER-GCaMP6f مع 400 ميليلتر التصوير المتوسطة. ضع غطاء على رأس الدائرة.
- استخدام عامل تصفية مجموعة ل GCaMP6f، العثور على الخلايا العصبية في التعبير عن OER-GCaMP6f.
- قم بإزالة الغطاء. بدء تسجيل الوقت الفاصل بين الساعة 2 هرتز أو أسرع. أثناء التسجيل، أضف يضع لمستقبل إلى جانب البروتين Gq (مثلاً، mGluR5 مؤثر [RS]--3، 5-ديهيدروكسيفينيلجليسيني [دهبج]) لاستحضار Ca2 + إطلاق سراح لائحة.
- حفظ الوقت الفاصل بين الصور على القرص الصلب، وتحليل البيانات.
النتائج
وأبديت لك-RCaMP2 و OER-GCaMP6f في خلايا هيلا، وسجلت كل الإشارات في وقت واحد باستخدام تقسيم الصورة البصريات، 24 ساعة بعد تعداء (الشكل 3 ألف و 1 فيديو). الصور تم الحصول عليها في 10 هرتز-الهيستامين (له 1 ميكرومتر)، الذي يستحث Ca2 + الإصدار لائحة، أضيفت أثناء التسجيل. عند تطبيق له، زيادة كثافة إشارة لك-RCaMP2 و OER-GCaMP6f، كما يتضح من عرض بسيودوكولور ΔF/F0، الذي يمثل التغيير من شدة الأسفار الأولى (الشكل 3B). وقورنت الدورات وقت Ca2 + الارتفاع (ΔF/F0) ذكرت لك-RCaMP2 و OER-GCaMP6f في المنطقة نفسها من الاهتمام (ROI) (الشكل 3). تم تطبيع القيم ΔF/F0 إلى قيمها الذروة لتمكين المقارنة بالطبع الوقت بين جيسيس مختلفة اثنين، التي لديها مستويات مختلفة من التعبير والتوزيعات. وأفادت كل من أجهزة الاستشعار التذبذب مثل Ca2 + ارتفاع. فحص لك-RCaMP2 و OER-GCaMP6f أظهرت نفس مسار الوقت Ca2 + ارتفاع في خلايا اثنين من بين أنواع الخلايا الخمس (الشكل 3، ROI 1 و 3). بيد أن Ca2 + المرتفعات تبديه لك-RCaMP2 ظلت في مستوى أعلى مقارنة بما تبديه OER-GCaMP6f (الشكل 3 جيم، دوروا 2 و 4 و 5). وتبين النتائج أن أمده Ca2 + الارتفاع محيط غشاء البلازما، في حين أنه يتم إنهاؤها في وقت سابق حول لائحة، الذي هو مصدر هذا Ca2 + إشارة الناجمين عن طريق تحفيز له.
Ca عفوية2 + إشارات من أستروسيتيس في الخلايا العصبية-astrocyte مختلطة الثقافة من الفئران هيبوكامبي (الشكل 4A) وكورتيكسيس (الشكل 4) عرضت لك-RCaMP2 و OER-GCaMP6f (الشكل 4، فيديو 2، 3 فيديو ، و الفيديو 4و الفيديو 5). تم أحياء الثقافات القشرية من الأسهم المجمدة التي تم إعدادها كما هو مبين في هذا البروتوكول. وسجلت إشارات لك--RCaMP2 و OER GCaMP6f تسلسلياً في 2 هرتز من نفس الخلايا. واختيرت رويس ثلاثة في المنطقة التي أظهر Ca2 + ارتفاع بكل جيتشي، وغيرت مجرى الزمن ΔF/وقاعدة (أي، شدة الأسفار) من الأسفار متوسط الكثافة أثناء فترة تسجيل كامل (وقاعدة ). عندما fluorescence الأساس مستقر و Ca2 + المرتفعات أقل تواترا، وقاعدة يصبح أساس مفيدة للكشف عن أحداث Ca2 + الارتفاع. عفوية Ca2 + المرتفعات كانت مرئية فقط في عملية أستروسيتيك، وليس في نص الخلية. هذه النتيجة غير متسقة مع التقارير السابقة بشأن أستروسيتيك Ca2 + إشارات عفوية جيسيس في المختبر تصور13 و المجراة في14أخرى. في astrocytes هيبوكامبال والقشرية على حد سواء، Ca2 + المرتفعات تبديه لك-RCaMP2 (أعلى) كانت أكثر تواترا مما أبداه OER-GCaMP6f. هذه النتيجة تتسق مع المظاهرة السابقة لدينا أن Ca2 + المرتفعات في أستروسيتيس بسبب GCaMP6f لك تم الكشف عن أكثر من تلك التي تعزى إلى OER-GCaMP6f7 ويوحي بأن هذا المفهوم ينطبق أيضا على مستوى خلية واحدة.
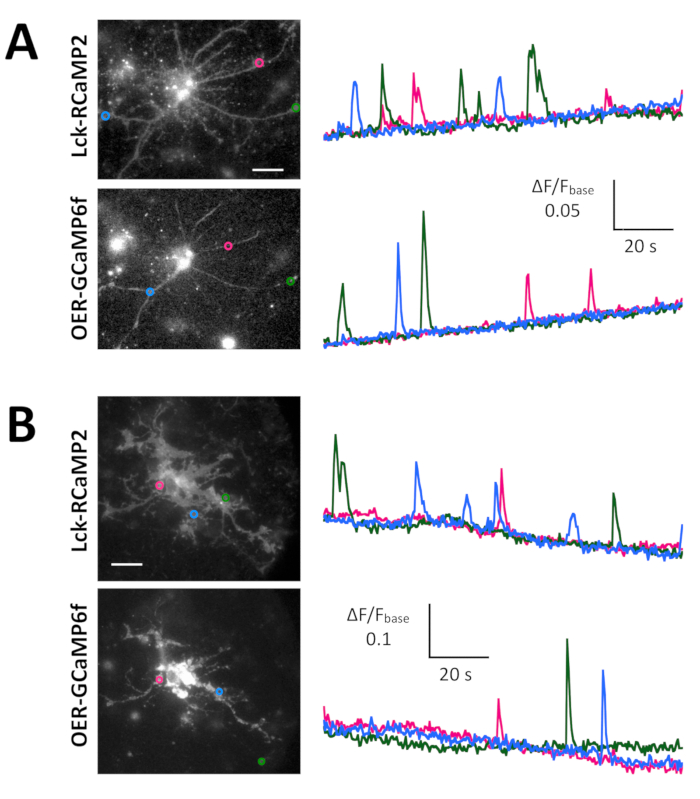
شوهدت عفوية Ca2 + المرتفعات التي GCaMP6f لك في الفئران غير ناضجة هيبوكامبال الخلايا العصبية (الدرجة 10) في 2 هرتز (الشكل 5 ألف و 6 فيديو). دورات الزمن ΔF/F0 في خمسة رويس مختلفة تشير إلى أن هذه Ca2 + المرتفعات تنحصر محلياً في المجالات سوبسيلولار. الشكل 5B ويبين (7 فيديو) Ca2 + الردود في الخلايا العصبية هيبوكامبال الماوس ناضجة (30 DIV) مصاب بناقلات إف OER-GCaMP6f-التعبير. وقد حفز الخلايا العصبية مع 100 ميكرومتر دهبج، وهو مؤثر على مستقبلات الغلوتامات ميتابوتروبيك، الذي يحفز Ca2 + الإصدار. تم الكشف عن دهبج الناجمة عن Ca2 + الإصدار سبب OER-GCaMP6f.
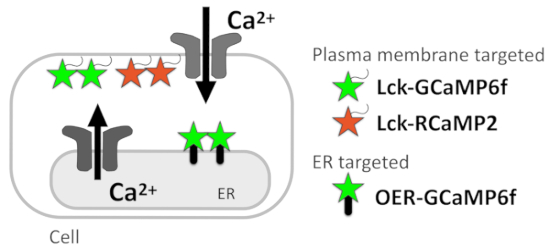
رقم 1: رسم تخطيطي يوضح جيسيس المستهدفة للغشاء. الرسم التخطيطي جيسيس المستهدفة لغشاء البلازما (GCaMP6f لك ولك-RCaMP2) والخارجي ER غشاء المستهدفة GCaMP6f (OER-GCaMP6f).
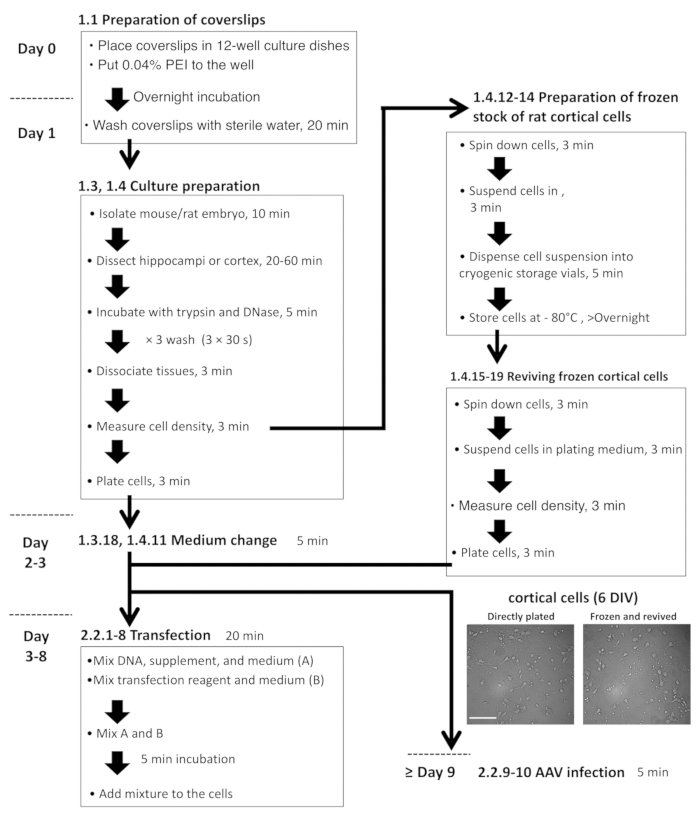
رقم 2: مخطط انسيابي لإعداد الخلية هيبوكامبال والقشرية وتعداء بلازميد العدوى إف. الصور المجهرية الممثل، طازجة مطلي DIV-6 القشرية الخلايا (يسار) وإحياء الخلايا من الأوراق المالية المجمدة (يمين). شريط المقياس = 100 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
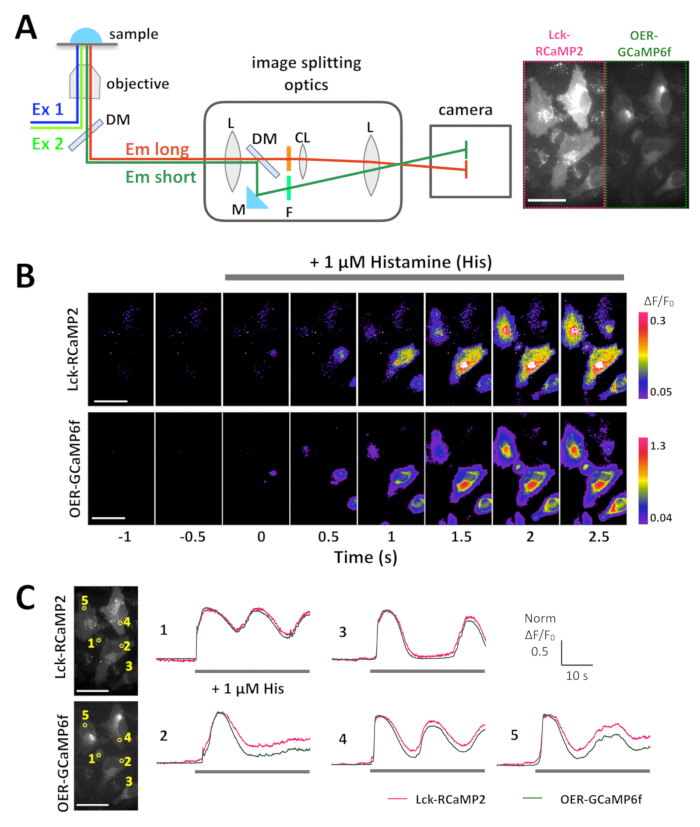
الشكل 3: مثال على تصوير المتزامنة لك-RCaMP2 و OER-GCaMP6f في خلايا هيلا. (أ) التمثيل التخطيطي لفصل الإشارات مع البصريات تقسيم الصورة. ومن المتوقع في نفس الوقت نفس الحقل من عرض لك-RCaMP2 و OER-GCaMP6f على الكاميرا. تسجيل ممثل المكتسبة في 10 هرتز بكاميرا CMOS يتم توفيرها في الفيديو 1، ويظهر إطار واحد لهذا التسجيل في الفريق A (يمين). (ب) الصور الملونة الزائفة من ΔF/F0 لك-GCaMP2 (أعلى) و OER-GCaMP6f (أسفل). الهيستامين (له, 1 ميكرومتر) أضيف في الممثل (ج) س. 0 مسار تطبيع ΔF/F0 الوقت لك-GCaMP2 (أرجواني) و OER-GCaMP6f (أخضر). تم تطبيع البيانات إلى الحد الأقصى للقيمة ΔF/F0 لكل قطعة. وتشير الأشرطة الرمادية إلى توقيت طلبه. تم تحليل البيانات مع برامج مصنوعة خصيصا منضدة تي15. شريط المقياس = 50 ميكرومتر (صورة مجهرية). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
الشكل 4: عفوية Ca2 + الارتفاع في أستروسيتيس رصد للتعبير لك-RCaMP2 و OER-GCaMP6f- (أ) ممثل هيبوكامبال و astrocytes القشرية (ب) transfected مع لك-RCaMP2 (أعلى) و OER-GCaMP6f (أسفل). تم أحياء الخلايا القشرية من الثقافات الأرصدة المجمدة. RCaMP2 لك والصور OER GCaMP6f اقتنى تسلسلياً في نفس الخلية، في 2 هرتز، مع كاميرا م-اتفاقية مكافحة التصحر. المؤامرات على إظهار الأيسر دورات الزمن ΔF/فباسي تقاس رويس المشار إليه في الصورة المجهرية. تم تحليل البيانات مع منضدة منظمة الشفافية الدولية. وترد في فيديو 2، فيديو 3، فيديو 4، و 5 فيديوأفلام الفعلية. شريط المقياس = 20 ميكرومتر (صورة مجهرية). وتقترح الانجراف الأساس التغيرات في Ca2 + المستوى العالمي في الخلية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
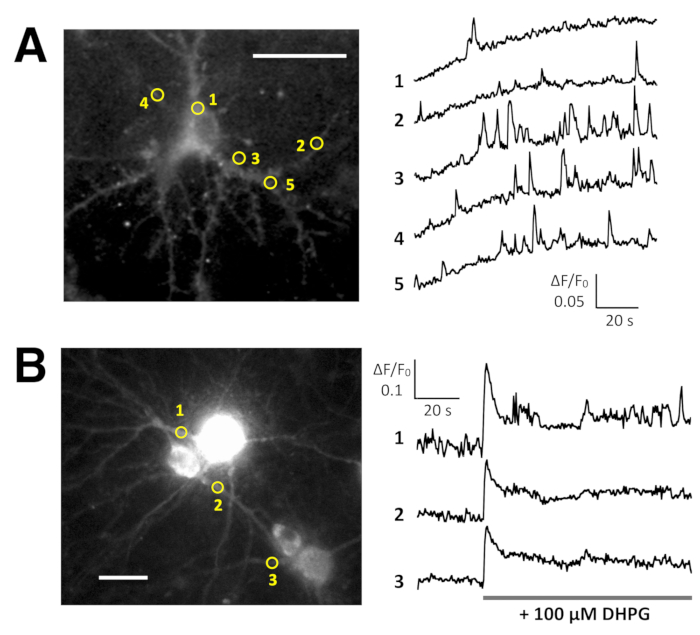
الشكل 5: أمثلة من Ca2 + تصوير في الخلايا العصبية مع GCaMP6f لك و OER-GCaMP6f- (أ) الممثل الفئران العصبية هيبوكامبال معربا عن GCaMP6f لك في 10 DIV (يسار) وقطع عرض الوقت دورات ΔF/F0 تقاس في رويس (الدوائر الصفراء) قد ذكرت في الصورة (على اليمين). الأرقام في مجرى الوقت تناظر الأرقام عائدات الاستثمار في الصورة. ملاحظة أن النمط الزمني Ca2 + الارتفاع يختلف بين مناطق مختلفة من الاهتمام. وتقترح الانجراف الأساس الزيادة في Ca2 + المستوى العالمي في هذه الخلايا العصبية. (ب) مثال على الماوس ناضجة هيبوكامبال الخلايا العصبية (DIV 30) مصاب بالتعبير OER-GCaMP6f إف ناقلات (يسار). الوقت يظهر المؤامرة بالطبع من ΔF/F0 يقاس Ca2 + الاستجابة إلى 100 ميكرومتر (RS)--3، 5-ديهيدروكسيفينيلجليسيني (دهبج) المطبقة في توقيت تظهر بشريط رمادي. الدوائر الصفراء تظهر موقف رويس حيث تم الحصول على مسار الزمن. حصلت على 2 هرتز مع كاميرا CCD تبريد (لوحة أ) أو كاميرا م-اتفاقية مكافحة التصحر (فريق ب) الصور وتحليلها مع منضدة منظمة الشفافية الدولية. شريط المقياس = 20 ميكرومتر (صورة مجهرية). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
الفيديو 1: مثال لتصوير المتزامنة لك-RCaMP2 و OER-GCaMP6f في خلايا هيلا. تسجيل الممثل المكتسبة في 10 هرتز، وعرضت في الشكل 3. شريط المقياس = 50 ميكرومتر. اضغط هنا لتحميل هذا الفيديو.

فيديو 2: عفوية Ca2 + عابرة لوحظت في RCaMP2 لك astrocyte هيبوكامبال- تسجيل الممثل المكتسبة في 2 هرتز (الشكل 4A)، سجلت في نفس الحقل للعرض فيديو 3. شريط المقياس = 20 ميكرومتر. اضغط هنا لتحميل هذا الفيديو.
الفيديو 3: عفوية Ca2 + عابرة لوحظت في OER GCaMP6f astrocyte هيبوكامبال. تسجيل الممثل المكتسبة في 2 هرتز (الشكل 4 أ)، في نفس الحقل للعرض الفيديو 2. شريط المقياس = 20 ميكرومتر. اضغط هنا لتحميل هذا الفيديو.
الفيديو 4: عفوية Ca2 + عابرة لوحظ في RCaMP2 لك في أستروسيتي القشرية تسجيل الممثل المكتسبة في 2 هرتز (الشكل 4 باء)، سجلت في نفس الحقل من عرض الفيديو5. شريط المقياس = 20 ميكرومتر. اضغط هنا لتحميل هذا الفيديو.
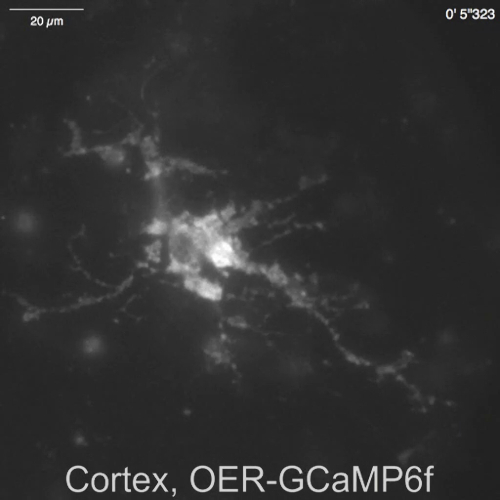
الفيديو 5: عفوية Ca2 + عابرة لوحظت في OER-GCaMP6f أستروسيتي القشرية. تسجيل الممثل المكتسبة في 2 هرتز (الشكل 4 باء)، في نفس الحقل من عرض الفيديو4. شريط المقياس = 20 ميكرومتر. اضغط هنا لتحميل هذا الفيديو.
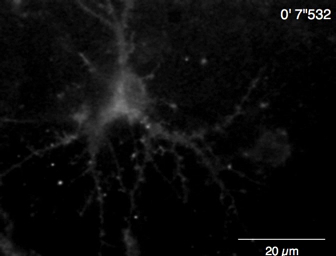
فيديو 6: مثال Ca2 + التصوير في الفئران هيبوكامبال خلية (الدرجة 10) التي GCaMP6f لك. مثال لكاليفورنيا العصبية2 + إشارات سجلت في 2 هرتز (الشكل 5A). شريط المقياس = 20 ميكرومتر. اضغط هنا لتحميل هذا الفيديو.
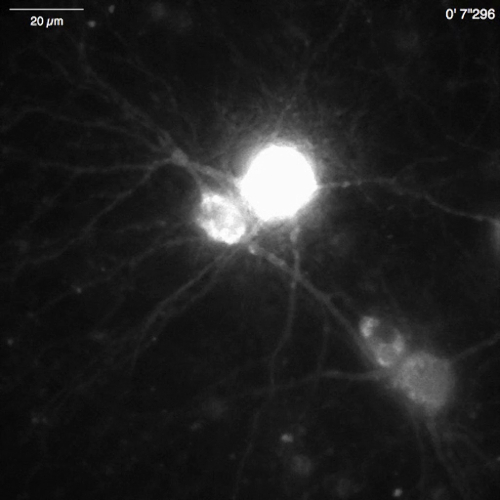
فيديو 7: Ca2 + الإصدار في العصبية هيبوكامبال ماوس (DIV 30) معربا عن OER-GCaMP6f- المثال العصبية Ca2 + الإشارات المسجلة في خلية هيبوكامبال ماوس المصابين OER-GCaMP6f التعبير إف ناقلات (الشكل 5 (ب)). العصبية وحفز مع 100 ميكرومتر ديهيدروكسيفينيلجليسيني (دهبج) يطبق في 30 ثانية لاستحضار Ca2 + الإصدار لائحة. شريط المقياس = 20 ميكرومتر. اضغط هنا لتحميل هذا الفيديو.
Discussion
النواتج بيولوجية متنوعة تبدأ بإشارات Ca2 + . Ca2 + رسول تنوعاً مما يشير إلى داخل الخلايا. تم فك التشفير Ca2 + إشارات نواتج محددة تثير سؤالاً بيولوجية أساسية، ومطلوبة من Ca2 + تقنيات التصوير لوصف تنوع Ca2 + إشارات. البروتوكول مفصلاً حاليا يتيح الكشف عن Ca2 + إشارات مميزة في غشاء البلازما و ER (رقم 3 و رقم 4) والمحلية Ca2 + ميكرودومينس داخل خلية (الشكل 4 و الشكل 5). وهذا يسهم في وصف تنوع Ca2 + الإشارات داخل الخلايا. يشير القرار الزماني من Ca2 + تحسنت أيضا باستهداف جيسيس في غشاء البلازما و ER نظراً لأنه يمكن تجنب تأثير انتشار ثلاثي الأبعاد من Ca2 + وجيسيس أنفسهم، وأن من الممكن للكشف عن اللحظة بالذات من Ca2 + تدفق أو Ca2 + الإصدار، الذي يحدث في الغشاء.
البروتوكول على بعض القيود. المستخدمين يجب أن نضع في اعتبارنا أن الإشارات التي تم الكشف عنها هي مجموع "في الوقت الراهن من Ca2 + تدفق أو الإفراج عنه" و "Ca2 + موزع خارجاً من Ca2 + المصدر الأصلي"، خاصة بالنسبة لكاليفورنيا2 + إشارات كبيرة. على سبيل المثال، على الرغم من أن يستحضر له التحفيز في خلايا هيلا Ca2 + الإفراج عن لائحة، Ca الناتجة عن اكتشاف2 + إشارات ليس فقط باستهداف ER OER-GCaMP6f ولكن أيضا بغشاء البلازما-تستهدف لك-RCaMP2 (الشكل 3). قيد آخر أن نمط الزمانية المكانية من Ca2 + إشارات قد لا تكون العامل المحدد الوحيد لإخراج Ca2 + إشارات. توزيع البروتينات المستجيب المتلقين للمعلومات (مثل Ca2 +-تعتمد مؤنزم و phosphatases) قد يكون أيضا تحديد عامل2. تماما فك Ca2 + الإشارات داخل الخلايا، تحليل سلوك إنزيم المصب، التي لم يتم تغطيتها في هذا البروتوكول، ضروري على الإطلاق.
أحد الجوانب الأكثر أهمية لنجاح Ca2 + تصوير هو اقتناء الإعداد والصورة تصوير الأوضاع، وكذلك فيما يتعلق بدراسات أخرى تعيش-التصوير. أظهرنا سابقا أن Ca2 + الردود في الخلية تعتمد اعتماداً كبيرا على مدة وشدة الإثارة وعلى شروط اكتساب صورة، بما في ذلك التعرض الوقت واكتساب التردد16. قوة الإضاءة الإثارة هو العامل الأهم، كما أنها يمكن أن تسبب السمية الخفيفة وفوتوبليتشينج من جيسيس. ينبغي أن يكون الأمثل شروط تسجيل وقت التعرض، تسجيل تواتر وكثافة الضوء الإثارة ومدة التسجيل وفقا للغرض من هذه التجربة. نحن نوصي بتقليل زمن التعرض وشدة الضوء الإثارة قدر الإمكان لتجنب فوتوبليتشينج والضيائيه للخلية. تكرار التسجيل ومدة التسجيل ينبغي أن يكون كافياً تغطية أحداث Ca2 + ارتفاع الاهتمام ولكن ينبغي أن تظل منخفضة قدر الإمكان لتجنب فوتوبليتشينج والضيائيه أيضا. نوصي بتحديد المدة وتواتر تسجيل أولاً والاستفادة المثلى من شدة الضوء وزمن التعرض حيث أن فوتوبليتشينج من جيسيس مصغراً. هناك عامل هام آخر هو مستوى جيسيس التعبير. لقد جيسيس Ca2 +-التخزين المؤقت التأثير كما هي Ca2 +-ملزم البروتينات. ولذلك، يؤدي overexpression جيسيس التخزين المؤقت من Ca2 +، الذي من الناحية الفسيولوجية اللازمة للخلايا. وينبغي تقليل مقدار التعبير جيتشي لتجنب تصوير الخلايا معربا عن كميات عالية من جيسيس.
وفي الختام، تشريح Ca2 + الإشارات بدقة سوبسيلولار هي واحدة من أهم الخطوات لفك التشفير Ca2 + الإشارات داخل الخلايا التي تحدد ظاهرة الإنتاج البيولوجي. هذا البروتوكول يوفر طريقة جديدة لتشريح Ca2 + إشارات لوصف التنوع فيما بين هذه الإشارات. في الوقت الحاضر، هذا الأسلوب محدود للتجارب في المختبر. بيد أن يتم بالفعل استخدام GCaMP6f لك لالمجراه في Ca2 + التصوير في الفئران17وأكدت OER-GCaMP6f لرصد Ca2 + إشارات في المجراة في الخلايا العصبية الحركية مرض جنسي في ايليجانس جيم-7. ولذلك، تستهدف جيسيس في حجرة سوبسيلولار لديه القدرة على توسيع المجراة في التصوير في المستقبل، وبالتالي تمكين Ca2 + تشريح المجراة.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
يتم دعم هذا العمل بالمنح التالية: "اليابانية للعلوم" والتكنولوجيا وكالة (JST) بريكورسوري للبحوث "الجنينية العلوم" والتكنولوجيا (المعزوفة) (JPMJPR15F8، اليابان)؛ الجمعية اليابانية لتعزيز العلوم (JSPS)/منح مساعدات للبحث العلمي (كاكينهي) (JP18H05414، JP17H05710، JP16K07316)، مؤسسة تأكيدا. يشكر المؤلفون هاروهيكو بيتو (جامعة طوكيو) لتوفير RCaMP2 وآرثر ج. ي هوانغ وتوماس ماك هيو (CBS بتبريد) لتوفير ناقلات إف وتعليمات بشأن إعداد إف. الكتاب أيضا يود أن يشكر المحررين في "مجلة تجارب تصور" لمساعدتهم بتصوير الفيديو وتحريرها.
Materials
| Name | Company | Catalog Number | Comments |
| (RS)-3,5-Dihydroxyphenylglycine (DHPG) | Tocris | #0342 | |
| 0.5% DNase I stock solution | Sigma-Aldrich | #11284932001 | Prepare 0.5% DNase I (w/v) in Hanks' Balanced Salt Solution supplemented with 120 mM MgSO4. Prepare 160 µL aliquots and store at -30 °C. |
| 0.5% Trypsin-EDTA solution | Thermo Fisher Scientific | #25300054 | |
| 100 mM L-glutamine (×100 stock) | Thermo Fisher Scientific | #25030081 | Preparing small aliquots of 250-750 µL and store at -30 °C. |
| 100 mM Sodium pyruvate (×100 stock) | Thermo Fisher Scientific | #11360070 | Aliquots (10 mL) can be stored at -20 °C. After thawing, the solution can be maintained at 4 °C for 2 months. |
| 12-Well multiwell culture plates with low-evaporation lid | Falcon | #353043 | Low-evaporation lid is critical for culturing neuron-glia mixed culture. For cell line cells, alternative culture dishes can be used. |
| 18 mm diameter circular coverslips | Karl Hecht "Assistent" | #41001118 | Thickness 1, 18 mm diameter circular coverslips; alternative coverslips can be used. |
| 1 M HEPES | Thermo Fisher Scientific | #15630080 | pH 7.2-7.6 |
| 2.5% Trypsin stock solution (×20 stock) | Sigma-Aldrich | #T4674 | Prepare 150 µL aliquot and store at -30 °C. |
| 50% Poly(ethyleneimine) (PEI) solution | Sigma-Aldrich | #P3143 | Prepare 2% (V/V) PEI stock solution (×50) with distilled water sterilized by filtration. Store stock solution at -30 °C after preparing small aliquots of 250-750 µL. Prepare 0.04% PEI solution with distilled water on the day of coverslip coating. |
| 70% Ethanol | Kept in a spray bottle to be used for surface disinfection. | ||
| Adeno-associated virus (AAV) for Lck-GCaMP6f, Lck-RCaMP2, and OER-RCaMP2 expression under the direction of the EF1a promoter | AAV can be prepared using AAV Helper Free System (Agilent Technologies) and HEK293 cells, or alternative methods. pAAV.EF1a.Lck-GCaMP6f, pAAV.EF1a.Lck-RCaMP2, and pAAV.EF1a.OER-GCaMP6f are available upon request. | ||
| B-27 supplement (×50 stock) | Thermo Fisher Scientific | #17504044 | This can be replaced by B-27 plus supplement (Thermo Fisher Scientific; #A3582801) or MACS NeuroBrew-21 (Miltenyi Biotec, Bergisch Gladbach, Germany; #130-093-566). |
| B57BL/6 | Japan SLC, Inc. | ||
| Camera for microscopic image recording | The following cameras were available for use: cooled-CCD camera (e.g., Hamamatsu Photonics, OECA-ER), EM-CCD camera (e.g., Hamamatsu Photonics, ImagEM; Andor, iXon) or CMOS camera (e.g., Hamamatsu Photonics ORCA-Flash4.0) | ||
| Cell freezing container | Sarstedt K.K. | #95.64.253 | Alternative cell freezing container can be used. |
| Cell strainer | Falcon | #352350 | |
| CO2 incubator | Maintain at 37 °C, 5% CO2. | ||
| Cryogenic tube | Corning | #430661 | Alternative cryogenic tubes can be used. |
| Cryopreservation medium | Zenoaq | "CELLBANKER1" | |
| Culture medium (for HeLa cells) | Dulbecco's modified Eagle's medium (DMEM) supplemented with 10% heat-inactivated fetal bovine serum, and penicillin-streptomycin solution (final concentration: Penicillin 100 U/mL and Streptomycin 100 µg/mL) | ||
| Dissection medium | One milliliter of 1 M HEPES (final concentration 20 mM) to 49 mL DMEM | ||
| DMEM | Nacalai | #08456-65 | Alternative DMEM can be used. |
| DMEM | Nacalai | #08456-65 | Low glucose |
| DNA transfection reagent | Sigma-Aldrich | #6366244001 | "X-tremegene HP DNA transfection reagent" Alternative transfection reagents can be used. |
| Glass jar with a lid | 500 mL jar (for mouse) or 1,500 mL jar (for rat) to anesthetize the animal | ||
| HBSS | Thermo Fisher Scientific | #14170161 | HBSS free of calcium and magnesium |
| Heat inactivated bovine serum | Thermo Fisher Scientific | #10100147 | |
| HeLa cells | RIKEN BioResource Center | #RCB0007 | |
| Histamine | Sigma-Aldrich | #H7125 | |
| Image analysis software | Such as Metamorph (Molecular Devices), ImageJ (NIH), and TI Workbench14 (custom made) | ||
| Image splitting optics | Hamamatsu Photonics | #A12801-01 | W-view GEMINI |
| Image splitting optics dichroic mirror | Semrock | #FF560-FDi01-25×36 | For separation of green fluorescent protein/red fluorescent protein (GFP/RFP) signal |
| Image splitting optics emission filters | Semrock | #FF01-512/25-25, #FF01-630/92-25 | For emission of GFP/RFP signal, respectively |
| Imaging medium and buffer | Use optimal medium or buffer for the experiment. When medium is used, medium without phenol red is desirable to reduce background fluorescence. Add 20 mM HEPES to maintain pH outside of CO2 incubator. | ||
| Incubation saline | Add 1 mL of 1 M HEPES (20 mM) to 49 mL HBSS | ||
| Inverted fluorescence microscope | Such as IX73 (Olympus) or Eclipse TI (Nikon Instech) | ||
| Isoflurane | Pfizer | Used for anesthesia | |
| Maintenance medium (for 4 × 12 well dishes) | 48.5 mL Neurobasal-A medium supplemented with 1 mL B-27, 500 µL of L-glutamine stock and 25 µL Penicillin-Streptomycin solution. | ||
| Maintenance medium for frozen cortical cells (for 1 × 12 well dishes) | 12.2 mL Neurobasal plus medium supplemented with 250 µL B-27, 125 µL of L-glutamine stock and 6.2 µL Penicillin-Streptomycin solution. | ||
| MEM (Minimum Essential Medium) | Thermo Fisher Scientific | #11090-081 | |
| Microscope filter set for GCaMP6f imaging | Appropriate filter for GFP (excitation, 480 ± 10 nm; emission, 530 ± 20 nm) | ||
| Microscope filter set for RCaMP2 imaging | Appropriate filter for RFP (excitation, 535 ± 50 nm; emission, 590 nm long pass) | ||
| Microscope filter sets for double imaging of RCaMP2 and GCaMP6f | Semrock | #FF01-468/553-25, #FF493/574-FDi01-25×36, #FF01-512/630-25 | Dual excitation filter, Dual dichroic mirror, and emission filter for GFP/RFP imaging. |
| Microscope heating system | A heating system to maintain cells at 37 °C during the imaging. To avoid drift caused by thermal expansion, heating systems covering the entire microscope itself (e.g., Tokai Hit, Thermobox) are recommended. | ||
| Microscope light source for excitation | Mercury lamp (100 W), xenon lamp (75 W), Light-emitting diode (LED) illumination system (e.g., CoolLED Ltd., precisExcite; Thorlabs Inc., 4-Wavelength LED Source; Lumencor, SPECTRA X light engine). In case of mercury lump and xenon lamp, use ND filter to reduce the excitation intensity. | ||
| Microscope objective lens | Plan-Apochromat oil immersion objective with numerical aperture higher than 1.3 is highly recommended for the recording of spontaneous Ca2+ activity in neurons and astrocytes. | ||
| Neurobasal plus medium | Thermo Fisher Scientific | #A3582901 | |
| Neurobasal-A Medium | Thermo Fisher Scientific | #10888022 | Neurobasal plus medium (Thermo Fisher, A3582901) can be used instead of Neurobasal-A medium. |
| PBS(-): Phosphate-buffered saline free of Ca2+ and Mg2+ | Fujifilm Wako Pure Chemical Cooperation | #164-23551 | The absence of Ca2+ and Mg2+ is critical not to inhibit the trypsin activity. An alternative to PBS(-) can be used. |
| PC and image acquisition software | Such as Metamorph (Molecular Devices); Micromanager; TI Workbench14. | ||
| Penicillin-Streptomycin solution | Thermo Fisher Scientific | #15140122 | Penicillin 10,000 U/mL and Streptomycin 10,000 µg/mL |
| Plasmid for Lck-GCaMP6f, Lck-RCaMP2, and OER-RCaMP2 expression under cytomegalovirus promoter 7-9 | Available upon request | ||
| Plating medium (for 4 × 12 well dishes) | 48 mL MEM supplemented with 1 mL B-27 supplement, 500 µL L-glutamine stock (final concentration: 2 mM), 500 µL of sodium pyruvate stock (1 mM) and 25 µL Penicillin-Streptomycin solution (penicillin 5 U/mL, streptomycin 5 µg/mL). This concentration of Penicillin-Streptomycin, which is 1/20 of the concentration recommended by the manufacturer, is critical for neuronal survival. | ||
| Recording chamber | Elveflow | Ludin Chamber | This recording chamber is for 18 mm diameter round coverslips. |
| Reduced serum media | Thermo Fisher | #11058021 | Opti-MEM |
| Stereomicroscope | Used to dissect hippocampi. Olympus SZ60 or equivalent stereomicroscopes are available. | ||
| Surgical instruments | Standard dissecting scissors to cut the abdomen of a mouse or a rat, tweezers to pinch the uterus, delicate dissecting scissors to cut the uterus and the head of embryo, ring forceps to pinch the embryos, 13 cm curved Semken forceps (Fine Science Tools #11009-13) to extract brains, 3 forceps with fine tips (Dumont Inox #5) | ||
| Transfection reagent for neuron | Thermo Fisher Scientific | #L3000008 | "Lipofectamine 3000" reagent. It is composed of the the "supplement (P3000)" that should be mixed with plasmid DNA in the step 2.2.3, and the "transfection reagent (lipofectamine 3000)" used in the step 2.2.4. |
| Trypan blue (0.4%) | Thermo Fisher Scientific | #15250061 | |
| Wash medium for frozen cortical cells | 25 mL DMEM, supplemented with 250 µL heat-inactivated fetal bovine serum + 12.5 µL Penicillin Streptomycin. | ||
| Wistar rats | Japan SLC, Inc | Pregnant rats (E18) |
References
- Clapham, D. E. Calcium signaling. Cell. 131 (6), 1047-1058 (2007).
- Bagur, R., Hajnoczky, G. Intracellular Ca(2+) Sensing: Its Role in Calcium Homeostasis and Signaling. Molecular Cell. 66 (6), 780-788 (2017).
- Bannai, H., et al. Bidirectional Control of Synaptic GABAAR Clustering by Glutamate and Calcium. Cell Reports. 13 (12), 2768-2780 (2015).
- Tojima, T., Hines, J. H., Henley, J. R., Kamiguchi, H. Second messengers and membrane trafficking direct and organize growth cone steering. Nature Reviews Neuroscience. 12 (4), 191-203 (2011).
- Shigetomi, E., Kracun, S., Sofroniew, M. V., Khakh, B. S. A genetically targeted optical sensor to monitor calcium signals in astrocyte processes. Nature Neuroscience. 13 (6), 759-766 (2010).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Niwa, F., et al. Dissection of local Ca(2+) signals inside cytosol by ER-targeted Ca(2+) indicator. Biochemical and Biophysical Research Communications. 479 (1), 67-73 (2016).
- Vervliet, T., et al. Basal ryanodine receptor activity suppresses autophagic flux. Biochemical Pharmacology. 132, 133-142 (2017).
- Sakuragi, S., Niwa, F., Oda, Y., Mikoshiba, K., Bannai, H. Astroglial Ca2+ signaling is generated by the coordination of IP3R and store-operated Ca2+ channels. Biochemical and Biophysical Research Communications. 486 (4), 879-885 (2017).
- Inoue, M., et al. Rational design of a high-affinity, fast, red calcium indicator R-CaMP2. Nature Methods. 12 (1), 64-70 (2015).
- Quasthoff, K., et al. Freshly frozen E18 rat cortical cells can generate functional neural networks after standard cryopreservation and thawing procedures. Cytotechnology. 67 (3), 419-426 (2015).
- Boehringer, R., et al. Chronic Loss of CA2 Transmission Leads to Hippocampal Hyperexcitability. Neuron. 94 (3), 642-655 (2017).
- Arizono, M., et al. Receptor-selective diffusion barrier enhances sensitivity of astrocytic processes to metabotropic glutamate receptor stimulation. Science Signaling. 5 (218), ra27 (2012).
- Kanemaru, K., et al. In vivo visualization of subtle, transient, and local activity of astrocytes using an ultrasensitive Ca(2+) indicator. Cell Reports. 8 (1), 311-318 (2014).
- Inoue, T. TI Workbench, an integrated software package for electrophysiology and imaging. Microscopy (Oxford, UK). 67 (3), 129-143 (2018).
- Miyamoto, A., Bannai, H., Michikawa, T., Mikoshiba, K. Optimal microscopic systems for long-term imaging of intracellular calcium using a ratiometric genetically-encoded calcium indicator. Biochemical and Biophysical Research Communications. 434 (2), 252-257 (2013).
- Srinivasan, R., et al. New Transgenic Mouse Lines for Selectively Targeting Astrocytes and Studying Calcium Signals in Astrocyte Processes In Situ and In Vivo. Neuron. 92 (6), 1181-1195 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved