Method Article
دليل لبناء يميل درجة عالية اجتاحت بلاط المجهر لتصوير جزيء مفرد الحقل لعرض موسع
In This Article
Summary
ويرد وصف تعليمات مفصلة حول كيفية بناء يميل درجة عالية اجتاحت مجهر بلاط (هيست) واستخدامها لتصوير جزيء واحد.
Abstract
تصوير جزيء واحد متقدمة إلى حد كبير فهمنا للآليات الجزيئية في الدراسات البيولوجية. ومع ذلك، لقد كان تحديا للحصول على صور كبيرة حقل من عرض، وعالية التباين في سميكة من الخلايا والأنسجة. هنا، نحن نقدم الفحص المجهري يميل شديدة اجتاحت بلاط (هيست) أن يتغلب على هذه المشكلة. ونفذ زوج من العدسات الاسطوانية لتوليد شعاع ممدود إثارة التي تم مسحها ضوئياً عبر منطقة تصوير كبيرة عبر مرآة جالفو بسرعة. تكوين 4و استخدمت لوضع المكونات البصرية. تم الكشف عن إشارة fluorescence كاميرا علمية تكميلية من أشباه الموصلات أكسيد المعدن ومنعت الخلفية خارج نطاق التركيز مع فتحه [كنفوكل] ديناميكية متزامنة مع أعمال التجريف شعاع. ونقدم لتعليمات خطوة بخطوة عن بناء المجهر هيست مع كافة المكونات الأساسية.
Introduction
تصوير fluorescence جزيء واحد دوراً هاما في العديد من الدراسات البيولوجية التي تكشف عن أولتراستروكتوريس وديناميات وكمية الجزيئات الحيوية1،،من23. ومع ذلك، قد تم تحدي لدراسة واحدة بين الجزيئات داخل الخلايا أو الأنسجة. بينما يوفر الفحص المجهري [كنفوكل] تقطيع ارتفاع قدرة4، أنها ليست مناسبة لتصوير جزيء واحد نظراً فوتوبليتشينج الشديد بكثافة عالية من الإثارة أو بطء سرعة التصوير. ويديفيلد المجهري يستخدم الإضاءة الضعيفة، لكنها تعاني من إشارة سيئة على خلفية نسبة (SBR)5. النور-ورقة الفحص المجهري، من ناحية أخرى، يمكن أن تظهر تمزيقها جيدة ومنخفضة فوتوبليتشينج6؛ ومع ذلك، إلى حد كبير محدودة الفتحة الرقمية المتاحة (غ) الشرط الوارد في الأهداف الموضوعة أورثوجونالي7. بدلاً من ذلك، فإنه يتطلب الأضواء الخاصة ونموذج الدوائر8،9.
لهذه الأسباب، الفحص المجهري الورقة الضوئية عالية يميل ومغلفة (حلو) تستخدم على نطاق واسع للتصوير 3D جزيء واحد10. عندما يصادف شعاع يميل واجهة وسائط اثنين (الزجاج والمياه، على سبيل المثال)، هو يتخلله الشعاع وفقا لقانون سنيل. الأهم من ذلك، شعاع يتخلله يحصل أرق، ويوصف به سمك dz = R/tan(θ) حيث R قطر شعاع ميلا وهي θ زاوية الانكسار الحزم المرسلة. نتائج هذا التنفيذ بسيط في قدرة على تقطيع جيد. ومع ذلك، هذه العلاقة يشير إلى أن إضاءة رقيقة (أي قدرة تقطيع عالية) يتطلب R صغيرة و/أو θ كبيرة. على سبيل المثال، عندما ص = 20 ميكرومتر و θ = 72 درجة، يمكن للمرء الحصول على dz = 6.5 ميكرون. نظراً لوجود حد عملي لزيادة زاوية الانكسار لصورة عميقة داخل الخلايا وتجنب التفكير الداخلي الإجمالي، هناك اقتران قوية من قطر الإضاءة وسمك شعاع. ولهذا السبب، تصوير حلو يظهر صغيرة نسبيا ميدان-من-عرض (FOV) تقيد إلى حد كبير على تطبيقاتها في تصوير متعددة الخلايا.
في الآونة الأخيرة، لقد تغلبنا على هذه المشكلة بالفحص المجهري يميل شديدة اجتاحت بلاط (هيست) حيث يتم انفصلت فوف من سمك شعاع في طريقة بسيطة للغاية11. أولاً، يتم إنشاء شعاع ممدود في اتجاه واحد عن طريق زوج من العدسات الاسطوانية. هذا الشعاع، توصف بأنها تجانب، تنتج إضاءة رقيقة مع dz ~ 4 ميكرومتر بينما به فوف هو 130 x 12 ميكرومتر2. ثم، هو البلاط واجتاحت العينة باستخدام مرآة galvo الدورية. وفي الوقت نفسه، يتم تسجيل الصورة الفلورية على كاميرا علمية تكميلية من أشباه الموصلات أكسيد المعدن (سكموس) الذي يقوم بتصفية الخلفية خارج التركيز كفاءة عن طريق تشغيل في وضع مصراع متداول هو بمثابة كشف الشق [كنفوكل] الانضباطي. وبهذه الطريقة، تمكن مجهرية هيست تصوير جزيء واحد مع مجال رؤية أكبر (~ 130 x 130 ميكرون2) وإضاءة أرق من تصوير حلو. قمنا بتطبيق هذا التصوير الجديدة تقنية للكشف عن الحمض النووي الريبي النصوص مع تحقيق واحد في الخلايا أو مع تحقيقات قليلة في أنسجة المخ الماوس، التي تتمتع بإمكانات كبيرة لدراسة التعبير الجيني والأمراض. خلافا لغيرها من النهج، توظف فقط هدفا واحد فتحه عددية عالية دون إضاءة إضافية أو أهداف الكشف البعيد هيست ومتوافقة تماما مع المجهر المقلوب. سوف تجعل هذه المزايا إلى جانب كبير من فوف والتباين العالي هيست مجهرية أداة بارزة في علم الأحياء والطب. نقدم إرشادات مفصلة بشأن أجهزة المجهر هيست، وكيفية اختبار ومعايرة الأداء على النحو المبين أدناه.
Protocol
1. إعداد أدوات مجهر وأشعة الليزر والمحاذاة
- قبل بناء المجهر، تعد جميع المكونات الضرورية بما في ذلك البصريات وأوبتوميتشانيكس والإلكترونيات كما هو موضح في الجدول للمواد.
- تعد هيئة مجهر تتكون أساسا من جزأين: حائز موضوعية مع منفذ RMS-مترابطة ومرحلة بيزو شنت على كتلة ألومنيوم (الشكل 1أ).
ملاحظة: يتم استخدام الجسم مجهر مصنوعة خصيصا لتوفير الراحة والمرونة للأجهزة12. يمكن استخدام أي جسم المجهر المتاحة تجارياً للفحص المجهري هيست. - الجمع بين خطوط الليزر متعددة واقتران لهم لألياف وضع واحد
- تثبيت 405، 561، 638 نانومتر الليزر على البصرية الجدول والجمع بين الحزم عن طريق مقسم شعاع استقطاب ومرآة طويلة-تمرير مزدوج اللون كما هو مبين في الشكل 1ب. تأكد من أن جميع أشعة الليزر تمر عبر الثقوب على أداة المحاذاة. إدراج نصف لوحات موجه للتكيف السلطة.
ملاحظة: ارتداء نظارات واقية لحماية العين واستخدام كتل شعاع لامتصاص أشعة الليزر غير المرغوب فيها. - تثبيت عدسة اقتران ألياف (f = 4.5 مم) ومحول ألياف في محور ع مترجم مع نظام قفص.
- قم بتوصيل ألياف المتعدد (MMF، Ø 62.5 ميكرون) المحول الألياف. ضبط كل زوج من مرآة توجيهي وزي-المترجم حتى كفاءة اقتران كل الليزر أعلى من 95%. شعاع الإخراج لديه ملف على شكل ضبابي قريب مع أنماط البقع واللطخ.
- يسلب الألياف المتعدد وتوصيل ألياف وضع واحد (SMF). MMF، على غرار صقل وتعظيم كفاءة اقتران ثلاث أشعة الليزر.
- تثبيت 405، 561، 638 نانومتر الليزر على البصرية الجدول والجمع بين الحزم عن طريق مقسم شعاع استقطاب ومرآة طويلة-تمرير مزدوج اللون كما هو مبين في الشكل 1ب. تأكد من أن جميع أشعة الليزر تمر عبر الثقوب على أداة المحاذاة. إدراج نصف لوحات موجه للتكيف السلطة.
- تجميع مصدر ضوء وتحديدالمنطقه التي ستستخدم لمحاذاة شعاع في مسارات الإثارة والكشف. ويتكون هذا الجهاز من مصدر الضوء متماسك وقتيا (561 nm) متصل بصندوق التدابير الخاصة، محول الألياف، عدسة achromatic (و = 60 مم)، آيريس و Ø1 "أنبوب فاصل في قفص نظام (الشكل 1ج). ضبط المسافة بين محول الألياف والعدسة باستخدام السابر قص لضمان collimation.
- إعداد أداة محاذاة شعاع (الشكل 1د). وهذا هو زوج من الوظائف الألومنيوم مع الثقوب في 2 "الارتفاع من على سطح المائدة البصرية، مما يسمح لمحاذاة شعاع سريعة ودقيقة.
- تجميع نظام مزدوج ثقب الذي يتكون من اثنين Ø1 "Ø1 اثنين والزجاج الأرض المحاذاة الأقراص في نهاية كل" عدسة أنابيب (مشقوبة واحد أسفل) كما هو مبين في الشكل 1ه.
2-إعداد مسار الكشف
- تأخذ بها الهدف وتثبيت وتحديدالمنطقه مصدر الضوء. ضبط المقابض للمرأة (M1) تحت صاحب هدف حيث الشعاع الناتج من المجهر تقريبا موازية للجدول البصرية في الارتفاع والانحياز مع ثقوب الخيوط في الجدول. الرجوع إلى الرقم 2 لمواقف مفصلة لكل مكون بصري.
- إدراج مرآة مزدوج اللون multiband (مارك ألماني) وتعكس الشعاع بمقدار 90 درجة. استخدام الحد الأقصى لحجم قزحية العين وتأكد من أن الشعاع يمر من خلال مركز المرأة مزدوج اللون من دون القطع.
- استخدام راشح شعاع يمر عبر مرآة مزدوج اللون لتوجيه المحاذاة للكشف عن المسار. ضع كاميرا سكموس في الشعاع وتأكد من أن الشعاع عدد مرات تصفح الموقع وسط رقاقة الكاميرا باستخدام اثنين من المرايا (M2 و M3).
- إدراج أنبوب عدسة (TL؛ و = 300 مم) حوالي 300 ملم بعيداً عن الكاميرا.
- إزالة مصدر الضوء وتحديدالمنطقه وضبط المسافة النسبية بين أنبوب العدسة والكاميرا حتى يتم حل نمط على السقف الواضح بالكاميرا.
- إدراج فرقة متعددة تمرير مرشح (BF) قبل أنبوب العدسة للتصوير متعدد الألوان الفلورية.
3-إعداد طريق الإثارة
- إعادة تثبيت مصدر الضوء وتحديدالمنطقه على صاحب الهدف. ضع مرآة حظيرة (M4) لإعادة توجيه الإخراج شعاع من المجهر بمقدار 90 درجة. ضبط المقابض مرآة مزدوج اللون وتجليد-المرأة تكراري حتى الشعاع يمر من خلال الثقوب في أداة المحاذاة الحزمة.
- فصل مصدر الضوء وتحديدالمنطقه وتثبيته على الطاولة، والذي تشير فيه الشعاع نحو الجسم المجهر. قم بمحاذاة الحزمة باستخدام أداة محاذاة شعاع ونظام ثقب مزدوجة.
- إدراج عدسة L4 (f = 400 مم؛ Ø = 2) إلى مسار بصري حوالي 400 ملم بعيداً عن صاحب الهدف. تثبيت العدسة الهدف وضبط موضع L4 على طول المحور البصري حتى يتم تشكيل نمط قرص جيدة التهوية مثالية على السقف.
ملاحظة: عند إدراج العدسة، الموقف الشعاع الذي يمر من خلال العدسة ينبغي أن تظل دون تغيير. وقد العدسة L4 مؤشر ترابط SM2 التي تسمح لها بأن تعلق/فصل من 60 مم من لوحة القفص SM2-مترابطة بسهولة. - فك الهدف وإعادة تثبيت مصدر الضوء وتحديدالمنطقه مع قزحية مفتوحة. تتبع أسفل الإخراج شعاع من المجهر مع بطاقة تعريف المهنة. جبل مرآة M5 في مكان أصغر حجم الحزمة وحوالي 400 ملم بعيداً عن L4، التي هي طائرة صورة مترافق (cIP).
- تثبيت مرآة M6 وتعكس الشعاع بمقدار 90 درجة. ضبط M5 و M6 تكراري باستخدام أداة المحاذاة الحزمة.
- إدراج عدسة L3 (f = 150 مم) حوالي 150 ملم بعيداً عن M5. استخدام السابر قص لضمان collimation الشعاع الناتج.
- مؤقتاً يسلب L4 وتتبع أسفل الشعاع العثور على موضع تركيز L3. وضع مرآة جالفو محور واحد في هذه المرحلة، وهي المستوى البؤري إلى الوراء مترافق (كبفب). إمداد فولت 0 للمرأة جالفو وتدوير حامل مرآة جالفو ذلك لأنه يعكس الشعاع بمقدار 90 درجة.
- مكان M7 إضعاف-مرآة. بشكل صحيح وضع L2 (f = 100 مم) بنفس الطريقة كخطوة 3.6.
- إزالة مصدر الضوء وتحديدالمنطقه من مالك الكائن. تثبيت عدسة collimation L1 (f = 100 ملم)، محول الألياف وقزحية العين. الاتصال ألياف بصرية واحدة وضع المحول وإرسال الحزم من خلال نظام التصوير.
- أعد إدخال L4 وتهذيب النظام حتى يظهر نمط قرص جيدة التهوية مثالية على السقف.
4-إعداد العدسات الاسطوانية
- إدراج عدسة أسطوانية (CL1، f = 400 ملم) بعد L1 وتأكد من أن تركز العدسة الاسطوانية شعاع على طول المحور س.
- إدراج آخر العدسة الاسطوانية (CL2, f = 50 مم) إلى مسار الشعاع. استخدام السابر قص لضمان شعاع الإخراج هو وتحديدالمنطقه.
ملاحظة: المسافة بين اثنين من العدسات الاسطوانية 450 مم. شعاع إخراج نسبة ضغط من 8 ويتم تشكيل نمط ممدود قرص المشرقة على شكل بيضاوي على السقف.
5-اختبار تصوير البلاط
- إعداد نموذج 3D المائية. ميكس 20 نانومتر قرمزي الخرز مع حل المائية، التي تتألف من 12% acrylamide:bisacrylamide (فيها)، 0.2% (v/v) تيميد وفوق كبريتات الأمونيوم 0.2% (w/v) في المخزن المؤقت x TAE 0.75. حقن 50 ميليلتر من الحل المختلط في حجرة تدفق كما هو موضح في مكان آخر من11. بعد 10 دقيقة، تكون العينة المائية 3D جاهزة للتصوير.
- وضع العينة على صاحب العينة. بدوره على 638 نانومتر ليزر وضبط السلطة < 1 ميغاواط للإثارة عينة.
- قم بتشغيل برنامج مراقبة الكاميرا. في لوحة الإعداد اقتناء الكاميرا، حدد الداخلية في وضع الزناد وثم انقر فوق أخذ فيديو مجاناً تشغيل وضع.
- ضبط موضع الكاميرا قليلاً بحيث الصورة يقع في مركز الكاميرا عندما يتم تطبيق 0 فولت للمرأة جالفو.
- قم بتدوير مقبض الأفقي من مرآة M5 لتحقيق إضاءة العالية تميل.
ملاحظة: مع زيادة زاوية الإضاءة، الصورة المائية يصبح أكثر وضوحاً من أن الصورة برنامج التحصين الموسع كالشعاع يحصل أرق. ومع ذلك، تبقى الصورة تقريبا نفس الموقف. - سجل تجانب الصورة. حساب عرض الإضاءة الفعالة11. ويبين الشكل 3 على سبيل المثال، عرض الإضاءة الفعالة 12 ميكرومتر.
6-هيست التصوير
- إعداد لوحة اقتناء بيانات المرتبطة بكتلة المحطة طرفية. قم بتوصيل موصل BNC المستخدم 1 مع P0.0 عن طريق أسلاك كهربائية. استخدم 1 المستخدم كإخراج رقمي لتحريك خارجي للكاميرا سكموس. الاتصال تناظرية الإنتاج AO0 إلى برنامج تشغيل متطابقة جالفو.
- توليد TTL نبض القطارات من P0.0 باستخدام برنامج مصنوعة خصيصا (الشكل 4أ) وتعيين وقت الفترة = 400 مللي ثانية و t_ON = 2 السيدة التحقق من البقول التي تم إنشاؤها من المستخدم 1 BNC المحطة الطرفية بالذبذبات رقمية ثم قم بتوصيل الكابل BNC للكاميرا منفذ خارجي الزناد.
ملاحظة: البرنامج التحكم المستخدمة في هذه الورقة متاح عند الطلب. عند التصوير بالكاميرا مختلف معدلات الإطار، ينبغي تعديل وقت الفترة تبعاً لذلك. - بدء تجتاح مرآة جالفو عن طريق برنامج مصنوعة خصيصا. ضبط الخامسدقيقة للسيارات-500 والخامسكحد أقصى إلى 500 أم للتصوير فوف بالكامل. ويلاحظ أن ضمن هذه العملية، عينات 3D المائية لا تزال تبين خلفية عالية مشابهة لبرنامج التحصين الموسع الإضاءة.
- تغيير إعداد اقتناء كاميرا.
- حدد خارجي في وضع الزناد و أسفل (تسلسلي) في القائمة المنسدلة زائد لايتسكان كما هو موضح في الشكل 4ب.
ملاحظة: هذا الإعداد، الكاميرا لا يأخذ الصور ما لم يتم تشغيل إشارة الزناد. - انقر فوق التحكم في سرعة المسح الضوئي لنافذة وقت التعرض الطول وخط السيطرة وتعيين القيم صفوف 180 و 28 مللي ثانية، على التوالي.
ملاحظة: عند عرض تجانب (Weff) هو 180 الصفوف (12 ميكرومتر) ووقت إدماج كل سطر (تيint) هو 28 مرض التصلب العصبي المتعدد، وقت تأخير بين الأسطر (تيد) يتحدد تيد = Tintثeff = 0.156 السيدة للتصوير 2,048 x 2,048 بكسل، هو وقت الامتلاك الكلية 2,048 س رد + Tint = 346 مرض التصلب العصبي المتعدد، تقابل ~2.9 في الثانية.
- حدد خارجي في وضع الزناد و أسفل (تسلسلي) في القائمة المنسدلة زائد لايتسكان كما هو موضح في الشكل 4ب.
- ضبط قليلاً الخامسكحد أقصى و الخامسدقيقة للحصول على صور أكثر وضوحاً.
- الحصول على الصور مكدس ثلاثي الأبعاد باستخدام برنامج مصنوعة خصيصا بتبديل على مكدس ثلاثي الأبعاد وتحديد عدد المكدسات وحجم الخطوة.
النتائج
على سبيل مثال، كان تصويرها واحد-الذين تقطعت بهم السبل الحمض النووي المسمى مع Atto647N مع الطول موجي إثارة 638 نانومتر في هيدروجيل 3D. كانت رأسية الحمض النووي بالشبكة المائية عن طريق مجموعة أكريديتي خلال البلمرة هلام. الصور أخذت في 5 ميكرون فوق السطح كما هو مبين في الشكل 5. وأظهرت صورة هيست الخلفية أقل بكثير مقارنة بالصورة برنامج التحصين الموسع، والتي حسبت إشارة إلى نسبة الخلفية لتكون 1.9 ± 0.7 للصورة هيست في حين أن معظم البقع جزيء واحد يمكن بالكاد يمكن كشفها بواسطة برنامج التحصين الموسع.
وأجرى واحد جزيء الحمض النووي الريبي fluorescence في الموقع التهجين (سمفيش) مع 4 تحقيقات الأسماك. الشكل 5 ب يعرض الصور سمفيش من EEF2 (ترجمة حقيقية النواة استطالة معامل 2) المسمى مع 647 اليكسافلور عن خلايا A549 في مخزن مؤقت لتصوير (الرجوع إلى أعمالنا السابقة فيما يتعلق ب إعداد نموذج11). تم إجراء إسقاطات أقصى شدتها على 20 z-مداخن الموافق 5 ميكرون سمك. وأظهرت صورة هيست سبر تحسنت كثيرا ليس فقط ولكن أيضا أكثر إضاءة موحدة بالمقارنة مع الصورة برنامج التحصين الموسع. لتصوير برنامج التحصين الموسع، كان وقت التعرض 400 مللي ثانية بينما الوقت كل سطر هيست التصوير الإدماج 32 مللي ثانية، كان كل منها نفس قوة الإضاءة 7.5 ميجاوات يقاس قبل الهدف. وكانت بسرعة التصوير لبرنامج التحصين الموسع وهيست 2.5 fps.

الشكل 1 . أدوات الجسم وأشعة الليزر والمحاذاة المجهر. (أ) الهدف وحامل عينة. (ب) صور لنظم الليزر. ليرة لبنانية، منذ فترة طويلة-تمرير مرآة مزدوج اللون؛ لوحات λ/2، ونصف الموجه؛ برنامج تلفزيوني، beamsplitter الاستقطاب. (ج) مصدر الضوء كوليماتيد. (د) أداة المحاذاة الحزم مع اثنين من الثقوب insertable. (ﻫ) نظام الثقب مزدوجة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
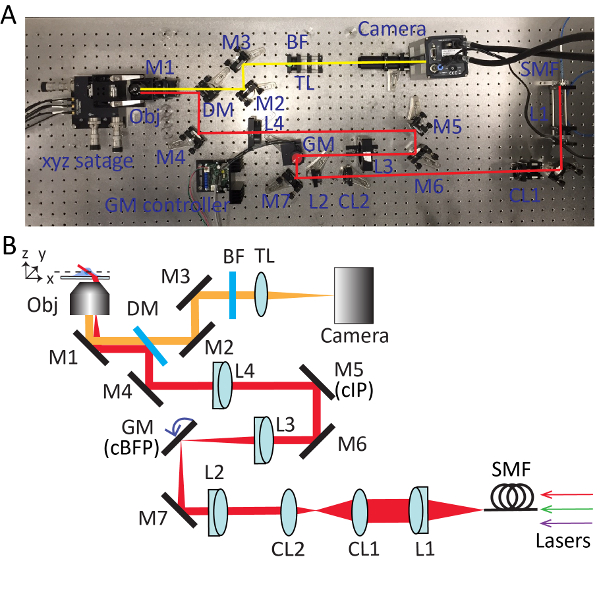
الشكل 2 . الإعداد التفصيلية للفحص المجهري يميل شديدة اجتاحت بلاط (هيست). الصورة (أ) والتخطيطي (ب) نظام المجهر هيست. فرنك بلجيكي، مرشح تمرير النطاق متعددة؛ عدسات CL1-2، أسطواني؛ مارك ألماني، ومرآة مزدوج اللون؛ جنرال موتورز، مرآة galvo؛ فرنك بلجيكي، مرشح تمرير النطاق؛ M1--7، مرايا؛ المستوى 1-4، العدسات؛ صندوق التدابير الخاصة، واحدة وضع الألياف؛ ليرة تركية، أنبوب العدسة؛ المركز الدولي للبطاطا، صورة مترافق الطائرة؛ كبفب، مترافق البؤري مرة أخرى. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
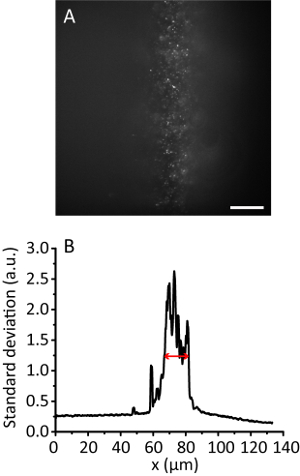
الشكل 3 . تجانب الإضاءة مع نسبة ضغط 8- (أ) صورة Fluorescence من 20 نانومتر الخرز في هيدروجيل 3D. مقياس بار، 20 ميكرومتر. (ب) الانحراف المعياري الإسقاط على طول اتجاه y A، ممهدة بالبيانات 10 نقاط. يشير السهم الأحمر إلى عرض إضاءة فعالة 12 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
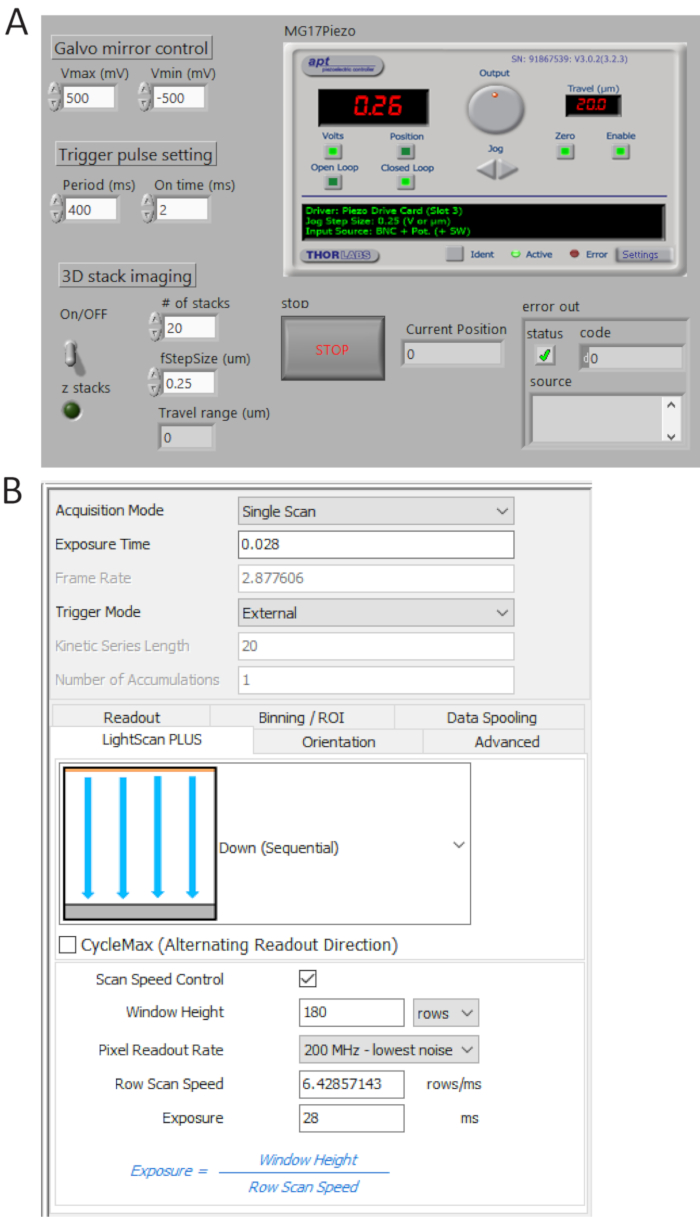
الشكل 4 . مراقبة وتصوير البرامج الأمامية الألواح. يتحكم برنامج LabView مصنوعة خصيصا (A) بشكل متزامن فحص مرآة galvo، انطلاق اقتناء كاميرا سكموس وحركة مرحلة بيزو. (ب) وضع الكاميرا اقتناء لوحة التحكم. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
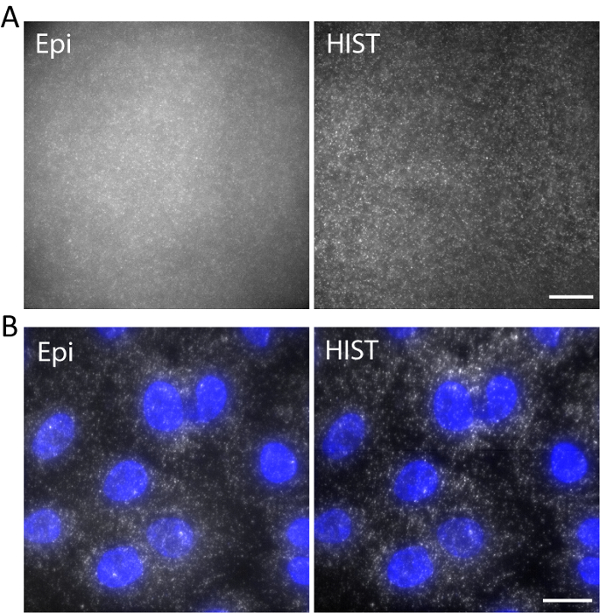
الشكل 5. (أ) تسمية الصور Atto647N الحمض النووي في هيدروجيل ثلاثي الأبعاد مع إضاءة هيست وبرنامج التحصين الموسع. (ب) سمفيش الصور من EEF2 باستخدام 4 الأسماك تحقيقات عن خلايا A549 بالفحص المجهري هيست وبرنامج التحصين الموسع. ويرد DAPI وصمة عار باللون الأزرق. تغيير حجم أشرطة، 20 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
هناك اثنين من الخطوات الحاسمة في هذا البروتوكول. الأول هو وضع L4 المناسب في الخطوة 3، 3، ضمان أن شعاع الحادث يمر من خلال مركز العدسة ويتم تشكيل نمط قرص جيدة التهوية مثالية على السقف. يحدد موضع L4 تنسيب جميع البصرية المكونات الأخرى، بما في ذلك M5 والآلية العالمية و L3 L2. الخطوة الهامة الثانية هي عملية المزامنة. لرفض الخروج الخلفية التركيز، النشط بكسل عرض الكشف الفعال الذي يساوي عرض التجانب ينبغي أن يتزامن مع أعمال التجريف شعاع. ولذلك، من الضروري قياس عرض الإضاءة الفعالة لشعاع بلاط (الخطوة 5، 6) والكاميرا تعيين المعلمات تبعاً لذلك في الخطوة 6، 4.
عند التصوير مع فوف كبيرة جداً، تظهر طريقة عرض خلفية زيادة في جانب واحد بالمقارنة مع الجانب الآخر. ويعزى هذا إلى زوايا مختلفة قليلاً من الإضاءة في مواقع التصوير المختلفة. تنفيذ مرآة galvo ثانية بدلاً من M5 يخفف من هذه المشكلة كما هو موضح من قبل بشكل متزامن ضبط الموقف و زاوية المسح11. بدلاً من دوبليتس الجاهزة متعامي، telecentric عدسة المسح الضوئي سوف تكون أيضا مفيدة. ولكن لتصوير منطقة < 8,080 مكم2، جالفو واحدة كنس مرآة كان كافياً. هيست مجهرية قد حد من عمق التصوير، بيد أنها قادرة على الحصول على من سبر جيدة عند التصوير يصل إلى 15 ~ ميكرومتر مع شعاع بلاط 12 ميكرون و 1.45 غ نفط غمر عدسة الهدف11.
في هذا البروتوكول، استخدمنا نسبة ضغط شعاع من 8 جعل شعاع بلاط. يمكن استخدامها إضاءة أرق في الفحص المجهري هيست لتحقيق أعلى سبر، التي قد تكون قوية للأنسجة جزيء واحد التصوير11. ومع ذلك، في هذه الحالة، أثر فوتوبليتشينج ينبغي النظر بشدة زيادة إثارة بينما نسبة ضغط الحزمة الحالية أظهرت انخفاض فوتوبليتشينج في تصوير ثلاثي الأبعاد بالمقارنة مع11من برنامج التحصين الموسع. مقابل مجاهر الورقة الضوء بهدفين أورثوجونالي الموضوعة، مجهرية هيست بسيطة لتنفيذ ومتوافقة مع الاستعدادات عينة التقليدية. سبر المحسنة وكبير فوف من الفحص المجهري هيست مناسبة لدراسة التفاعلات وديناميات الجزيئات الحيوية الوحيدة في خلايا متعددة ويمكن استخدامها كذلك في تصوير القرار فائقة وتتبع جزيء واحد.
Disclosures
جامعة فلوريدا الوسطى قدم طلب براءة تغطي العمل الموصوف في هذه الورقة.
Acknowledgements
أيد هذا العمل الدفاع المتقدم البحث مشاريع وكالة (داربا) (HR00111720066) ومؤسسة العلوم الوطنية (NSF) (1805200). ونحن نشكر سيرج مايكل في التكنولوجيا Andor لسخاء إعارة الكاميرا سكموس.
Materials
| Name | Company | Catalog Number | Comments |
| 1" Achromatic doublet | Thorlabs | AC254-060-A-ML | Collimator |
| 1" Achromatic doublet | Thorlabs | AC254-100-A-ML | L1,L2 |
| 1" Achromatic doublet | Thorlabs | AC254-300-A-ML | TL |
| 1" Broadband Dielectric Mirrors | Thorlabs | BB1-E02-10 | M1~M7 |
| 1" Cylindrical Lenses | Thorlabs | LJ1363RM-A | CL1 |
| 1" Cylindrical Lenses | Thorlabs | LJ1695RM-A | CL2 |
| 1" square kinematic mount | Edmund Optics | 58-857 | For dichroic mirror mounting |
| 1" Threaded Cage Plate | Thorlabs | CP02 | For holding other lenses |
| 2" Achromatic doublet | Thorlabs | AC508-150-A-ML | L3 |
| 2" Achromatic doublet | Thorlabs | AC508-400-A-ML | L4 |
| 2" Threaded Cage Plate | Thorlabs | LCP01 | For holding L4 |
| 2" Threaded Cage Plate | Thorlabs | LCP01T | For holding L3 |
| 2% Bis Solution | Bio Rad | 64085292 | hydrogel component |
| 20 nm fluorescent beads | Thermo Fisher | F8782 | For testing imaging |
| 30 mm Cage Right-Angle Kinematic Mirror Mount | Thorlabs | KCB1 | For objective & camera mounting |
| 30mm Cage System Iris | Thorlabs | CP20S | |
| 3-Axis NanoMax Stage | Thorlabs | MAX311D | |
| 40% Acrylamide Solution | Bio Rad | 64148001 | hydrogel component |
| 405 nm laser | Cobolt | Cobolt 06-MLD | |
| 50x TAE buffer | Bio-Rad | 161-0743 | hydrogel component |
| 561 nm laser | Cobolt | Cobolt 06-DPL | |
| 638 nm laser | Cobolt | Cobolt 06-MLD | |
| Ammonium persulfate | Sigma | A3678-25G | hydrogel component |
| Beam alignment tool | custom made | ||
| BNC terminal blocks | Natural Instruments | BNC-2110 | |
| Cage plate with M9 x 0.5 internal threads | Thorlabs | CP1TM09 | For holding aspheric lens |
| Cage System Rods | Thorlabs | SR series | |
| Cell culture & smFISH | See a reference [11] | ||
| Double side tape | Scotch | 515182 | Flow chamber |
| Epoxy | Devcon | 14250 | Flow chamber |
| Galvo mirror | Thorlabs | GVS211 | GM |
| Galvo System Linear Power Supply | Thorlabs | GPS011 | |
| Half wave plate | Thorlabs | WPH10M-405/561/633 | Power adjustment |
| long-pass dichroic mirror | Chroma | T550lpxr | For combining lasers |
| Microscope slides | Fisherbrand | 12549-3 | Flow chamber |
| Mikroskopische Deckglaser | Hecht Assistent | 990/5024 | Flow chamber |
| Mounted Frosted Glass Alignment Disk | Thorlabs | DG10-1500-H1-MD | For double pinhole system |
| Mounted rochester aspheric lens | Thorlabs | A230TM-A | |
| Multi-band dichroic mirror | Semrock | Di03-R405/488/561/635-t3 | DM; 3 mm thickness |
| Multi-band filter | Semrock | FF01-446/523/600/677-25 | BF |
| Multimode fiber | Thorlabs | M31L02 | MMF |
| N,N,N',N'-tetramethyl ethylenediamine | Sigma | T7024-25ML | hydrogel component |
| NI-DAQ board | Natural Instruments | PCI-6733 | |
| Ø1" Kinematic Mirror Mount | Thorlabs | KM100 | For holding mirrors |
| Objective lens | Olympus | PLANAPO N 60X | 60X 1.45NA oil |
| Pedestal Base Clamping Forks | Newport | 9916 | |
| Pedestal Pillar Posts | Thorlabs | RS1P8E | |
| Piezo controller | Thorlabs | BPC303 | |
| Polarized beam splitter | Thorlabs | PBS251 | For combining lasers |
| RMS-SM1 adapter | Thorlabs | SM1A3TS | For objective lens |
| Rod holder | custom made | ||
| Rotation cage mount | Thorlabs | RSP1/CRM1/CRM1P | For HWP & cylindrical lens mounting |
| sCMOS camera | Andor | Zyla-4.2P-CL10 | |
| Shearing interferometer | Thorlabs | SI100 | Beam collimation test |
| Single mode fiber | Thorlabs | P5-405BPM-FC-2 | SMF |
| SM1 Lens Tubes | Thorlabs | SM1S25 | For double pinhole system |
| SM1 Slotted Lens Tube | Thorlabs | SM1L30C | For double pinhole system |
| Stage mount | custom made | ||
| threaded fiber adapter | Thorlabs | SM1FC | |
| Z-Axis Translation Mount | Thorlabs | SM1Z | Fiber coupling |
References
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361, 880-887 (2018).
- Lerner, E., et al. Toward dynamic structural biology: Two decades of single-molecule Forster resonance energy transfer. Science. 359, (2018).
- Raj, A., van Oudenaarden, A. Single-Molecule Approaches to Stochastic Gene Expression. Annual Review of Biophysics. 38, 255-270 (2009).
- Wilson, T. Resolution and optical sectioning in the confocal microscope. Journal of microscopy. 244, 113-121 (2011).
- Sase, I., Miyata, H., Corrie, J. E., Craik, J. S., Kinosita, K. Real time imaging of single fluorophores on moving actin with an epifluorescence microscope. Biophysical Journal. 69, 323-328 (1995).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical Sectioning Deep Inside Live Embryos by Selective Plane Illumination Microscopy. Science. 305, 1007-1009 (2004).
- Cella Zanacchi, F., et al. Live-cell 3D super-resolution imaging in thick biological samples. Nature Methods. 8, 1047 (2011).
- Galland, R., et al. 3D high- and super-resolution imaging using single-objective SPIM. Nature Methods. 12, 641 (2015).
- Gustavsson, A. K., Petrov, P. N., Lee, M. Y., Shechtman, Y., Moerner, W. E. 3D single-molecule super-resolution microscopy with a tilted light sheet. Nature Communications. 9, 123 (2018).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nature Methods. 5, 159-161 (2008).
- Tang, J., Han, K. Y. Extended field-of-view single-molecule imaging by highly inclined swept illumination. Optica. 5, 1063-1069 (2018).
- Han, K. Y., Kim, S. K., Eggeling, C., Hell, S. W. Metastable Dark States Enable Ground State Depletion Microscopy of Nitrogen Vacancy Centers in Diamond with Diffraction-Unlimited Resolution. Nano Letters. 10, 3199-3203 (2010).
- Sinkó, J., Szabó, G., Erdélyi, M. Ray tracing analysis of inclined illumination techniques. Optics Express. 22, 18940-18948 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved