A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس الاسترخاء تدور شعرية الاعتماد المجال المغناطيسي من فرط الاستقطاب [1-13C] بيروفات
In This Article
Summary
نقدم بروتوكولا لقياس الاعتماد على المجال المغناطيسي من وقت الاسترخاء تدور شعرية من 13مركبات C المخصب، والاستقطاب المفرط عن طريق الاستقطاب النووي الديناميكي، وذلك باستخدام قياس الاسترخاء بسرعة الميدان دورة. على وجه التحديد، لقد أثبتنا هذا مع[1-13C]pyruvate، ولكن يمكن توسيع البروتوكول إلى ركائز أخرى شديدة الاستقطاب.
Abstract
الحد الأساسي في تطبيقات التصوير في الجسم الحي من المركبات الشديدة الاستقطاب 13C المخصب هو أوقات الاسترخاء تدور شعرية محدودة. عوامل مختلفة تؤثر على معدلات الاسترخاء، مثل تكوين العازلة، ودرجة الحموضة الحل، ودرجة الحرارة، والمجال المغناطيسي. في هذا الصدد الأخير، يمكن قياس وقت الاسترخاء تدور شعرية في نقاط القوة المجال السريري، ولكن في الحقول السفلى، حيث يتم الاستغناء عن هذه المركبات من الاستقطاب ونقلها إلى التصوير بالرنين المغناطيسي، والاسترخاء هو أسرع وصعبة لقياس. للحصول على فهم أفضل لكمية المغناطيسية المفقودة أثناء النقل، استخدمنا سريع الميدان ركوب الدراجات relaxometry، مع الكشف عن الرنين المغناطيسي من 13C النوى في ~ 0.75 T، لقياس تشتت الرنين المغناطيسي النووي لل [سبين-كلتيك] استرخاء وقت من [هبربولّد][1-13[ك][بيروفات]. وقد استخدم الاستقطاب النووي الديناميكي للانحلال لإنتاج عينات شديدة الاستقطاب من البيروفات بتركيز قدره 80 مليمول/لتر والأس الهيدروجيني الفسيولوجي (حوالي 7.8). تم نقل هذه الحلول بسرعة إلى مقياس الاسترخاء سريع الدراجات الميدانية بحيث يمكن قياس الاسترخاء من مغنطة عينة كدالة للوقت باستخدام زاوية الوجه الصغيرة معايرة (3 °-5 °). لتعيين تشتت T1 من C-1 من بيروفات، سجلنا بيانات لمجالات الاسترخاء المختلفة التي تتراوح بين 0.237 mT و 0.705 T. مع هذه المعلومات، حددنا معادلة تجريبية لتقدير الاسترخاء تدور شعرية من الركيزة فرط الاستقطاب ضمن مجموعة المذكورة من المجالات المغناطيسية. ويمكن استخدام هذه النتائج للتنبؤ بكمية الممغنطة المفقودة أثناء النقل ولتحسين التصاميم التجريبية لتقليل فقدان الإشارة.
Introduction
التصوير الطيفي بالرنين المغناطيسي (MRSI) يمكن أن تنتج خرائط مكانية من الأيض الكشف عن طريق التصوير الطيفي، ولكن استخدامه العملي غالبا ما يكون محدودا بسبب حساسيته منخفضة نسبيا. هذه الحساسية المنخفضة في التصوير بالرنين المغناطيسي في الجسم الحي وطرق التحليل الطيفي تنبع من درجة صغيرة من المغناطيسية النووية التي يمكن تحقيقها في درجات حرارة الجسم ونقاط القوة المجال المغناطيسي معقولة. ومع ذلك، يمكن التغلب على هذا القيد باستخدام الاستقطاب النووي الديناميكي (DNP) لتعزيز كبير في المختبر مغنطة من ركائز السائل، والتي يتم حقنها في وقت لاحق للتحقيق في التمثيل الغذائي في الجسم الحي باستخدام MRSI1،2 , 3 , 4.DNP قادرة على تعزيز مغنطة معظم النوى مع تدور النووية غير صفر، وقد استخدمت لزيادة في حساسية MRSI الجسم الحي من 13مركبات C المخصب مثل بيروفات5،6،بيكربونات 7،8، fumarate9، اللاكتات10، الجلوتامين11، وغيرها من قبل أكثر من أربعة أوامر من حجم12. وتشمل تطبيقاته تصوير أمراض الأوعية الدموية13،14،15، ضخ الأعضاء13،16،17،18، السرطان الكشف1،19،20،21،22،تنظيم الورم23،24،والقياس الكمي للاستجابة العلاجية2 , 6 , 23 , 24 , 25 , 26.
الاسترخاء بطيئة تدور شعرية أمر ضروري للكشف في الجسم الحي مع MRSI. تدور شعرية أوقات الاسترخاء(T1ق) في ترتيب عشرات الثواني ممكنة للنوى مع نسب الدوران المغناطيسي منخفضة داخل جزيئات صغيرة في الحل. العديد من العوامل المادية تؤثر على نقل الطاقة بين انتقال تدور النووية وبيئتها (شعرية) مما يؤدي إلى الاسترخاء، بما في ذلك قوة المجال المغناطيسي، ودرجة الحرارة، والمطابقة الجزيئية27. يتم تقليل الاسترخاء ثنائي القطب في جزيئات لمواقف الكربون مع عدم وجود البروتونات المرفقة مباشرة، وdeuteration من وسائل الإعلام حل يمكن أن تقلل من الاسترخاء ثنائي القطب بين الجزيئية. لسوء الحظ، المذيبات المبتورة لديها قدرات محدودة على تمديد في استرخاء الجسم الحي. زيادة الاسترخاء من كاربونيل أو الأحماض الكربوكسيلية (مثل بيروفات) يمكن أن تحدث في نقاط القوة المجال المغناطيسي عالية بسبب عدم التحامل التحول الكيميائي. وجود الشوائب شبه المغناطيسية من مسار السوائل أثناء الانحلال بعد الاستقطاب يمكن أن يسبب الاسترخاء السريع وتحتاج إلى تجنبها أو القضاء عليها باستخدام chelators.
توجد بيانات قليلة جداً للاسترخاء من 13المركبات التي تحتوي على C في الحقول المنخفضة، حيث الاسترخاء تدور شعرية يمكن أن يكون أسرع بكثير. ومع ذلك، من المهم قياس T1 في الحقول المنخفضة لفهم الاسترخاء أثناء إعداد العامل المستخدم في التصوير الحي، حيث أن عوامل التباين شديدة الاستقطاب عادة ما يتم الاستغناء عنها من جهاز DNP بالقرب من الأرض أو في الميدان. عوامل مادية إضافية مثل تركيز الركيزة 13C المخصب، ودرجة الحموضة الحل، والمخازن المؤقتة ودرجة الحرارة تؤثر أيضا على الاسترخاء، وبالتالي يكون لها تأثير على صياغة العامل. كل هذه العوامل ضرورية في تحديد المعلمات الرئيسية في تحسين عملية حل DNP، وحساب حجم فقدان الإشارة التي تحدث في نقل العينة من جهاز DNP إلى مغناطيس التصوير.
وعادة ما يتم الحصول على قياسات تشتت الرنين المغناطيسي النووي، أي قياسات T1، كدالة للمجال المغناطيسي باستخدام مطياف NMR. للحصول على هذه القياسات، يمكن استخدام طريقة الاغلاق حيث يتم نقل العينة لأول مرة من مطياف للاسترخاء في بعض المجالات التي يحددها موقعها في مجال هامش المغناطيس28،29،30 ثم انتقلت بسرعة مرة أخرى إلى المغناطيس NMR لقياس المغناطيسية المتبقية. من خلال تكرار هذه العملية في نفس النقطة في المجال المغناطيسي ولكن مع فترات متزايدة من الاسترخاء، يمكن الحصول على منحنى الاسترخاء، والتي يمكن تحليلها بعد ذلك لتقدير T1.
نحن نستخدم تقنية بديلة تعرف باسم قياس الاسترخاء السريع للدراجات الميدانية31و32و33 للحصول على بيانات NMRD الخاصة بنا. لقد قمنا بتعديل مقياس الاسترخاء التجاري للدراجات الميدانية (انظر جدول المواد)،لقياسات T1 للحلول التي تحتوي على النوى 13C شديد الاستقطاب. وبالمقارنة مع طريقة المكوك، فإن الدراجات الميدانية تمكن مقياس الاسترخاء هذا من الحصول بشكل منهجي على بيانات NMRD على نطاق أصغر من المجالات المغناطيسية (0.25 مليون متر مربع إلى 1 T). ويتم ذلك عن طريق تغيير بسرعة المجال المغناطيسي نفسه، وليس موقع العينة في المجال المغناطيسي. لذلك، يمكن أن تكون ممغنطة عينة في قوة حقل عالية، "استرخاء" في قوة مجال أقل، ومن ثم قياسها عن طريق الحصول على الحرة التعريفي الاضمحلال في حقل ثابت (وتردد Larmor) لتحقيق أقصى قدر من الإشارة. وهذا يعني أنه يمكن التحكم في درجة حرارة العينة أثناء القياس، ولا يحتاج مسبار NMR إلى ضبطه في كل مجال استرخاء يعزز الاكتساب التلقائي على نطاق المجال المغناطيسي بأكمله.
مع تركيز جهودنا على آثار الاستغناء عن الحلول الشديدة الاستقطاب ونقلها في المجالات المغناطيسية المنخفضة، يقدم هذا العمل منهجية مفصلة لقياس وقت الاسترخاء تدور شعرية من فرط الاستقطاب 13C-بيروفات باستخدام سريع مجال ركوب الدراجات relaxometry للمجالات المغناطيسية في نطاق 0.237 mT إلى 0.705 T. وقد سبق عرض النتائج الرئيسية لاستخدام هذه المنهجية ل[1-13C]pyruvate34 و 13C-المخصب الصوديوم والسيزيوم بيكربونات35 حيث عوامل أخرى مثل التركيز الجذري وحلها درجة الحموضة لديها كما تمت دراستها.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. إعداد عينة
ملاحظة: يتم تنفيذ الخطوات 1.1-1.8 مرة واحدة فقط
- إعداد 1 مل من المخزون 13C-المخصب محلول حمض البيروفيك، وتستخدم على نطاق واسع في البحوث الحية 1،2،5،6،تتكون من 15 مليمول / لتر من ثلاثي الكريل ميثيل جذرية حل في [1- 13 C] حمض بيروفيك (انظر جدول المواد). Aliquots من هذا الحل الأسهم سوف تستخدم للعينات التي سيتم استقطابها بشكل فردي والخضوع في وقت لاحق relaxometry في مختلف المجالات المغناطيسية. يظهر في الشكل 1تمثيل لجزيء حمض البيروفيك [1-13C].
- على واجهة البرمجيات الاستقطاب النووي الديناميكي (انظر جدول المواد)،انقر على زر التبريد لخفض درجة حرارة درجة الحرارة المتغيرة إدراج (VTI) إلى 1.4 K.
- مرة واحدة وقد وصلت DNP درجة الحرارة المطلوبة، تحميل 10 درجة مئوية من حل الأوراق المالية في كوب عينة، وفتح الأبواب البرج وإدراج الكأس في VTI باستخدام عصا الإدراج مصممة خصيصا لهذه المهمة.
- بعد ذلك، استخراج بسرعة عصا وتأكد من الإفراج عن الكأس. ثم أغلق أبواب البرج واستمر في الخطوات التالية في حين أن درجة حرارة VTI يعود إلى 1.4 K.
- إعداد DNP لتشغيل مسح الميكروويف من أجل العثور على تردد الترددات اللاسلكية الأمثل لفرط الاستقطاب من حل الأوراق المالية.
- على الكمبيوتر الذي يتحكم في مطياف (جزء من نظام DNP)، قم بإنشاء الاتصال بين مطياف وبرنامج التحكم DNP بالنقر المزدوج على رمز HyperTerminal، الذي تم تكوينه مسبقًا باستخدام الاتصال التسلسلي المناسب معلمات.
- بمجرد تأسيس الاتصال، قم بتشغيل برنامج RINMR، اكتب في سطر الأوامر الخاص به . HYPERSENSENMR، ومن ثم اضغط enter.
- بعد ذلك، سيتم عرض إطار جديد على الشاشة وعلى ذلك اكتب رقم واحد (1) في الحقل "رقم التكوين". ثم انقر فوق الزر تحديد تكوين.
- انقر على زر هل اكتساح الميكروويف. سيتم إطلاق نافذة صغيرة مع عداد تنازلي من الثواني مما يشير إلى أن مطياف جاهز وسوف يكون في انتظار إشارات الزناد الدورية، قادمة من برنامج التحكم DNP، لأخذ عينات من الاستقطاب.
- في برنامج التحكم DNP، حدد علامة التبويب معايرة وانقر فوق الزر إنشاء.
- باستخدام إطار إعداد المعايرة، أدخل المعلومات التالية: بدء التردد = 94.117 غيغاهرتز، تردد النهاية = 94.137 غيغاهرتز، حجم الخطوة = 1 ميغاهرتز، مدة الخطوة = 300 s، الطاقة = 50 مواط، مستوى الهليوم السائل = 65٪، ودرجة الحرارة = 1.4 K.
- انقر على زر إنشاء، والتي سيتم إغلاق إطار الإعداد والعودة إلى علامة التبويب معايرة التي ستعرض عدد الخطوات والوقت اللازم لتنفيذ الاجتياح الميكروويف المطلوب.
- بمجرد تحقيق درجة حرارة VTI المطلوبة، انقر فوق الزر تمكين ثم ابدأ في تهيئة عملية مسح الميكروويف.
- في نهاية الاجتياح الميكروويف، واستعادة العينة وتسجيل التردد الأمثل حيث يتم تحقيق أقصى قدر من الاستقطاب. ويُعرَّف هذا التردد الأمثل بأنه تردد الاستقطاب الذي يوفر أقصى قدر من الاستقطاب كما هو مبين في الشكل 2. وسوف تستخدم هذه الترددة لفرط الاستقطاب جميع aliquots التي تم الحصول عليها من هذا الحل مخزون معين من حمض البيروفيك.
- إعداد 250 مل من الأوراق المالية المتوسطة باستخدام حل 40 مليمول / لتر تريس قاعدة، 50 مليمول / لتر من كلوريد الصوديوم، و 80 مليمول / لتر هيدروكسيد الصوديوم في المياه منزوعة الأيونات. يُضاف حمض الإثيلين ديايمينتيتراتيك (EDTA) بتركيز 100 ملغم/لتر لعزل أي تلوث بأيون معدني. وبالمثل إلى محلول مخزون حمض البيروفيك، سيتم استخدام هذه الوسيلة حل لجميع العينات المختلفة التي سيتم استقطابها. يرجى الرجوع إلى جدول المواد للحصول على مزيد من التفاصيل المحددة بشأن المواد الكيميائية المستخدمة.
- أيضا، إعداد 500 مل من محلول تنظيف الأسهم تتكون من 100 ملغ / لتر EDTA المذاب في المياه منزوعة الأيونات. يتم استخدام ما يقرب من 10 مل من هذا الحل التنظيف بعد كل استقطاب لتنظيف مسار حل DNP.
ملاحظة: يتم تنفيذ الخطوات 1.9-1.27 لكل عينة فردية. - تبريد جهاز DNP إلى 1.4 K في التحضير لفرط الاستقطاب عينة حمض بيروفيك [1-13C] عن طريق الضغط على زر التبريد في النافذة الرئيسية DNP.
- إذا كان البرنامج المستخدم لمطياف نشط بالفعل مع تحديد التكوين 1، فتابع الخطوات التالية. وإلا، قم بتنفيذ الخطوات 1.5.1 إلى 1.5.3 ثم تابع مع الخطوات التالية.
- بعد التحقق من تحديد التكوين 1 في الإطار الذي يتحكم في مطياف DNP، انقر فوق الزر "بناء الصلبة".
- أدخل اسم الملف SSBuilupXXX، حيث "XXX" هو رقم في تسلسل الملفات المخزنة مع بيانات الإنشاء. يتم زيادة هذا الرقم تلقائياً بواسطة البرنامج. ثم انقر فوق موافق. وعلى غرار حالة كنس الموجات الدقيقة، سيتم إطلاق نافذة صغيرة مع عداد تنازلي من الثواني تشير إلى أن مطياف جاهز وسوف ينتظر إشارات الزناد الدورية، القادمة من برنامج التحكم DNP، لأخذ عينات من الاستقطاب .
- باستخدام حمض البيروفيك - OX063 حل الأسهم أعدت في الخطوة 1.1، تزن 30 ملغ في كوب عينة.
- عندما يتم تحقيق درجة الحرارة VTI المطلوب (1.4 K) انقر على إدراج عينة، ثم حدد نموذج عادي ثم انقر على التالي. بعد احتياطات السلامة المعروضة على الشاشة، أدخل الكوب في جهاز DNP البارد، باستخدام عصا طويلة مصممة خصيصًا لهذه المهمة.
- بمجرد إدراج الكأس، تتم إزالة العصا، وأغلقت أبواب DNP، انقر فوق التالي ثم الانتهاء. عند هذه النقطة نظام hyperpolarizer يخفض كوب عينة إلى غرفة التشعيع شغل جزئيا (65٪) مع الهليوم السائل.
- انتظر حتى تعود درجة الحرارة إلى 1.4K ثم انقر فوق الزر نموذج الاستقطاب.
- في النافذة المنبثقة الجديدة، قم بتعيين قيمة التردد إلى تلك التي تم الحصول عليها من اكتساح الميكروويف في الخطوة 1.6. في نفس الإطار، أيضا تعيين الطاقة إلى 50 mW ووقت أخذ العينات إلى 300 s. انقر على التالي، تحقق من تمكين إنشاء مراقبة مربع، ثم انقر فوق إنهاء.
ملاحظة: بمجرد بدء الاستقطاب، يقوم برنامج التحكم DNP بإنشاء إشارات الزناد كل 300 s لإرشاد مطياف لأخذ عينات من الاستقطاب باستخدام زاوية طرف صغيرة. وبهذه الطريقة، يضيف برنامج مطياف نقطة عينة إلى منحنى مغنطة الحالة الصلبة، المعروضة الآن في كل من برنامج مطياف وفي برنامج التحكم DNP تحت علامة التبويب الاستقطاب تراكم. بعد العينة الرابعة وكل عينة بعد ذلك، برنامج مطياف يناسب المنحنى لوظيفة النمو الأسي للنموذج:
S = A * exp (-t/Tp) + y0
حيث A هو سعة الاستقطاب، في وحدات تعسفية، t هو وقت أخذ العينات، Tp هو ثابت وقت الاستقطاب (في الثواني على حد سواء)، وy0 هو إزاحة. استناداً إلى المعلمات المجهزة، يقوم البرنامج أيضًا بحساب النسبة المئوية للاستقطاب التي تحققت حتى تلك النقطة من الزمن، والتي يتم عرضها أيضًا في علامة التبويب حالة الاستقطاب في DNP. - استقطاب حتى تراكم المغناطيسية الحالة الصلبة تصل إلى ما لا يقل عن 95٪ من الحد الأقصى (ساعة واحدة تقريبا).
- في حين أن العينة هي الاستقطاب، وإعداد Fast-Field-ركوب الدراجات Relaxometer كما هو موضح في القسم 2 أدناه.
- عندما يتم تحقيق الاستقطاب المطلوب، انقر على تشغيل حل وتحت طريقة،حدد اختبار حمض البيروفيك. ثم انقر فوق التالي.
- بعد التعليمات على الشاشة، فتح الأبواب برج DNP وتحميل غرفة التدفئة والضغط في الجزء العلوي من الجهاز مع ~ 4.55 مل من حل المتوسطة أعدت في القسم 1.5 لإنتاج تركيز 80 مليمول / لتر بيروفات على حل عند درجة الحموضة من ~ 7.75 ودرجة الحرارة من ~ 37 درجة مئوية.
- ضع عصا التعافي في الموضع الصحيح، وأغلق أبواب البرج، وعند الكمبيوتر انقر على التالي ثم على الانتهاء. عند هذه النقطة سيتم تسخين وسائل الإعلام حل حتى يصل الضغط 10 بار.
- بمجرد بلوغ ضغط البار 10، يتم رفع البيروفات المجمدة وفرط الاستقطاب تلقائيا من حمام الهليوم السائل، مختلطة بسرعة، وذاب مع وسائل الإعلام حل ساخنة وطرد من خلال أنابيب الشعرية في قارورة على شكل كمثرى. في حين يتم طرد خليط وسائل الإعلام بيروفات/حل hyperpolarized، دوامة باستمرار قارورة لضمان خليط متجانس.
- عندما يتم طرد جميع الخليط، رسم بسرعة 1.1 مل من السائل في حقنة، ونقل إلى أنبوب NMR 10-قطرها قبل تسخينها (37 درجة مئوية)، والنقل بسرعة إلى مقياس الاسترخاء الدراجات الميدانية (انظر الخطوة 2.2.12).
- الاستغناء عن aliquot المتبقية من كل انحلال بيروفات في مطياف NMR 0.55-T (انظر جدول المواد)للتحقق من الآثار التجريبية المنهجية المحتملة.
- تنظيف مسار السائل DNP على الفور باستخدام حل نظيف المتوسطة تليها الإيثانول. ضربة غاز الهليوم من خلال مسار السوائل لإزالة سوائل التنظيف المتبقية وتطهير مسار الأكسجين. تنظيف جميع الأواني الزجاجية.
- بعد كل قياس، تسجيل درجة الحموضة من العينات من كل من مطياف أعلى مقاعد البدلاء ومقياس الاسترخاء الدراجات الميدانية.
ملاحظة: كل قياس T1 هو انحلال فرط الاستقطاب منفصلة من جهاز DNP، لذلك يلزم الحرص لضمان القياس إلى القياس استنساخ تكوين العينة. ويتم ذلك من خلال وزن جميع العوامل والمذيبات بدقة 0.1 ملغ لضمان إعداد دقيق واستنساخ الحلول النهائية فرط الاستقطاب.
2. قياس الاسترخاء
ملاحظة الرجاء الرجوع إلى الجدول 1 لفهم أفضل لاختيار واستخدام المعلمات المختلفة الموضحة في الخطوات التالية. قبل الانحلال، يجب حساب زاوية الوجه مقياس الاسترخاء ويجب أن يكون مقياس الاسترخاء الإعداد وعلى استعداد لقياس الحل hyperpolarized (انظر أدناه).
- معايرة زاوية الوجه
- إعداد 1 مل من حمض البيروفيك أنيق [1-13C] في أنبوب NMR وإضافة عامل تباين الغادولينيوم للحد من T1 من النوى 13C إلى قيمة أقل من 200 مللي ثانية ولكن أكثر من 50 مللي ثانية.
- ختم أنبوب NMR بحيث يمكن استخدامه عدة مرات كمعيار المعايرة.
- باستخدام مقياس عمق مقياس الاسترخاء، تعيين عمق الإدراج من أنبوب NMR إلى الارتفاع المناسب لضمان أن العينة سوف تكون موجودة في مركز لفائف RF relaxometer.
- ضع علامة على عمق الإدراج لمعيار معايرة البيروفات 13C مع شريط لاصق لضمان التكرار.
- ضع سدادة العمق على أنبوب NMR إلى الموضع المشار إليه من قبل الشريط وأدخل معيار المعايرة هذا في تجويف مقياس الاسترخاء في مجال ركوب الدراجات. استخدام الوزن للحفاظ على أنبوب NMR في الموضع.
- فتح صمام الهواء الصك ومن لوحة أمامية relaxometer تعيين وحدة تحكم في درجة الحرارة إلى 37 درجة مئوية. وهذا سيحافظ على درجة حرارة العينة عند 37 درجة مئوية (± 0.5 درجة مئوية) باستخدام الهواء الساخن أثناء التجربة.
- إعداد مجال ركوب الدراجات relaxometer الأجهزة للحصول على 13C إشارات النوى. ويشمل ذلك تركيب وتنشيط لفائف الشهم الخارجية (انظر جدول المواد)،وضبط ومطابقة لفائف الترددات اللاسلكية إلى 8 ميغاهيرتز (~ 0.75 T للنوى 13C)، واستخدام كابل 1/4 المناسبة.
- في برنامج الأدوات، قم بتنفيذ الخطوات التالية:
- حدد علامة التبويب الاسمية الرئيسية
- انقر على الخلية بجوار تجربة التسمية ومرر لأسفل في النافذة المنبثقة لتحديد تسلسل النبض "13CANGLE. [فّك] ".
- تعيين معلمات الاكتساب التالية: RFA = 5; SWT = 0.005، RD = 0.5، BPOL = 30 ميغاهيرتز، TPOL = 0.5.
- حدد علامة التبويب Acq. par ثم حدد علامة التبويب الفرعية الأساسية.
- انقر على الخلية بجوار العلامة النواة والتمرير لأسفل في النافذة المنبثقة لتحديد 13C.
- ثم، قم بتعيين المعلمات التالية: SF = 8 ميغاهرتز، SW = 1000000، BS = 652، FLTR = 100000، MS = 32.
- حدد علامة التبويب الفرعية Conf.
- تعيين المعلمات التالية: RINH = 25 ACQD = 25.
- حدد علامة التبويب الفرعية nDim
- تعيين NBLK = 32، BINI = 2، بيند = 62.
- حدد علامة التبويب تقييم ثم علامة التبويب الفرعية معلمات.
- تعيين المعلمات التالية: EWIP = 10، EWEP = 128، EWIB = 1، EWEB = 32.
- ثم انقر فوق رمز البدء في الاكتساب لتشغيل تسلسل النبض.
- بمجرد الانتهاء من عملية الشراء، احفظ البيانات، حدد رمز مربع حوار التقييم ومن قائمة التحليل حدد نافذة WAM: الحجم المطلق. ثم حدد ورقة التقريروالرسوم البيانية وملف التصدير وأخيرا انقر على تنفيذ.
- في إطار التقرير ابحث عن عرض نبض الترددات اللاسلكية الذي يوفر الحد الأقصى للسعة وصقل القيمة مع مساعدة المؤشر في الرسم البياني المعروض، والذي يشبه المخططات المعروضة في الصف السفلي من الشكل 3. سيتم استخدام عرض النبض هذا للمعلمة PW90 من التجارب التالية.
- انقر فوق رمز F1 لضبط التحول التردد من مقياس الاسترخاء.
ملاحظة: نافذة وام: الحجم المطلق هو إجراء لدمج حجم واحد أو سلسلة من عمليات الاستحواذ على الاضمحلال التعريفي الحر (FIDs) من النقطة التي حددتها EWIP إلى النقطة المحددة من قبل EWEP ومن الكتلة تعريف EWIB إلى الكتلة المحددة من قبل EWEB.
- T1- القياسات
- تأكد من تثبيت لفائف الشهم الخارجية وتنشيطها.
- في برنامج الصك تنفيذ الخطوات التالية:
- حدد علامة التبويب الاسمية الرئيسية
- انقر على الخلية بجوار تجربة التسمية ومرر لأسفل في النافذة المنبثقة لتحديد تسلسل النبض HPUB/S، والذي يظهر في الشكل 4.
- تعيين معلمات الاكتساب التالية: RFA = 25، T1MX = القيم بين 3 و 5; SWT = 0.2، RD = 0، BRLX = حقل الاسترخاء المطلوب في ميغاهيرتز (بروتون Larmor التردد).
- حدد علامة التبويب Acq. par ثم حدد علامة التبويب الفرعية الأساسية.
- انقر على الخلية بجوار العلامة النواة والتمرير لأسفل في النافذة المنبثقة لتحديد 13C.
- ثم، قم بتعيين المعلمات التالية: SF = 8 ميغاهرتز، SW = 1000000، BS = 652، FLTR = 50000.
- حدد علامة التبويب الفرعية Conf.
- تعيين المعلمات التالية: PW90 يساوي القيمة الموجودة في الخطوة 2.1.10 RINH = 25 ACQD = 25.
- حدد علامة التبويب الفرعية Puls وقم بتعيين PW = 5.
- حدد علامة التبويب الفرعية nDim وقم بتعيين NBLK = 100.
- انتظر واستعد لتلقي الحل شديد الاستقطاب لبدء الحصول على البيانات.
- مباشرة قبل إدراج العينة في مقياس الاسترخاء، يدويا بدء تسلسل النبض من وحدة التحكم، لتجنب إدراج العينة في حقل مغناطيسي فارغة. لهذا السبب، من المهم تجاهل الاضمحلال التعريفي الحر الأول (FID) أثناء تحليل البيانات.
- بمجرد الانتهاء من عملية الشراء، احفظ البيانات بالنقر فوق الزر حفظ.
- باستخدام برنامج التحليل، دمج حجم كل إشارة FID لإنتاج سلسلة بيانات تتألف من مغنطة عينة كدالة للوقت.
- استخراج وقت الاسترخاء تدور شعرية من نموذج الأسي ثلاثة معلمة باستخدام معيار غير الخطية أقل المربعات المناسب خوارزمية تنفيذها في برنامج تحليلي تجاري (انظر جدول المواد)على افتراض الترجيح حتى ل جميع البيانات:
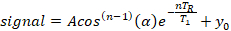
حيث A هو السعة إشارة الأولية(y-intercept)، T1 هو وقت الاسترخاء تدور شعرية، TR هو وقت التكرار، وهو قيمة معروفة، y0 هو إشارة الإزاحة، والكوس(n-1)(α)هو تصحيح لفقدان المغناطيسية الطولية في قياس ال نلزاوية الوجه، α.
Access restricted. Please log in or start a trial to view this content.
النتائج
ويقدم الشكل 2 مثالاً على عملية مسح عالية الاستبانة للموجات الدقيقة كاملة المدى لحمض البيروفيك. وفيما يتعلق بالحالة المعروضة، فإن تردد الموجات الدقيقة الأمثل هذا يتوافق مع GHz 94,128، الذي تم إبرازه في الشكل. نظام DNP لدينا يمكن أن تعمل عادة في نطاق 93.750 غيغاهرتز إلى 94.241 غيغاهرتز ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
استخدام DNP لتعزيز اكتساب إشارة هو حل تقني لعدم كفاية إشارة الرنين المغناطيسي المتاحة من النوى 13C بتركيزات محدودة، مثل تلك المستخدمة في حقن الحيوانات، ولكن يطرح تحديات تجريبية أخرى. ويمثل كل قياس للاسترخاء المبين في الشكل 7 مقياساً لعينة معدة بشكل فريد لأنه لا يمكن إع?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
وليس لدى أصحاب البلاغ أي كشف.
Acknowledgements
ويود المؤلفون أن يشكروا معهد أونتاريو لبحوث السرطان وبرنامج ترجمة التصوير ومجلس العلوم الطبيعية والبحوث الهندسية في كندا على تمويل هذا البحث. كما نود أن نعترف بالمناقشات المفيدة مع ألبرت تشين، جنرال إلكتريك للرعاية الصحية، تورونتو، كندا، جياني فيرانتي، ستالار s.r.l.، إيطاليا، ووليام ماندر، أكسفورد للأدوات، المملكة المتحدة.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| [1-13C]Pyruvic Acid | Sigma-Aldrich, St. Louis, MO, USA | 677175 | |
| 10mm NMR Tube | Norell, Inc., Morganton NC, USA | 1001-8 | |
| De-ionized water | |||
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | Sigma-Aldrich, St. Louis, MO, USA | E5134 | |
| HyperSense Dynamic Nuclear Polarizer | Oxford Instruments, Abingdon, UK | Includes the following: "DNP-NMR Polarizer" software used to control and monitor the whole DNP polarizer; "RINMR" used to monitor the solid state polarization levels; "HyperTerminal" used to communicate the DNP software with the RINMR software that monitors the solid state polarization level. Also includes the MQC bench top spectrometer to monitor the liquid state polarization in conjunction with it own RINMR software | |
| MATLAB R2017b | MathWorks, Natick, MA | Include scripts for non-linear fitting of magnetization decay over time and T1 NMRD analysis of hyperpolarized pyruvic acid. | |
| OX063 Triarylmethyl radical | Oxford Instruments, Abingdon, UK | ||
| pH meter - SympHony | VWR International, Mississauga, ON., Canada | SB70P | |
| ProHance | Bracco Diagnostics Inc. | Gadoteridol, Gd-HP-DO3A | |
| Pure Ethanol (100% pure) | Commercial Alcohols, Toronto, ON, Canada | P016EAAN | |
| Shim Coil | Developed in-house | ||
| Sodium Chloride | Sigma-Aldrich, St. Louis, MO, USA | S7653 | |
| Sodium Hydroxide | Sigma-Aldrich, St. Louis, MO, USA | S8045 | |
| SpinMaster FFC2000 1T C/DC | Stelar s.r.l., Mede (PV) Italy | Includes the software "AcqNMR" that is used to set experimental parameters, monitor the tuning and matching of the RF coil, loading different pulse sequences, calibrate flip angle, data acquisition and curve fitting, among other functions. Also includes a depth gauge, some weights and a depth stopper. | |
| Trizma Pre-Set Crystals (pH 7.6) | Sigma-Aldrich, St. Louis, MO, USA | T7943 |
References
- Golman, K., Zandt, R. I., Lerche, M., Pehrson, R., Ardenkjaer-Larsen, J. H. Metabolic imaging by hyperpolarized 13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Research. 66 (22), 10855-10860 (2006).
- Witney, T. H., Brindle, K. M. Imaging tumour cell metabolism using hyperpolarized 13C magnetic resonance spectroscopy. Biochemical Society Transactions. 38 (5), 1220-1224 (2010).
- Kurhanewicz, J., et al. Analysis of cancer metabolism by imaging hyperpolarized nuclei: prospects for translation to clinical research. Neoplasia. 13 (2), 81-97 (2011).
- Golman, K., et al. Cardiac metabolism measured noninvasively by hyperpolarized 13C MRI. Magnetic Resonance in Medicine. 59 (5), 1005-1013 (2008).
- Golman, K., in 't Zandt, R., Thaning, M. Real-time metabolic imaging. Proceedings of the National Academy of Science of the United States of America. 103 (30), 11270-11275 (2006).
- Day, S. E., et al. Detecting response of rat C6 glioma tumors to radiotherapy using hyperpolarized [1- 13C]pyruvate and 13C magnetic resonance spectroscopic imaging. Magnetic Resonance in Medicine. 65 (2), 557-563 (2011).
- Gallagher, F. A., et al. Magnetic resonance imaging of pH in vivo using hyperpolarized 13C-labelled bicarbonate. Nature. 453 (7197), 940-943 (2008).
- Wilson, D. M., et al. Multi-compound polarization by DNP allows simultaneous assessment of multiple enzymatic activities in vivo. Journal of Magnetic Resonance. 205 (1), 141-147 (2010).
- Gallagher, F. A., et al. Production of hyperpolarized [1,4-13C2]malate from [1,4-13C2]fumarate is a marker of cell necrosis and treatment response in tumors. Proceedings of the National Academy of Science of the United States of America. 106 (47), 19801-19806 (2009).
- Chen, A. P., et al. Feasibility of using hyperpolarized [1-13C]lactate as a substrate for in vivo metabolic 13C MRSI studies. Magnetic Resonance Imaging. 26 (6), 721-726 (2008).
- Gallagher, F. A., Kettunen, M. I., Day, S. E., Lerche, M., Brindle, K. M. 13C MR spectroscopy measurements of glutaminase activity in human hepatocellular carcinoma cells using hyperpolarized 13C-labeled glutamine. Magnetic Resonance in Medicine. 60 (2), 253-257 (2008).
- Ardenkjaer-Larsen, J. H., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proceedings of the National Academy of Sciences of the United States of America. 100 (18), 10158-10163 (2003).
- Ishii, M., et al. Hyperpolarized 13C MRI of the pulmonary vasculature and parenchyma. Magnetic Resonance in Medicine. 57 (3), 459-463 (2007).
- Lau, A. Z., Chen, A. P., Cunningham, C. H. Integrated Bloch-Siegert B(1) mapping and multislice imaging of hyperpolarized (1)(3)C pyruvate and bicarbonate in the heart. Magnetic Resonance in Medicine. 67 (1), 62-71 (2012).
- Lau, A. Z., et al. Rapid multislice imaging of hyperpolarized 13C pyruvate and bicarbonate in the heart. Magnetic Resonance in Medicine. 64 (5), 1323-1331 (2010).
- Golman, K., Ardenkjaer-Larsen, J. H., Petersson, J. S., Mansson, S., Leunbach, I. Molecular imaging with endogenous substances. Proceedings of the National Academy of Sciences of the United States of America. 100 (18), 10435-10439 (2003).
- Johansson, E., et al. Cerebral perfusion assessment by bolus tracking using hyperpolarized 13C. Magnetic Resonance in Medicine. 51 (3), 464-472 (2004).
- Johansson, E., et al. Perfusion assessment with bolus differentiation: a technique applicable to hyperpolarized tracers. Magnetic Resonance in Medicine. 52 (5), 1043-1051 (2004).
- Albers, M. J., et al. Hyperpolarized 13C lactate, pyruvate, and alanine: noninvasive biomarkers for prostate cancer detection and grading. Cancer Research. 68 (20), 8607-8615 (2008).
- Chen, A. P., et al. Hyperpolarized C-13 spectroscopic imaging of the TRAMP mouse at 3T-initial experience. Magnetic Resonance in Medicine. 58 (6), 1099-1106 (2007).
- Lupo, J. M., et al. Analysis of hyperpolarized dynamic 13C lactate imaging in a transgenic mouse model of prostate cancer. Magnetic Resonance Imaging. 28 (2), 153-162 (2010).
- von Morze, C., et al. Imaging of blood flow using hyperpolarized [(13)C]urea in preclinical cancer models. Journal of Magnetic Resonance Imaging. 33 (3), 692-697 (2011).
- Brindle, K. M., Bohndiek, S. E., Gallagher, F. A., Kettunen, M. I. Tumor imaging using hyperpolarized 13C magnetic resonance spectroscopy. Magnetic Resonance in Medicine. 66 (2), 505-519 (2011).
- Park, I., et al. Detection of early response to temozolomide treatment in brain tumors using hyperpolarized 13C MR metabolic imaging. Journal of Magnetic Resonance Imaging. 33 (6), 1284-1290 (2011).
- Bohndiek, S. E., et al. Detection of tumor response to a vascular disrupting agent by hyperpolarized 13C magnetic resonance spectroscopy. Molecular Cancer Therapeutics. 9 (12), 3278-3288 (2010).
- Witney, T. H., et al. Detecting treatment response in a model of human breast adenocarcinoma using hyperpolarised [1-13C]pyruvate and [1,4-13C2]fumarate. British Journal of Cancer. 103 (9), 1400-1406 (2010).
- Levitt, M. H. Spin dynamics: basics of nuclear magnetic resonance. , John Wiley & Sons. (2001).
- Mieville, P., Jannin, S., Bodenhausen, G. Relaxometry of insensitive nuclei: optimizing dissolution dynamic nuclear polarization. Journal of Magnetic Resonance. 210 (1), 137-140 (2011).
- Redfield, A. G. Shuttling device for high-resolution measurements of relaxation and related phenomena in solution at low field, using a shared commercial 500 MHz NMR instrument. Magnetic Resonance in Chemistry. 41 (10), 753-768 (2003).
- Grosse, S., Gubaydullin, F., Scheelken, H., Vieth, H. -M., Yurkovskaya, A. V. Field cycling by fast NMR probe transfer: Design and application in field-dependent CIDNP experiments. Applied Magnetic Resonance. 17 (2), 211-225 (1999).
- Kimmich, R., Anoardo, E. Field-cycling NMR relaxometry. Progress in Nuclear Magnetic Resonance Spectroscopy. 44 (3-4), 257-320 (2004).
- Guðjónsdóttir, M., Belton, P., Webb, G. Magnetic Resonance in Food Science: Challenges in a Changing World. , The Royal Society of Chemistry. 65-72 (2009).
- Anoardo, E., Galli, G., Ferrante, G. Fast-field-cycling NMR: Applications and instrumentation. Applied Magnetic Resonance. 20 (3), 365-404 (2001).
- Chattergoon, N., Martinez-Santiesteban, F., Handler, W. B., Ardenkjaer-Larsen, J. H., Scholl, T. J. Field dependence of T1 for hyperpolarized [1-13C]pyruvate. Contrast Media & Molecular Imaging. 8 (1), 57-62 (2013).
- Martínez-Santiesteban, F. M., Dang, T. P., Lim, H., Chen, A. P., Scholl, T. J. T1 nuclear magnetic relaxation dispersion of hyperpolarized sodium and cesium hydrogencarbonate-13C. NMR in Biomedicine. 30 (9), 3749(2017).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved