Method Article
CRISPR/Cas9 Ribonucleoprotein بوساطة تحرير الجينات الدقيقة عن طريق أنبوب الكهربائي
In This Article
Summary
يقدم هنا بروتوكول للكفاءة كريسبر / Cas9 ribonucleoprotein بوساطة تحرير الجينات في خلايا الثدييات باستخدام electroporation أنبوب.
Abstract
النوى تحرير الجينات، ممثلة بالبروتين المرتبط كريسبر 9 (Cas9)، أصبحت الأدوات الرئيسية في البحوث الطبية الحيوية. إن النجاح في تسليم عناصر CRISPR/Cas9 إلى الخلايا المستهدفة عن طريق التطفل هو شرط أساسي لتحرير الجينات بكفاءة. يوضح هذا البروتوكول أن أنبوب electroporation (TE) الآلات بوساطة تسليم كريسبر / Cas9 ريبونوكليوبروتين (RNP)، جنبا إلى جنب مع وحيد stranded oligodeoxynucleotide (ssODN) قوالب المانحين لأنواع مختلفة من خلايا الثدييات، يؤدي إلى قوية دقيقة الجينات تحرير الأحداث. أولاً، تم تطبيق TE لتسليم CRISPR/Cas9 RNP وssODNs للحث على الطفرات المسببة للأمراض في جين الخلايا الفرعية لمستقبلات interleukin 2 (IL2RG) وجين اختزال البنيبيفيتين (SPR) في خلايا الخلايا الليفية للأرانب. تم تحقيق معدلات طفرة دقيقة من 3.57%-20% على النحو الذي يحدده تسلسل استنساخ TA البكتيري. ثم استخدمت نفس الاستراتيجية في iPSCs الإنسان على العديد من الجينات ذات الصلة سريريا بما في ذلك مستقبلات عامل نمو البشرة (EGFR)، البروتين الميوسين ملزمة C، القلب (Mybpc3)، وبيتا الهيموجلوبين الفرعية (HBB). وعلى نحو متسق، تحققت معدلات طفرات دقيقة للغاية (11.65 في المائة - 37.92 في المائة) كما يحددها التسلسل العميق (DeepSeq). ويبين العمل الحالي أن الكهرباب الأنبوبي لـ CRISPR/Cas9 RNP يمثل بروتوكولافعالا للتَنَزَل في تحرير الجينات في خلايا الثدييات.
Introduction
CRISPR/Cas9 هو النوى الأكثر استخداما للبرمجة لتحرير الجينات. وهو يعمل من خلال دليل واحد RNA (sgRNA) بوساطة الاعتراف من كل من التسلسلات الهدف وتتابع الزخرفة البروتوسبيسر المجاورة (PAM) في الجينوم. وينتج عن النواة Cas9 كسر الحمض النووي مزدوجة stranded (DSB) تقع ثلاثة النيوكليوتيدات المنبع من تسلسل PAM1. يتم إصلاح DSBs إما من خلال ربط نهاية غير متجانسة عرضة للخطأ (NHEJ) أو مسارات الإصلاح الموجه homology (HDR). لتحقيق تحرير الجينات بدقة من خلال مسار HDR، غالبا ما يتم توفير قوالب المانحين في شكل الحمض النووي البلازميد (pDNA) أو oligodeoxynucleotide واحد stranded (ssODN).
CRISPR/Cas9 وsgRNA يمكن تسليمها إلى الخلايا في ثلاثة أشكال: مجمع ريبونوكليوبروتين (RNP) من بروتين Cas9 وgRNA2,3; Cas9 mRNA وsgRNA4,5; أو الحمض النووي البلازميد (pDNA) الذي يحتوي على المروجين اللازمة،مدفوعة sgRNA، ومنطقة الترميز Cas9 6،7،8. وقد أظهرت العديد من المجموعات أنه عندما يتم تسليم كريسبر/كاس9 كما RNP, كفاءة تحرير الجينات غالبا ً تفوق تلك التي تحققت في صيغ pDNA أو MRNA, يعزى إلى حجم أصغر بكثير من RNP مقارنة مع الأحماض النووية9. وعلاوة على ذلك، فقد ثبت سابقا أن أنبوب جديد الكهربائي (TE) آلة فعالة بشكل خاص في تطبيقات تحرير الجينات في عدة أنواع الخلايا9.
ويرد في العمل الحالي بروتوكول خطوة بخطوة في استخدام TE لتسليم CRISPR/Cas9 RNP إلى خلايا الثدييات من مختلف الأنواع في العديد من المواقع ذات الصلة سريريا. هذه الرواية TE تقنية ترانسفيكشن وارتفاع معدل ظاهرة HDR قد تجد تطبيقات واسعة في البحوث الطبية الحيوية.
Protocol
وقد استعرضت اللجنة المؤسسية لرعاية الحيوانات واستخدامها ووافقت عليها اللجنة المؤسسية لرعاية الحيوانات واستخدامها في جامعة ميشيغان جميع إجراءات الصيانة والرعاية والاستخدام.
1. إعداد الخلايا
-
الحصول على iPSCs الإنسان (ACS-1030) من مجموعة الثقافة الأمريكية النوع (ATCC). ثقافة iPScs على مصفوفة خارج الخلية الاصطناعية مع خلية خالية من التغذية وسط ثقافة (انظر جدول المواد) في حاضنة ثقافة الخلية (5٪ CO2 في 37 درجة مئوية) اتباع تعليمات المورد.
- 2 ساعة قبل الامتصاص، علاج iPSCs مع 10 ميكروم رو المرتبطة، لفائف ملفوف ة البروتين كيناز (ROCK) مثبط Y27632 (استخدام الذي يقلل من المبرمج من hiPSCs الإنسان المنفصلة ويزيد من كفاءة البقاء على قيد الحياة والاستنساخ من hiPSCs دون تؤثر على القدرة على تعدد هات.
- عند التغوط، فصل iPSCs مع حل مفرزة الخلية (انظر جدولالمواد) إلى خلايا واحدة في 37 درجة مئوية لمدة 5 دقائق.
-
إنشاء زراعة خلايا الخلايا الليفية أرنب باستخدام الثقافة الأولية من الخزعات أنسجة الجلد الأذن أرنب، كما سبق وصفها10.
- يتم الحصول على خزعة الجلد الأذن 0.5 سم x 0.5 سم من طرف الأذن الأرنب. اقطع الشعر عن أنسجة الأذن.
- شطف 2X مع ملحي الفوسفات العازلة دولبيك (DPBS) مع 5٪ البنسلين-ستربتوميسين. نقل أنسجة الأذن إلى طبق جديد من نسيج الأنسجة 6 سم، ثم قطع الأنسجة إلى قطع صغيرة (~ 1.0 مم × 1.0 مم). إضافة بضع قطرات من مصل جنين يوفي لمنع الأنسجة من الجفاف.
- انشر الأنسجة المقطّعَة إلى طبق زراعة الأنسجة 10 سم، ثمّ تُضاف 10 مل من الوسط الثقافي. يتم استزراع خلايا الخلايا الليفية للأرانب في متوسط النسر المعدل في دولبيككو (DMEM) مع 10% مصل جنيني بقري. وضع طبق الأنسجة في حاضنة زرع الخلية (5٪ CO2 في 37 درجة مئوية).
- بعد ثلاثة إلى خمسة أيام من الطلاء، استخدم التربسين-EDTA لهضم الخلايا عند 37 درجة مئوية لمدة 2 دقيقة.
2. تصميم وتوليف الـ gRNAs وOligos المانحة
- لكل جين، دليل تصميم الجيش الملكي النيبالي على أساس تسلسل الموضع المستهدف باستخدام أداة على الإنترنت (على سبيل المثال، http://crispor.tefor.net/>).
- لصق في تسلسل الحمض النووي من الفائدة.
- اختر جينوم وزخرفة متجاورة (PAM). سيتم عرض تسلسلات الدليل المحتملة في تسلسل اتلال الحمض النووي للإدخال على صفحة الإخراج. من المستحسن تحديد gRNA مع كفاءة أعلى المتوقعة وانخفاض إمكانات خارج الهدف.
- توليف الحمض النووي من قبل بائع تجاري لنسخ gRNAs. إجراء النسخ في المختبر من gRNA باستخدام مجموعة التوليف gRNA وفقا لتعليمات الشركة المصنعة.
- تنقية الـ gRNA باستخدام عمود صغير لتنقية الحمض النووي الريبي المدرج في مجموعة التوليف gRNA. قياس التركيز، ثم تخزين gRNAs في -80 درجة مئوية.
- تصميم قالب متبرع ssODN لكل موقع طفرة. يمكن توليف ssODNs من قبل البائعين التجاريين مثل IDT. بشكل عام، كل ssODN هو 120-160 النيوكليوتيدات (نت) في الطول، وتتألف من 60-80 nt في الذراع homology الأيسر و 60-80 NT في الذراع homology الحق. لمنع إعادة قطع الحمض النووي المحرر، يجب إدخال طفرة صامتة في PAM في ssODN كلما كان ذلك ممكنا. وينبغي أن يكون موقع قطع كريسبر موجوداً بالقرب من التغير الجيني المقصود قدر الإمكان.
3. أنبوب الكهربائي من CAS9 RNP وssODNs
- إعداد الخلايا كما هو موضح في القسم 1.
- قم بتعليق 2-3 x 105 خلايا في 20 ميكرولتر من العازلة الكهربائية. الماصة صعودا وهبوطا بعناية لإنتاج تعليق خلية واحدة.
- لـ Cas9 RNP transfection، premix 2 ميكروغرام من بروتين Cas9-NLS مع 0.67 ميكروغرام من جرنا في درجة حرارة الغرفة (RT) لمدة 10-15 دقيقة. بعد ذلك، امزج يُمزج تركيبRNP المشكّل برفق مع 2 ميكروغرام من ssODN مع الخلايا.
- نقل خليط الخلية إلى أنبوب كهربائي 20 ميكرولتر باستخدام نصائح الماصة الشاملة التي تقدمها مجموعة أنابيب الكهرباء. لتحقيق أفضل electroporation، في محاولة لتجنب تشكيل فقاعات الهواء أثناء نقل.
- وضع أنبوب الكهربائي في فتحة من الكهربائي واضغط على "الذهاب" لإنهاء. اتبع المعلمات المقترحة لكل نوع من الخلايا. على سبيل المثال، بالنسبة لخلايا الخلايا الليفية للخلايا البشرية وخلايا الخلايا الليفية للأرانب، فإن مجموعة الجهد هي 420 فولت ووقت النبض هو 30 مللي ثانية، ويشار إلى دورة الكهربا الكهربائية الناجحة من خلال تقرير النبض على شاشة العرض للكهرباء.
- بعد ال [إلكتروبورأيشن], إنتقال الإنسان [إيبس] خلايا إلى 1 [مل] من [بر-ورمد] [ي-27632-ت] ثقافة وسط يوصف في خلية ثقافة جزء. لخلايا الخلايا الليفية أرنب، نقلها إلى DMEM مع 10٪ مصل جنيني البقري.
- لوحة الخلايا resuspended إلى بئر واحد من 12 لوحة ثقافة الخلية جيدا.
- تغيير الوسط الثقافة كل يوم. تتم إزالة Y-27632 من ثقافة iPSC البشرية المتوسطة 24 ح بعد الإلكتروبورأيشن.
4. تحليل أحداث تحرير الجينات
- حصاد الخلايا 72 ح بعد electroporation. الخلايا الخلاصة من لوحة الثقافة باستخدام التربسين-EDTA لخلايا الخلايا الليفية أرنب أو حل مفرزة الخلية لiPSCs الإنسان. بعد الطرد المركزي، إعادة تعليق الخلايا مع 350 مل من العازلة lysis (1 M تريس حمض الهيدروكلوريك، 5 م كلوريد الصوديوم، 0.5 M EDTA؛ درجة الحموضة 8.0، 10٪ SDS، إضافة 20 ميكرولتر من 20 ملغ / مل البروتين ك المخزون لكل 1 مل من العازلة lysis)، ثم احتضان في 55 درجة مئوية بين عشية وضحاها.
- استخراج الحمض النووي الجينومي مع الفينول كلوروفورم باستخدام الإجراءات القياسية.
- تضخيم 100-200 شظايا الحمض النووي BP التي تحتوي على المنطقة المستهدفة باستخدام عالية الدقة الحمض النووي البلمرات، ثم تنقية شظايا الحمض النووي من المواد الهلامية باستخدام مجموعة استخراج هلام أو مباشرة من منتجات PCR باستخدام مجموعة مصغرة PCR SV.
- لتحديد كفاءة تحرير الجينات عن طريق تسلسل مستعمرة البكتيرية، يُقدّم منتجات PCR المنقّية إلى ناقل pCR4-TOPO باستخدام مجموعة استنساخ TOPO TA. التقاط عشوائيا استنساخ البكتيرية، ثم تسلسل إدراج باستخدام التمهيدي تسلسل عالمي المقدمة من مجموعة استنساخ TOPO TA.
- لتحديد كفاءة تحرير الجينات عن طريق التسلسل العميق، أرسل منتجات PCR المنقى (~100-200 bp) من الخطوة 4.3 لتسلسل المتابعة كريسبر في جوهر تسلسل الحمض النووي.
النتائج
TE من CAS9 RNP وssodns إلى خلايا الخلايا الليفية أرنب
ويتجلى في الشكل 1العملية الشاملة لتسليم الخلايا المنوية من نوع Cas9 إلى خلايا الثدييات بوساطة TE . أولاً، تم إنتاج طفرات C231Y وX235X في جين IL2RG، وتم إنتاج طفرة R150G في جين SPR في خلايا الخلايا الليفية للأرانب. ومن المعروف أن الطفرات فقدان الوظيفة في الجينات IL2RG وSPR تسبب نقص المناعة الأولي11 والعجز في المحرك والمعرفي12، على التوالي.
وموضحة تصاميم sgRNA محددة في الشكل 2A. وترد في الجدول 3الطلّاب المستخدمة لتضخيم المناطق المستهدفة. وترد في الجدول 1تسلسلات ssODNs . تم تحديد معدلات تحرير الجينات عن طريق استنساخ TA البكتيري (الشكل2B). في ال [إيل2رغ] [ك231] موضع, من ال 28 مستنسخات أنّ كان تسلسل, واحدة (3.57%) حمل الطفرة الدقيقة C231Y، أربعة (14.28%) (indel) الطفرات التي تحملها أو تقوم بإدخالها أو حذفها، و23 (82 في المائة) المتبقية كانت البرية من نوع. في موقع IL2RG Q235، من أصل 27 استنساخ التي تم تسلسلها، واثنين (7.41%) حملت الطفرة Q235X دقيقة، ثلاثة الطفرات indel (11.11٪ والمتبقية كانت البرية من نوع. في موقع SPG R150، من بين 20 استنساخ متتابعة، خمسة (25%) حمل ال [ر150غ] دقيقة طفرة, 10 (50%) حملت طفرات indel ، والمتبقية كانت من نوع البرية.
TE من Cas9 RNP وssodns إلى iPSCs الإنسان
ثم تم استخدام TE لتسليم Cas9 RNP وssODNs إلى iPSCs الإنسان واستهداف المواقع ذات الصلة سريريا في EGFR، Mybpc3، وHBB الجينات. الطفرات نقطة في منطقة EGFR T790 القريبة تضفي مقاومة لمثبطات كيناز التيروزين EGFR في المرضى الذين يعانون من سرطان الرئة خلية غير صغيرة (NSCLC) إيواء الطفرات تفعيل EGFR13. وتورط طفرة في الإطارات 16 في Mybpc3 في اعتلال عضلة القلب الضخامي14. الطفرة نقطة E6V في الجين سداسي البروم ثنائي الفينيل يؤدي إلى مرض الخلايا المنجلية15.
وموضحة تصاميم sgRNA محددة في الشكل 3A. وترد في الجدول 3الطلّاب المستخدمة لتضخيم المناطق المستهدفة. وترد في الجدول 1تسلسلات ssODNs . تم تحديد معدلات تحرير الجينات من قبل DeepSeq (الشكل3B). في موقع EGFR، حمل 15.68% من الأليلات طفرات نقطة دقيقة (6,315 قراءة)، وحمل 22.75% طفرات indel (9,162 قراءة)، وكانت نسبة 61.57% المتبقية من النوع البري (24,797 قراءة). في [مبّك3] موقعة, حمل 37.92% الدقيقة 4[بب] [تغا] حذف (11,654 يقرأ), 2.24% يحمل [إيندل] طفرات (410 يقرأ) والمتبقّي 59.84% كان [ويلد-تب] (18,692 يقرأ). في موقع سداسي البروم ثنائي الفينيل، حمل 11.65% طفرة E6V دقيقة (6,565 قراءة)، وحمل 23.35% طفرات indel (13,163 قراءة) وكانت نسبة 65% المتبقية من النوع البري (36,644 قراءة).

الشكل 1: مخطط تدفق أنبوب كهربائي من CAS9 RNP.

الشكل 2 تحرير الجينات من خلايا الخلايا الليفية الأرنب. (أ) توضيح لتسلسلات الهدف. تشير الصناديق إلى موقع مستهدف. الحروف المسطرة تتوافق مع تسلسلات gRNA. الحروف الحمراء الملونة تشير إلى تسلسل PAM. (B) نتائج استنساخ TA لأحداث تحرير الجينات. تشير الصناديق إلى موضع متحول بدقة. تسلسل Indel هو ممثل فقط من نوع أليل واحد. لا تظهر تسلسلات indel الأخرى. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
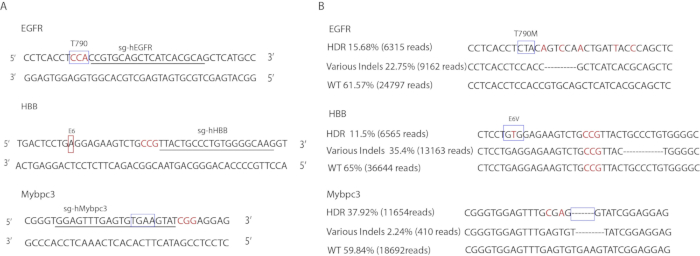
الشكل 3 تحرير الجينات من iPSCs الإنسان. (أ) توضيح لتسلسلات الهدف. تشير الصناديق إلى موقع مستهدف. الحروف المسطرة تتوافق مع تسلسل gRNA. الحروف الحمراء الملونة تشير إلى تسلسل PAM. (ب) نتائج ديبسيك لأحداث تحرير الجينات. تشير الصناديق إلى موضع متحول بدقة. تشير الحروف الحمراء الملونة إلى الطفرات الصامتة التي تم إدخالها في قوالب المانحين. تسلسل Indel هو ممثل فقط من نوع أليل واحد. لا تظهر تسلسلات indel الأخرى. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
| الجراد |
تسلسل أوليغو | |||||||
| (الطفرة المستهدفة) | ||||||||
| أرنب IL2RG (C231Y) | AGCGTGGGGGGGCAACTCTACACGTCCGTCCGAGCGTTTTATGTGTGTGTGGGTGTCAGCATGTGTGTGT غاتغاسيكجاكاكتاكتغغاكاأكتكاتاغاجتاااجتغاجتجيغاتغغكاكت | |||||||
| أرنب IL2RG (Q235X) | AGCGTGGGGGGGAAACTCTACACGTCCGTCCGAGCGTTTTATGTGTGTGTGTGTGTGTTAGGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGGG غاتغاسيكجاكاكتاكتغغاكاأكتكاتاغاجتاااجتغاجتجيغاتغغكاكت | |||||||
| أرنب SPR | شركة الدراسات اللّيّة كهال الكه | |||||||
| (R150G) | ||||||||
| الإنسان EGFR | ACGTGGGCGCGTGCTGCTGCGTGCGCGCGCTCTCTACGTCACCACGTCACACTACTGATTACCCACCCACTACTGATTACCCACCCACTGATTACCCACCC اااااااااكاتاكتاكتكتكتكتكتكتكتكتكتكتكتكتكتكتكتاكتكتكتكتكتكتكتكتككجغاكاااااجاتاكتاكتا | |||||||
| (الطفرات نقطة بواسطه إلى T790) | ||||||||
| الإنسان Mybpc3 | مجلس التعاون الخليجيCCCGTGTCTCCACGCGCCCCGTGGTGTGTGTGTGTGGGGGGGGGGGTGTGTGTGTGTGTGTGTGTGTATCGGA جيغغغغغغاغتكاغاتغاغاغاغاغاغاغاغاغغغغغغغغغغغغغغغغغغغات | |||||||
| (حذف 4-bp) | ||||||||
| الإنسان سداسي البروم ثنائي الفينيل | تكتجاكاكاتاكتاكتاكتاكتكاتاكاتكاتاتاكتاكاياكاكاتاككاتاكتاكتاكتاكتكتكتكتكتكتكتغكتككتككتكسيسيسيسيسيسي CTGTGGGGGGAGGGAACGTGTGTGTGTGTGTCCCTGGGCAG | |||||||
| (E6V) | ||||||||
الجدول 1: تسلسلات من ssODNs.
| خطوه | المشكله | الأسباب المحتملة | حلول |
| 2.1 | انخفاض معدل indel | دليل ضعيف تصميم الجيش الملكي النيبالي، دليل مخزون الجيش الملكي النيبالي > 6 أشهر، وانخفاض تركيز دليل الجيش الملكي النيبالي | إعادة تصميم دليل الجيش الملكي النيبالي، وإنتاج / النظام دليل جديد الجيش الملكي النيبالي. |
| 2-3 | كفاءة منخفضة PGE | سوء تصميم الحمض النووي المانحة، وانخفاض كفاءة دليل RNA، كمية غير صحيحة من الحمض النووي المانحة أو الحمض النووي رديئة الجودة | زيادة طول الذراع homology، إدخال الطفرة PAM، إدخال الطفرات الصامتة إلى الحمض النووي المانحة، واستخدام دليل أكثر كفاءة الجيش الملكي النيبالي، وتحسين نسبة البروتين Cas9 على دليل الجيش الملكي النيبالي. |
| 3.4 | فشل عملية الامتصاص | فقاعات الهواء التي تشكلت أثناء نقل الخلايا العازلة الخليط إلى أنبوب electroporation، غير صحيح الجهد / مدة الإعداد | في محاولة لتجنب تشكيل فقاعات الهواء، وضبط الجهد / المدة الإعداد. |
| 3.6 | بقاء الخلايا المنخفضة بعد الكتروبوريشن | بقاء منخفض من [إيبس] وحيد إنسانيّة | إضافة مثبطات روك بعد electroporation، وزيادة عدد الخلايا. |
| 4.1 | فشل PCR | محتويات GC عالية، أو تسلسل متكرر | تحسين حالة PCR، إضافة DMSO إلى نظام PCR. |
الجدول 2: استكشاف أخطاء الأدلة للمشاكل المتكررة.
| اسم التمهيدي | تسلسل | ملاحظه |
| Rb-IL2RG-F | مركز المكافحة العامة للتصنيف | لتضخيم جزء الحمض النووي الأرانب IL2RG |
| Rb-IL2RG-R | تجاجاجاجاكاجاجاجاجاجا | |
| Rb-SPR-F | GTACTTTGTGGGGACAGG | لتضخيم الأرانب SPR جزء الحمض النووي |
| RB-SPR-R | CTCAGCACCCTGACACTGGG | |
| H-EGFR-F | TGATGGCCAGCGTGGACAAC | لتضخيم الإنسان EGFR جزء الحمض النووي |
| H-EGFR-R | اوووووووووووووووووووووووووووو | |
| H-Mybpc3-F | أتجكككتكتكك | لتضخيم الإنسان Mybpc3 جزء الحمض النووي |
| H-Mybpc3-R | TCAGGGGAGACCCTCAT | |
| H-HBB-F | TAACCTTGATACCAACCTGC | لتضخيم الإنسان سداسي الفينيل سداسي البروم ثنائي في الحمض النووي |
| H-HBB-R | الـCATTTTTTTCTGACACAACT |
الجدول 3: الطلّاب المستخدمة في الخطوة 4-3.
Discussion
وكانت طريقة electroporation الأنبوب فعالة في تقديم CRISPR/Cas9 RNP وssODNs إلى الأرانب والخلايا البشرية، مما أدى إلى تحرير الجينات دقيقة قوية (PGE). والفرق الأساسي بين TE والأجهزة الكهربائية التقليدية الأخرى هو استخدام أنبوب، الذي اثنين من الأقطاب الكهربائية هي على أعلى وأسفل الأنبوب ويتم تحميل العينة في كامل ثم مختومة على electroporation (الشكل 1). وعلى النقيض من ذلك، في كوفيت التقليدية، والأقطاب الكهربائية على الجانبين والعينة ليست مختومة تماما خلال electroporation. هذا التصميم الجديد يقلل من توليد فقاعة الهواء ويضغط حجم فقاعة الهواء، مما يحسن بالتالي توزيع حتى من الجهد الكهربائي،ونتيجة لذلك يؤدي إلى انخفاض خلية الموت وارتفاع كفاءة ترانسفيكشن 9. في العمل الحالي، معدلات عالية من الناتج الأدنى (15 في المائة إلى 37 في المائة) وتحققت استهداف EGFR، Mybpc3 وHBB الجينات في iPSCs الإنسان. وتتسق هذه النتائج مع تقرير سابق تحقق فيه ارتفاع معدلات الإصابة بالإصابة بالسرطان في الخلايا الجذعية البشرية9.
واستهدفت الطفرات المسببة للأمراض في الجينات IL2RG وSPR في خلايا الأرانب. في الآونة الأخيرة، تم إنتاج الأرانب IL2RG-knockout كنماذج لنقص المناعة البشري المرتبط بX (SCID-X1)16،17. ويبين العمل الحالي أن طفرات المريض IL2RG (على سبيل المثال، C231Y و Q235X) يمكن أن تولد بكفاءة في خلايا الأرانب، مما يدل على جدوى إنشاء نماذج الأرانب SCID-X1 تحمل طفرات المريض. وقد ثبت أيضا أن طفرات SPR R150G يمكن إنشاؤها بكفاءة في خلايا الأرانب. هذه الطفرة تسبب العجز في الحركية والمعرفية لدى الأطفال12. هذه IL2RG ونماذج الأرانب طفرة SPR, بمجرد توليدها, قد تكون بمثابة نماذج قيمة قبل السريرية للدراسات الترجمة. ويمكن أيضا أن تستخدم لإنشاء العلاجات القائمة على تحرير الجينات لهذه الأمراض أحادية المنشأ.
أحد الاهتمامات لتطبيقات تحرير الجينات التي يتم بوساطة CRISPR/Cas9 هو أحداث التحرير خارج الهدف. تم تحليل معدلات Indel في المواقع المتوقعة خارج الهدف لsgRNAs المستخدمة في هذه الدراسة (الجدولS1)،وذلك باستخدام الأساليب الموصوفة سابقا9. في المجموع، تم تحليل سبعة المواقع المحتملة خارج الهدف لSG-RB-IL2RG-01، وخمسة لSG-RB-SPR، وسبعة لSG-hEGFR، وخمسة لSG-hMybPC3، وسبعة لSG-HHBB)، وذلك باستخدام التمهيديات المدرجة في الجدول S2. لم يتم الكشف عن أي indels خارج الهدف من قبل الاختبارات T7E1 (الشكلS1)،مما يشير إلى الحد الأدنى من المخاطر خارج الهدف لتحرير الجينات CRISPR/Cas9 بوساطة باستخدام هذه sgRNAs. كما يشير إلى أن طريقة electroporation الأنبوبية نفسها لا تسبب أو تزيد من الإنفـاضات خارج الهدف. ومع ذلك، ينبغي تكريس الجهود للحد من الإنصات غير المرغوب فيها أو القضاء عليها. وقد يكون تسلسل الجينوم الكامل ضروريالاستبعاد مثل هذه الأحداث بالنسبة للخلايا التي يقصد استخدامها في التطبيقات السريرية.
على المستوى التقني، تعتبر العوامل الرئيسية التالية لتحقيق كفاءة تحرير الجينوم الدقيق بواسطة كريسبر/Cas9 RNP أنبوب الكهربائي. أولاً، ينصح باختيار sgRNA فعالة مع توقعات منخفضة خارج الهدف المحتملة. من المهم التحقق من فعالية indel من sgRNA المحددة قبل استخدامه لتطبيقات PEG. ليس من النادر أن برنامج تنبأ SgRNA جيدة فشل في خطوة التحقق من الصحة.
ثانيا، لتحقيق ارتفاع PGE، فمن المستحسن للحث على طفرة PAM إلى المتبرع ssODN كلما كان ذلك ممكنا. والأساس المنطقي لذلك هو أن إعادة القطع بعد إدماج نموذج المانحين قد تم منعها من ذلك. في بعض الحالات، PGE نفسها يدخل طفرات PAM. في حالات أخرى، من الممكن إدخال طفرات صامتة إلى تسلسل PAM. في حالة عدم إمكانية حدوث طفرة في PAM، ينصح بمحاولة تضمين العديد من الطفرات الصامتة في المتبرع الذي يتوافق مع تسلسل sgRNA.
ثالثا، لا سيما ذات الصلة لTE، من المهم تجنب تشكيل فقاعات الهواء عند نقل الخلايا وخليط RNP إلى أنبوب electroporation. في حين أن تصميم أنبوب TE يقلل بالفعل تشكيل فقاعة الهواء، والتعامل مع دقيق سوف يقلل أكثر وربما حتى إكمال تجنب تشكيل فقاعة الهواء. وهناك دليل اطلاق النار مشكلة للمشاكل المتكررة التي قد تكون واجهتفي تطبيق أنبوب الكهربائي لكريسبر/ Cas9 ribonucleoprotein بوساطة تحرير الجينات الدقيقة في الجدول 2.
في الختام، ثبت هنا أن أنبوب الكهربائي وسيلة فعالة لتسليم كريسبر/ كاس9 RNP وssodns إلى خلايا الثدييات لتحقيق معدلات عالية PGE. قد تسهل تقنية TE الجديدة هذه ومعدل تحرير الجينات الدقيق القوي تطوير تطبيقات تحرير الجينات.
Disclosures
J. C. يعمل في Celetrix LLC، الشركة المصنعة للأنبوب الكهربائي. L.M., L. J., J. S., D.Y., J. z., Y. E.C., and J. X. تعلن عدم وجود مصالح متنافسة.
Acknowledgements
وقد دعمت هذا العمل المعاهد الوطنية للصحة (R21OD023194 إلى JX). استخدم هذا العمل الخدمات الأساسية التي يدعمها مركز النماذج المتقدمة للعلوم الترجمة والعلاجات (CAMTraST) في المركز الطبي لجامعة ميشيغان.
Materials
| Name | Company | Catalog Number | Comments |
| Accutase | STEMCELL Technologies | 792 | Cell detachment solution for human iPSCs, first used in Step 1.1.2. |
| Cas9 Nuclease 3NLS | IDT | 1074182 | Cas9 protein, first used in Step 3.3. |
| DMEM | Thermo Fisher | 11965092 | For cell culture, first used in Step 1.2.3. |
| DPBS | Thermo Fisher | 1708075 | For preparing cell culture, first used in Step 1.2.2. |
| EDTA | Lonza | 51201 | For making lysis buffer, first used in Step 4.1. |
| Electroporation buffer | Celetrix | 13–0104 | The electroporation buffer, first used in Step 3.2. |
| Electroporation tubes | Celetrix | 20 μL: 12–0107; 120 μL: 12–0104 | The electroporation tube, first used in Step 3.4. |
| Electroporator | Celetrix | CTX-1500A LE | The tube electroporation machine, first used in Step 3.5 |
| Fetal bovine serum | Sigma Aldrich | 12003C | For cell culture, first used in Step 1.2.2. |
| Forma CO2 Incubators | Thermo Fisher | Model 370 | For cell culture, first used in Step 1.1. |
| Gel Extraction Kit | Qiagen | 28115 | For gel purification, first used in Step 4.3. |
| Human induced pluripotent stem cells | American Type Culture Collection | ACS-1030 | Human iPSCs, first used in Step 1.1. |
| Matrigel | Corning | 354277 | Artificial extracellular matrix; for precoating cell culture plate, first used in Step 1.1. |
| mTeSR 1 medium | STEMCELL Technologies | 85850 | Feeder-free cell culture medium for human iPSCs, first used in Step 1.1. |
| PCR SV mini | GeneAll | 103-102 | For PCR product purification, first used in Step 4.3. |
| Penicillin-Streptomycin | Thermo Fisher | 15140163 | For preparing cell culture, first used in Step 1.2.2. |
| Phenol-chloroform | Thermo Fisher | 15593031 | For DNA extraction, first used in Step 4.2. |
| Precision gRNA Synthesis Kit | Invitrogen | A29377 | For the generation of full length gRNA (guide RNA), first used in Step 2.4. |
| Proteinase K Solution | Thermo Fisher | AM2548 | For DNA extraction, first used in Step 4.1. |
| Q5 high-fidelity DNA polymerase | NEB | M0491 | For PCR amplification, first used in Step 4.3. |
| Sodium dodecyl sulfate | Sigma Aldrich | L3771 | For making lysis buffer, first used in Step 4.1. |
| TA Cloning Kit | Thermo Fisher | K457502 | For TA clone sequencing, first used in Step 4.4. |
| Tissue Culture Dish (10 cm) | FALCON | 353003 | For cell culture, first used in Step 1.2.3. |
| Tissue Culture Dish (12 well) | FALCON | 353043 | For cell culture, first used in Step 3.7. |
| Tissue Culture Dish (6 cm) | FALCON | 353004 | For cell culture, first used in Step 1.2.2. |
| Tris HCl | Thermo Fisher | BP1757-500 | For making lysis buffer, first used in Step 4.1. |
| Trypsin-EDTA | Thermo Fisher | 25200056 | For cell digestion, first used in Step 1.2. 4. |
| Universal Fit Pipette Tips | Celetrix | 14-0101 | For electroporation, first used in Step 3.4. |
| Y27632 | LC Labs | Y-5301 | The apoptosis inhibotor, first used in Step 1.1.1. |
References
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Mout, R., et al. Direct Cytosolic Delivery of CRISPR/Cas9-Ribonucleoprotein for Efficient Gene Editing. ACS Nano. 11 (3), 2452-2458 (2017).
- Zuris, J. A., et al. Cationic lipid-mediated delivery of proteins enables efficient protein-based genome editing in vitro and in vivo. Nature Biotechnology. 33 (1), 73-80 (2015).
- Miller, J. B., et al. Non-Viral CRISPR/Cas Gene Editing In Vitro and In Vivo Enabled by Synthetic Nanoparticle Co-Delivery of Cas9 mRNA and sgRNA. Angew Chem Int Ed Engl. 56 (4), 1059-1063 (2017).
- Finn, J. D., et al. A Single Administration of CRISPR/Cas9 Lipid Nanoparticles Achieves Robust and Persistent In Vivo Genome Editing. Cell Reports. 22 (9), 2227-2235 (2018).
- Liang, C., et al. Tumor cell-targeted delivery of CRISPR/Cas9 by aptamer-functionalized lipopolymer for therapeutic genome editing of VEGFA in osteosarcoma. Biomaterials. 147, 68-85 (2017).
- Luo, Y. L., et al. Macrophage-Specific in Vivo Gene Editing Using Cationic Lipid-Assisted Polymeric Nanoparticles. ACS Nano. 12 (2), 994-1005 (2018).
- Wang, H. X., et al. Nonviral gene editing via CRISPR/Cas9 delivery by membrane-disruptive and endosomolytic helical polypeptide. Proceedings of the National Academy of Sciences of the United States of America. 115 (19), 4903-4908 (2018).
- Xu, X., et al. Efficient homology-directed gene editing by CRISPR/Cas9 in human stem and primary cells using tube electroporation. Scientific Reports. 8 (1), 11649 (2018).
- Du, F., et al. Beneficial effect of young oocytes for rabbit somatic cell nuclear transfer. Cloning Stem Cells. 11 (1), 131-140 (2009).
- Allenspach, E., Rawlings, D. J., Scharenberg, A. M., Adam, M. P., et al. . GeneReviews(R). , (1993).
- Friedman, J., et al., Adam, M. P., et al. . GeneReviews(R). , (1993).
- Hidaka, N., et al. Most T790M mutations are present on the same EGFR allele as activating mutations in patients with non-small cell lung cancer. Lung Cancer. 108, 75-82 (2017).
- Ma, H., et al. Correction of a pathogenic gene mutation in human embryos. Nature. 548 (7668), 413-419 (2017).
- Vakulskas, C. A., et al. A high-fidelity Cas9 mutant delivered as a ribonucleoprotein complex enables efficient gene editing in human hematopoietic stem and progenitor cells. Nature Medicine. 24 (8), 1216-1224 (2018).
- Song, J., et al. Bacterial and Pneumocystis Infections in the Lungs of Gene-Knockout Rabbits with Severe Combined Immunodeficiency. Frontiers in Immunology. 9, 429 (2018).
- Song, J., et al. Production of immunodeficient rabbits by multiplex embryo transfer and multiplex gene targeting. Scientific Reports. 7 (1), 12202 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved