Method Article
زرع الذرية القشرية الهندسية كيميائياً في عقول الفئران المبكرة بعد الولادة
In This Article
Summary
هنا نقدم بروتوكول، مصممة لاستخدام الأدوات الكيميائية الوراثية للتعامل مع نشاط الذرية القشرية بين الخلايا العصبية المزروعة في قشرة الفئران في وقت مبكر بعد الولادة.
Abstract
يتم تنظيم تطوير الخلايا العصبية من خلال مزيج معقد من العوامل البيئية والوراثية. تقييم المساهمة النسبية لكل مكون مهمة معقدة، والتي من الصعب بشكل خاص فيما يتعلق بتطوير حمض غاما أمينوبوتيريك (غابا) الخلايا القشرية التحسسية (CIs). CIs هي الخلايا العصبية المثبطة الرئيسية في القشرة الدماغية، وأنها تلعب أدوارا رئيسية في الشبكات العصبية، من خلال تنظيم كل من نشاط الخلايا العصبية الهرمية الفردية، فضلا عن السلوك المذبذب للفرق العصبية. وهي تتولد في هياكل جنينية عابرة (الوسائط المتوسطة والعقدية الصدغية - MGE وCGE) التي يصعب جداً استهدافها بكفاءة باستخدامها في نُهُج التهريج الرحمي. يهاجر الذريون بين الخلايا العصبية لمسافات طويلة أثناء النمو الجنيني الطبيعي، قبل أن يندمجوا في الدائرة القشرية. هذه القدرة الرائعة على تفريق والاندماج في شبكة النامية يمكن أن اختطفت عن طريق زرع السلائف بين الخلايا العصبية الجنينية في القشرية المضيفة في وقت مبكر بعد الولادة. هنا، نقدم بروتوكول يسمح بالتعديل الجيني للذرية بين الخلايا العصبية الجنينية باستخدام الكهربة البؤرية في الجسم الحي. ثم يتم زرع هذه السلائف بين الخلايا العصبية المهندسة في القشرية المضيفة في وقت مبكر بعد الولادة، حيث أنها سوف تنضج في CIs يمكن التعرف عليها بسهولة. يسمح هذا البروتوكول باستخدام أدوات متعددة مشفرة وراثيا، أو القدرة على تنظيم التعبير عن جينات محددة في الذرية بين الخلايا العصبية، من أجل التحقيق في تأثير المتغيرات الوراثية أو البيئية على النضج و دمج CIs.
Introduction
وظيفة الشبكات العصبية تعتمد في وجود تكملة متوازنة من الخلايا العصبية الإسقاط المحفزة والخلايا العصبية المثبطة. على الرغم من أن الخلايا العصبية القشرية (CIs) تمثل فقط 20٪ من جميع الخلايا العصبية في القشريات الثدييات، ويعتقد أن العجز في عددها أو وظيفتها تلعب دورا رئيسيا في مسببات الأمراض من اضطرابات النمو العصبي1،2. دراسة تطوير CI هو التحدي لأن يتم إنشاء CIs في الهياكل الجنينية العابرة التي يصعب الوصول إليها، وأنها تتبع هجرة عرضية طويلة قبل أن تصل إلى باليوم وتطوير ناضجة التشريحية والفسيولوجية 3. ومن المعروف أن الآليات الوراثية والبيئية على حد سواء التي تنظم تطوير CI4، ولكن ثبت أنه من الصعب دراسة المساهمة النسبية لعوامل متعددة.
تم الحصول على العديد من الأفكار في تطوير CI باستخدام أنظمة الثقافة في المختبر بعد عزل الذرية من البروز العقدية5،6. واحدة من المزايا الكبيرة لهذه الأساليب هي القدرة على تسمية وتعديل وراثيا الذرية المعزولة واتباع تمايزها بالتفصيل، للكشف عن التغيرات الخلية المستقلة. ومع ذلك، هذه الطرق غير قادرة على تقديم معلومات بشأن التفاعلات بين الخلايا العصبية النامية وشبكة نشطة. لقد قمنا بتكييف هذه البروتوكولات، عن طريق زرع السلائف المعدلة في القشرة المبكرة بعد الولادة. الذرية بين الخلايا العصبية معزولة عن البروزات العقدية الجنينية قادرة على البقاء على قيد الحياة، تفريق والاندماج في الشبكة المضيفة عند زرع في القشرة7،8. وقد استخدمت هذه الطريقة للحد من شدة النوبات الصرعية في نماذج الماوس الوراثية، واقترح كعلاج جديد ممكن لمختلف اضطرابات النمو العصبي9،10. يصف بروتوكول سابق إجراء لتبديل هذه السلائف مع ناقلات الفيروسية قبل زرع11. البروتوكول الذي نصفه هنا يسمح أيضا التعديل الجيني للخلايا العصبية البينية، ولكن لا يتطلب إنشاء ناقلات الفيروسية، التي تتطلب فقط الحمض النووي بلازميد، مما يزيد كثيرا من مرونته. وأفادت بعض الدراسات النجاح في استخدام في الكهربائي الرحم لتعديل وراثيا الذرية بين الخلايا العصبية في سماحة العقدية الكليلة (CGE)12, ولكن هذه الطريقة قد ثبت من الصعب جدا أن تتكاثر.
في قسم النتائج التمثيلية، نقوم بتوضيح استخدام هذه الطريقة للتعبير عن مستقبلات المصمم التي يتم تنشيطها حصريًا من قبل أدوية المصمم (DREADDs13)في CIs المزروعة، وهي طريقة استخدمناها في منشور حديث14. عبرنا عن hM3D (Gq)، مستقبلات هندسية على أساس مستقبلات الكولين الإنسان CHRM3، والتي لا تؤثر على وظيفة الخلايا العصبية إلا إذا كان يربط لها كلوزابين-N-أكسيد (CNO). إدارة CNO بشكل انتقائي مشغلات تنشيط hM3D (Gq) التعبير عن الخلايا. استخدمنا هذه الطريقة لإظهار أن الخلية المستقلة وعابرة إزالة الاستقطاب يكفي لمنع المبرمج من CIs أثناء التنمية14. جنبا إلى جنب مع أدوات مختلفة مشفرة وراثيا، وهذا البروتوكول لديه القدرة على أعلى أو أسفل تنظيم التعبير الجيني، وتصور أو التلاعب نشاط الخلية خلال مراحل مختلفة من التمايز بين الخلايا العصبية.
Protocol
وتربب الحيوانات وتؤوي وفقا لقانون المملكة المتحدة للالحيوانات (الإجراءات العلمية) (1986).
ملاحظة: لتوليد pCAGGs-hM3D (Gq)-IRES-RFP بناء، تم عزل جزء SalI-StuI، التي تحتوي على تسلسل hM3D(Gq)، من بلازميد 50463 (أدجين)، وإدراجها في التعبير ناقلات pGS-RFP (هدية من F. Guillemot) هضمها مع F. Guillemot) هضمها مع F. Guillemot) (زهوي إيكورف)
1. إعداد الشرائح القشرية الجنين الماوس
- تعقيم معدات المختبر (على سبيل المثال، المجاهر ستيريو) والأسطح (على سبيل المثال، مقاعد) مع المذيبات المنظفات المناسبة و70٪ الإيثانول (EtOH) الحل في الماء (H2O).
- استخدام أدوات تشريح التي تم autoclaved والاحتفاظ بها في كل وقت في EtOH 100٪.
- إعداد ثلاثة aliquots 20 مل من 4٪ منخفضة الهلام درجة الحرارة أغاروز في 1X الفوسفات العازلة الحل (PBS)، في أنابيب 50 مل، والحفاظ عليها في 55 درجة مئوية.
- التضحية بالفئران الحامل عن طريق خلع عنق الرحم في 13.5 أو 14.5 يوما من الحمل (اليوم الجنيني E13.5-E14.5).
- مع زوج من مقص تشريح، فتح بطن الفئران الحوامل، وإزالة قرون الرحم (مع الأجنة) ووضعهافي حل كريبس الجليد الباردة (الجدول 1)، في طبق بيتري 90 ملم.
- مع زوج من الملقط غرامة الطالب على التوالي، وفتح الحاص السلوي، وإزالة الأجنة ونقلها في حل كريبس الجليد الباردة الطازجة، في طبق بيتري 90 ملم جديدة. تشريح الدماغ الجنين الماوس (الدماغ الأمامي، منتصف الدماغ، الدماغ الخلفي) من بقية جسم الجنين.
- عقد العقول تشريح من الدماغ الخلفي، ونقلها في حل كريبس الجليد الباردة في طبق بيتري 90 ملم جديدة، وإبقائها على الجليد.
- مع قلم مقاوم للماء، رسم خط مستقيم في السطح الخارجي، في الجزء السفلي من الجزء السفلي من ستة أطباق بيتري 35 ملم.
- وضع واحد 4٪ منخفضة الهلام أغاروز / PBS 20 مل aliquot في 37 درجة مئوية لمدة 5 دقائق.
ملاحظة: يجب أن تواجه المصابيح الشمية إلى أسفل (الجزء السفلي من طبق بيتري). تضمين 3-4 العقول في طبق بيتري، محاذاة لهم في خط مستقيم رسمها سابقا. اترك مساحة 3-5 مم بين كل عقلين. - كرر الخطوتين 1.8 و 1.9 حتى يتم تضمين كافة العقول التي تم تشريحها.
- وضع العقول جزءا لا يتجزأ من 4 درجة مئوية، من أجل أجاروز لتقوية، ونحت في وقت لاحق العقول الثلاثة في كتلة واحدة من الحجم المناسب والتوجه.
ملاحظة: ترك ما يقرب من 3 ملم حول حواف عينات الدماغ. تغيير اتجاه العقول، مع المصابيح الشمية على القمة. - الغراء كتلة على سطح قاعدة microtome واستخدام شفرة الجراحية قطع على طول الطريق من خلال الجزء السفلي من الكتلة، بين كل اثنين من العقول، من أجل إنشاء 3 كتل مستقلة (كل كتلة صغيرة تحتوي على دماغ واحد).
- قسم الكتل، في حل كريبس الجليد الباردة، إلى شرائح سميكة 250 ميكرومتر، وذلك باستخدام ميكروتومي شفرة تهتز.
- مع ملعقة صغيرة مسطحة منتهية المسطحة جمع فقط شرائح تحتوي على المبدية أو الصدغية (MGE أو CGE; الشكل 1) ونقلها بشكل فردي على أغشية التصفية (قطر 13 ميكرومتر، حجم المسام 8.0 ميكرومتر)، العائمة على الحد الأدنى من المتوسط الأساسي (MEM، الجدول1) في أطباق زراعة الجهاز مركز البوليستيرين (60 مم × 15 مم).
- وضع الأطباق في حاضنة زراعة الأنسجة CO 2، في 37 درجة مئوية، لمدة 1 ساعة، والاستعداد للكهرباء البؤرية.
2. حاد الدماغ شريحة الكهربائي
- قبل البدء في إجراء الكهرباء، إعداد 50 مل من هلام أغاروز 1٪ في طبق بيتري 100 ملم. اترك جل الأجروز لتقوية في درجة حرارة الغرفة (RT) لمدة 30 دقيقة تقريبًا.
- إعداد أعمدة أغاروز صغيرة (قطر هاجروز 1 مم وطول 10 مم)، لكمة مع ماصة زجاجية (طول 225 ملم؛ 2 مل قدرة) ونقلها في حلول كريبس الجليد الباردة.
ملاحظة: يتم إرفاق لمبة قطرات المطاط مناسبة لمصاة 2 مل إلى ماصة، وعن طريق الضغط عليه يمكن تحرير العمود من الماصة الزجاجية إلى حل كريبس. - مع شفرة جراحية، وقطع كتل الأجاروز الصغيرة من حجمين: واحد صغير من شأنها أن تناسب على سطح القطب الكهربائي (انظر أدناه) وأكبر واحد، والتي سيتم استخدامها كقاعدة لأداء حقن الحمض النووي البؤري في شرائح الدماغ. نقل كتل أغاروز في الجليد الباردة كريبس الحل كذلك.
- إعداد الإعداد للحقن البؤرية والكهرباء الحادة (الشكل2).
ملاحظة: للحقن، وهناك حاجة إلى المعدات التالية: 1) مشرق حقل تشريح مجهر ستيريو، 2) وهومأ مضخة بيكو حاقن، 3) ميكرومنبولاتور، 4) موقف المغناطيسي، و 5) لوحة قاعدة الصلب. لالكهربائي شريحة حادة، وهناك حاجة إلى المعدات التالية: 1) واحد البلاتين مربع 10 مم بيتري طبق القطب، 2) واحد البلاتين مربع 10 مم غطاء الكهربائي، 3) ميكرونيبولاتور، و 4) الكهربائي. -
حقن الحمض النووي البؤري
- إعداد خليط الحمض النووي من ناقلات التعبير: pCAGGs-IRES-GFP (ناقلات التحكم) + pCAGGs-hM3D (Gq)-IRES-RFP، بتركيز 1 ميكروغرام/ميكرولتر لكل متجه وإضافة محلول أخضر سريع (المخزون 25 ملغ/مل) في تخفيف 1/10.
- ملء ميكرومازيت الزجاج المسحوب (قطر داخلي 0.5 مم و1 مم القطر الخارجي) مع 10 ميكرولتر من خليط الحمض النووي وحقن كميات صغيرة (على نطاق 25-50 نل) في المنطقة المختارة (MGE/CGE) من الشريحة (الشكل1 والشكل 2).
-
الكهربة الحادة
ملاحظة: وينبغي أن يتم الكهربة مباشرة بعد حقن الحمض النووي البؤري.- ضع كتلة الأجاروز الصغيرة على قطب طبق بيتري وأرفق عمود الأجاروز بقطب الغطاء المحمول بمساعدة ملعقة صغيرة مسطحة.
- نقل شريحة مع غشاء دعم لها على كتلة أغاروز ووضع القطب العلوي مع عمود أغاروز على رأس المنطقة المختارة (MGE / فريق الخبراء الاستشاري) من شريحة.
ملاحظة: شحن الفولتية من 125 V (نبضتين من 5 مللي ثانية لكل منهما،الفاصل الزمني 500 مللي ثانية) سوف تسفر عن الكهربائي ناجحة (الشكل 3).
- بعد الكهربائي، ضع الشريحة مع غشاء ها دعم في الطبق ونقل الطبق في حاضنة زراعة الأنسجة CO 2، في 37 درجة مئوية.
- بعد 1 ح, تبادل المتوسطة MEM لوسط الأساسية المناسبة للثقافات العصبية الأولية (الخلايا العصبية المتوسطة الأساسية; الجدول1) واحتضان شرائح بين عشية وضحاها، لمدة 18-24 ساعة تقريبا.
3. إعداد الطعوم الخلوية
- تحقق من كفاءة الكهربائي في جميع الشرائح. حدد الشرائح فقط حيث لوحظ عدد مقبولمن الخلايا الفلورية (الشكل 3).
ملاحظة: الكهربائي ما يقرب من 30 شريحة / لكل تجربة من أجل الحصول على العدد المناسب من الخلايا للتطعيم (انظر أدناه). - قم بتشريح المنطقة المختارة (MGE/CGE) من كل شريحة وقطع الأنسجة إلى قطع صغيرة في محلول كريبس البارد ة الثلج، تحت المجهر الاستريو تشريح الفلورسنت.
- وفي الوقت نفسه، وضع أنبوب 1.5 مل مع 900 درجة مئوية الخلايا العصبية الأساسية المتوسطة في حمام مائي في 37 درجة مئوية.
- نقل قطع الأنسجة مع ميكروبيبتور P1000 إلى أنبوب 1.5 مل يحتوي على 500 ميكرولتر من L15/DNase المتوسطة التي أعدت بإضافة 100 ميكرولتر من 1 ملغ / مل DNase الأسهم في DMEM /F12 المتوسطة إلى 900 ميكرولتر من L15 المتوسطة. غسل قطع الأنسجة عن طريق التنصت.
- إضافة 100 درجة مئوية من DNase (الأسهم 1 ملغ / مل في DMEM / F12 المتوسطة) في 900 درجة مئوية الخلايا العصبية الأساسية المتوسطة.
- تجاهل متوسط L15/DNase وإعادة تعليق قطع الأنسجة في 200 ميكرولتر الخلايا العصبية الأساسية / DNase المتوسطة أعدت في الخطوة 3.5.
- تعيين ميكروبيبتور P200 إلى 180 درجة مئوية وفصل ميكانيكيا قطع الأنسجة عن طريق الأنابيب صعودا وهبوطا بلطف، 20-30 مرة، حتى يتم الحصول على تعليق على نحو سلس و "دسم".
- إضافة 200 درجة مئوية من الخلايا العصبية الأساسية / DNase المتوسطة (المجلد الإجمالي النهائي 400 درجة مئوية) وإعادة تعليق.
- خذ 4 ميكرولتر aliquot من الخلايا، وتخفيف بشكل مناسب وجبل على مقياس الهيموميتومتر.
- تحت مجهر حقل مشرق، والتحقق من كفاءة التفكك وحساب عدد من الخلايا.
ملاحظة: إذا كان التفكك ناجحاً، سيتم ملاحظة الخلايا المفردة الساطعة (على قيد الحياة) وليس مجاميع الخلايا. - تعليق الخلايا الطرد المركزي من الخطوة 3.8، في 1000 دورة في الدقيقة، في RT، لمدة 5 دقائق، وبعد ذلك، إزالة supernatant من الأنبوب وإضافة المتوسطة L15/DNase المناسبة (عادة 5-7 ميكرولتر) بحيث يكون التركيز النهائي للخلايا 8 × 105-1.2 × 106 الخلايا / ميكرولتر.
ملاحظة: خلال إعادة تعليق، من المهم للغاية لتجنب فقاعات الهواء. - ضع aliquot الخلية على الجليد ولها وسيلة L15/DNase إضافية للحقن.
4. الحقن داخل الجمجمة
ملاحظة: يتم إجراء الإجراءات التالية في غرفة العمليات داخل مرفق بيت الحيوان. منذ سيتم حقن الخلايا مباشرة إلى الدماغ من الجرو حديثي الولادة دون تعريض الدماغ، يتم الاحتفاظ بظروف العقيم عن طريق تعقيم مساحة العمل مع 70٪ حل EtOH واستخدام الإبر الزجاجية الأوتوكلاف. هناك حاجة إلى المعدات التالية للحقن داخل الجمجمة: 1) مقطع حقل مشرق مجهر ستيريو، 2) حقن ة صغيرة، و 3) وسادة التدفئة لاسترداد الماوس.
- إعداد إبرة زجاجية عن طريق سحب الإبر وفقا لتوصيات الشركة المصنعة. وتستخدم الإبر الزجاجية ذات القطر الخارجي 80 ميكرومتر، وقطرها الداخلي 40 درجة مئوية، وشطبة 30 درجة في هذا البروتوكول.
ملاحظة: كما ذكر أعلاه، يجب أن تكون الإبر الأوتوكلاف قبل الاستخدام. - الردم يدويا الإبرة مع زيت خامل بيولوجيا باستخدام 30 G، 2 إبرة بوصة وحقنة.
- تجميع وإدراج الإبرة إلى وحدة حاقن وفقا لتعليمات الشركة المصنعة.
- تحديد إعدادات الحقن في الحد الأقصى لحجم (69 nL) ومعدل بطيء نسبيا (23 nL /s).
- إفراغ الإبرة حتى يتم تمديد الغطاس بالكامل.
-
املأ الإبرة
- قطع قطعة صغيرة من شريط التطعيم ووضعها تحت حقل مشرق تشريح مجهر ستيريو. مع ميكرومازيت P10، نقل 5 ميكرولتر من العينة (aliquot الخلية) على الشريط، بحيث يتم تشكيل قطرة كروية.
- وضع غيض من الإبرة في العينة وملء الإبرة (الغطاس يتراجع ويرسم العينة معها).
ملاحظة: منذ العينة يجب أن تكون لزجة جدا، وملء الإبرة في خطوات صغيرة بحيث العينة سوف توازن، وبمعدل بطيء يمنع فقاعات من تشكيل. يجب أن تكون العينة على نحو سلس ومتجانس داخل الإبرة. إذا كانت العينة لزجة جدا وليس من الممكن لملء الإبرة، إضافة قدر L15 /DNase المتوسطة كما هو مطلوب للحصول على اللزوجة الصحيحة. ومع ذلك، فإن هذا سيغير تركيز العينة، ومن الناحية المثالية ينبغي تجنبها.
- التخدير الجراء المولودة حديثا (يوم ما بعد الولادة 0-2 [P0-P2]) على الجليد لمدة 2-5 دقائق.
ملاحظة: تأكد من أن الجرو لا يتحرك. - وضع الجرو التخدير تحت حقل مشرق تشريح مجهر ستيريو.
- إجراء 3-4 حقن من 69 نل لكل في كل نصف الكرة الأرضية.
ملاحظة: وتقع مواقع الحقن ما يقرب من 1 ملم الجانبي إلى خط الوسط، وبين 1 ملم caudal إلى bregma و 1 مم rostral إلى الخط بين الأورال. يجب وضع طرف الإبرة حوالي 1 مم عميق على سطح الpial. بعد كل حقن، يتم ترك الإبرة في مكانها لمدة 30 s تقريبًا ويتم سحبها في فترات. - مباشرة بعد الحقن، وضع الجرو على وسادة التدفئة مع التدفئة في أدنى وضع لها (37 درجة مئوية). عندما يتعافى الجرو نقله إلى القفص مع والدته.
ملاحظة: لا تترك الأم بدون جراء في القفص يجب أن يستمر الإجراء بأكمله (من إزالة الجرو من زملائه في القمامة، حتى يتم إرجاعه) أقل من 10 دقائق.
5. كلوسابين-N-أكسيد الحقن
- إعداد ligand DREADD، CNO حل الأوراق المالية عن طريق تخفيف 1 ملغ من CNO في 50 درجة مئوية من كبريتيد ثنائي الميثيل (DMSO) حتى يكون الحل شفافا. تصل إلى 10 مل مع المالحة بحيث يكون التركيز النهائي للCNO 0.1 ملغ/مل.
ملاحظة: DMSO سامة. تجنب استخدامه إلى تركيز أعلى من 0.1٪. استخدم كعنصر تحكم محلول ملحي يحتوي على نفس تركيز DMSO مثل محلول CNO الذي يحتوي على. - من اليوم التالي للولادة 14 ولمدة 3 أيام تأسيسية (P14-P16)، في كل فأر إجراء حقنين داخل الصفاق (I.P.) من CNO (تركيز CNO: 1 ملغ / كغ) أو 0.05٪ DMSO في المالحة، في اليوم الواحد، 12 ساعة بعيدا.
- في اليوم الأخير (P17)، إجراء حقنة واحدة والتضحية الفئران عن طريق خلع عنق الرحم في غضون نافذة زمنية من 30 دقيقة-1 ساعة.
النتائج
باستخدام الإجراء المعروض هنا، اختبرنا ما إذا كان بقاء الخلايا العصبية القشرية خلال مراحل ما بعد الولادة المبكرة ينظمه النشاط بطريقة مستقلة الخلية. قمنا بإجراء 3 تجارب لكهربة شريحة الدماغ (12-16 جنينًا [E14.5 جنينًا] لكل تجربة) مع متجهات التعبير pCAGGs-IRES-GFP (التحكم) وpCAGGs-hM3D(Gq)-IRES-RFP، بتركيز 1 ميكروغرام/ميكرولتر لكل بناء. في تجارب نا [إلكتروبورأيشن], فقط كسر (تقريبا 50%; الشكل 3) من GFP+ الخلايا العصبية شارك في التعبير عن hM3D (Gq) (RFP+) وبالتالي GFP+RFP- السكان بمثابة رقابة داخلية لتأثير ligands DREADD. تم فصل الخلايا العصبية الجنينية القشرية المنقولة ميكانيكيا وتعليق الخلية الناتجة (8 × 105 خلايا / ميكرولتر) المطعمة في قشرة الفئران من النوع البري P0-P1. لقد أجرينا 6 حقن لكل دماغ في كل تجربة، تم حقن ما لا يقل عن 6 جراء مولودجديد. إدارة CNO زيادة انتقائية نشاط RFP المتحولة+ الخلايا، كما يتضح من التعبير عن cFos البروتين المعتمد على النشاط (الشكل4). أدى العلاج CNO وفقا للبروتوكول الموصوف (إدارة مرتين يوميا P14-P17) إلى زيادة في نسبة GFP+RFP+ نسبة إلى GFP+RFP- الخلايا، بالمقارنة مع السيارة (0.5٪ DMSO في المالحة) [100](الشكل 5).
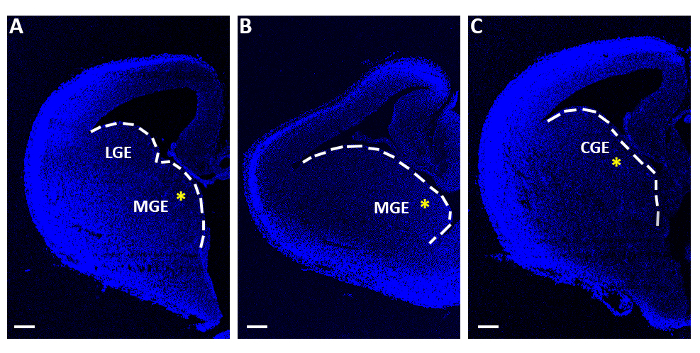
الشكل 1: الشرائح التهلية التمثيلية المستخدمة في تجارب الكهرباء الحادة. (A-C) شرائح Telencephalic التي تم الحصول عليها في ثلاثة مستويات مميزة متتالية rostro-caudal, ملطخة 4′,6-دياميدينو-2-فينيليندول (DAPI). [لج]: [غنلّيكل] جانبيّة سماحة; MGE: سماحة العقدية الوسيطة; [غغّر]: [كدلول] [غنلّيستيك] سماحة. قضبان مقياس = 200 ميكرومتر. تشير العلامات النجمية الصفراء إلى موقع الكهرباء في كل شريحة. الخط الأبيض يمثل حافة سماحة العقدية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
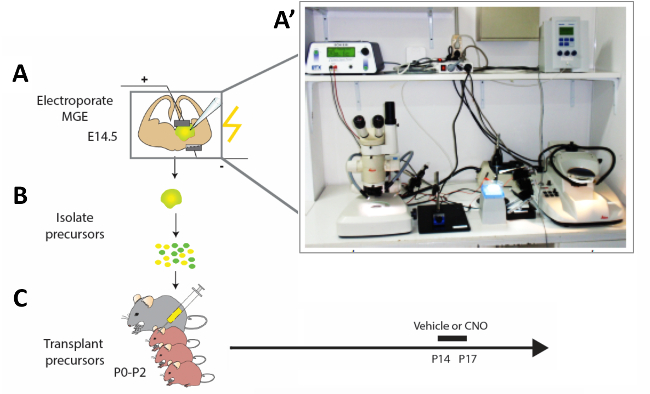
الشكل 2: التمثيل التخطيطي لسير العمل التجريبي. (أ) يتم الكهربائي شرائح الدماغ الماوس مع المنشآت المناسبة، و (B)بعد 12 ح تعديل السلائف بين الخلايا العصبية القشرية (CI) معزولة و (C) زرعها في pallium من الجرو الماوس حديثي الولادة (P0−P2). من أجل تعديل نشاط التهابات الجهاز المركزي غير الناضجة، تم حقن الجراء P14 التي تلقت عمليات زرع الخلايا مع CNO أو مركبة لمدة أربعة أيام تأسيسية وفقا للبروتوكول المقدم. (أ) صورة لشريحة الدماغ الماوس الحاد ة الكهربائي ة الإعداد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
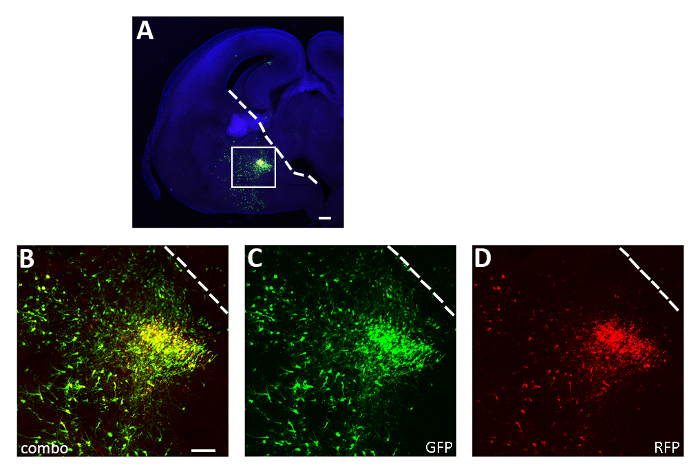
الشكل 3: ممثلة ناجحة حادّة شريحة [إلكتروبورأيشن] تجربة. (أ) قسم الإكليل التمثيلي من الدماغ الجنيني E14.5 الذي تم نقله في فريق الخبراء الاستشاري مع كل من pCAGGs-IRES-GFP (GFP) وpCAGGs-hM3D(Gq)-IRES-RFP (RFP) بلازميدات ومستزرعة لمدة 12 ساعة. وقد تم تلوين هذا القسم مناعي لGFP (A، B، C) وRFP (A، B، D). يتم تكبير المنطقة المربعة في اللوحة A لإظهار التعبير عن كل من الصحفيين الفلورسنت (B) ، GFP (C) وRFP فقط (D). الخط الأبيض يمثل حافة سماحة العقدية. B-D: نفس الصورة، وقنوات مختلفة أو مزيج من قناتين مختلفتين. قضبان المقياس = 200 ميكرومتر (A)، 100 ميكرومتر (B-D). تم تعديل هذا الرقم من Denaxa et al.14. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
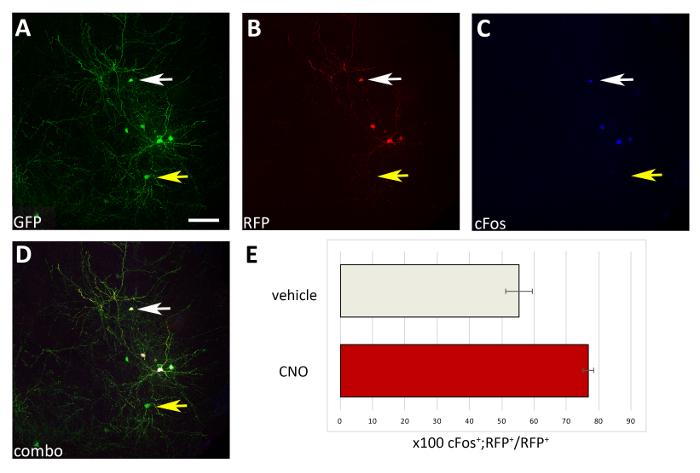
الشكل 4: زيادة الخلية المستقلة في نشاط M3D (Gq) التعبير عن CIs المزروعة على إدارة CNO. (A-D) صور تمثيلية للمقطع الإكليلي من فأر P17 المزروعة في P1 مع السلائف CI المنقولة مع كل من pCAGGs-IRES-GFP (GFP) وpCAGGs-hM3D (Gq)-IRES-RFP (RFP) بلازميدس وتعامل مع CNO. وقد تم هذا القسم مناعي لGFP (A)، RFP (B)، وcFos(C). (د) الصورة مجتمعة من A، B و C المناعية (التحرير والسرد). لاحظ أن CIs فقط المشاركة في التعبير عن كل من بلازميدات (الأسهم البيضاء في A-D) هي أيضا cFos+ مقارنة مع CIs التعبير فقط عن التحكم GFP بلازميد (السهام الصفراء في A-D). (E) القياس الكمي لـ cFos+RFP+ الخلايا الموجودة في pallium من الفئران P17 المزروعة في P1 (تطبيع إلى مجموع RFP+ السكان) وتعامل مع السيارة أو CNO (N = 2). A-D: نفس الصورة، قنوات مختلفة، أو مزيج من القنوات الثلاث المختلفة. قضبان مقياس = 50 درجة.
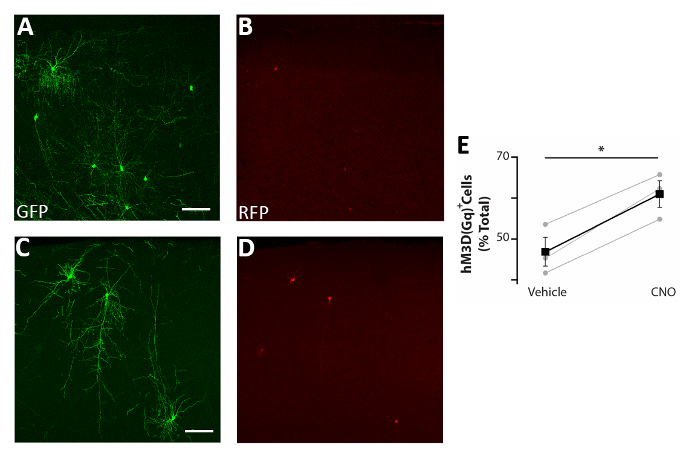
الشكل 5: زيادة الخلية المستقلة في نشاط CIs يعزز البقاء على قيد الحياة . (A-D) صور تمثيلية للشرائح الإكليلية للقشرة الحسية الجسدية من الفئران P17 المزروعة في P0-P2 مع السلائف CI transfected مع كل من pCAGGs-IRES-GFP (GFP) و pCAGGs-hM3D (Gq)-IRES-RFP (RFP) بلازميدات وتعامل مع مركبة(A-B)أو CNO (C-D). (E) القياس الكمي لRFP+ الخلايا الموجودة في الدماغ الأمامي للفئران P17 المزروعة في P0-P2 (تطبيع إلى إجمالي GFP+ السكان). RFP+(مركبة) = 47٪ ± 3٪، CNO = 61٪ ± 3٪، ص = 0.01، الطالب نموذج المقترنة اختبار ر، ن = 3 مركبة و 3 CNO، ما لا يقل عن 150 خلية تحسب في الدماغ. A و B: نفس الصورة، وقنوات مختلفة. C و D: نفس الصورة، وقنوات مختلفة. قضبان مقياس = 50 ميكرومتر. تم تعديل هذا الرقم من Denaxa et al.14. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
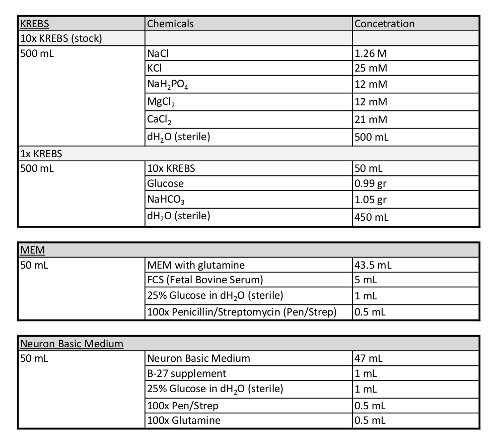
الجدول 1: معلومات إضافية عن الوسائط المستخدمة في هذا البروتوكول.
Discussion
هنا نقوم بوصف منهجية يمكن الوصول إليها على نطاق واسع لتعديل وراثيا نشاط السلائف CI لدراسة تأثير النشاط الجوهري على نضج CI، و / أو تأثير النشاط المغيرC على الجمعية / وظيفة القشرية المتكاملة الدوائر.
في الماضي، العديد من المختبرات، بما في ذلك لنا، قد أجريت في تجارب الكهربائي الرحم من أجل تعديل وراثيا الخلايا العصبية الإسقاط6. ومع ذلك، في الكهرباء الرحم في سماحة العقدية التي تشمل ذرية CI من الصعب جدا، وذلك بسبب مشاكل مسار التوصيل الكهربائي. من أجل حل هذه المشكلة، يقوم عدد قليل من المختبرات بإجراء الحقن الموجهة بالموجات فوق الصوتية تليها الكهربائي، وهي تقنية شاقة تتطلب معدات باهظة الثمن. ويوفر هذا البروتوكول بديلاً لهذه المنهجيات التي يمكن لغالبية الأوساط العلمية الوصول إليها.
أحد الجوانب الأكثر تحديا من هذا البروتوكول هو تعظيم عدد الخلايا التي البقاء على قيد الحياة في القشرة المضيفة إلى مراحل ناضجة، عندما يتم عادة إجراء التحليل phenotypic (تعتمد جدا على تصميم التجربة، ولكن عادة أقدم من P17). هناك ثلاث خطوات رئيسية يجب على المحقق أن تولي اهتماما: (1) كفاءة الكهربائي. ويمكن تعظيم هذا عن طريق ضمان نقاء بلازميدات الحمض النووي. فقط عالية الجودة بلازميدات الحمض النووي (نسبةA 260/ A280 من 1.9-2.0) ينبغي أن تستخدم لهذا الإجراء. نحصل على مثل هذه الاستعدادات عالية الجودة الحمض النووي عن طريق استخدام تنقية الحمض النووي كلوريد السيزيوم. وثمة عامل حاسم آخر هو المروج الذي يدفع إلى التعبير عن جين الاهتمام. وجدنا أن ناقلات pCAGGs, الذي يتكون من الدجاج ب-أكتين المروج, قوية للغاية ويمكن أن تزيد بشكل كبير من كفاءة الكهربائي. (2) عدد الأجنة المانحة الأولية. من المهم التأكد من أن عددا كبيرا (12-16) من الأجنة من نفس المرحلة هي الكهربائي. ويمكن زيادة هذا العدد، إذا كان المزيد من التجارب يقومون بتشريح الأجنة وتشريحها معا، حيث أنه من المهم الحصول على شرائح القشرية الجنينية، والكهربائي ونقلها إلى الحاضنة في أقرب وقت ممكن. (3) من المهم التأكد من أن يتم حقن عدد كبير من الخلايا في كل جرو لضمان فرصة عالية للبقاء على قيد الحياة الخلية المزروعة حتى مراحل ناضجة. وبالإضافة إلى ذلك، فإن هذا سيحسن بشكل كبير من احتمال نجاح عمليات زرع الأعضاء لأن الاستعدادات للخلايا ذات الكثافة المنخفضة ستؤدي إلى خلط غير متساو للخلايا مع الوسط، مما سيؤدي إلى تباين كبير في العقول المزروعة15 .
وقد صُمم البروتوكول الموصوف هنا للتحقيق في دور النشاط في تنظيم بقاء السي آي بطريقة مستقلة عن الخلايا. تم اختيار النافذة الزمنية P14-P17 لأداء حقن CNO على وجه التحديد وفقا للبيانات المنشورة، والتي تبين أن ذروة موت الخلايا CELL CELL cell s المزروعة يحدث خلال هذه الفترة16. ولذلك، فإن هذا الإطار الزمني أو تواتر حقن CNO قد لا ينطبق على أنواع الخلايا الأخرى أو مناطق الدماغ، ويجب على المحقق ضبط هذه المعلمات وفقا للأغراض التجريبية المحددة. وأخيراً، فإن المنهجية الموصوفة هنا للحقن داخل الجمجمة من CIs غير ممكنة إلا للجراء P0-P5 (اعتماداً أيضاً على خلفية خط الماوس). من حيث المبدأ، فإن أي حقن أكثر من P5 تتطلب ترقق أو إزالة الجمجمة15.
وتتمثل إحدى المزايا الرئيسية لهذا البروتوكول في القدرة على استخدام أدوات جديدة مرمزة وراثياً لتصور أو التلاعب بنشاط الـ CIs خلال مراحل مختلفة من التمايز أثناء اندماجها في شبكة نامية. مع وتيرة اكتشاف أجهزة استشعار جديدة للجهد وأجهزة استشعار الكالسيوم المشفرة وراثياً، فضلاً عن أدوات جديدة للجينات الكيميائية والوراثية البصرية، يسمح هذا البروتوكول للباحثين باستخدامها في غضون أسابيع من إطلاقها في مستودعات بلازميد، مثل أدجين.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وقد تم دعم هذا العمل من خلال منحة كاتب ERC (282047)، وجائزة ويلكوم للمحققين الاستئمانيين (095589/Z/11/Z)، ومنحة FP7 EC DESIRE، وجائزة معهد ليستر إلى JB. ويدعم العمل في مختبر V.P. من قبل BBSRC (BB/L022974/1)، ومجلس البحوث الطبية في المملكة المتحدة (MRC)، ومعهد فرانسيس كريك (الذي يتلقى التمويل من MRC، أبحاث السرطان في المملكة المتحدة، وصندوق ويلكوم الاستئماني). وقد أمكن إجراء البحوث في مختبر M.D. من خلال منحة من مؤسسة ستافروس نيارخوس إلى B.S.R.C. "Alexander Fleming"، كجزء من مبادرة المؤسسة لدعم البحوث اليونانية.
Materials
| Name | Company | Catalog Number | Comments |
| Medium/Supplements | |||
| B-27 | GIBCO (ThermoFisher Scientific) | 175040-044 | |
| DMEM/F12 | GIBCO (ThermoFisher Scientific) | 21331-020 | |
| DNAse | SIGMA | DN15-100MG | |
| FBS | GIBCO (ThermoFisher Scientific) | 10270-098 | |
| 100x Glutamine | GIBCO (ThermoFisher Scientific) | 35050-061 | |
| L15 | GIBCO (ThermoFisher Scientific) | 11415-049 | |
| MEM alpha, GlutaMAX | GIBCO (ThermoFisher Scientific) | 32561-029 | |
| Neurobasal medium | GIBCO (ThermoFisher Scientific) | 21103-049 | Neuron basic medium |
| 100x P/S | GIBCO (ThermoFisher Scientific) | 15140-122 | |
| Equipment | |||
| Electroporator | BTX | ECM 830 generator | |
| Injector for acute slice electroporation | Eppendorf | FemtoJet Microinjector | |
| Injector for cell transplantation (I) | Visual Sonics | Vevo Injector System | |
| Injector for cell transplantation (II) | WPI | NANOLITER2010 | |
| Magnetic Stand | WPI | M10L Magnetic Stand | |
| Kite Manual Micromanipulator | WPI | KITE-M3-R | |
| Platinum Elecrode (I) | Protech International Inc. | CUY-700-1 | |
| Platinum Elecrode (II) | Protech International Inc. | CUY-700-2 | |
| Steel Base Plate | WPI | 5479 | |
| Vibratome | Leica | VT1200S | |
| Other Material | |||
| Glass capillaries for electroporation | VWR | 1B100-4 | |
| Glass capillaries for cell transplantation | Visual Sonics | provided by Visual Sonics | |
| Nuclepore 8 µm whatman membrane | SLS | 110414 | |
| Organ tissue culture dishes | BD Biosciences (Falcon) | 353037 |
References
- Marin, O. Interneuron dysfunction in psychiatric disorders. Nature Review Neuroscience. 13 (2), 107-120 (2012).
- Glausier, J. R., Lewis, D. A. GABA and schizophrenia: Where we stand and where we need to go. Schizophrenia Research. 181, 2-3 (2017).
- Fishell, G., Rudy, B. Mechanisms of inhibition within the telencephalon: "where the wild things are". Annual Review Neuroscience. 34, 535-567 (2011).
- Wamsley, B., Fishell, G. Genetic and activity-dependent mechanisms underlying interneuron diversity. Nature Review Neuroscience. 18 (5), 299-309 (2017).
- Xu, Q., Cobos, I., De La Cruz, E., Rubenstein, J. L., Anderson, S. A. Origins of cortical interneuron subtypes. Journal of Neuroscience. 24 (11), 2612-2622 (2004).
- Denaxa, M., et al. Maturation-promoting activity of SATB1 in MGE-derived cortical interneurons. Cell Reports. 2 (5), 1351-1362 (2012).
- Wichterle, H., Garcia-Verdugo, J. M., Herrera, D. G., Alvarez-Buylla, A. Young neurons from medial ganglionic eminence disperse in adult and embryonic brain. Nature Neuroscience. 2 (5), 461-466 (1999).
- Alvarez-Dolado, M., et al. Cortical inhibition modified by embryonic neural precursors grafted into the postnatal brain. Journal of Neuroscience. 26 (28), 7380-7389 (2006).
- Baraban, S. C., et al. Reduction of seizures by transplantation of cortical GABAergic interneuron precursors into Kv1.1 mutant mice. Proccedings of the National Academy of Sciences of the United States of America. 106 (36), 15472-15477 (2009).
- Southwell, D. G., et al. Interneurons from embryonic development to cell-based therapy. Science. 344 (6180), 1240622 (2014).
- Vogt, D., et al. Viral-mediated Labeling and Transplantation of Medial Ganglionic Eminence (MGE) Cells for In Vivo Studies. Journal of Visualized Experiments. (98), e52740 (2015).
- De Marco Garcia, N. V., Karayannis, T., Fishell, G. Neuronal activity is required for the development of specific cortical interneuron subtypes. Nature. 472 (7343), 351-355 (2011).
- Urban, D. J., Roth, B. L. DREADDs (designer receptors exclusively activated by designer drugs): chemogenetic tools with therapeutic utility. Annual Review of Pharmacology and Toxicology. 55, 399-417 (2015).
- Denaxa, M., et al. Modulation of Apoptosis Controls Inhibitory Interneuron Number in the Cortex. Cell Reports. 22 (7), 1710-1721 (2018).
- Quatrocolo, G., et al. Homochronic Transplatation of Interneuron Precursors into Early Postnatal Mouse Brains. Journal of Visualized Experiments. (136), e57723 (2018).
- Southwell, D. G., et al. Intrinsically determined cell death of developning cortical interneurons. Nature. 491 (7422), 103-113 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved