A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
القياس الكمي لثلاثه آفات الحمض النووي عن طريق قياس الطيف الكتلي وتقييم مستوياتها في انسجه الفئران المعرضة للجسيمات الدقيقة المحيطة
* These authors contributed equally
In This Article
Summary
ونحن هنا وصف طرق لتحديد الكمية الحساسة ودقيقه من آلافات 8-oxo-7 ، 8-ديهيدرو-2'غوانوسين (8-oxodGuo) ، 1 ،ن6-ايثينو-2 '-ديوكسينونونوسين (1 ،ن6-dado) و 1 ،n- غوانوسين (1,N2-DGUO) في الحمض النووي. وقد طبقت الطرق علي تقييم اثار الجسيمات الدقيقة المحيطة (PM2.5) في الانسجه (الرئة والكبد والكلي) من الفئران المكشوفة A/J.
Abstract
الحمض النووي والأحماض النووية المؤكسدة هي أمثله من آفات الحمض النووي التي هي مفيده العلامات الحيوية لتقييم السمية من المواد التي هي الكتروفيريك ، توليد الكهربائية رد الفعل علي التحول الإحيائي ، أو الحث علي الاكسده. من بين النيوبيواسات المؤكسدة ، والأكثر دراسة واحد هو 8-oxo-7 ، 8-ديهيدروجوانيني (8-oxoGua) أو 8-اوكسو-7 ، 8-ديهيدرو-2 '-غوانوسين (8-oxodGuo) ، وهو البيولوجية من الضرر قاعده المستحثة بشكل مؤكسد في الحمض النووي. الديهيديس و ابكسييلديهيديس الناتجة عن عمليه الاكسده الدهنية هي جزيئات كهربية قادره علي تشكيل أنابيب الحمض النووي المتحولة وراثيا ، مثل القناات etheno 1 ،n2-etheno-2'-غوانوسين (1 ،n2- εdGuo) و 1,n6-ايثينو-2 '-ديوكسينونوسين (1,ن6-εdado), التي تم اقتراحها كمؤشرات الحيوية المحتملة في الفيزيولوجيا المرضية للالتهاب. والأساليب الانتقائية والحساسة لقياسها في الحمض النووي ضرورية لوضع استراتيجيات وقائية لإبطاء معدلات طفرة الخلايا وتطور الامراض المزمنة (مثل السرطان والامراض التنكسية العصبية). ومن بين الطرق الحساسة المتاحة للكشف عنها (اللوني السائل عاليه الأداء إلى جانب كاشفات الطيف الكهروكيميائية أو ترادفية ، فحص المذنب ، اختبارات المناعة ، 32P-التسميات البريدية) ، والأكثر انتقائية هي تلك التي تستند علي اللوني السائل عالي الأداء إلى جانب الطيف الكتلي الترادفي (HPLC-ESI-MS/MS). الانتقائية هي ميزه أساسيه عند تحليل العينات البيولوجية المعقدة و HPLC-ESI-MS/MS تطورت كمعيار الذهب للقياس الكمي من النيونوسيدس المعدلة في المصفوفات البيولوجية ، مثل الحمض النووي والبول والبلازما واللعاب. ويضيف استخدام المعايير الداخلية المسمية بالنظائر ميزه التصحيحات المتعلقة بخسائر الجزيئات اثناء التحلل بالحمض النووي والخطوات التحليلية للتحليل ، فضلا عن الاختلافات في التاين التحليلي بين العينات. كما انه يساعد في تحديد ذروه الكروماتوغرافي الصحيحة عند وجود أكثر من ذروه واحده.
نقدم هنا التحقق من صحة حساسة ودقيقه ودقيقه HPLC-ESI-MS/MS الأساليب التي تم تطبيقها بنجاح لتحديد الكمية من 8-oxodGuo ، 1 ،ن6-dado و 1 ،n2-dado في الرئة والكبد والكلي الحمض النووي للفئران A/J تقييم اثار التعرض المحيطة PM2.5 .
Introduction
بعض أنواع الأكسجين التفاعلية (ROS) قادره علي أكسده الروابط المزدوجة الكربون من قواعد الحمض النووي وبعض الكربونات في moiety ديوكسيريبوز ، وتوليد القواعد المؤكسدة وفواصل حبلا الحمض النووي1. كجزيء مشحونة سلبا الغنية في ذرات النيتروجين والأكسجين ، والحمض النووي هو أيضا هدف للمجموعات الكهربائية التي تتفاعل بشكل تساهميا مع المواقع النونويه (النيتروجين والأكسجين) ، وإعطاء المنتجات التي تسمي الحمض النووي القناات2. لذلك ، الحمض النووي الأنابيب والأحماض النووية المؤكسدة هي أمثله من آفات الحمض النووي التي هي مفيده العلامات الحيوية لتقييم السمية من المواد التي هي الكتروفيريك ، توليد الكهربائية رد الفعل علي التحول الإحيائي ، أو الحث علي الاكسده1، 2- علي الرغم من ان قواعد الحمض النووي المعدلة يمكن ازالتها من الحمض النووي عن طريق إصلاح الاستئصال القاعدي أو النوكليوتيد (BER أو NER) ، فان التحريض علي عدم التوازن بين توليد وأزاله آفات الحمض النووي لصالح السابق يؤدي إلى زيادة صافيه في مستوياتها في العمل الإضافي للحمض النووي3 < /c5 >. النتائج هي زيادة معدلات طفرة الحمض النووي ، وانخفاض التعبير الجيني ، وتقلص النشاط البروتين2،4،5،6،7، والآثار التي ترتبط ارتباطا وثيقا تطور الامراض. قد تؤثر طفرات الحمض النووي علي وظائف خلوية متنوعة ، مثل إشارات الخلايا ، ودوره الخلايا ، وسلامه الجينوم ، واستقرار التيتيمير ، والنعوت ، وهيكل الكروماتين ، والربط الريبي ، وتوازن البروتين ، والأيض ، والخلايا المبرمجة ، وتمايز الخلية8 ،9. استراتيجيات لإبطاء معدلات الطفرة الخلية وتطوير الامراض المزمنة (مثل السرطان, امراض الأعصاب) تمر من خلال معرفه مصادر الطفرة, من بينها, آفات الحمض النووي وأسبابها.
ومن الأسباب الهامه للضرر الجزيء ، بما في ذلك الحمض النووي وتلف الدهون ، الاصابه بالامراض المزمنة بسبب التعرض للتلوث ، والتهابالمستمر ، والمرض الباثولوجي المرضي (مثل مرض السكري) ، وما إلى ذلك. وعلي سبيل المثال ، فان الراديكالية الهيدروكسيل عاليه التفاعل (OH) شكلت من H2O2 الحد من خلال الانتقال أيونات المعادن (Fe2 +، Cu +) أكسده قواعد الحمض النووي ، والحمض النووي السكر شارده والأحماض الدهنية غير المشبعة في السيطرة علي انتشار معدلات10. من بين 80 التي تتميز بالفعل النيوبواسات المؤكسدة3، والأكثر دراسة واحد هو 8-oxo-7 ، 8-ديهيدروجوانيني (8-oxoGua) أو 8-oxo-7 ، 8-ديهيدرو-2'غوانوسين (8-oxodGuo ، الشكل 1) ، وهي آلافه التي هي قادره علي الحث GT transversions خلايا الثدييات10،11. يتم تشكيلها من قبل أحاديه الاكسده الكترونيه من الغوانين ، أو بواسطة الهيدروكسيل الراديكالية أو الهجوم الأكسجين قميص من الغوانين في الحمض النووي1. الأحماض الدهنية غير المشبعة هي الأهداف الهامه الأخرى للاكسده عاليه التفاعل, مثل •آوه, التي تبدا عمليه الاكسده الدهنية1,12. فانه يعطي ارتفاعا إلى أكاسيد الهيدروجين الأحماض الدهنية التي قد تتحلل لالالديهيدات الكهربائية و ابكسييلديهيديس, مثل مالونوديهايد, 4-هيدروكسي-2-نونينال, 2, 4-ديكادينال, 4, 5-الايبوكسي-(2ه)-ديسينال, hexenal, اكرولاين, كروتونالديهيد, وهي قادره علي تشكيل مغيرات الحمض النووي المبيدات الوراثية ، مثل مالونوديهايد-، propano-، أو etheno ادوكتس1،12،13. القناات etheno 1,n2-etheno-2 '-غوانوسين (1,n2-εdguo, الشكل 1) و 1,n6-ايثينو-2 '-ديوكسينونوسين (1,ن6-εdado, الشكل 1 ) وقد اقترح كالمؤشرات الحيوية المحتملة في الفيزيولوجيا المرضية للالتهاب14،15.
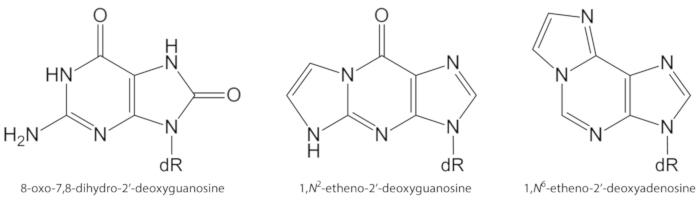
الشكل 1 الهياكل الكيميائية للآفات الحمض النووي الكمية في هذه الدراسة. الدكتور = 2 ' ديوكسيريبوز. وقد تم تعديل هذا الرقم من اوليفيرا وآخرون34. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
سمحت الدراسات التي أجريت في أوائل الثمانينات بالكشف الحساس ل 8-oxodGuo بواسطة اللوني السائل عالي الأداء إلى جانب الكشف الكهروكيميائي (HPLC-نماء الطفولة المبكرة). القياس الكمي من 8-oxodguo بواسطة hplc-النماء في الطفولة الباكرة في العديد من النظم البيولوجية التي خضعت لظروف مؤكسده أدت إلى الاعتراف 8-oxodguo كمؤشر حيوي من الضرر قاعده المستحثة بالاكسده في الحمض النووي1,16. علي الرغم من ان قويه والسماح للقياس الكمي من 8-oxodGuo في نطاق fmol منخفضه17, قياسات hplc-النماء في مرحله الطفولة المتوسطة تعتمد علي دقه الوقت الاحتفاظ التحليلية لتحديد التحليل وعلي القرار اللوني لتجنب التدخلات من مكونات عينه أخرى. كما يتطلب الكشف الكهروكيميائية استخدام الملح (علي سبيل المثال ، فوسفات البوتاسيوم ، خلات الصوديوم) في المرحلة المتنقلة ، والحفاظ علي الظروف التحليلية المناسبة يحتاج العمود الروتيني والمعدات وقت التنظيف.
بدلا من ذلك ، فان استخدام الحمض النووي البكتيرية إصلاح الانزيم الحمض النووي الجليكوسيلاسي (fpg) و ، بعد ذلك ، الإنسان 8-oxoguanine جليكوسيلاسي 1 (hOGG1) ، للكشف عن وأزاله 8-oxogua من الحمض النووي ، برزت كوسيلة لتحريض الحمض النووي القلوي عطوب مواقع. يتم تحويل المواقع القلوية عطوب إلى فواصل حبلا الحمض النووي والسماح للقياس الدقيق غير المباشر عاليه جدا من 8-oxogua القلوية خليه واحده هلام الكهربائي ("فحص المذنب"). الحساسية العالية وإنجاز التحاليل دون الحاجة إلى استخراج الحمض النووي الخلوي هي المزايا الرئيسية لهذا النوع من الفحص. فانه يعطي ادني مستويات الحالة الثابتة من 8-oxoGua في الحمض النووي ، عاده 7-10 مرات اقل من المستويات التي تم الحصول عليها من قبل الأساليب التحليلية الحيوية علي أساس HPLC. ومع ذلك ، فمن قياس غير مباشر من 8-oxogua وبعض العيوب هي عدم وجود خصوصية أو الكفاءة غير معروفه لانزيمات الإصلاح المستخدمة1،16،18.
اختبارات المناعية هي مجموعه أخرى من الأساليب المستخدمة للكشف عن 8-oxoGua1 و adducts الحمض النووي exocyclic, مثل 1,n6-dado و 1,n2-dado12. علي الرغم من الحساسية ، والقصور في استخدام الأجسام المضادة للكشف عن آفات الحمض النووي هو عدم وجود خصوصية بسبب التفاعل التبادلي إلى مكونات أخرى من العينات البيولوجية ، بما في ذلك قواعد الحمض النووي الطبيعي1،12. ويمكن أيضا الكشف عن الحمض النووي المبيدات ، بما في ذلك 1 ،n6-Dado و 1 ،n2-dado ، وتحديدها كميا من قبل 32حساسة للغاية المقايسات P-postlabeling12. حساسية عاليه من 32P-التسمية البريدية يسمح باستخدام كميات صغيره جدا من الحمض النووي (علي سبيل المثال ، 10 ميكروغرام) للكشف عن حوالي 1 معقد إضافي لكل 10 10 قواعد طبيعيه19. ومع ذلك ، فان استخدام المواد الكيميائية الراديويه ، وعدم وجود خصوصية كيميائية وانخفاض الدقة هي بعض العيوب19،20.
والتقييد المشترك للأساليب المذكورة أعلاه هو الانتقائية أو التحديد المنخفض للكشف عن الجزيئات المطلوبة. في هذا السيناريو ، HPLC بالاضافه إلى التاين بالكهرباء بالتوازي الطيف الكتلي (HPLC-ESI-MS/MS و HPLC-MS3) تطورت كمعيار الذهب للقياس الكمي من النيونوسيدس المعدلة في المصفوفات البيولوجية ، مثل الحمض النووي والبول والبلازما واللعاب 1 , 19 , 20. مزايا HPLC-ESI-MS/ms طرق هي حساسية (عاده في نطاق fmol منخفضه) والخصوصية العالية التي قدمتها ط) الانفصال الكروماتوغرافي ، الثاني) السمة والمعروفة نمط من تجزئه جزيء داخل كتله مطياف الاصطدام الغرفة ، والثالث) القياس الدقيق للكتلة المحددة لتهمه نسبه (m/z) في رد فعل متعددة وضع الرصد1،19. ويضيف استخدام المعايير الداخلية المسمية بالنظائر ميزه التصحيحات المتعلقة بخسائر الجزيئات اثناء التحلل بالحمض النووي والخطوات التحليلية للتحليل ، فضلا عن الاختلافات في التاين التحليلي بين العينات. هو أيضا [ايدس] في التحديد من ال يصح [كروغرفيك] قمة عندما أكثر من واحده قمة يكون حاضره1,12,19,20.
وقد استخدمت عده طرق علي أساس hplc-ESI-ms/ms للقياس الكمي من 8-oxodguo, 1,n6-dado و 1,n2-dado في الحمض النووي المستخرج من عينات بيولوجية مختلفه12,15,20 ،21،22،23،24،25،26،27،28،29 . الجسيمات الدقيقة (PM2.5) تحمل المواد الكيميائية العضوية وغير العضوية ، مثل الهيدروكربونات العطرية متعددة الدوريات ، نيترو-pahs ، الديهيديس ، كيتون ، والأحماض الكربوكسيليه ، الكينولين ، والمعادن ، والأيونات القابلة للذوبان في الماء ، والتي قد تحفز التهاب الاكسده ، والظروف التي تحبذ حدوث الضرر جزيء والمرض30،31،32،33. نقدم هنا التحقق من صحة HPLC-ESI-MS/MS الأساليب التي تم تطبيقها بنجاح للقياس الكمي من 8-oxodGuo ، 1 ،n6-Dado و 1 ،n2-dado في الرئة والكبد والكلي الحمض النووي من الفئران A/J لتقييم اثار المحيطة PM2.5 التعرض34.
Protocol
وقد تم الحصول علي أربعه أسابيع من العمر الذكور A/J الفئران ، والممرض محدده مجانا ، من مركز تربيه الماشية المختبرات من Fundação Oswaldo كروز (FIOCRUZ) ، ريو دي جانيرو ، البرازيل ، وتعامل وفقا لذلك إلى لجنه الأخلاق في كليه الطب ، جامعه ساو باولو (البروتوكول no 1310/09).
1. جمع الانسجه الفئران
- تخدير الحيوانية مع اكسيليازين والكيتامين. للماوس مع 30 غرام من وزن الجسم ، حقن محلول (لا يزيد عن 2 مل) تحتوي علي 2.63 ملغ من الكيتامين و 0.38 ملغ من اكسيليازين ، داخل الصفاق.
- جمع الدم (0.5-1.5 mL) للتحليلات التكميلية (علي سبيل المثال ، النشاط انزيم المضادة للاكسده ، مستويات مالونوديهايد).
- حلق شعر البطن من الحوض إلى عمليه الخنجري. اجراء شق في الخط الأوسط العمودي في منطقه أصلع. اجراء شقوق في الخطوط الافقيه الجانبية من أجل فضح أعضاء البطن.
- قطع الابهر البطني لتعزيز الإفراط في الدم ولموت ببطء الحيوانية.
- أزاله الانسجه من الفائدة (في هذه الحالة ، والكبد والكلي والرئتين).
- لأزاله الكبد ، وقطع الوريد الكافا السفلي والوريد الكبدي المدخل.
- لأزاله الكلي ، قسم الاورده الكلوية والشرايين.
- لأزاله الرئتين ، اجراء شق في الأطراف الحجاب الحاجز ومحيط بالقرب من الجدار الصدري. كسر الترقوة عن طريق فتح مقص في المناطق الداخلية من التجويف الصدري. قطع العظم extern من عمليه الخنجري نحو القصبة الهوائية ، من أجل فضح الرئتين والقلب.
- عقد الرئة مع ملقط ، قسم القصبة الهوائية والاربطه حول الرئتين. أزاله بعناية الرئتين كتله بالاضافه إلى القلب. لأزاله الرئتين من الكتلة ، وعقد القلب مع ملقط وقطع جميع السفن في قاعدتها.
- يغسل الانسجه المعزولة فورا في محلول ملحي بارد (0.9 ٪ كلوريد الصوديوم) ، ونقل إلى أنابيب المبردة ، وتراجع علي الفور الأنابيب إلى النيتروجين السائل. بعد الانتهاء من العمل ، وتخزين الأنابيب في-80 درجه مئوية.
تحذير: النيتروجين السائل في اتصال مباشر مع الجلد أو الغشاء المخاطي أو العينين يسبب الحروق. استخدام الحماية الفردية المناسبة لتجنب الاتصال. العمل في مختبر التهوية لتجنب اختناق بسبب بخار النيتروجين السائل.
2. استخراج الحمض النووي
ملاحظه: تم تعديل طريقه استخراج الحمض النووي من Loureiro et al. (2009)35 للسماح للتحليلات من آلافات التي درست هنا.
- نقل الأنابيب التي تحتوي علي الانسجه إلى الثلج الجاف.
- استخدام لوحه ثقافة وضعت علي الجليد كقاعده لقطع قطعه من الانسجه مع مشرط. الوزن 1 ز للاستخدام الفوري. يجب ان تبقي الانسجه المتبقية علي الجليد الجاف حتى يعود إلى التخزين في-80 درجه مئوية.
ملاحظه: من المهم تجنب ذوبان الانسجه المتبقية لمنع تشكيل القطع الاثريه إذا كانت هناك حاجه إلى تكرار التحاليل. - لكل 1 غرام من الانسجه في أنابيب 50 mL المغطية ، أضافه 10 مل من الحل التحلل الخلية التجارية التي تحتوي علي 0.5 مم ديفيكسيامين والحفاظ علي الجليد.
ملاحظه: أضافه ديفيكسيامين إلى حجم الحل للاستخدام الفوري. لكل 100 مل من المحلول ، أضف 0.0328 غرام من الملح المستتاخر. - تجانس الانسجه باستخدام الخالط الانسجه حتى يتم الحصول علي حل متجانس دون شظايا الانسجه. الحفاظ علي أنبوب الباردة (علي الجليد) خلال التجانس. استخدام سرعه منخفضه لتجنب التدفئة.
- أضافه 150 μL من محلول بروتيني K (20 ملغ/مل) لكل عينه متجانسة. يهز الأنابيب عن طريق عكس والاحتفاظ بها في درجه حرارة الغرفة بين عشيه وضحيها.
- أضافه 40 μL من المحلول الريبي (15 ملغ/مل) ، يهز عن طريق عكس ، والحفاظ علي أنابيب في درجه حرارة الغرفة لمده 2 ساعة.
ملاحظه: اعداد المحلول الريبي في خلات الصوديوم العازلة 10 ملم ، pH 5.2 لتجنب هطول الامطار. سخني المحلول عند 100 درجه مئوية لمده 15 دقيقه قبل الاستخدام للحصول علي حل خال من ديوكسيريبونكليوداز. - أضافه 5 مل من محلول البروتين التجاري هطول الامطار ، دوامه بقوة ، والطرد المركزي في 2,000 x g، 4 درجه مئوية ، لمده 10 دقائق.
- نقل supernatants إلى 50 mL أنابيب مغطاه التي تحتوي علي 10 مل من الايزوبروبانول الباردة. عكس الأنابيب بلطف عده مرات حتى الملاحظة من الحمض النووي عجلت.
ملاحظه: يمكن إيقاف البروتوكول مؤقتا هنا ، والحفاظ علي الأنابيب عند-20 درجه مئوية. - جمع الحمض النووي المعجل باستخدام ماصه باستور مغلقه في نهاية المطاف. نقله إلى أنابيب تحتوي علي 4 مل من 10 مم تريس العازلة ، 1 مم ديفيكسيامين ، pH 7.0.
- بعد ان يذوب الحمض النووي تماما في المحلول المذكور أعلاه (لا دوامه) ، أضافه 4 مل من محلول كلوروفورم تحتوي علي 4 ٪ من الكحول كحول ايزو اميلي.
- عكس الأنابيب 10 مرات لتجانس ، أجهزه الطرد المركزي في 2,000 x g، 4 درجه مئوية ، لمده 10 دقائق للفصل بين مرحلتين ، ونقل المرحلة العليا إلى أنبوب جديد.
- كرر الخطوات 2.10 و 2.11 مرتين أكثر.
- أضافه 8 مل من الايثانول المطلق و 0.4 مل من محلول NaCl 5 م ليعجل الحمض النووي.
- جمع مره أخرى الحمض النووي عجلت ونقله إلى 3 مل من الايثانول 70 ٪. كرر هذه الخطوة مره أخرى.
- تجاهل محلول الايثانول بحذر وعكس الأنابيب التي تحتوي علي الحمض النووي المعجل علي ورقه ماصه لأزاله الفائض من الحل.
- أضافه 200 μL من 0.1 mM الحل ديفيكسيامين لأذابه الحمض النووي. الحفاظ علي أنابيب في 4 درجه مئوية حتى يتم أعاده ترطيب الحمض النووي تماما (بين عشيه وضحيها).
- تحديد تركيز الحمض النووي من خلال قياس الامتصاص في 260 نانومتر ونقاءه بنسبه الامتصاص 260/280 nm.
ملاحظه: لتحديد تركيز الحمض النووي ، نقل قسامه من 10 μl من محلول الحمض النووي إلى 990 μl من الماء نقاء (100x التخفيف). مضاعفه الامتصاص في 260 نانومتر (يجب ان يكون اقل من 1) بواسطة 50 (50 ميكروغرام/مل هو تركيز الحمض النووي المزدوج تقطعت بهم السبل عندما الامتصاص من محلول طول المسار 1 سم في 260 نانومتر هو 1) والتخفيف المستخدمة (100x) للحصول علي تركيز الحمض النووي في ميكروغرام/مل. إذا كان الامتصاص عند 260 نانومتر فوق 1 ، المخففات الاضافيه ضرورية. يجب ان تكون نسبه الامتصاص 260/280 nm مساويه أو اعلي 1.8 لنقاء الحمض النووي المطلوب ، ولكن النسب حول 1.6 مقبوله.
3. الحمض النووي الانزيمي التحلل
- تحليل وصفه
- 1,n6-εdado و 1,n2-εdguo تحليلات: إلى قسامه تحتوي علي 150 ميكروغرام من الحمض النووي, أضافه 7.5 μl من 200 mM تريس/mgcl2 العازلة (pH 7.4), 1.4 μl من الحل القياسي الداخلي الذي يحتوي علي 250 fmol/μl من [15N5 ] 1 ،n6-εdado و [15ن5] 1 ،n2-εdguo ، و 15 وحده من deoxyribonnicase ط. ضبط حجم النهائي إلى 200 μl مع المياه نقاء ، طرح كميات من الانزيمات لاستخدامها علي الخطوة 1.2.3.
- 8-تحليل oxodguo: إلى قسامه تحتوي علي 80 ميكروغرام من الحمض النووي ، أضافه 3.8 μl من 200 mM تريس/mgcl2 العازلة (pH 7.4) ، 2 μl من الحل القياسي الداخلي الذي يحتوي علي 1,000 fmol/μl من [15ن5] 8-oxodguo ، و 8 وحدات من ضبط حجم النهائي إلى 100 μl مع المياه نقاء ، طرح كميات من الانزيمات لاستخدامها علي الخطوة 3-2-2.
ملاحظه: المعايير الداخلية [15ن5] 1 ،ن6-εdado ، [15ن5] 1 ،n2-εdguo و [15ن5] 8-oxodguo يمكن ان تكون متزامنة ووصفها بأنها وصف35،36،37. وينبغي ان تكون كميات المعايير الداخلية في وحدات تخزين العينات المحقونة هي نفس الكميات الموجودة في احجام منحنيات المعايرة المحقونة.
- احتضان العينات في 37 درجه مئوية لمده 1 ساعة.
- عينات من الخطوة 3.1: أضافه 0.006 وحدات من فوسفوديستريس I من كروتاليوس ترويكس و 15 وحده من الفوسفاتيز القلوية من الغشاء المخاطي المعوي البقري.
- عينات من الخطوة 3.2: أضافه 0.0032 وحدات من فوسفوديستريس I من كروتاليوس ترويكس و 8 وحدات من الفوسفاتيز القلوية من الغشاء المخاطي المعوي البقري.
- احتضان العينات في 37 درجه مئوية لمده 1 ساعة.
- الطرد المركزي العينات في 14,000 x g لمده 10 دقائق.
- العينات من الخطوة 3-2-1: افصل 10 μL من كل عينه للقياس الكمي للديوكسينونيوسيدس (dAdo ، Dado) بواسطة HPLC/DAD (الخطوة 9). يخضع الحجم المتبقي لاستخراج المرحلة الصلبة (الخطوة 4).
- عينات من الخطوة 3-2-2: نقل 80 μl من ماده طافي إلى قوارير للحقن من 50 μl (1,000 fmol من [15ن5] 8-oxodguo) في hplc-ESI-ms/ms النظام. حجز المتبقية 20 μL للقياس الكمي من dGuo بواسطة HPLC/ابي (الخطوة 9).
4. استخراج المرحلة الصلبة للتحليلات من 1 ، ن6-εdado و 1 ، n2-εdguo
- تحميل خراطيش (C18 ، 30 ملغ/مل ، 33 μm ، 1 مل) مع 1 مل من التسلسل التالي من الحلول: 100 ٪ الميثانول ، الماء منزوع الأيونات ، تحلل الحمض النووي عينه ، المياه منزوع الأيونات ، 10 ٪ الميثانول ، 15 ٪ الميثانول ، و 100 ٪ الميثانول (التي سيتم جمعها).
ملاحظه: لا تترك الخراطيش جافه بين تطبيقات الحلول المختلفة. أضافه الحل التالي مباشره بعد الحل السابق يدخل خرطوشه تماما. - فراغ الجافة الجزء الأخير الشطف (100 ٪ الميثانول) التي تحتوي علي القناات.
- أعاده تعليق العينات المجففة في 83.1 μl من المياه نقاء مباشره قبل hplc-ESI-ms/ms التحليل ، للحصول علي 200 fmol من كل معيار داخلي في 50 μl من كل عينه.
5. اعداد منحنيات المعايرة
- اعداد ما لا يقل عن خمس نقاط في الفترة من 300 إلى 6,000 fmol من 8-oxodGuo القياسية ، مع كميه ثابته من 1,000 fmol من [15ن5] 8-oxodguo في كل نقطه. خذ بالاعتبار هذه المبالغ في وحده التخزين التي تم حقنها.
- اعداد ما لا يقل عن خمس نقاط في الفاصل الزمني من 1 إلى 40 fmol من 1,n6-εdado و 1,n2-εdguo, مع كميات ثابته من 200 fmol من [15n5] 1,n6-εdado و [15ن5] 1, ن 2-εdguo في كل نقطه. خذ بالاعتبار هذه المبالغ في وحده التخزين التي تم حقنها.
- اعداد ما لا يقل عن خمس نقاط في الفترة من 0.05-1 نانومول من dguo و dguo. خذ بالاعتبار هذه المبالغ في وحده التخزين التي تم حقنها.
6. اعداد عينات الحمض النووي للتحقق من صحة الأسلوب
- 1,n6-εdado و 1,n2-εdguo التحليلات: أضافه كميات متفاوتة من 1,ن6-εdado و 1,n2-εdguo (مثل, 1.75, 8.75, 17.5, 35 fmol) وكميات ثابته من [15ن5] 1, N6-εdado و [15n5] 1,n2-εdguo (350 fmol) إلى 100 ميكروغرام من الغدة الوراثية التوتة العجل وتنفيذ التحلل الانزيمي كما هو موضح في الخطوة 3. معالجه العينات في بيلوروسي في يومين مختلفين. استخدم العينات لدقه الأسلوب وتقييم الدقة.
ملاحظه: سيكون الحجم النهائي من والايزولات الحمض النووي 200 μl (الخطوة 3) ، والتي سيتم فصلها من 10 μl للقياس الكمي من ديوكسينونيوسيدس بواسطة hplc/ابي (الخطوة 9). سيتم إخضاع الحل المتبقي (190 μL) لاستخراج المرحلة الصلبة (الخطوة 4) ، سيتم أعاده تعليق الجزء المجفف في 83.1 μL (الخطوة 4.3) ، والتي سيتم حقن 50 μL في نظام HPLC-ESI-MS/MS. كميات 1,n6-Εdado و 1,n2-εdguo حقن سيكون 1, 5, 10, و 20 fmol, مع 200 fmol من [15ن5] 1,ن6-εdado و [15ن5] 1,n 2-εdguo في كل عينه. - 8-التحليلات oxodGuo: أضافه كميات متفاوتة من 8-oxodGuo (علي سبيل المثال ، 734 ، 1,468 ، 2,938 ، 4,408 fmol) وكميه ثابته من [15ن5] 8-oxodguo (2,000 fmol) إلى 100 ميكروغرام من الغدة الوراثية التوتة العجل وتنفيذ التحلل الانزيمي كما هو موضح في الخطوة 3. معالجه العينات في بيلوروسي في يومين مختلفين. استخدم العينات لدقه الأسلوب وتقييم الدقة.
ملاحظه: سيكون الحجم النهائي من والايزولات الحمض النووي 100 μl (الخطوة 3) ، من الذي سيتم حقن 50 μl في نظام hplc-ESI-ms/ms. وسوف تكون كميات من 8-oxodGuo حقن 367 ، 734 ، 1469 ، 2204 fmol ، مع 1,000 fmol من [15ن5] 8-oxodguo في كل عينه. - أضافه 13.125 fmol من 1,n6-εdado (للحصول علي 7.5 fmol في حجم الحقن) و 35 fmol من 1,n2-εdguo (للحصول علي 20 fmol في حجم الحقن) إلى ثمانيه عينات من 100 ميكروغرام من الغدة الوراثية التوتة العجل.
- أضافه المعايير الداخلية[15n5] 1,n6-εdado و [15ن5] 1,n2-εdguo (200 fmol) إلى أربعه من العينات. المضي قدما في التحلل DNA واستخراج المرحلة الصلبة من جميع العينات.
- أضافه المعايير الداخلية[15ن5] 1 ،n6-εdado و [15n5] 1 ،n2-εdguo (200 fmol) إلى العينات الأربع الأخرى.
- استخدام عينات لحساب الانتعاش من القناات من استخراج المرحلة الصلبة.
7. HPLC-ESI-MS/MS التحليل من 8-oxodGuo
- Infusing القياسية 8-oxodGuo في المعدات ، تعيين المعلمات ESI-MS/MS للكشف عن أفضل من نمط التجزئة الخاصة به عن طريق رصد رد فعل متعددة (MRM): m/z 284 [m + h] + → m/z 168 [م-2 '-ديوكسيبوز + h] +.
- استخدام نفس المعلمات للكشف عن[15ن5] 8-oxodguo : m/z 289 [m + h] +m/z → 173 [م-2 '-ديوكسيبوز + H] +.
ملاحظه: استخدام معدات مكافئه أو أفضل من المعدات المستخدمة في هذا العمل (انظر جدول المواد). تم تعيين معلمات ESI-MS/MS كما هو موضح في الجدول 1.
- استخدام نفس المعلمات للكشف عن[15ن5] 8-oxodguo : m/z 289 [m + h] +m/z → 173 [م-2 '-ديوكسيبوز + H] +.
- فلتر (باستخدام اغشيه مساميه 0.22 μm) و degasify (باستخدام sonicator) جميع المذيبات HPLC المياه القائمة.
- استخدم الشروط اللونية التالية للتحليلات ، وتركيب النظام كما هو موضح في الشكل 2.
ملاحظه: العمود A متصل بالمضخة الثنائية. ويوجه لها التملص إلى الكشف عن الاشعه فوق البنفسجية والنفايات في أول 16 دقيقه ومن 32 إلى 46 دقيقه من اللوني ، كما هو مبين في الشكل 2A. هذا هو العمود الذي من خلاله يتم التملص من العينة مباشره بعد الحقن. العمود B متصل بالمضخة الدينية ومطياف الكتلة. فانه يتلقى التي لا العمود A الا في الفاصل الزمني 16-32 دقيقه ، عندما يتم تبديل صمام إلى الموقف المبين في الشكل 2B. يسمح تبديل الصمام بالاتصال بين العمودين ، والتي يتم التملص منها بواسطة تدرج المضخة الثنائية. يسمح التكوين الموضح في الشكل 2B بالمزيد من الفصل الأقصى والتضييق. بالاضافه إلى ذلك ، فقط الجزء الكروماتوغرافي من الفائدة يصل إلى مطياف الكتلة ، وتحسين الحساسية والانتقائية.- Elute 50 x 2.0 مم الهوية ، 2.5 μm ، عمود C18 (العمود ا من الشكل 2) إلى جانب خرطوشه حارس أمن C18 (4.0 × 3.0 ملم الهوية) مع التدرج من 0.1 ٪ حمض الفورميك (المذيبات a) و الميثانول التي تحتوي علي 0.1 ٪ حمض فورميك (المذيب ب) بمعدل تدفق 150 μl/min و 25 درجه مئوية.
- استخدام برنامج التدرج التالي للمضخة ثنائي: من 0 إلى 25 دقيقه ، 0-15 ٪ من المذيبات B ؛ 25 إلى 28 دقيقه ، 15-80 ٪ من المذيبات ب ؛ 28 إلى 31 دقيقه ، 80 ٪ من المذيبات ب ؛ 31 إلى 33 دقيقه ، 80-0 ٪ من المذيبات ب ؛ 33 إلى 46 دقيقه, 0% من مذيب B.
- استخدام صمام التبديل لتوجيه أول 16 دقيقه من التملص إلى النفايات والجزء 16-32 دقيقه إلى عمود ثان (150 x 2.0 ملم ، 3.0 μm ، C18 ، العمود B من الشكل 2) متصلا بمصدر ESI ومكيفه من قبل مضخة اسقراطيه مع حل من 15 ٪ لي ثانول في المياه التي تحتوي علي 0.1 ٪ حمض فورميك (150 μL/min).
ملاحظه: قبل استخدام برنامج صمام التبديل من الخطوة 7.3.1.2 ، تحقق ما إذا كان القياسية 8-oxodGuo التملص من العمود الأول بعد 16 دقيقه. من المهم لإغلاق صمام في 32 دقيقه لاستخدام التدرج من المضخة الثنائية إلى الوت 8-oxodguo من العمود الثاني والحصول علي ذروه الكروماتوغرافي حاده. آلافه 8-oxodGuo التملص من العمود الثاني في حوالي 36 دقيقه تقريبا. قد تحدث اختلافات في وقت الاستبقاء للتحليل تبعا للعمود والمعدات المستخدمة. قد تكون التعديلات من برنامج التدرج المذيب HPLC ضرورية.
- Elute 50 x 2.0 مم الهوية ، 2.5 μm ، عمود C18 (العمود ا من الشكل 2) إلى جانب خرطوشه حارس أمن C18 (4.0 × 3.0 ملم الهوية) مع التدرج من 0.1 ٪ حمض الفورميك (المذيبات a) و الميثانول التي تحتوي علي 0.1 ٪ حمض فورميك (المذيب ب) بمعدل تدفق 150 μl/min و 25 درجه مئوية.
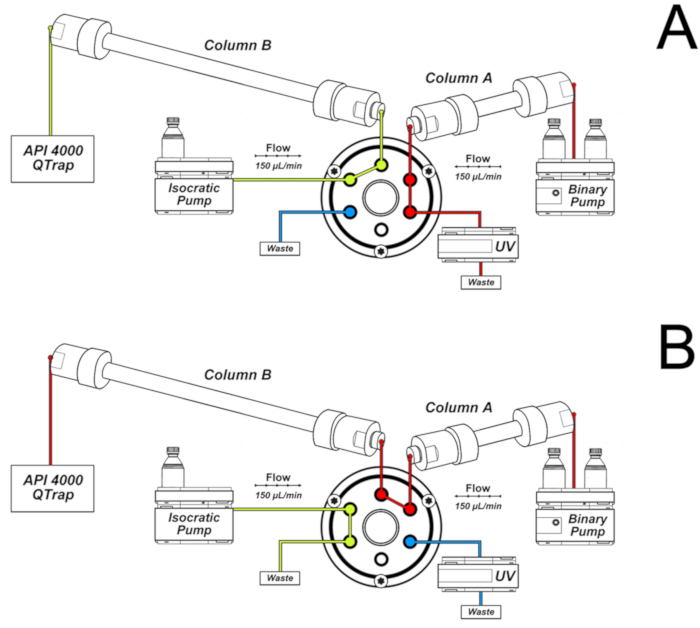
الشكل 2 نظام من عمودين المستخدمة ل 8-اوكسو-7 ، 8-ديهيدرو-2 '-غوانوسين (8-oxodGuo) التحليلات. ا) التكوين المستخدمة في أول 16 دقيقه ومن 32 إلى 46 دقيقه من اللوني ؛ B) التكوين المستخدمة في الفاصل الزمني 16-32 دقيقه ، والسماح لمزيد من الانفصال والذروة تضييق في العمود B قبل التملص إلى مصدر ESI من مطياف الكتلة. وقد أعيد نشر هذا الرقم من اوليفيرا وآخرون34. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
8. HPLC-ESI-MS/MS تحليل 1, n 6 -εdado و 1, n 2 -εdguo
- Infusing 1,n6-εdado و 1,n2-εdguo المعايير في المعدات, تعيين ESI-ms/مللي معلمات للكشف عن أفضل من أنماط التجزئة الخاصة بهم عن طريق رصد ردود الفعل المتعددة (MRM): m/z 276 [m + h] + → m/z 160 [m 2 '- ديوكسيريبوز + H] + للكشف عن 1,N6-εdado و M/z 292 [m + h] + → m/z 176 [م-2 '-ديوكسيبوز + ح ] + للكشف عن 1 ،ن2-εdguo.
- استخدام نفس المعلمات للكشف عن[15ن5] 1 ،ن6-εdado (m/z 281 [m + h] +m/z → 165 [م-2 '-ديوكسيبوز + ح] +) و [15ن 5] 1,N2-εdguo (m/z 297 [m + H] + → m/z 181 [م-2 '-ديوكسيبوز + H] +). تعيين معلمات ESI-MS/MS كما هو موضح في الجدول 1.
| ESI-MS/MS المعلمات | 8-oxodGuo | قناه ايثينو |
| ستاره الغاز | 20 رطل | 20 رطل |
| نيبوليزينج الغاز | 55 | 50 |
| الغاز المصدر الأيوني | 50 المبادرة | 40 المبادرة |
| غاز التفكك الناجم عن الاصطدام | المتوسطه | المتوسطه |
| أيون رذاذ الجهد | 5000 | 4500 |
| ESI مسبار درجه الحرارة | 450 | 450 |
| القوائم المحتملة | 31 فولت ، 8-oxodGuo | 41 الخامس ، 1 ، ن6-εdado |
| 31 فولت ، [15ن5] 8-oxodguo | 41 V, [15ن5] 1, N6-εdado | |
| 45 الخامس ، 1 ، ن2-εdguo | ||
| 45V ، [15n5] 1 ، N2-εdguo | ||
| الطاقة الاصطدام | 23 eV, 8-oxodGuo | 25 eV, 1, N6-εdado |
| 23 eV, [15ن5] 8-oxodguo | 25 eV, [15ن5] 1, N6-εdado | |
| 27 eV, 1, N2-εdguo | ||
| 27 eV, [15ن5] 1, N2-εdguo | ||
| احتمال خروج خلايا الاصطدام | 16 V ، 8-oxodGuo ، | 8 فولت ، 1 ، ن6-εdado |
| 16 فولت ، [15ن5] 8-oxodguo | 8 فولت ، [15ن5] 1 ، ن6-εdado | |
| 16 V, 1, N2-εdguo | ||
| 16 فولت ، [15ن5] 1 ، ن2-εdguo | ||
| مدخل المحتملة | 10 خامسا | 10 خامسا |
الجدول 1 المعلمات المستخدمة في أجهزه ESI-MS/MS للكشف عن آفات الحمض النووي. تم تعديل هذا الجدول من اوليفيرا وآخرون34.
- فلتر (باستخدام اغشيه مساميه 0.22 μm) و degasify (باستخدام sonicator) جميع المذيبات HPLC المياه القائمة.
- استخدم شروط الفصل اللوني التالية للتحليلات.
- Elute 150 x 2.0 مم الهوية ، 3.0 μm ، C18 العمود إلى C18 الأمن خرطوشه الحرس (4.0 x 3.0 مم الهوية) مع التدرج من خلات الأمونيوم 5 ملم ، pH 6.6 (المذيبات A) و اسيتلونيتريل (المذيب ب) بمعدل تدفق 130 μL/min و 25 ° c.
- استخدام برنامج التدرج التالي للمضخة ثنائي: من 0 إلى 10 دقيقه ، 0 ٪ من المذيبات B ؛ 10 إلى 39 دقيقه ، 0-20 ٪ من المذيبات ب ؛ 39 إلى 41 دقيقه, 20-75% من مذيب [ب]; 41 إلى 46 دقيقه, 75% من مذيب [ب]; 46 إلى 47 دقيقه ، 75-0 ٪ من المذيبات ب ؛ 47 إلى 60 دقيقه, 0% من مذيب B.
- استخدام صمام التبديل لتوجيه أول 35 دقيقه من التملص إلى النفايات والجزء 35-42 دقيقه إلى مصدر ESI. تاكد من ان المعايير القناة الوت من العمود في الفاصل الزمني المحدد (35-42 min). قم باجراء التعديلات إذا لزم الأمر.
- Elute 150 x 2.0 مم الهوية ، 3.0 μm ، C18 العمود إلى C18 الأمن خرطوشه الحرس (4.0 x 3.0 مم الهوية) مع التدرج من خلات الأمونيوم 5 ملم ، pH 6.6 (المذيبات A) و اسيتلونيتريل (المذيب ب) بمعدل تدفق 130 μL/min و 25 ° c.
9. التقدير الكمي لل 2 '-ديكسيريبوننوكليوسيدس العادية من قبل HPLC-UV
- استخدام معدات مماثله للمعدات المستخدمة في هذا العمل (انظر جدول المواد).
- Elute 250 مم x 4.6 مم الهوية ، 5 μm ، C18 العمود المرفقة C18 الأمن خرطوشه الحرس (4.0 x 3.0 مم الهوية) مع التدرج من 0.1 ٪ حمض الفورميك و الميثانول.
- استخدام برنامج التدرج التالي: من 0 إلى 25 دقيقه ، 0 إلى 18 ٪ الميثانول. من 25 إلى 27 دقيقه ، 18 إلى 0 ٪ الميثانول. من 27 إلى 37 دقيقه ، 0 ٪ الميثانول) بمعدل تدفق 1 مل/دقيقه و 30 درجه مئوية.
- حقن 5 μL من كل عينه محجوزه للقياس الكمي 2 '-ديوكسينوديوسيدس.
- تعيين كاشف أب في 260 نانومتر للتكامل من القمم dGuo و Dguo.
10. القياس الكمي للآفات الحمض النووي
- دمج قمم 8-oxodGuo ، [15ن5] 8-oxodguo ، 1 ،ن6-εdado ، [15ن5] 1 ،ن6-εdado ، 1 ،n2-εdguo ، و [15ن5] 1 ،ن2 -εdguo من التحليلات HPLC-ESI-ms/ms.
- احسب نسب المنطقة 8-oxodGuo/[15n5] 8-oxodguo, 1,n6-εdado/[15n5] 1,n6-εdado, و 1,n2-εdguo/[15n5 ] 1,N2-εdguo للمعايرة المنحنيات والعينات.
- ارسم منحنيات المعايرة باستخدام نسب المساحة التي تم الحصول عليها في الخطوة 10.1.1 في محور y وكميات التحاليل الموجودة في كل نقطه في محور x.
- حساب المبالغ (fmol) من آلافات في كل عينه حقن باستخدام النسب المحسوبة في الخطوة 10.1.1 ومنحنيات المعايرة ل10.1.2 الخطوة.
- دمج قمم dGuo و Dguo من تحليلات HPLC-الاشعه فوق البنفسجية.
- ارسم منحنيات المعايرة باستخدام المناطق التي تم الحصول عليها في الخطوة 10.2 في محور y وكميات التحاليل الموجودة في كل نقطه في محور x.
- حساب المبالغ (nmol) من dGuo و Dguo في كل عينه حقن باستخدام المناطق التي تم الحصول عليها في الخطوة 10.2 ومنحنيات المعايرة ل10.2.1 الخطوة.
- حساب المبالغ (nmol) من dGuo و Dguo الموجودة في كل عينه حقن في نظام HPLC-ESI-MS/MS ، معتبرا ان المبالغ المحسوبة في 10.2.2 الخطوة موجودة في حجم العينة من 5 μL ، في حين تم حقن 50 μL في نظام HPLC-ESI-MS/MS.
ملاحظه: لحساب مقدار dGuo في العينات المستخدمة للتحليل 8-oxodGuo ، فقط ضرب المبلغ (nmol/μL) الحصول عليها في الخطوة 10.2.2 بواسطة 50. لحساب كميات dAdo و Dado في العينات المستخدمة للتحليلات من 1,n6-εdado و 1,n2-εdguo, النظر في خطوه التركيز بعد استخراج المرحلة الصلبة. حجم 50 μL حقن في HPLC-ESI-MS/MS النظام يتوافق مع 114.32 μL من العينة الاصليه. يجب ان تتضاعف المبالغ (nmol/μL) التي تم الحصول عليها في الخطوة 10.2.2 ب114.32 للحصول علي القيم الصحيحة. - احسب الكسور المولية 8-oxodGuo/dGuo, 1,n6-Εdado/Dguo, 1,n2-εdguo/dguo. النسب (fmol آلافه/nmol العادي deoxyالنيونوموسيد) تعطي عدد آلافات لكل 106 dguo العادي أو dguo.
النتائج
متوسط تركيزات الحمض النووي (± SD) التي تم الحصول عليها من الفئران الكبد (~ 1 ز الانسجه), الرئة (~ 0.2 g الانسجه) والكلي (~ 0.4 g الانسجه) كانت, علي التوالي, 5,068 ± 2,615, 4,369 ± 1,021, و 3,223 ± 723 ميكروغرام/مل في الحجم النهائي من 200 μL. ويظهر كروماتوجرام الممثل الذي تم الحصول عليه من قبل HPLC-أب من الح?...
Discussion
مشكله كبيره وجدت في تحليلات 8-oxodguo من قبل أساليب hplc هو الاستقراء المحتمل لتشكيلها خلال إجراءات العمل من استخراج الحمض النووي ، التحلل الحمضي النووي ، وتركيز الحمض النووي والايزولات22،38. من أجل التقليل من مشكله التشكيل 8-oxodGuo المادية ، فمن المستحسن أضافه ديفيك...
Disclosures
وليس لدي المؤلفين ما يفصحون عنه.
Acknowledgements
FAPESP (Fundação de الحماية الدستورية 2012/22190-3 و 2012/08616-8) ، CNPq (Proc. 454214/2014-6 و 429184/2016-6) ، الرؤوس ، PRPUSP (Pró-Reitoria de Pesquisa da جامعه de São Paulo) ، INCT INAIRA (MCT/CNPq/FAPESP/الرؤوس/ FAPEMIG/Fابيرج/FAPESP; 573813/2008-6) ، INCT ريدوكورم (FAPESP/CNPq/الرؤوس ؛ 573530/2008-4) ، برنامج العمل الوطني (PRPUSP; 2011.1.9352.1.8) و CEPID ريدوكوما (FAPESP; Proc. 2013/07937-8). وتلقي ت. ف. اوليفيرا و ا. ا. و. اوليفيرا منحا دراسية من FAPESP (2012/21636-8 ، 2011/09891-0 ، 2012/08617-4) والرؤوس (Coordenação دي ابيرفيتشونتو دي بسال دي نيفل سوبيريور). وقد حصل علي زمالات من الشركة المذكورة ، وهي السيدة م. ح. ج. ميديروس ، وب. دي ماسسيو ، وب. ح. ن. سالديفا ، والسيد ا. م. لورييرو.
وقد نشرت في الأصل بعض الأرقام والجداول الموجودة في هذا العمل في اوليفيرا A.A.F. et al. السمية الجينية والآثار السمية الجينية في الفئران المعرضة لماده الجسيمات الدقيقة المحيطة المركزة (PM2.5) من مدينه ساو باولو ، البرازيل. الجسيمات وألياف السموم. 15, 40 (2018).
Materials
| Name | Company | Catalog Number | Comments |
| [15N5]-2’-deoxyadenosine | Cambridge Isotope Laboratories | NLM-3895-25 | |
| [15N5]-2’-deoxyguanosine | Cambridge Isotope Laboratories | NLM-3899-CA-10 | |
| acetonitrile | Carlo Erba Reagents | 412413000 | |
| alkaline phosphatase from bovine intestinal mucosa | Sigma | P5521 | |
| ammonium acetate | Merck | 101116 | |
| calf thymus DNA | Sigma | D1501 | |
| cell lysis solution | QIAGEN | 158908 | |
| chloroform | Carlo Erba Reagents | 412653 | |
| deferoxamine | Sigma | D9533 | |
| deoxyribonuclease I (DNase I) | Bio Basic Inc | DD0649 | |
| ethanol | Carlo Erba Reagents | 414542 | |
| formic acid | Sigma-Aldrich | F0507 | |
| HPLC-ESI-MS/MS system | HPLC: Agilent 1200 series ESI-MS/MS: Applied Biosystems/MDS Sciex Instruments | HPLC: binary pump (G1312B), isocratic pump (G1310A), column oven with a column switching valve (G1316B), diode array detector (G1315C), auto sampler (G1367C). ESI-MS/MS: Linear Quadrupole Ion Trap mass spectrometer, Model 4000 QTRAP. | |
| HPLC/DAD system | Shimadzu | Two pumps (LC-20AT), photo diode array detector (DAD-20AV), auto-injector (Proeminence SIL-20AC), column oven (CTO-10AS/VP) | |
| HPLC column (50 x 2.0 mm i.d., 2.5 µm, C18) | Phenomenex | 00B-4446-B0 | |
| HPLC column (150 x 2.0 mm i.d., 3.0 µm, C18) | Phenomenex | 00F-4251-B0 | |
| HPLC column (250 x 4.6 mm i.d., 5.0 µm, C18) | Phenomenex | 00G-4252-E0 | |
| HPLC C18 security guard cartridge (4.0 x 3.0 mm i.d.) | Phenomenex | AJO-4287 | |
| isoamyl alcohol | Sigma-Aldrich | M32658 | |
| isopropyl alcohol (isopropanol) | Carlo Erba Reagents | A412790010 | |
| ketamine | Ceva | Commercial name: Dopalen | |
| magnesium chloride | Carlo Erba Reagents | 349377 | |
| magnesium chloride | Sigma | M2393 | |
| methanol | Carlo Erba Reagents | L022909K7 | |
| phosphodiesterase I from Crotalus atrox | Sigma | P4506 | |
| protein precipitation solution | QIAGEN | 158912 | |
| proteinase K | Sigma-Aldrich | P2308 | |
| ribonuclease A | Sigma | R5000 | |
| sodium chloride | Sigma-Aldrich | S9625 | |
| SPE-C18 (Strata-X) | Phenomenex | 8B-S100-TAK | |
| tris(hydroxymethyl)-aminomethane | Carlo Erba Reagents | 489983 | |
| xylazine | Syntec do Brasil | Commercial name: Xilazin |
References
- Cadet, J., Davies, K. J. A., Medeiros, M. H. G., Di Mascio, P., Wagner, J. R. Formation and repair of oxidatively generated damage in cellular DNA. Free Radical Biology and Medicine. 107, 13-34 (2017).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46, 1213-1224 (2018).
- Cadet, J., Davies, K. J. A. Oxidative DNA damage & repair: An introduction. Free Radical Biology and Medicine. 107, 2-12 (2017).
- Cao, H., Jiang, Y., Wang, Y. Stereospecific synthesis and characterization of oligodeoxyribonucleotides containing an N2-(1-carboxyethyl)-2'-deoxyguanosine. Journal of the American Chemical Society. 129, 12123-12130 (2007).
- Breyer, V., et al. Analysis and biological relevance of advanced glycation end-products of DNA in eukaryotic cells. The FEBS Journal. 275, 914-925 (2008).
- Tamae, D., Lim, P., Wuenschell, G. E., Termini, J. Mutagenesis and repair induced by the DNA advanced glycation end product N2-1-(carboxyethyl)-2'-deoxyguanosine in human cells. Biochemistry. 50, 2321-2329 (2011).
- Hecht, S. S. Lung carcinogenesis by tobacco smoke. International Journal of Cancer. 131, 2724-2732 (2012).
- Garraway, L. A., Lander, E. S. Lessons from the cancer genome. Cell. 153, 17-37 (2013).
- Ong, T. P., Loureiro, A. P. M. Nutritional interventions in age-related genetic and epigenetic instability and cancer. Anti-ageing nutrients: Evidence-based prevention of age-associated diseases. , (2015).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutation Research. 567, 1-61 (2004).
- Moriya, M. Single-stranded shuttle phagemid for mutagenesis studies in mammalian cells: 8-oxoguanine in DNA induces targeted GC → TA transversions in simian kidney cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 1122-1126 (1993).
- Medeiros, M. H. G. Exocyclic DNA adducts as biomarkers of lipid oxidation and predictors of disease. Challenges in developing sensitive and specific methods for clinical studies. Chemical Research in Toxicology. 22, 419-425 (2009).
- Guéraud, F. 4-Hydroxynonenal metabolites and adducts in pre-carcinogenic conditions and cancer. Free Radical Biology and Medicine. 111, 196-208 (2017).
- Nair, U., Bartsch, H., Nair, J. Lipid peroxidation-induced DNA damage in cancer-prone inflammatory diseases: A review of published adduct types and levels in humans. Free Radical Biology and Medicine. 43, 1109-1120 (2007).
- Pang, B., et al. Lipid peroxidation dominates the chemistry of DNA adduct formation in a mouse model of inflammation. Carcinogenesis. 28, 1807-1813 (2007).
- Møller, P., et al. Harmonising measurements of 8-oxo-7,8-dihydro-2'-deoxyguanosine in cellular DNA and urine. Free Radical Research. 46, 541-553 (2012).
- Hofer, T., Moller, L. Optimization of the workup procedure for the analysis of 8-oxo-7,8-dihydro-2'-deoxyguanosine with electrochemicaldetection. Chemical Research in Toxicology. 15, 426-432 (2002).
- Collins, A., El Yamani, N., Dusinska, M. Sensitive detection of DNA oxidation damage induced by nanomaterials. Free Radical Biology and Medicine. , 69-76 (2017).
- Zubel, T., Buerkle, A., Mangerich, A. Mass spectrometric analysis of sulfur mustard-induced biomolecular adducts: Are DNA adducts suitable biomarkers of exposure?. Toxicology Letters. 293, 21-30 (2018).
- Tretyakova, N., Goggin, M., Sangaraju, D., Janis, G. Quantitation of DNA adducts by stable isotope dilution mass spectrometry. Chemical Research in Toxicology. 25, 2007-2035 (2012).
- Churchwell, M. I., Beland, F. A., Doerge, D. R. Quantification of multiple DNA adducts formed through oxidative stress using liquid chromatography and electrospray tandem mass spectrometry. Chemical Research in Toxicology. 15, 1295-1301 (2002).
- Chao, M. R., Yen, C. C., Hu, C. W. Prevention of artifactual oxidation in determination of cellular 8-oxo-7,8-dihydro-2'-deoxyguanosine by isotope-dilution LC-MS/MS with automated solid-phase extraction. Free Radical Biology and Medicine. 44, 464-473 (2008).
- Danielsen, P. H., et al. Oxidative stress, inflammation, and DNA damage in rats after intratracheal instillation or oral exposure to ambient air and wood smoke particulate matter. Toxicological Sciences. 118, 574-585 (2010).
- Danielsen, P. H., et al. Oxidative stress, DNA damage, and inflammation induced by ambient air and wood smoke particulate matter in human A549 and THP-1 cell lines. Chemical Research in Toxicology. 24, 168-184 (2011).
- Garcia, C. C. M., et al. [13C2]-Acetaldehyde promotes unequivocal formation of 1,N2-propano-2'-deoxyguanosine in human cells. Journal of the American Chemical Society. 133, 9140-9143 (2011).
- Angeli, J. P. F., et al. Lipid hydroperoxide-induced and hemoglobin-enhanced oxidative damage to colon cancer cells. Free Radical Biology and Medicine. 51, 503-515 (2011).
- Yu, Y., et al. Comprehensive assessment of oxidatively induced modifications of DNA in a rat model of human Wilson's disease. Molecular and Cellular Proteomics. 15, 810-817 (2016).
- Torres-Cuevas, I., Aupi, M., Asensi, M. A., Vento, M., Ortega, &. #. 1. 9. 3. ;., Escobar, J. 7,8-Hydroxy-2'-deoxyguanosine/2'-deoxiguanosine ratio determined in hydrolysates of brain DNA by ultrachromatrography coupled to tandem mass spectrometry. Talanta. 170, 97-102 (2017).
- Wu, D., et al. Detection of 8-hydroxydeoxyguanosine (8-OHdG) as a biomarker of oxidative damage in peripheral leukocyte DNA by UHPLC-MS/MS. Journal of Chromatography B. 1064, 1-6 (2017).
- IARC. . Monographs on the Evaluation of Carcinogenic Risks to Humans: Outdoor Air Pollution. 109, (2016).
- De Martinis, B. S., Kado, N. Y., Carvalho, L. R. F., Okamoto, R. A., Gundel, L. A. Genotoxicity of fractionated organic material in airborne particles from São. Mutation Research. 446, 83-94 (1999).
- Karlsson, H. L., Nygren, J., Möller, L. Genotoxicity of airborne particulate matter: The role of cell-particle interaction and of substances with adduct-forming and oxidizing capacity. Mutation Research. 565, 1-10 (2004).
- Bell, M. L., Dominici, F., Ebisu, K., Zeger, S. L., Samet, J. M. Spatial and temporal variation in PM2.5 chemical composition in the United States for health effects studies. Environmental Health Perspectives. 115, 989-995 (2007).
- Oliveira, A. A. F., et al. Genotoxic and epigenotoxic effects in mice exposed to concentrated ambient fine particulate matter (PM2.5) from São Paulo city, Brazil. Particle and Fibre Toxicology. 15, 40 (2018).
- Loureiro, A. P. M., Zhang, W., Kassie, F., Zhang, S., Villalta, P. W., Wang, M., Hecht, S. S. Mass spectrometric analysis of a cyclic 7,8-butanoguanine adduct of N-nitrosopyrrolidine: comparison to other N-nitrosopyrrolidine adducts in rat hepatic DNA. Chemical Research in Toxicology. 22, 1728-1735 (2009).
- Loureiro, A. P. M., Marques, S. A., Garcia, C. C. M., Di Mascio, P., Medeiros, M. H. G. Development of an on-line liquid chromatography-electrospray tandem mass spectrometry assay to quantitatively determine 1,N2-etheno-2'-deoxyguanosine in DNA. Chemical Research in Toxicology. 15, 1302-1308 (2002).
- Mangal, D., et al. Analysis of 7,8-dihydro-8-oxo-2′-deoxyguanosine in cellular DNA during oxidative stress. Chemical Research in Toxicology. 22, 788-797 (2009).
- ESCODD (European Standards Committee on Oxidative DNA Damage). Comparative analysis of baseline 8-oxo-7,8-dihydroguanine in mammalian cell DNA, by different methods in different laboratories: an approach to consensus. Carcinogenesis. 23, 2129-2133 (2002).
- Helbock, H. J., et al. DNA oxidation matters: The HPLC-electrochemical detection assay of 8-oxo-deoxyguanosine and 8-oxo-guanine. Proceedings of the National Academy of Sciences of the United States of America. 95, 288-293 (1998).
- Risom, L., et al. Oxidative DNA damage and defence gene expression in the mouse lung after short-term exposure to diesel exhaust particles by inhalation. Carcinogenesis. 24, 1847-1852 (2003).
- Risom, L., et al. Repeated inhalations of diesel exhaust particles and oxidatively damaged DNA in young oxoguanine DNA glycosylase (OGG1) deficient mice. Free Radical Research. 41, 172-181 (2007).
- Tsurudome, Y., et al. Changes in levels of 8-hydroxyguanine in DNA, its repair and OGG1 mRNA in rat lungs after intratracheal administration of diesel exhaust particles. Carcinogenesis. 20, 1573-1576 (1999).
- Marie-Desvergne, C., Maître, A., Bouchard, M., Ravanat, J. L., Viau, C. Evaluation of DNA adducts, DNA and RNA oxidative lesions, and 3-hydroxybenzo(a)pyrene as biomarkers of DNA damage in lung following intravenous injection of the parent compound in rats. Chemical Research in Toxicology. 23, 1207-1214 (2010).
- Iwai, K., et al. Early oxidative DNA damages and late development of lung cancer in diesel exhaust-exposed rats. Environmental Research. 84, 255-264 (2000).
- Ichinose, T., et al. Lung carcinogenesis and formation of 8-hydroxy-deoxyguanosine in mice by diesel exhaust particles. Carcinogenesis. 18, 185-192 (1997).
- Schmerold, I., Niedermu, H. Levels of 8-hydroxy-2'-deoxyguanosine in cellular DNA from 12 tissues of young and old Sprague Dawley rats. Experimental Gerontology. 36, 1375-1386 (2001).
- Garcia, C. C. M., Freitas, F. P., Di Mascio, P., Medeiros, M. H. G. Ultrasensitive simultaneous quantification of 1,N2-etheno-2'-deoxyguanosine and 1,N2-propano-2'-deoxyguanosine in DNA by an online liquid chromatography-electrospray tandem mass spectrometry assay. Chemical Research in Toxicology. 23, 1245-1255 (2010).
- Godshalk, R., et al. Comparison of multiple DNA adduct types in tumor adjacent human lung tissue: effect of cigarette smoking. Carcinogenesis. 23, 2081-2086 (2002).
- Dechakhamphu, S., et al. Lipid peroxidation and etheno DNA adducts in white blood cells of liver fluke-infected patients: protection by plasma alpha-tocopherol and praziquantel. Cancer Epidemiology Biomarkers and Prevention. 19, 310-318 (2010).
- Arab, K., et al. Typical signature of DNA damage in white blood cells: a pilot study on etheno adducts in Danish mother-newborn child pairs. Carcinogenesis. 30, 282-285 (2009).
- Nair, J., et al. High dietary omega-6 polyunsaturated fatty acids drastically increase the formation of etheno-DNA base adducts in white blood cells of female subjects. Cancer Epidemiology Biomarkers and Prevention. 6, 597-601 (1997).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved