Method Article
الحمض النووي عالي الكثافة وmicroarrays RNA - التوليف الضوئي، والتهجين وإعداد مكتبات الأحماض النووية الكبيرة
In This Article
Summary
في هذه المقالة، نقدم ونناقش التطورات الجديدة في تركيب وتطبيقات microarrays الحمض النووي ملفقة في الموقع. على وجه التحديد، نعرض كيف يمكن توسيع بروتوكولات تخليق الحمض النووي الريبي إلى الحمض النووي الريبي وكيف يمكن استخدام المصفوفات الدقيقة لإنشاء مكتبات الحمض النووي القابلة للاسترداد.
Abstract
التصوير الضوئي هو تقنية قوية لتركيب oligonucleotides الحمض النووي على الشرائح الزجاجية، كما أنه يجمع بين كفاءة تفاعلات اقتران الفوسفوراميديت مع دقة وكثافة ضوء الأشعة فوق البنفسجية تنعكس من المرايا ميكرومتر الحجم. ينتج التصوير الضوئي للتصوير الضوئي مصفوفات دقيقة يمكن أن تستوعب من مئات الآلاف تصل إلى عدة ملايين من تسلسلات الحمض النووي المختلفة، 100-nt أو أكثر، في غضون ساعات قليلة فقط. مع هذا الفضاء تسلسل كبير جدا، microarrays هي منصات مثالية لاستكشاف آليات الحمض النووي · ligand التفاعلات، والتي هي ذات صلة خاصة في حالة RNA. أبلغنا مؤخرا عن إعداد مجموعة جديدة من الفوسفوراميدات RNA متوافقة مع التصوير الضوئي في الموقع والتي استخدمت في وقت لاحق لزراعة OLIgonucleotides RNA، homopolymers وكذلك تسلسل قاعدة مختلطة. هنا، نوضح بالتفصيل عملية تصنيع الصفيف الصغير RNA، من التصميم التجريبي، إلى الإعداد الآلي، وتوليف الصفيف، وإزالة الحماية، والمسح النهائي للتهجين باستخدام تسلسل قالب 25mer يحتوي على جميع القواعد الأربعة كمثال. وفي موازاة ذلك، نتجاوز التجارب القائمة على التهجين ونستغل التصوير الضوئي للصفيف اتّبأ كبوابة غير مكلفة إلى مكتبات الأحماض النووية المعقدة. وللقيام بذلك، يتم تصنيع رغائف الحمض النووي الدقيقة عالية الكثافة على مونومر حساس للقاعدة يسمح للحمض النووي أن يكون مُقَبَّلًا بشكل ملائم ويتم استرداده بعد التوليف وإزالة الحماية. يتم تحسين بروتوكول التصنيع بحيث يحد من عدد الأخطاء الاصطناعية ولهذا الغرض، يتم إدخال طبقة من محلول β-carotene لامتصاص فوتونات الأشعة فوق البنفسجية التي قد تعكس خلاف ذلك مرة أخرى على ركائز التوليف. ونحن نصف بطريقة تدريجية العملية الكاملة لإعداد المكتبة، من التصميم إلى الانقسام والقياس الكمي.
Introduction
الاستخدام العملي للصفائف الدقيقة الحمض النووي كان تقليديا في دراسة الاختلافات في مستويات التعبير الجيني بين اثنين من السكان الخلايا، وذلك باستخدام خيوط تكميلية والفلورة كوسيلة الكشف1. في بعض الأحيان، وmicroarrays الحمض النووي المغامرة في أحداث ملزمة مع الأربطة حمض غير النووية، مثل البروتينات، مع استراتيجية من التحول تسلسل منهجي الذي يقدم نظرة شاملة على المناظر الطبيعية ملزمة2،3، 4،5. ويحول هذا النهج بشكل فعال النُصائف الصغرى من مجرد أسطح التهجين إلى منصات ذات نطاق واسع من التغطية، وهو ما سيكون رصيداً لدراسة العالم الأكثر ثراءً وتعقيداً لهيكل ووظيفة الحمض النووي الريبي. بدعم من تفاعل اقتران الفوسفوراميدات كفاءة للغاية6، يمكن الآن في الموقع صفائف الحمض النووي توليفها أن ينظر إليها الآن كمصدر رخيص للحمض النووي7، والتي أصبحت ذات أهمية خاصة بالنظر إلى الطلب المتزايد باستمرار على المواد الحمض النووي لتجميع الجينات8،9، الهياكل النانوية المستندة إلى الحمض النووي10، تخزين المعلومات أو تسلسل11،12. وبالمثل، من المرجح أن تستفيد تكنولوجيات التسلسل من تطوير الأساليب التي تسفر عن خليط معقد جدا من الحمض النووي الريبي oligonucleotides13. وفي هذا السياق، فإن بروتوكولات تصنيع الصفيف اتّبع القلة في الموقع وبكثافة عالية تكون في وضع مثالي لتلبية احتياجات مجال التكنولوجيا الأحيائية للحمض النووي الذي يتوسع بسرعة. ومع ذلك، مع مجال متنوع مثل التكنولوجيا الحيوية، قد يتطلب الغرض من كل تطبيق أن يتم إنتاج الحمض النووي على microarray إما في الإنتاجية العالية أو مع كمية منخفضة جدا من الأخطاء الاصطناعية14،15،أو كليهما، مما يتطلب نظرة فاحصة على بروتوكولات التوليف من microarrays الحمض النووي التي، تاريخيا، وقد تم الأمثل في المقام الأول لاختبارات التهجين. وفي الوقت نفسه، تم العثور على التوليف في الموقع من microarrays RNA أن يكون مسعى تحديا، مع معظم الصعوبة المرتبطة مجموعة حماية ل2'-OH وظيفة، وعادة ما moiety سيليل في توليف المرحلة الصلبة القياسية التي تتم إزالتها مع الكواشف القائمة على الفلور، والمواد الكيميائية التي تتعارض مع الأسطح الزجاجية أو السيليكون. وكانت تلك القضايا والتحديات في الحمض النووي والحمض النووي الريبي التوليف microarray في الآونة الأخيرة موضوع مجموعة كبيرة من العمل، ولا سيما مع نهج التصوير الضوئي16.
يستخدم التصوير الضوئي الضوء فوق البنفسجية لإلغاء حظر oligonucleotides قبل اقتران ويتطلب أقنعة لبناء نمط من التعرض للأشعة فوق البنفسجية، وبالتالي تنظيم مكانيا والسيطرة على نمو oligonucleotides. وقد تم استبدال الأقنعة المادية بمرايا صغيرة يتم التحكم فيها بواسطة الكمبيوتر والتي يعكس إمالة انتقائيضوء الأشعة فوق البنفسجية على الركيزة microarray17،18،19. كمصدر للأشعة فوق البنفسجية، ونحن نستخدم 365 نانومتر ضوء من مصدر LED عالية الطاقة20. وقد تم تجهيز الإعدادات الضوئية الحالية مع صفائف micromirror تحتوي على 1024 × 768 المرايا، المقابلة لأكثر من 780،000 البقعالقابلة للعنونة بشكل فردي ("الميزات") على مساحة صغيرة من 1.4 سم فقط 2، أو 1080p مع صفائف من 1920 × 1080، أو > 2 مليون مرآة. كل من المرايا في الجهاز وبالتالي لديها سيطرة مباشرة على تسلسل نمت على الميزة المقابلة. باستثناء الأشعة فوق البنفسجية، وظائف التصوير الضوئي مثل تقنية التوليف في المرحلة الصلبة ويعتمد كيمياء الفوسفوراميديت القائمة على دورة. فقط هو يتطلّب تماما مختلفة حماية إستراتيجية ل [رنا] تأليف أن ينجح. قمنا بتطوير سلسلة جديدة من الفوسفوراميدات الحمض النووي الريبي الحساسة للضوء تحمل هيدرازين-لابيل حماية المجموعات21. تسمح هذه المونومرات بإزالة حماية الحمض النووي الريبي في ظل ظروف خفيفة لا تؤثر على سلامة السطح. وتستخدم الخطوة الأولى لإزالة الحماية ثلاثي إيثيلامين لإزالة مجموعات حماية الفوسفوديستر السيانوإيثيلي، في حين يستخدم الهيدرازين في خطوة ثانية منفصلة لإزالة تلك التي في وظائف الأمين 2'-OH وexocyclic. في القيام بذلك، RNA oligonucleotides ~ 30-nt في الطول وأي تسلسل يمكن الآن توليفها في الموقع على microarrays22،23. وبالتوازي مع ذلك، بدأنا مؤخرا ً في معالجة مسائل الإنتاجية والجودة والسرعة في التصوير الضوئي للحمض النووي الريبي والحمض النووي الريبي. قمنا بقياس كفاءة اقتران > 99٪ لجميع الحمضالنووي وRNA أميديتس (الشكل 1) وبحثت في كل خطوة فردية في دورة استطالة oligonucleotide، من وقت الأكسدة، إلى اختيار المنشط والتعرض الأمثل للأشعة فوق البنفسجية24 , 25.لقد جلبنا في جديدة حساسة للضوء 5 'حماية المجموعات التي يمكن إزالتها في ثوان فقط، وتحويل توليف مئات الآلاف من 100mers إلى عملية بضع ساعات طويلة26. كما ضاعفنا الإنتاجية من تصنيع مجموعة من خلال فضح اثنين من ركائز في وقت واحد27. وأخيرا، قدمنا الفوسفوراميديت dT التي تحتوي على قاعدة حساسة مجموعة succinyl كوسيلة مريحة لشق وجمع وتحليل الحمض النووي وoligonucleotides الحمض النووي الريبي، وهو أمر أساسي لإعداد المكتبة28.
على الرغم من الجانب الدنيوي نسبيا من الحمض النووي والحمض النووي الريبي توليف المرحلة الصلبة، وخاصة بالنسبة للكيميائيين حمض النووية، وmicroarray photolithography لا يزال ترقية غير تافهة تتطلب إعداد معقدة، ومراقبة دقيقة والإشراف على العملية، و تعليمات منفصلة للتعامل بعد الاصطناعية اعتمادا على طبيعة oligonucleotide ونوع التطبيق. في هذه المقالة، نود أن نقدم عرضا مفصلا لكامل الإجراء خطوة بخطوة من التوليف في الموقع من الحمض النووي والحمض النووي الريبي microarrays عن طريق التصوير الضوئي، من التصميم التجريبي لتحليل البيانات، مع التركيز على إعداد الأدوات و المواد الاستهلاكيه. ثم نقوم بوصف أساليب إزالة الحماية بعد التركيبية التي تتوافق مع الغرض المقصود من تصنيع المصفوفة الدقيقة (أي إما التهجين أو استعادة مكتبات الأحماض النووية).
Protocol
1. تصميم microarray
- اكتب التسلسلات ليتم توليفها في محرر نص، 5'→3'، سطر واحد لكل تسلسل. لمراقبة الجودة 25mer، استخدم تسلسل "GTCATCATCATGAACCACCCTGGTC". استخدام A، C، G و T الحروف للنيوكليوتيدات الحمض النووي و 5، 6، 7 و 8 أرقام للنيوكليوتيدات RNA.
- في حالة إعداد المكتبة، يضاف رقم إضافي (أي 9) في نهاية 3'من كل تسلسل. وهذا سوف يتوافق مع اقتران مونومر قاعدة حساسة.
- يجب أن يتبع كل تسلسل فاصلة. تعيين اسم لكل تسلسل بعد الفاصلة، وتحقق من أن كل حارة يتبع تنسيق [تسلسل،#sequence_name] (بدون أقواس). حفظ قائمة التسلسلات كملف .txt.
- بدء MatLab ثم تحميل برنامج ChipDesign.m. قم بتشغيل البرنامج.
- في إطار "لوحة الخصائص" ، تحميل ملف تخطيط EntireChip الصفيف. تحميل ملف تخطيط MilliChip إذا كان الهدف هو توليف الصفيف بأكمله في أربعة مواقع متطابقة.
- في إطار لوحة الخصائص، ضمن مواصفاتالشريحة، حدد تحديد حاوية ثم منطقة التوليف. ضمن نقش، حدد النمط الذي ينتج الكمية الصحيحة من الميزات القابلة للعنونة، مع حساب عدد التسلسلات × عدد النسخ المتماثل. لمراقبة الجودة 25mer، حدد نمط 25:36.
- ضمن تحديد حاوية، حدد Fiducial. عادة ما يتم تصنيع الميزات Fiducial في زوايا منطقة التوليف وتستخدم لاستخراج بيانات التهجين. مع Fiducial المحدد، اكتب تسلسل (5'→3') التي سيتم توليفها على الميزات fiducial والتي يمكن أن تكون بمثابة سيطرة إيجابية. لتجربة 25mer، استخدم نفس تسلسل الحمض النووي.
- ضمن تسلسل، قم بتحميل الملف النصي الذي يحتوي على كافة التسلسلات المكتوبة. تأكد من تحديد العشوائية. إعطاء عنوان للتجربة في عنوان المشروع، وفي تسلسل Linker،اكتب TTTTT (المقابلة لرابط T5).
- اضغط على إنشاء، ثم ابحث عن ملفات تصميم الصفيف والأقنعة (الشكل2)ضمن مجلد MaskGen_delta_rc1/Designs. تأكد من أنه يحتوي على برنامج نصي للعرضوتسلسل تدفق وملف تصميم.
- لإعداد المكتبة، افتح البرنامج النصي للعرض. إضافة سطر إضافي في الجزء السفلي من البرنامج النصي للعرض الذي ينسخ بالضبط السطر الأول من البرنامج النصي (على سبيل المثال، عرض First_Mask.bmp 150). سيؤدي هذا إلى إزالة مجموعة حماية الصور الطرفية في نهاية 5 'من جميع oligonucleotides.
- بدء تشغيل برنامج AutoJob منشئ الوظيفة، تحميل قالب عن طريق النقر على قالبالتحميل، ثم انقر على عرض البرنامج النصي لتحميل ملف البرنامج النصي العرض الذي تم إنشاؤه من قبل MatLab. اضغط على إنشاء. هذه الخطوة سوف تخلق سلسلة من التعليمات، ودعا jobfile، التي من شأنها السيطرة على اتصال الكمبيوتر مع micromirrors وتوليف الحمض النووي.
2. إعداد الشريحة وإضفاء الطابع الوظيفي
- حفر شريحة واحدة في موقفين المقابلة لموقع مدخل ومخرج الأنابيب على الخلية التوليفية. استخدام بت الماس 0.9 ملم على جهاز التوجيه باستخدام الحاسب الآلي لحفر بدقة وموثوق بها. شطف الشرائح المحفورة بالماء النقي جدا وترتيبها في رف الشريحة.
- تنظيف الأسطح عن طريق sonicating الشرائح في حمام مائي يحتوي على 5٪ من منظف الأغراض الخاصة على أساس الأمونيا لمدة 30 دقيقة عند 35 درجة مئوية. شطف الشريحة مع مزدوج المقطر H2O ونقلها في رف نظيفة وجافة.
- ترتيب الشرائح المجهر حفر وغير حفر في رف الشريحة. في اسطوانة كبيرة تخرج، وإعداد حل وظيفية عن طريق خلط 475 مل من الإيثانول (EtOH) مع 25 مل من ddH2O، 10 غرام من الكاشف silanizing (N -(3-triethoxysilylpropyl) -4-هيدروكسيبوتيراميد) و 1 مل من حمض الخليك. يُحرّك المزيج جيّداً حتى يصبح متجانساً ثميّك في وعاء مناسب ومغلق.
- وضع الرف المحملة في الحاوية، وإغلاق الغطاء والسماح للحاوية الصخور بلطف على شاكر المداريلمدة 4 ساعة في درجة حرارة الغرفة.
- بعد 4 ح، تجاهل حل وظيفية واستبدال مع 500 مل من محلول الغسيل، وتتكون من 475 مل من EtOH، 25 مل من ddH2O و 1 مل من حمض الخليك. يهيّج ببطء لمدة 20 دقيقة في درجة حرارة الغرفة، ثم تجاهل واستبدال مع 500 مل من محلول الغسيل الطازج.
- بعد 20 دقيقة إضافية في درجة حرارة الغرفة، وتجاهل الحل، وتجفيف الشرائح مع تيار من الأرجون وعلاجها في فرن فراغ ساخنة مسبقا في 120 درجة مئوية. بعد 2 ساعة، إيقاف الفرن ومضخة فراغ ولكن ترك الشرائح تحت ضغط منخفض بين عشية وضحاها. ثم، وجلب الفرن مرة أخرى إلى الضغط الجوي وتخزين الشرائح في المجفف حتى مزيد من الاستخدام.
3- إعداد الكواشف والكواشف التوليفية
- جلب مساحيق الفوسفوراميديت(الشكل 1) من درجة حرارة تخزينها (-25 أو -45 درجة مئوية) إلى درجة حرارة الغرفة في المجفف.
- عندما وصلت الفوسفورية درجة حرارة الغرفة، حل المسحوق مع حجم من الأسيتاتونيتريل الجافة جدا (<30 جزء في المليون H2O) من أجل الوصول إلى تركيز 30 M للحمض النووي القياسي والفوسفوراميدات الحمض النووي الريبي، و 50 مل لمونة dT الحساسة للقاعدة ( إعداد المكتبة). إضافة كيس منخل الجزيئية الصغيرة لاعتراض أي أثر للرطوبة.
- إعداد حل من 1٪ (ث / ث) إيميدازول في DMSO عن طريق حل 11 غرام من إيميدازول في 1 لتر من DMSO الجافة. يُرج جيداً حتى يذوب تماماً. إرفاق الحل إلى الميناء المساعد لمجمع الحمض النووي. هذا سيكون المذيبات التعرض اللازمة لإزالة كاملة من مجموعة 5′-photoprotect.
- لتوليف المكتبات، وإعداد حل من 1٪ (ث / الخامس) β-كاروتين في ثنائي كلورو الميثان عن طريق حل 100 ملغ من β-كاروتين في 10 مل من ثنائي كلورو الميثان. يهز جيدا في زجاجة العنبر ثم التفاف في رقائق الألومنيوم.
4- إعداد ورصد توليف المصفوفات الدقيقة.
- تسجيل درجة الحرارة والرطوبة في غرفة تصنيع microarray وتأكد من المزج الحمض النووي تحت ضغط الهليوم كافية.
- قم بتشغيل الأشعة فوق البنفسجية LED ومروحة التبريد الخاصة بها. إرفاق مقياس كثافة الأشعة فوق البنفسجية في المستوى البؤري للضوء الأشعة فوق البنفسجية واردة وتشغيله (الشكل3A).
- على جهاز الكمبيوتر، بدء تشغيل jobfile/micromirror/synthesis ملفات وحدة تحكم البرمجيات (يسمى WiCell). قم بتشغيل الجهاز micromirror ثم قم بتحميل ملف قناع أبيض بدرجة كل شيء بالنقر بزر الماوس الأيمن على DMD، ثم تحديد تحميل صورة.
- انقر بزر الماوس الأيمن على رمز الأشعة فوق البنفسجية وحدد الأشعة فوق البنفسجية مصراع فتح. قراءة قيمة الطاقة (في mW / سم2)على متر كثافة وعدد 60 ق. بعد 60 ثانية، اقرأ قيمة الطاقة مرة أخرى ولاحظ أسفل قيم البداية والنهاية. أغلق الغالق عن طريق تحديد إغلاق مصراع الأشعة فوق البنفسجية وإيقاف تشغيل مقياس الكثافة. حساب متوسط قيمة كثافة الأشعةفوق البنفسجية في mW/cm 2.
- حساب وقت التعرض اللازم للوصول إلى طاقة مشعة من 6 J / سم2 ل5 '-NPPOC photodeprotection (الحمض النووي وRNA microarrays) و
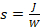 3 J / سم2 ل5 '-BzNPPOC photodeprotection (مكتبات الحمض النووي)، ببساطة بعد العلاقة.
3 J / سم2 ل5 '-BzNPPOC photodeprotection (مكتبات الحمض النووي)، ببساطة بعد العلاقة. - في برنامج محطة عمل المزج الحمض النووي إنشاء ملف تسلسل في محرر التسلسل عن طريق نسخ ولصق محتويات تسلسل التدفق التي تم إنشاؤها بواسطة MatLab. إضافة خطوتين الغسيل إضافية اثنين في نهاية 3 '(حرف دورة الافتراضي: "ق") لغسل سطح الركائز قبل الانتقال إلى اقتران الأول. حفظ ملف التسلسل وتصديره.
- في "محرر بروتوكول" من برنامج محطة العمل إنشاء بروتوكول يحتوي على دورة مخصصة باسم كل من الأحرف والأرقام الموجودة في ملف التسلسل (على سبيل المثال، إذا كان ملف تسلسل يحتوي على الأحرف A و C و G و T فقط، ثم يجب أن ملف البروتوكول تحتوي على أربع دورات، تسمى A، C، G و T).
- تعيين وقت اقتران لالفوسفوراميدات الحمض النووي (دورات A، C، G و T) إلى 15 ق، إلى 120 ق لrU الفوسفوراميديت (دورة 8) وإلى 300 ق لrA، rC و rG phosphoramidites (دورات 5 و 6 و 7). لإعداد المكتبة، تعيين اقتران أحادية dT حساسة للقاعدة، قابلة للتحديد إلى 2 × 120 ق (الجدول 1 والجدول 2).
- تأكد من أن وقت الانتظار بين حدثين من أحداث الاتصال في كل دورة يتوافق مع وقت التعرض للأشعة فوق البنفسجية المحسوبللوصول إلى الطاقة المشعة اللازمة. أما بالنسبة لملف التسلسل، قم بحفظ ملف البروتوكول وتصديره.
- في برنامج WiCell تحميل ملفات المهمة والتسلسل والبروتوكول في الإطارات الفرعية الخاصة بهم ثم انقر فوق إرسال لإرسال ملفات التسلسل والبروتوكول إلى مركب الحمض النووي.
- في ملف التسلسل، عد عدد الوصلات لكل فسفوريديت.
- لقياس الحجم المطلوب (باللتر) من محلول الفوسفوراميديت اللازم لتنفيذ كل توليف، اضرب عدد الوصلات بـ 60. إضافة 250 درجة مئوية إلى كل وحدة من وحدات التخزين للسلامة وفتيلة الخط على المزج الحمض النووي. استخدام حجم قاعدة من 250 درجة مئوية للفسفور مما يتطلب اقتران واحد فقط.
- نقل الحل بسرعة إلى قارورة على المزج الحمض النووي المقابلة لحرف الميناء / عدد في دورات البروتوكول.
- قم بتعبئة المنافذ مع حلول الفوسفوراميديت مع 10 نبضات رئيسية لكل منها من أجل ملء الخطوط بالكاشف. رئيس خط غسل acetonitrile قبل إرفاق خلية رد الفعل.
- لتجميع الخلية التوليفية، ضع طوقا ً سميكاً (250 ميكرومتر) (FFKM) أولاً على كتلة الكوارتز من الخلية. وضع حفر، وظيفية شريحة المجهر على رأس طوقا الأولى، والتحقق من أن الثقوب على الشرائح الاتصال مع مدخل ومخرج أنابيب من الخلية التوليفية.
- ضع طوقاً ثانياً رفيعاً (50 درجة مئوية) من البولي تترافلوروإيثيلين (PTFE) على الشريحة المحفورة، المحيطة بالثقوب. وأخيرا، وضع الشريحة الثانية، وظيفية ولكن غير حفر فوق طوقا الثاني (الشكل3B). وضع إطار معدني 4 المسمار على رأس الخلية مزدوجة الركيزة تجميعها وتشديد المسمار إلى نفس قوة لقط (0.45 نيوتن متر) باستخدام مفك عزم الدوران.
- إرفاق مدخل ومخرج الأنابيب إلى المزج الحمض النووي. رئيس خط غسل acetonitrile والتحقق من التدفق السليم من acetonitrile (ACN) من خلال ركائز. تفكيك وإعادة تجميع الخلية إذا كان يمكن ملاحظة أي تسرب من ACN في هذه المرحلة. قياس حجم ACN في خط النفايات بعد الذهاب من خلال 7 دورات من فتيلة ACN. يجب أن يكون حجم وحدة التخزين هذه 2 مل.
- إرفاق خلية التوليف في المستوى البؤري للضوء الأشعة فوق البنفسجية واردة. في حالة إعداد المكتبة، قم بإرفاق مدخل إضافي وخط منفذ إلى الجزء الخلفي من الخلية وملء الغرفة الخلفية مع الحل بيتا كاروتين (2 مل من الحل يكفي). تأكد من عدم وجود تسرب (الشكل3C).
- بدء التوليف عن طريق النقر أولاً على تشغيل في برنامج WiCell. في الأمر WAIT الأول في ملف المهمة، اضغط ابدأ على مركب الحمض النووي.
- أثناء التوليف، تحقق بانتظام من أن عرض ملفات القناع يتزامن مع التعرض للأشعة فوق البنفسجية وفتح الغالق.
- بعد تركيب microarrays العادية، وقطع الخلية من المزج، وتفكيك الخلية واستخدام قلم الماس لحفر رقم التوليف على الشرائح الزجاجية. حفر الرقم على الوجه غير توليفها من كل شريحة. نقل الشرائح إلى أنابيب الطرد المركزي 50 مل وتخزينها في منطقة المجففة حتى مزيد من الاستخدام.
- بعد تركيب microarrays مكتبة، أولا استنزاف الحل β-كاروتين للخروج من الغرفة ثم غسله عن طريق تتدفق 2 × 5 مل من CH2Cl2، ثم استنزاف. المضي قدما في تفكيك وفقا للخطوة 4.21. قد تكون مجموعة توليفها مرئيةللعين المجردة (الشكل 4).
5. الحمض النووي إزالة الحماية microarray
- ملء جرة الزجاج تلطيخ مع 20 مل من EtOH و 20 مل من الإيثيلينديامين (EDA). ضع الميكروarrays الحمض النووي فقط عمودياً في الجرة، وأغلق الغطاء، واترك الشرائح لإزالة الحماية لمدة 2 ساعة في درجة حرارة الغرفة.
تحذير: EDA هو سائل سام للغاية، وتآكل والقابلة للاشتعال. العمل مع القفازات في غطاء محرك السيارة الدخان جيدة التهوية. - بعد 2 ح، استرداد الشرائح باستخدام ملاقط وشطفها جيدا مع مزدوج المقطر H2O.
- تجفيف الشرائح في جهاز طرد مركزي microarray لبضع ثوان ثم تخزينها في المجفف.
6. الحمض النووي الريبي إزالة الحماية
- في أنبوب الطرد المركزي 50 مل، وإعداد حل جاف من 2:3 triethylamine /ACN (20 مل و 30 مل لكل منهما، على التوالي). نقل واحد RNA شريحة microarray في أنبوب الطرد المركزي، وإغلاق الغطاء ثم التفاف مع فيلم الختم البلاستيك. هز بلطف أنبوب الطرد المركزي على شاكر المداري ة لمدة ساعة و30 دقيقة في درجة حرارة الغرفة.
- بعد 1h و 30 دقيقة، وإزالة الشريحة، وغسل مع 2 × 20 مل ACN الجافة ثم تجف في جهاز طرد مركزي microarray لبضع ثوان.
تحذير: ثلاثي إيثيلامين هو سائل سام للغاية، وتآكل والقابلة للاشتعال. الأسيتوتريل سام وقابل للاشتعال. العمل مع القفازات في غطاء محرك السيارة الدخان جيدة التهوية.
ملاحظة: إكمال الخطوة الأولى إزالة الحماية. - إعداد 0.5 M هيدرازين الهيدرات الحل في 3:2 بيريدين / حمض الخليك. أولا، مزيج 20 مل من حمض الخليك و 30 مل من البيريدين في اسطوانة تخرج. انتظر الحل لتبرد قبل إضافة 1.21 مل من هيدرات الهيدرازين. نقل حوالي 40 مل من الحل الناتج في أنبوب الطرد المركزي 50 مل.
تحذير: هيدرات هيدرازين هو سائل سام وأكال حاد. بيريدين قابل ة للاشتعال للغاية وشديدة السمية. حمض الخليك قابل للاشتعال وتآكل. العمل مع القفازات في غطاء محرك السيارة الدخان جيدة التهوية. - بعد الخطوة الأولى لإزالة الحماية، نقل الشريحة RNA في محلول هيدرازين هيدرازين، وإغلاق الغطاء والتفاف مع فيلم الختم البلاستيك. يهز بلطف الأنبوب على شاكر المداري لمدة 2 ساعة في درجة حرارة الغرفة. بعد 2 ح، إزالة الشريحة، وغسل مع 2 × 20 مل من ACN الجافة ثم تجف في جهاز طرد مركزي microarray لبضع ثوان.
ملاحظة: اكتمال الخطوة إزالة الحماية الثانية. - إذا كان microarray RNA يحتوي أيضا على النيوكليوتيدات الحمض النووي، والمضي قدما في خطوة إزالة الحماية الثالثة. في أنبوب الطرد المركزي 50 مل، مزيج 20 مل من EDA مع 20 مل من EtOH. أضف الصفيف الصغير للحمض النووي/الحمض النووي الريبي إلى حل EDA/EtOH 1:1 واترك في درجة حرارة الغرفة لمدة 5 دقائق.
- بعد 5 دقائق، قم بإزالة الشريحة، واغسلها بـ 2 × 20 مل من الماء المعقم ثم جفف في جهاز طرد مركزي صغير ومخزن في المجفف.
7. التهجين مع حبلا تكميلية تحمل علامة الفلورسنت
- إذابة أسيتيلاتي مصل البقر الزلال (10 ملغ / مل) وحبلا تكميلية Cy3 المسمى (100 nM) والاحماء لدرجة حرارة الغرفة.
- في أنبوب أجهزة الطرد المركزي الدقيقة المعقمة 1.5 مل، مزيج 150 ميكرولتر من2X MES العازلة (200 مل 2-(N-morpholino) حمض الإيثانسولفونيك؛ 1.8 M NaCl؛ 40 MM EDTA؛ 0.02٪ توين-20) مع 26.7 ميكرولتر من الحمض النووي المسمى Cy3، 13.4 ميكرولتر من أسيتيل BSA و 110 ميكرولتر من H 2 O. مزيج معقمة و 110 درجة مئوية من H2O. مزيج معقمة دوامه. مضاعفة وحدة التخزين إذا كان كل من الشرائح لاستخدامها للتهجين.
- قبل تسخين فرن التهجين إلى درجة حرارة أقل من Tم من دوبلكس ولكن عالية بما فيه الكفاية لضمان التمييز الجيد بين كامل المباراة وتسلسل غير المباراة. لمراقبة الجودة 25mer، تعيين درجة الحرارة إلى42 درجة مئوية (Tم من 59 درجة مئوية).
- ضع بعناية غرفة تهجين ذاتية اللصق بـ 300 درجة مئوية فوق منطقة التوليف على كل شريحة وأنبوب في محلول التهجين المعد أعلاه. تغطية ثقوب الغرفة مع نقاط لاصقة والتفاف الشريحة بأكملها في رقائق الألومنيوم.
- ضع الشريحة الدقيقة في فرن التهجين، اغطيها واتركها تدور بلطف في درجة حرارة التهجين المحددة لمدة 2 ساعة.
- بعد 2 ساعة، فصل الشريحة، وإزالة رقائق الألومنيوم والمسيل للدموع بعناية قبالة غرفة التهجين. نقل الشرائح إلى أنبوب الطرد المركزي الذي يحتوي على 30 مل من حاجز غسل غير صارم (NSWB؛ 0.9 M NaCl، 0.06 M الفوسفات، 6 MM EDTA، 0.01٪ Tween20، درجة الحموضة 7.4) ويهز بقوة لمدة 2 دقيقة في درجة حرارة الغرفة.
- نقل الشريحة إلى أنبوب الطرد المركزي التي تحتوي على 30 مل من العازلة غسل صارمة (SWB؛ 100 MM MES، 0.1 M NaCl، 0.01٪ Tween20) ويهز بقوة لمدة 1 دقيقة.
- وأخيرا، نقل الشريحة إلى أنبوب الطرد المركزي التي تحتوي على 30 مل من المخزن المؤقت للغسيل النهائي (FWB؛ 0.1x سيترات ملحي الصوديوم) ويهز لبضع ثوان. تجفيف الشريحة في جهاز طرد مركزي microarray.
- ضع الصفيف الصغير الجاف، منطقة التوليف التي تواجه أسفل، في حامل الشريحة من الماسح الضوئي microarray. بالنسبة للدوبلكس اتّس بـ Cy3، قم بالمسح الضوئي بدقة 5 ميكرومتر مع الطول الموجي للإثارة بـ 532 نانومتر، وفلتر 575 نانومتر، ومضاعف ضوئي قدره 350. حفظ المسح الضوئي عالية الدقة كملف صورة .tif (الشكل5A).
8 - استخراج البيانات وتحليلها
- قبل استخراج البيانات، قم بتدوير مسح الصفيف المحفوظ في محرر الصور من أجل وضع أطول سلسلة من الميزات fiducial في الزاوية العلوية اليسرى من الفحص. حفظ الصورة التي تمت استدارة.
- بدء NimbleScan، ثم اضغط على ملف | افتح مسح الصفيف وحمّله. ثم، بالنقر فوق استعراض في القسم الفرعي "ملف التصميم"، قم بتحميل ملف . ndf تصميم الملف الذي تم إنشاؤه تلقائيا أثناء تصميم تجربة microarray. ثم انقر فوق فتح.
- في طريقة العرض، انقر فوق التباين التلقائي /السطوع. انقر على الرمز محاذاة يدويا فوق المسح الضوئي. ضع أربعة علامات على شكل مربع في الزوايا الأربعة للمسح الضوئي، ثم انقر على الرمز الأخضر الآن مرة أخرى. استخراج بيانات التهجين عن طريق النقر على تحليل, تقارير ثم تقرير التحقيق.
- افتح . التحقيق في ملف تقرير في محرر جدول بيانات. الاحتفاظ بالعمودين B و I وتجاهل الباقي قبل الشروع في حساب متوسط القيم والانحراف المعياري عن البيانات المستخرجة (الشكل5B).
9 - إزالة الحماية من المكتبة والانقسام والانتعاش
- لإزالة الحماية وانسداد مكتبات الحمض النووي، وإعداد حل من 1:1 EDA الجافة / التولوين في أنبوب الطرد المركزي 50 مل. تزج الشريحة في حل الانقسام، وإغلاق الشريحة والتفاف مع فيلم ختم البلاستيك، ثم تدوير بلطف في شاكر المدارية لمدة 2 ساعة في درجة حرارة الغرفة.
- بعد 2 ساعة، إزالة الشريحة وغسل مع 2 × 20 مل من ACN الجافة بدقة. إزالة الشريحة والسماح لها الهواء الجاف.
- مع ماصة، وتطبيق 100 درجة مئوية من H2O معقمة على منطقة التوليف يمكن تمييزها الآن. Pipet الحل صعودا وهبوطا عدة مرات قبل نقله إلى أنبوب الطرد المركزي الصغير 1.5 مل. كرر العملية والجمع بين eluate microarray فينفس الأنبوب (الشكل 6).
- تتبخر 2 × 100 درجة مئوية من إلوت رقاقة لجفاف ثم إعادة الذوبان في 10 ميكرولتر من خالية من nuclease H2O. قياس امتصاص على مقياس الطيف UV-Vis.
- إزالة الملح مكتبة الحمض النووي على طرف ماصة 10 درجة مئوية مجهزة الراتنج C18. أولا، تحويل رقاقة eluate إلى 0.1 M خلات ثلاثي إيثيلالأمونيوم (TEAA) حل المخزنة مؤقتا.
- قم بترطيب الراتنج من خلال الطموح 3 × 10 ميكرولتر من H2O/ACN 1:1، ومعادلة الراتنج عن طريق الغسيل مع 3 × 10 ميكرولتر من 0.1 M TEAA العازلة. ربط الحمض النووي عن طريق الأنابيب رقاقة eluate 10 مرات صعودا وهبوطا من خلال الراتنج. غسل الراتنج مع 3 × 10 درجة مئوية من 0.1 M TEAA العازلة، 3 × 10 درجة مئوية من H2O.
- Elute الحمض النووي منزوع الملح من طرف عن طريق غسل الراتنج مع 10 ميكرولتر من H2O / ACN 1:1. تجفيف الحل منزوع الملح أسفل وإعادة الذوبان في 10 ميكرولتر من H2O. معقمة قياس الامتصاص على مقياس الطيف الأشعة فوق البنفسجية فيس (الشكل7). تتبخر المكتبة لتجف وتخزينها في -20 درجة مئوية حتى مزيد من الاستخدام.
النتائج
التهجين الحمض النووي والحمض النووي الريبي
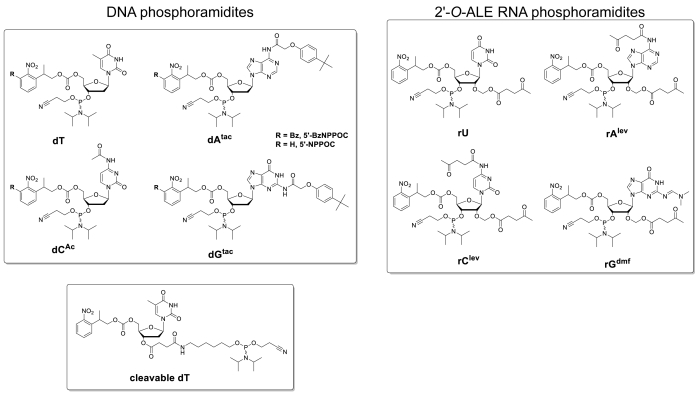
ويبين الشكل 5 نتائج فحص التهجين الذي أجري على صفيف صغير يحتوي على نسخ الحمض النووي والحمض النووي الريبي لتسلسل 25 mer (5'-GTCATCATGAACCACCACCTGGTC-3' في شكل الحمض النووي). يظهر المسح في الشكل 5ألف في شكل أخضر يتوافق مع طيف الإثارة/الانبعاثات من الفلورة Cy3، مع كثافة الفلورة المسجلة في وحدات تعسفية بين 0 و65536. يتبع تصميم الصفيف تخطيط ميزة 25:36 الموضحة في مقطع البروتوكول. يظهر المسح الضوئي بعد التوجه الصحيح للصفيف، مع ملء الزاوية اليسرى العليا مع أطول سلسلة من الميزات fiducial. هنا، تحتوي الميزات fiducial على نسخة الحمض النووي من 25mer، وينبغي، من حيث المبدأ، تعطي دائما إشارة الفلورة الإيجابية من أجل إجراء محاذاة المسح الضوئي واستخراج البيانات. ال يتهجّى [ميكرور] سوفت ظهرت بشكل متّسق ساطعة, مع الحافات من التوليف منطقة يكون مهما عادة أكثر إشراقا من المركز ([أوب تو] 50% أكثر إشراقا). وتقلل الكمية الكبيرة من تكرار التسلسل، الموزعة عشوائيا في جميع أنحاء المنطقة، من تأثير القطع الأثرية المكانية. هنا، تم تصنيع كل تسلسل (الحمض النووي والحمض النووي الريبي) في 2000 موقع عشوائي. هناك عادة ضوضاء الفلورة منخفضة (الخلفية)، <50 a.u.، مما يؤدي إلى نسبة إشارة /ضوضاء في ترتيب 200:1 إلى 800:1 في الاختبارات التهجين. بعد استخراج البيانات، يتم متوسط كثافة الفلورة خارج ومرسومة ± SD.
وهناك تباين كبير في قيم الفلورة المطلقة بين التجارب. هنا، نعرض النتائج لثلاث توليفات مستقلة باستخدام نفس معلمات التصنيع ونفس المناولة بعد التركيبية. الحمض النووي 25mer، عندما هجين إلى حبلا الحمض النووي الخاص به ساي3 المسمى التكميلية، سوف تسفر عن إشارات الفلورة تتراوح في أي مكان من 20،000 إلى 30،000، نادرا جدا فوق أو أقل. والحمض النووي الريبي 25mer، عندما هجين إلى نفس S3 المسمى الحمض النووي تكملة، وسوف تعطي كثافة الفلورة على الميزات المقابلة تتراوح بين 15،000 إلى 20،000. ومع ذلك، فإن كثافة الفلورة من الحمض النووي الريبي / الحمض النووي المزدوج سوف تنخفض في بعض الأحيان أقل من 8000، عندما الحمض النووي المقابلة / الحمض النووي المزدوج سوف لا يزال الفلورة ضمن نطاق 20،000-30،000. في مثل هذه الحالات، يمكن اعتبار نتائج الحمض النووي الريبي دون الأمثل. فشل التوليف أو التهجين، إما للحمض النووي أو الحمض النووي الريبي، وسوف تكون ملحوظة على الفور أثناء المسح الضوئي من نقص واضح في الفلورة. هناك فرص متعددة لتوليف RNA إما فشل أو جزئيا ً بنجاح وسيتم تحديدها في جزء المناقشة.
إزالة الحماية من المكتبة والانقسام والاسترداد
اعتمادا على تعقيد وكثافة المكتبة، يمكن رؤية شكل ومخطط مجموعة توليفها دون التكبير ولكن تحت الإضاءة المناسبة (الشكل4)، مع الحمض النووي لا يزال في شكل محمي. بعد إزالة الحماية مع EDA / التولوين، وقبل إضافة المياه من أجل جمع المكتبة المخطوفة، قد تبرز منطقة التوليف التي تحتوي على oligonucleotides غير المحمية الآن كمنطقة مائية، عندما تظهر بقية الشريحة الزجاجية مغطاة بطبقة كارهية عكر. وتعتمد المراقبة المباشرة لمنطقة التوليف على المساحة الإجمالية المستخدمة لتجميع القلة: فزيادة استخدام منطقة التوليف ستتوافق مع وجود فرصة أكبر للتمييز الواضح بين المناطق المائية والمائية الكارهة للماء على السطح. وعلى العكس من ذلك، قد لا تكون المكتبات التي تم تصنيعها باستخدام مرايا أقل ومع ميزات أصغر يمكن ملاحظتها على الفور.
وبالمثل، فإن كمية الحمض النووي المسترد بعد إزالة الأملاح تتناسب مباشرة مع المساحة الإجمالية المستخدمة للتوليف. إذا تم استخدام جميع الميزات لتخليق oligonucleotide، يجب أن تسفر عملية الانقسام والانتعاش بين 25 و 30 pmol من الحمض النووي. وبالتالي فإن استخدام 10٪ من منطقة التوليف سوف تحمل فقط حوالي 3 pmol من الحمض النووي.
الشكل 1 . الهياكل الكيميائية للحمض النووي والفوسفوراميدات الحمض النووي الريبي المستخدمة في توليف oligonucleotide عن طريق التصوير الضوئي microarray. وتستخدم مجموعات الحماية الحساسة للضوء في 5'-OH في الحمض النووي العادي والحمض النووي الريبي التوليف microarray لأغراض التهجين. لتوليف مكتبات الحمض النووي المعقدة، ويفضل أكثر photolabile البنزيل-NPPOC (BzNPPOC) في 5'-OH، كما تتم إزالة BzNPPOC ضعف سرعة NPPOC، مما يقلل بشكل كبير من مجموع الوقت التوليف microarray. الحمض النووي oligonucleotides للمكتبات تتطلب أيضا اقتران مونومر dT قابل للتصلب في نهاية 3'. هذا مونومر، الذي يحمل وظيفة استر succinyl، سيتم شق أثناء إزالة الحماية، مما يسمح للحمض النووي ليتم جمعها من رقاقة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2 . مثال على قناع كملف صورة تم إرساله إلى جهاز micromirror أثناء التعرض للأشعة فوق البنفسجية. البيكسلات البيضاء تتوافق مع المرايا التيسيتم إمالة في "ON" الموقف، مما يعكس ضوء الأشعة فوق البنفسجية على الخلية التوليفية. بكسل أسود تتوافقمع "OFF" المرايا، حيث سيتم عكس ضوء الأشعة فوق البنفسجية بعيدا عن الخلية. وبالتالي فإن بكسل الأبيض تسمح لاقتران الفوسفوراميديت واردة المقبل على oligonucleotides وجدت في الميزات المقابلة على ركائز الزجاج. Oligonucleotides توليفها على الميزات التي المرايا المقابلة هي، في هذا الملف قناع، سوف بكسل أسود ومع ذلك تبقى خاملة خلال الحدث اقتران المقبل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3 . صور من التصوير الضوئي microarray البصرية والإعداد التوليف. (أ) الدائرة البصرية للتعرض للأشعة فوق البنفسجية. يتم أولاً تجانس ضوء الأشعة فوق البنفسجية من الأشعة فوق البنفسجية-LED من خلال أنبوب ضوء مستطيل عبر المقطع ثم ينعكس على المرايا الدقيقة. سوف تعكس المرايا الدقيقة التي تم إمالة في موقف "OFF" الأشعة فوق البنفسجية بعيدا عن الخلية التوليفية، ولكن micromirrors في موقف "ON" سوف تعكس الضوء على الخلية التوليفية، وتقع في المستوى البؤري، من خلال المرور أولا من خلال 1:1 Offner التتابع نظام التصوير. (ب) خلية التوليف، بمجرد تجميعها، تتكون من شريحة حفر وضعت أولا على كتلة الكوارتز من الخلية، مفصولة طوقا PTFE سميكة (لم تظهر). ثم يتم وضع شريحة ثانية غير محفورة فوق الشريحة المحفورة، مفصولة طوقا PTFE رقيقة. إطار معدني (غير مبين) يحمل التجميع معا. (C). لإعداد المكتبة، وبمجرد أن يتم إرفاق الخلية التوليفية في المستوى البؤري للضوء الأشعة فوق البنفسجية واردة، يتم تعبئة الغرفة الواقعة بين كتلة الكوارتز والشريحة المحفورة مع حل 1٪ من β-كاروتين في CH2Cl2. للقيام بذلك، يتم إرفاق مدخل إضافي وأنابيب منفذ إلى كتلة الكوارتز والحل البرتقالي يتدفق من أقصى اليمين إلى أقصى اليسار. يظهر تدفق الكواشف والمذيبات للتوليف في الأسهم البيضاء. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4 . منطقة التوليف عادة ما تكون مرئية للعين المجردة. هنا، يمكن رؤية مكتبة الحمض النووي على سطح الزجاج مباشرة بعد التوليف، مع الحمض النووي لا يزال في شكل محمي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 5 . اختبارات التهجين إلى الحمض النووي 25mer وتسلسل الحمض النووي الريبي توليفها في الموقع على microarrays. (أ) مسح الفلورة من الحمض النووي الهجين بأكمله وmicroarray RNA. يتم هجين الحمض النووي 25mer وoligonucleotides RNA إلى خيوط هامة تسمى Cy3. تم مسح المصفوفة بالليزر على طول موجة الإثارة 532 نانومتر، عند دقة 5 ميكرومتر. (ب) كثافة الفلورة (وحدات تعسفية) من الحمض النووي: الحمض النووي والحمض النووي الريبي: الحمض النووي المزدوج في ثلاث تجارب منفصلة. يمكن اعتبار البيانات الخضراء الخفيفة لـ RNA oligonucleotides في الموقع غير الأمثل، بالمقارنة مع كثافة الفلورة لتسلسلات الحمض النووي المقابلة. أشرطة الخطأ هي SD. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
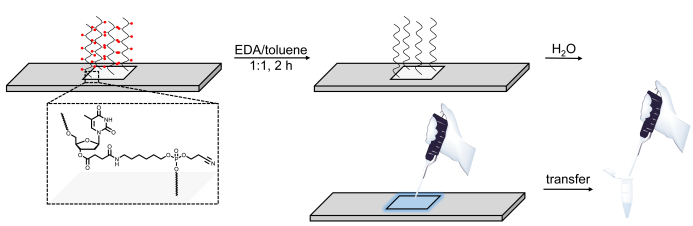
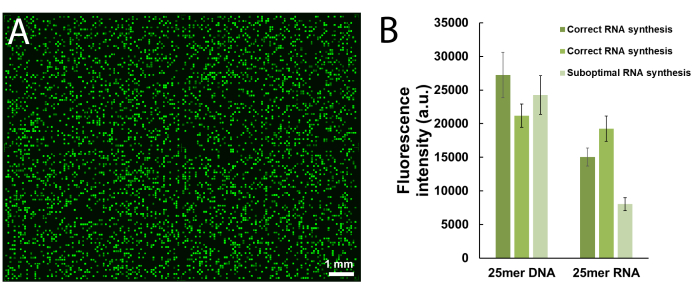
الشكل 6 . التمثيل التخطيطي لإجراءات إزالة الحماية والانقسام والاسترداد لمكتبات الحمض النووي التي تم تصنيعها على المصفوفات الدقيقة. وتزرع تسلسل اتّجاهات الحمض النووي على نيوكليوسايد dT حساسة للقاعدة (كما هو موضح في المنطقة التي تم تكبيرها). بعد التوليف، وإزالة الحماية من oligonucleotides الحمض النووي (يتم تمثيل مجموعات حماية قاعدة كما المجالات الحمراء) في EDA / تولوين يترك المواد غير المحمية متجهة كهربائيا إلى السطح، ويمكن بعد ذلك أن يكون pipetted من خلال تطبيق كمية صغيرة من المياه على المنطقة توليفها. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
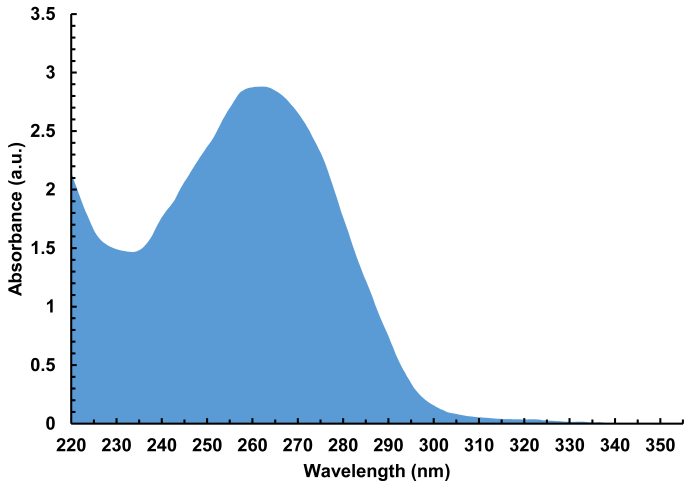
الشكل 7 . طيف الامتصاص التمثيلي (220 - 350 نانومتر) لمكتبة الحمض النووي المُحلَّبة والمملحة التي تحتوي على 000 4 تسلسل مختلف، بطول 100-nt. تم عزل ما مجموعه 940 نانوغرام من الحمض النووي من توليف صفيف واحد، المقابلة ل30 pmol من مجموع الحمض النووي، أو 15 pmol لكل الركيزة الزجاجية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
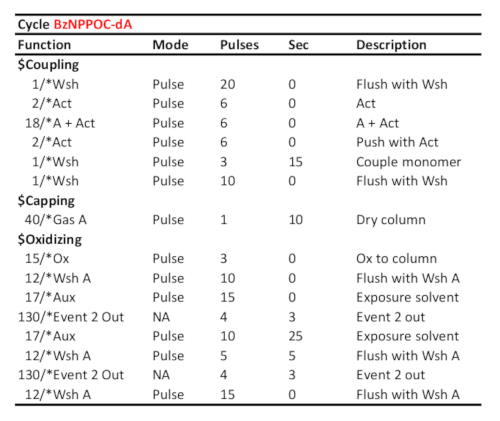
الجدول 1 بروتوكول دورة تمثيلية لاقتران/أكسدة/photodeprotection من 5'-BzNPPOC-dA، على افتراض أن الفوسفوراميدات المقابلة تم تحميلها على المنفذ "A". يظهر وقت اقتران (بالثواني) في خط "الزوجين مونومر". يتم حساب وقت الحماية الضوئية للأشعة فوق البنفسجية، هنا المقابلة لطاقة مشعة من 3 J / سم2 (BzNPPOC الكيمياء الضوئية)، والوقت المنقضي بين اثنين من إشارات الاتصال "الحدث 2 خارج".
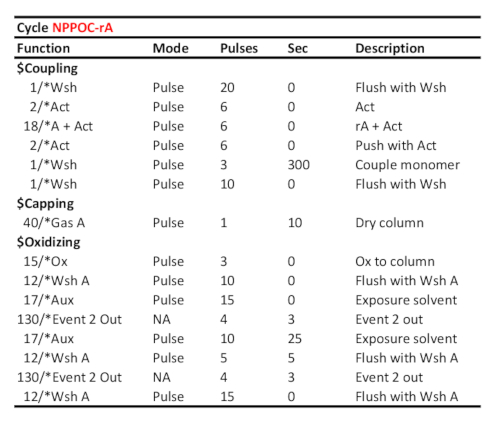
الجدول 2 بروتوكول دورة تمثيلية لاقتران / أكسدة / photodeprotection من 5 '-NPPOC-rA، على افتراض أن الفوسفوراميدات RNA المقابلة تم تحميلها على ميناء "A". يظهر وقت اقتران (بالثواني) في خط "الزوجين مونومر". يتم حساب وقت الحماية الضوئية للأشعة فوق البنفسجية، هنا المقابلة لطاقة مشعة من 6 J / سم2 (الكيمياء الضوئية NPPOC)، كما الوقت المنقضي بين اثنين من إشارات الاتصال "الحدث 2 خارج".
Discussion
تركيب الحمض النووي والحمض النووي الريبي في المرحلة الصلبة هو الخبز والزبدة من كل مختبر كيمياء حمض نووي، وعلى الرغم من أن إضافة مكون التصوير الضوئي هو عملية معقدة باعتراف الجميع، تصنيع microarray بوساطة ضوء الأشعة فوق البنفسجية هو أيضا عملية موثوقة جدا . وهو، بالإضافة إلى ذلك، الطريقة الوحيدة المتاحة لتوليف الحمض النووي الريبي في الموقع على المصفوفات الدقيقة. ومع ذلك، وكما هو الحال في أي إجراء تجريبي متعدد المراحل، هناك مجال واسع للخطأ البشري.
ربما الخطوة الأكثر أهمية هي اقتران الفوسفوراميديت، كما أنه يحتاج إلى أن يكون باستمرار رد فعل كيميائي عالي الغلة من أجل تحمل oligonucleotides مع عدد قليل من الأخطاء الاصطناعية. في بروتوكول نا microarray التوليف، اقتران الفوسفوراميديت هو أكثر محورية لنوعية التوليف الشاملة منذ عملية التصنيع يتجاوز السد ويمنع تنقية oligonucleotide. وقد تم حساب كفاءة اقتران خطوة فوق 99٪ لجميع الحمض النووي الحساس ة للضوء والفوسفوراميدات الحمض النووي الريبي، حتى لأوقات اقتران قصيرة جدا (15 ق)24 ولكن انخفاض غلة اقتران يمكن أن تحدث في بعض الأحيان، لا سيما في حالة أميديات dG. وقد تم التحقيق في استقرار الفوسفوراميدات الذوبانفية في درجة حرارة الغرفة من قبل، وتبين أن تعتمد على طبيعة النيوكليوbase، مع الفوسفورالوراميدات الغوانوسين عرضة للتدهور واسعة النطاق في غضون أيام فقط29، 30. ولكن عند تخزينها في -25 درجة مئوية، تم العثور على الفوسفوراميدات dG المذاب ة في ACN كحل 30 mM لتكون مستقرة لعدة أسابيع. عدم الاستقرار النسبي لحلول الفوسفوراميديت dG في درجة حرارة الغرفة لا يعني مع ذلك أنه لا ينبغي أن تبقى تعلق على المزج الحمض النووي لعدة أيام.
بالنسبة للفسفور الريبي، يعتمد عائد الاقتران بشكل كبير على جودة الفوسفوراميديت (والتي يمكن تقييمها بواسطة مطيافية P NMR 31)ووقت الاقتران. أوقات اقتران 5 دقائق لrA، rG، rC و 2 دقيقة لrU تبدو ضرورية. في الواقع، وجدنا أن تقصير وقت التكثيف إلى 2 دقيقة لجميع الفوسفوراميدات الحمض النووي الريبي أدى إلى إشارات التهجين أقل بكثير.
المزج الحمض النووي نفسه، فضلا عن الكواشف والمذيبات، يحتاج بالتأكيد إلى أن تكون نظيفة قدر الإمكان من أجل تحقيق أعلى عائد من توليف oligonucleotide. ومع ذلك، المواد غير القابلة للذوبان، والأملاح أو الجسيمات، يمكن أن تتراكم مع مرور الوقت في خطوط وأنابيب نظام التسليم، مما يؤدي إلى انخفاض تدريجي في استهلاك الكواشف والفاعلين. حيث التنظيف العام للمركب لا يحل انخفاض حجم الإخراج، يمكن أن تكون زيادة في عدد البقول حلا بديلا. مفيدة بشكل خاص في حالة انخفاض استهلاك الفوسفوراميديت، يمكن أن يكون الخط في بروتوكول اقتران المقابلة لضخ مزيج من الفوسفوراميدات والمنشط (السطر الثالث من القسم الفرعي اقتران في الجدول 1 والجدول 2) تعديل، من 6 إلى 9 نبضات دون أي تأثير سلبي ملموس على جودة التوليف. وعلاوة على ذلك، فإن عدد نبضات المنشط اللازمة لجلب مزيج أميديت/المنشط إلى الركيزة التوليفية (حاليا6، السطر الرابع في القسم الفرعي اقتران، انظر الجدول 1 والجدول 2)يعتمد على المزج الحمض النووي نفسه وكذلك على طول الأنابيب في الخلية التوليفية. ويمكن تعديل هذا الرقم بعد استبدال الفوسفوراميديت مع محلول ملون وحساب عدد البقول اللازمة لدفع المزيج الملون إلى الركيزة الزجاجية لاقتران.
الطريقة الموصوفة هنا يسمح لتوليف الحمض النووي والحمض النووي الريبي للمضي قدما في وقت واحد، على نفس المصفوفة الدقيقة. ويمكن أيضا ً إعداد هجين اتّاس الحمض النووي والحمض النووي الريبيّ دون أي تغيير في بروتوكولات تصنيع الصفيف، وطالما تم اتباع بروتوكول إزالة الحماية الثلاثي الخطوات. ومع ذلك، تجدر الإشارة إلى أن النُحِشّيات الدقيقة الحمض النووي الريبي فقط لا تتطلب سوى إزالة الحماية من خطوتين: التفكيك أولاً مع Et3N متبوعاً بالهيدروكسيل وإزالة الحماية الأساسية مع الهيدرازين. وقد تبين أن النيوكليوالقواعد النووية للحمض النووي غير محمية تماماً في ظل هذه الظروف، وتحتاج إلى خطوة إضافية في هيئة النهوض بالجماعة من أجل إحداث الإزالة الكاملة لمجموعات فينوكسياسيتيل (باك). هذا العلاج الإضافي مع EDA أقصر (5 دقائق) من لإزالة الحماية القياسية من microarrays الحمض النووي31، ولكن يكفي لدفعه إلى الانتهاء بعد العلاج ثلاثي إيثيلامين والهيدرازين. وبالإضافة إلى ذلك، فإن وقت رد الفعل القصير مع EDA يحد من تعرض oligonucleotide RNA غير المحمية بالكامل إلى الظروف الأساسية.
ميزة توليف مجموعة RNA في الموقع على طرق بديلة مثل اكتشاف أو نسخ الحمض النووي32،33،34 هو القدرة على تخزين رقاقة RNA توليفها في شكل محمي حتى الاستخدام ، وبالتالي تجنب خطر تدهور الحمض النووي الريبي المحتمل. الإجراءات ما بعد الاصطناعية لRNA لا، من ناحية أخرى، يعني أن المواد الاستهلاكية والكواشف يتم الاحتفاظ معقمة وأن يتم التعامل في ظل ظروف خالية من RNase. وتجدر الإشارة إلى أن إضافة مثبطRNase إلى مزيج التهجين لم تسفر عن إشارات تهجين أقوى لميزات RNA.
إن تركيب مكتبات الحمض النووي على مونومر حساس للقاعدة أكثر تعقيداً من تركيب عدد قليل من تسلسلات التحكم على السطح، وعلى هذا النحو فهو بالتأكيد أكثر عرضة لأخطاء التصميم. ومع ذلك، وعلى افتراض أن تصميم التسلسل (أي طبيعة التسلسلات وعددها) صحيح، فإن تحويل هذه القائمة إلى مجموعة من أقنعة التعرض وسلسلة مرتبة من دورات الاقتران لا يزال عملية مباشرة. ومع ذلك، توجد اختلافات هامة من توليف الصفيفات الدقيقة القياسية وهي حاسمة لنجاح تصنيع صفيف مكتبة عالي الكثافة.
أولاً، يتم الجمع بين مونومر dT الحساس ة القاعدة كأول فوسفوريميت بعد تركيب الرابط. تم العثور على العائداقتران من هذا مونومر (الشكل 1) أن تكون منخفضة نسبيا، حوالي 85٪28،وهذا هو السبب في بذل الجهود لتحسين معدل التأسيس، إما عن طريق زيادة تركيزها في ACN من 30 MM إلى 50 MM، أو عن طريق تكرار خطوة اقتران: اثنين من ردود الفعل اقتران متتالية باستخدام مونومرات جديدة، أو اثنين من دورات اقتران منفصلة ولكن متتالية.
التغيير الثاني هو إضافة محلول بيتا كاروتين في الغرفة الخلفية للخلية التوليفية، والتي تمتص مريح 365 نانومتر الضوء. هذا هو تعديل مهم من إعداد التصوير الضوئي كما أنه يمنع ضوء الأشعة فوق البنفسجية من التفكير مرة أخرى على الركيزة مجموعة. في الواقع، بعد عبور الوسط الخلالي بين الركائز، يخرج ضوء الأشعة فوق البنفسجية الواردة من خلال الشريحة حفر وتصل إلى كتلة الكوارتز من الخلية. المعادلات فريسنل توقع أن ~ 4٪ من الأشعة فوق البنفسجية الحادث عموديا سوف تعكس من كل من واجهات الهواء والزجاج المصب الثلاثة (الجانب الخروج من الركيزةالثانية وكلا الجانبين من كتلة الكوارتز) والعودة إلى الركيزة التوليف، مما يؤدي إلى التعرض غير المقصود للoligonucleotides المحمية ضوئيا. كما يسهم الانعراج والتشتت في إزالة الحماية الضوئية "خارج الهدف"، وبالتالي في إدراج النيوكليوتيد، مما يؤثر بشكل مباشر على معدل الخطأ في التوليف، ولكن هذه المساهمات أصغر بكثير من الانعكاسات ويمكن معالجتها أساساً عن طريق الحد من الكثافة التوليفية (ترك الفجوات بين الميزات). لقد وجدنا أن مستوى محلول بيتا كاروتين في الغرفة السفلى من الخلية يميل إلى الانخفاض قليلا فقط خلال الدقائق الأولى من توليف مجموعة، وبالتالي يحتاج إلى رصد هاوتعديلها.
وأخيراً، فإن التغيير الثالث هو حل إزالة الحماية، ليحل محل EtOH للتولوين، الذي يحافظ على مكتبة الحمض النووي المُلَفَلّة مرتبطة بالسطح، ويفترض أن يكون ذلك من خلال التفاعلات الكهروستاتيكية. تطبيق كمية صغيرة من المياه على منطقة التوليف بعد غسل ACN يسمح للمكتبة ليتم جمعها بسهولة. العملية مهما فقط ناجحة إن الماء محتوى في [إدا] و [تولوين] حدّ أدنى, يجعل ال [نوكليك سد] تماما غيرقابل للذوبان في الحماية كوكتيل. بدلا من ذلك، قد تكون مكتبات الحمض النوويمقطع قبالة رقاقة باستخدام الأمونيا 9،10،14،35،ثم مزيد من الحماية عن طريق تسخين محلول الأمونيا المائية التي تحتوي على الحمض النووي إلى 55 درجة مئوية بين عشية وضحاها. إن استعادة مكتبات الحمض النووي باستخدام الأمونيا غير متوافقة مع الحمض النووي الريبي. يمكن أن يكون rna oligonucleotides على الركيزة قاعدة مقولبة من السطح باستخدام نفس الإجراء EDA / التولوين المذكورة أعلاه، ولكن فقط في المرحلة قبل الأخيرة بعد Et3N وhydrazine اثنين من خطوة استراتيجية إزالة الحماية28.
الاستراتيجيات البديلة لاستعادة برك oligonucleotide من المصفوفات الدقيقة دون الحاجة إلى علاج أساسي محدد موجودة، متوافقة من حيث المبدأ مع التصوير الضوئي وتعتمد على استخدام الإنزيمات. على سبيل المثال، يمكن أن يكون النيوكليوتيد الديوكسيأوراسيل واحد هدفا لorcil-DNA غليكوزيلاز (UDG) ومقتطعة من بقية تسلسل الحمض النووي، أو وحدة RNA واحدة يمكن التعرف عليها من قبل إنزيمات RNase H من النوع 2 ورابطة فوسفوديستر 5' إلى RNA مقطع ، والإفراج عن جزء الحمض النووي 5 '23.
لدينا الآن طريقة قوية وموثوق بها وعالية الكثافة لتركيب الحمض النووي، RNA، والحمض النووي الهجين / RNA microarrays. هذه لا يمكن أن تكون فقط بمثابة منصات للتهجين أو الاختبارات ملزمة36، ولكنها تمثل أيضا وسيلة سريعة وغير مكلفة لإنتاج مكتبات الأحماض النووية المعقدة. وبالنسبة لتخزين البيانات الرقمية المستندة إلى الحمض النووي، قد يصبح التصوير الضوئي للصفيف اتّصالي ّ ة حلمحتمل لاختناق "الكتابة" (أي ترميز المعلومات عن طريق التوليف). يعتمد النجاح في الترميز الرقمي على الحمض النووي وفي تجميع الجينات دي نوفو على الإخلاص التسلسل الذي، على مستوى التوليف، يترجم إلى معدل الخطأ. سيتم مناقشة الأخطاء التركيبية والبصرية في بروتوكولات تصنيع الصفيف الحالية الخاصة بنا والإبلاغ عنها في أماكن أخرى. وبالتوازي مع ذلك، تُبذل الآن جهود لزيادة حجم التصنيع والإنتاجية.
Disclosures
ويشهد أصحاب البلاغ بأنهم لا ينتمون إلى أي منظمة تستهدف الربح.
Acknowledgements
وقد دعم هذا العمل صندوق العلوم النمساوي (منح الاتحاد من الهبات P23797 وP27275 وP30596) والمؤسسة الوطنية السويسرية للعلوم (منحة #PBBEP2_146174).
Materials
| Name | Company | Catalog Number | Comments |
| Slide functionalization | |||
| Acetic acid >99.8% | Sigma | 33209 | For RNA deprotection |
| CNC router | Stepcraft | 300 CK | |
| Ethanol absolute | VWR | 1.07017.2511 | For deprotection and functionalization |
| N-(3-triethoxysilylpropyl)-4-hydroxybutyramide | Gelest | SIT8189.5 | Silanizing reagent |
| Nexterion Glass D microscope slides | Schott | 1095568 | |
| Polymax 1040 | Heidolph | Orbital shaker | |
| Proclean 507 Ultrasonic water bath | Ulsonix | To clean slides after drilling | |
| Tickopur RW 77 Special Purpose Cleaner | Sigma | Z860086 | To clean slides after drilling |
| Microarray synthesis | |||
| 0.25 M dicyanoimidazole in ACN | Biosolve | 0004712402BS | Activator |
| 0.7 XGA DMD | Texas Instruments | Digital Micromirror Device | |
| 20 mM I2 in pyridine/H2O/THF | Sigma | L860020-06 | Oxidizer |
| 250 μm thick Chemraz 584 perfluoroelastomer | FFKM | Lower teflon gasket | |
| 2'-O-ALE RNA phosphoramidites | ChemGenes | ||
| 365 nm high-power UV-LED | Nichia | NVSU333A | |
| 5'BzNPPOC DNA phosphoramidites | Orgentis | ||
| 5'NPPOC DNA phosphoramidites | FlexGen | ||
| Acetonitrile | Biosolve | 0001205402BS | For DNA synthesis |
| Amidite Diluent for DNA synthesis | Sigma | L010010 | For dissolving phosphoramidites |
| Cleavable dT | ChemGenes | Base-sensitive monomer for library preparation | |
| DMSO | Biosolve | 0004474701BS | As exposure solvent |
| DNA and RNA microarray deprotection | |||
| Ethylenediamine >99.5% | Sigma | 3550 | For deprotection |
| Expedite 8909 | PerSeptive Biosystems | DNA synthesizer | |
| Hydrazine hydrate 50-60% hydrazine | Sigma | 225819 | For RNA deprotection |
| Imidazole | Sigma | 56750 | |
| Industrial Strength lower-density PTFE tape | Gasoila | Thin, upper teflon gasket | |
| Pyridine >99% | Sigma | P57506 | For RNA deprotection |
| Triethylamine >99% | Sigma | T0886 | For RNA deprotection |
| β-carotene | Sigma | C9750 | For library preparation |
| Hybridization and scanning | |||
| 20x Sodium Saline Citrate | Roth | 1054.1 | |
| 5'Cy3-labelled complementary strand | Eurogentec | For duplex hybridization | |
| Biopur Safe-Lock microcentrifuge tube | Eppendorf | ||
| BSA (10 mg/mL) | Promega | R3961 | |
| EDTA molecular biology grade | Promega | H5031 | |
| GenePix 4100A | Molecular Devices | Microarray scanner | |
| Hybridization oven | Boekel Scientific | 230500 | |
| MES monohydrate | Sigma | 69889 | |
| MES sodium | Sigma | M3058 | |
| NaCl >99.5% | Sigma | 71376 | |
| SecureSeal SA200 hybridization chamber | Grace BioLabs | 623503 | |
| Spectrafuge mini | Labnet | C1301 | Microarray centrifuge |
| Tween-20 molecular biology grade | Sigma | P9416 | |
| Data extraction | |||
| Excel | Microsoft | For data extraction | |
| MatLab | MathWorks | Microarray design | |
| NimbleScan 2.1 | Roche NimbleGen | ||
| Desalting and quantification | |||
| NanoDrop One Spectrophotometer | Thermo Scientific | ||
| Toluene | Merck | ||
| ZipTip C18 | Millipore | ZTC18s008 | Desalting pipet tips |
References
- Bumgarner, R. Current protocols in molecular biology. 101, 22(2013).
- Berger, M. F., Bulyk, M. L. Universal protein-binding microarrays for the comprehensive characterization of the DNA-binding specificities of transcription factors. Nature Protocols. 4 (3), 393-411 (2009).
- Tietjen, J. R., Donato, L. J., Bhimisaria, D., Ansari, A. Z. Sequence-specificity and energy landscapes of DNA-binding molecules. Methods in enzymology. 497, 3-30 (2011).
- Katilius, E., Flores, C., Woodbury, N. W. Exploring the sequence space of a DNA aptamer using microarrays. Nucleic Acids Research. 35 (22), 7626-7635 (2007).
- Franssen-van Hal, N. L. W., et al. Optimized Light-Directed Synthesis of Aptamer Microarrays. Analytical Chemistry. 85 (12), 5950-5957 (2013).
- Matteucci, M. D., Caruthers, M. H. Nucleotide Chemistry .4. Synthesis of Deoxyoligonucleotides on a Polymer Support. Journal of the American Chemical Society. 103 (11), 3185-3191 (1981).
- Eroshenko, N., Kosuri, S., Marblestone, A. H., Conway, N., Church, G. M. Gene Assembly from Chip-Synthesized Oligonucleotides. Current Protocols in Chemical Biology. 2012, (2012).
- Kosuri, S., et al. Scalable gene synthesis by selective amplification of DNA pools from high-fidelity microchips. Nature Biotechnology. 28 (12), 1295(2010).
- Richmond, K. E., et al. Amplification and assembly of chip-eluted DNA (AACED): a method for high-throughput gene synthesis. Nucleic Acids Research. 32 (17), 5011-5018 (2004).
- Schmidt, T. L., et al. Scalable amplification of strand subsets from chip-synthesized oligonucleotide libraries. Nature Communications. 6, (2015).
- Grass, R. N., Heckel, R., Puddu, M., Paunescu, D., Stark, W. J. Robust Chemical Preservation of Digital Information on DNA in Silica with Error-Correcting Codes. Angewandte Chemie International Edition. 54 (8), 2552-2555 (2015).
- Erlich, Y., Zielinski, D. DNA Fountain enables a robust and efficient storage architecture. Science. 355 (6328), 950-953 (2017).
- Garalde, D. R., et al. Highly parallel direct RNA sequencing on an array of nanopores. Nature Methods. 15 (3), 201-206 (2018).
- Cleary, M. A., et al. Production of complex nucleic acid libraries using highly parallel in situ oligonucleotide synthesis. Nature Methods. 1 (3), 241-248 (2004).
- LeProust, E. M., et al. Synthesis of high-quality libraries of long (150mer) oligonucleotides by a novel depurination controlled process. Nucleic Acids Research. 38 (8), 2522-2540 (2010).
- Lietard, J., Damha, M. J., Somoza, M. M. Enzymatic and Chemical Synthesis of Nucleic Acid Derivatives. Fernández-Lucas, J. , Wiley Online Books. (2018).
- Fodor, S. P. A., et al. Spatially Addressable Parallel Chemical Synthesis. Science. 251 (4995), 767-773 (1991).
- Singh-Gasson, S., et al. Maskless fabrication of light-directed oligonucleotide microarrays using a digital micromirror array. Nature Biotechnology. 17 (10), 974-978 (1999).
- Pease, A. C., et al. Light-Generated Oligonucleotide Arrays for Rapid DNA-Sequence Analysis. Proceedings of the National Academy of Sciences of the United States of America. 91 (11), 5022-5026 (1994).
- Holz, K., Lietard, J., Somoza, M. M. High-Power 365 nm UV LED Mercury Arc Lamp Replacement for Photochemistry and Chemical Photolithography. ACS Sustainable Chemistry & Engineering. 5 (1), 828-834 (2017).
- Lackey, J. G., Mitra, D., Somoza, M. M., Cerrina, F., Damha, M. J. Acetal Levulinyl Ester (ALE) Groups for 2′-Hydroxyl Protection of Ribonucleosides in the Synthesis of Oligoribonucleotides on Glass and Microarrays. Journal of the American Chemical Society. 131 (24), 8496-8502 (2009).
- Lackey, J. G., Somoza, M. M., Mitra, D., Cerrina, F., Damha, M. J. In-situ chemical synthesis of rU-DNA chimeras on chips and enzymatic recognition. Chimica Oggi-Chemistry Today. 27 (6), 30-33 (2009).
- Lietard, J., Ameur, D., Damha, M., Somoza, M. M. High-density RNA microarrays synthesized in situ by photolithography. Angewandte Chemie International Edition. 57 (46), 15257-15261 (2018).
- Agbavwe, C., et al. Efficiency, Error and Yield in Light-Directed Maskless Synthesis of DNA Microarrays. Journal of Nanobiotechnology. 9, (2011).
- Sack, M., et al. Express photolithographic DNA microarray synthesis with optimized chemistry and high-efficiency photolabile groups. Journal of Nanobiotechnology. 14, (2016).
- Kretschy, N., Holik, A. K., Somoza, V., Stengele, K. P., Somoza, M. M. Next-Generation o-Nitrobenzyl Photolabile Groups for Light-Directed Chemistry and Microarray Synthesis. Angewandte Chemie International Edition. 54 (29), 8555-8559 (2015).
- Sack, M., Kretschy, N., Rohm, B., Somoza, V., Somoza, M. M. Simultaneous Light-Directed Synthesis of Mirror-Image Microarrays in a Photochemical Reaction Cell with Flare Suppression. Analytical Chemistry. 85 (18), 8513-8517 (2013).
- Lietard, J., et al. Base-cleavable microarrays for the characterization of DNA and RNA oligonucleotides synthesized in situ by photolithography. Chemical Communications. 50 (85), 12903-12906 (2014).
- Krotz, A. H., et al. Solution stability and degradation pathway of deoxyribonucleoside phosphoramidites in acetonitrile. Nucleosides Nucleotides & Nucleic Acids. 23 (5), 767-775 (2004).
- Hargreaves, J. S., Kaiser, R., Wolber, P. K. The Degradation of Dg Phosphoramidites in Solution. Nucleosides Nucleotides & Nucleic Acids. 34 (10), 691-707 (2015).
- McGall, G. H., et al. The efficiency of light-directed synthesis of DNA arrays on glass substrates. Journal of the American Chemical Society. 119 (22), 5081-5090 (1997).
- Collett, J. R., et al. Functional RNA microarrays for high-throughput screening of antiprotein aptamers. Analytical Biochemistry. 338 (1), 113-123 (2005).
- Buenrostro, J. D., et al. Quantitative analysis of RNA-protein interactions on a massively parallel array reveals biophysical and evolutionary landscapes. Nature Biotechnology. 32 (6), 562-568 (2014).
- Wu, C. -H., Holden, M. T., Smith, L. M. Enzymatic Fabrication of High-Density RNA Arrays. Angewandte Chemie International Edition. 53 (49), 13514-13517 (2014).
- Tian, J., et al. Accurate multiplex gene synthesis from programmable DNA microchips. Nature. 432 (7020), 1050-1054 (2004).
- Lietard, J., et al. Mapping the affinity landscape of Thrombin-binding aptamers on 2'F-ANA/DNA chimeric G-Quadruplex microarrays. Nucleic Acids Research. 45 (4), 1619-1632 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved