Method Article
باستخدام الإنسان المستحثة الخلايا الجذعية مستحث لتوليد خلايا T الأورام مستضد محدده
* These authors contributed equally
In This Article
Summary
توضح هذه المقالة طريقه لتوليد الوظيفية الورم مستضد الخاصة المستحثة مستحث الخلايا الجذعية المشتقةCD8αβ + أحاديه الخلية T ايجابيه باستخدام OP9/DLL1 نظام الثقافة المشتركة.
Abstract
توليد وتوسيع الخلايا الوظيفية T في المختبر يمكن ان يؤدي إلى مجموعه واسعه من التطبيقات السريرية. أحد هذه الاستخدامات هو لعلاج المرضي الذين يعانون من سرطان متقدمة. وقد ثبت ان نقل الخلايا T بالتبني (ACT) من الخلايا العالية التخصيب مستضد الأورام الخاصة تسبب انحدار دائم من السرطان المنتشر في بعض المرضي. ومع ذلك ، خلال التوسع ، قد تصبح هذه الخلايا استنفدت أو السكون ، والحد من وظيفتها المستجيب والثبات في الجسم المجري. قد المستحثة مستحث الخلايا الجذعية (iPSC) التكنولوجيا التغلب علي هذه العقبات من خلال المؤدية إلى توليد في المختبر من اعداد كبيره من الخلايا T الأورام اقل تمايزا المحددة. IPSC الإنسان (hiPSC) لديها القدرة علي التفريق في اي نوع من الخلايا الجسدية ، بما في ذلك اللمفاويات ، والتي تحتفظ الاصليه مستقبلات الخلية T (TCR) أعاده ترتيب الجينوم عندما يتم استخدام خليه T كخليه البداية. لذلك ، أعاده برمجه الخلايا البشرية الخاصة مستضد الورم إلى hiPSC متبوعا بالتمايز إلى سلاله الخلية T لديه القدرة علي إنتاج خلايا T الأورام التي تجدد شبابها المحددة. وصفت هنا طريقه لتوليد الأورام مستضد محددهCD8αβ + واحده ايجابيه (SP) خلايا T من hipsc باستخدام OP9/DLL1 نظام الثقافة المشتركة. هذه الطريقة هي أداه قويه لتوليد سلاله الخلايا T في المختبر وسوف تسهل تطوير خلايا T المستمدة من المختبر لاستخدامها في الطب التجديدي والعلاجات القائمة علي الخلايا.
Introduction
بالاضافه إلى المزايا الفسيولوجية ، الخلايا T لديها العديد من التطبيقات العلاجية المحتملة. ويمكن استخدام الجيل والتوسع في خلايا T في المختبر لنمذجة الامراض والتحقق من صحة العلاج ، فضلا عن مصدر لعلاج الدول الوراثية والمكتسبة من العوز المناعي (اي نقص المناعة الفيروسية والثانوية اللمفاوية العلاج الكيميائي أو زرع) والقضاء علي السرطان. وقد أدت هذه النوعية الاخيره إلى تطوير نقل الخلية T التبني (ACT) لعلاج المرضي الذين يعانون من سرطان متقدمة1.
ACT يتكون من أعاده إخراج الورم المريض ، واستخراج الخلايا الليمفاوية التسلل الورم (TILs) ، وتوسيع TILsالسابقينالجسم الخارجي ، ثم reinfusing الخلية الموسعة في المريض 2. وقد ثبت ان طريقه العلاج الفعال لبعض المرضي الذين يعانون من السرطان المنتشر. لسوء الحظ ، ليس كل المرضي يستجيبون لهذا العلاج. وقد أظهرت التقارير السابقة ان حاله التمايز من الخلايا المنقولة3،4،5،6،7،8،9، استخدام اعداد كبيره من الخلايا السرطانية العالية التخصيب الخاصة مستضد السرطان10، واستمرار الخلايا t بعد نقل11،12 كلها ترتبط مع ردود أكثر دواما13،14. ولذلك ، عندما يفشل ACT للحصول علي استجابه مضاده للورم ، فانه قد يكون جزئيا بسبب انخفاض الغلة من الخلايا السرطانية الخاصة مستضد السرطان ، والتوسع السابق غير فعاله التي تؤدي إلى استنفاد وفقدان الاستنساخ التفاعلية ، أو عدم الثبات بعد نقل4 . وقد افترض انه يمكن التغلب علي هذه العقبات من خلال توليد اعداد كبيره من خلايا T السرطانية الخاصة الأقل تمايزا في المختبر15,16.
الخلايا الجذعية/السلف التي تكون الدم (HSPCs) هي مصدر تقليدي لتوليد خلايا T في المختبر ، علي الرغم من ان هذه الطريقة محدوده بعدد صغير من الخلايا التي يمكن استعادتهامن متبرع واحد. كما تبين ان الخلايا الجذعية الجنينية (ESCs) تنتج خلايا T ولكن مع انخفاض الغلة17، مما يجعلها غير فعاله للتطبيقات السريرية. وعلاوة علي ذلك ، نظرا لان الخلايا السلالة T تجربه أعاده الدمج الجينية العشوائية من مستقبلات الخلية T (TCRs) في مراحل النمو في وقت مبكر ، فانه ليس من الممكن استخدام HSPCs أو ESCs لتوليد السكان النقي من خلايا T مستضد محدده دون مزيد من الجينوم التعديلات مثل محول الجينات TCR.
نهج واحد للتغلب علي هذه المحاذير هو أعاده برمجه TILs للخلايا الجذعية مستحث الإنسان المستحثة (hiPSCs) ، والتي قد توفر مصدرا لا حدود له في المختبر توليد الخلايا T. وقد تبين ان السرطان tils محدده مستضد يمكن أعاده برمجتها في hipscs والتفريق إلى السلالة t الخلية, الذي يحتفظ بنفس مستقبلات الخلية t (TCR) الجينات ترتيب كما الأصلي تي الخلية18,19. هذه التفاصيل مهمة بالنسبة للقانون لان أورام المريض الفردية لها ملامح فريدة من نوعها ، وقد ثبت ان عدد قليل جدا من مستضدات السرطان مشتركه بين المرضي20. ولذلك ، فان استخدام TILs الخاصة بالسرطان كمصدر للجيل المختبر من خلايا T المشتقة من hiPSC قد يوفر استراتيجية جديده للمعالجة الشخصية للمرضي المصابين بالسرطان المنتشر.
ويرد هنا بالتفصيل بروتوكول للتمييز بين خلايا السلالة T المشتقة من hiPSC في خلاياCD8αβ الوظيفية الخاصة بالمولدات المناعية الخاصة (SP) باستخدام OP9/DLL1. هذا الأسلوب هو أداه قويه في المختبر التمايز الخلية T من hiPSCs ، الأسلاف التي تكون الدم ، والخلايا الجذعية الجنينية ، فضلا عن تطبيقاتها الأخرى في الطب التجديدي والعلاجات القائمة علي الخلايا.
Protocol
1. كولتورينج الإنسان iPSCs (hiPSCs) علي الخلايا الليفية الجنينية الماوس (MEF)
ملاحظه: ويمكن أيضا استخدام الطرق البديلة لزراعه أفراس النهر ، بما في ذلك ولكن لا تقتصر علي: البذر علي 6 لوحه جيدا قبل المغلفة مع الجيلاتين ، وخليط البروتين الهلامي ، المؤتلف laminin 511 ، أو اي مصفوفة أخرى خارج الخلية المستخدمة في التوسع Hipscs ، و مثقف باستخدام وسائل الاعلام المحددة التي وضعت خصيصا لثقافة الخلايا الجذعية مستحث الإنسان.
-
الخياطة MEF
- معطف ثقافة خليه 10 سم طبق بيتري مع 4 مل من 0.1 ٪ من الجيلاتين واحتضان لمده 30 دقيقه في 37 درجه مئوية.
- ذوبان قارورة من 4 × 106 المشعة mef بسرعة إلى 10 مل من 37 درجه مئوية من وسائل الاعلام MEF (dmem + 10 ٪ + 1x البنسلين-ستربتوميسين + 1X L-الجلوتامين الملحق). الطرد المركزي في 300 x ز ل 5 دقيقه في 4 ° c. يستنشق ماده طافي وأعاده تعليق بيليه الخلية في 9 مل من وسائل الاعلام MEF.
- أزاله طبق الجيلاتين المغلفة من الحاضنة. يستنشق الجيلاتين وأضافه 7 مل من وسائل الاعلام MEF. لوحه 3 مل من التعليق MEF (من الخطوة 1.1.2) علي طبق الجيلاتين المغلفة. صخره الطبق جنبا إلى جنب والامام إلى الخلف لضمان توزيع حتى من MEF علي الطبق. احتضان في 37 درجه مئوية ل 8-36 ح.
-
العبور hiPSC علي MEF
ملاحظه: تم إنشاء البيانات باستخدام iPSC مارت-1 مشتقه من سرطان الجلد طويل الأجل المثقف TIL ، والتي تعترف علي وجه التحديد مارت-1 الببتيد في سياق هلا-A * 02:01 ، كما سبق وصفها18.- مرور hiPSCs عندما تكون المستعمرات بين 0.8-1.2 مم في القطر. قبل المرور ، تحقق مستعمرات hiPSC في المجهر ستيريو وأزاله اي مجالات التمايز من الثقافة باستخدام حافه بلاستيكية من تلميح 200 μL.
- الطامحين تنفق وسائل الاعلام وأضافه 10 mL hiPSC وسائل الاعلام (الإنسان وسائل الاعلام الثقافة [جدول المواد] + 10 نانوغرام/مل عامل النمو الخلايا الليفية الاساسيه البشرية [hbFGF]) تستكمل مع مثبطات الصخور 10 μM.
- عقد الطبق ثقافة الخلية في يد واحده ولفه أداه المرور الخلية القابل للتصرف عبر الطبق بأكمله في اتجاه واحد. تطبيق ما يكفي من الضغط بحيث شفره الاسطوانه بأكملها يمس الطبق الثقافة والحفاظ علي ضغط موحد اثناء العمل المتداول.
- تدوير طبق الثقافة 90 درجه وكرر الخطوة 1.2.3. عرض لوحه في المجهر لتاكيد بصريا القطع السليم من المستعمرات ، والتي ينبغي ان تظهر متقلب. افصل المستعمرات المقطعة بواسطة التنظيف الميكانيكي اللطيف باستخدام ماصه 200 μL.
ملاحظه: يجب ان يتم مفرزه من قطع المستعمرات عن طريق بيغ الميكانيكية علي الفور بعد قطع المستعمرات مع الاسطوانه ، لأنه بعد 3 دقائق سوف تبدا المستعمرات قطع لأعاده إرفاق إلى الطبق ، وسوف يصبح من الصعب فصل مستعمرات من حجم متجانس من قبل بيغ. - نقل 350-600 كتل من المستعمرات قطع علي طبق جديد 10 سم من MEF (مطلي 8-36 h قبل المرور hiPSC) مع 10 مل من وسائل الاعلام الطازجة hiPSC تستكمل مع مثبطات الصخور 10 μM. احتضان في 37 درجه مئوية.
ملاحظه: 600 الكتل يمثل تقريبا 1.0 × 106 مارت-1 ipsc وسوف تسفر عن 0.5-1.0 x 106 موانئ دبي الخلايا في اليوم 35. ومع ذلك ، سوف تختلف الأرقام المتوقعة تبعا لفاعليه خط الخلية البداية والظروف الثقافية. - في اليوم التالي ، والطامحين تنفق وسائل الاعلام وأضافه 10 مل من وسائل الاعلام hiPSC الطازجة. تغيير الوسائط hiPSC كل 1-2 أيام اعتمادا علي معدل النمو hiPSC.
2. اعداد خلايا OP9/DLL1 للثقافة المشتركة مع hiPSCs
- الثقافة OP9/DLL1 الخلايا في وسائل الاعلام OP9 [α-الحد الأدنى الاساسيه (α-ميم) + 20% مصل الأبقار الجنينية + 1x البنسلين-ستربتوميسين] في 37 درجه مئوية. عندما OP9/DLL1 الخلايا تصل إلى كونفلوينسي, يستنشق وسائل الاعلام ويغسل مره واحده مع 5 مل من 1x المغنيسيوم, الكالسيوم, والفينول الأحمر خاليه من الفوسفات مخزنه المالحة (تلفزيوني).
- يستنشق التلفزيونية وأضافه 2 مل من 0.05 ٪ تريبسين-أدتا. احتضان لمده 5 دقائق في 37 درجه مئوية. ثم ، أضافه 4 مل من وسائل الاعلام OP9 وفصل ميكانيكيا طبقه الخلية عن طريق التنضيد لجعل تعليق خليه واحده.
- نقل تعليق الخلية إلى أنبوب مخروطي 50 mL من خلال مصفاه الخلية 100 μm لتجنب كتل الخلية. الطرد المركزي في 300 x ز ل 5 دقيقه في 4 ° c. يستنشق ماده طافي وأعاده التعليق في 12 مل من وسائل الاعلام OP9.
- أضافه 8 مل من وسائل الاعلام OP9 إلى كل من سته جديده 10 سم خليه الثقافة الاطباق بيتري. لوحه 2 مل من OP9/DLL1 تعليق الخلية من الخطوة 2.3 علي كل جديد 10 سم طبق. صخره الطبق جنبا إلى جنب ثم الامام إلى الخلف لضمان توزيع حتى OP9/DLL1 علي الطبق.
- احتضان في 37 درجه مئوية. كرر المرور كل 2-3 يوما عندما تصل الخلايا إلى كونفلوينسي.
ملاحظه: من المهم لجعل ما يكفي من المخزون المجمدة من الخلايا OP9/DLL1 وذوبان الجليد الجديد كل 4-6 أسابيع.
3. في المختبر التمايز من hiPSCs فيCD8αβ + واحده ايجابيه (SP) خلايا T
- اعداد الجيلاتين OP9/DLL1 الاطباق أسبوع واحد قبل المشاركة في الثقافة مع hiPSCs. لاعداد 0.1 ٪ محلول الجيلاتين ، أضافه 5 مل من درجه حرارة الغرفة (RT) النسيج الصف الأوراق المالية حل الجيلاتين إلى 500 مل من تلفزيوني.
- معطف 3 جديده 10 سم خليه الثقافة بيتري الاطباق عن طريق أضافه 4 مل لكل طبق من 0.1 ٪ الجيلاتين. احتضان 30 دقيقه في 37 درجه مئوية.
- يستنشق الجيلاتين وأضافه 8 مل من وسائل الاعلام OP9 إلى كل طبق. مرور طبق واحد متموج من OP9/DLL1 (كما هو مبين في القسم 2 أعلاه) إلى ثلاثه اطباق الجيلاتين قبل المغلفة.
- بعد 4 أيام ، أضافه 10 مل من وسائل الاعلام OP9 إلى كل طبق 10 سم من OP9/DLL1 علي الجيلاتين ، لما مجموعه 20 مل من وسائل الاعلام لكل طبق.
- بعد 7-8 يوما ، تبدا الثقافة المشتركة hiPSC علي OP9/DLL1 متموج الاطباق (يوم التمايز 0).
- الطامحين أنفق وسائل الاعلام من متموج 10 سم طبق من hiPSCs علي MEF. أضافه 10 مل من وسائل الاعلام OP9. قطع وفصل مستعمرات hiPSC باستخدام أداه المرور الخلية القابل للتصرف كما هو القيام به في الخطوات 1.2.3 و 1-2.
- نقل 350-600 كتل من المستعمرات قطع علي 10 سم قبل الجيلاتين OP9/DLL1 طبق (الخطوة 3.1) مع 10 مل من وسائل الاعلام الطازجة OP9 باستخدام الماصة 200 μL. صخره الطبق الثقافة جنبا إلى جنب ثم الامام إلى الخلف لضمان توزيع حتى المستعمرات.
ملاحظه: بدلا من ذلك ، قد يتم استخدام الهيئات الجنينية hiPSC سابقه التشكيل (الحديدية) أو تعليق تكتل صغير. ومع ذلك ، يفضل استخدام أداه المرور الخلية القابل للتصرف أو نظام تشكيل EB لإنتاج كتل hiPSC من حجم موحد.
- في اليوم 1 ، يستنشق وسائل الاعلام المستهلكة واستبدال مع 20 مل من وسائل الاعلام الطازجة OP9. وسوف تظهر كتل hiPSC شارك في استزراعها علي OP9/DLL1 لمده 1 يوم كمستعمرات أحاديه الطبقة المستديرة الصغيرة (الشكل 1).
- في اليوم 5 ، يستنشق 10 مل من وسائل الاعلام المستهلكة وأضافه 10 مل من وسائل الاعلام الطازجة OP9. ستبدا مستعمرات hiPSC في التفريق في الأديم الوسطي البدائي ، والذي يتميز بمركز مظلم متعدد الطبقات.
- في اليوم 9 ، يستنشق 10 مل من وسائل الاعلام المستهلكة وأضافه 10 مل من وسائل الاعلام الطازجة OP9. عند هذه النقطة ، ستتطور الهياكل المركزية متعددة الطبقات إلى اشكال شبيهه بالقبة ، ستبدا منطقه شبيهه بالشبكة الطرفية تصبح واضحة.
- في اليوم 13 ، حصاد خلايا السلف التي تكون الدم (HPCs) (الشكل 1). وتتميز الهياكل المستمدة من hiPSC في اليوم 13 من الهيكل المركزي المظلم المحاط بشبكه من المناطق الشبيهة بالقبة ، وهي ممثله للمناطق التي تكون فيها الدم (HZs) التي ذكرت سابقا انها أرفقت بالخلايا الجذعية الجنينية المشتقة من الدم البشري 21-الآن
ملاحظه: يدل وجود الهياكل الشبيهة بالقبة علي عمليه ناجحه حتى في غياب المراكز المظلمة. قد يكون عدم القدرة علي إنتاج HPCs بسبب رداءه نوعيه OP9/DLL1 ، ونوعيه الكثير من الشحنات الصغيرة ، كونفلوينسي من كتل iPSC المصنفة علي OP9/DLL1 (الكتل 350-600 هو الأمثل) ، و/أو الاختلافات في قوه خطوط iPSC لإنتاج السلائف التي تكون الدم.- شفط السائل الإعلامي وغسل 1x مع 5 مل من 1x الفينول الأحمر خاليه من محلول الملح المتوازنة هانكس تعديل مع الكالسيوم والمغنيسيوم (HBSS).
- يستنشق HBSS وأضافه 250 μL من 5000 وحده/مل كولاجيناز الرابع في 10 مل من HBSS. احتضان في 37 درجه مئوية ل 45 دقيقه. يستنشق HBSS مع كولاجيناز الرابع ويغسل مره واحده مع 5 مل من تلفزيوني.
- يستنشق التلفزيونية وأضافه 5 مل من 0.25 ٪ تريبسين-أدتا. احتضان في 37 درجه مئوية لمده 20 دقيقه. ثم ، أضافه 4 مل من وسائل الاعلام OP9 وفصل طبقه الخلية عن طريق التنضيد لجعل تعليق خليه واحده.
- نقل تعليق الخلية إلى أنبوب مخروطي 50 mL من خلال مصفاه الخلية 100 μm. جهاز الطرد المركزي في 300 x g لمده 5 دقائق في 4 °c. يستنشق ماده طافي وأعاده التعليق في 10 مل من وسائل الاعلام OP9.
- لوحه تعليق خليه علي الجيلاتين الجديدة 10 سم خليه الثقافة طبق بيتري (انظر الخطوات 3-1-1 و 3-1-2). احتضان في 37 درجه مئوية لمده 45 دقيقه. ثم ، جمع الخلايا غير الملتصقة بواسطة الأنابيب لطيف.
- نقل التعليق الخلية التي تم جمعها إلى أنبوب مخروطي 50 mL من خلال مصفاه الخلية 100 μm. جهاز الطرد المركزي في 300 x g لمده 5 دقائق في 4 °c. يستنشق ماده طافي وأعاده التعليق في 10 مل من وسائل الاعلام التمايز [OP9 media مع 5 نانوغرام/مل عامل الخلايا الجذعية البشرية (hscf ثابته) ، 5 نانوغرام/مل Flt3 يجند الإنسان (hFLT3L) ، و 5 نانوغرام/مل انترلوكين الإنسان 7 (هيل-7)].
- لوحه تعليق الخلية علي الجديد 10 سم OP9/DLL1 متموج طبق.
- في اليوم 16 ، مرور الخلايا.
- افصل الخلايا غير الملتصقة ميكانيكيا بواسطة الماصات اللطيفة والفلتر من خلال مصفاه خلايا 100 μm. الطرد المركزي في 300 x ز ل 5 دقيقه في 4 ° c. يستنشق ماده طافي وأعاده التعليق في 10 مل وسائل الاعلام التمايز.
- لوحه تعليق الخلية علي الجديد 10 سم OP9/DLL1 متموج طبق.
- مواصله المرور الخلايا غير ملتصقة كل 5-7 أيام بعد ذلك عن طريق تكرار الخطوة 3.8.
- في اليوم 35 ، إثراءCD8 +الايجابيهالمزدوجة (DP) السكان وتحفيز لإنتاجCD8αβ + SP T الخلايا (الشكل 2).
- افصل الخلايا غير الملتصقة ميكانيكيا بواسطة الماصات اللطيفة والفلتر من خلال مصفاه خلايا 100 ميكرومتر لأزاله كتل الخلايا. إثراء السكانخلايا الخلية بواسطة العزلة المغناطيسية الخرزة التي وفقا لبروتوكول الشركة المصنعة.
ملاحظه: الأساس المنطقي لاستخدام الخرز المغناطيسي هوأزاله خلايا CD8- DN من الثقافة ، كما ثبت ان هذه تسبب القتل المباشر للخلايا +CD8 + DP بعدالتحفيز22. - الكونت يعيش الخلايا المخصبة باستخدام الكريات الدموية والصبغة الزرقاء التركان. تعليق في OP9 وسائل الاعلام في إجمالي تركيز 0.5 x 106 خلايا/مل. Aliquot 1 مل من تعليق الخلية (0.5 x 106 خلايا) في كل بئر من ثقافة الانسجه مسطحه أسفل 24 لوحه جيدا من متموج OP9/DLL1.
- أضافه 100 IU الإنسان انترلوكين 2 (هيل-2) ، 5 نانوغرام/مل هيل-7 ، 500 ng/ml مكافحه الإنسان CD3 الأجسام المضادة ، و 2 ميكروغرام/مل مكافحه الإنسان CD28 الأجسام المضادة ، ثم الثقافة في 37 درجه مئوية.
- في اليوم 4-7 بعد التحفيز ، وجمع الخلايا للتحليل الجزيئي (الشكل 3) أو المشاركة في الثقافة مع الببتيد-نبض الخلايا العرض مستضد (apcs).
- افصل الخلايا غير الملتصقة ميكانيكيا بواسطة الماصات اللطيفة والفلتر من خلال مصفاه خلايا 100 ميكرومتر لأزاله كتل الخلايا. إثراء السكانخلايا الخلية بواسطة العزلة المغناطيسية الخرزة التي وفقا لبروتوكول الشركة المصنعة.
4. قياس خصائص مستضد hiPSC المستمدةCD8αβ + SP T الخلايا
ملاحظه: يعتمد نوع APCs الذي سيتم استخدامه لهذه التجربة علي تقييد MHC للخلايا T المشتقة من hiPSC. هنا ، يتم استخدام خط الخلية T2 ، والذي هو هجين من T و B خطوط الخلايا اللمفية اللمفاوية. T2 الخلايا التعبير هلا-A * 02:0123، والتي يتم التعرف عليها من قبل خلايا JKF6 التي تم اشتقاق MART1-ipsc18. ويمكن توسيع هذا الخط T2 الخلية في RPMI 1640 + 20 ٪ + 1 س البنسلين-ستربتوميسين ويتم المرور عندما تصل الخلايا كثافة 5 × 105 خلايا/مل.
- العد الحية هلا-A * 02:01 + تي-B الخلايا الهجينة الليمفاوية اللمفاوية T2 باستخدام الكريات الدموية وصبغه الأزرق التريان. احتضان APCs في 24 لوحه ثقافة الانسجه جيدا مع 1 ميكروغرام/مل مارت-1 الببتيد ل 2 ح في 37 درجه مئوية.
ملاحظه: تركيز الببتيد الأمثل هو متغير ، اعتمادا علي خط الخلية وخصوصية مستضد. - جمع APCs وغسل 2x مع 10 مل من تلفزيوني لأزاله اي الببتيد اضافيه.
- عد APCs وتوقف في 2-5 × 105 خلايا/مل في وسائل الاعلام OP9 مع 100 IU il-2 و 5 Ng/ml il-7. Aliquot 100 μL من تعليق الخلية (2-5 x 104 خلايا) في كل بئر من مرفق منخفض جدا U أسفل 96 لوحه جيدا أو مباشره إلى لوحه اليسبوت المغلفة مسبقا.
- فرز hiPSC-المستمدةCD8αβ + SP T الخلايا (1 أسبوع بعد مكافحه الإنسان CD3/CD28 تحفيز الأجسام المضادة) باستخدام الخلية فأرز والتوقف المرحلي في 1 × 106 خلايا/مل في وسائل الاعلام OP9 مع 100 IU il-2 و 5 ng/ml il-7. Aliquot 100 μL من تعليق الخلية (1 × 105 خلايا) في كل بئر من apcs والثقافة ل 16-20 h في 37 درجه مئوية.
- بعد 16-20 h ، تحليل الملف الشخصي إفراز السايسيسين بفحص ELISpot في بروتوكول الشركة المصنعة (الشكل 4).
النتائج
بعد 13 يوما لل hipscs المشاركة في الخياطة مع OP9/DLL1 ،CD34 +CD43 وظهرت الخلايا سلف التي تكون الدم (الشكل 1). بعد 22 يوما اضافيه من الثقافة علي غير--الجيلاتين OP9/DLL1 في وجود هفيت ، hFLT3L ، وهيل-7 ، المولدات التي تكون الدم متمايزة إلىCD3 +CD7 + + +CD8 + المزدوجة الايجابيه (DP) T الخلايا النسب ، و الاغلبيه التي أعربت عن TCR محدده لل مارت-1 مردوب (رباعيه) (الشكل 2).
وقد سبق ان تبين انCD8 + SP t الخلايا يمكن ان تكون مستحثه من الخلايا التائية +CD8 + موانئ دبي t عن طريق الإشارات tcr عبر الببتيد ناهض أو الأجسام المضادة يحركها التحفيز tcr24,25. ولذلك ، في اليوم 35 من الثقافة ، تمتحفيز الخلايا المشتقة من hipscCD8 + DP T مع المضادة لCD3 الإنسان والأجسام المضادة CD28 الإنسان في وجود هيل-7 وهيل-2. بعد أربعه أيام من التحفيز ، زاد عدد خلاياCD3 +CD8αβ + SP بشكل كبير وبقيت محدده لمرمه مارت-1 ، مؤكدا علي الحفاظ علي خصائص مستضدها الموروثة (الشكل 3).
لتحديد الخصائص الوظيفية لخلاياCD8αβ + SP T المشتقة من hipsc ، تم تحليل التنشيط المعتمد علي مستضد وإفراز غاما مضاده للفيروسات (ifn-γ). بعد التحفيز مع CD3 المضادة للإنسان ومكافحه الإنسان CD28 الأجسام المضادة لمده 1 أسبوع ، وقد تم عزل hipsc المستمدةCD8αβ + SP T الخلايا باستخدام فأرز الخلية وشارك في استزراع مع خط الخلية T2 التعبير عن هلا-a * 02:01 مع أو بدون مشابه MART1 الببتيد ل 16-20 h. كشفت المقايسة ELISpot ان الخلايا المشتقة hiPSCCD8αβ + sp t تفرز كميات اعلي من ifn-γ مقارنه معCD8αα + sp t الخلايا ، عندما مثقف في وجود سوق-1 الببتيد. كان التعبير γ null للخلايا T و APCs وحدها ، مما يدل علي ان الإنسان t-iPSC المشتقة الخلايا T هي مستضد محدده والوظيفية (الشكل 4).
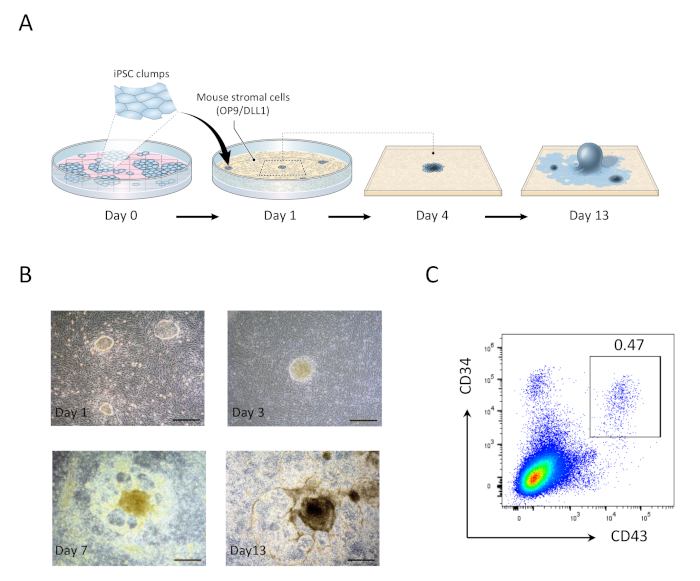
الشكل 1: توليد خلايا السلف التي تستمد الدم من hipsc. (ا) نظره عامه تخطيطيه لتمايز الهياس لسلاله الدم باستخدام OP9/DLL1 الثقافة المشتركة. (ب) ظهور الهياكل المشتقة من hipsc في الأيام 1 (اعلي اليسار) ، 3 (اعلي اليمين) ، 7 (أسفل اليسار) ، و 13 (أسفل اليمين). قضبان المقياس = 100 μm. (ج) تحليل التدفق الخلوي لل hipsc المشتقةCD34 +CD43 + الخلايا سلف للدم في اليوم 13. وتمثل البيانات ست تجارب مستقله (ن = 1 إلى 2). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
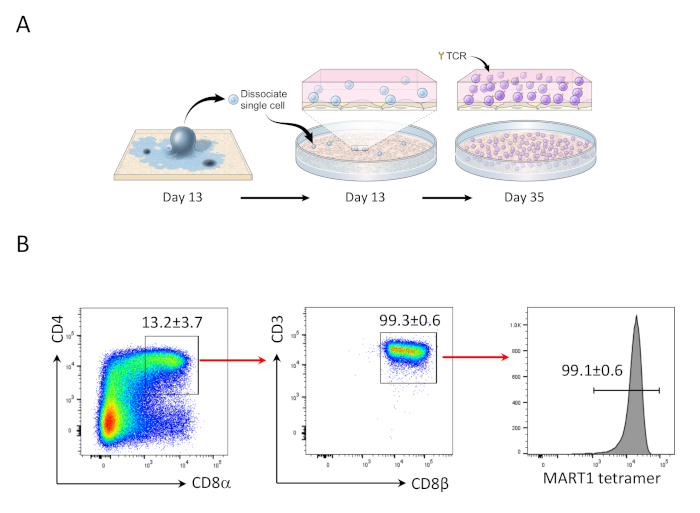
الشكل 2: التمايز hiPSC إلى Mart1 + CD8αβ + الخلايا DP T . (ا) نظره عامه تخطيطيه للتمييز بين سلاله الدم المشتقة من hipsc والخلايا التائية غير الناضجة باستخدام الثقافة المشتركة OP9/DLL1. (ب) تحليل التدفق الخلوي لCD8Α ، CD3 مقابل CD8β ، والتعبير الرباعي مارت-1 في خلايا T المشتقة من hipsc في اليوم 35. بوابات علي الخلايا الليمفاوية ، خليه واحده ، PI السلبية. وتمثل البيانات ثلاث تجارب مستقله (ن = 3-8). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
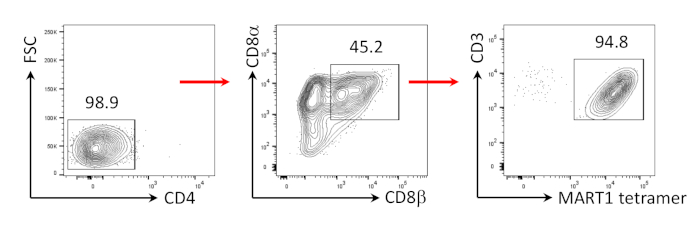
الشكل 3: استقراء النمط الظاهري للخليةCD8αβ + SP T. تحليل التدفق الخلوي للخلايا المشتقة من الخلاياالتائية التي تم اشتقاقها بعد 4 أيام من الCD3 البشرية والتحفيز البشري المضاد لCD28. بوابات علي الخلايا الليمفاوية ، خليه واحده ، PI السلبية (ن = 4). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
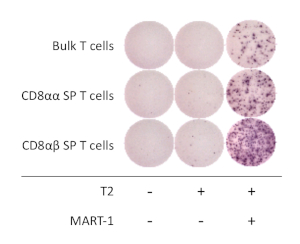
الشكل 4: خصوصية مستضد الخلايا المشتقة من hipsc CD8αβ + SP T. Γ إفراز من قبل المقايسة ELISpot من المشتقة hiPSCCD8αβ + Sp ،CD8αα + sp ، والجزء الأكبر من الخلايا T بعد 20 ساعة شارك في الثقافة مع أو بدون خلايا T2 نابض (أو لا) مع الببتيد مارت-1. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
Discussion
الثقافة المشتركة OP9 murine الخلايا اللحمية هو نظام راسخ لتوليد في المختبر من الخلايا الليمفاوية (اي ، ناغورني كاراباخ ، B ، وخليه T) من HSPCs والخلايا الجذعية مستحث. مطلوب الشق الإشارات للحث علي النسب t التزام ويمكن إنجازها من قبل التعبير عن الرحم من الشق يجند DLL1 أو DLL4 ، والتي لها فعاليه مماثله لتوليد الخلايا t1. ولذلك ، أصبح نظام الثقافة المشتركة OP9/DLL1 طريقه تستخدم علي نطاق واسع لإنتاج خلايا T في المختبر. وعلاوة علي ذلك ، ينطبق هذا الأسلوب للاستخدام مع عده أنواع ومصادر الخلايا البشرية ، بما في ذلك دم الحبل الشوكي ، ونخاع العظم HSPCs و ESCs. ومع ذلك ، فان توليد خلايا T من هذه المصادر محدود اما عن طريق الاسترجاع غير الكافي للخلايا المصدر أو عن طريق التمايز غير الفعال إلى الخلايا T1. بالاضافه إلى ذلك ، لا يمكن إنشاء منتج خليه T مع أعاده تجميع TCR واحد من مصادر المرجع المفتوحة هذه. باستخدام تقنيات الطب التجديدي ، اي المستحثة مستحث الخلايا الجذعية (iPSC) التكنولوجيا ، فانه قد يكون من الممكن لإنتاج اعداد هائله من خلايا T مستضد محدده للاستخدام في العلاجات القائمة علي الخلايا15.
hiPSCs تشبه مستحث ESCs في قدرتها علي التجديد الذاتي ، والتوسع لا حدود لها ، والقدرة علي التفريق إلى اي نوع من الخلايا الجسدية في الجسم. ومع ذلك ، فانها تفتقر إلى المخاوف الاخلاقيه المحيطة باستخدام المنتجات من أصل جنيني للتطبيقات السريرية. وعلاوة علي ذلك ، يمكن إنتاج hiPSCs من اي خليه جسديه ، مما يسمح بتطوير المنتجات الخلوية للطب الشخصي. في التقارير السابقة ، وقد تم إنتاج hipscs من خلايا t الإنسان باستخدام خلايا أحاديه النواة الطرفية كامله ،CD3 + الخلايا ، أو اللمفاويات المعزولة السامة للخلايا (ctls) كمصدر18،19،22، 26. عندما يتم إنشاء hipscs من مصدر خليه t (t-ipscs) ، يتم توريث أعاده ترتيب الجينات TCR الأصلي. ولذلك ، المريض T-iPSC الخلايا المشتقة T قد توفر نموذجا لعلاج شخصيه القانون من خلال استهداف مستضدات السرطان متميزة المريض.
وينقسم التفريق بين الخلايا الجذعية مستحث الإنسان إلى خلايا النسب T إلى خطوتين: جيل خلايا السلف التي تكون الدم (HPCs)27 والتمايز المزيد في الخلايا T النسب21. ويمكن إنجاز كلا الخطوتين باستخدام نظام الثقافة المشتركة OP9/DLL1. الأهم من ذلك ، فان نوعيه الخلايا المغذية OP9/DLL1 أمر بالغ الاهميه لنجاح التمايز الخلية T. وبما ان الخلايا OP9/DLL1 ليست خطا للخلايا المتجانسة الخلد ، فان نوعيه الأوضاع الخاصة بالنقابات والظروف الثقافية لها اهميه حاسمه في الحفاظ علي توسعها دون فقدان القدرة علي دعم تمايز hiPSC. ولذلك ، فمن المستحسن لتقييم ما قبل الكثير من الإجراءات المنفذة والمرور باستمرار عندما يبدا الاتصال سيتوبلازمي خليه إلى خليه تحدث ، من أجل منع تمايز الخلايا والشيخوخة. نقطه واحده لتاخذ في الاعتبار هو ان الاتصال من الخلية إلى الخلية يمكن ان تظهر لا يمكن تمييزها من الخلفية اعتمادا علي النقيض من المرحلة والتكبير من المجهر. في تجربتنا ، ومعظم الاطباق OP9/DLL1 وسوف يبدو ان 80 ٪ متموج عندما تكون جاهزه للمرور.
وقد تبين ان الخلايا السلالة t التي تم إنشاؤها من t-ipscs بواسطة OP9/DLL1 الثقافة المشتركة يمكن ان تنتجCD8 + SP t الخلايا علي التحفيز18,19. ومع ذلك, أعادهCD8 + SP T الخلايا الحصول علي الفطرية مثل CD8αα homodimer22,28, وهو غير فعاله مستقبلات مشتركه للإشارات TCR29. بالاضافه إلى ذلك ، فقد أظهرت هذه الخلاياCD8 + SP T القوية للخلايا الخلوية المستقلة TCR ، مما يجعل هذه الخلايا غير المواتية للاستخدام السريري30. يصف هذا البروتوكول أسلوبا حديثا ينطوي علي تحفيزخلايا CD8 +DP المنقية لتوليد خلاياCD8αβ + SP T ذات النمط الظاهري الأكثر تقليديه والمحسنة للخلايا الخلوية الخاصةبها. علي الرغم من ان فقدان خصوصية مستضد بسبب الثانوية TCRα اليليه أعاده ترتيب يحدث في مرحله موانئ دبي بعد طويلة الأمد الثقافة ، وهذا يمكن التغلب عليها من خلال تحرير الجينوم في T-iPSCs31. في تجربتنا ، والخلايا المستمدة من hiPSC موانئ دبي تبدا في الظهور في اليوم 30-35 من الثقافة ، وهذه الخلايا DP التي تم إنشاؤها حديثا لم تخضع بعد أعاده ترتيب TCRα الثانوية. لذلك ، تحتفظ معظم الخلايا DP في اليوم 35 خصوصية antigen ويمكن استخدامها لإنشاء خلاياCD8αβ + SP T الخاصة antigen.
قبل الإنسان المضادة لCD3 والتحفيز المضادة لCD28 في اليوم 35 ، يجبأزاله الخلايا CD8 DNمن الثقافة ، كما ثبت ان هذه تسبب القتل المباشر للخلايا +CD8 + موانئ دبي بعد التحفيز22. باستخدام التخصيب المغناطيسي الخرزة (الخطوة 3.10) سوف تثري لكل من موانئ دبي وCD8 +المتوسطة واحده ايجابيه (ISP) الخلايا1، والتي ثبت ان لدينا اي اثار سلبيه22. بدلا من ذلك ، يمكن اجراء فرز الخلايا المنشطة مضان بواسطة قياس التدفق الخلوي لعزل الخلايا DP. ومع ذلك ، يفضل الفصل المغناطيسي حبه لأنه يتجنب الإجهاد الميكانيكية الناجمة عن تدفق الخلوية.
جيلCD8αβ + SP T الخلايا من الخلايا الجذعية مستحث الإنسان دون التنشيط بوساطة اختيار ناهض وقد ثبت في وقت لاحق من خلال استخدام 3d الخلايا اللحمية الخلية الثقافة32. ومع ذلك ، الاختيار الفسيولوجية الايجابيه تعتمد علي التفاعل من TCR مع المجمعات الببتيد الذاتي-MHC ، والتي تتم معالجتها بشكل فريد والتي قدمتها الخلايا الظهاريه القشرية ثيميك33. وعلاوة علي ذلك, وقد ثبت تقارب TCR لاختيار الببتيدات لتحديد القدرات الوظيفية اللاحقة لCD8αβ الناضجة + SP T الخلايا34. حاليا ، لا يوجد اي دليل يوحي بان نظام الثقافة المشتركة القائم علي خليه الشق يمكن ان توفر الببتيد اختيار محدده ومعقده MHC المطلوبة للاختيار الفسيولوجية الايجابيه.
وقد تم الإبلاغ عنها سابقا في نموذج murine ان الخلايا T السلالة المتولدة من الورم مستضد الخاصة المشتقة من الخلايا الجذعية hiPSCs باستخدام OP9/DLL1 وحدها تفشل في تجربه النضج التقليدية. ومع ذلك ، فان الخلايا غير الناضجة المشتقة من ipsc التي تم إنشاؤها بواسطة نظام OP9/DLL1 يمكن ان تنضج إلى خلايا t ساذجه من خلال المزيد من التعليم الفسيولوجي الفيزيولوجي في نظام الثقافة 3d 28،35. ولذلك ، فان البروتوكول المقدم هنا لإنتاج الخلايا T غير ناضجه المستمدة iPSC المتولدة من نظام OP9/DLL1 أمر حيوي لمزيد من المحاولات لتوليد الإنسان الحقيقي مستضد الأورام البشرية الخاصة بالخلايا T التي يمكن ان تكون طويلة الأمد في الجسم الحي مع كفاءه لعلاج الأورام الوعائية الراسخة.
Disclosures
ولم يفصح صاحبا البلاغ عن ذلك.
Acknowledgements
ونحن نشكر الآن ب. Hoofring و رينا H. هو للمساعدة الرسوميه. وقد تم دعم هذا البحث من قبل برنامج البحوث المجتمعية للمعهد الوطني للسرطان (ZIA BC010763) ومبادرة القمر الخاصة لسرطان الخلايا العصبية المناعية لعلاج السرطان القائم علي الخلية.
Materials
| Name | Company | Catalog Number | Comments |
| 10 cm dish | Corning, Inc. | 353003 | |
| Anti-CD3, human | BD Biosciences | Cat# 561812, RRID:AB_1089628 | |
| Anti-CD34, human | BD Biosciences | Cat# 348791, RRID:AB_400381 | |
| Anti-CD4, human | Biolegend | Cat# 344612, RRID:AB_2028479 | |
| Anti-CD43, human | BD Biosciences | Cat# 560198, RRID:AB_1645460 | |
| Anti-CD7, human | BD Biosciences | Cat# 555361, RRID:AB_395764 | |
| Anti-CD8a, human | BD Biosciences | Cat# 555369, RRID:AB_398595 | |
| Anti-CD8b, human | BD Biosciences | Cat# 641057, RRID:AB_1645747 | |
| Anti-TCRb, human | BD Biosciences | Cat# 555548, RRID:AB_395932 | |
| CD28 human monoclonal antibody (15E8), pure functional grade | Miltenyl Biotec | 130-093-375 | |
| CD3 human monoclonal antibody (OKT3), pure functional grade | Miltenyl Biotec | 130-093-387 | |
| CD4 Microbeads, human | Miltenyl Biotec | 130-045-101 | |
| Cell strainer 100 um | Fisher Scientific | 22-363-549 | |
| Fetal Bovine Serum (FBS) | Gemini | 100-500 | |
| Flt-3 ligand | R&D Systems | 427-FL | |
| Gelatin Solution 2% | SIGMA-Aldritch | G1393-100ML | |
| GlutaMAX (100X) | Thermo Fisher Scientific | 35050-061 | L-Glutamine supplement |
| HBSS Mg+Ca+ Phenol-Red Free | Gibco | 14025-092 | |
| Interleukin-2 | R&D Systems | 202-IL | |
| Interleukin-7 | R&D Systems | 407-ML | |
| iTAG MHC Tetramer HLA-A*0201 Mart1 Tetramer -ELAGIGILTV | MBL | Cat#TB-0009-2 | |
| Mart1-hiPSC | Vizcardo et al., Cell Stem Cell 2013 | RIKEN-IMS | |
| Melan-A, MART 1 (26-35) | InnoPep | 3146-0100 | |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| αMEM powder | Gibco | 61100061 | |
| Mouse Embryonic Fibroblasts (MEF) | Thermo Fisher Scientific | C57BL/6 MEF MITC-TREATED 4M EACH; A34962 | |
| OP9/N-DLL1 | Riken Bioresource center | Cat# RCB2927; RRID:CVCL_B220 | OP9/DLL1 |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140-122 | |
| Phosphate buffered saline pH 7.4 (1x) | Thermo Fisher Scientific | 10010-023 | |
| Primate ES Cell Medium | Reprocell | RCHEMD001 | Human ESC Culture Media |
| Rhok inhibitor (Y-27632 dihydrochloride) | Tocris | 1254 | |
| RPMI 1640 | Gibco | 11875093 | |
| Stem Cell Factor (SCF) | R&D Systems | 455-MC | |
| StemPro | EZPassage | 23181-010 | |
| T2-tumor | ATCC | T2 (174 x CEM.T2) (ATCC® CRL-1992™) | |
| Trypsin-EDTA (0.05%), phenol red | Thermo Fisher Scientific | 25300-062 | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher Scientific | 25200-072 | |
| U Bottom 96 well plate | Corning, Inc. | 3799 |
References
- Brauer, P. M., Singh, J., Xhiku, S., Zuniga-Pflucker, J. C. T Cell Genesis: In Vitro Veritas Est. Trends in Immunology. 37 (12), 889-901 (2016).
- Rosenberg, S. A., Restifo, N. P. Adoptive cell transfer as personalized immunotherapy for human cancer. Science. 348 (6230), 62-68 (2015).
- Gattinoni, L., et al. Acquisition of full effector function in vitro paradoxically impairs the in vivo antitumor efficacy of adoptively transferred CD8+ T cells. Journal of Clinical Investigation. 115 (6), 1616-1626 (2005).
- Rosenberg, S. A., et al. Durable complete responses in heavily pretreated patients with metastatic melanoma using T-cell transfer immunotherapy. Clinical Cancer Research. 17 (13), 4550-4557 (2011).
- Crompton, J. G., et al. Lineage relationship of CD8(+) T cell subsets is revealed by progressive changes in the epigenetic landscape. Cellular and Molecular Immunology. 13 (4), 502-513 (2016).
- Henning, A. N., Klebanoff, C. A., Restifo, N. P. Silencing stemness in T cell differentiation. Science. 359 (6372), 163-164 (2018).
- Henning, A. N., Roychoudhuri, R., Restifo, N. P. Epigenetic control of CD8(+) T cell differentiation. Nature Reviews Immunology. 18 (5), 340-356 (2018).
- Vodnala, S. K., et al. T cell stemness and dysfunction in tumors are triggered by a common mechanism. Science. 363 (6434), (2019).
- Restifo, N. P., Gattinoni, L. Lineage relationship of effector and memory T cells. Current Opinion in Immunology. 25 (5), 556-563 (2013).
- Tran, E., et al. Cancer immunotherapy based on mutation-specific CD4+ T cells in a patient with epithelial cancer. Science. 344 (6184), 641-645 (2014).
- Gattinoni, L., et al. Wnt signaling arrests effector T cell differentiation and generates CD8+ memory stem cells. Nature Medicine. 15 (7), 808-813 (2009).
- Gautam, S., et al. The transcription factor c-Myb regulates CD8(+) T cell stemness and antitumor immunity. Nature Immunology. 20 (3), 337-349 (2019).
- Klebanoff, C. A., et al. Determinants of successful CD8+ T-cell adoptive immunotherapy for large established tumors in mice. Clinical Cancer Research. 17 (16), 5343-5352 (2011).
- Klebanoff, C. A., Gattinoni, L., Restifo, N. P. Sorting through subsets: which T-cell populations mediate highly effective adoptive immunotherapy. Journal of Immunotherapy. 35 (9), 651-660 (2012).
- Crompton, J. G., Clever, D., Vizcardo, R., Rao, M., Restifo, N. P. Reprogramming antitumor immunity. Trends in Immunology. 35 (4), 178-185 (2014).
- Crompton, J. G., Rao, M., Restifo, N. P. Memoirs of a reincarnated T cell. Cell Stem Cell. 12 (1), 6-8 (2013).
- Kennedy, M., et al. T lymphocyte potential marks the emergence of definitive hematopoietic progenitors in human pluripotent stem cell differentiation cultures. Cell Reports. 2 (6), 1722-1735 (2012).
- Vizcardo, R., et al. Regeneration of human tumor antigen-specific T cells from iPSCs derived from mature CD8(+) T cells. Cell Stem Cell. 12 (1), 31-36 (2013).
- Nishimura, T., et al. Generation of rejuvenated antigen-specific T cells by reprogramming to pluripotency and redifferentiation. Cell Stem Cell. 12 (1), 114-126 (2013).
- Lo, W., et al. Immunologic recognition of a shared p53 mutated neoantigen in a patient with metastatic colorectal cancer. Cancer Immunology Research. , (2019).
- Timmermans, F., et al. Generation of T cells from human embryonic stem cell-derived hematopoietic zones. Journal of Immunology. 182 (11), 6879-6888 (2009).
- Maeda, T., et al. Regeneration of CD8alphabeta T Cells from T-cell-Derived iPSC Imparts Potent Tumor Antigen-Specific Cytotoxicity. Cancer Research. 76 (23), 6839-6850 (2016).
- Salter, R. D., Howell, D. N., Cresswell, P. Genes regulating HLA class I antigen expression in T-B lymphoblast hybrids. Immunogenetics. 21 (3), 235-246 (1985).
- Snauwaert, S., et al. In vitro generation of mature, naive antigen-specific CD8(+) T cells with a single T-cell receptor by agonist selection. Leukemia. 28 (4), 830-841 (2014).
- Takahama, Y., Suzuki, H., Katz, K. S., Grusby, M. J., Singer, A. Positive selection of CD4+ T cells by TCR ligation without aggregation even in the absence of MHC. Nature. 371 (6492), 67-70 (1994).
- Seki, T., et al. Generation of induced pluripotent stem cells from human terminally differentiated circulating T cells. Cell Stem Cell. 7 (1), 11-14 (2010).
- Vodyanik, M. A., Slukvin, I. I. Hematoendothelial differentiation of human embryonic stem cells. Current Protocols in Cell Biology. , (2007).
- Vizcardo, R., et al. Generation of Tumor Antigen-Specific iPSC-Derived Thymic Emigrants Using a 3D Thymic Culture System. Cell Reports. 22 (12), 3175-3190 (2018).
- McNicol, A. M., et al. CD8alpha/alpha homodimers fail to function as co-receptor for a CD8-dependent TCR. European Journal of Immunology. 37 (6), 1634-1641 (2007).
- Themeli, M., Riviere, I., Sadelain, M. New cell sources for T cell engineering and adoptive immunotherapy. Cell Stem Cell. 16 (4), 357-366 (2015).
- Minagawa, A., et al. Enhancing T Cell Receptor Stability in Rejuvenated iPSC-Derived T Cells Improves Their Use in Cancer Immunotherapy. Cell Stem Cell. 23 (6), 850-858 (2018).
- Montel-Hagen, A., et al. Organoid-Induced Differentiation of Conventional T Cells from Human Pluripotent Stem Cells. Cell Stem Cell. 24 (3), 376-389 (2019).
- Takada, K., Kondo, K., Takahama, Y. Generation of Peptides That Promote Positive Selection in the Thymus. Journal of Immunology. 198 (6), 2215-2222 (2017).
- Takada, K., et al. TCR affinity for thymoproteasome-dependent positively selecting peptides conditions antigen responsiveness in CD8(+) T cells. Nature Immunology. 16 (10), 1069-1076 (2015).
- Vizcardo, R., et al. A Three-dimensional Thymic Culture System to Generate Murine Induced Pluripotent Stem Cell-derived Tumor Antigen-specific Thymic Emigrants. JoVE. , e58672 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved