Method Article
تقييم قدره التمايز من الخلايا الظهاريه البروستاتا الماوس باستخدام الثقافة Organoid
* These authors contributed equally
In This Article
Summary
الفئران البروستاتا العضوية تمثل سياق واعده لتقييم أليات التي تنظم التمايز. تصف هذه الورقة نهجا محسنا لإنشاء organoids البروستاتا ، ويقدم أساليب ل (1) جمع البروتين محلله من organoids ، و (2) الإصلاح والهيكل التنظيمي وصمه عار لكامل جبل المجهر البؤري.
Abstract
وتتالف ظهاره البروستاتا في الغالب من الخلايا القاعدية والاناره. وقد استخدمت في تتبع سلاله الجسم الحي لتحديد قدره التمايز من الخلايا القاعدية البروستاتا الماوس والاناره خلال التنمية ، وتجديد الانسجه والتحول. ومع ذلك ، تقييم الخلايا الذاتية والمنظمين خارج البروستاتا من قدره التمايز الظهاريه البروستات باستخدام نهج تتبع النسب غالبا ما يتطلب تربيه واسعه النطاق ويمكن ان تكون باهظه التكلفة. في فحص organoid البروستاتا ، خلايا القاعدية والتلالؤ توليد ظهاره البروستاتا السابق الجسم الحي. الأهم من ذلك ، يمكن عزل الخلايا الظهاريه الاوليه من الفئران من اي خلفيه وراثيه أو الفئران التعامل مع اي عدد من الجزيئات الصغيرة قبل ، أو بعد ، والطلاء في الثقافة ثلاثية الابعاد (3D). وتنشا مواد كافيه لتقييم قدره التمايز بعد 7-10 يوما. مجموعه من المشتقات القاعدية والمستمدة من التلالؤ لتحليل البروتين بواسطة لطخه الغربية و (2) تحليل مناعي العضوية السليمة من قبل المجهر الكامل جبل المحورية تمكن الباحثين لتقييم التمايز الجسم الحي السابق قدره الخلايا الظهاريه البروستاتا. عندما تستخدم في تركيبه, هذه النهجين توفر معلومات تكميليه حول قدره التمايز من خلايا البروستاتا القاعدية والاناره استجابه للتلاعب الوراثية أو الدوائية.
Introduction
تتكون الخلايا القاعدية والتلالؤه من غالبيه ظهاره البروستاتا1. وقد كشفت دراسات تتبع النسب ان هذه الأنواع من الخلايا هي في الغالب مكتفيه ذاتيا من قبل الأسلاف متميزة في الماوس الكبار2; ومع ذلك, وقد لوحظ التمايز التلالؤ من الأسلاف القاعدية في عده سياقات بما في ذلك التنمية3,4, تجديد الانسجه5, التهاب6,7 وبدء سرطان البروستاتا2,8. وعلاوة علي ذلك ، تدعم البيانات الناشئة وجود المولدين المضيئين متعددي القوي وكذلك الأسلاف الملتزمين بالاناره9. في سرطان البروستاتا المنتشر ، والتمايز من سلاله الاناره التابعة لل AR إلى النسب غير مبال مع القاعدية وميزات الغدد الصماء يمثل اليه التقدير علي نحو متزايد من المقاومة لمثبطات المسار الاندروجين10،11،12. ولذلك ، كما هو متورط في التمايز الفسيولوجية الطبيعية ، والشروع في السرطان والمقاومة للعلاج ، توضيح المنظمين الجزيئية الرئيسية للتمييز الخلايا الظهاريه البروستاتا أمر بالغ الاهميه.
ظهر نموذج organoid البروستاتا الماوس كسياق السابقة الجسم الخارجي انيقه لدراسة البروستاتا الظهاريه التمايز الخلية9,13,14. في هذا الفحص ، يتم طلاء الخلايا الظهاريه الفردية في مصفوفة 3D حيث انها تولد الهياكل الغديه التي تحتوي علي كل من الخلايا القاعدية والاناره في غضون 1 أسبوع. في حين يمكن استخدام النهج القائمة لطلاء الخلايا في الثقافة العضوية لتوليد بكفاءة العضوية العضوية ، وهذه النهج تتطلب المزيد من التحسين14. وتشمل التحديات البارزة المرتبطة بزراعه البروستاتا العضوية (1) باستثناء المستعمرات ثنائيه الابعاد (2D) التي تشكل تحت الحاكم (مصفوفة هلام) من التحليل ، (2) الحفاظ علي سلامه هلام مصفوفة خلال التغييرات وسائل الاعلام ، و (3) العد العضوي بدقه. هذه الورقة الخطوط العريضة لنهج لتوليد العضوية من الخلايا الظهاريه معزولة من البروستاتا الماوس. النهج الموصوف ينطوي علي لوحات الطلاء مع بولي (2-هيدروكسي ايثيل ميثاكريلات) (بولي هيما) لمنع حدوث مستعمرات 2D. وعلاوة علي ذلك ، يتم طلاء الخلايا في حلقه هلام مصفوفة ، بدلا من قرص هلام مصفوفة ، مما يجعل تغيير وسائل الاعلام والعد organoids اقل تحديا. تسمح هذه التقنيات للباحثين بالتحقيق بسهوله أكبر في كيفيه تغير التغيرات الجينية أو الجزيئات الصغيرة التي تم إدخالها قبل أو اثناء التشكيل العضوي الذي يغير العمليات الرئيسية مثل التمايز.
حصاد البروستاتا العضوية للطخه الغربية أو تحليل مناعي من قبل المجهر البؤري الكامل جبل يمكن ان توفر البصيرة الميكانيكية قيمه في التمايز13، ولكن البروتوكولات الراسخة لاعداد العضوية لهذه التقنيات تفتقر. تصف هذه المخطوطة النهج المتبعة في حصاد العضو العضوي (1) لجمع البروتين ، أو (2) التثبيت وتلطيخ المجهر البؤري. الأهم من ذلك ، تم تحسين النهج الموصوف لتحديد وتلطيخ organoids البروستاتا إلى حد كبير فيما يتعلق بالأساليب القائمة. وفي حين تعتمد هذه الطريقة علي الهيكل العضوي15، فان الأسلوب الموصوف في هذه المخطوطة يستخدم الهيكل العضوي السليم ، الذي يساعد علي الحماية من التلف العضوي اثناء اعداد العينة. عندما تستخدم في تركيبه ، وصمه عار الغربية والمجهر البؤري يمكن ان توفر نظره قيمه في المنظمين الجزيئية من التمايز. وبدلا من ذلك ، يمكن استخدام هذه النهج لنمذجة عمليات أخرى مثل التنمية والتحول.
Protocol
وقد تمت الموافقة علي جميع الطرق الموصوفة هنا من قبل مجلس المراجعة المؤسسية في جامعه كاليفورنيا ، لوس انجليس.
ملاحظه: ويرد في الشكل 1 رسمتخطيطي يوضح النهج الموصوفة في الورقة.
1. عزل الماوس القاعدية والخلايا الظهاريه البروستاتا باستخدام الفلورية الخلايا المنشطة الفرز (FACS)-التوقيت: 30 دقيقه
ملاحظه: تنفيذ الخطوات 1.3-1.5 في الظلام.
- بعد انفصام الخلايا من البروستاتا الماوس الكلي كما هو موضح في لوسون وآخرون16، نقل الخلايا إلى أنابيب facs وأعاده التعليق 0.1-5 × 106 خلايا في 100 μl من وسائل الاعلام التفكك (الجدول 1).
- أضافه الحجم المناسب من الأجسام المضادة الاساسيه التالية مترافق مباشره: CD45 ، CD31 ، Ter-119 ، EpCAM و CD49f.
- احتضان علي الجليد ، محمية من الضوء ، لمده 20 دقيقه.
ملاحظه: من المستحسن استخدام 10% من إجمالي الخلايا المنفصلة لعناصر التحكم غير الملونة والملونة. هذه الضوابط ضرورية لتعيين التعويض الصحيح والجهد للفرز. - إخماد كوكتيل الأجسام المضادة عن طريق أضافه 1 مل من وسائل الاعلام التفكك لكل عينه. بيليه الخلايا بواسطة طرد في 800 x g ل 5 دقيقه في درجه حرارة الغرفة (RT) وأزاله ماده طافي عن طريق الشفط.
- أعاده تعليق الخلايا في وحده التخزين المناسبة (250 μL لكل 1 × 106 خلايا) من وسائل الاعلام التفكك التي تحتوي علي 1 ميكروغرام/مل 4 ' ، 6-diamidino-2-فينيلانديول (dapi). انتقل إلى FACS. يتم توضيح المؤامرات تدفق الخلوية مما يدل علي عزله من الماوس القاعدية والخلايا الظهاريه البروستاتا التلالؤ في الشكل 2.
2. تصفيح فرزها البروستاتا الخلايا الظهاريه في الاساسيه الماوس الثقافة العضوية-التوقيت: 2-3 H (باستثناء بولي-هيما-المغلفة اعداد اللوحة)
ملاحظه: والمغلفة لوحات مع بولي هيما لمنع تشكيل مستعمره 2D علي سطح بئر تحت هلام المصفوفة. اعداد لوحات بولي هيما المغلفة 1 قبل يوم من الطلاء فرزها القاعدية أو الخلايا الظهاريه البروستاتا في الثقافة organoid الماوس. ذوبان الجليد 1 مل من الكبسولات المنخفضة من هلام مصفوفة عامل النمو ، ويشار اليها فيما بعد باسم هلام مصفوفة ، علي الثلج 2 ح قبل الخطوة 2.1. Y-27632 (المانع روك) ينبغي ان تضاف إلى وسائل الاعلام الماوس organoid مباشره قبل الخطوة 2.1. تنفيذ الخطوات 2.1-2.8 علي الجليد.
- بيليه الخلايا في 5 مل جولة أسفل أنابيب بواسطة طرد في 800 x g ل 5 دقيقه في 4 °c ويستنشق supernatant.
- غسل بيليه الخلية في 500 μL من وسائل الاعلام العضوية الماوس (الجدول 2)14.
- بيليه الخلايا بواسطة طرد في 800 x g ل 5 دقيقه في 4 °c ويستنشق supernatant.
- أعاده التعليق في وسائط الماوس organoid في كثافة خليه من 1,000 خلايا/μL.
- لاعداد يمزج الرئيسية ، مزيج الخلايا الظهاريه معلقه في وسائط الماوس organoid مع هلام مصفوفة لتوليد خليط النهائي الذي يحتوي علي 25 ٪ خلايا/وسائل الاعلام و 75 ٪ هلام مصفوفة. عاده ما تكون الخلايا القاعدية مطليه بتركيز 100-2000 خليه/80 μL ، في حين ان خلايا الاناره عاده ما تكون مطليه بتركيز من 2000-10000 خليه/80 μL. كثافة الخلايا مطلي تختلف تبعا ليوم جمع المواد المتوقعة ، والتطبيق المطلوب المصب.
ملاحظه: البرد أنبوب الحجم المناسب (ق) لحجم الرئيسية المتوقعة 5 دقائق قبل الاعداد الرئيسي مزيج. للتاكد من هلام مصفوفة لا تتصلب اثناء المناولة ، فمن المهم لتهدئه غيض ماصه عن طريق الأنابيب هلام مصفوفة 3-4 مرات قبل نقله إلى أنبوب جديد. - أضافه 80 μL من مصفوفة هلام/خليه خليط لكل بئر من لوحه 24 بئر. ويوصي بوضع قطره علي النصف السفلي من جدار البئر ، مع تجنب الملامسة المباشرة لطلاء بولي-هيما. بعد أضافه هلام مصفوفة ، دوامه لوحه للسماح للمصفوفة هلام/خليه خليط لتشكيل حلقه حول حافه البئر.
- وضع لوحه 24 بئر في 37 درجه مئوية 5 ٪ CO2 حاضنه الجانب الأيمن لمده 10 دقيقه للسماح للمصفوفة هلام لتتصلب جزئيا.
ملاحظه: بدء تسخين الماوس وسائل الاعلام organoid في 37 درجه مئوية مباشره بعد وضع لوحه 24 بئر في الحاضنة. - بعد احتضان لمده 10 دقيقه ، والوجه لوحه 24 جيدا راسا علي عقب واحتضان لمده اضافيه 50 دقيقه للسماح لهلام مصفوفة تتصلب تماما.
- أضافه 350 μL من قبل الحرارة الماوس organoid وسائل الاعلام قطره إلى وسط كل بئر.
ملاحظه: للحفاظ علي سلامه هلام مصفوفة ، فمن المهم لتجنب حلقه هلام مصفوفة في حين أضافه وسائل الاعلام. - بعد أضافه وسائل الاعلام ، والعودة لوحه 24 بئر إلى 37 درجه مئوية 5 ٪ CO2 حاضنه.
3. تجديد الماوس Organoid وسائل الاعلام-التوقيت: 10-15 دقيقه لكل لوحه 24 بئر
ملاحظه: وينبغي استبدال وسائل الاعلام القائمة مع وسائل الاعلام الجديدة كل 48 h. قبل كل تغيير وسائل الاعلام ، قبل الحارة الماوس الوسائط organoid. ليس من الضروري أضافه المثبط روك إلى وسائل الاعلام المستخدمة لتجديد.
- قم بآماله الصفيحة التي تبلغ 24 بئر بزاوية 45 درجه وأزل الوسائط الموجودة برفق من وسط كل بئر باستخدام ماصه p1000 ، مع تجنب حلقه هلام المصفوفة.
- أضافه 350 μL من قبل الحرارة الماوس organoid وسائل الاعلام كما في الخطوة 2.9. من المستحسن أضافه حجم أكبر من وسائل الاعلام (تصل إلى 1 مل) إلى العضوية المستزرعة لمده أطول من 5 أيام من أجل منع الاستنزاف السريع للعوامل الغذائية الرئيسية وعوامل النمو.
4. استخراج البروتين Lysate من Organoids البروستاتا لتحليل لطخه الغربية-التوقيت: 2.5-4 H
ملاحظه: قبل جمع العضوية العضوية لاستخراج البروتين ، واعداد وقبل الحارة وسائل الاعلام التي تحتوي علي الاستغناء (الجدول 1).
- أزاله وسائل الاعلام من كل بئر كما في الخطوة 3.1.
- لجمع العضوية ، والانفجار مرارا وتكرارا هلام مصفوفة بالأنابيب 1 مل من وسائل الاعلام التي تحتوي علي يوزع مباشره علي حلقه هلام المصفوفة حتى يتم فك الطوق بأكمله ، ونقل إلى أنبوب الطرد المركزي 1.5 mL.
ملاحظه: ومن الاهميه بمكان تجنب الاتصال المباشر بالآبار المغلفة بالبولي هيما. الاتصال المباشر قد يسبب تلوث المواد التي تم جمعها مع بولي هيما ، والتي يمكن ان تؤثر سلبا علي بقاء الخلية. - وضع 1.5 mL أنبوب الطرد المركزي (ق) في 37 درجه مئوية 5 ٪ CO2 حاضنه لمده 30 دقيقه إلى 1 ح للسماح الهضم الكامل للمصفوفة هلام بواسطة الاستغناء.
- بيليه العضوي بواسطة طرد في 800 x g ل 5 دقيقه في RT وأزاله ماده طافي باستخدام ميكروماص.
- أضافه الفوسفات-مخزنه المالحة (تلفزيوني) إلى بيليه العضوي وأعاده التعليق عن طريق الوخز بلطف.
ملاحظه: قد يؤدي الفشل في أعاده تعليق بشكل كاف بيليه العضوي في تلوث المواد العضوية مع البقايا المتبقية أو هلام مصفوفة. - بيليه الهيكل العضوي بواسطة طرد في 800 x g ل 5 دقيقه في RT وأزاله ماده طافي باستخدام ميكروماص.
- تجميد الكريات العضوية بسرعة عن طريق وضع كل أنبوب في محلول يحتوي علي الجليد الجاف والميثانول. تخزين أنبوب (ق) حتى استخدامها في المستقبل في-80 درجه مئوية. بدلا من ذلك ، استخراج محلله البروتين مباشره بعد الخطوة 4.6.
- أعاده تعليق الكريات organoid في 100 μL من البروتين تحلل العازلة (الجدول 1) لكل 10 μl من حجم الخلايا المعباه. التمرير السريع لأعاده التعليق.
ملاحظه: في حاله الاستئناف بعد التجميد السريع ، تاكد من أذابه البروتين تحلل العازل قبل أزاله العينات من-80 درجه مئوية ، حيث يجب أضافه العازل التحلل إلى العينات فورا من أجل منع نشاط الفوسفاتيز والانزيم البروتيني. - احتضان العينات في تحلل البروتين العازلة علي الجليد لمده لا تقل عن 45 دقيقه.
ملاحظه: فمن المستحسن ان الفقس قبل الحضانة علي الجليد لزيادة كفاءه استعاده البروتين النووي; ومع ذلك ، سونيكيشن غير مطلوب. إذا لم يتم تنفيذ سونيكيشن ، انتقل إلى الخطوة 4.10.- للفظ ، الأنابيب الفرعية في الجليد الرطب وتطبيق بلطف غيض من تقطيع أوصال الصوتية إلى خارج أنبوب الطرد المركزي الصغير. سوكاتي ل 40 s في 20 كيلوهرتز.
- انتقل إلى لطخه الغربية بعد البروتوكولات المعمول بها.
5. تحديد وتلطيخ Organoids البروستاتا للتحليل مناعي من قبل المجهر البؤري الكامل جبل
-
جمع organoids البروستاتا من لوحات 24 جيدا — التوقيت: 45-60 دقيقه
ملاحظه: عند جمع organoids البروستاتا لمعالجه المجهر البؤري ، فمن المهم للتعامل معها بعناية من أجل الحفاظ علي بنيتها. تم تصميم بروتوكول الجمع أدناه للحد من انقطاع الهيكل العضوي اثناء العزلة.- أزاله وسائل الاعلام من كل بئر كما في الخطوة 3.1.
- هضم هلام مصفوفة من خلال احتضان مع 500 μL من الوسائط المحتوية علي الاستغناء (الجدول 1) لمده 30 دقيقه في 37 درجه مئوية 5 ٪ CO2 حاضنه.
- جمع التعليق العضوي هضمها في أنبوب الطرد المركزي وبيليه الهيكل التنظيمي من قبل طرد في 800 x g لمده 3 دقائق في RT. أزاله سوبرناتانت.
-
كامل جبل تلطيخ المناعية من البروستاتا العضوي — التوقيت: 3-4 أيام (1-5 ساعة/يوم)
- أضافه 500 μL من 4 ٪ بارافورمالدهيد في التلفزيونية العامة واحتضان لمده 2 ح في RT مع اهتزاز لطيف.
- بيليه الهيكل التنظيمي من قبل طرد في 800 x ز لمده 3 دقائق في RT ، أزاله supernatant ، وغسل بيليه مع 1 مل من تلفزيوني لمده 15 دقيقه مع اهتزاز لطيف.
- غسل بيليه كما هو الحال في الخطوة 5.2.2 لمرتين اضافيه.
- بيليه الهيكل التنظيمي من قبل طرد في 800 x g لمده 3 دقائق في RT وأزاله supernatant. أضافه 1 ميكروغرام/مل DAPI في منع الحل (الجدول 1). احتضان لمده 2 ساعة في RT أو بدلا من ذلك بين عشيه وضحيها في 4 درجه مئوية مع اهتزاز لطيف.
- بيليه الهيكل التنظيمي من قبل طرد في 800 x g لمده 3 دقائق في RT وأزاله supernatant. أضافه الأجسام المضادة الاساسيه (أرنب مكافحه-p63 ، الماوس المضادة للسيتوكيراتين 8) في منع الحل واحتضان بين عشيه وضحيها في 4 درجه مئوية مع اهتزاز لطيف.
- بيليه الهيكل التنظيمي من قبل طرد في 800 x g لمده 3 دقائق في RT وأزاله supernatant. غسل بيليه مع 1 مل من تلفزيوني لمده 15 دقيقه مع اهتزاز لطيف.
- غسل بيليه كما هو الحال في الخطوة 5.2.6 لمرتين اضافيه.
- بيليه الهيكل التنظيمي من قبل طرد في 800 x g لمده 3 دقائق في RT وأزاله supernatant. أضافه الأجسام المضادة الثانوية (الماعز مكافحه الأرنب مفتش-اليكسا فلور 594 ، الماعز المضادة للماوس مفتش-اليكسا فلور 488) في منع الحل واحتضان بين عشيه وضحيها في 4 درجه مئوية مع اهتزاز لطيف.
- بيليه الهيكل التنظيمي من قبل طرد في 800 x ز لمده 3 دقائق في RT ، أزاله supernatant ، وغسل بيليه مع 1 مل من تلفزيوني لمده 15 دقيقه مع اهتزاز لطيف.
- غسل بيليه كما هو الحال في الخطوة 5.2.9 لمرتين اضافيه.
6. تنظيف الانسجه وتركيب البروستاتا الملونة العضوية لكامل جبل المجهر البؤري — التوقيت: 7 H
- بيليه الهيكل التنظيمي من قبل طرد في 800 x g لمده 3 دقائق في RT وأزاله supernatant.
- أضافه 1 مل من السكروز 30 ٪ في تلفزيوني مع 1 ٪ تريتون X-100 واحتضان لمده 2 ح في RT مع اهتزاز لطيف.
- بيليه الهيكل التنظيمي من قبل طرد في 800 x g لمده 3 دقائق في RT وأزاله supernatant.
- أضافه 1 مل من السكروز 45 ٪ في تلفزيوني مع 1 ٪ تريتون X-100 واحتضان لمده 2 ح في RT مع اهتزاز لطيف.
- بيليه الهيكل التنظيمي من قبل طرد في 800 x g لمده 3 دقائق في RT وأزاله supernatant.
- أضافه 1 مل من السكروز 60 ٪ في تلفزيوني مع 1 ٪ تريتون X-100 واحتضان لمده 2 ح في RT مع اهتزاز لطيف.
- بيليه الهيكل التنظيمي من قبل طرد في 800 x g ل 3 دقيقه في RT وأزاله 95 ٪ من supernatant.
ملاحظه: بيليه يصبح أكثر مرونة كما ان تركيز السكروز يصبح اعلي. مراقبه العضوية الملونة dapi تحت ضوء الاشعه فوق البنفسجية للتاكد من انها لم تضيع اثناء أزاله من ماده طافي ينصح. - نقل قطره 10-20 μl من التعليق المتبقي إلى كوفيرسليب المعلقة والمضي قدما إلى المجهر البؤري.
ملاحظه: ويمكن وضع شظايا coverslip علي جانبي القطرة لاستخدامها كفواصل (الشكل 4C). وتمنع هذه العوامل العضوية من الانهيار عند وضع الشفة فوق القطرة.
النتائج
يتم طلاء الخلايا الظهاريه البروستاتا في الثقافة العضوية الماوس حيث انها تشكل العضوية ، والتي يتم حصادها قبل التحضير للتحليل المصب (الشكل 1).
يتم عزل الخلايا الظهاريه القاعدية والاناره باستخدام FACS. بعد استبعادDAPI + الخلايا والخلايا المستنفدةللأوزون + (CD45, CD31, Ter119), وتتميز الخلايا القاعدية والاناره علي أساس التعبير التفاضلي من epcam و CD49f (الشكل 2). النهج الموصوف لصفيحه البروستاتا القاعدية وخلايا الاناره في الثقافة العضوية يستتبع: (1) طلاء الخلايا في حلقات هلام مصفوفة ، و (2) الآبار الطلاء مع بولي هيما. وقد سبق وصف الطلاء في حلقات في اغروال وآخرون9. الاستفادة من هذا النهج (الشكل 3ا) يسمح للباحثين لتجنب بسهوله أكبر هلام مصفوفة في حين تجديد وسائل الاعلام (الخطوة 3) ، وأكثر سهوله العد organoids باتباع محيط البئر. وقد ثبت الآبار طلاء مع بولي هيما لمنع تشكيل مستعمره 2D في الشبكية العضوية17; ومع ذلك ، لم يتم استخدام هذا النهج في نموذج organoid البروستاتا. الأهم من ذلك ، الآبار الطلاء مع بولي هيما (الجدول 3) يلغي حدوث المستعمرات 2d دون التدخل في تشكيل organoid (الشكل 3ب). هذه التعديلات توسيع قدرات الفحص organoid البروستاتا.
تشكل الخلايا القاعدية والاناره العضوية العضوية مع مورفولوجيس متميزة (الشكل 4ا). في حين ان معظم العضوية المشتقة القاعدية متشابهة في الحجم (100-300 ميكرومتر قطر) بعد 7 أيام في الثقافة ، والعضوية العضوية المستمدة من التلالؤ التي تظهر تغاير كبير (30-450 μm قطر). واستخدمت النهج الموصوفة أعلاه لاعداد الهيكل التنظيمي للتحليل النهائي (الخطوات 4 و 5) للتحقيق فيما إذا كانت هذه الاختلافات في النمط الظاهري تعكس الاختلافات في تعبير علامة النسب. وكشف تحليل لطخه الغربية ان القاعدية والمستمدة من التلالؤ العضوية تحتفظ الميزات المرتبطة القاعدية والخلايا الاساسيه الاناره. العضوية المشتقة القاعدية تعبر عن مستويات اعلي من العلامة القاعدية سيتوكيراتين 5 (K5) ، في حين ان العضوية المشتقة من التلالؤ تعبر عن مستويات اعلي من العلامة المضيءه سيتوكيراتين 8 (K8) (الشكل 4ب). وقد تم الكشف عن علامات القاعدية والاناره في العضوية القاعدية والمستمدة من التلالؤ في الجزء الأكبر من السكان ، وربما توحي بالتمايز (الشكل 4ب).
سعينا إلى توصيف التعبير علامة النسب في العضوية المشتقة القاعدية وتحديد ما إذا كانت العضوية المستمدة من المصابيح المشتقة المميزة من الناحية الشكلية الاختلافات في تعبير العلامة عن طريق تلطيخ الهيكل العضوي السليم وأداء المجهر البؤري (الشكل 4د). المشتقة القاعدية التي تحتوي علي ظهاره متعددة الطبقات مع الطبقات الخارجية التعبير عن مستويات عاليه من p63 ماركر القاعدية ومستويات معتدله من علامة لوميال K8 (p63hi، K8mid) ، والطبقات الداخلية دون مستويات يمكن كشفها من p63 ومستويات عاليه من الK8(p63lo، K8hi) في حين ان جميع الخلايا في الاحاديه الطبقات المستمدة التلالؤ الملونة بشكل إيجابي ل K8 ، فقط حدد الخلايا الواردة p63 النووية (الشكل 4D ، أسفل). هذه البيانات التحقق من النهج لحصاد واعداد العضوية للتحليل بواسطة لطخه الغربية أو المجهر البؤري ، التالي توسيع قدره الفحص العضوي لدراسة العمليات الخلوية الرئيسية ، بما في ذلك التمايز.
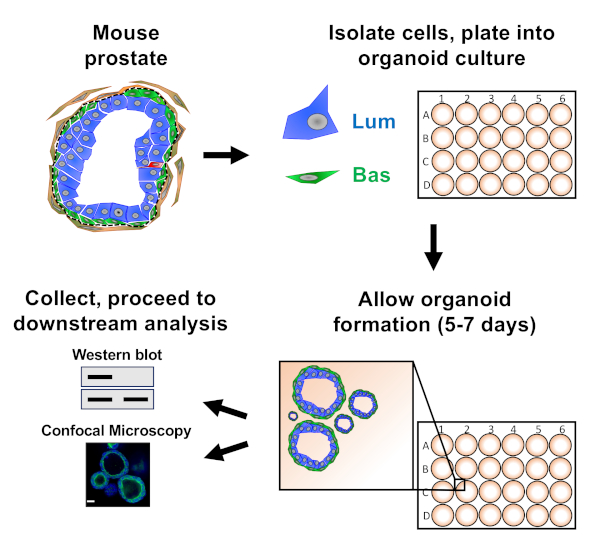
الشكل 1: رسم تخطيطي يوضح سير العمل لتوليد organoids البروستاتا لجمعها وتحليلها. يتم فصل البروستاتا الماوس الكلي والقاعدية والخلايا الظهاريه البروستاتا هي معزولة عن طريق الفرز الخلية المنشطة الفلورية عن طريق البروتوكولات المعمول بها18،19. يتم طلاء الخلايا القاعدية أو المصابيح المعلقة في خليط من وسائل الاعلام العضوية الماوس وهلام مصفوفة في حلقات هلام مصفوفة. بعد 5 إلى 7 أيام من الثقافة ، يتم حصاد العضو العضوي للتحليل بواسطة لطخه الغربية أو المجهر البؤري. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
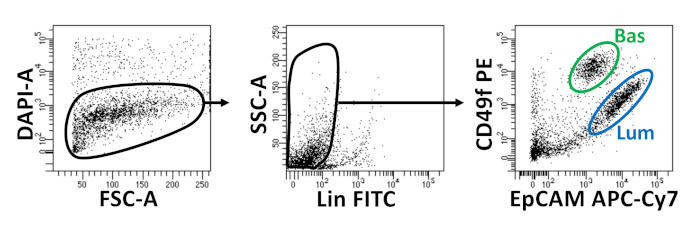
الشكل 2: عزل الخلايا الظهاريه البروستاتا القاعدية والاناره باستخدام الفرز الخلية المنشطة مضان (FACS). يتم تلطيخ الخلايا المنفصلة من البروستاتا الماوس مع DAPI ، للتمييز العيش من الخلايا الميتة ، والأجسام المضادة السطحية ، للتمييز القاعدية من خلايا الاناره ، قبل FACS. اليسار = بوابات علي DAPI-الخلايا. FSC-A = مبعثر إلى الامام. مركز = بوابات عليالخلايا لين (CD45lo، CD31lo، Ter119lo). SSC-A = الجانب-مبعثر. الحق = الخلايا القاعدية (Bas) (EpCAMمرحبا، CD49fhi) ، خلايا الاناره (لوم) (epcamمرحبا، CD49fmid). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
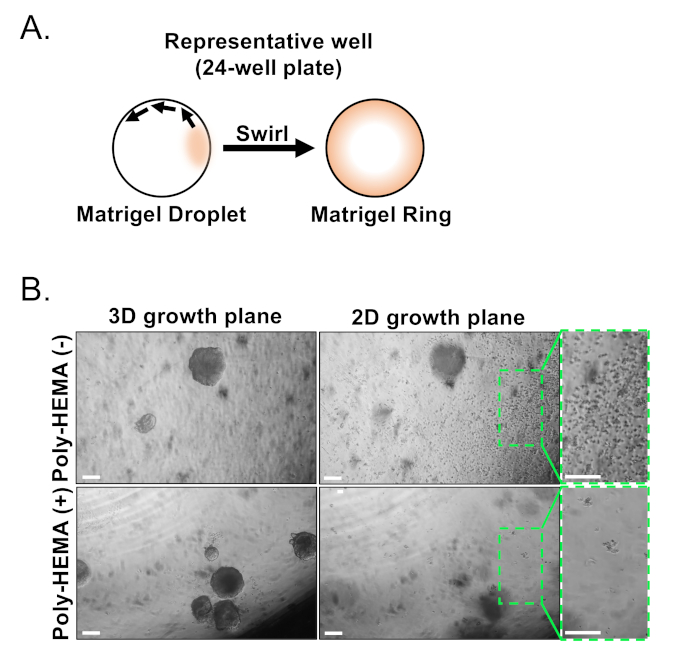
الشكل 3: إنشاء الفئران البروستاتا العضوي. (ا) التخطيطي الذي يوضح النهج لتوليد حلقه هلام مصفوفة في بئر من لوحه 24 بئر. (ب) الصور التمثيلية التباين المرحلة من العضوية (3d النمو الطائرة) والمستعمرات ثنائيه الابعاد (2d النمو الطائرة) شكلت 7 أيام بعد الطلاء الخلايا الظهاريه البروستاتا في الأمم المتحدة المغلفة (بولي-هيما (-)) ، أو المغلفة (بولي هيما (+)) لوحات 24 بئر. يتم تضخيم المناطق المحاصرة داخل مستوي النمو ثنائي الابعاد علي اليمين. قضبان المقياس = 200 μm. الرجاء النقر هنا لعرض نسخه أكبر من هذا الرقم.
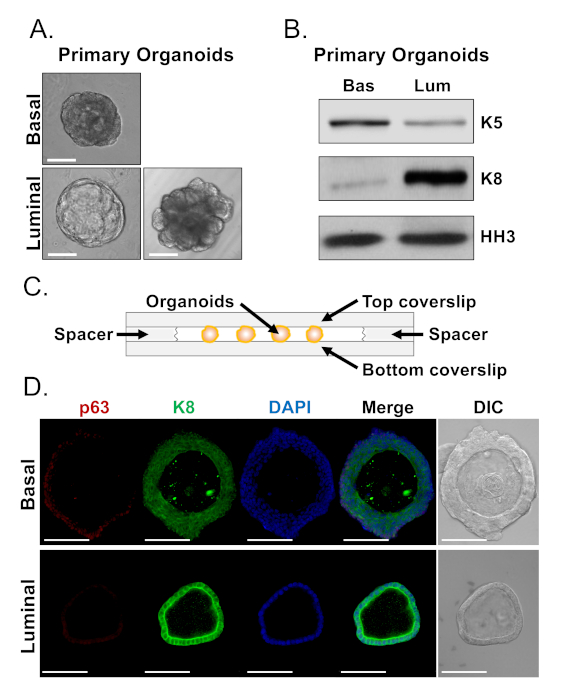
الشكل 4: تحليل التعبير علامة النسب في البروستاتا العضوية بواسطة لطخه الغربية وكامل جبل المجهر البؤري. (ا) صور متباينة للمرحلة التمثيلية من الهيكل العضوي المشتق من القاعدي (العلوي) والمستمد من التلالؤ (السفلي) بعد 7 أيام من الثقافة. شريط مقياس = 100 μm. (ب) التحليل الغربي للطخه المشتقة من القاعدية (السفلي) والمستمدة من التلالؤ (لوم) العضوي بعد 5 أيام من الثقافة. تلطيخ للعلامة القاعدية ، سيتوكيراتين 5 (K5) ، وعلامة لوميال ، سيتوكيراتين 8 (K8) ، والتحكم في التحميل ، هيستون H3 (HH3). (ج) التخطيط التخطيطي الذي يوضح الفواصل المزخرفة التي يتم المباعدة بينها. (د) تباين تمثيل التداخل التفاضلي (DIC) والصور المناعية للعضوي المشتق من القاعدي (العلوي) والمستمد من التلالؤ (السفلي) بعد 7 أيام من الثقافة. تلطيخ ل p63 (الأحمر) ، K8 (الأخضر) و DAPI (الأزرق) بشكل فردي ودمجها. قضبان المقياس = 100 μm. الرجاء النقر هنا لعرض نسخه أكبر من هذا الرقم.
| وصفات | |
| وسائل الاعلام المحتوية علي الاستغناء | 1 ملغ/مل ديداز + 10 μM المانع روك في المتقدمة DMEM F12. تصفيه تعقيم باستخدام فلتر 0.22 μm. |
| وسائط التفكك | 10% + 1 x البنسلين-ستربتوميسين في RPMI 1640. تصفيه تعقيم باستخدام فلتر 0.22 μm. |
| تحلل البروتين العازلة | ريبا العازلة + مثبطات الفوسفاتيز + مثبطات الانزيم البروتيني |
| حظر الحل | 10% [س] في [ببس] مع 0.2% [تريتون] [اكس-100] |
الجدول 1: التعليمات الخاصة باعداد الحلول الرئيسية.
| مكون | تركيز |
| باء-27 | 1x (تمييع من 50x التركيز) |
| جلوساماكس | 1x (تمييع من 100x التركيز) |
| N-اسيتيل-L-السيستين | 1.25 مم |
| Normocin | 50 ميكروغرام/مل |
| المؤتلف الإنسان EGF ، خاليه من الحيوانية | 50 ng/mL |
| المؤتلف الإنسان نوجين | 100 ng/mL |
| R-سبوندين 1-وسائل الاعلام المكيفة | 10% وسائل الاعلام المكيفة |
| A83-01 | 200 نيوتن متر |
| دهت | 1 نيوتن متر |
| Y-27632 ثنائي هيدروكلوريد (المانع روك) | 10 ميكرومتر |
| المتقدمة DMEM/F-12 | الوسائط الاساسيه |
| ويتم إنشاء وسائل الاعلام المكيفة علي النحو الموصوف في دروست ، وآخرون13. بعد أضافه جميع المكونات ، وتصفيه تعقيم الماوس الوسائط organoid باستخدام فلتر 0.22 μm. يتم أضافه مثبطات الصخور فقط اثناء إنشاء الثقافة والمرور من organoids. | |
الجدول 2: تعليمات لاعداد وسائل الاعلام الماوس organoid.
| بروتوكول لاعداد لوحات بولي هيما المغلفة | |
| 1 | أضافه 0.25 g بولي هيما إلى 50 mL 98 ٪ EtOH. حل بولي هيما في 37 درجه مئوية علي شاكر. تستغرق هذه العملية 4 ساعات علي الأقل. |
| 2 | تصفيه تعقيم بولي هيما باستخدام فلتر 0.22 μm. |
| 3 | أضافه 200 ميكرولتر من الحل بولي هيما في بئر من 24 بئر لوحه (ق). |
| 4 | أزاله الغطاء (الاغطيه) من 24-حسنا لوحه (ق) بعد أضافه بولي هيما والسماح للحل تتبخر بين عشيه وضحيها. |
| 5 | يغسل كل بئر مرتين مع تلفزيوني وضمان الآبار جافه تماما قبل التخزين بعد الغسيل النهائي. ملاحظه: تعطيل طلاء بولي هيما اثناء الغسيل يمكن ان تسهم في النمو ثنائي الابعاد علي طلاء الخلايا الظهاريه في ثقافة organoid. لمنع الاضرار التي لحقت الآبار بولي هيما المغلفة ، وتجنب الاتصال المباشر مع طرف الماصة اثناء الغسيل. ستظل سلامه الآبار المغلفة بالبولي هيما سليمه ما لم يتم كشط البولي هيما من طرف الماصة. |
| 6 | ويمكن تخزين لوحات بولي هيما المغلفة في 4 درجه مئوية لمده تصل إلى أسبوعين. ملاحظه: لوحات التغليف في بارافيلم قبل التخزين سوف تقلل من خطر التلوث. |
الجدول 3: بروتوكول اعداد لوحات البولي-هيما المغلفة.
Discussion
وقد تورط البروستاتا الظهاريه التمايز الخلية في كل من البيولوجيا البروستاتا العادية2,3,4,5,6,7 والبيولوجيا المرض8,10,11,12; ومع ذلك ، يبقي المنظمون الرئيسيون لهذه العملية غير معرف. وقد كان من الصعب تحديد الجهات التنظيمية الرئيسية لتمايز الخلايا الظهاريه البروستاتا ، ويرجع ذلك جزئيا إلى عدم وجود سياقات راسخة لنمذجة ذلك. في حين يمكن استخدام 2d الثقافة أحاديه الطبقة لنموذج التمايز11,12, فشل هذا السياق لتلخيص البيئة المجهرية البروستاتا المعقدة. وعلاوة علي ذلك ، في السياقات المجرية إلى التمايز النموذجي لا تصلح للدراسات الميكانيكية ، لأنها تشكل تحديا للتلاعب. ولذلك ، فان تحديد السياق الذي يسهل التلاعب به ، وان كان مناسبا من الناحية الفسيولوجية ، لدراسة التمايز أمر بالغ الاهميه.
نموذج organoid البروستاتا يمثل سياق الجسم الحي السابق انيقه حيث يتم الإبلاغ عن القاعدية إلى التمايز التلالؤ تحدث. طرق لإنشاء البروستاتا العضوية راسخة14؛ ومع ذلك ، من الضروري زيادة تحسين هذه الأساليب. وعلاوة علي ذلك ، لا توصف بوضوح النهج المتبعة لحصاد واعداد الأرغن البروستاتا للتحليل. تصف هذه الورقة نهجا للخلايا البروستاتا الظهاريه الخلايا المعزولة من البروستاتا الماوس إلى ثقافة organoid. هذا النهج يسمح للباحثين ل (1) منع حدوث المستعمرات 2D خلال تشكيل organoid ، (2) الحد من خطر تعطيل هلام مصفوفة خلال تجديد وسائل الاعلام ، و (3) العد العضوي أكثر فعاليه. الاضافه إلى ذلك ، توجز هذه المخطوطة النهج المتبعة لحصاد الهيكل العضوي للتحضير للتحليل الغربي للطخه ، أو المجهر البؤري الكامل الذي يعلو الجبل. الأهم من ذلك ، فان النهج المستخدم لاعداد العضوية للمجهر البؤري يحافظ علي البنية السليمة من الهيكل العضوي خلال مدته ، مما يقلل من الضرر العضوي قبل اكتساب الصورة. تماما ، والنهج الموصوفة توسيع قدرات الفحص organoid البروستاتا.
وعلي وجه الخصوص ، يمكن تغيير القدرة العضوية المكونة للخلايا القاعدية وخلايا الاناره علي حد سواء من خلال الطرق المستخدمة لعزل السكان المعنيين ، وبحسب الظروف الثقافية. وصفت الظروف الثقافية العضوية المستخدمة في هذا الفحص لأول مره من قبل Karthaus et al.13. في حين ان Karthaus et al. وقد ذكرت ان الخلايا القاعدية لديها اعلي العضوية تشكيل القدرة (15 ٪) من خلايا الاناره (1 ٪)13، chua et al. ، باستخدام أساليب العزلة المتميزة والظروف الثقافية ، وأفادت ان خلايا الاناره (0.2-0.3 ٪) لديها قدره اعلي تشكيل العضوية من الخلايا القاعدية (0.03 ٪)20. وعموما ، فان الطرق الموصوفة من قبل Karthaus et al. تؤدي إلى ارتفاع معدلات التشكيل العضوي للخلايا القاعدية وخلايا الاناره ، مما يعكس علي الأرجح الاختلافات في النهج المستخدم لعزل الخلايا القاعدية والاناره13، بدلا من الظروف الثقافية التي تحيز ضد التشكيل العضوي ولا يزال من غير الواضح ما إذا كان البروتوكول الموصوف في هذه المخطوطة يفضل تشكيل الهيكل العضوي من المولدات المضيءه متعددة الفعاليات ، أو الملتزمين-المولدين اللامعين9. علي الرغم من ان في الوقت المناسب وباهظه التكلفة ، في الكائنات المجرية تتبع الدراسات يمكن استخدامها للتحقق من الميزات سلف المرتبطة بسلالات الظهاريه البروستاتا واضحة في الفحص organoid.
عمليات مثل التنمية والتمايز والتحول ليست فقط ذات الصلة بعلم الاحياء البروستاتا ، ولكن أيضا ذات الصلة بعلم الاحياء من الانسجه الأخرى بما في ذلك الدماغ والرئة والأمعاء والبنكرياس والكبد. الأساليب الموصوفة تسهل استخدام النموذج العضوي لدراسة هذه العمليات ليس فقط في البروستاتا ، ولكن أيضا مجموعه واسعه من الانسجه.
Disclosures
وليس لدي المؤلفين ما يفصحون عنه.
Acknowledgements
يتم دعم PDC و JMG من قبل روث ل. كيرششتاين جائزه خدمه البحوث الوطنية GM007185. ويدعم جاد من قبل المعهد الوطني للعلوم الطبية العامة من المعاهد الوطنية للصحة (R25GM055052) الممنوحة ل t. هالان ومنحه شاول مارتينيز. ويدعم صندوق مؤسسه سبيتزر للاسره وهبه جيل الأمين المساعد. وقد دعم هذا العمل من قبل جمعيه السرطان الامريكيه (RSG-17-068-01-TBG), وزاره الدفاع (W81XWH-13-1-0470), مارغريت ه. البحوث الطبية المبكرة الثقة, المعاهد القومية للصحة/انجي (P50CA092131/كاليفورنيا بوغ في سرطان البروستاتا), روز هيلز المؤسسة, ودعم من جامعه كاليفورنيا جونسون مركز السرطان الشامل, مركز أبحاث الخلايا الجذعية واسعه, معهد العلوم السريرية والانتقالية, ومعهد علم الأورام البولي.
Materials
| Name | Company | Catalog Number | Comments |
| µ-Dish 35 mm, high | ibidi | 81156 | |
| 16% Paraformaldehyde | Thermo Fisher Scientific | 50-980-487 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Thermo Fisher Scientific | D1306 | |
| A83-01 | Tocris | 2939 | |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634010 | |
| APC/Cy7 anti-mouse CD326 (Ep-CAM) Antibody, 100 μg | BioLegend | 118218 | |
| B-27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| Complete Protease Inhibitor Cocktail | Sigma | 11836145001 | |
| (DiHydro)testosterone (5α-Androstan-17β-ol-3-one) | Sigma | A-8380 | |
| Dispase II, Powder | Thermo Fisher Scientific | 17-105-041 | |
| Fetal Bovine Serum (FBS) | Sigma | F8667 | |
| FITC anti-mouse CD31 Antibody (0.5 mg/mL, 50 μg) | BioLegend | 102405 | |
| FITC anti-mouse CD45 Antibody (0.5 mg/mL, 50 μg) | BioLegend | 103107 | |
| FITC anti-mouse TER-119/Erythroid Cells Antibody (0.5 mg/mL, 50 μg) | BioLegend | 116205 | |
| Goat anti-mouse IgG-Alexa Fluor 488 | Invitrogen | A28175 | |
| Goat anti-rabbit IgG-Alexa Fluor 594 | Invitrogen | A11012 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Halt Phosphatase Inhibitor | Thermo Fisher Scientific | 78428 | |
| Matrigel GFR Membrane Matrix | Corning | CB-40230C | |
| Mouse anti-cytokeratin 8 | BioLegend | 904804 | |
| N-acetyl-L-cysteine | Sigma | A9165 | |
| Normocin | Thermo Fisher Scientific | ant-nr-1 | |
| PE anti-human/mouse CD49f Antibody | BioLegend | 313612 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15-140-122 | |
| Poly(2-hydroxyethyl methacrylate) (Poly-HEMA) | Sigma | P3932-25G | |
| Rabbit anti-p63 | BioLegend | 619002 | |
| Radioimmunoprecipitation assay (RIPA) | Thermo Fisher Scientific | PI89901 | |
| Recombinant Human EGF, Animal-Free | PeproTech | AF-100-15 | |
| Recombinant Human Noggin | PeproTech | 120-10C | |
| RPMI 1640 Medium, HEPES (cs of 10) | Thermo Fisher Scientific | 22400105 | |
| Sonic Dismembrator | Thermo Fisher Scientific | FB120 | |
| Sucrose | Sigma | S0389-500G | |
| Triton X-100 | Sigma | X100-5ML | |
| Y-27632 dihydrochloride (ROCK inhibitor) | Selleck Chemical | S1049-50MG |
References
- Kwon, O. J., Xin, L. Prostate epithelial stem and progenitor cells. American Journal of Clinical and Experimental Urology. 2 (3), 209-218 (2014).
- Choi, N., Zhang, B., Zhang, L., Ittmann, M., Xin, L. Adult Murine Prostate Basal and Luminal Cells Are Self-Sustained Lineages that Can Both Serve as Targets for Prostate Cancer Initiation. Cancer Cell. 21 (2), 253-265 (2012).
- Ousset, M., Van Keymeulen, A., et al. Multipotent and unipotent progenitors contribute to prostate postnatal development. Nature Cell Biology. 14 (11), 1131-1138 (2012).
- Wang, J., et al. Symmetrical and asymmetrical division analysis provides evidence for a hierarchy of prostate epithelial cell lineages. Nature Communications. 5, 1-13 (2014).
- Wang, Z. A., Mitrofanova, A., et al. Lineage analysis of basal epithelial cells reveals their unexpected plasticity and supports a cell-of-origin model for prostate cancer heterogeneity. Nature Cell Biology. 15 (3), 274-283 (2013).
- Kwon, O. J., Zhang, B., Zhang, L., Xin, L. High fat diet promotes prostatic basal-to-luminal differentiation and accelerates initiation of prostate epithelial hyperplasia originated from basal cells. Stem Cell Research. 16 (3), 682-691 (2016).
- Kwon, O. J., Zhang, L., Ittmann, M. M., Xin, L. Prostatic inflammation enhances basal-to-luminal differentiation and accelerates initiation of prostate cancer with a basal cell origin. Proceedings of the National Academy of Sciences. 192 (3), 997-999 (2014).
- Stoyanova, T., et al. Prostate cancer originating in basal cells progresses to adenocarcinoma propagated by luminal-like cells. Proceedings of the National Academy of Sciences. 110 (50), 20111-20116 (2013).
- Agarwal, S., Hynes, P. G., et al. Identification of Different Classes of Luminal Progenitor Cells within Prostate Tumors. Cell Reports. 13 (10), 2147-2158 (2015).
- Ku, S. Y., et al. Rb1 and Trp53 cooperate to suppress prostate cancer lineage plasticity, metastasis, and antiandrogen resistance. Science. 355 (6320), 78-83 (2017).
- Mu, P., et al. SOX2 promotes lineage plasticity and antiandrogen resistance in TP53- and RB1-deficient prostate cancer. Science. 355 (6320), 84-88 (2017).
- Bishop, J. L., et al. The Master Neural Transcription Factor BRN2 Is an Androgen Receptor-Suppressed Driver of Neuroendocrine Differentiation in Prostate Cancer. Cancer Discovery. 7 (1), 54-71 (2016).
- Karthaus, W. R., et al. Identification of multipotent luminal progenitor cells in human prostate organoid cultures. Cell. 159 (1), 163-175 (2014).
- Drost, J., Karthaus, W. R., et al. Organoid culture systems for prostate epithelial and cancer tissue. Nature Protocols. 11 (2), 347-358 (2016).
- McCray, T., Richards, Z., Marsili, J., Prins, G. S., Nonn, L. Handling and Assessment of Human Primary Prostate Organoid Culture. Journal of Visualized Experiments. (143), e59051(2019).
- Lawson, D. A., Xin, L., Lukacs, R. U., Cheng, D., Witte, O. N. Isolation and functional characterization of murine prostate stem cells. Proceedings of the National Academy of Sciences of the United States of America. 104 (1), 181-186 (2007).
- Chen, H. Y., Kaya, K. D., Dong, L., Swaroop, A. Three-dimensional retinal organoids from mouse pluripotent stem cells mimic in vivo development with enhanced stratification and rod photoreceptor differentiation. Molecular vision. 22, 1077-1094 (2016).
- Liu, X., et al. Low CD38 Identifies Progenitor-like Inflammation-Associated Luminal Cells that Can Initiate Human Prostate Cancer and Predict Poor Outcome. Cell Reports. 17 (10), 2596-2606 (2016).
- Lukacs, R. U., Goldstein, A. S., Lawson, D. A., Cheng, D., Witte, O. N. Isolation, cultivation and characterization of adult murine prostate stem cells. Nature protocols. 5 (4), 702-713 (2010).
- Chua, C. W., Shibata, M., et al. Single luminal epithelial progenitors can generate prostate organoids in culture. Nature Cell Biology. 16 (10), 951-961 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved