Method Article
تطبيقات التهجين في الموقع من الجيل التالي من الحمض النووي الريبي الفيروسي / الحمض النووي النووي الريبي في أبحاث فيروس نقص المناعة البشرية / فيروس نقص المناعة السيميان
In This Article
Summary
نقدم هنا اختبار التهجين في الموقع من الجيل التالي لتحديد تسلسل الحمض النووي الريبي الفيروسي أو الحمض النووي في أنسجة البارافين المدمجة بالفورمالين (FFPE). يسمح هذا النهج بتصور نسخ منخفضة من الحمض النووي الريبي والحمض النووي في أقل من 24 ساعة بحساسية وخصوصية عالية جدا.
Abstract
التهجين في الموقع هو تقنية قوية لتحديد تسلسل الحمض النووي الريبي أو الحمض النووي المحدد داخل الخلايا الفردية في أقسام الأنسجة ، مما يوفر رؤى مهمة حول العمليات الفسيولوجية والتسبب في المرض. تم استخدام التهجين في الموقع (ISH) لسنوات عديدة لتقييم موقع الخلايا المصابة بالفيروسات ، ولكن في الآونة الأخيرة تم تطوير نهج ISH من الجيل التالي مع استراتيجية تصميم مسبار فريدة تسمح بتضخيم الإشارة المتزامن وقمع الخلفية لتحقيق تصور جزيء واحد مع الحفاظ على مورفولوجيا الأنسجة. يعتمد هذا الجيل التالي من ISH على نهج مثل تفاعل البوليميراز المتسلسل المتفرع ، ولكنه يتم إجراؤه في الموقع وهو أكثر سهولة وحساسية وقابلية للتكرار من طرق ISH الكلاسيكية أو مناهج تفاعل البوليميراز المتسلسل في الموقع في الكشف الروتيني عن الحمض النووي الريبي أو الحمض النووي في أنسجة البارافين المدمجة بالفورمالين (FFPE). على مدى السنوات العديدة الماضية ، تم تطبيق مختبرنا منصة ISH هذه للكشف عن نقص المناعة البشرية (HIV) ونقص المناعة السيميان (SIV) والحمض النووي الريبي الفيروسي (vRNA) و / أو الحمض النووي الفيروسي (vDNA) الخلايا الإيجابية داخل العديد من أنسجة FFPE. مع هذه المخطوطة الفنية التفصيلية, نود أن نشارك معرفتنا ونصائحنا مع جميع الأفراد المهتمين باستخدام الجيل التالي من ISH في أبحاثهم.
Introduction
ISH هو النهج التجريبي المستخدم لاستهداف وتصور خيوط الحمض النووي أو الحمض النووي التكميلي أو الحمض النووي المعدل (أي المجسات) إلى تسلسل محدد من الحمض النووي أو الحمض النووي الريبي داخل خلية أو جزء من الأنسجة. يسمح ISH بتوطين وتصور محدد للتسلسلات النووية المحددة في الأنسجة ، وهو أمر مهم لفهم مستوى التعبير والتنظيم والتوزيع والتفاعلات بين الهدف وبيئته الخلوية ، وهي معلومات قيمة لا يمكن الحصول عليها باستخدام تقنيات شائعة أخرى ، مثل qPCR. حتى وقت قريب ، تم إجراء ISH بشكل شائع إما باستخدام DNA تكميلي مسمى أو RNA تكميلي (riboprobe). تم اقتران هذه المجسات مباشرة مع قواعد مسمى الراديو أو الفلورسنت أو المستضد (على سبيل المثال ، 35S و FITC و digoxigenin) ثم تم توطينها وتحديدها كميا في الأنسجة باستخدام إما التصوير الشعاعي الذاتي أو المجهر الفلوري أو مناهج الكشف عن الكيمياء المناعية ، على التوالي. في حين أن هذه التقنيات في الموقع لا تزال مناهج قيمة ، إلا أن هناك مجالا واسعا للتحسين لتطوير مناهج أقل كثافة في العمالة وأبسط وأسرع وحساسية ومحددة.
يعتمد نهج ISH التجاري البديل من الجيل التالي (على سبيل المثال ، مقايسة RNAscope) ، الذي تم وصفه لأول مرة في عام 2012 ، للكشف عن الحمض النووي الريبي المرسل للمضيف (mRNA) على تفاعل البوليميراز المتسلسل المتفرع. يتم إجراء الكشف عن mRNA في خلايا وأنسجة FFPE ، مع حساسية تقترب من تصور جزيء الحمض النووي الريبي الفردي في الخلاياالفردية 1. يتم تحقيق خصوصية هذا النهج في ظل الشرط الفريد الذي يرتبط فيه مجسان مستهدفان مزدوجان Z بشكل متجاور بتسلسلات الحمض النووي الريبي التكميلية الخاصة بهما (أو الحمض النووي) لمضخم الإشارة لربط 1بالتسلسل. يسمح هذا ببدء سلسلة تضخيم الإشارة عبر خطوات التهجين اللاحقة المشابهة للحمض النووي المتفرع (bDNA) 1،2. بالإضافة إلى ذلك ، فإن هذا النهج سريع وسهل بشكل ملحوظ ، حيث تم الحصول على نتائج في يوم واحد فقط (<8 ساعات) ، وهي ميزة كبيرة مقارنة بما يصل إلى 4 أسابيع مع التقنيات البديلة ، بما في ذلك Radio-ISH1،2. وقد فتح هذا الجيل القادم من ISH آفاقا وفرصا جديدة لأبحاث فيروس نقص المناعة البشرية / SIV. العقبات الرئيسية أمام علاج فيروس نقص المناعة البشرية هي الخزانات الخلوية والأنسجة التي يتم إنشاؤها خلال المراحل المبكرة من المرض3،4. الهدف العام من هذه التقنية هو تحديد وتحديد وفهم مقصورات الأنسجة الرئيسية التي تعمل كخزان فيروسي وثابتة داخل مضيف مصاب. وهذا بدوره سيساعد في وضع استراتيجيات فعالة للعلاج ضد فيروس نقص المناعة البشرية.
في هذه المخطوطة, نشرح بروتوكول ISH متعدد الإرسال من الجيل التالي من الحمض النووي الريبي / الحمض النووي (على سبيل المثال, RNAscope / DNAscope) بالتفصيل ونوضح كيف قمنا بتعديل بروتوكول RNA ISH الحالي لتحسين الجيل التالي من ISH لعيناتنا وأهدافنا المحددة. يسمح هذا البروتوكول بتصور وتوطين وقياس الحمض النووي الريبي الفيروسي لفيروس نقص المناعة البشرية / SIV والحمض النووي الفيروسي داخل أقسام الأنسجة 5 ميكرومتر. يتم إجراء التصور المتزامن لكل من vRNA و vDNA من خلال الجمع بين مجموعتين مخصصتين من المسبارات: إحساس واحد ، يستهدف خيط ترميز vDNA (مسبار C1 SIVmac239 Gag-Pol-Sense [416141-C1]) ، وواحد مضاد للإحساس ، يستهدف نصوص vRNA (مسبار C2 SIVmac239 Vif-Env-Nef-Tar-Anti-Sense [416131-C2]) يغطي مناطق مختلفة من الجينوم الفيروسي (الجدول 1)، باستخدام قناتين مختلفتين للتصوير، C1 وC2. في هذا البروتوكول ، تسمح لنا القناتان C1 و C2 بتصور الإشارات بألوان مختلفة (على سبيل المثال ، AP باللون الأحمر و HRP باللون البني) واكتشاف المجسات بطرق مختلفة. باستثناء معالجة تثبيت الأنسجة وقطعها ، يستغرق هذا الاختبار يومين. يتم تقديم بروتوكول التهجين المزدوج vRNA و vDNA في الموقع الذي يمكن إجراؤه على كريات الخلايا أو أقسام الأنسجة.
Protocol
1. القسم والشرائح التحضيرية
- قم بقص كتل البارافين واستخدم ميكروتوم لقطع 5 +/- 1 ميكرومتر. قم بتركيب الأقسام أو كريات الخلية على شرائح مجهر مشحونة في حمام مائي خال من RNase 40-45 درجة مئوية. ينزلق الهواء الجاف طوال الليل عند 37 درجة مئوية أو RT.
ملاحظة: يمكن تخزين الشرائح لمدة تصل إلى 3 أشهر في درجة حرارة الغرفة (RT) و 6 أشهر عند 4 درجات مئوية. - قم بإزالة شرائح FFPE.
- تخبز الشرائح في فرن جاف لمدة ساعة واحدة عند 60 درجة مئوية.
- في غطاء الدخان ، املأ طبقين من التلوين ب ~ 200 مل من الزيلين الطازج ، وطبقين إضافيين من التلوين ب ~ 200 مل من الإيثانول الطازج بنسبة 100٪. غطي الحاويات بأغطية.
- ضع الشرائح في رف واغمرها في أول طبق يحتوي على الزيلين. احتضن لمدة 5-10 دقائق في RT مع التحريض.
- ضع الشرائح في الطبق الثاني الذي يحتوي على الزيلين واحتضنه لمدة 5-10 دقائق في RT مع التحريض.
- ضع الشرائح على الفور في الطبق الذي يحتوي على 100٪ من الإيثانول. احتضن الشرائح لمدة 5-10 دقائق في RT مع التحريض.
- ضع الشرائح على الفور في الطبق الثاني الذي يحتوي على 100٪ من الإيثانول واحتضانها لمدة 5-10 دقائق في RT مع التحريض.
- قم بإزالة الرف من الإيثانول ، واضغط برفق على جانب الرف لإزالة الإيثانول الزائد ، واشطفه بالماء الخالي من RNase لمدة 5-15 دقيقة.
2. تحضير الفرن
- قم بتشغيل فرن التهجين واضبط درجة الحرارة على 40 درجة مئوية.
- ضع قطعة قماش أو منشفة ورقية ماصة متينة في صينية وبللها تماما بالماء المقطر المزدوج للسماح بالتحكم في الرطوبة.
- أدخل الصينية المغطاة في الفرن وأغلق باب الفرن. قم بتسخين الصينية لمدة 30 دقيقة على الأقل عند 40 درجة مئوية قبل الاستخدام. احتفظ بالصينية في الفرن عندما لا تكون قيد الاستخدام.
3. استرجاع الحاتمة الناجمة عن الحرارة
- قم بإعداد المخزن المؤقت لاسترجاع هدف التهجين ISH القائم على السترات 0.5x (10 نانومول / لتر ، الرقم الهيدروجيني = 6 ، انظر جدول المواد). اتركيه ليغلي في دورق على لوح التسخين.
- قم بإجراء استرجاع الحاتمة الناجم عن الحرارة عن طريق وضع الشرائح في المخزن المؤقت لاسترجاع هدف الغليان لمدة 30 دقيقة.
- قم بإزالة الشرائح من المخزن المؤقت للاسترجاع المستهدف واغسلها على الفور بالماء المقطر المزدوج. جفف في 100٪ إيثانول لمدة 5 دقائق قبل التجفيف بالهواء.
- بمجرد أن تجف الشرائح بالهواء ، ضع قلم حاجز كاره للماء لتطويق قسم الأنسجة على الشريحة. تأكد من ترك الحاجز الكارهة للماء يجف تماما في الهواء.
4. المعالجة المسبقة للبروتياز
- ضع الشرائح المجففة على رف منزلق قفل ، ثم قم بإعداد كواشف المعالجة المسبقة للبريتياز (محلول هضم البروتياز ، 2.5 ميكروغرام / مل) عن طريق التخفيف باستخدام معقم ، بارد ، PBS بنسبة 1: 5. اخلط جيدا.
ملاحظة: يتم توفير ثلاثة كواشف مختلفة من البروتياز بتركيزات مختلفة في المجموعة المتاحة تجاريا. البروتياز الثالث (قياسي) ، والبروتياز الرابع (قوي) ، والبروتياز الإضافي (خفيف). اختبر تجريبيا وقت هضم البروتياز وتخفيفه قبل التنفيذ في دراسة لأن الظروف المثلى ستختلف بناء على نوع الأنسجة والتثبيت والسمك (انظر المناقشة). - قم بتوزيع محلول البروتياز المخفف على الشرائح لتغطية أقسام الأنسجة بالكامل. احتضن الشرائح على الفور لمدة 20 دقيقة عند 40 درجة مئوية في فرن (محضر في الخطوة 1.4) ، مع التأكد من إغلاق الشرائح في صينية التهجين الرطبة. لا تدع أقسام الأنسجة تجف لبقية البروتوكول.
- اشطف على الفور 3 مرات عن طريق غمر رف منزلق القفل في صينية غسيل مملوءة بالماء المقطر المزدوج.
- قم بإجراء كتلة البيروكسيديز الذاتية عن طريق إسقاط محلول البيروكسيديز على كل قسم من أقسام الأنسجة لتغطيته بالكامل. احتضن الشرائح لمدة 10 دقائق في RT. بمجرد الانتهاء من ذلك ، اشطف الأقسام 3 مرات في ماء مقطر مزدوج.
5. تهجين التحقيق وتضخيم الإشارة
ملاحظة: لمنع التبخر ، تأكد من إغلاق الدرج الذي يتم التحكم فيه بالرطوبة بشكل صحيح حتى لا تجف الأنسجة أثناء خطوات الحضانة. ضع حجرة الرطوبة مرة أخرى في الفرن أثناء خطوة الغسيل للتأكد من بقائها عند 40 درجة مئوية.
- امزج المسبار C2 والمسبار C1 بنسبة 1:50 عن طريق سحب مجلد واحد من مسبار C2 إلى 50 مجلدا من مسبار C1 في أنبوب كما اقترحت الشركة المصنعة. اقلب الأنبوب عدة مرات. قم بتسخين خليط المسبار المستهدف في فرن 40 درجة مئوية لمدة ~ 10 دقائق لإذابة أي هطول للأمطار قبل الاستخدام.
ملاحظة: يمكن تخزين مجسات الهدف المختلطة عند 4 درجات مئوية لمدة تصل إلى 6 أشهر. - قم بإزالة الشرائح من الماء. اشطفها واضغط عليها أو قم بنقرها لإزالة الماء الزائد من أقسام الأنسجة. قم بتوزيع المسبار على الفور على الشرائح ، مع التأكد من تغطية كل قسم من الأنسجة بالكامل دون أي فقاعات هواء. احتضان مزيج المسبار في غرفة الرطوبة طوال الليل عند 40 درجة مئوية.
- في اليوم التالي ، أخرج الشرائح من الفرن وضعها في صينية الغسيل التي تحتوي على مخزن غسيل 0.5x لمدة 5 دقائق في RT. كرر خطوة الغسيل مرة أخرى.
- قم بإزالة الشرائح من مخزن الغسيل. اشطفها واضغط عليها أو مررها لإزالة محلول الغسيل الزائد من أقسام الأنسجة.
- قم بتوزيع كاشف AMP 1 تجاريا جاهزا للاستخدام (2 نانومول / لتر) في مخزن التهجين B (20٪ فورماميد ، 5x SSC ، 0.3٪ كبريتات ليثيوم دوديسيل ، 10٪ كبريتات ديكستران ، حجب الكواشف) على الشرائح ، مما يضمن تغطية كاملة لقسم الأنسجة دون أي فقاعات هواء. احتضن لمدة 30 دقيقة عند 40 درجة مئوية في غرفة الرطوبة. كرر الخطوات 1.6.3-1.6.4 ، وقم بإجراء الغسيل لمدة دقيقتين لكل منهما.
- الاستغناء عن AMP 2 المتاح تجاريا. تأكد من تغطية قسم الأنسجة بالكامل دون أي فقاعات هواء. احتضان الشرائح في غرفة الرطوبة لمدة 15 دقيقة عند 40 درجة مئوية. كرر الخطوات 5.3-5.4 ، وقم بإجراء الغسيل لمدة دقيقتين لكل منهما.
- الاستغناء عن AMP 3 المتاح تجاريا. تأكد من تغطية قسم الأنسجة بالكامل دون أي فقاعات هواء. احتضان الشرائح في غرفة الرطوبة لمدة 30 دقيقة عند 40 درجة مئوية. كرر الخطوات 5.3-5.4 ، وقم بإجراء الغسيل لمدة دقيقتين لكل منهما.
- الاستغناء عن AMP 4 المتاح تجاريا. تأكد من تغطية قسم الأنسجة بالكامل دون أي فقاعات هواء. احتضان الشرائح في غرفة الرطوبة لمدة 15 دقيقة عند 40 درجة مئوية. كرر الخطوات 5.3-5.4 ، وقم بإجراء الغسيل لمدة دقيقتين لكل منهما.
- الاستغناء عن AMP 5 المتاح تجاريا. تأكد من تغطية قسم الأنسجة بالكامل دون أي فقاعات هواء. احتضان الشرائح في غرفة الرطوبة لمدة 30 دقيقة عند 40 درجة مئوية. كرر الخطوة 5.3-5.4 ، وقم بإجراء الغسيل لمدة دقيقتين لكل منهما.
- الاستغناء عن AMP 6 المتاح تجاريا. تأكد من تغطية قسم الأنسجة بالكامل دون أي فقاعات هواء. احتضان الشرائح في غرفة الرطوبة لمدة 15 دقيقة عند 40 درجة مئوية. كرر الخطوة 5.3-5.4 ، وقم بإجراء الغسيل لمدة دقيقتين لكل منهما.
- قبل الكشف ، اشطف الشرائح مرة واحدة في 1x TBS-Tween 20 (0.05٪ حجم / حجم). قم بإزالة الشرائح من مخزن الغسيل ، واشطفها ، واضغط أو قم بنقر الشرائح لإزالة محلول الغسيل الزائد من أقسام الأنسجة. ضعه على الفور في صينية الغسيل المملوءة بمخزن مؤقت 1x TBS-Tween.
6. القناة 1 (C1) الكشف عن إشارة الهدف
ملاحظة: يتم تنفيذ ذلك باستخدام الفوسفاتيز القلوي الأحمر وتضخيم الكروموجين الأحمر السريع 6 من مجموعات الكشف 2-plex (انظر جدول المواد) التي تحتوي على ملصقات الفوسفاتيز القلوية والكشف عن الكروموجينيك. يستخدم اللون الأحمر السريع كركيزة لتوليد إشارة حمراء.
- قم بإعداد حل عمل أحمر سريع (FR) باستخدام تخفيف 1:60 من Fast RED-B إلى Fast RED-A. اخلط جيدا. لتقليل الترسيب والحصول على إشارة أنظف ، قم بتصفية محلول الكروموجين من خلال غشاء MCE 0.45 ميكرومتر باستخدام حقنة.
ملاحظة: استخدم محلول Fast RED-B في غضون 5 دقائق. لا تعرض لأشعة الشمس المباشرة أو الأشعة فوق البنفسجية. - قم بإزالة الشرائح من TBS-Tween ، واشطفها ، واضغط أو قم بنقر الشرائح لإزالة المخزن المؤقت الزائد من أقسام الأنسجة.
- قم بتوزيع محلول FR المختلط والمفلتر على كل قسم من أقسام الأنسجة ، مع التأكد من تغطية كل قسم بالكامل. احتضن في RT لمدة 6-8 دقائق. راقب تحت المجهر.
- اشطف الشرائح في محلول غسيل 0.5x 2x. قم بإزالة الشرائح من مخزن الغسيل ، واشطفها ، واضغط أو قم بنقر الشرائح لإزالة محلول الغسيل الزائد من أقسام الأنسجة.
- الاستغناء عن AMP 7 المتاح تجاريا. تأكد من تغطية قسم الأنسجة بالكامل دون أي فقاعات هواء. احتضان الشرائح في غرفة الرطوبة لمدة 10 دقائق عند 40 درجة مئوية. كرر الخطوة 5.3-5.4 ، وقم بإجراء الغسيل لمدة دقيقتين لكل منهما.
- الاستغناء عن AMP 8 المتاح تجاريا. تأكد من تغطية قسم الأنسجة بالكامل دون أي فقاعات هواء. احتضان الشرائح في غرفة الرطوبة لمدة 15 دقيقة عند 40 درجة مئوية. كرر الخطوة 5.3-5.4 ، وقم بإجراء الغسيل لمدة دقيقتين لكل منهما.
- الاستغناء عن AMP 9 المتاح تجاريا. تأكد من تغطية قسم الأنسجة بالكامل دون أي فقاعات هواء. احتضان الشرائح في غرفة الرطوبة لمدة 30 دقيقة عند 40 درجة مئوية. كرر الخطوة 5.3-5.4 ، وقم بإجراء الغسيل لمدة دقيقتين لكل منهما.
- الاستغناء عن AMP 10 المتاح تجاريا. تأكد من تغطية قسم الأنسجة بالكامل دون أي فقاعات هواء. احتضان الشرائح في غرفة الرطوبة لمدة 30 دقيقة عند 40 درجة مئوية. كرر الخطوة 5.3-5.4 ، وقم بإجراء الغسيل لمدة دقيقتين لكل منهما.
7. القناة 2 (C2) الكشف عن إشارة الهدف
ملاحظة: يتم تنفيذ ذلك باستخدام مجموعات Brown HRP و DAB Chromogen المتوفرة تجاريا (انظر جدول المواد). يحتوي التضخيم 10 من الكشف عن 2-plex على ملصقات بيروكسيداز الفجل الحار ، ويتم إجراء الكشف الكروموجيني باستخدام DAB لتوليد إشارة بنية.
- للكشف الأمثل عن إشارة DAB ، استخدم المجموعات المتوفرة تجاريا واتبع تعليمات الشركة المصنعة (انظر جدول المواد). راقب تحت المجهر.
تنبيه: DAB سام. اتبع الاحتياطات المناسبة وإرشادات السلامة عند التعامل مع هذه المادة الكيميائية والتخلص منها.
8. مكافحة التلوين والتركيب
- مضاد للشرائح باستخدام الهيماتوكسيلين.
- قم بإزالة الشرائح لمدة 30 ثانية باستخدام 50٪ من الهيماتوكسيلين الطازج المصفى أثناء تحريك الشرائح. ستظهر الشرائح باللون الأرجواني. اشطفها على الفور بالماء الجاري أثناء تحريك الشرائح لأعلى ولأسفل حتى يصبح الماء صافيا. ستبقى أقسام الأنسجة أرجوانية.
- للحصول على تباين أفضل ، ضع الشرائح الملطخة في الماء المقطر المشبع بكربونات الليثيوم لمدة 1 دقيقة. اشطفها بالماء الجاري جيدا 3 مرات على الأقل أثناء تحريك الشرائح. استخدم الماء المقطر المزدوج للشطف النهائي.
- نظرا لأن FR حساس للمذيبات العضوية ، يجب تغطية الشرائح الملطخة ب FR بوسط تركيب مائي وتجفيفها طوال الليل في RT.
- قم بتركيب الشرائح.
- تأكد من جفاف أقسام الأنسجة المغطاة بوسط تركيب مائي
- اغمس الشرائح في الزيلين قبل انزلاق الغطاء باستخدام كاشف التثبيت. تأكد من منع أو إزالة أي فقاعات هواء بين الغطاء وقسم المناديل واتركها تجف لمدة 16 ساعة في RT.
9. بروتوكول تحليل الصور الكمي ل RNAscope باستخدام CellProfiler5
- باختصار ، تأكد من أن البرنامج سيفصل بقع الهيماتوكسيلين و FR في صور منفصلة. تحديد وقياس الأشياء ذات الأهمية: النوى ، والفيروسات ، والخلايا الموجبة ، وإجمالي تلطيخ FR الإيجابي. قم بتخزين القياسات في ملف CSV واحفظ الصورة التي تم تحليلها.
- حدد خيار "فك مزج الألوان" ، الذي يفصل البقع ، ويقسم منطقة الاهتمام الأصلية (ROI) إلى صور هيماتوكسيلين وFR منفصلة.
- إذا تداخل الهيموسيدرين أو الوشم أو الميزات المماثلة مع التحليل ، أضف خطوة "Unmix" ثانية مع الهيماتوكسيلين و FR و DAB. استخدم صورة FR الثانية للعثور على وحدات بكسل FR الأكثر كثافة. سيتم استخدام هذه الصورة الثانية كقناع لتلوين FR الحقيقي.
- اختياريا ، قم بتنعيم الصور الملطخة قبل عتبةها. هذا قرار تجريبي وليس هناك حاجة إليه دائما. عتبة الصور الملطخة الفردية باستخدام "IdentifyPrimaryObjects" لتحديد وحدات البكسل الموجبة.
- حدد الأنواع الثلاثة المختلفة من الكائنات (فيريون ، مجاميع فيريون ، خلية منتجة).
- تأكد من أن النوى عبارة عن كائنات قطرها 4-100 بكسل (بكسل) ملطخة بالهيماتوكسيلين. قم بتفكيك وملء الثقوب بعد العتبة. يبلغ قطر كائنات "IntenseFastRed" من 4 إلى 100 بكسل وتشمل الفيروسات والخلايا الموجبة والتلوين الإيجابي الكلي ، كما هو الحال في الخلايا المتغصنة المسامية (FDCs) في بصيلات الخلايا البائية (BCF). تستخدم هذه الصورة لتصفية الإيجابيات الخاطئة (على سبيل المثال ، الهيموسيديرين).
- تأكد من أن الإيجابيات الصغيرة FR هي كائنات قطرها 2-12 بكسل. يشمل هذا القياس الفيروسات وخلايا vDNA +. تجاهل أي كائنات خارج هذا النطاق. قم بتفكيك وملء الثقوب بعد العتبة.
- تأكد من أن الإيجابيات الكبيرة FR: كائنات قطرها 9-100 بكسل. يتضمن هذا القياس الخلايا الإيجابية vRNA + والتلوين الإيجابي الإجمالي. تتكتل بعد العتبة. يمكن أن يتداخل حجم الكائنات الموجبة FR الصغيرة والكبيرة. سيتم فصلهم في خطوة لاحقة.
ملاحظة: يستخدم البرنامج (على سبيل المثال، Cellprofiler) وحدات بكسل لأحجام الكائنات، وتلك المستخدمة هنا مشتقة من الشرائح الممسوحة ضوئيا بدقة 0.2510 ميكرومتر/بكسل (40x).
- تحديد النتائج واستخراجها.
- بعد تحديد أي كائنات ، حدد واستخرج النتائج لعدد الفيروسات والخلايا المصابة المنتجة والنوى.
- حدد الفيروسات عن طريق إخفاء FastRedSmallPositives مع تعيين كائن IntenseFastRed لإزالة الإيجابيات الخاطئة (على سبيل المثال ، الهيموسيديرين).
- بعد ذلك ، حدد الخلايا الإيجابية ومجموع تلطيخ FR الإيجابي. قم بإزالة الإيجابيات الخاطئة والفيروسات من FastRedLargePositives عن طريق إخفاءها باستخدام IntenseFastRed ومع مجموعة كائن virion.
- استخرج الخلايا الموجبة من FastRedLargePositives المكرر عن طريق الإخفاء مرة أخرى باستخدام Nuclei. قم بتقسيم الكائنات التي لم تعد تلامس ، وقم بتصفية النتائج حسب منطقة الكائن ، وإزالة الكائنات الصغيرة (≤6 بكسل). هذا يزيل البقع التي تم إنشاؤها عن طريق إخفاء تداخل النوى. والنتيجة هي الخلايا الموجبة.
- أخيرا ، حدد إيجابيات FR الإجمالية. تستخدم هذه الخطوة IdentifyTertiaryObjects، للعثور على الكائنات المضمنة في كائن أصل أكبر. في هذه الحالة ، تكون مجموعة الكائن FastRedLargePositives المكررة هي الأصل ويتم طرح الخلايا الموجبة.
- احسب عدد الفيروسات والخلايا الموجبة.
- قم بقياس المساحة الموجبة الإجمالية وتحويلها من وحدات البكسل إلى مم2. اختياريا ، قم بتسجيل المنطقة التي تشغلها الفيروسات والخلايا الموجبة في مم2 إذا كان التحليل يتطلب استخدام خلايا قياسية وأحجام فيريون بدلا من العد المباشر.
- تراكب الكائنات الإيجابية على الصورة الأصلية واحفظ النتيجة.
ملاحظة: يتم الإبلاغ عن بيانات ISH من خلال عدد الفيروسات لكل 106 نوى (خلايا) وعدد خلايا vRNA + المصابة بشكل منتج لكل 106 نوى (خلايا) لفهم أفضل وتسهيل المقارنة مع بيانات qPCR ، ولكن يمكن أيضا الإبلاغ عن النتائج حسب مساحة الأنسجة في مم2.
النتائج
في مخطوطة سابقة2،6،7،8،9،10،11 ، أبلغنا أنه يمكن دمج منصات ISH من الجيل التالي التي تكتشف إما vRNA أو vDNA ، باستخدام مجسات الإحساس (vDNA) التي تستهدف جزء 5 'gag-pol من جينوم SIV / HIV ومجسات مضادة للمعنى (vRNA) تستهدف الجينات في 3 'نصف الجينوم (VIF, VPX, VPR, tat و env و nef) بالإضافة إلى عنصر TAR في الجينوم 5 '(الجدول 1). يميز هذا النهج الخلايا النشطة النسخ (vRNA + ، vDNA +) عن الخلايا المصابة غير النشطة (الكامنة بشكل مفترض) أو الخلايا التي تؤوي فيروسات أولية غير كفؤة النسخ (vRNA- ، vDNA +) في نفس قسم الأنسجة2 (الشكل 1).
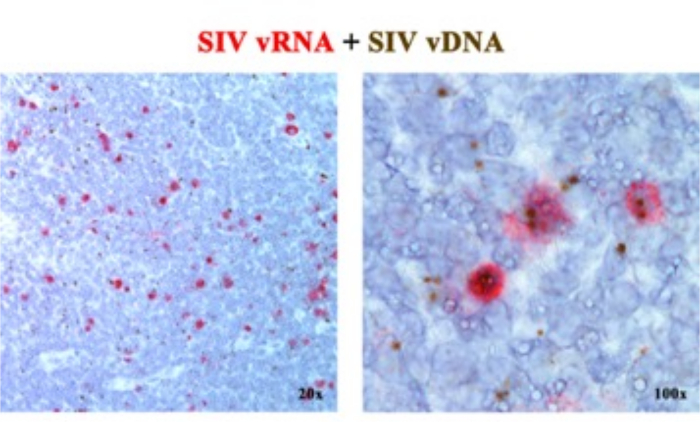
الشكل 1: الكشف عن الحمض النووي الريبي الفيروسي وvDNA في نفس قسم الأنسجة. مزيج من كل من تهجين الحمض النووي الريبي (الأحمر) وتهجين الحمض النووي (البني) في العقدة الليمفاوية RM المصابة بشكل حاد ب SIV مما يدل على القدرة على اكتشاف vRNA و vDNA في نفس قسم الأنسجة وتوفير نهج قوي لتحديد خلايا vDNA + vRNA الصامتة في الموقع. تم تعديل هذا الرقم من Deleage C. et al.2. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مجموعات مسبار RNA / DNAscope أحادية Plex | |||
| اسم | كتالوج ACD # | عدد ZZ | وصف |
| SIVmac239 (مضاد للاستشعار) | 312811 | 83 | استهداف المسبار المضاد للمعنى في حدود 1251-9420 نقطة أساس من D01065.1 (gag و pol و vif و vpx و vpr و tat و env و nef) |
| SIVmac239 (الاستسه) | 314071 | 83 | مسبار الاستشعار الذي يستهدف الخيط العكسي في حدود 1251-9420 نقطة أساس من D01065.1 (gag و pol و vif و vpx و vpr و tat و env و nef) |
| V-HIV1-Clade A (مضاد للإحساس) | 416101 | 80 | استهداف المسبار المضاد للمعنى في حدود 879-7629 نقطة أساس من إجماع فيروس نقص المناعة البشرية -1 Clade A (gag و pol و vif و vpr و tat و rev و vpu و env و nef) |
| V-HIV1-Clade A (الإحساس) | 426341 | 80 | مسبار الإحساس الذي يستهدف الخيط العكسي في حدود 879-7629 نقطة أساس من إجماع Clade A لفيروس نقص المناعة البشرية -1 (gag و pol و vif و vpr و tat و rev و vpu و env و nef) |
| V-HIV1-Clade B (مضاد للإحساس) | 416111 | 78 | استهداف المسبار المضاد للحس في حدود 854-8291 نقطة أساس من AF324493.2 ، فيروس نقص المناعة البشرية -1 Clade B NL4-3 (gag ، pol ، vif ، vpr ، tat ، rev ، vpu ، env ، و nef) |
| V-HIV1-Clade B (الإحساس) | 425531 | 78 | مسبار الاستشعار الذي يستهدف الخيط العكسي في حدود 854-8291 نقطة أساس من AF324493.2 ، HIV-1 Clade B NL4-3 (gag ، pol ، vif ، vpr ، tat ، rev ، vpu ، env ، و nef) |
| V-HIV1-Clade D (مضاد للإحساس) | 416121 | 76 | استهداف المسبار المضاد للمعنى في حدود 894-7697 نقطة أساس من إجماع فيروس نقص المناعة البشرية -1 Clade D (gag ، pol ، vif ، vpr ، tat ، rev ، vpu ، env ، nef) |
| V-HIV1-Clade D (الإحساس) | 426351 | 76 | مسبار الإحساس الذي يستهدف الخيط العكسي في حدود 894-7697 نقطة أساس من إجماع فيروس نقص المناعة البشرية -1 Clade D (gag ، pol ، vif ، vpr ، tat ، rev ، vpu ، env ، nef) |
| مجموعات مسبار الحمض النووي الريبي / منظار الحمض النووي متعددة الإرسال | |||
| اسم | كتالوج ACD # | عدد ZZ | وصف |
| V-SIVmac239-gag-pol-Sense-C1 | هاتف: 416141-C1 | 40 | مسبار الاستشعار الذي يستهدف الخيط العكسي في حدود 1251-4093 نقطة أساس من D01065.1 (الكمامة والبول) |
| V-SIVmac239-vif-env-nef-tar-C2 (مضاد للإحساس) | هاتف: 416131-C2 | 47 | استهداف المسبار المضاد للمعنى في حدود 5381-10257 نقطة أساس من D01065.1 (vif و vpx و vpr و tat و env و nef وعنصر TAR) |
| V-HIV1-Clade_B-gag-pol-sense-C1 | هاتف: 444051-ج1 | 40 | مسبار الاستشعار الذي يستهدف الخيط العكسي في حدود 854-3940 نقطة أساس من AF324493.2 ، HIV-1 Clade B NL4-3 (gag and pol) |
| V-HIV1-Clade_B-vif-vpr-tat-rev-vpu-env-nef-tar-C2 (مضاد للإحساس) | هاتف: 444061-ج2 | 40 | استهداف المسبار المضاد للاستحساس في حدود 5042-9673 نقطة أساس من AF324493.2 ، وفيروس نقص المناعة البشرية -1 Clade B NL4-3 (vif ، vpr ، tat ، env ، nef ، وعنصر TAR) |
| V-HIV1-Clade_C-gag-pol-sense-C1 | هاتف: 444021-ج1 | 48 | مسبار الإحساس الذي يستهدف الخيط العكسي في حدود 888-5032 نقطة أساس من تسلسل إجماع Clade C لفيروس نقص المناعة البشرية -1 (الكمامة والبول) |
| V-HIV1-Clade_C-vif-vpr- rev-vpu-env-nef-tar-C2 (مضاد للاستحساس) | هاتف: 444041-ج2 | 49 | استهداف المسبار المضاد للاستشعار في حدود 5078-9698 نقطة أساس من تسلسل إجماع Clade C لفيروس العوز المناعي البشري-1 (vif، vpr، tat، env، nef، وعنصر TAR) |
| V-HIV1-Clade_AE-gag-pol-sense-C1 | هاتف: 444011-ج1 | 55 | مسبار الاستشعار الذي يستهدف الخيط العكسي في حدود 890-4812 نقطة أساس من AF259954.1 ، HIV-1 Clade AE (الكمامة والبول) |
| V-HIV1-Clade_AE-vif-vpr-tat-rev-vpu-env-nef-tar-C2 (مضاد للإحساس) | هاتف: 444031-ج2 | 57 | استهداف المسبار المضاد للاستشعار في حدود 5052-9694 نقطة أساس من AF259954.1 ، HIV-1 Clade AE (vif ، vpr ، tat ، env ، nef ، وعنصر TAR) |
الجدول 1: قائمة المجسات لاستهداف vRNA و vDNA لفيروس نقص المناعة البشرية -1 و SIV.
Discussion
التهجين في الموقع هو اختبار دقيق يتطلب صرامة ومعرفة أساسية بكيمياء الحمض النووي وبيولوجيا الخلية وعلم الأنسجة لتكون قادرة على تكييف كل خطوة حاسمة لتوطين الهدف في بيئة محفوظة جيدا. في هذه المناقشة ، نود أن نسلط الضوء على الخطوات الحاسمة حيث يكون استكشاف الأخطاء وإصلاحها أمرا بالغ الأهمية للحصول على نتائج دقيقة وقابلة للتفسير.
يعد تثبيت الأنسجة ومعالجتها أمرا بالغ الأهمية ويجب معالجته مقدما للتأكد من أن الفحص يمكن أن يحقق أفضل النتائج. يعد مثبت PFA المخزن المحايد (4٪ محضر حديثا) مثاليا لمقايسة الإرسال ثنائي الإتجاه. ومع ذلك ، يمكن أيضا إجراء الفحص على الأنسجة المجمدة (OCT) مع ظروف التثبيت المناسبة بعد التقطيع بالتبريد.
المعالجة المسبقة لأقسام الأنسجة هي خطوة حاسمة. هناك خطوتان للمعالجة المسبقة في هذا الفحص: الأولى هي استرجاع الحاتمة الناجمة عن الحرارة (HIER). هذه الخطوة مهمة لعكس الروابط المتقاطعة لجسر الميثيلين واستعادة هياكل البروتين ، وهو أمر مطلوب في الأنسجة الثابتة. تعتمد كفاءة هذا العلاج على الوقت ودرجة الحرارة ونوع المخزن المؤقت للاسترجاع ودرجة الحموضة. المعالجة المسبقة الثانية هي استرجاع الحاتمة الناجم عن البروتياز (PIER). تشق هذه الخطوة الببتيدات ، وتعريض المستضد أو النيوكليوتيدات ، وتستخدم إنزيمات بما في ذلك البروتيناز K والتربسين والبيبسين. هذه خطوة حساسة للغاية يمكن أن تلحق الضرر بكل من مورفولوجيا الأنسجة والهدف المثير للاهتمام. يعد تركيز الإنزيم ، وكذلك وقت ودرجة حرارة الحضانة أمرا بالغ الأهمية في هذه العملية. يؤدي فرط الهضم إلى ضعف ترسيم النوى وصعوبة في خطوات القياس الكمي. من الأهمية بمكان إيجاد توازن بين الوصول الأمثل إلى هدف الحمض النووي الريبي / الحمض النووي وظروف المعالجة المسبقة التي لا تلحق الضرر بالأنسجة أو الهدف المهم. كل نوع من أنواع الأنسجة له مستوى مختلف من الحساسية لكل من هذه المعالجات المسبقة ويجب اختبار كل معلمة (تركيز الإنزيم والوقت ودرجة الحرارة) تجريبيا.
تعتمد صرامة المخزن المؤقت للغسيل على ثلاثة معايير رئيسية: درجة الحرارة وتركيز الأملاح والمنظفات والوقت. المخزن المؤقت للغسيل عبارة عن مخزن مؤقت لسترات الصوديوم المالحة (SSC) ، ويتحكم تركيز الملح داخل المخزن المؤقت في الصرامة أثناء خطوات الغسيل. في بروتوكولهم ، تنصح ACD باستخدام مخزن الغسيل المؤقت عند تركيز نهائي يبلغ 0.1x SSC ، 0.03٪ كبريتات الليثيوم دوديسيل. أثناء العمل على منظار الحمض النووي وتحسين تعدد الإرسال ، قررنا أن استخدام مخزن الغسيل المؤقت بتركيز نهائي يبلغ 0.05x SSC أعطانا نتائج أفضل لتصور إشارة الحمض النووي وساعدنا بشكل كبير في تقليل التهجين غير المحدد خارج الهدف الناتج عن الحضانة الليلية لمسبار الإحساس.
يجب التفكير في اختيار نهج الكشف ، الكروموجين (الأحمر أو البني) مقابل التألق بناء على نوع الأنسجة والهدف قبل البدء في الفحص. سيعطي نهج اللونان الأحمر تباينا لطيفا ، لأن اللون الأحمر غير موجود بشكل طبيعي في الأنسجة. سيعطي الكروموجين البني نتائج مماثلة للكروموجين الأحمر. ومع ذلك ، من المهم أن تضع في اعتبارك أن بعض منتجات تحلل الدم الموجودة في الأنسجة لها لون مماثل ، وسيكون من الصعب فصل حبر الوشم عن الإشارة البنية أثناء القياس الكمي. سيسمح نهج الكشف عن التألق بتمييز واضح بين العلامات الخلوية المختلفة وسيوفر تعدد الإرسال فحصا مثاليا للنمط الظاهري للخلايا التي تؤوي vRNA و / أو vDNA.
عناصر التحكم المتعددة ضرورية لضمان خصوصية المجسات وجودة الفحص. يجب اختبار كل مسبار مصمم حديثا على أنسجة التحكم الإيجابية والسلبية المعروفة أو كريات الخلايا. غالبا ما نقوم بإنشاء بلازميدات تحتوي على تسلسلنا المستهدف ونقوم بإجراء تعداء في خطوط الخلايا لتوليد عناصر تحكم إيجابية. لكل جولة نضيف نسيجا سلبيا معروفا (HIV أو SIV سلبي) ، وعنصر تحكم بدون مسبار يحتوي فقط على مخفف المسبار ، وعنصر تحكم معالج RNase لضمان جودة وخصوصية الفحص.
يعد القياس الكمي خطوة مهمة للغاية ويجب إجراؤه باستخدام الأدوات والخوارزمية المناسبة بناء على السؤال المطروح. في هذه المخطوطة ، قدمنا برنامجا لتحليل الصور (على سبيل المثال ، Cellprofiler) ، اخترناه بعد تقييم خيارات متعددة. قدرنا أن هذا البرنامج كان أفضل برنامج لاحتياجاتنا ، ولكن هناك العديد من برامج تحليل الصور التي يمكن استخدامها.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم تمويل هذا المشروع بالكامل بأموال فيدرالية من المعهد الوطني للسرطان ، المعاهد الوطنية للصحة ، بموجب رقم العقد. HHSN261200800001E ومنحة المركز الوطني لأبحاث الرئيسيات في ولاية أوريغون من قبل المعاهد الوطنية للصحة P51OD011092 (JDE). لا يعكس محتوى هذا المنشور بالضرورة وجهات نظر أو سياسات وزارة الصحة والخدمات الإنسانية ، ولا يعني ذكر الأسماء التجارية أو المنتجات التجارية أو المنظمات تأييدا من قبل حكومة الولايات المتحدة. تم تطوير الطباعة على الوجهين بمساعدة تشخيص الخلايا المتقدمة.
Materials
| Name | Company | Catalog Number | Comments |
| ACD HybEZII Hybridization system (110V) with ACD EZ-Batch Slides system | ACD | 321710 | Hybridization oven |
| CAT Hematoxylin | Biocare medical | CATHE-GAL | colorstain |
| Clear-Mount | ELECTRON MICROSCOPY SCIENCES | 17985-15 | mounting reagent for red chromogen |
| Immpact DAB Peroxidase Kit | Vector | SK-4105 | Used to reveal HRP - DAB (Brown) to replace the DAB coming in the ACD kit |
| lithium carbonate | Fisher chemical | L119-500 | bluing solution |
| paraformaldehyde | ELECTRON MICROSCOPY SCIENCES | 15714-S | for tissue fixation (4%) |
| PBS | life technology | 14190-136 | |
| Permount Mounting Medium | ThermoFisher Scientific | SP15-100 | mounting regaent for brown chromogen |
| Prolong Gold | ThermoFisher Scientific | P36930 | mounting regaent for fluorescence |
| ribonucleases A | ThermoFisher Scientific | 12091039 | for RNAse treatment in DNAscope protocol |
| ribonucleases T1 | Roche | R1003 | for RNAse treatment in DNAscope protocol |
| RNAscope 2.5, 2-plex detection reagent | ACD | 322430 | Brown and red kit chromogen detection |
| RNAscope Target Retrieval Reagents | ACD | 322000 | retrieval buffer |
| SuperFrost Plus Glass Slides | ThermoFisher Scientific | 12-550-17 | |
| TBS | BOSTON BIOPRODUCTS | BM-301-4L | for washes |
| TSA Plus Fluorescence palette kit (Cy3, Cy5, TMR, Fluorescein) | Perkin elmer | NEL760001KT | HRP Fluorescence detection |
| Tween 20 | SIGMA | P1379-1L | for washes |
| XYLENE 20LT | ThermoFisher Scientific | AC422680200 |
References
- Wang, F., et al. RNAscope: a novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. Journal of Molecular Diagnosis. 14 (1), 22-29 (2012).
- Deleage, C., et al. Defining HIV and SIV Reservoirs in Lymphoid Tissues. Pathogens and Immunity. 1 (1), 68-106 (2016).
- Sengupta, S., Siliciano, R. F. Targeting the Latent Reservoir for HIV-1. Immunity. 48 (5), 872-895 (2018).
- Churchill, M. J., Deeks, S. G., Margolis, D. M., Siliciano, R. F., Swanstrom, R. HIV reservoirs: what, where and how to target them. Nature Reviews Microbiology. 14 (1), 55-60 (2016).
- McQuin, C., et al. CellProfiler 3.0: Next-generation image processing for biology. PLoS Biology. 16 (7), e2005970 (2018).
- Deleage, C., Chan, C. N., Busman-Sahay, K., Estes, J. D. Next-generation in situ hybridization approaches to define and quantify HIV and SIV reservoirs in tissue microenvironments. Retrovirology. 15 (1), 4 (2018).
- Deleage, C., Turkbey, B., Estes, J. D. Imaging lymphoid tissues in nonhuman primates to understand SIV pathogenesis and persistence. Current Opinion in Virology. 19, 77-84 (2016).
- Estes, J. D., et al. Defining total-body AIDS-virus burden with implications for curative strategies. Nature Medicine. 23 (11), 1271-1276 (2017).
- Mavigner, M., et al. Simian Immunodeficiency Virus Persistence in Cellular and Anatomic Reservoirs in Antiretroviral Therapy-Suppressed Infant Rhesus Macaques. Journal of Virology. 92 (18), (2018).
- Peterson, C. W., et al. Differential impact of transplantation on peripheral and tissue-associated viral reservoirs: Implications for HIV gene therapy. PLoS Pathogen. 14 (4), e1006956 (2018).
- Deleage, C., et al. Impact of early cART in the gut during acute HIV infection. Journal of Clinical Investigation Insight. 1 (10), e87065 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved