Method Article
العزلة والكولاجين 3D ساندويتش الثقافة من الخلايا الكبدية الماوس الاساسيه لدراسة دور Cytoskeleton في الصفراء الصفراوية تكوين في المختبر
In This Article
Summary
المقدمة هنا هو بروتوكول لعزل الخلايا الكبدية الماوس من كبد الفار الكبار باستخدام تقنيه ترويه المعدلة كولاجيناز. كما يوصف هو ثقافة طويلة الأجل من الخلايا الكبدية في اعداد ساندويتش الكولاجين 3d ، فضلا عن المناعية للمكونات خلوي لدراسة تشكيل الصفراوية كاناليكاجي واستجابتها للعلاج.
Abstract
الكبد هي الخلايا المركزية للكبد المسؤولة عن وظيفتها الايضيه. علي هذا النحو ، فانها تشكل ظهاره الاستقطاب فريد ، والتي تسهم فيها اثنين أو أكثر من الخلايا الكبدية اغشيه قمي لتشكيل شبكه قنيوي الصفراوية من خلالها يفرز الصفراء. الاستقطاب الكبد أمر ضروري لتشكيل قنيوي الصحيح ويعتمد علي التفاعلات بين cytoskeleton الخلايا الكبدية ، والاتصالات خليه خليه ، ومصفوفة خارج الخلية. في المختبر الدراسات من الخلايا الكبدية مشاركه خلوي في تشكيل كاناليكولي واستجابتها للحالات المرضية ويعوقها عدم وجود ثقافة الخلية ، والتي من شانها ان تشبه بشكل وثيق بنيه شبكه كاناليكولي في الجسم الفيفو. وصف هنا هو بروتوكول لعزل الخلايا الكبدية الماوس من الكبد الفار الكبار باستخدام تقنيه ترويه التحوير المعدلة. كما هو موضح هو إنتاج الثقافة في اعداد ساندويتش الكولاجين 3d ، والذي يستخدم للمناعة من مكونات خلوي لدراسة تشكيل الصفراوية قنيوي واستجابتها للعلاجات في المختبر. ويظهر ان الخلايا الكبدية 3d الكولاجين ساندويتش الثقافات تستجيب للعلاجات مع السموم (الايثانول) أو الاكتين خلوي تغيير المخدرات (علي سبيل المثال ، blebbistatin) وبمثابه أداه قيمه للدراسات في المختبر من تكوين كاناليكولي الصفراوية ووظيفتها.
Introduction
الخلايا الكبدية ، والهياكل الخلوية المركزية للكبد التي هي المسؤولة عن وظائفها الايضيه ، هي فريدة من نوعها الاستقطاب الظهاريه. الاستقطاب ، والتي تظهر في الثدييات بعد فتره وجيزة من الولادة ، والنتائج في تشكيل شبكه قنيوي الصفراوية وضروري لإفراز الصفراء السليم. الاغشيه apical من الخلايا الكبدية تشكل مجتمعه canaliculi الصفراوية ، في حين تبقي الاغشيه القاعدية في اتصال مع بطانة من السينويدات. يؤدي فقدان استقطاب الخلايا الكبدية إلى أعاده توزيع الناقلات الصفراوية والنتائج في العمليات المرضية المرتبطة باحتباس الصفراء في الكبد (اي ، الركود الصفراوي).
إنشاء وصيانة الاستقطاب الخلايا الكبدية وتطوير كاناليكولي الصفراوية يستتبع أليات معقده. تعتمد العمليات الاساسيه علي التفاعل الجماعي بين خلايا الكبد الخلوية ، واتصالات خلايا الخلية ، والتفاعلات مع المصفوفة الخارجة عن الخلية1. يتكون الخلايا الكبدية من جميع الشبكات خيوط الثلاثة ، و خلوي الاكتين ، الأنابيب الدقيقة ، وخيوط المتوسطة ، والتي توفر الدعم الهيكلي لتشكيل قنيوي. وقد سبق توضيح الدور التفاضلي للمكونات خلوي في تجديد وصيانة الشبكات الصفراوية قنيوي في المختبر في 3d الكولاجين-ساندويتش الكبد الثقافات2.
الخيوط الدقيقة actin والأنابيب الدقيقة هي مهمة خلال المراحل الاوليه من الاستقطاب غشاء الخلايا الكبدية في مواقع الجيل كاناليكولوس2. ال [اكتيتن] يؤسس البنية وعمل من [كنكلولي] صفراويه, يشكل غشاء-يرتبط [ميكروخيوط] والحلقة محيطيه, لذلك يساند الهندسة المعمارية [كنولولار] ويدخل ال [اكتيتن] [سيتوسيتون] داخل مشدودة وملتصقة تقاطعات3. الحلقة من الشعيرات المتوسطة الكيراتين خارج الجهاز الخلوي الأكثر استقرارا هيكل قنيوي3.
وقد تم توثيق اهميه البروتينات في مجمعات الخلايا الكبدية في تنظيم الهندسة المعمارية كاناليكولي الصفراوية بشكل جيد في عده نماذج الماوس تدق الخروج ، والتي تظهر المشوهة كاناليكولي في الفئران التي تفتقر إلى كل من ضيق و/أو تمسك البروتينات الموجبة4،5،6. حذف البروتين تقاطع الملتصقة α-catenin وقد ثبت ان يؤدي إلى فوضي من الخلايا الكبدية الدهنية الخلوية ، وتوسع من شمعه قنيوي الصفراوية ، التقاطعات ضيقه راشح ، وبشكل فعال إلى النمط الظاهري الركودي4. وعلاوة علي ذلك ، أظهرت الدراسات في المختبر اهميه التمسك مكونات تقاطع E-الملتصقون و β-catenin في أعاده عرض التجويف كبديه قمي والبروتين الاتجار7.
لافت للنظر ، والاجتثاث من سيتوكلاتون البروتين المتقاطع plectin ، والذي هو منظم الكيراتين الرئيسية ، وكشفت الأنماط الظاهرية مماثله لتلك المرتبطة بالشبكات الخلويةالثمانية. وهذا يوحي بدور حاسم من خيوط الكيراتين المتوسطة في دعم هيكل كاناليكاجي. في المختبر الدراسات التي تستخدم 3d الكبد الكولاجين السندويشات وأظهرت أيضا اهميه كيناز البروتين المنشط AMP ولها LKB1 المنشط المنبع في تكوين شبكه قنيوي الصفراوية9. بعد ذلك أكدت هذا استنتاجات كان لاحقا في [فيفو] دراسات10,11. التالي ، فقد أصبح من الواضح ان الدراسات في المختبر ضرورية لتعزيز فهم عمليات الإشارات المشاركة في إنشاء الاستقطاب الخلايا الكبدية ، وتشكيل شبكه قنيوي السليم ، وإفراز الصفراء.
ومن التحديات الرئيسية في دراسة العمليات المرتبطة بتكوين الصفراء الصفراوية واستجابتها للحالات المرضية في المختبر استخدام ظروف ثقافة الخلية التي تشبه بشكل وثيق الوضع في الجسم المجري12. الخلايا الكبدية الاوليه المعزولة الطازجة ليست مستقطبه. وهكذا ، فانها تفقد وظيفتها ، المورفولوجية ، والصفراوية الوظيفية كاناليكولي في ظروف الثقافة 2d (علي سبيل المثال ، التغييرات في تنظيم الجينات ، والاستقطاب ، وأزاله التمايز13،14،15). علي الرغم من هذه الحقيقة, الخلايا الكبدية المعزولة الطازجة تعكس بشكل وثيق طبيعة الكبد في الجسم الطبيعي, علي عكس الكبد مشتقه من خطوط الخلايا16. علي الرغم من انها قد استخدمت في الماضي ، وخطوط الخلايا الخلد لا تمارس المورفولوجية مثل الشكل المميز للخلايا الكبدية ، والصفراوية شمعه كاناليكاجي التي تشكلها هذه الخلايا تشبه canalميكولi الكبد سيئه7. في الاونه الاخيره ، أصبحت الثقافات 3d من الخلايا الكبدية الاوليه ، من كل من الفئران والجرذان ، أداه مفيده للتحقيق في العمليات التي تنطوي علي تكوين شبكه قنيوي الصفراوية في المختبر9. يمكن للخلايا الكبدية الاوليه المستزرعة بين طبقتين من الكولاجين (يشار اليها باسم ثقافة ساندويتش الكولاجين ثلاثي الابعاد) ان تعيد الاستقطاب في عده أيام. بسبب الطلبات التقنية العالية المطلوبة عند زراعه الخلايا الكبدية الماوس في السندويشات الكولاجين 3d ، هنا نقدم بروتوكول معقده لعزل ، للزراعة ، والخلايا الكبدية الماوس المناعية جزءا لا يتجزا من السندويشات الكولاجين 3d من أجل توصيف مشاركه مكونات خلوي خلال تشكيل قنيوي الصفراوية.
Protocol
وأجريت جميع التجارب الحيوانية وفقا للتوجيه الأوروبي 2010/63/EU ووافقت عليها اللجنة المركزية التشيكية لرعاية الماشية.
1-المواد
- المنزل الحيوانية تحت ظروف محدده خاليه من العوامل الممرضة وفقا للمبادئ التوجيهية للاتحاد لجمعيات العلوم الحيوانية المختبرية مع حريه الوصول إلى الطعام العادي ومياه الشرب. منزل الحيوانية تحت 12 ساعة/12 ساعة الظلام/ضوء دوره. لعزل الخلايا الكبدية والثقافة ، واستخدام 8-12 أسبوعا من العمر الحيوانية.
- حلول الأسهم الف وباء
- اعداد حل المخزون A والحل الأسهم B وفقا للجدول 1 والجدول 2، علي التوالي ، مقدما. ذوب جميع المكونات في 1 لتر من المقطر H2o (dH2o).
- ضبط درجه الحموضة من الحلول إلى 7.2 وتصفيه الحلول من خلال فلتر 0.2 μm. يمكن تخزين كلا الحلين في 4 درجات مئوية لمده تصل إلى 6 أشهر.
- حل الأسهم C
- اعداد الحل C في يوم عزل الخلايا الكبدية الاوليه.
- أضافه جميع المكونات وفقا للجدول 3 ، وملء إلى 50 mL الحجم الإجمالي مع dH2س ، وتذوب. ضبط درجه الحموضة إلى 7.3.
- Aliquot 50 mL من الحل في أنابيب 50 mL. استخدام أنبوب واحد لكل الحيوانية. ضع جميع الارصفه المطلوبة في حمام مائي قبل التسخين (37 درجه مئوية).
- حل الأسهم D
- اعداد الحل D في يوم عزل الخلايا الكبدية الاوليه.
- قم باضافه جميع المكونات وفقا للجدول 4، وأملا الحجم الكلي بمقدار 30 مللي بقيمه2س ، وذوب. ضبط درجه الحموضة إلى 7.3.
- Aliquot 30 مل من الحل في أنابيب 50 mL. أضافه كولاجيناز انا (5 مغ/30 مل) في الحل d. استخدام واحده من القسامه لكل الحيوانية. وضع جميع قسامات في حمام مياه الحرارة السابقة (37 درجه مئوية).
- حل الأسهم E
- اعداد الحل E في يوم عزل الخلايا الكبدية الاوليه.
- أضافه جميع المكونات وفقا للجدول 5 ، وملء إلى 50 mL الحجم الإجمالي مع dH2س ، وتذوب. ضبط درجه الحموضة إلى 7.3.
- Aliquot 50 mL من الحل في أنابيب 50 mL. أضافه الزلال الخامس (0.65 g/50 mL) في الحل e. استخدام واحده علي الارصفه لكل الحيوانية. وضع جميع قسامات في حمام مياه الحرارة السابقة (37 درجه مئوية).
2. اعداد السندويشات الكولاجين
- قبل يوم واحد من عزل الخلايا الكبدية الاوليه ، واعداد الطبقة الاولي من الكولاجين انا ساندويتش.
ملاحظه: العمل علي الجليد واستخدام الحلول المبردة مسبقا ، نصائح ، لوحات ، وأنابيب للتقليل من دبق غير المرغوب فيها من الكولاجين انا. - تحييد الكمية المطلوبة من الكولاجين I (من ذيل الفئران) وفقا لبروتوكول الشركة المصنعة. مطلوب حجم 100 μL من الكولاجين المتعادل (1.5 ملغم/مل) لكل عينه تجريبية (طبق 3.5 سم). لاعداد 1 مل من الكولاجين تحييد (1.5 ملغ/مل) ، أضافه 100 μL من 10x DMEM ، 1.5 μL من NaOH 1M ، و 48.5 μL من dH2O إلى 500 μl من الكولاجين (تركيز الأسهم = 3 ملغ/مل). التحقق من درجه الحموضة من الكولاجين تحييد مع ورقه عباد الأس (يجب ان يكون الأس الهيدروجيني ~ 7.5).
- تفريق 100 μL من محلول الكولاجين تحييد بالتساوي باستخدام المبردة مسبقا 200 μL غيض علي سطح طبق 3.5 سم مجموعه علي الجليد.
- احتضان بين عشيه وضحيها تحت ظروف الثقافة القياسية (حاضنه مع 5 ٪ CO2 في 37 درجه مئوية). في يوم العزلة الكبدية الاوليه ، أضف 1 مل من الحرارة السابقة (37 درجه مئوية) إلى طبقه الكولاجين الاولي. السماح للكولاجين لترطيب ل 2-3 ح في 37 درجه مئوية.
3-المعدات التي أنشئت
- اعداد جميع المعدات المدرجة في جدول المواد واعدادها كما هو موضح في الشكل 1.
4. العملية الجراحية
- تخدير الماوس عن طريق الحقن العضلي من tiletamine (60 ملغ/كغ من وزن الجسم) ، زولازيبام (60 ملغم/كغ) ، والاكسيليازين (4.5 ملغم/كغ). بعد عده دقائق ، تاكد من التخدير السليم بواسطة قرصه اصبع القدم. إذا كان الحيوانية لا تستجيب لقرصه ، والمضي قدما إلى 4.2.
- وضع الماوس تخدير علي حصيره تشريح والشريط الأطراف السفلية والعليا لإصلاح الماوس في موقف ضعيف. مسحه البطن مع 70 ٪ الايثانول وفتح البطن مع شق علي شكل V من منطقه العانة إلى الساقين الاماميه. اضعاف الجلد فوق الصدر للكشف عن تجويف البطن. وضع حصيره تشريح تحت المجهر تشريح.
- ينحني ابره حقنه الانسولين (30 G) إلى زاوية 45 درجه. فضح الوريد الأجوف السفلي (ivc) عن طريق تحريك الأمعاء والقولون في الاتجاه الذيليه.
- أملا 2.5 مل من محلول التسخين المسبق (37 درجه مئوية) C في حقنه 2 مل مع الكانولا. تاكد من عدم وجود فقاعات الهواء في قني أو حقنه.
- قبل التعليب من IVC ، وأعاده وضع فصوص الكبد عن طريق الضغط عليها حتى الحجاب الحاجز مع مسحه القطن الرطب (تلفزيوني). وضع خياطه الحرير حول IVC تحت الكبد فقط (الشكل 2ا ، ب).
- حقن 10 μL من الهيبارين (5000 U/mL) في الوريد المدخل باستخدام حقنه الانسولين مع 30 G ابره عازمه علي زاوية 45 ° (الشكل 2ج).
- لتعليب الكبد ، وجعل شق صغير مع مقص الجراحية المجهرية إلى IVC مباشره بجوار الكبد (تحت الخياطة. الشكل 2د) الذي هو كبير بما فيه الكفاية لادراج cannula. تامين قني في الموقف باستخدام الغرز واثنين من عقده الجراحية (الشكل 2ه).
- قطع الوريد المدخل (الشكل 2و) للسماح المخازن المؤقتة ترويه للتدفق من الكبد لمنع التوسع في الكبد.
- حقنت يدويا الكبد مع 1.5 mL من محلول قبل تسخينه C بالضغط ببطء علي حقنه متصلة قني (وهذا ينبغي ان يستغرق ~ 15 ق). أزاله الدم من الكبد عن طريق تلون الكبد يمكن الآن ان يلاحظ.
- أملا المضخة التمعجيه مسبقا بمحلول التسخين المسبق (37 درجه مئوية) c. التحقق من جهاز ترويه وضمان عدم وجود فقاعات الهواء في النظام.
- افصل الكانولا بحذر من الحقنه وتوصيله بأنابيب المضخة التمعجيه التي تعمل بمعدل تدفق 2.5 مل/دقيقه. العمل بسرعة ولكن بعناية وضمان ان قني لا يزال في الموقف وانه لا فقاعات تدخل الأنابيب أو قني.
- Perfuse الكبد مع محلول C لمده 2 دقيقه (5 مل من محلول C). تغيير إلى الحل d ومواصله ترويه لمده 10 دقيقه اضافيه (25 مل من الحل d).
- بمجرد ان يتم استخدام الكبد ، ازالته من تجويف البطن. سيكون الكبد الآن هشه جدا وشاحب في اللون (الشكل 3).
5. عزل الخلايا الكبدية الاوليه
- أزاله الكبد من الماوس. وسوف لا يزال يتم ربط قني إلى الكبد ، لذلك استخدام ملقط لرفع قني مع الكبد ، وقطع بعناية قباله جميع الوصلات اللفافة. نقل الكبد إلى أنبوب 50 mL التي تحتوي علي 20 مل من محلول الحرارة المسبقة E.
- عقد قني مع الكبد باستخدام ملقط واقران الانسجه عن طريق فرك الكبد حول جدار الأنبوب لنقل الخلايا الكبدية معزولة في العازلة. الحفاظ علي الخلايا المعزولة علي الجليد.
ملاحظه: خلايا الكبد الاوليه المعزولة قابله للحياة لعده ساعات بينما تبقي علي الجليد. يمكن للمستخدمين تكرار الخطوات 4.1 من خلال 5.2 عزل الخلايا الكبدية الاساسيه من ماوس مانح آخر ، إذا لزم الأمر ، أو المضي قدما إلى الخطوة التالية. - وضع مصفاه خليه النايلون 70 μm علي راس أنبوب 50 mL وتصفيه الخلايا المعزولة.
- الطرد المركزي الأنبوب في 50 x g و 4 درجه مئوية لمده 5 دقائق يستنشق العملاق. لأزاله الخلايا الميتة وزيادة النسبة المئوية للخلايا قابله للحياة ، وأعاده تعليق بيليه في 20 مل من 40 ٪ percol في DMEM.
- الطرد المركزي أنبوب في 50 x g و 4 درجه مئوية لمده 5 دقيقه. يستنشق ماده طافي التي تحتوي علي خلايا ميتة وأعاده تعليق بيليه في 20 مل من الحل E.
- أنابيب الطرد المركزي في 50 x g و 4 درجه مئوية لمده 5 دقيقه. يستنشق ماده طافي وأعاده تعليق بيليه في 10 مل من الحل E.
- تحقق من الغلة الكبدية الاساسيه والقدرة علي البقاء باستخدام التريلون الأزرق تلطيخ. حساب رقم الخلية باستخدام خليه نويباور غرفه العد وضبط تركيز الخلية إلى 3.75 × 105 خلايا قابله للحياة/مل. ابق الخلايا علي الثلج
6. زراعه الخلايا الكبدية الاوليه في السندويشات الكولاجين 3D
- اعداد ثقافة الخلايا الكبدية المتوسطة (HCM). أضافه 15 μL من جلوكاجون (1 ملغ/مل) ، 15 μL من هيدروكورتيزون (50 ملغ/مل) ، و 40 μL من الانسولين (10 ملغ/مل) إلى 50 مل من متوسطه كامله (DMEM ، الجلوكوز العالي ، 10 ٪ من الكربون ، 1 ٪ البنسلين-ستربتوميسين).
- تفريق بالتساوي 2 مل (5 × 105 خلايا/مل) من الكبد الاساسيه قابله للحياة في طبق ما قبل المغلفة 3.5 سم. احتضان الخلايا مع 5 ٪ CO2 في 37 درجه مئوية ل 3 ح. المهم: توزيع الخلايا بالتساوي عن طريق أماله الطبق في جميع الاتجاات فقط قبل وضع الطبق في الحاضنة.
- اعداد الكولاجين تحييد I (100 μL/3.5 cm طبق ، اي حجم كاف لجميع الاطباق كما هو موضح أعلاه [الخطوة 2.1]). تبقي علي الجليد حتى الاستخدام.
- بعد 3 ح ، وأزاله بعناية الخلايا المتوسطة وغير المرفقة وأضافه 100 μL من الكولاجين تحييد I لكل طبق 3.5 سم لتشكيل الطبقة العليا من ساندويتش الكولاجين علي الخلايا. احتضان ساندويتش الكولاجين تحت ظروف الخلية القياسية الثقافة (5 ٪ CO2 في 37 درجه مئوية) لمده 1 ساعة. بعد 1 h الحضانة ، أضافه بعناية 2 مل من HCM.
- بعد 24 ساعة من الثقافة ، تغيير المتوسطة HCM لواحده جديده.
- الثقافة لمده 3 – 8 أيام ، اعتمادا علي تشكيل canaliculi الصفراوية. تحقق من الثقافة كل يوم تحت المجهر (الشكل 4). تغيير HCM كل يوم ثان.
7. مناعة الخلايا الكبدية الاوليه في السندويشات الكولاجين 3D
- أزاله وسائل الاعلام من السندويشات الكبد ، ثم يغسل بعناية مع ما قبل الإحماء تلفزيوني. إصلاح الثقافات ساندويتش مع 1 مل من بارافورمالدهيد 4 ٪ في الخدمات التلفزيونية لمده 30 دقيقه في درجه حرارة الغرفة (RT).
- بعد التثبيت ، وغسل السندويشات 3x لمده 10 دقيقه في 2 مل من تلفزيوني + 0.1 ٪ توين 20 (تلفزيوني-T).
- تتخلل الخلايا مع 1 مل من 0.1 M الجليسين ، 0.2 ٪ تريتون X-100 في الاذاعه التلفزيونية في RT ل 1 ح. غسل 3x لمده 10 دقيقه في التلفزيونية الخاصة-T.
- يزعج بلطف الطبقة العليا من الكولاجين باستخدام 10 μL تلميح التحميل متصلة بشفط الفراغ لضمان اختراق الأجسام المضادة كافيه.
- كتله مع 1 مل من 5 ٪ جيش الصرب البوسنيين في التلفزيونية الخاصة-T (اي ، ومنع الحل) لمده 2 ح. احتضان مع الأجسام المضادة الاوليه المخففة في منع الحل بين عشيه وضحيها في 37 درجه مئوية. غسل 3x لمده 15 دقيقه في الاذاعه التلفزيونية-T.
- بعد الغسيل ، احتضان مع الأجسام المضادة الثانوية في 37 درجه مئوية ل 5 ح. غسل 3x لمده 15 دقيقه في تلفزيوني-T تليها 1x يغسل مع المقطر H2O.
- جبل مع وسائل الاعلام المضادة للتلاشي المتصاعدة (انظر جدول المواد) لمجهر.
النتائج
وكانت خلايا الكبد الاساسيه الماوس معزولة والمصنفة في السندويشات الكولاجين 3D. الصفراوية كاناليكولي بين اثنين من الخلايا المجاورة بدات تتشكل في غضون عده ساعات بعد البذر. شكلت الخلايا مجموعات والتنظيم الذاتي في شبكه منتظمة تقريبا من كاناليكولي الصفراوية في غضون يوم واحد (الشكل 4). في غضون 3-6 أيام ، وعاده ما لوحظت مجموعات من 5 إلى 10 خلايا ، مع الاستقطاب الكامل للخلايا الكبدية تشكيل شبكه قنيوي (الشكل 4).
علاج الخلايا الكبدية الماوس الاساسيه في السندويشات الكولاجين 3d مع اما السموم (الايثانول) أو المخدرات المغيرة cytoskeleton (علي سبيل المثال ، blebbistatin ، حمض okadaic) ادي إلى تغييرات في الخلايا الكبدية cytoskeleton ، كاناليكولي العرض والشكل ، وعدد من كاناليكولي الصفراوية التي تم توضيحها بواسطة المناعي مع الأجسام المضادة ل الكيراتين 8 (الكيراتين الأكثر وفره في الخلايا الكبدية) ، phسبائك (تصور F-actin) ، والأجسام المضادة لضيق تقاطع البروتين zonula أوككلودينس (ZO-1 ؛ الشكل 5).
وكان العلاج الايثانول فقط تاثير خفيف علي تنظيم الكيراتين 8; ومع ذلك ، فانه زاد من التورتوقي (كما راينا من تلطيخ F-actin) وتوزيع الاعراض الصفراوية كاناليكاجي (الشكل 5). وقد انخفضت شده الاشاره لتلطيخ زو-1 في الصفراوية المعالجة الايثانول بالمقارنة مع الضوابط غير المعالجة ، مما يوحي بفقدان التقاطعات الضيقة بعد العلاج الايثانول. تثبيط الانقباض العضلي مع blebbistatin يؤثر بشكل كبير علي شكل وعدد من canaliculi الصفراوية. وقد أعيد تنظيم شبكه قنيوي العادية, بالمقارنة مع الخلايا الكبدية غير المعالجة, في canalميكولi الصفراوية علي شكل غير منظم مع زيادة حدوث الصفراوية مستديرة سميكه canalميكولi بدلا من تلك طويلة رقيقه (كما راينا في الرسم البياني للعرض قنيوي).
بالاضافه إلى ذلك ، العلاج مع حمض okadaic (الزراعة العضوية) تثبيط الفوسفاتاسيس يؤثر بشده علي الخصائص الفيزيائية من الكيراتينات ، كما هو مبين سابقا8،17. الزراعة العضوية يتغير الذوبان من خيوط الكيراتين. لذلك, نتج المعالجة في أعاده تنظيم عميقة من ال [كيراتين] [مشعمل], اي انهار داخل [سيتوبلازمي مجاميع] كبيره. كلا F-actin وضيق تقاطع البروتين زو-1 لم يتم ترجمتها إلى اي هياكل معينه ، مما يوحي باختفاء كامل تقريبا من كاناليكولي الصفراوية المنظمة وفقدان كامل لقطبيه الكبد. وضاقت كاناليكولي الصفراوية المتبقية بشكل كبير بالمقارنة مع الضوابط غير المعالجة ، كما راينا في الرسم البياني العرض قنيوي (الشكل 5).
لربط الملاحظات المجهرية للتغيرات في خلوي الخلايا الكبدية مع الاستجابة البيوكيميائية كبديه للعلاج ، والبروتوكول أيضا قياس مستويات الأنين امينوترانسداز (ALT) و ترانساميناز اسبارتات (AST) (اثنين من انزيمات الكبد التي يشيع استخدامها كعلامات الاصابه كبديه) فيماده طافي من السندويشات العلاج الايثانول ارتفاعا كبيرا في مستويات كل من ALT و AST ، مما يوحي باصابه شديده في الخلايا الكبدية. لم يؤدي علاج blebbistatin إلى اي تغييرات كبيره في كل من المستويين ALT و AST مقارنه بعلاج حمض okadaic ، والتي تسببت في تغييرات بيوكيميائية معتدله مع زيادة مستويات ALT ، ولكن لا يوجد تغيير في مستويات AST. وهكذا ، علامات البيوكيميائية من أصابه كبديه تقاس في المختبر من الخلايا الكبدية الفائقة ترتبط مع التغيرات خلوي التي لوحظت من قبل المناعي.
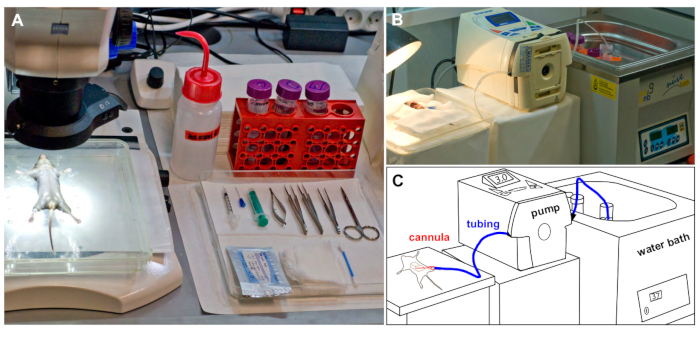
الشكل 1: الاعداد التجريبي. (ا) الماوس الثابتة في موقف ضعيف ، يوضع تحت المجهر تشريح قبل الجراحة. يتم وضع جميع الاداات الجراحية المطلوبة علي صينية. (B) جناح ترويه اثناء الفئران الكبد ترويه تظهر أنابيب السيليكون التي تربط الخزان مع العازلة الدافئة والماوس perfused مستخدمه. (ج) التمثيل التخطيطي ل b. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
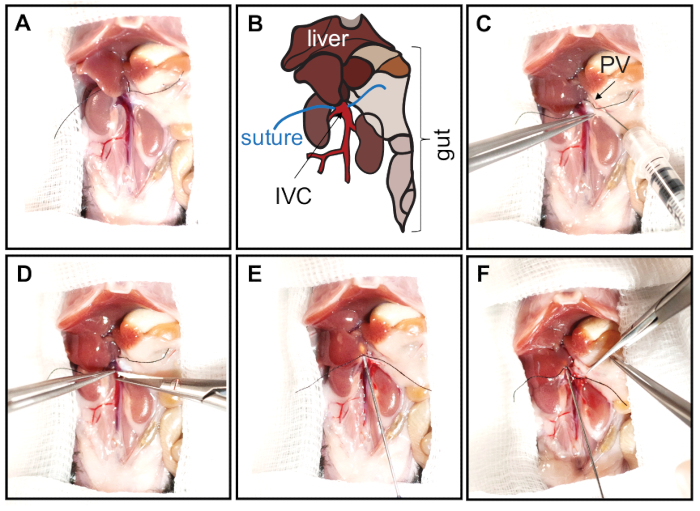
الشكل 2: فتح تجويف البطن والتعليب لل IVC. يتم فتح البطن مع شق علي شكل V من منطقه العانة إلى الساقين الاماميه. يتم طي الجلد فوق الصدر للكشف عن وتكبير تجويف البطن. لفضح IVC ، يتم نقل الأمعاء والقولون بعناية caudally. (الف ، باء) قبل القيام بالتعليب من ال IVC ، يجب ان يتم وضع فصوص الكبد عن طريق الضغط عليها صعودا إلى الحجاب الحاجز مع مسحه من القطن المبلل بالماسح الضوئي. ثم يتم فصل بعناية من IVC من الانسجه المحيطة بها ، ويتم وضع خياطه الحرير حول IVC علي مقربه من الكبد. يمثل اللوحة B مخططات تجويف البطن الموضح في اللوحة A. يتم الاشاره إلى فصوص الكبد والأمعاء والوريد الأجوف السفلي (IVC والأحمر) والغرز. (C) يتم حقن الهيبارين في الوريد المدخل (PV ، السهم) مع حقنه الانسولين (30 G ابره عازمه علي 45 درجه زاوية). (د) لتعليب الكبد ، يتم التطعيم مباشره بجانب الكبد (تحت الخياطة). (ه) يتم إدخال الكانولا وتامينها بالغرز عن طريق ربط عقده جراحيه اثنين. (و) يتم قطع الوريد المدخل بالبالكامل للسماح بالتدفق الحر للمخزن المؤقت ، مما يمنع توسع الكبد. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
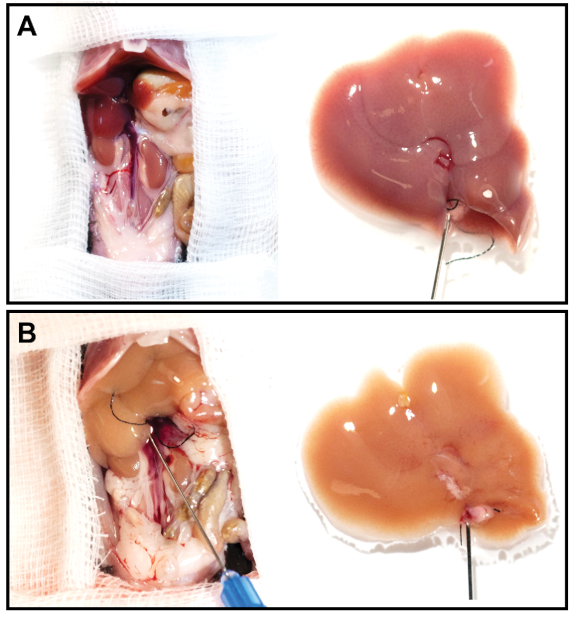
الشكل 3: صور الكبد التمثيلية قبل وبعد التروية. (الف ، باء) تم تقسيم الكبد الذي تم تعليبه واستخدامه لمده 12 دقيقه بمعدل تدفق 2.5 مل/دقيقه. لاحظ الكبد المشوه بشكل ملحوظ بعد الانصهار (B) بالمقارنة مع الكبد الذي تم استئصاله حديثا (A). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 4: ثقافة ساندويتش الكولاجين 3D من خلايا الكبد الماوس الاساسيه. تمثيل الصور الميدانية الساطعة للخلايا الكبدية الاساسيه للماوس لمده 1 و 2 و 3 أيام في ظروف ثلاثية الابعاد. وتجدر الاشاره إلى ان مجموعات أكبر من الخلايا المنظمة بشكل كبير تتشكل بعد 3 أيام في الثقافة. المناطق محاصر تظهر ~ 3x تضخيم الصور. نصال تشير إلى الصفراوية canaliculi. شريط مقياس = 100 μm. الرجاء النقر هنا لعرض نسخه أكبر من هذا الرقم.
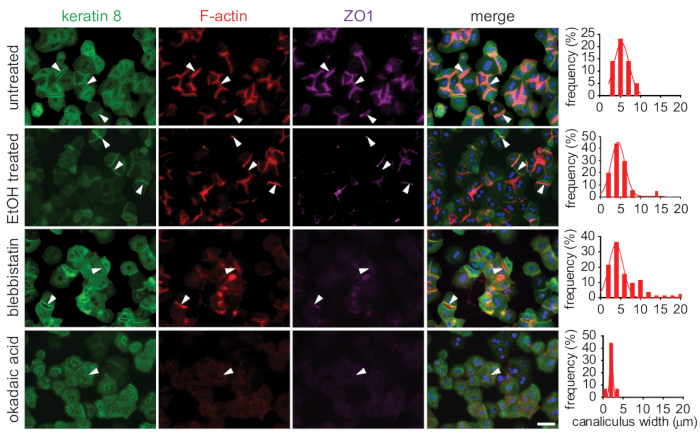
الشكل 5: تقييم الاستجابة المورفولوجية للإجهاد السام عن طريق المجهر الضوئي المناعي. تم التعامل مع الخلايا الكبدية الماوس الاساسيه المستزرعة في السندويشات الكولاجين 3D مع السموم (الايثانول ، blebbistatin ، أو حمض okadaic) في اليوم 3 من الثقافة. كانت ملطخه الخلايا الثابتة لتصور مكونات خلوي: الكيراتين 8 (الأخضر) ، F-actin (الأحمر) ، و zonula أوككلودينس (ZO-1 ، أرجواني) عن طريق المناعي. المعالجة السامة أدت إلى فوضي من المكونات خلوي تصور ، وانها خفضت عدد وزيادة المرارة من canaliculi الصفراوية. وقد قيست الاعراض الحلقية في الخلايا الكبدية غير المعالجة والمعالجة ، كما تم تصويرها علي انها رسوم بيانيه لتوزيع الاعراض. نصال تشير إلى الصفراوية canaliculi. شريط مقياس = 100 μm. الرجاء النقر هنا لعرض نسخه أكبر من هذا الرقم.
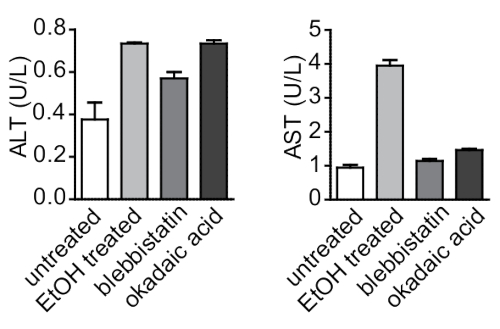
الشكل 6: التحليل البيوكيميائي لاستجابه سندويشات الكولاجين ثلاثية الابعاد للاصابه السامة في المختبر. تم قياس ALT و AST ، علامات راسخة من الإصابات الكبدية ، في ماده طافي من السندويشات الكولاجين الكبد 3d تعامل مع السموم (الايثانول ، blebbistatin ، وحمض okadaic). تم رفع ALT و AST في الخلايا المعالجة مقارنه بغير المعالجة. يتم الإبلاغ عن البيانات كوسائل حسابيه ± SEM. الرجاء النقر هنا لعرض نسخه أكبر من هذا الرقم.
| حل الأسهم A (10x) | |
| كاشف | التركيز النهائي (ز/لتر) |
| كلوريد | 80 |
| بوكل | 4 |
| MgSO4· 7h2س | 1.97 |
| Na2hpo4· 2h2س | 0.598 |
| KH2PO4 | 0.6 |
الجدول 1: حل المخزون وصفه.
| الحل الأسهم B (10x) | |
| كاشف | التركيز النهائي (ز/لتر) |
| كلوريد | 69 |
| بوكل | 3.6 |
| KH2PO4 | 1.30 |
| MgSO4· 7h2س | 2.94 |
| CaCl2 | 2.772 |
الجدول 2: وصفه حل المخزون B.
| الحل جيم | |
| كاشف | |
| حل الأسهم A (10x) | 5 مل |
| شركه النهدي3 | 0.1094 غ |
| EGTA | 0.0095 غ |
| 2س dH | إلى 50 mL |
الجدول 3: وصفه محلول الأسهم C.
| الحل دال | |
| كاشف | |
| حل الأسهم A (10x) | 3 مل |
| شركه النهدي3 | 0.065 غ |
| CaCl2 | 0.0125 غ |
| 2س dH | إلى 30 مل |
الجدول 4: وصفه حل الأسهم D.
| الحل هاء | |
| كاشف | |
| حل الأسهم B (10x) | 5 مل |
| شركه النهدي3 | 0.1 غ |
| الجلوكوز | 0.045 غ |
| 2س dH | إلى 50 mL |
الجدول 5: وصفه حل الأسهم E.
Discussion
استخدام الماوس الثقافات الكبدية الاساسيه الهامه للدراسات في المختبر لفهم أفضل عمليات الإشارات المشاركة في إنشاء الاستقطاب الكبد, تشكيل هيكل قنيوي السليم, وإفراز الصفراء. وقد دفعت التحديات في العزلة وثقافة طويلة الأجل من الخلايا الكبدية الاوليه الماوس في الثقافة 2D اختراع العديد من النهج التقنية مع زيادة العزلة الاستئجار وطول العمر من الخلايا المعزولة ، ولكل منها العديد من المزايا عيوب. ومن المقبول علي نطاق واسع الآن ان الثقافات 2D من الخلايا الكبدية الاوليه تقليد عدد محدود فقط من سمات بيولوجيا الكبد لفتره قصيرة من الزمن. وهكذا ، زراعه 3d في ترتيب ساندويتش الكولاجين علي نطاق واسع لتحل محل الظروف 2d ، وخاصه عندما تركز علي وظيفة خلوي في بيولوجيا الكبد (علي سبيل المثال ، اثار المخدرات السامة أو التنظيم المكاني للنقل الصفراوية).
منذ 1980s ، وقد وصفت عده بروتوكولات لعزل خلايا الكبد الماوس مع مختلف التعديلات. وقد أصبح نهج المزج بين الخطوتين الثنائية الاتجاه يستخدم علي نطاق واسع في العديد من المختبرات. أضافه طرد التدرج في بروتوكول العزل يسمح بازاله الخلايا الميتة19،20 ويزيد بشكل كبير من عدد الخلايا القابلة للحياة (هنا ، بشكل روتيني إلى ~ 93 ٪). علي الرغم من ان هذه الخطوة تمتد وقت المناولة من الخلايا والنتائج في أرقام الخلايا المنخفضة21، وينظر إلى هذه الخطوة كما هو ضروري في ثقافة ساندويتش الكولاجين 3d لتشكيل شبكه قنيوي السليم. بالاضافه إلى ذلك ، فمن الأكثر اهميه للمضي قدما بسرعة وبدقه اثناء الخطوات ترويه ، الذي يقصر الوقت يتم التعامل مع الخلايا.
العوامل الهامه الأخرى التي تزيد من صلاحيه الخلايا وقدرتها علي تشكيل شبكات قنيوي في 3d هو استخدام الحلول الطازجة وتجنب فقاعات خلال perfusion. ولذلك ، يجب اعداد الحلول في يوم عزل الخلايا الكبدية الفاره ، ويجب فحص المضخة التمعجيه والأنابيب عند تغيير الحلول. إذا تم اتباع البروتوكول عن كثب ، يجب ان تكون عزله الخلايا الكبدية الاوليه ناجحه مع الغلة العالية للخلايا قابله للحياة.
وهناك عامل حاسم آخر في ثقافة الخلايا الكبدية ثلاثية الابعاد الطويلة الأجل هو المصدر الاولي للخلايا الكبدية الاوليه التي يتم استخدامها. من المهم استخدام الحيوانية التي هي 8-12 أسابيع من العمر ، والتي تخدم كمتبرعين الأمثل من الخلايا الكبدية. استخدام خلايا الكبد من الكائنات القديمة لم يكن ناجحا في الثقافة علي المدى الطويل, كما ان هذه الخلايا الكبدية غيرت المورفولوجية في كثير من الأحيان, الاستقطاب, وتوقفت عن تشكيل شبكات قنيوي. أيضا ، الخلايا الكبدية الطلاء علي بشكل صحيح تحييد هلام الكولاجين التي تشكلت من حل مركزه للغاية نسبيا هو خطوه حيوية. في معظم البروتوكولات ، يتم استخدام تركيزات حوالي 1 مغ/مل. بعد العديد من التحسينات, تركيز 1.5 مغ/مل هو الأمثل لزراعه الخلايا الكبدية علي المدى الطويل ويوفر الخلايا الكبدية المنظمة للغاية مع canaliculi الصفراوية المشكلة.
هذا البروتوكول سهله المتابعة يسمح للزراعة طويلة الأجل من خلايا الكبد الماوس الاساسيه. تظهر النتائج التمثيلية طيفا واسعا من الاستخدام لخلايا الكبد الاساسيه المثقفة ثلاثية الابعاد عند دراسة دور مكونات خلوي في تشكيل كاناليكولي الصفراوية.
Disclosures
وليس لدي المؤلفين ما يفصحون عنه.
Acknowledgements
وقد حظي هذا العمل بدعم وكاله المنح التابعة للجمهورية التشيكية (02699S) ؛ وكاله المنح التابعة لوزارة الصحة في الجمهورية التشيكية (31538A) ؛ مشروع البحوث المؤسسية للاكاديميه التشيكية للعلوم (RVO 68378050) و MEYS CR المشاريع (LQ1604 NPU II ، LTC17063 ، LM2015040 ، OP RDI CZ. 1.05/2.1.00/19.0395 ، و OP RVO CZ. 02.1.01/0.0/0.0/16_013/0001775) ؛ جامعه تشارلز (الراتب الشخصي لk.k.) ، وبرنامج تشغيلي براغ-مشروع القدرة التنافسية (CZ. 2.16/3.1.00/21547). ونحن نعترف الخفيفة المجهر الاساسيه مرفق ، IMG CAS ، براغ ، جمهوريه التشيك (دعم MEYS CR المشاريع LM2015062 و LO1419) للحصول علي الدعم مع التصوير المجهري قدم.
Materials
| Name | Company | Catalog Number | Comments |
| 35 mm TC-treated culture dish | Corning | 430165 | |
| 50 mL Centrifuge tubes, SuperClear, Ultra High Performance | VWR | 525-0156 | |
| 70 µm nylon cell strainer | Biologix | 15-1070 | |
| Albumin Fraction V | ROTH | 8076.4 | |
| Arteriotomy Cannula (1mm) | Medtronic | 31001 | |
| Calcium Chloride | Sigma-Aldrich | P5655 | |
| Collagen I. from Rat tail (3mg/ml) | Corning | 354249 | |
| Collagenase (from Clostridium Hystolyticum) | Sigma-Aldrich | C5138 | |
| D(+) glucose monohydrate | ROTH | 6780.1 | |
| Dissecting microscope | Zeiss | Stemi 508 | |
| DMEM, high glucose | Sigma-Aldrich | D6429 | |
| EGTA | ROTH | 3054.2 | |
| FBS | Gibco | 10270-106 | |
| Glucagon | Sigma-Aldrich | G-2044 | |
| Glycine | Pufferan | G 05104 | |
| Heparin (5000 U/mL) | Zentiva | 8594739026131 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | |
| Insulin | Sigma-Aldrich | I9278 | |
| Insulin syringe (30G) | BD Medical | 320829 | |
| Magnesium Sulphate Heptahydrate | ROTH | T888.1 | |
| microsurgical forceps | FST | 11252-20 | |
| microsurgical forceps | FST | 11251-35 | |
| microsurgical scissor | FST | 15025-10 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | |
| Percoll | Sigma-Aldrich | P1644 | |
| Peristaltic Pump Minipuls Evolution | Gilson | F110701, F110705 | |
| Potassium Chloride | ROTH | 6781.1 | |
| Potassium Phosphate monobasic | Sigma-Aldrich | P5655 | |
| ProLong Gold Antifade Mountant | Thermo Fischer Scientific | P10144 | |
| Refrigerated centrifuge | Eppendorf | 5810 R | |
| Round cover glasses, 30 mm, thickness 1.5 | VWR | 630-2124 | |
| Silk braided black | Chirmax | EP 0.5 – USP 7/0 | |
| Sodium Chloride | ROTH | 3957.1 | |
| Sodium Hydrogen Carbonate | Sigma-Aldrich | 30435 | |
| Sodium hydroxide | Sigma-Aldrich | 221465 | |
| Sodium Hydroxide | Sigma-Aldrich | S8045 | |
| Sodium Phosphate Dibasic Dihydrate | Sigma-Aldrich | 30435 | |
| Syringe 2 ml | Chirana | CH002L | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Water bath | Nuve | NB 9 | |
| Whatman membrane filters nylon, pore size 0.2 μm, diam. 47 mm | Sigma-Aldrich | WHA7402004 | |
| Whatman pH indicator papers, pH 6.0-8.1 | GE Healthcare Life Sciences | 2629-990 | |
| Zoletil | Vibrac | VET00083 |
References
- Gissen, P., Arias, I. M. Structural and functional hepatocyte polarity and liver disease. Journal of Hepatology. 63 (4), 1023-1037 (2015).
- LeCluyse, E. L., Fix, J. A., Audus, K. L., Hochman, J. H. Regeneration and maintenance of bile canalicular networks in collagen-sandwiched hepatocytes. Toxicology In Vitro. 14 (2), 117-132 (2000).
- Tsukada, N., Ackerley, C. A., Phillips, M. J. The structure and organization of the bile canalicular cytoskeleton with special reference to actin and actin-binding proteins. Hepatology. 21 (4), 1106-1113 (1995).
- Herr, K. J., et al. Loss of alpha-catenin elicits a cholestatic response and impairs liver regeneration. Scientific Reports. 4, 6835(2014).
- Yeh, T. H., et al. Liver-specific beta-catenin knockout mice have bile canalicular abnormalities, bile secretory defect, and intrahepatic cholestasis. Hepatology. 52 (4), 1410-1419 (2010).
- Pradhan-Sundd, T., et al. Dual catenin loss in murine liver causes tight junctional deregulation and progressive intrahepatic cholestasis. Hepatology. 67 (6), 2320-2337 (2018).
- Theard, D., Steiner, M., Kalicharan, D., Hoekstra, D., van Ijzendoorn, S. C. Cell polarity development and protein trafficking in hepatocytes lacking E-cadherin/beta-catenin-based adherens junctions. Molecular Biology of the Cell. 18 (6), 2313-2321 (2007).
- Jirouskova, M., et al. Plectin controls biliary tree architecture and stability in cholestasis. Journal of Hepatology. 68 (5), 1006-1017 (2018).
- Fu, D., Wakabayashi, Y., Ido, Y., Lippincott-Schwartz, J., Arias, I. M. Regulation of bile canalicular network formation and maintenance by AMP-activated protein kinase and LKB1. Journal of Cell Science. 123, Pt 19 3294-3302 (2010).
- Woods, A., et al. LKB1 is required for hepatic bile acid transport and canalicular membrane integrity in mice. Biochemical Journal. 434 (1), 49-60 (2011).
- Porat-Shliom, N., et al. Liver kinase B1 regulates hepatocellular tight junction distribution and function in vivo. Hepatology. 64 (4), 1317-1329 (2016).
- Sarnova, L., Gregor, M. Biliary system architecture: experimental models and visualization techniques. Physiological Research. 66 (3), 383-390 (2017).
- Talamini, M. A., Kappus, B., Hubbard, A. Repolarization of hepatocytes in culture. Hepatology. 25 (1), 167-172 (1997).
- Bhandari, R. N., et al. Liver tissue engineering: a role for co-culture systems in modifying hepatocyte function and viability. Tissue Engineering. 7 (3), 345-357 (2001).
- Godoy, P., et al. Recent advances in 2D and 3D in vitro systems using primary hepatocytes, alternative hepatocyte sources and non-parenchymal liver cells and their use in investigating mechanisms of hepatotoxicity, cell signaling and ADME. Archives of Toxicology. 87 (8), 1315(2013).
- Wilkening, S., Stahl, F., Bader, A. Comparison of primary human hepatocytes and hepatoma cell line Hepg2 with regard to their biotransformation properties. Drug Metabolism and Disposition. 31 (8), 1035-1042 (2003).
- Strnad, P., Windoffer, R., Leube, R. E. In vivo detection of cytokeratin filament network breakdown in cells treated with the phosphatase inhibitor okadaic acid. Cell and Tissue Research. 306 (2), 277-293 (2001).
- Chalupsky, K., et al. ADAM10/17-Dependent Release of Soluble c-Met Correlates with Hepatocellular Damage. Folia Biologica. 59 (2), 76-86 (2013).
- Li, W. C., Ralphs, K. L., Tosh, D. Isolation and culture of adult mouse hepatocytes. Methods in Molecular Biology. 633, 185-196 (2010).
- Horner, R., et al. Impact of Percoll purification on isolation of primary human hepatocytes. Scientific Reports. 9 (1), 6542(2019).
- Severgnini, M., et al. A rapid two-step method for isolation of functional primary mouse hepatocytes: cell characterization and asialoglycoprotein receptor based assay development. Cytotechnology. 64 (2), 187-195 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved