Method Article
توصيف وظيفي لحلقه من نوع E3 اوبيكويتين الاربطه في المختبر وفي بلانتa
In This Article
Summary
الهدف من هذه المخطوطة هو تقديم مخطط للدراسات الكيميائية الحيوية والوظيفية الشاملة للحلبة من النوع الدائري E3. هذا الخط متعدد الخطوات ، مع بروتوكولات مفصله ، والتحقق من صحة النشاط الانزيمي للبروتين اختبار ويوضح كيفيه ربط النشاط لوظيفة.
Abstract
ان الانتشار المطلق للبروتينات ، باعتباره تعديل البروتينات ، يلعب دورا تنظيميا هاما في التوازن الداخلي للخلايا ذات النواة الحقيقية. المرفق التكافؤ من 76 الأحماض الامينيه المعدلات اوبيكويتين إلى البروتين المستهدف ، اعتمادا علي طول وطوبولوجيا سلسله polyubiquitin ، يمكن ان يؤدي إلى نتائج مختلفه تتراوح بين تدهور البروتين والتغيرات في توطين و/أو نشاط البروتين المعدل. ثلاثه انزيمات بالتتابع تحفيز عمليه التبطين المطلق: E1 اليوبييتين-تنشيط الانزيم ، E2 اوبيكويتين-اقتران انزيم ، و E3 اوبيكويتين ligase. E3 اوبيكويتين يغاز يحدد خصوصية الركيزة ، التالي ، يمثل موضوع دراسة مثيره جدا للاهتمام. هنا نقدم نهجا شاملا لدراسة العلاقة بين النشاط الانزيمي ووظيفة الحلقة من نوع E3 اوبيكويتين ligase. يصف هذا البروتوكول الرباعي الخطوات 1) كيفيه توليد متحولة ناقصه يغاز من خلال الطفرة الموجهة إلى الموقع المستهدفة في مجال RING المحفوظة. 2 – 3) كيفيه فحص نشاط التبطين المطلق في المختبر وفي الأخمص ؛ 4) كيفيه ربط تلك التحليلات البيوكيميائية إلى الاهميه البيولوجية للبروتين اختبارها. جيل من متحولة E3 ligase ناقصه التي لا تزال تتفاعل مع الركيزة ولكن لم يعد اوبيتاميناتيس للتحلل يسهل اختبار التفاعلات انزيم الركيزة في الجسم الخارجي. وعلاوة علي ذلك ، فان الطفرة في مجال RING المحفوظة غالبا ما تضفي علي النمط الظاهري السلبي المهيمن الذي يمكن استخدامه في الدراسات الوظيفية بالضربة القاضية كنهج بديل لنهج التداخل الريبي. وكانت أساليبنا الأمثل للتحقيق في الدور البيولوجي للمصنع الطفيلية الديدان الخيطية RHA1B ، الذي يخطف النظام المضيف اوبيتامييشن في الخلايا النباتية لتعزيز التطفل. مع تعديل طفيف لنظام التعبير في الجسم المجري ، يمكن تطبيق هذا البروتوكول علي تحليل اي نوع من الحلقات E3 يغاز بغض الأصل عن أصولها.
Introduction
تنتمي الغالبية العظمي من المجموعاتالكبيرة من ال E3 إلى الحلقة (Rابعاد عالي Iالفوائد New G ene) من نوع البروتينات. وقد تم تحديد المجال الدائري الاصبع في الأصل من قبل Freemont et al. 1 ووصفت وظيفيا كمجال التوسط بروتين البروتين التفاعل2. البنصر الكنسي هو نوع خاص من مجال تنسيق الزنك يعرف بأنه تسلسل توافقي من ثمانيه Cys المحفوظة (C) وله (H) متباعدة علي وجه التحديد من بقايا الأحماض الامينيه الأخرى (X) ، C-X2-c-x9-39-c-x1-3-H-x2-3-c/H-x2-c-x4-48-c-x2-c. يتم تثبيت اثنين من الزنك2 + أيونات من قبل الاساسيه ج و ح المخلفات من خلال فريدة من نوعها "عبر قوسين" طوبولوجيا مع c1/c2 و c/H5/c6 تنسيق أول الزنك2 + أيون في حين c3/H4 و c7/c8 ربط الثانية (الشكل 1ا)3،4. اعتمادا علي وجود اما C أو H في الخامس الزنك2 +-موقع التنسيق ، تم تعريف فئتين فرعيتين الكنسي من البروتينات البنصر: C3HC4 و C3H2C3 (حلقه-HC وخاتم-H2 ، علي التوالي). لان المجال RING من E3 اوبيكويتين يغاز يتوسط التفاعل بين الانزيمات الاقتران E2 وركائز ، وقد ثبت طفرة من هذه المخلفات C و H الاساسيه لتعطيل النشاط يغاز5. وقد وصفت خمس فئات فرعيه اقل شيوعا من ring E3 الليغاز (حلقه-v ، خاتم-C2 ، ring-D ، ring-S/T ، و ring-G)6. ويمكن تقسيم الحلقات E3 من النوع الدائري إلى انزيمات E3 بسيطه ومعقده. تحتوي الوحدة الفرعية المفردة البسيطة RING E3 علي كل من موقع التعرف علي الركيزة ومجال RING الربط E2. وعلي النقيض من ذلك ، فان المجمع المتعدد الوحدات من النوع الدائري E3 اما ان يكون الركيزة التي يقوم بتعيينها أو ان يكون ملزما لوسيط الفئة E2-اوبيكويتين إلى مجمع E3. وقد يكون المجال RING (s) بقايا (ق) التي تخدم كموقع المرفق الاوليه (ق) للحصول علي الذاتي--اوبيتميوستس أيضا المهم للنشاط الرابطة E3.
لا تعمل جميع البروتينات المحتوية علي الرنين كاربطه E3. التالي ، فان التنبؤ بالمعلوماتية الحيوية للنطاق الحلقي والقدرة علي الاعتماد علي البروتين الذي يعتمد علي E2 يجب ان يتم التحقق منه بيولوجيا كيميائيا وربطه بالدور البيولوجي للبروتين المختبر. هنا ، نقوم بوصف البروتوكول خطوه بخطوه الذي يحدد كيفيه الكشف عن النشاط الانزيمي الخاص بالحلقة الحلقية E3 من النوع الدائري ، سواء في المختبر أو في الأخمص ، من خلال نهج الطفرات الموجهة إلى الموقع ، وتوصيفه وظيفيا. وتظهر النتائج التمثيلية من خط الأنابيب هذا لحلقه النوع E3 يغاز RHA1B. RHA1B هو بروتين المستجيب التي تنتجها النبات الطفيلية كيس الديدان الخيطية جلوموديرا المسكن لقمع مناعة النبات والتلاعب في المورفولوجية من الخلايا الجذرية النباتية. لحماية أنفسهم من الممرض/الطفيلي الغزو ، وقد تطورت النباتات المجال النيوكليوتيد ملزمه وتكرار لوسين الغنية (NB-LRR) نوع المستقبلات المناعية التي تكشف عن وجود الممرض أو الطفيلي ، ونتيجة لذلك ، تطوير استجابه حساسية (HR) ، وهو شكل من اشكال الموت الخلايا السريعة والموضعية واحده من هذه المستقبلات المناعية هو بروتين Gpa2 البطاطا التي تمنح مقاومه لبعض العزلات من g. المسكن (السكان الميدانيين D383 و D372)7.
وباستخدام البروتوكولات المقدمة ، وجد مؤخرا ان RHA1B يتداخل مع الإشارات المناعية النباتية بطريقه تعتمد علي E3 من خلال استهداف المصنع Gpa2 مستقبلات مناعية للابده والتحلل8.
Protocol
1-الطفرة الموجهة إلى الموقع (الشكل 1)
- التعرف علي cys المحفوظة والأحماض الامينيه له في المجال الدائري (الشكل 1ا) والإشعال التصميم تحمل كودون الاستبدال من الفائدة يحيط بها 15 أزواج الاساسيه علي جانبي موقع الطفرة (الشكل 1ب).
- إدخال الطفرة المطلوبة من قبل التضخيم القائم علي PCR من البلازميد إيواء الجينات من الفائدة باستخدام الإشعال الطفرات وعاليه الدقة الحمض النووي البوليميرات التي تحتوي علي pfu في 50 μl من إجمالي حجم رد الفعل pcr كما هو مبين في الجدول 1 والجدول 2 وفقا لبروتوكول الشركة المصنعة.
- هضم الحمض النووي المشتق من القولونيةوشبه الميثيه باضافه 3 μl من انزيم تقييد dpni مباشره إلى تفاعل PCR (الخطوة 1.2) والاحتضان عند 37 درجه مئوية لمده 2 ساعة.
ملاحظه: ميثيل هو تعديل بروتين ما بعد التحويل الذي يضاف إلى البلازميد المنتجة والمعزولة عن البكتيريا. التالي فان النسخ الجديدة لنقص البلازما المتولد من PCR ، التالي ، ستظل النسخ الجديدة سليمه اثناء معالجه Dpni . - تنقيه البلازميدات الطفرات الجينية باستخدام مجموعه استخراج الحمض النووي التجارية علي أساس تكنولوجيا العمود تدور والحمض النووي الوت مع 50 μl من الماء.
- تحويل DH5α الخلايا المختصة كيميائيا مع 0.5 μl من الحمض النووي المستعادة المغيرة الدنا وفقا لبروتوكول الشركة المصنعة. باختصار ، احتضان الخلايا المختصة مع الحمض النووي علي الجليد لمده 30 دقيقه ، ثم الحرارة صدمه لهم ل 20 ق في 42 درجه مئوية ، ووضع أنابيب مره أخرى علي الجليد لمده 2 دقيقه. احتضان الخلايا مع 500 μL من وسائط LB في 37 درجه مئوية ل 1 ح في 250 دوره في الدقيقة ومن ثم نشرها علي pates انتقائية
- تحقق من الطفرة المطلوبة بواسطة Sanger تسلسل البلازميدات الحمض النووي معزولة من كولاي.
2. تنقيه البروتين المؤتلف وفي المختبر الفحص المطلق
- استنساخ العصابة نوع البرية والجينات حلقه تحور من الفائدة في ناقل pMAL-c2 (اتبع بروتوكول الشركة المصنعة; الجدول 3) لصهر هذه الجينات مع العلامة المربه mbp التي تسمح تنقيه خطوه واحده باستخدام الراتنج اميلوز. إدخال ثوابت الناتجة في BL21 سلاله e. القولونية كما هو موضح في الخطوة 1.5.
- تنمو BL21 سلاله e. القولونية إيواء بناء المطلوب في 50 mL السائل LB المتوسطة في 37 درجه مئوية لمده 2-3 h حتى تصل إلى المرحلة اللوغاريتمية (OD600 من 0.4-0.6).
- أضافه IPTG إلى تركيز نهائي من 0.1 – 1 مم للحث علي التعبير عن البروتين المؤتلف MBP الموسومة من الفائدة واحتضان الثقافة e. كولاي ل 2 – 3 ح في 28 درجه مئوية. وضع الثقافة علي الجليد بعد الحضانة.
ملاحظه: تنفيذ الخطوات 2-4 – 2.13 علي الجليد لحماية البروتينات من التحلل. - للتحقق من كفاءه الاستقراء ، وجمع 1.5 مل من الخلايا المستحثة ، تدور عليها في 13,000 x g لمده 2 دقيقه ، وأزاله supernatant ، وأعاده تعليق الخلايا في 20 μl من 2x SDS-صفحه المخزن المؤقت التحميل (24 مم تريس-HCl pH 6.8 ، 0.8 ٪ sds ، 10 ٪ (v/v) الجلسرين ، 4 مم dtt ، 0.04 ٪ (ث/ف) الأزرق بروموفينول).
- اغلي العينات لمده 5 دقائق وقم بتشغيلها علي هلام بنسبه 10% من الصفحة. لتقييم بصريا تراكم بروتين MBP-فيوجن (الوزن الجزيئي للبروتين من الفائدة + 42.5 كده MBP) ، وصمه عار الهلام لمده 20 دقيقه عن طريق التحريض مع العازلة تلطيخ كوماسي (50 ٪ الميثانول ، 10 ٪ حمض الخليك ، 0.1 ٪ كوماسي الأزرق) والمبيت بين عشيه وضحيها مع العازلة ديلينينغ (20 ٪ الميثانول ، 10 ٪ حمض الخليك).
- حصاد الخلايا المتبقية e. كولاي بطرد في 1,350 x g ل 6 دقيقه ، وتجاهل supernatant ، وأعاده تعليق بيليه الخلية مع 5 مل من المخزن المؤقت العمود (20 ملم تريس HCl ، 200 mm كلوريد الصوديوم ، 1 مم أدتا ، مثبطات البكتيريا البروتينية).
ملاحظه: هذا مكان جيد لإيقاف البروتوكول بين عشيه وضحيها. يمكن تخزين الخلايا المجمدة لمده أسبوع واحد عند-20 درجه مئوية. - كسر الخلايا e. القولونية عن طريق وضع الأنبوب الذي يحتوي علي البكتيريا في حمام الماء المثلج وتطبيق 10 دورات سونيكيشن: 10 ق صوتنه في 30 ٪ أمبير تليها فواصل 20 ق.
- الطرد المركزي عينه في 13,000 x ز في 4 درجه مئوية لمده 10 دقيقه وحفظ ماده طافي (استخراج الخام).
- اعداد 500 μl من الراتنج اميلوز في أنبوب 15 مل. غسل الراتنج عن طريق أضافه 10 مل من العازلة العمود البارد ويطرد في 1,800 x g، 4 درجه مئوية لمده 5 دقائق. القيام بذلك 2x.
- أضافه 5 مل من استخراج الخام إلى أنبوب مع الراتنج اميلوز واحتضان بين عشيه وضحيها في 4 درجه مئوية.
- الطرد المركزي في 1,800 x ز في 4 درجه مئوية لمده 5 دقائق وتجاهل supernatant.
- أضافه 10 مل من العازلة العمود إلى بيليه الراتنج واحتضان لمده 20 دقيقه. ثم جهاز الطرد المركزي في 1,800 x g في 4 درجه مئوية لمده 5 دقائق كرر هذه الخطوة 2x.
- Elute البروتين الانصهار مع 0.5 mL من العمود العازلة التي تحتوي علي 10 مم المالتوز باحتضان عينه ل 2 ح في 4 ° c. جهاز الطرد المركزي في 1,800 x g في 4 درجه مئوية لمده 5 دقائق وجمع البروتين الذي لا يمكن التملص منه. كرر هذه الخطوة 2x.
- [ديتز] 1 [مل] من البروتين كسر ضد الباردة [ببس]. بروتين aliquot في أنابيب أحاديه الاستخدام (10 – 20 μL) لتجنب التجمد والذوبان والتخزين عند-80 درجه مئوية حتى الحاجة.
- قياس تركيز البروتين باستخدام الفحص برادفورد9.
- اعداد رد فعل في المختبر في الحجم الإجمالي لل 30 μL عن طريق خلط 40 ng من E1 (علي سبيل المثال ، AtUBA1) ، 100 ng من E2 (علي سبيل المثال ، AtUBC8 ، SlUBC1/4/6/7/12/13/17/20/22/27/32) ، 1 ميكروغرام من نوع البروتين الحلقي MBP ، و 2 ميكروغرام العلم-Ub (أو ها-Ub) في العازلة اوبيتاميتاز (50 mM تريس-HCl pH 7.5 ، 2 مم ATP ، 5 مم MgCl2، 30 مم الكرياتين الفوسفات ، 50 ميكروغرام/مل الكرياتين فوسفوكيناسي). احتضان الخليط في 30 درجه مئوية لمده 2 ساعة.
ملاحظه: Premake 20x العازل المؤقت وتخزينه حتى 6 أشهر في-20 درجه مئوية في الارصفه الصغيرة لاستخدام واحد. فوسفوكيناز الكرياتين يفقد بسهوله نشاطه الانزيمي عندما يتم أذابه العازلة وتجميدها مرارا وتكرارا. - إنهاء رد الفعل عن طريق خلط عينات ل 30 μL مع 7.5 μL من 5x SDS-صفحه المخزن المؤقت التحميل (60 mM تريس-HCl pH 6.8 ، 2 ٪ SDS ، 25 ٪ (v/v) الجلسرين ، 10 ملم DTT ، 0.1 ٪ (ث/ف) الأزرق بروموفينول) والغليان لمده 5 دقائق.
- فصل البروتينات مع 7.5 ٪ SDS-بولياكريلاميد هلام الكهربائي (SDS-الصفحة) ، ثم نقل علي غشاء PDVF ، والكشف عن التنقيط التي الغربية باستخدام المضادة للعلم (أو المضادة لل HA).
- وصمه عار غشاء PVDF مع الأزرق كوماسي للتحقق من التحميل علي قدم المساواة من اختبار MBP-حلقه من نوع البروتين.
3.agamamamama-بوساطة التعبير البروتين عابره في أوراق نيكوتيانا benthamiana وفي النباتات المقايسة
- السلسلة المناسبة من السلالات التي تحمل الجينات الموسومة بالاهتمام (علي سبيل المثال ، RHA1B ، ha-RHA1BC135S، HA-RHA1BK146R، ha-Ub) والمتجه الفارغ كعنصر تحكم في الوسط الذي يحتوي علي المضادات الحيوية المناسبة للاختيار.
- بعد يومين من النمو في 28 درجه مئوية ، والتقاط مستعمرات واحده وتنمو لهم في المتوسطة السائل LB مع المضادات الحيوية المناسبة في 28 درجه مئوية/250 دوره في الدقيقة لأخر 24 ساعة.
- نقل 100 μL من ثقافة أجروباكتيريال إلى 3 مل LB الطازجة مع المضادات الحيوية المناسبة واحتضان الثقافة لمده 4-6 ساعة اضافيه في 28 درجه مئوية مع دوران (250 دوره في الدقيقة) إلى مرحله النمو الاسي في وقت متاخر.
- تدور الخلايا أجروباكتيريال في 1,800 x ز ل 6 دقيقه ، وتجاهل supernatant ، وأعاده التعليق الخلايا مع 3 مل من العازلة غسل (50 mm MES الأس الهيدروجيني 5.6 ، 28 ملم الجلوكوز ، 2 مم الجناح2PO4). كرر هذه الخطوة 2x.
- بعد الغسيل الثاني ، أعاده التعليق الخلايا في العازلة التعريفي (50 mM MES pH 5.6, 28 مم الجلوكوز, 2 مم الجناح2بو4, 200 μM اسيتاوسيرينجون, 37 mm NH4Cl, 5 مم mgso4. 7h2, 4 مم kcl, 18 μM فيسو4.7h 2س, 2 مم cacl2). احتضان الخلايا مع العازلة التعريفي لاضافيه 10-12 ح في 28 درجه مئوية.
ملاحظه: اسيتاوسيرينجون الحث علي نقل الحمض النووي T. - الطرد المركزي الخلايا في 1,800 x ز لمده 6 دقائق ، وتجاهل supernatant ، وأعاده تعليق الخلايا مع 2 مل من تسرب العازلة (10 ملم MES pH 5.5 ، 200 μM اسيتاوسيرينجون).
ملاحظه: إذا Agrobacteria التجميعية بعد الحضانة مع العازلة التعريفي ، والسماح للخلايا المجمعة تغرق إلى الجزء السفلي من الأنبوب عن طريق تركها علي مقاعد البدلاء لبضع دقائق ، ونقل التعليق agrobacteria واضحة إلى أنبوب جديد قبل المضي قدما مع الخطوة 3.6. - قياس تركيز البكتيريا باستخدام OD600 قيمه (الكثافة البصرية في الامتصاص من 600 نانومتر). ضبط القيم OD600 لتلك المطلوبة.
ملاحظه: عاده ما تكون قيمه OD600 بين 0.2-0.4 يعمل بطريقه أفضل للتعبير عن وصمه عار أجروباكتيريال واحده. إذا تم تطبيق مجموعه من سلالات أجروباكتيريال مختلفه ، يجب ان لا يتجاوز إجمالي القيم OD600 من سلالات أجروباكتيريال 1. - الزراعية التسلل 4-الأسبوع القديم n. بيثاميانا يترك عن طريق الخداع لهم بلطف مع ابره ، تليها باليد حقن اجروطره مع حقنه دون ابره. دائره المنطقة ورقه تسللت مع علامة (عاده 1-2 سم في القطر).
- جمع الانسجه المخترقة ورقه 36 h بعد التسلل. طحن الانسجه إلى مسحوق غرامه مع النيتروجين السائل.
- أعاده تعليق مسحوق الانسجه مع 300 μL من العازلة استخراج البروتين (50 mM تريس-HCl pH 7.5 ، 150 mM كلوريد الصوديوم ، 5 مم أدتا ، 2 مم DTT ، 10 ٪ الجلسرين ، 1 ٪ بوليفينيلبوليبيروليدوني ، 1 مم PMSF ، مصنع الانزيم البروتيني المثبط كوكتيل) والطرد المركزي في 15,000 x ز لمده 15 دقيقه في 4 °c.
- انقل العملاق إلى أنبوب جديد أضافه 5x SDS-تحميل الصفحة العازلة إلى تركيز نهائي من 1x ويغلي لمده 5 دقائق.
- افصل البروتينات الخام علي 10% من الكبسولات الهلامية من SDS ، وانقلها إلى اغشيه PVDF ، ودقق مع مضادات الهكتار للكشف عن وجودها في النباتات المطلقة.
4. أقامه الصلة بين النشاط الانزيمي والوظيفة في الموز
ملاحظه: علي سبيل المثال ، RHA1B يعزز تدهور البروتين المقاوم Gpa2 لقمع موت خلايا الموارد البشرية. توضح هذه الخطوة كيفيه التحقق من ان هذه الانشطه الخبيثة RHA1B تعتمد E3.
- خط المناسبة اجروطره توميفاسينس سلالات تحمل الموسومة الجينات من الفائدة (في هذا المثال RHA1B ، RHA1BC135S، ha-RHA1BK146R، myc-Gpa2 ، RBP1) وناقل فارغ كعنصر تحكم. اتبع الخطوات من 3.1 إلى 3.8 لاعداد الاغديه والحقن علي أوراق ن. بيثاميانا .
- لتحلل البروتين الركيزة التابعة E3 ، اتبع الخطوات 3.9 – 3.12 واجراء التنقيط الغربية باستخدام الأجسام المضادة المناسبة للكشف عن تراكم البروتين في الخلايا النباتية (علي سبيل المثال ، المضادة لل HA ومكافحه MYC).
- بالنسبة لاستجابه حساسية المعتمدة علي E3 (HR) بوساطة الموت الخلية ، رصد الأوراق الزراعية لاعراض الموت خليه الموارد البشرية 2-4 أيام بعد التسلل.
النتائج
في هذا القسم ، يتم توفير النتائج التمثيلية للبروتوكول المستخدم لفحص وحده فرعيه واحده E3 اوبيكويتين يغاز RHA1B التي لديها النطاق المتوقع prosite الدائري-H2 نوع (132-176 الأحماض الامينيه)10. وكما هو مبين في الشكل 1، من أجل الحصول علي بروتين متحول من فئة E3 ، فان واحدا علي الأقل من الثمانية المحفوظة أو النظام المنسق في النطاق الحلقي (الشكل 1ا) يحتاج إلى الطفرة (الشكل 1ب). وهكذا ، كخطوه اولي ، نسختين متحولة من RHA1B ، RHA1BC135S (استبدال cys بواسطة السير في C المحفوظة3 من المجال الدائري) و RHA1BK146R (استبدال Lys من قبل الأرجنتين في ليز الوحيدة الموجودة في RHA1B) تم إنشاؤها. علي الرغم من ان الوحدة الفرعية الوحيدة e3 الليغاز التوسط في نقل اوبيكييتين من اوبيكويتين إيواء E2 إلى الركيزة بدلا من التفاعل مباشره مع اوبيكويتين ، قد تكون مطلوبه الذاتي المطلقة من e3 في Lys لنشاطها الانزيمي القصوى.
النتائج الغربية التنقيط في الشكل 2a تظهر الايجابيه النموذجية في المختبر النتائج المقايسة الحرارية ، مع مسحه متعددة النطاقات بدءا من الوزن الجزيئي للبروتين اختبار (e. g. ، MPB-تنصهر RHA1B ~ 100 كده) وتتقدم صعودا. المضادة--HA الأضداد المعترف بها HA--الموسومة Ub أدمجت في سلسله بولي-اوبيتاميتايشن من أطوال مختلفه ، وخلق هذا النموذجية اوبيكويتين المرتبطة السلم مثل مسحه. للتحقق من صحة النتائج الايجابيه ، الشكل 2A كما يعرض كافة عناصر التحكم السلبية الهامه المفقودة المكونات الفردية (E1 ، E2 ، UB ، أو mbp-RHA1B) أو باستخدام mbp كعنصر تحكم وتفتقر إلى اشاره اوبيتميوتيتيبل. وعلاوة علي ذلك ، أظهرت تلطيخ الأزرق كوماسي من غشاء PVDF التحميل علي قدم المساواة من MBP-RHA1B أو MBP في جميع عناصر التحكم.
ويبين الشكل 2(ب) كيف تختلف نتائج التحقق المطلق في المختبر تبعا لتركيبه E2/E3 المحددة. في هذا المثال ، تم اختبار 11 E2s مختلفه تمثل 10 عائلات مختلفه E2. وتراوح نشاط الكشف المطلق الذي تم اكتشافه من عدم وجود اشاره (لا مسحه) إلى مسحه متعددة النطاقات بدءا من الأوزان الجزيئية المختلفة ، مما يشير إلى أنماط مختلفه من الترقيم المطلق.
يظهر الشكل 3 نتائج فحص الترقيم المطلق لإصدارات RING و K-متحولة من البروتين المختبر. عدم وجود النشاط الانزيمي ل RHA1BC135S يدعمه عدم قدرته علي توليد مسحه متعددة النطاقات في المختبر (الشكل 3ا) أو تعزيز اشاره بولي-اوبيتاميتاز في الموز (الشكل 3ب). ومن الجدير بالتنويه ان الإفراط في التعبير عن الكلمات الدلالية Ub في أخمصي علي تلقاء نفسها اعطي القاعدية المستوي المطلق في جميع العينات التي تم اختبارها ، بما في ذلك مكافحه ناقلات ، علي النقيض من الاشاره القوية التي تمنحها النشاط الانزيمي من نوع RHA1B البرية. وعلاوة علي ذلك ، يشير التحليل علي RHA1BK146R متحولة إلى ان بقايا K146 ضروري أيضا للنشاط E3 من RHA1B. علي الرغم من انه تم الكشف عن اشاره هامشيه الذاتي المطلقة في المختبر (الشكل 3ا) ، في النبات المقايسة تحديد المتحول هو E3-ناقص (الشكل 3ب، فقط الخلفية الكشف عن الإشارات المطلقة).
بعد توليد والتحقق من الصحة الحيوية لمتحولة E3-ناقص ، يمكن تصميم الدراسات الوظيفية لتحديد الدور E3 المرتبطة البيولوجية للاختبار RING E3 اوبيكويتين ligase. في حاله RHA1B ، هذا المستجيب الديدان الخيطية يقمع الإشارات المناعية النباتية ، كما يتجلى من خلال قمع وفاه خليه الموارد البشرية التي تسببها Gpa2. كما هو مبين في الشكل 4ا، علي عكس النوع البري RHA1B ، فان RHA1BC135S متحولة تفتقر إلى النشاط E3 يغاز لا تتداخل مع موت الخلايا البشرية. النظر إلى ان النتيجة الأكثر شيوعا من البروتين المطلق هو تدهور بوساطة بروتينيه ، والطفرات التي تعيش في مجال RING يمكن أيضا ان تستخدم للتحقق من القدرة علي الاعتماد E3 لتحريك تدهور الركائز المباشرة و/أو غير المباشرة. التالي ، فان النتائج الغربية التي تحدث في الشكل 4ب تؤكد ان Gpa2 لم تتراكم في وجود النوع البري RHA1B ولكن RHA1BC135S لم يكن له اي تاثير علي استقرار البروتين الGpa2.
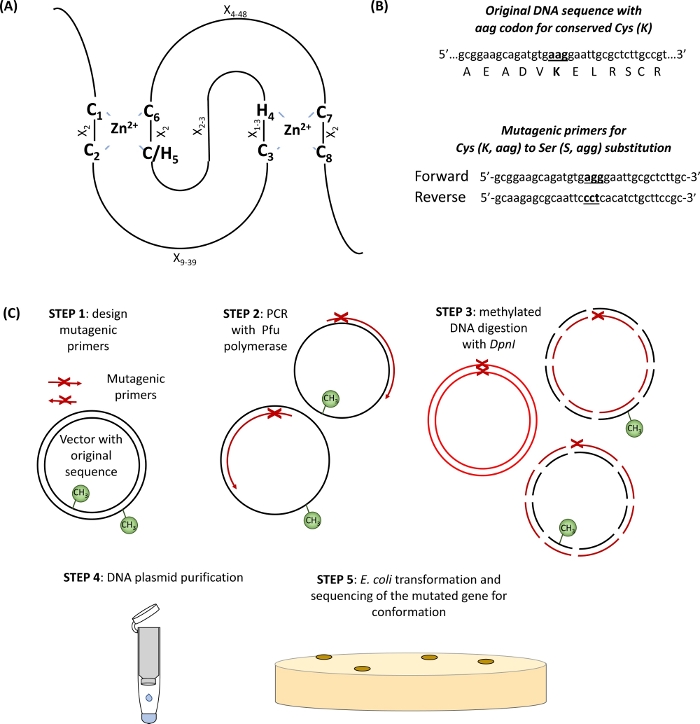
الشكل 1: التمثيل التخطيطي للمبدا والخطوات التي ينطوي عليها الطفرات الموجهة إلى الموقع. (A) الحلبة CH/H2 المجال مع cys المحفوظة والأحماض الامينيه له أبرز. (ب) مثال علي تصميم الإشعال بالطفرات الجينية. (ج) خطوات الطفرات الموجهة للمواقع. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
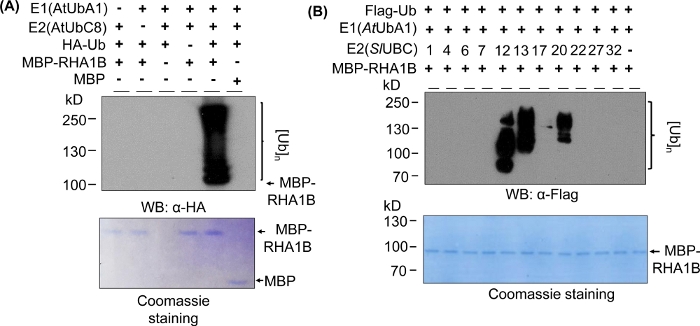
الشكل 2: التمثيل في المختبر. (A) هلام اعلي يظهر الفحص اوبيتاميتيويشن بما في ذلك جميع الضوابط السلبية ، وهلام أسفل يظهر التحميل علي قدم المساواة. (ب) نطاق النتائج المتوقعة تبعا لانزيمات الفئة E2. وقد تم تعديل هذا الرقم من Kud وآخرون8. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
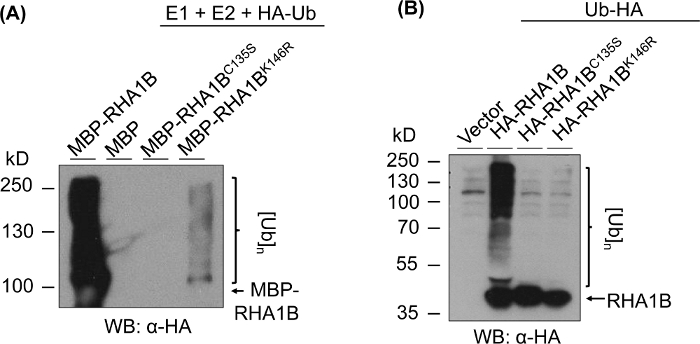
الشكل 3: النتائج الاختبارية لاختبارالC135S الحلقي-و K-المسوخ (RHA1B و RHA1BK146R). (ا) النتائج المطلقة في المختبر لRHA1BC135S و RHA1BK146R. (ب) في الزراعة المطلقة نتائج الفحص بالنسبة لRHA1BC135S و RHA1BK146R. وقد تم تعديل هذا الرقم من Kud وآخرون8. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
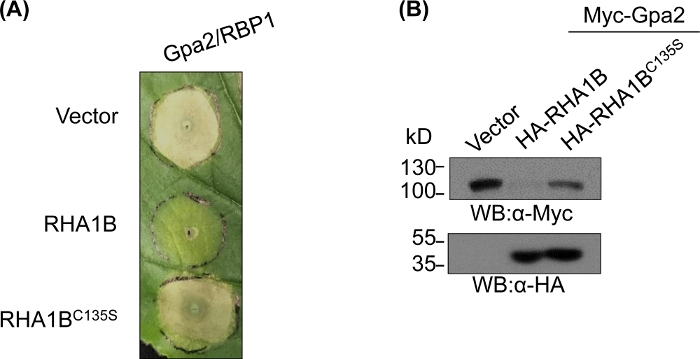
الشكل 4: دراسة وظيفية تمثيليه للوظائف البيولوجية التابعة لE3. مثال علي الدراسات الوظيفية التي تبين الوظيفة البيولوجية المعتمدة علي E3. (ا) قمع موت خلايا الموارد البشرية المعتمد علي الفئة هاء-3 و (ب) تدهور مستقبل المناعة النباتية Gpa2. وقد تم تعديل هذا الرقم من Kud وآخرون8. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
| [بكر] ثبتت فوق | |
| 1 μL | البلازميد (~ 100 ng) |
| 1.5 μL | F التمهيدي الطفرات (10 μM) |
| 1.5 μL | R التمهيدي الطفرات (10 μM) |
| 1 μL | dNTPs (10 ملم) |
| 5 μL | المخزن المؤقت (10x) |
| 1 μL | الترا Pfu البوليميريز (2.5 U/μl) |
| 39 μL | ddH2O |
| 50 μL | مجموع الحجم |
الجدول 1: اعداد تفاعل PCR
| برنامج ثيرموسيكلير | |||
| 1 | 95 درجه مئوية | 30 ثانيه | |
| 2 | 95 درجه مئوية | 30 ثانيه | |
| 3 | 60 درجه مئوية | 30 ثانيه | |
| 4 | 72 درجه مئوية | 5 دقائق | كرر 2-4 30 مرات |
| 5 | 72 درجه مئوية | 5 دقائق | |
الجدول 2: برنامج PCR ثيرموسيكلير
| اعداد رد فعل الربط لRHA1B المثال | ||
| 1.5 μL | pmal-c2:: mbp المتجهة خطي عن طريق الهضم مع bamhi وسالي (60 ng) | |
| 7 μL | RHA1B/RHA1BC135S أو RHA1BK146R ادراج هضمها مع بامهي وسالي (25 نانوغرام) | |
| 1 μL | المخزن المؤقت T4 يغاز (10x) | |
| 0.5 μL | T4 يغاز (400 U/μl) | |
| 10 μL | مجموع الحجم | |
الجدول 3: تفاعل الربط الذي تم اعداده لRHA1B المثال.
Discussion
يمكن توضيح الأساس البيوكيميائية والميكانيكية من نوع حلقه E3 اوبيكييتين الليغاز تسهم بشكل كبير في فهمنا لأهميتها البيولوجية في التنمية ، والإجهاد الإشارات ، والحفاظ علي التوازن. البروتوكول وصفت هنا الأزواج نهج الطفرات مع في المختبر والدراسات الوظيفية الموز. عن طريق إدخال استبدال الأحماض الامينيه واحده في بقايا المحفوظة للمجال RING من خلال الطفرات المباشرة في الموقع ، يمكن اختبار متحولة E3 ناقص الناتجة بالتوازي مع البروتين نوع البرية لربط النشاط الانزيمي مع وظيفة.
ومن المهم لتحديد المجال RING بشكل صحيح ، ولا سيما المحفوظة Cys ومخلفاته. أدوات علي الإنترنت مثل PROSITE يمكن استخدامها للقيام بذلك10. لزعزعه استقرار المجال RING المسؤولة عن تجنيد الانزيم E2 ، عاده ما يتم استبدال Cys مع السير ، الذي هو أقرب استبدال الهيكلية التي تفتقر إلى القدرة علي إنشاء السندات الكبريتيد المستخدمة للتنسيق الزنك. وأظهرت lorick وآخرون ان الطفرة في اي من هذه البقايا الحرجة cys ستلغي نشاط الترقيم المطلق للوحدة الفرعية الوحيدة من النوع الحلقي E3 الليغاز5. وعلي الرغم من ان بعض بقايا سيس مهم أيضا لمجمعات متعددة الوحدات التي تحتوي علي البروتينات الحلقية ، وذلك بسبب البنية الثلاثية الابعاد والديناميكية لتلك المجمعات المتعددة الأنواع والدور المختلف للبروتينات الحلقية ، فان الاستبدالات المفردة لبقايا الحفظ في المجال RING في
بالنسبة للطفرة الموجهة إلى الموقع ، وجدنا ان استخدام ناقلات البلازميد أصغر ودورات التضخيم الأقل عاده ما ينتج عنه كفاءه اعلي للطفرة. ويمكن استبدال انزيم Pfu مع اي الأخرى عاليه الدقة وعاليه الحمض النووي الريبي البوليميريز. وعلاوة علي ذلك ، إذا كان الجين من الفائدة يحتوي علي المخطوطات النادرة ، واخر e. القولونية وصمه عار ، روزيتا ، ويمكن استخدامها لتحقيق عائد اعلي من البروتين المؤتلف. بالاضافه إلى ذلك ، كل من وقت الحضانة ودرجه الحرارة ل IPTG التعريفي يمكن ان تكون أكثر الأمثل. انخفاض درجات الحرارة خفض معدل القسمة القولونية ، والتي قد تكون مواتيه للتعبير عن بعض البروتينات. علي الرغم من ان تركيز اعلي من IPTG يمكن ان يحسن التعبير عن البروتين ، كما انه يثبط عمليات القسمة القولونية ولا ينصح به.
واحده الوحدة الفرعية حلقه نوع E3 الليغاز ليس فقط تعمل كسقالة الجزيئية التي مواقف المتوسطة E2-Ub علي مقربه من الركيزة ولكن أيضا تحفيز النشاط نقل اوبيكييتين من E2s الخاصة بهم. وعلاوة علي ذلك ، النظر إلى ان الجمع بين الفئتين E2/E3 مهم لطول وروابط سلسله polyubiquitin التي تحدد مصير الركيزة المعدلة ، فان اي اعتبار لE3s الحلقية يجب ان يشمل شركائها الانزيميين ، E2s12. كما هو مبين في الشكل 3ب، ليست جميع الE2s المختبرة متوافقة مع RHA1B ligase. ولذلك ، في المختبر يجب ان يتم اختبارات اوبيتامييشن بالتوازي مع الانزيمات E2 متعددة تمثل فئات E2 مختلفه لتجنب نتائج سلبيه كاذبه.
يقدم هنا الفحص الانزيمي في المختبر الذي يكتشف القدرة الذاتية للبروتينات المختبرة من النوع الحلقي. ومع ذلك ، مع التعديلات الصغيرة ، ويمكن تكييف هذا البروتوكول بسهوله للكشف عن في المختبر اوبيتامييشن من ركائز. وتحقيقا لهذه الغاية ، ينبغي ان تستكمل الخليط في المختبر من الخطوة 2.15 البروتين المؤتلف من الركيزة المحتملة E3 يغاز (500 ng). بعد الحضانة 2 ح في 30 درجه مئوية ، يجب ان يتم القبض علي البروتين اوبيتامينيد باستخدام 15 μL من مصفوفة التقارب المضادة HA (إذا تم استخدام ها-Ub ، أو المضادة للعلم مصفوفة تقارب إذا تم استخدام العلم-Ub) عن طريق التحريض ل 2 ح في 4 درجه مئوية. بعد غسل الخرز 4x مرات مع الباردة Ub غسل العازلة (20 مم تريس الرقم الهيدروجيني 7.5 ، 100 mM كلوريد الصوديوم ، 0.1 mM أدتا ، 0.05 ٪ توين 20 ، 1x PMSF) ، وتجاهل جميع ولكن 40 μL من المخزن المؤقت والانتقال إلى الخطوة 2.16. اشاره اوبيكتيكتيز ، التي تم الكشف عنها من قبل الأجسام المضادة الخاصة بالملحقات-الموسومة Ub والركيزة ، علي التوالي ، الناشئة من الوزن الجزيئي للبروتين الركيزة ، يؤكد الركيزة/الانزيم الخصوصية.
وعلاوة علي ذلك ، عاده ما يرتبط تحديد ركائز الرابطة E3 في الجسم الآخر مع التحديات المتعددة بسبب التفاعل الانزيم الركيزة العابرة والتحلل السريع للبروتين المستهدف اوبيتاميناتيد. باستخدام E3 يغاز نقص متحولة ، والتي لا تزال تتفاعل مع هدفها ولكن لم يعد اوبيتاميناتيس انه13، هو بديل مفيد جدا لأضافه مثبطات بروتينيه MG132 ، والتي لا تتداخل دائما بما فيه الكفاية مع وظيفة بروتياسومي 26s.
ومن الخصائص الشائعة لعصابات E3 من النوع الحلقي ميل إلى الشكل والعمل باعتباره شاذا و/أو مغايرا. ومن المثير للاهتمام ، وعاده ما يرتبط الاستبدال في بقايا المحفوظة للمجال ring مع النمط الظاهري السائد السلبية حيث تحور حلقه من نوع E3 يغاز كتل النشاط الانزيمي من نوع البروتين البرية الأصلي13. التالي ، قد يكون الإفراط في التعبير عن المسوخ RING في بلانتa نهجا بديلا لضرب الجينات E3 يغاز.
Disclosures
وليس لدي المؤلفين ما يفصحون عنه.
Acknowledgements
وقد تسني عملنا بالدعم المالي المقدم من المنحة التنافسية لمبادرة الزراعة والبحوث الغذائية (2017-67014-26197 ؛ 2017-67014-26591) التابعة للمعهد الوطني للاغذيه والزراعة في الوزارة ، ومشروع قانون مزرعة المزارع الشمالية ، والبطاطا الغربية كونسورتيوم ، والمحاصيل المتخصصة ISDA.
Materials
| Name | Company | Catalog Number | Comments |
| Acetic acid | Sigma-Aldrich | A6283 | |
| Acetosyringone | Sigma-Aldrich | D134406 | |
| Amylose resin | NEB | E8021S | |
| ATP | Sigma-Aldrich | A1852 | |
| Bacterial protease inhibitor | Sigma-Aldrich | P8465 | |
| Bromphenol Blue | VWR | 97061-690 | |
| CaCl2 | Sigma-Aldrich | C1016 | |
| Centrifuge | Beckman Coulter | model: Avanti J-25 | |
| Commassie Blue | VWR | 97061-738 | |
| Creatine phosphate | Sigma-Aldrich | P7936 | |
| Creatine phosphokinase | Sigma-Aldrich | C3755 | |
| DNA clean & concentrator Kit | ZYMO RESEARCH | D4029 | |
| DpnI | NEB | R0176S | |
| DTT | Sigma-Aldrich | D0632 | |
| E. coli BL21 | Thermo Fisher Scientific | C600003 | |
| E. coli DH5α competent cells | Thermo Fisher Scientific | 18265017 | |
| EDTA | Sigma-Aldrich | 324504 | |
| FeSO4 7H2O | Sigma-Aldrich | F7002 | |
| FLAG-Ub | BostonBiochem | U-120 | |
| Glucose | VWR | 188 | |
| Glycerol | Sigma-Aldrich | G5516 | |
| HA-Ub | BostonBiochem | U-110 | |
| Heat block | VWR | model: 10153-318 | |
| Incubator | VWR | model: 1525 Digital Incubator | |
| Incubator shaker | Thermo Fisher Scientific | model: MaxQ 4000 | |
| IPTG | Roche | 10724815001 | |
| KCl | Sigma-Aldrich | P9333 | |
| LB Broth | Sigma-Aldrich | L3022 | |
| Liquide nitrogen | university chemistore | ||
| Maltose | Sigma-Aldrich | 63418 | |
| MES | Sigma-Aldrich | M3671 | |
| Methanol | Sigma-Aldrich | 34860 | |
| MgCl2 | Sigma-Aldrich | 63138 | |
| MgSO4 7H2O | Sigma-Aldrich | 63138 | |
| Microcentrifuge | Eppendorf | model: 5424 | |
| Miniprep plasmid purification kit | ZYMO RESEARCH | D4015 | |
| monoclonal anti-FLAG antibody | Sigma-Aldrich | F3165 | |
| monoclonal anti-HA antibody | Sigma-Aldrich | H9658 | |
| monoclonal anti-MYC antibody | Sigma-Aldrich | WH0004609M2 | |
| Mortar | VWR | 89038-144 | |
| NaCl | Sigma-Aldrich | S7653 | |
| NaH2PO4 | Sigma-Aldrich | S8282 | |
| NanoDrop | Thermo Fisher Scientific | model: 2000 Spectrophotometer | |
| Needle | Thermo Fisher Scientific | 14-826-5C | |
| NH4Cl | Sigma-Aldrich | A9434 | |
| PCR machine | Bio-Rad | model: C1000 | |
| Pestle | VWR | 89038-160 | |
| Pfu Ultra | Agilent Technologies | 600380 | |
| Plant protease inhibitor coctail | Sigma-Aldrich | P9599 | |
| pMAL-c2 | NEB | N8076S | |
| PMSF | Sigma-Aldrich | P7626 | |
| Polyvinylpolypyrrolidone | Sigma-Aldrich | P6755 | |
| SDS | Sigma-Aldrich | 1614363 | |
| Sonicator | Qsonica Sonicators | model: Q125 | |
| Syringe | Thermo Fisher Scientific | 22-253-260 | |
| Tris | Sigma-Aldrich | T1503 | |
| T4 ligase | NEB | M0202S |
References
- Freemont, P. S., Hanson, I. M., Trowsdale, J. A novel gysteine-rich sequence motif. Cell. 64, 483-484 (1991).
- Borden, K. L. B. RING fingers and B-boxes: Zinc-binding protein-protein interaction domains. Biochemistry and Cell Biology. 76, 351-358 (1998).
- Barlow, P. N., Luisi, B., Milner, A., Elliott, M., Everett, R. Structure of the C3HC4 Domain by 1H-nuclear Magnetic Resonance Spectroscopy: A New Structural Class of Zinc-finger. Journal of Molecular Biology. 237, 201-211 (1994).
- Borden, K. L. B., et al. The solution structure of the RING finger domain from the acute promyelocytic leukaemia proto-oncoprotein PML. The EMBO Journal. 14, 1532-1541 (1995).
- Lorick, K. L., et al. RING fingers mediate ubiquitin-conjugating enzyme (E2)-dependent ubiquitination. Proceedings of the National Academy of Sciences. 96, 11364-11369 (1999).
- Jiménez-López, D., Muñóz-Belman, F., González-Prieto, J. M., Aguilar-Hernández, V., Guzmán, P. Repertoire of plant RING E3 ubiquitin ligases revisited: New groups counting gene families and single genes. PLoS ONE. 13, 1-28 (2018).
- Sacco, M. A., et al. The Cyst Nematode SPRYSEC Protein RBP-1 Elicits Gpa2- and RanGAP2-Dependent Plant Cell Death. PLoS Pathogens. 5, 1-14 (2009).
- Kud, J., et al. The potato cyst nematode effector RHA1B is a ubiquitin ligase and uses two distinct mechanisms to suppress plant immune signaling. PLoS Pathogens. 15, 1007720(2019).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Sigrist, C. J. A., et al. New and continuing developments at PROSITE. Nucleic Acids Research. 41, 344-347 (2013).
- Dove, K. K., Stieglitz, B., Duncan, E. D., Rittinger, K., Klevit, R. E. Molecular insights into RBR E3 ligase ubiquitin transfer mechanisms. EMBO Reports. 17, 1221-1235 (2016).
- Metzger, M. B., Pruneda, J. N., Klevit, R. E., Weissman, A. M. RING-type E3 ligases: Master manipulators of E2 ubiquitin-conjugating enzymes and ubiquitination. Biochimica et Biophysica Acta - Molecular Cell Research. 1843, 47-60 (2014).
- Xie, Q., et al. SINAT5 promotes ubiquitin-related degradation of NAC1 to attenuate auxin signals. Nature. 419, 167-170 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved