A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
صورة موجهة عبرية Mitral صمام ثقب نموذج ثقب من حجم الزائد التحكم من الغرسال في الفئران
In This Article
Summary
تم الإبلاغ عن نموذج القوارض من حجم القلب الأيسر الزائد من قلس الميترالي. يتم حث الغرسة التاجية للشدة الخاضعة للرقابة عن طريق إدخال إبرة ذات أبعاد محددة إلى النشرة المؤقتة للصمام التاجي ، في قلب ينبض ، مع توجيه الموجات فوق الصوتية.
Abstract
قلس الميترال (MR) هو آفة صمام القلب المنتشرة على نطاق واسع، والتي تسبب إعادة عرض القلب ويؤدي إلى فشل القلب الاحتقاني. على الرغم من أن مخاطر التصوير بالرنين المغناطيسي غير المصححة وتشخيصه الضعيف معروفة ، إلا أن التغيرات الطولية في وظيفة القلب والهيكل وإعادة عرض هاهي غير مفهومة تمامًا. وقد حدت هذه الفجوة المعرفية فهمنا للتوقيت الأمثل لتصحيح MR، والفائدة التي قد يكون تصحيح MR في وقت مبكر مقابل وقت متأخر على البطين الأيسر. للتحقيق في الآليات الجزيئية التي تكمن وراء إعادة عرض البطين الأيسر في إعداد MR ، نماذج الحيوانات ضرورية. تقليديا، وقد استخدمت نموذج الناسور الأبهري الكافال للحث على حجم الزائد، والذي يختلف عن الآفات ذات الصلة سريريا مثل MR MR يمثل ضغط منخفض حجم الزائد الإجهاد الهيموديناميكي، الذي يتطلب نماذج الحيوانات التي تحاكي هذا الشرط. هنا، ونحن نصف نموذج القوارض من MR شديدة فيها يتم مغرفة نشرة aterior من الصمام التاجي الفئران مع إبرة 23G، في قلب ينبض، مع توجيه صورة صدى القلب. يتم تقييم شدة MR وتأكيدها باستخدام تخطيط صدى القلب ، ويتم الإبلاغ عن استنساخ النموذج.
Introduction
قلس الميترال (MR) هو آفة صمام القلب الشائعة ، التي تم تشخيصها في 1.7٪ من عموم سكان الولايات المتحدة وفي 9٪ من السكان المسنين الذين تزيد أعمارهم عن 65عامًا. في هذه الآفة صمام القلب، إغلاق غير لائق من منشورات الصمام التاجي في systole، يسبب قلس الدم من البطين الأيسر في الأذين الأيسر. يمكن أن يحدث MR بسبب العديد من المسببات. ومع ذلك ، يتم تشخيص الآفات الأولية للصمام التاجي (MR الأولية) وعلاجها بشكل أكثر تكرارًا مقارنة بـ MR2الثانوي. غالبًا ما يكون MR الأولي المعزول نتيجة لانحطاط النخاع في الصمام التاجي ، مما يؤدي إلى إسطالة المنشورات أو الوترتينين، أو تمزق بعض الوتر، وكلها تساهم في فقدان التمادير الانقباضي للصمام.
MR الناتجة عن مثل هذه الآفات صمام يرفع حجم الدم ملء البطين الأيسر في كل ضربات القلب، وزيادة الإجهاد الجدار الانبساطي نهاية وتوفير الإجهاد الهيموديناميكي الذي يحرض على التكيف القلب وإعادة عرض. غالباً ما تتميز إعادة عرض القلب في هذه الآفة بتكبير كبير للغرفة3،4، تضخم جدار معتدل ، مع وظيفة انقباض ية محفوظة لفترات طويلة من الزمن. نظرًا لأن كسر القذف غالبًا ما يتم الحفاظ عليه ، غالبًا ما يتأخر تصحيح MR باستخدام الوسائل الجراحية أو عبر القسطرة ، حتى ظهور أعراض مثل عسر التنفس وفشل القلب وعدم انتظام ضربات القلب. ومع ذلك ، يرتبط MR غير المصحح ة بمخاطر عالية للأحداث السلبية القلبية ، على الرغم من أن المعرفة الحالية بشأن التغييرات الهيكلية الفائقة الكامنة وراء هذه الأحداث غير معروفة.
نماذج الحيوانات من MR توفير نموذج قيم للتحقيق في مثل هذه التغيرات الهيكلية في القلب، ودراسة التقدم الطولي للمرض. سابقا، وقد تسبب الباحثون MR في الحيوانات الكبيرة بما في ذلك الخنازير والكلاب والأغنام، عن طريق خلق تحويلة خارجية البطين الأذيني5،تمزق وتري داخل القلب6،أو نشرة التشبك7. في حين أن التقنيات الجراحية أسهل في الحيوانات الكبيرة ، فقد اقتصرت هذه الدراسات على المتابعة دون المزمنة في حجم عينة صغيرة ، بسبب ارتفاع تكاليف إجراء مثل هذه الدراسات في الحيوانات الكبيرة. وعلاوة على ذلك، فإن التحليل الجزيئي للأنسجة من هذه النماذج غالباً ما يكون صعباً بسبب الأجسام المضادة المحدودة الخاصة بالأنواع ومكتبات الجينوم المشروحة للمحاذاة.
نماذج الحيوانات الصغيرة من MR يمكن أن توفر بديلا مناسبا لدراسة هذه الآفة صمام وتأثيرها على إعادة عرض القلب. تاريخيا، تم استخدام نموذج الفئران من الناسور الأبهري (ACF) من حجم القلب الزائد. وصف لأول مرة في عام 1973 من قبل Stumpe وآخرون8،يتم إنشاء الناسور الشرياني الوريدي جراحيا لتجاوز الدم الشرياني ارتفاع الضغط من الشريان الأورطا تنازلي إلى انخفاض الضغط أقل فينا كافا. يؤدي ارتفاع معدل التدفق في الناسور إلى زيادة حجم كبيرة على جانبي القلب ، مما يسبب تضخم ًا كبيرًا للالبطينين الأيمن والأيسر وخللًا وظيفيًا يحدث في غضون أيام من إنشاء ACF9. على الرغم من نجاحها، ACF لا يحاكي الديناميكا الدموية من MR، حمولة زائدة حجم الضغط المنخفض، الذي يرفع الحمل المسبق ولكن أيضا يقلل من الحمل بعد. بسبب مثل هذه القيود من نموذج ACF، سعينا لتطوير وتوصيف نموذج MR الذي يحاكي بشكل أفضل الزائد حجم الضغط المنخفض.
هنا، ونحن نصف بروتوكول لنموذج من ثقب منشور الصمام التاجي لخلق MR شديدة في الفئران10،11. تم إدخال إبرة تحت الجلد في قلب الفئران النابض ، وتقدمت إلى منشور الصمام التاجي الرعنى في الوقت الحقيقي تحت توجيه تخطيط صدى القلب في الوقت الحقيقي. هذه التقنية قابلة للاستنساخ للغاية ونموذج جيد نسبيا يحاكي MR كما رأينا في المرضى. يتم التحكم في شدة MR من خلال حجم الإبرة المستخدمة لترميز المنشور التاجي ويمكن تقييم شدة MR باستخدام تخطيط صدى المريء (TEE).
Protocol
تمت الموافقة على الإجراءات من قبل برنامج رعاية الحيوانات واستخدامها في جامعة إيموري بموجب البروتوكول رقم EM63Rr، تاريخ الموافقة 06/06/2017.
1. إعداد ما قبل الجراحة
- البخار تعقيم الأدوات الجراحية قبل العملية.
- في يوم الإجراء، نقل الفئران من السكن إلى الجراحة، ووزنها.
- رسم الأدوية قبل الجراحة وما بعد الجراحة وفقا للوزن: جرعتين من كاربروفين (2.5 ملغ/كغ لكل منهما)، وجرعة واحدة من جنتامايسين (6 ملغ/كغ)، وجرعة واحدة من بوبرينورفين (0.02 ملغم/كغ).
- ضمان حجم كاف من الإيزوفدران في خلاط الغاز، والأكسجين في خزانات متوفرة لعملية جراحية. خزان واحد كامل من الأكسجين (24 قدم3)غالبا ما يكون كافيا.
2. إعداد الحيوانات
ملاحظة: الفئران الذكور Sprague-Dawley الكبار وزنها 350-400 غرام استخدمت في هذه الدراسة. التقنيات الجراحية قابلة للحيوانات أصغر قليلا أو أكبر، إذا رغبت في ذلك.
- تخدير الفئران في غرفة التعريفي مع 5٪ isoflurane مختلطة في 1 LPM (لتر في الدقيقة) من الأكسجين 100٪. تحديد مستوى كاف من التأنيمن من معدل تنفسية أبطأ تحت المراقبة البصرية، وفقدان الارتعاش عند قرص إصبع قدم الجرذ.
- تبيد الجرذ بـ 16 G angiocath، المجهزة للاستخدام كأنبوب الإندوتراكفيل.
- تصور القصبة الهوائية والحبال الصوتية باستخدام منظار الشوفان، واستخدام قضيب طرف القطن لمسح إفرازات البلعوم.
- إدخال أنبوب endotracheal على سلك إرشادي 0.034 بوصة، في الحبال الصوتية. مرة واحدة يتم وضع الأنبوب بشكل مناسب في القصبة الهوائية، ودفع أنبوب إلى الداخل وسحب السلك(الشكل1).
- ضع الجرذ على وسادة جراحية ساخنة يتم صيانتها عند درجة حرارة 37 درجة مئوية وقم بتوصيل أنبوب الإنفوركترافيل بجهاز التنفس الصناعي الميكانيكي. إدخال وزن الجرذ في برنامج التحكم في جهاز التنفس الصناعي ، والذي يحسب معدل التهوية وحجم المد والجزر. 66 التنفس في الدقيقة الواحدة مع حجم المد والجزر من 1 مل/100 غرام وزن الجسم استخدمت في هذه الدراسة(الشكل 1D).
- استخدام الأكسجين 100٪ (1 LPM) مختلطة مع 2-2.5٪ isoflurane كما مخدر المستنشق وتأكيد مستوى التخدير مع فقدان لهجة الفك وفقدان الاستجابة لقرصة إصبع القدم.
- لاحظ أنه إذا تم تنبيببشكل صحيح، يجب مزامنة حركة الصدر مع جهاز التنفس الصناعي.
- إذا تم تنبيب بشكل غير صحيح، لن تتزامن حركة الصدر مع جهاز التنفس الصناعي. لاختبار التنبيب غير السليم، ضغط بطن الفئران، مما يخلق الضغط الخلفي على جهاز التنفس الصناعي، وتوليد إنذار الإفراط في الضغط. في هذا السيناريو، تراجع عن الأوعية بلطف، والعودة الفئران إلى غرفة التعريفي مع 5٪ isoflurane لبضع دقائق لضمان هو بالمناسب وبعملية تهيئة الفئران.
- مرة واحدة تنبيب بشكل صحيح، وتأمين أنبوب الإنفوركتعاال عن طريق خياطة الطرف القريب من الأنبوب إلى خد الجرذ مع خياطة الحرير 4-0 لتجنب الاستئصال أثناء الإجراء.
- أدخل مسبار درجة حرارة المستقيم لمراقبة درجة حرارة الجسم، ومخطط كهربي رباعي لمراقبة تخطيط القلب أثناء العملية بأكملها.
- استخدام مصباح التدفئة النفقات العامة إذا كانت الحرارة من منصة الجراحية غير كافية. إيقاف مصباح إذا ارتفعت درجة حرارة الجسم فوق 37 درجة مئوية.
- تقييم بصريا تخطيط القلب لأي عدم انتظام ضربات القلب أو علامات نقص التروية عضلة القلب. إذا لم يكن هناك أي شيء، قم بتسجيل مخطط كهربية القلب الأساسي.
- إجراء تخطيط صدى الصدر (TTE) لوظيفة القلب الأساسية(الشكل 2A).
- تحويل الفئران إلى موقف supine ويكون الأعلى من الصدر. للحصول على آراء واضحة صدى، وإزالة الشعر باستخدام كريم إزالة الرذاذ.
- استخدام أي نظام الموجات فوق الصوتية مع تردد كاف لتصوير معدل ضربات القلب عالية. في هذه الدراسة استخدمنا نظام Visualsonics 2100 مع مسبار 21 ميغاهرتز ، وهو مناسب لتصوير القلب في الفئران.
- الحصول على صور وضع B في المستوى المظلي ذات المحور الطويل، لحساب وحدات التخزين البطينية اليسرى. في نفس المستوى، احصل على صور M-Mode لقياس أبعاد الجدار.
- قم بتشغيل المسبار بمقدار 90 درجة، والحصول على طرق عرض قصيرة للوضع B وM-Mode على المستوى المتوسط الحليمي لقياس أبعاد الجدار المقطعي العرضي.
- إجراء تخطيط صدى المريء (TEE) للتصوير الأساسي(الشكل 2B).
- ضع الجرذ في وضع الديكوبية الأيمن وأدخل مسبار الموجات فوق الصوتية داخل القلب 8 Fr (8 ميغاهرتز) في مريء الجرذ مع كمية صغيرة من الجل المطبق على الطرف. تواتر ICE (تصوير صدى القلب) كافية للحصول على 4-6 إطارات لكل نبضة القلب، والتي هي كافية لتصور حركة صمام.
ملاحظة: يمكن استخدام نظام جنرال إلكتريك حية I أو سيمنز SC2000 رئيس الوزراء للتصوير ICE. - الحصول على عرض المريء عالية للحصول على وجهة نظر من غرفتين من الجانب الأيسر من القلب. هذا المنظر مثالي لتصور الأذين الأيسر والصمام التاجي والبطين الأيسر. وضع التحقيق بحيث يتم تصور المنشورات الأمامية والخلفية وcoaptation هو مركزي. تسمح هذه الزاوية أيضًا بقياسات دوبلر عبر الصمام التاجي ، دون تصحيح زاوية.
- غادر قياس منطقة الأذين والصمام التاجي أبعاد الإبطال في هذا الرأي.
- تنفيذ لون دوبلر التصوير لتأكيد كفاءة صمام وعدم وجود MR في خط الأساس. إجراء موجة نبضية وموجة مستمرة دوبلر التصوير لتحديد تدفق التاجي وتأكيد عدم وجود تدفق regurgitant.
- تنفيذ B-وضع ونبض موجة دوبلر التصوير من الأبهر لقياس قطر الجذر الأبهري وحساب تدفق الأبهر.
- إجراء تصوير دوبلر موجة نبضية من الوريد الرئوي لقياس تدفق وذم ة رئوية.
- ضع الجرذ في وضع الديكوبية الأيمن وأدخل مسبار الموجات فوق الصوتية داخل القلب 8 Fr (8 ميغاهرتز) في مريء الجرذ مع كمية صغيرة من الجل المطبق على الطرف. تواتر ICE (تصوير صدى القلب) كافية للحصول على 4-6 إطارات لكل نبضة القلب، والتي هي كافية لتصور حركة صمام.
- حقن جرعة واحدة من Carprofen (2.5 ملغ / كجم، SQ، غير الستيرويدية المضادة للالتهابات)، جنتاماين (6 ملغ / كغ، SQ، المضادات الحيوية)، والمالحة المعقمة (1 مل، SQ) للتعويض بشكل استباقي عن فقدان الدم أثناء الإجراء.
- قم بحلاقة الجانب الأيسر من الصدر حسب الحاجة لإزالة أي شعر متبقي من المجال الجراحي. يجب أن يكون الحلاقة من منطقة الرقبة السفلية إلى xyphoid ، ومن الذراع الأيسر وصولاً إلى منتصف القص كافية لضمان حقل يخلو من الشعر ويقلل من خطر تلوث الموقع الجراحي.
- فرك المنطقة الجراحية مع شاش غارق ة في Betadine، تليها شاش غارقة في الإيثانول 70٪. فرك المنطقة في حركات دائرية على الجلد، بحيث لا تلامس الشاش منطقة تم تنظيفها سابقا.
- كرر هذه الخطوة ثلاث مرات لتحقيق حقل معقم بشكل كاف للجراحة.
- قم بثني الحيوان بأغطية معقمة، وفتح نافذة للوصول إلى المنطقة الجراحية المعقمة.
3- جراحة الصدر اليسرى
- إجراء العملية الجراحية بأكملها باستخدام تقنيات العقيم، مع الحفاظ على إيزوفران في 2-2.5٪ في 1 LPM من الأكسجين. ضع جميع الأدوات في صينية معقمة، ثم ضعها مرة أخرى في الدرج بعد كل استخدام.
- ارتداء قفازات معقمة وقناع وقبعة جراحية من قبل الجراح للإجراء بأكمله. يمكن ارتداء ثوب جراحي معقم أيضًا ، ولكنه اختياري ما لم يكن من المتوقع التلوث.
- استخدم مشرطًا جراحيًا بشفرة لا #15 لإجراء شق جلدي على الجانب الأيسر من الصدر، وتقريبًا 1 سم قريبًا من الإكسيفود. استخدم مقص ًا مُشرّحًا لفصل طبقة الجلد عن طبقة العضلات وإجراء شق طولي.
- تشريح طبقات العضلات بنفس الطريقة حتى يتم كشف الأضلاع.
- جعل بعناية شق طولي 2-3 سم في الفضاء الخامس بين التكاليف، كافية لإدراج المنتقدين وفضح القلب.
- استخدام ملقط يميل غرامة لرفع التامور، ومقص صغير لاستئصاله في المنطقة المحيطة قمة القلب. تساعد هذه الخطوة على تجنب التصاقات القلب بعد الجراحة بجدران الصدر والحجاب الحاجز.
ملاحظة: تجنب الشقوق الجراحية بالقرب من القص لتقليل النزيف. قد يسبب تحويل الشرايين الثديية الداخلية التي تعمل على طول القص نزيفًا مفرطًا. إذا واجهت مع مثل هذا النزيف، وتحديد النزيف وcauterize ذلك.
4. صدى توجيه إجراءات MR(الشكل 3 والشكل 4)
- استخدم خياطة برولين 6-0 وحامل إبرة صغيرة، لوضع خياطة سلسلة محفظة على قمة البطين الأيسر. إذا لزم الأمر، استخدم ملقط صغيرة لتحقيق الاستقرار في القلب.
- ربط بلطف خياطة apical لتثبيت قمة وإدراج إبرة 23 G (مسح مع المالحة، ومع stopcock في نهايتها القاصية) في وسط غرزة سلسلة محفظة، في تجويف البطين الأيسر.
- استخدام يد واحدة لعقد وبتوجيه ثابت الإبرة، واليد الأخرى للتلاعب في وقت واحد التحقيق صدى عبر المريء لتحقيق عرض صدى الأمثل لتصور الإبرة، كما هو موضح أعلاه.
- مع التوجيه الموجات فوق الصوتية في الوقت الحقيقي، تقدم الإبرة نحو الجانب البطيني من نشرة التاجي ة أترتور. بمجرد تأكيد موضع الإبرة على الموجات فوق الصوتية ، تقدم الإبرة في حركة واحدة دقيقة من خلال منشور الصمام. إذا شعر مقاومة، وتحريف الإبرة كما هو المتقدم في النشرة لتبربها.
ملاحظة: يمكن أن يؤدي تقدم الإبرة بعيداً جداً إلى الأذين الأيسر إلى حدوث ثقوب الأذين الأيسر، مما يسبب نزيفاً مفرطاً ووفاة الحيوانات. يجب تصور الإبرة على الموجات فوق الصوتية في جميع الأوقات. - تراجع الإبرة في غرفة البطين الأيسر، بعيدا عن الصمام التاجي، وتأكيد MR عن طريق تشغيل لون دوبلر التصوير.
- إذا لم يتم مشاهدة MR على تصوير دوبلر اللون، كرر الخطوتين 4.4 و 4.5. ضبط مسبار الصدى إذا لزم الأمر للحصول على عرض أفضل. بعد الممارسة في عدد قليل من الفئران ، من الممكن الحث على ثقب منشور في حركة واحدة من الإبرة ، مما يؤدي إلى ثقب بحجم القطر الخارجي للإبرة. وقد تأكد هذا بعد تشريح قلوب الفئران.
- بمجرد تأكيد MR ، اسحب الإبرة من تجويف البطين الأيسر وربط خياطة سلسلة المحفظة بلطف.
- استخدام شاش معقم لامتصاص أي دم على قمة وفي تجويف الصدر.
ملاحظة: قد يؤدي لمس مسبار الصدى بالقفازات الجراحية إلى تلوث البيئة المعقمة. رش قفازاتك بالإيثانول بنسبة 70% أو استبدل القفازات بقفازات جديدة، بشكل مناسب.
5- شفاء الحيوانات والرعاية بعد الجراحة
- بعد 5-10 دقائق من وظيفة القلب مستقرة (تخطيط القلب العادي ومعدل ضربات القلب)، وإغلاق فاحش الصدر في طبقات مع 4-0 vicryl، مع الحد من الايزوفوران في الخطوات.
- استخدام خياطة متقطعة لتقريب الأضلاع، مع الحفاظ على إيسوفلوران في 2٪. أدخل أنبوب الصدر في الفضاء السادس بين التكاليف وتأمينه إلى الستائر العقيمة لتجنب التقدم غير المقصود للأنبوب في تجويف الصدر.
- استخدام خياطة مستمرة لإغلاق طبقة العضلات مع إيسوفلوران الحفاظ على 1.5٪.
- استخدام خياطة مستمرة لإغلاق طبقة الجلد مع الإيسوفلوران الحفاظ على 1٪.
- قم بتوصيل حقنة صمام Luer-lock ذات 10 مل بالمقلوب بأنبوب الصدر واستنزاف 10-12 مل من الهواء من تجويف الصدر ثم قم بإزالة أنبوب الصدر.
- إعطاء جرعة نهائية من كاربروفين (2.5 ملغ / كجم, SQ) وإيقاف إيسوفلوران.
- مواصلة التهوية الميكانيكية في حين الفعن الفئران من التخدير، ورصد العلامات الحيوية (SpO2 ومعدل ضربات القلب). في بداية التنفس التلقائي، إيقاف التهوية لاختبار قدرة الفئران للحفاظ على مثل هذا التنفس وجيدة SpO2.
- إذا بدأت مستويات SpO2 في الانخفاض إلى أقل من 90٪، قم بتشغيل جهاز التنفس الصناعي. مرة واحدة الجرذ قادرة على الحفاظ على مستويات SpO2 دون تهوية، يتم قطع خياطة الرسو إلى أنبوب endotracheal، ويتم إعداد الحيوان لextubation.
- مرة واحدة يظهر الفئران علامات اليقظة بما في ذلك شعيرات أو حركات العين، extubate الحيوان.
- وضع مخروط الأنف مع الأكسجين 100٪ حتى الجرذ هو الإسعافية.
- نقل الفئران إلى قفص نظيف مع الحد الأدنى من الفراش والاستمرار في رصد العلامات الحيوية باستخدام جهاز عرض SpO2 محمول ، يوضع على قدم الجرذ أو الذيل ، حتى يكون الجرذ متنقلًا.
ملاحظة: إذا لوحظت الآثار السلبية من الجراحة، قد يكون للحيوانات وقت أطول للتعافي وقد يستغرق وقتا أطول لعقد مستويات عالية SpO2. إذا حدث ذلك، يمكن تطبيق مخروط الأنف مع الأكسجين 100٪ حتى مستويات SpO2 مستقرة. - للحد من خطر الإصابة في موقع الجراحة وتجنب خطر العدوى ، والجرذان منزل واحد بعد الجراحة.
- إدارة Buprenorphine في غضون 3 ح بعد أن يكون الجرذ مستيقظا والإسعافية بما فيه الكفاية. قد يسبب البوبرينورفين ضيقًا تنفسية عند إعطائه في وقت مبكر من فترة التعافي المحيطة، وبالتالي يؤخرها حتى يتنفس الجرذ دون صعوبة.
- بعد الجراحة ، تتلقى جميع الحيوانات الأدوية التالية: جنتاميسين (6 ملغ / كجم ، SQ ، SID POD 1-3) والريماديل (5 ملغ / كجم ، SQ ، SID POD 1-3). تتم ملاحظة جميع الحيوانات مرة واحدة يوميًا لمدة خمسة أيام بعد الجراحة لفحص مواقع الشقوق ، ومرة واحدة يوميًا لأول أسبوعين بعد الجراحة لتقييم الألم.
6. التحقق من صحة شدة MR مع تخطيط صدى القلب(الشكل 5)
- كرر TEE بعد أسبوعين من الجراحة، باستخدام نفس الخطوات المحددة في القسم 2.7. أسبوعين بعد الجراحة هو الوقت المناسب لديناميكية الهيموميكا لتحقيق الاستقرار.
- الحصول على لون دوبلر التصوير على عرض من غرفتين باستخدام التصوير بالموجات فوق الصوتية عبر المريء، وتصور البطين الأيسر والأذين الأيسر. قياس مساحة الأذين الأيسر وطائرة MR. حساب كسر منطقة الطائرة MR باستخدام
 (1)
(1)
يتم تعريف السيد الشديد على أنه منطقة طائرة MR ≥ 30٪. - تقريب مساحة الأورجيان المتربّج عن طريق حساب مساحة إبرة 23 G ، باستخدام القطر الخارجي للإبرة. تفترض هذه المعادلة أن مساحة الأوريفستان تساوي مساحة إبرة 23G.
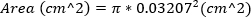 (2)
(2) - الحصول على التصوير دوبلر الموجة المستمرة مع بوابة دوبلر عند فتحة الطائرة الرجيجة. تتبع الموجي لحساب VTI من الطائرة regurgitant. يمكن تقدير حجم MR باستخدام
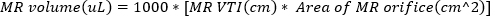 (3)
(3)
يتم تعريف MR الشديد على أنه حجم MR ≥ 95 μL. - الحصول على نبض موجة دوبلر التصوير من الوريد الرئوي عن طريق تدوير التحقيق صدى laterally, في اتجاه عقارب الساعة. قياس سرعات الموجة الانقباضي والانبساطي واستخدام المعادلة التالية لحساب النسبة.
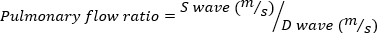 (4)
(4)
تشير نسبة التدفق الرئوي السلبية إلى مرض الرنين المغناطيسي الحاد.
7. شام الجراحة
- تنفيذ المقاطع 1-3 كما هو موضح.
- تعديل القسم 4 تم تعديلها بحيث يتم إدخال إبرة 23 G في غرفة البطين الأيسر، من خلال غرزة سلسلة محفظة على قمة البطين الأيسر، ولكن لم تقدم في الصمام التاجي لإنشاء MR. إدراج الإبرة في غرفة البطين الأيسر والتراجع على الفور، تليها عن طريق تشديد وإغلاق قمة البطين.
- تنفيذ القسم 5 كما هو موضح.
- إجراء تقييم الصمام التاجي كما هو موضح في القسم 6. ومع ذلك ، لا ينبغي أن يكون MR موجودًا في أي من الحيوانات ، وبالتالي فإن التحديد الكمي كما هو موضح ليس ضروريًا.
النتائج
الجدوى والاستنساخ
نموذج MR المقترح قابل للاستنساخ للغاية ، مع ثقب محدد جيدًا في المنشور التاجي الذي تحقق في 100٪ من الفئران المستخدمة في هذه الدراسة. يصور الشكل 6A اتجاه الإبرة أثناء إدخالها في الصمام التاجي. يصور الشكل 6
Discussion
يتم الإبلاغ عن نموذج القوارض القابلة للاستنساخ من MR الشديد مع بقاء جيد (93.75٪ البقاء على قيد الحياة بعد الجراحة) ودون مضاعفات كبيرة بعد الجراحة. التصوير في الوقت الحقيقي مع تخطيط صدى المريء وإدخال إبرة في القلب النابض لثقب المنشور التاجي ممكن ويمكن تدريسه. تم إنتاج MR شديدة مع حجم إبرة 23 G في ه...
Disclosures
M.P هو مستشار لتقنيات إصلاح القلب (HRT)، والتي حصل على رسوم استشارية. ولم يكن لإذاعة وتلفزيون كرواتيا أي دور في هذه الدراسة، كما أنها لم تقدم أي تمويل لدعم هذا العمل.
Acknowledgements
تم تمويل هذا العمل من خلال منحة 19PRE34380625 و 14SDG20380081 من جمعية القلب الأمريكية إلى D. كوركوران وM. بادالا على التوالي، يمنح HL135145، HL133667، وHL140325 من المعاهد الوطنية للصحة إلى M. بادالا، وتمويل البنية التحتية من مركز كارلايل فريزر للقلب في مستشفى جامعة إيموري ميدتاون إلى M. بادالا.
Materials
| Name | Company | Catalog Number | Comments |
| 23G needle | Mckesson | 16-N231 | |
| 25G needle, 5/8 inch | McKesson | 1031797 | |
| 4-0 vicryl | Ethicon | J496H | |
| 6-0 prolene | Ethicon | 8307H | |
| 70% ethanol | McKesson | 350600 | |
| ACE Light Source | Schott | A20500 | |
| ACUSON AcuNav Ultrasound probe | Biosense Webster | 10135936 | 8Fr Intracardiac echo probe |
| ACUSON PRIME Ultrasound System | Siemens | SC2000 | |
| Betadine | McKesson | 1073829 | |
| Blunted microdissecting scissors | Roboz | RS5990 | |
| Buprenorphine | Patterson Veterinary | 99628 | |
| Carprofen | Patterson Veterinary | 7847425 | |
| Chest tube (16G angiocath) | Terumo | SR-OX1651CA | |
| Disposable Surgical drapes | Med-Vet | SMS40 | |
| Electric Razor | Oster | 78400-XXX | |
| Gentamycin | Patterson Veterinary | 78057791 | |
| Heat lamp with table clamp | Braintree Scientific | HL-1 120V | |
| Hemostatic forceps, curved | Roboz | RS7341 | |
| Hemostatic forceps, straight | Roboz | RS7110 | |
| Induction chamber | Braintree Scientific | EZ-1785 | |
| Injection Plug, Cap, Luer Lock | Exel | 26539 | |
| Isoflurane | Patterson Veterinary | 6679401725 | |
| Mechanical ventilator | Harvard Apparatus | Inspira ASV | |
| Microdissecting forceps | Roboz | RS5135 | |
| Microdissecting spring scissors | Roboz | RS5603 | |
| Needle holder | Roboz | RS6417 | |
| No. 15 surgical blade | McKesson | 1642 | |
| Non-woven sponges | McKesson | 446036 | |
| Otoscope | Welch Allyn | 23862 | |
| Oxygen | Airgas Healthcare | UN1072 | |
| Pulse Oximeter | Nonin Medical | 2500A VET | |
| Retractor, Blunt 4x4 | Roboz | RS6524 | |
| Rodent Surgical Monitor | Indus Instruments | 113970 | The integrated platform allows for monitoring of vital signs and surgical warming |
| Scale | Salter Brecknell | LPS 150 | |
| Scalpel Handle | Roboz | RS9843 | |
| Silk suture 3-0 | McKesson | 220263 | |
| Small Animal Anesthesia System | Ohio Medical | AKDL03882 | |
| Sterile saline (0.9%) | Baxter | 281322 | |
| Sugical Mask | McKesson | 188696 | |
| Surgical cap | McKesson | 852952 | |
| Surgical gloves | McKesson | 854486 | |
| Syringe 10mL | McKesson | 1031801 | |
| Syringe 1mL | McKesson | 1031817 | |
| Ultra-high frequency probe | Fujifilm Visualsonics | MS250 | |
| Ultrasound gel | McKesson | 150690 | |
| VEVO Ultrasound System | Fujifilm Visualsonics | VEVO 2100 |
References
- Nkomo, V. T., et al. Burden of valvular heart diseases: a population-based study. Lancet. 368 (9540), 1005-1011 (2006).
- Zamorano, J. L., et al. Mechanism and Severity of Mitral Regurgitation: Are There any Differences Between Primary and Secondary Mitral Regurgitation?. The Journal of Heart Valve Disease. 25 (6), 724-729 (2016).
- Grossman, W., Jones, D., McLaurin, L. P. Wall stress and patterns of hypertrophy in the human left ventricle. Journal of Clinical Investigation. 56 (1), 56-64 (1975).
- Carabello, B. A. Concentric versus eccentric remodeling. Journal of Cardiac Failure. 8 (6), S258-S263 (2002).
- Braunwald, E., Welch, G. H., Sarnoff, S. J. Hemodynamic effects of quantitatively varied experimental mitral regurgitation. Circulation Research. 5 (5), 539-545 (1957).
- Sasayama, S., Kubo, S., Kusukawa, R. Hemodynamic and angiocardiographic studies on cardiodynamics: experimental mitral insufficiency. Japanese Circulation Journal. 34 (6), 513-530 (1970).
- Hennein, H., Jones, M., Stone, C., Clark, R. Left ventricular function in experimental mitral regurgitation with intact chordae tendineae. Journal of Thoracic and Cardiovascular Surgery. 105 (4), 624-632 (1993).
- Stumpe, K. O., Sölle, H., Klein, H., Krück, F. Mechanism of sodium and water retention in rats with experimental heart failure. Kidney International. 4 (5), 309-317 (1973).
- Abassi, Z., Goltsman, I., Karram, T., Winaver, J., Hoffman, A. Aortocaval fistula in rat: A unique model of volume-overload congestive heart failure and cardiac hypertrophy. Journal of Biomedicine and Biotechnology. 2011 (January), 1-13 (2011).
- Corporan, D., Onohara, D., Hernandez-Merlo, R., Sielicka, A., Padala, M. Temporal changes in myocardial collagen, matrix metalloproteinases, and their tissue inhibitors in the left ventricular myocardium in experimental chronic mitral regurgitation in rodents. American Journal of Physiology - Heart and Circulatory Physiology. 315 (5), H1269-H1278 (2018).
- Onohara, D., Corporan, D., Hernandez-Merlo, R., Guyton, R. A., Padala, M. Mitral Regurgitation Worsens Cardiac Remodeling in Ischemic Cardiomyopathy in an Experimental Model. The Journal of Thoracic and Cardiovascular Surgery. , (2019).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovascular Research. 24 (5), 430-432 (1990).
- Brower, G. L., Janicki, J. S. Contribution of ventricular remodeling to pathogenesis of heart failure in rats. American Journal of Physiology-Heart and Circulatory Physiology. 280 (2), H674-H683 (2001).
- McCutcheon, K., et al. Dynamic changes in the molecular signature of adverse left ventricular remodeling in patients with compensated and decompensated chronic primary mitral regurgitation. Circulation Heart Failure. 12 (9), (2019).
- McCutcheon, K., Manga, P. Left ventricular remodeling in chronic primary mitral regurgitation. Cardiovascular Journal of Africa. 29 (1), 51-64 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved