A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تقييم الأكسدة الخلوية باستخدام مقصورة فرعية خاصة ببروتين الفلورسنت الأخضر الحساس للأكسدة الحمراء
In This Article
Summary
يصف هذا البروتوكول تقييم حالة الأكسدة الخاصة بالحجرة الفرعية داخل الخلية. يسمح مسبار الفلورسنت الحساس لل الأكسدة بالتحليل التناسبي المريح في الخلايا السليمة.
Abstract
قياس التوازن بين الخلايا الأكسدة / تخفيض يوفر لمحة عامة عن الحالة الأكسدة الفسيولوجية و / أو المرضية فيزيولوجيا للكائن الحي. ثيولس مهمة بشكل خاص لإلقاء الضوء على حالة الأكسدة من الخلايا عن طريق انخفاض ديثيول ونسبة كبريتيد المؤكد. البروتينات الفلورية المحتوية على السيستين المهندسة تفتح حقبة جديدة لمواسات الاستشعار الحيوي الحساسة للأحمر. واحد منهم، أحمر الأكسدة الخضراء البروتين الفلورسنت (roGFP)، يمكن بسهولة أن تدخل في الخلايا مع تحويل adenoviral، مما يسمح لحالة الأكسدة الحمراء من المقصورات دون الخلوية ليتم تقييمها دون تعطيل العمليات الخلوية. وقد cysteines انخفاض والسيستين المؤكد من roGFP استثارة ماكسيما في 488 نانومتر و 405 نانومتر، على التوالي، مع انبعاث في 525 نانومتر. تقييم نسب هذه الأشكال المخفضة والأكسدة يسمح حساب مريح لتوازن الأكسدة داخل الخلية. في هذه المقالة الطريقة، تم استخدام خلايا سرطان الثدي ثلاثية السلبية البشرية (MDA-MB-231) لتقييم حالة الأكسدة داخل الخلية الحية. وتشمل خطوات البروتوكول MDA-MB-231 خلية خط نقل مع الفيروس الغدي للتعبير عن cytosolic roGFP, العلاج مع H2O2,وتقييم نسبة السيستين والسيستين مع كل من تدفق الخلايا والمجهر الفلورسي.
Introduction
تم تعريف الإجهاد التأكسي في عام 1985 من قبل هيلموت سيز بأنه "اضطراب في التوازن prooxidant-antioxidant لصالح السابق"1، وقد تم إجراء عدد كبير من الأبحاث للحصول على المرض ، والتغذية ، والشيخوخة محددة حالة الأكسدة للكائنات الحية1،2،3. ومنذ ذلك الحين، أصبح فهم الإجهاد التأ المؤسدي أوسع نطاقاً. وقد أظهرت اختبار فرضيات استخدام المواد المضادة للاكسدة ضد الأمراض و / أو الشيخوخة أن الإجهاد التأسدي لا يسبب الضرر فحسب ولكن أيضا أدوار أخرى في الخلايا. وعلاوة على ذلك، فقد أظهر العلماء أن الجذور الحرة تلعب دورا هاما في نقل إشارة2. كل هذه الدراسات تعزيز أهمية تحديد التغيرات في خفض الأكسدة (الأكسدة الحمراء) نسبة الجزيئات الكبيرة. يمكن تقييم نشاط الانزيم ومضادات الأكسدة و / أو المواد المؤكدة ومنتجات الأكسدة بطرق مختلفة. من بين هذه الطرق التي تحدد أكسدة الثيول يمكن القول إن الأكثر استخداما لأنها تقرير عن التوازن بين المواد المضادة للاكسدة وprooxidants في الخلايا، وكذلك الكائنات الحية4. على وجه التحديد، وتستخدم النسب بين الجلوتاثيون (GSH)/الجلوتاثيون ثاني كبريتيد (GSSG) و / أو السيستين (CyS)/السيستين (CySS) كما المؤشرات الحيوية لرصد حالة الأكسدة الكائنات الحية2.
تعتمد الطرق المستخدمة في تحليل التوازن بين البروتوكسيدات ومضادات الأكسدة بشكل رئيسي على مستويات البروتينات المخفضة /المؤكدة أو الجزيئات الصغيرة داخل الخلايا. وتستخدم بقع الغربية وقياس الطيف الشامل لتقييم واسع النطاق نسب الجزيئات الجزئية المتقلصة/المؤكسدة (البروتين، الدهون الخ)، ويمكن تقييم نسب GSH/GSSG مع قياسالطيفي 5. ومن السمات المشتركة لهذه الطرق الانزعاج المادي للنظام عن طريق تجانس الخلايا و/أو الأنسجة. هذه التحليلات أيضاً تصبح صعبة عندما يكون من الضروري قياس حالة الأكسدة من مقصورات الخلوية المختلفة. كل هذه الانزعاجات تسبب التحف في بيئة الفحص.
فتحت البروتينات الفلورية الحساسة للريدox حقبة مفيدة لتقييم توازن الأكسدة الحمراء دون التسبب في اضطراب في الخلايا6. ويمكن أن تستهدف مقصورات مختلفة داخل الخلايا، مما يسمح بالتدبير الكمي للأنشطة الخاصة بالحجرة (على سبيل المثال، فحص حالة الأكسدة الحمراء للميتوكوندريا والسيتوزول) للتحقيق في المحادثات المتبادلة بين العضيات الخلوية. بروتين الفلورسنت الأصفر (YFP) ، البروتين الفلورسنت الأخضر (GFP) ، والبروتينات HyPeR يتم استعراضها من قبل ماير وزملاؤه6. ومن بين هذه البروتينات، فإن GFP الحساسة للox (roGFP) فريدة من نوعها بسبب قراءات الفلورسنت المختلفة لCyS (488 نانومتر/م 525 نانومتر) وCySS (ex. 405 nm/525 nm) المخلفات، والتي تسمح التحليل النسب، على عكس البروتينات الأخرى الحساسة الأكسدة مثل YFP7،8. نسبة الناتج قيمة لأنه يوازن الفروق بين مستويات التعبير، وحساسيات الكشف، وphotobleaching8. يمكن استهداف مقصورات الخلايا الفرعية (السيتول ، الميتوكوندريا ، النواة) أو الكائنات الحية المختلفة (البكتيريا وكذلك خلايا الثدييات) عن طريق تعديل roGFP7،9،10.
وتجري مقايسات roGFP باستخدام تقنيات التصوير الفلورسنت، وخاصة بالنسبة لتجارب التصور في الوقت الحقيقي. إن التحليلات السيتوميترية لتدفق roGFPs ممكنة أيضًا للتجارب التي لها نقاط زمنية محددة مسبقًا. توضح المقالة الحالية استخدام المجهر الفلورسنت والتدفق للخلايا لإجراء تقييم نسبة لحالة الأكسدة الحمراء في الخلايا الثديية التعبير الزائد عن صوت roGFP (المستهدفة بالcytosol) عبر تحويل أدينوفيرال.
Access restricted. Please log in or start a trial to view this content.
Protocol
ملاحظة: تم تحسين هذا البروتوكول ل 70% -80% التقاء خلايا MDA-MB-231. بالنسبة لخطوط الخلايا الأخرى، ينبغي إعادة تهيئة عدد الخلايا وتعدد العدوى (MOI).
1. إعداد الخلايا (اليوم 1)
- الحفاظ على MDA-MB-231 خط الخلية في 75 سم2 قارورة مع 10 مل من المتوسط النسر المعدلة دولبيككو (DMEM) تكملها 10٪ مصل الأبقار الجنين (FBS) في 37 درجة مئوية في 5٪ CO2 الغلاف الجوي المرطب.
ملاحظة: DMEM تكمل مع 10٪ FBS، 37 درجة مئوية، ويستخدم 5٪ CO2 جو مرطب لجميع الاحتضانات المرفق والعلاج في جميع أنحاء البروتوكول بأكمله. - إعداد خلايا MDA-MB-231 للتجربة.
- استلهم الوسط داخل القارورة، افصل الخلايا بـ 2 مل من محلول 0.25% من التربسين-EDTA لمدة 2 دقيقة، وفكّك نشاط التربسين مع 6 مل من المتوسط الكامل (DMEM مع 10٪ FBS). الطرد المركزي الخلايا في 150 س ز لمدة 5 دقائق. سبيرتبيربيربيربيريد وتعليق الخلايا في 5 مل من المتوسط الكامل.
- مزيج تعليق خلية متساوية حجم و0.4٪ trypan الأزرق. خذ 10 ميكرولتر من هذا الخليط وعد الخلايا مع عداد الخلايا الآلي.
ملاحظة: يمكن أيضاً استخدام عداد كولتر أو مقياس للهيموسيتتر لعد الخلايا. - بذور الخلايا في لوحة 6 جيدا لتحليلات تدفق الخلايا والبذور 150،000 الخلايا في 1 مل من المتوسط في البئر. انتظر 16 ساعة لمرفق الخلية.
- بذور الخلايا في شريحة غرفة 4 جيدا للتصوير الفلورسنت والبذور 25،000 الخلايا في 0.5 مل من المتوسط في البئر. انتظر 16 ساعة لمرفق الخلية.
ملاحظة: آبار التحكم في البذور بالإضافة إلى آبار المعالجة. استخدم أحد آبار التحكم لتحديد رقم الخلية (اختياري: إذا كانت فترة المرفقات للخلايا أقصر من وقت المضاعفة، يمكن افتراض أن رقم الخلية هو نفس كثافة البذر) والآخر لعنصر تحكم غير مصاب (0 MOI).
2. adenoviral roGFP النقل (اليوم 2 و 3)
تنبيه: يمكن أن تسبب الفيروسات الغدية الأمراض. أثناء تحويل الخلايا ، استخدم النصائح المصفاة ونصائح التطهير ، والماصات الباستور ، وأنابيب microcentrifuge مع 10٪ من التبييض.
ملاحظة: تم إظهار هذا البروتوكول مع roGFP الخاصة بالسياتسول، ولكن يمكن استهداف مقصورات خلوية أخرى (مثل، الميتوكوندريا أو الفضاء المشترك بين الميتوكوندريا) مع هذا البروتوكول نفسه.
- إنشاء منحنى الجرعة استجابة لوزارة الداخلية للحصول على أعلى كفاءة تحويل عن طريق حساب حجم الفيروس الغدي (مل) اللازمة لكل قيمة وزارة الداخلية ل MDA-MB-231 خط الخلية(الجدول 1):
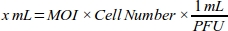
ملاحظة: يتم توفير titer الوظيفية من كل دفعة من الأسهم adenoviral، والتي يتم التعبير عنها كوحدة تشكيل البلاك (PFU) لكل مل، من قبل الشركة. يختلف MOI الأمثل لـ النقل بين أنواع الخلايا. بالنسبة لمعظم خلايا الثدييات، فإن نطاق MOI الأمثل يتراوح بين 10 و 300. وفقا لاستجابة الخلوية، ينبغي إعادة حساب قيم MOI (على سبيل المثال، ينبغي تخفيض نطاق وزارة الداخلية إذا كانت الخلايا لديها استجابة السامة للخلايا، أو ينبغي زيادة نطاق إذا كانت الخلايا لديها كفاءة نقل منخفضة). - جعل 1:100 تخفيف 6 × 1010 PFU / مل أدينوفيرال roGFP حل مع خلية ثقافة المتوسطة (DMEM مع 10 ٪ FBS) للأنابيب موثوق بها.
- 0.0125 مل (12.5 ميكرولتر)، 0.025 مل (25 ميكرولتر)، 0.05 مل (50 ميكرولتر) من تخفيف الـ adenoviral roGFP إلى كل بئر من 6 بئر من أجل نقل 150000 خلية مع 50، 100، و 200 MOI على التوالي لتحليل تدفق قياس الالكتوم (الجدول 1).
- الماصات وإضافة 0.0042 مل (4.2 ميكرولتر) من تخفيف roGFP adenoviral في 4-غرفة الآبار الشريحة إلى نقل 25000 الخلايا مع 100 MOI للتصوير الفلوريسين(الجدول 1).
ملاحظة: ينبغي استخدام الحد الأدنى من المتوسط في الآبار لضمان أعلى تفاعل بين بناء roGFP الأدنوفيرال والخلايا. قد يحتاج محتوى المصل من الوسط ثقافة إلى أن ينخفض لخطوط الخلايا المختلفة لأن مستويات عالية من المصل يمكن أن تؤثر سلبا على كفاءة نقل في بعض أنواع الخلايا. - احتضان الخلايا لمدة 16-24 ساعة في ظل ظروف صيانة الخلية. في اليوم التالي (اليوم 3) ، تغيير المتوسطة إلى خلية ثقافة المتوسطة (DMEM مع 10 ٪ FBS) للسماح لاسترداد الخلايا ل 24 ح إضافية تصور الخلايا تحت المجهر لتقييم مورفولوجيا ؛ يمكن للخلايا التعبير عن roGFP حتى لو كان لديهم تغييرات المورفولوجية.
ملاحظة: في اليوم الثالث، يجب أن تبدأ الخلايا للتعبير عن roGFP; لذلك، يمكن رصد كفاءة النقل باستخدام المجهر الفلوري (مرشحات مع ex. 488/em. 525). للحصول على نتائج فحص متسقة، تكون على علم وتوثيق التغيرات المورفولوجية تحت المجهر النقيض المرحلة ومراقبة مورفولوجيا أثناء تقييم كفاءة النقل. - بناء منحنى استجابة للجرعة باستخدام عينات MOI 50 و100 و200 التي تم إعدادها في الخطوة 2.3 ونتائج كفاءة الشحن التي تم الحصول عليها من تحليل قياس التدفق (الخطوتين 3.1 و 4.1). تقييم كفاءة النقل الأمثل مع توثيق التغيرات المورفولوجية (الخطوة 2.5) ومنحنى الاستجابة للجرعة من وزارة الداخلية.
ملاحظة: على الرغم من أن أكثر من 98٪ من عدد الخلايا في 100 MOI و 200 MOI التعبير عن roGFP (انظر النتائج التمثيلية)، وأظهرت مجموعة وزارة الداخلية 200 تغييرات كبيرة في مورفولوجيا الخلية من خلايا MDA-MB-231. وبالتالي، فإن وزارة الداخلية الأكثر فعالية لخلايا MDA-MB-231 تم تحديدها لتكون 100 وزارة. - بعد وزارة الداخلية الأمثل (هنا، تم اختيار 100 MOI) لخط الخلية MDA-MB-231، وإجراء تجربة مع مواد الاختبار (10 μM H2O2 و سيارتها 0.1٪ المياه deionized).
- إعداد وبذير الخلايا وفقا للقسم 1. باستخدام وحدة تخزين تحويل الغددوفيرال لـ 100 MOI محسوبة في الخطوة 2.1، كرر الخطوات 2.2−2.4 لـ 100 تحويل الخلايا الأدنوفية من MOI. ثم احتضان لوحة والشرائح الغرفة وفقا للخطوة 2.5.
3. الحصول على الرصيد CyS / CySS
- تدفق قياس الاستئصالية (اليوم 4)
- في اليوم 4، تنبي الخلايا من الخطوة 2.7.1 مع 10 μM H2O2 ل 1 ساعة.
ملاحظة: 10 ميكرومتر H2O2 تم استخدام المادة الاختبارية و 0.1% المياه غير المؤينة استخدمت كمعالجة مركبة في هذا البروتوكول. يمكن استخدام عوامل مؤكسدة أخرى كضوابط إيجابية هنا. - وسائط التعرق من لوحة 6 جيدا، مع استبدال 750 μL من 0.25٪ تريبسين-EDTA الحل وانتظر لمدة 2 دقيقة للخلايا لفصل. إلغاء تنشيط التربسين مع 2 مل من المتوسط الكامل (DMEM مع 10٪ FBS) وجمع حجم في أنابيب مخروطية 15 مل.
- أجهزة الطرد المركزي الأنابيب في 150 × ز لمدة 5 دقائق في 4ºC. تجاهل عظمى وتعليق الخلايا في 500 ميكرولتر من المالحة الفوسفات المخزنة (PBS).
- كرر الخطوة 3.1.3
- تصفية تعليق الخلية في تدفق أنابيب متوافقة مع القياس الخلوي باستخدام شبكة 40 ميكرومتر. الحفاظ على أنابيب على الجليد وبعيدا عن الضوء واتبع الخطوة 4.1 لتحليل البيانات.
- في اليوم 4، تنبي الخلايا من الخطوة 2.7.1 مع 10 μM H2O2 ل 1 ساعة.
- التصوير المجهري (اليوم الرابع)
- في اليوم 4، علاج الخلايا مع 10 μM H2O2،الحصول على الصور على الفور (نقطة الوقت 0) و 1 ساعة بعد العلاج واتبع الخطوة 4.2 لتحليل البيانات.
4 - تحليل البيانات
- كمية قياس التدفق
- تعيين تدفق طريقة قياس الخلايا ل 3 تحليلات مختلفة عن طريق عينة اقتناء البرمجيات (انظر جدول المواد): مبعثر إلى الأمام (FCS) على محور س والجانب تشتت (SSC) على محور y لتقييم حجم الخلية وتعقيد الخلايا (SSC يمكن استخدامها لتحديد الخام من الخلايا الميتة والذخيرة الحية) ؛ ex. 488 نانومتر / م. 525 نانومتر (الفلوريسين ايزوثيوسايانات [FITC]) مرشح شريط النطاق على محور س و SSC على المحور y لتقييم CyS-roGFP؛ ex. 405 نانومتر / م. 525 نانومتر (الرائعة البنفسجي 510 [BV510]) شريطية تصفية على محور س و SSC على محور y لتقييم CySS-roGFP.
- الحصول على 0 التحكم MOI وتصور الخلايا مع عينة الحصول على البرمجيات. كرر هذه الخطوة للعينات المتبقية (50، 100، 200 مجموعات MOI ولاحقاً على 10 ميكرومتر H2O2 الخلايا المعالجة والخلايا المعالجة مركبة). حفظ الملفات لتحليل البيانات.
- فتح برنامج تحليل البيانات (انظر جدول المواد)وفتح ملف عينة 0 MOI. تقييم عدد الخلايا موضع الاهتمام (البوابة 1). إعداد البوابات التالية لتقليل الفلورية الخلفية لـ ex. 488 نانومتر/م. 525 نانومتر (البوابة 2) و 405 نانومتر/م. 525 نانومتر (بوابة 3) مرشحات شريطية مع خلايا التحكم غير المصابة (0 MOI).
- افتح ملفات عينة 50 و100 و200 MOI ضمن برنامج تحليل البيانات لتقييم منحنى الاستجابة للجرعة. تحليل الشدات المفلورة المتوسط مع البوابتين 2 و 3 لكل عينة. كرر هذه الخطوة لعينات الاختبار (10 ميكرومتر H2O2 الخلايا المعالجة والخلايا المعالجة مركبة).
- حساب متوسط نسبة كثافة الفلورسنت بين أشكال مؤكسدة مقابل مخفضة من roGFP مع المعادلة التالية.

- تقييم الصورة
- استخدم مجهر يحتوي على مرشحات الفلوريسنس لـ CyS-roGFP و CySS-roGFP (488 نانومتر/م 525 نانومتر و 405 نانومتر/م. مرشحات 525 نانومتر، على التوالي).
- في كل بئر من الشريحة الغرفة، واختيار 4 مناطق عشوائية للحصول على الصور، وذلك باستخدام الهدف 4x لتصور مساحات أكبر.
ملاحظة: يمكن أيضاً استخدام 20x الهدف لعرض الصور. - فتح الصورة مع برنامج ImageJ11. تطبيق تحليل | قياس الأوامر لكل صورة واستخدام المعادلة في الخطوة 4.1.5 لتحديد حجم البيانات.
ملاحظة: القياس الكمي للصور هو قياس نسبة؛ لذلك، لا يتضمن البروتوكول طرح الخلفية. ومع ذلك، يجب أن تكون قادرة على مقارنة الصور والسطوع والتباين والتشبع هي نفسها لكل صورة. وتم تقييم الأهمية الإحصائية بتحليل التباين في اتجاه واحد واختبار توكي بعد فترة مخصصة.
Access restricted. Please log in or start a trial to view this content.
النتائج
يتم فحص حالة الأكسدة الحمراء لـ CyS/CySS بسهولة مع roGFPs المستحثة. ويُحدد المسبار الفلوري مقدار النسبة بين الشكلين المخفضين والأكسدة (الطول الموجي للإثارة 488 نانومتر و405 نانومتر على التوالي). يمكن الحصول على بيانات الفلوريسين عن طريق كل من عملية استئصال التدفق والمجهر.
يمكن الحصو...
Access restricted. Please log in or start a trial to view this content.
Discussion
يعكس توازن الثيول/ثاني كبريتيد في كائن حي حالة الأكسدة الحمراء للخلايا. الكائنات الحية لديها الجلوتاثيون، السيستين، thiols البروتين، وthols منخفضة الوزن الجزيئي، وكلها تتأثر بمستوى الأكسدة وتردي حالة الأكسدة من الخلايا4. 2006 2006 تسمح roGFPs المهندسة بالكم غير التخريبية لتوازن الثيول/...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
تم إنشاء بناء و المؤتلف الفيروس الأدينول للتعبير عن cytosol محددة roGFP في الخلايا في مختبر بول T. Schumacker, دكتوراه, فرايبرغ كلية الطب, جامعة نورث وسترن, وشركة ViraQuest, على التوالي. وقد دعمت هذه الدراسة من قبل مركز دراسات الاستجابة المضيفة لعلاج السرطان منحة P20GM109005 من خلال المعهد الوطني للصحة مراكز العلوم الطبية العامة من التميز البحوث الطبية الحيوية (COBRE NIGMS)، المعهد الوطني لأنظمة العلوم الطبية العامة الصيدلة وبرنامج التدريب على السموم منحة T32 GM106999، UAMS مؤسسة / جائزة الوقف البحوث الطبية AWD00053956، UAMS في نهاية العام جوائز المستشار AWD00053484. تم دعم مرفق القلب الأساسي للتدفق من قبل مركز الإمراض الميكروبية ومضيف الاستجابات الالتهابية منحة P20GM103625 من خلال COBRE NIGMS. والمحتوى هو مسؤولية المؤلفين وحده ولا يمثل بالضرورة وجهات النظر الرسمية لل المعاهد القومية للصحة. وقد تم دعم المساعدة من قبل مجلس البحوث العلمية والتكنولوجية في تركيا (TUBITAK) 2214-A المنح الدراسية.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco by Life Sciences | 25200-056 | Cell culture |
| 4-well chamber slide | Thermo Scientific | 154526 | Cell seeding material for fluorescent imaging |
| 5 ml tubes with cell strainer cap | Falcon | 352235 | Single cell suspension tube for flow cytometry analysis |
| 6-well plate | Corning | 353046 | Cell seeding material for flow cytometry analysis |
| 15 ml conical tubes | MidSci | C15B | Cell culture |
| 75 cm2 ventilated cap tissue culture flasks | Corning | 4306414 | Cell culture |
| Adenoviral cytosol specific roGFP | ViraQuest | VQAd roGFP | roGFP construct kindly provided by Dr. Schumaker |
| Class II, Type A2 Safety Hood Cabinet | Thermo Scientific | 1300 Series A2 | Cell culture |
| Countess automated cell counter | Invitrogen | C10227 | Cell counting |
| Countess cell counter chamber slides | Invitrogen | C10283 | Cell counting |
| DMEM | Gibco by Life Sciences | 11995-065 | Cell culture |
| FBS | Atlanta Biologicals | S11150 | Cell culture |
| Filtered pipette tips, sterile, 20 µl | Fisherbrand | 02-717-161 | Cell culture |
| Filtered pipette tips, sterile, 1000 µl | Fisherbrand | 02-717-166 | Cell culture |
| Flow Cytometer | BD Biosciences | LSRFortessa | Instrument equipped with FITC and BV510 bandpass filters for flow cytometry analyses |
| Fluorescent Microscope | Advanced Microscopy Group (AMG) | Evos FL | Fluorescent imaging |
| Hydrogen Peroxide 30% | Fisher Scientific | H325-100 | Positive control |
| Light Cube, Custom | Life Sciences | CUB0037 | Fluorescent imaging of roGFP expressing cells (ex 405 nm) |
| Light Cube, GFP | Thermo Scientific | AMEP4651 | Fluorescent imaging of roGFP expressing cells (ex 488 nm) |
| MDA-MB-231 | American Tissue Culture Collection | HTB-26 | Human epithelial breast cancer cell line |
| Microcentrifuge tubes, 2 ml | Grenier Bio-One | 623201 | Cell culture |
| PBS | Gibco by Life Sciences | 10010-023 | Cell culture |
| Pipet controller | Drummond | Hood Mate Model 360 | Cell culture |
| Serologycal pipet, 1 ml | Fisherbrand | 13-678-11B | Cell culture |
| Serologycal pipet, 5 ml | Fisherbrand | 13-678-11D | Cell culture |
| Serologycal pipet, 10 ml | Fisherbrand | 13-678-11E | Cell culture |
| Tissue Culture Incubator | Thermo Scientific | HERACell 150i | CO2 incubator for cell culture |
| Trypan blue stain 0.4% | Invitrogen | T10282 | Cell counting |
References
- Sies, H. Oxidative stress: A concept in redox biology and medicine. Redox Biology. 4, 180-183 (2015).
- Jones, D. P. Redefining Oxidative Stress. Antioxidants & Redox Signalling. 8 (9-10), (2006).
- Pizzino, G., et al. Oxidative Stress: Harms and Benefits for Human Health. Oxidative Medicine and Cellular Longevity. 20117, 8416763(2017).
- Go, Y. M., Jones, D. P. Thiol/disulfide redox states in signaling and sensing. Critical Reviews in Biochemistry and Molecular Biology. 48 (2), 173-191 (2013).
- Hansen, J. M., Go, Y., Jones, D. P. Nuclear and Mitochondrial Compartmentation of Oxidative Stress and Redox Signaling. Annual Review of Pharmacology and Toxicology. 46 (1), 215-234 (2006).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants and Redox Signaling. 13 (5), 621-650 (2010).
- Dooley, C. T., et al. Imaging dynamic redox changes in mammalian cells with green fluorescent protein indicators. Journal of Biological Chemistry. 279 (21), 22284-22293 (2004).
- Björnberg, O., Østergaard, H., Winther, J. R. Measuring intracellular redox conditions using GFP-based sensors. Antioxidants and Redox Signaling. 8 (3-4), 354-361 (2006).
- Bhaskar, A., et al. Reengineering Redox Sensitive GFP to Measure Mycothiol Redox Potential of Mycobacterium tuberculosis during Infection. PLoS Pathogens. 10 (1), 1003902(2014).
- Loor, G., et al. Mitochondrial oxidant stress triggers cell death in simulated ischemia-reperfusion. Biochimica et Biophysica Acta - Molecular Cell Research. 1813 (7), 1382-1394 (2011).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Loor, G., et al. Menadione triggers cell death through ROS-dependent mechanisms involving PARP activation without requiring apoptosis. Free Radical Biology and Medicine. 49 (12), 1925-1936 (2010).
- Esposito, S., et al. Redox-sensitive GFP to monitor oxidative stress in neurodegenerative diseases. Reviews in the Neurosciences. 28 (2), 133-144 (2017).
- Meyer, A. J., et al. Redox-sensitive GFP in Arabidopsis thaliana is a quantitative biosensor for the redox potential of the cellular glutathione redox buffer. Plant Journal. 52 (5), 973-986 (2007).
- Galvan, D. L., et al. Real-time in vivo mitochondrial redox assessment confirms enhanced mitochondrial reactive oxygen species in diabetic nephropathy. Kidney International. 92 (5), 1282-1287 (2017).
- Swain, L., Nanadikar, M. S., Borowik, S., Zieseniss, A., Katschinski, D. M. Transgenic organisms meet redox bioimaging: One step closer to physiology. Antioxidants and Redox Signaling. 29 (6), 603-612 (2018).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51 (11), 1943-1951 (2011).
- Dey, S., Sidor, A., O'Rourke, B. Compartment-specific control of reactive oxygen species scavenging by antioxidant pathway enzymes. Journal of Biological Chemistry. 291 (21), 11185-11197 (2016).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved